Биоорганическая химия, 2020, T. 46, № 6, стр. 670-675
Действие пептида LKEKK на кератиноциты человека
Е. В. Наволоцкая 1, *, В. Б. Садовников 1, Д. В. Зинченко 1, Ю. А. Золотарев 2, В. М. Липкин 3, А. Н. Мурашев 1
1 Филиал ФГБУН Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Московская область, Пущино, проспект Науки, 6, Россия
2 ФГБУН Институт молекулярной генетики РАН
123182 Москва, пл. Акад. Курчатова, 2, Россия
3 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: navolotskaya@bibch.ru
Поступила в редакцию 10.04.2020
После доработки 24.04.2020
Принята к публикации 29.04.2020
Аннотация
Синтезирован пептид LKEKK (Np5), соответствующий последовательности 16–20 тимозина-α1 (TM-α1) и последовательности 131–135 интерферона-α2 (IFN-α2), получили [3H]Np5 и установили, что он с высоким сродством и специфичностью связывается с кератиноцитами человека (Kd 2.6 нМ). В диапазоне концентраций 50–1000 нМ Np5 дозозависимо снижал индуцированную интерлейкином-17А (IL-17A) продукцию кератиноцитами провоспалительных цитокинов (TNF-α, IL-6, IL-1α) и увеличивал продукцию ими противовоспалительного цитокина IL-10 in vitro. Показано, что действие пептида опосредовано активацией растворимой гуанилатциклазы.
ВВЕДЕНИЕ
Кожа, самый большой по площади орган человека и животных, выполняет защитную функцию, участвует в дыхании, терморегуляции, обменных и многих других жизненно важных процессах. Кожа млекопитающих состоит из двух слоев: эпидермиса, который образует защитный барьер на поверхности тела, и дермы, которая представляет собой соединительную ткань, содержащую петли капилляров, нервные окончания, волосяные фолликулы, железы и мышечные волокна, придающие коже прочность и эластичность. Эпидермис представляет собой многослойный плоский эпителий, состоящий из пролиферирующих базальных и дифференцированных супрабазальных кератиноцитов, которые являются основными клетками эпидермиса [1]. Кератиноциты реагируют на различные факторы внешней среды и непосредственно участвуют в регуляции воспалительного ответа кожи. Показано, что пять провоспалительных цитокинов, продуцируемых кератиноцитами, участвуют в индукции воспаления кожи: IL-17A, IL-22, онкостатин M, TNF-α и IL-1α [2]. Установлена роль отдельных цитокинов в развитии воспалительных процессов кожи: IL-22 и онкостатин M контролируют эпидермальную гиперплазию и потерю дифференцировки, тогда как IL-1α, IL-17A и TNF-α обеспечивают активацию врожденного иммунитета [3].
Несколько лет назад мы синтезировали пептид LKEKK (Np5), соответствующий последовательностям 16–20 тимозина-α1 (TM-α1) и 131–135 интерферона-α2 (IFN-α2), и показали его способность специфически связываться с T- и B-лимфоцитами человека [4, 5], мембранами эпителиальных клеток тонкого кишечника крысы [6, 7], эпителиальными клетками линий IEC-6 крысы [8, 9] и Caco-2 человека [9], клетками линии Raw 264.7 мыши [10]. Во всех случаях обработка протеазами не влияла на связывание, что указывало на небелковую природу рецептора пептида; связывание конкурентно ингибировали TM-α1, IFN-α2 и B субъединица холерного токсина. Мы предположили, что рецептором Np5 может быть рецептор токсина GM1-ганглиозид [11, 12].
Недавно показано, что Np5 способен подавлять развитие воспаления в эпителиальных клетках кишечника in vitro и in vivo: в клетках линии Caco-2 человека пептид значительно снижал TNF-α-индуцированную экспрессию IL-6, IL-8, IL-1β и, в то же время, увеличивал экспрессию IL-10, а также уменьшал выраженность воспаления у мышей с экспериментальным колитом [13].
Цель данного исследования – охарактеризовать противовоспалительное действие Np5 на кератиноциты человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные характеристики пептидов (чистота, данные аминокислотного анализа, молекулярная масса) приведены в табл. 1.
Таблица 1.
Основные характеристики синтезированных пептидов
| Пептид | Чистота, % | Данные аминокислотного анализа | Молекулярная масса, Да | |
|---|---|---|---|---|
| экспериментальное значение | расчетное значение | |||
| Np5 | >98 | Glu 1.08 (1), Leu 1.00 (1), Lys 3.32 (3) | 645.2 | 644.87 |
| iNp5 | >97 | Glu 1.14 (1), Leu 1.05 (1), Lys 3.30 (3) | 648.65 | 644.87 |
Удельная активность [3H]Np5 составила 28 Ки/ммоль.
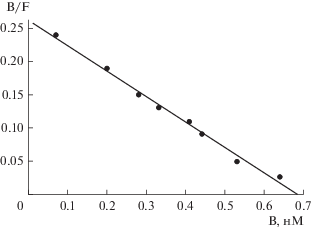
Эксперименты показали, что в выбранных нами условиях [3H]Np5 специфически связывается с кератиноцитами человека, связывание было обратимым и насыщаемым, динамическое равновесие в системе меченый пептид–рецептор устанавливалось примерно через 30 мин и сохранялось, по крайней мере, 1 ч. Поэтому для определения Kd, реакцию связывания проводили в течение 30 мин. Неспецифическое связывание меченого пептида в этих условиях составляло 12.6 ± 0.3% от величины его общего связывания. На рис. 1 приведен график Скэтчарда, характеризующий специфическое связывание [3H]Np5 с кератиноцитами. Линейность графика свидетельствует о наличии на клетках одного типа рецепторов к CT-B, а значение Kd = 2.6 ± 0.2 нМ – о высоком сродстве пептида к рецептору.
Рис. 1.
Анализ в координатах Скэтчарда специфического связывания [3H]Np5 с кератиноцитами человека. B и F – молярные концентрации связанного и свободного меченого пептида соответственно.
Для характеристики специфичности связывания [3H]Np5 с клетками, в качестве потенциальных конкурентов меченого пептида были протестированы немеченые TM-α1, IFN-α2, Np5 и iNp5. Приведенные в табл. 2 значения Ki свидетельствуют о высокой ингибирующей способности TM-α1, IFN-α2 и Np5 и отсутствии таковой у пептида с инвертированной последовательностью iNp5. Неспособность iNp5 ингибировать связывание указывает на высокую специфичность рецептора. Таким образом, TM-α1, IFN-α2 и Np5 связываются с высоким сродством и специфичностью с общим рецептором на кератиноцитах человека.
Таблица 2.
Ингибирование немечеными лигандами специфического связывания [3H]Np5 с кератиноцитами человека
| Лиганд | IC50 | Ki |
|---|---|---|
| нМ ± SEM | ||
| IFN-α2 | 7.2 ± 0.4 | 2.5 ± 0.2 |
| TM-α1 | 7.6 ± 0.4 | 2.6 ± 0.3 |
| Np5 | 8.3 ± 0.3 | 2.9 ± 0.2 |
| iNp5 | >100 | >100 |
Скрининг активности 36 цитокинов позволил идентифицировать пять мощных индукторов воспаления – IL-17A, IL-22, онкостатин M, TNF-α и IL-1α, при этом IL-1α, IL-17A и TNF-α проявляли наибольшую активность [2]. Год назад мы продемонстрировали противовоспалительную активность Np5 на моделях TNF-индуцированного воспаления человеческих клеток кишечника линии Caco-2 in vitro и DSS-индуцированного колита у мышей in vivo [13]. Здесь мы исследовали противовоспалительную активность Np5, используя in vitro модель IL-17A-индуцированного воспаления кератиноцитов человека. Для этого клетки обрабатывали пептидом (10–1000 нМ) и IL-17A (20 нг/мл) добавляли для индукции воспаления. Параллельно в качестве отрицательного контроля был протестирован пептид с инвертированной последовательностью iNp5. Эксперименты показали, что обработка кератиноцитов пептидом Np5 в диапазоне концентраций 50–1000 нМ дозозависимо снижала IL-17A-индуцируемую продукцию трех провоспалительных цитокинов (TNF-α, IL-6 и IL-1α) (табл. 3) и, в то же время, увеличивала выработку противовоспалительного цитокина IL-10 (табл. 4). Пептид с инвертированной последовательностью был неактивен, что указывало на высокую специфичность действия Np5.
Таблица 3.
Влияние Np5 и iNp5 на IL-17A-индуцированную продукцию провоспалительных цитокинов кератиноцитами человека
| Концентрация пептида (нМ) | Цитокин (пг/мг белка ± SEM) | |||||
|---|---|---|---|---|---|---|
| TNF-α | IL-6 | IL-1α | ||||
| Np5 | iNp5 | Np5 | iNp5 | Np5 | iNp5 | |
| – (Контроль) | 28.3 ± 2.3 | 15.5 ± 1.7 | 27.4 ± 2.2 | |||
| 10 | 29.6 ± 2.5 | 28.8 ± 2.7 | 15.9 ± 1.2 | 15.5 ± 1.6 | 28.0 ± 2.9 | 27.1 ± 2.5 |
| 50 | 23.4 ± 2.8* | 27.5 ± 3.3 | 11.6 ± 1.4* | 15.9 ± 1.4 | 24.7 ± 2.6 | 27.5 ± 2.7 |
| 100 | 19.6 ± 2.5* | 28.2 ± 2.9 | 9.7 ± 1.3* | 15.2 ± 1.5 | 20.7 ± 2.5* | 27.7 ± 2.9 |
| 500 | 15.3 ± 2.4* | 27.8 ± 2.5 | 8.5 ± 1.4* | 16.0 ± 1.8 | 17.5 ± 2.4* | 27.4 ± 2.8 |
| 1000 | 15.9 ± 2.7* | 29.2 ± 2.6 | 8.8 ± 1.6* | 15.7 ± 1.6 | 18.1 ± 2.9* | 27.2 ± 2.3 |
Таблица 4.
Влияние Np5 и iNp5 на IL-17A-индуцированную продукцию противовоспалительного цитокина IL-10 кератиноцитами человека
| Концентрация пептида (нМ) | IL-10 (пг/мг белка ± SEM) | |
|---|---|---|
| Np5 | iNp5 | |
| – (Контроль) | 33.4 ± 3.2 | |
| 10 | 30.9 ± 3.6 | 34.0 ± 3.7 |
| 50 | 26.2 ± 3.4* | 33.2 ± 3.5 |
| 100 | 23.3 ± 3.3* | 32.9 ± 3.3 |
| 500 | 20.5 ± 3.7* | 33.7 ± 3.2 |
| 1000 | 21.1 ± 3.0* | 33.5 ± 3.4 |
Ранее мы установили, что действие Np5 на различные клетки (человеческие T- и B-лимфоциты, человеческие Caco-2 и крысиные IEC-6 эпителиальные клетки кишечника, мышиные Raw 264.7 макрофагоподобные клетки) реализуется cGMP-зависимым путем передачи сигнала [4, 5, 8]. Результаты настоящей работы, представленные в табл. 5, показывают, что Np5 при концентрациях 50–1000 нМ дозозависимо увеличивает активность sGC в кератиноцитах, но не влияет на активность pGC; протестированный параллельно iNp5 был неактивен. Таким образом, связывание Np5 с кератиноцитами человека приводит к увеличению активности в них sGC. Мы также исследовали действие пептида на способность кератиноцитов к IL-17A-индуцированной продукции TNF-α и IL-1α при частичной или полной потери активности sGC. Для ингибирования активности фермента был использован ODQ, специфический ингибитор sGC [14]. Данные, представленные в табл. 6, показывают, что ODQ дозозависимо снижал активность sGC и ингибирующий эффект 500 нМ Np5 на IL-17A-индуцированную продукцию кератиноцитами TNF-α и IL-1α. Таким образом, снижение активности фермента сопровождалось потерей Np5 способности ингибировать секрецию противовоспалительных цитокинов, и следовательно действие пептида опосредовано через sGC.
Таблица 5.
Влияние Np5 и iNp5 на активность sGC и pGC в кератиноцитах человека
| Пептид (нМ) | Гуанилатциклазная активность (нмоль cGMP/мг белка за 10 мин ± SEM) | |||
|---|---|---|---|---|
| sGC | pGC | |||
| Np5 | iNp5 | Np5 | iNp5 | |
| Контроль | 1.6 ± 0.2 | 2.2 ± 0.2 | ||
| 10 | 1.7 ± 0.3 | 1.6 ± 0.2 | 2.3 ± 0.3 | 2.0 ± 0.3 |
| 50 | 2.1 ± 0.2* | 1.7 ± 0.2 | 2.4 ± 0.3 | 2.2 ± 0.3 |
| 100 | 2.4 ± 0.2* | 1.6 ± 0.3 | 2.1 ± 0.2 | 2.0 ± 0.4 |
| 500 | 2.9 ± 0.3* | 1.5 ± 0.3 | 2.2 ± 0.3 | 2.3 ± 0.2 |
| 1000 | 2.8 ± 0.3* | 1.8 ± 0.3 | 2.4 ± 0.2 | 2.0 ± 0.4 |
Таблица 6.
Влияние ODQ на активность sGC и IL-17A-индуцированный уровень цитокинов в кератиноцитах человека, преинкубированных с 500 нМ Np5
| ODQ (мкМ) | Гуанилатциклазная активность (нмоль cGMP/мг белка за 10 мин ± SEM) | Цитокин (пг/мг белка ± SEM) | |
|---|---|---|---|
| TNF-α | IL-1α | ||
| Контроль | 2.8 ± 0.2 | 15.9 ± 2.7 | 18.0 ± 2.4 |
| 5 | 2.2 ± 0.3* | 18.2 ± 2.5* | 20.2 ± 2.6 |
| 10 | 1.3 ± 0.3* | 20.3 ± 2.2* | 24.2 ± 2.3* |
| 50 | <0.1* | 29.2 ± 2.7* | 26.6 ± 2.9* |
| 100 | <0.1* | 28.5 ± 2.4* | 27.0 ± 2.5* |
ЗАКЛЮЧЕНИЕ
Пептид Np5 (LKEKK) связывается с высокой специфичностью и аффинностью с кератиноцитами человека, снижает их способность к IL-17A-индуцированной продукции провоспалительных цитокинов (TNF-α, IL-6 и IL-1α) и, в то же время, увеличивает выработку противовоспалительного цитокина IL-10. Таким образом, Np5, короткий пептид с простой структурой, обладает значительным противовоспалительным потенциалом и пригоден для разработки на его основе лекарственного препарата.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали TM-a1, IL-17A, TNF-α, IL-1α (“Immundiagnostik AG”, Германия), фенилметилсульфонилфторид (PMSF), Tris (“Fluka”, США), апротинин, лейпептин, пепстатин А, фетальную сыворотку теленка и Hepes (“ICN”, США); сахарозу, БСА, ЭДТА, ЭГТА, азид натрия (NaN3) (“Serva”, Германия), среду для культивирования клеток EpiGro (“Cell Applications, Inc.”, США), все остальные реагенты и растворители были отечественного производства и использовались после соответствующей очистки.
Пептиды Np5 (LKEKK) и iNp5 (KKEKL) синтезировали на автоматических синтезаторах (модель 430A и Vega Coupler, модель C250; “Applied Biosystems”, США) с использованием Boc/Bzl-тактики наращивания пептидной цепи и очищали препаративной обращеннофазовой хроматографией (хроматограф “Gilson”, Франция), колонка Waters SymmetryPrep C18 (19 × 300 мм) (“Malva”, Греция). Синтезированные пептиды были охарактеризованы данными аналитической обращеннофазовой ВЭЖХ (хроматограф “Gilson”, Франция; колонка XТerra RP18, “Malva”, Греция), аминокислотного анализа (гидролиз 6 М HCl, 24 ч, 110°C; аминокислотный анализатор 4151 Alpha Plus, “LKB”, Швеция) и масс-спектрального анализа (масс-спектрометр “Finnigan”, США). Рекомбинантный интерферон-α2 был получен из ФГУП “Гос, НИИ ОЧБ” ФМБА (Санкт-Петербург, Россия).
Нормальные эпидермальные кератиноциты человека (NHEK, “Cell Applications, Inc.”, США) культивировали в течение 24 ч в не содержащей сыворотку среде EpiGro, содержащей 10% эмбриональную сыворотку теленка, при 37°C в атмосфере 5% CO2. Клетки (106/лунка) высевали в 6-луночные планшеты для культивирования клеток (“Nunc”, Дания). Жизнеспособность клеток оценивали по окрашиванию трипановым синим (выживаемость клеток: 95%). Клетки преинкубировали с Np5 или iNp5 (10–1000 нМ) в течение 1 ч до стимуляции IL-17A (20 нг/мл) [15].
[3H]Np5 получали реакцией высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО) [16]. К раствору 2.0 мг пептида в 0.5 мл воды добавляли 50 мг окиси алюминия и упаривали на роторном испарителе. Окись алюминия с нанесенным пептидом смешивали с 10 мг катализатора (5% Rh/Al2O3). Полученную твердую смесь помещали в ампулу объемом 10 мл. Ампулу вакуумировали, заполняли газообразным тритием до давления 250 мм рт. ст., нагревали до 170°C и выдерживали при этой температуре в течение 20 мин. Затем ампулу охлаждали, вакуумировали, продували водородом и повторно вакуумировали. Меченый пептид экстрагировали из твердой реакционной смеси двумя порциями по 3 мл 50% водного этанола, полученный раствор объединяли и упаривали. Для удаления лабильного трития процедуру повторяли дважды. Очистку меченого пептида проводили методом ВЭЖХ со спектрофотометром “Beckman” при длинах волн 254 и 280 нм на колонке Kromasil (4 × 150 мм, зернение 5 мкм) при 20°C, элюент – 0.1% ТХУ, градиент метанола 42–70% за 20 мин, скорость потока 3 мл/мин. Включение трития в пептид рассчитывали с использованием жидкостного сцинтилляционного счета.
Реакцию связывания [3H]Np5 с кератиноцитами проводили в соответствии со следующей схемой: клеточную суспензию (106 клеток/мл) инкубировали с меченым пептидом (10–11–10–7 М, три параллельных пробы для каждой концентрации) в 1 мл среды EpiGro, содержавшей 10 мМ Hepes, 20 мМ NaN3 и 50 мкМ PMSF, pH 7.4, при 4°C в течение 30 мин. По окончании инкубации реакционную смесь фильтровали через стекловолокнистые фильтры GF/A (“Whatman”, Англия). Фильтры промывали ледяным физиологическим раствором, содержащим 10 мМ Hepes, pH 7.4 (три раза по 5 мл). Радиоактивность на фильтрах подсчитывали с помощью жидкостного сцинтилляционного счетчика LS 5801 (“Beckman”, США). Величину специфического связывания [3H]Np5 с клетками определяли по разности между его общим и неспецифическим связыванием, а величину неспецифического связывания [3H]Np5 – в присутствии 10–4 М немеченого пептида (1000-кратный избыток по отношению к самой большой концентрации меченого пептида – 10–7 М). Для определения равновесной константы диссоциации Kd строили график зависимости отношения молярных концентраций связанного (B) и свободного (F) меченого пептида от молярной концентрации связанного меченого пептида (B) [17].
Для оценки способности TM-α1, IFN-α2, пептидов Np5 и iNp5 ингибировать специфическое связывание [3H]Np5 с кератиноцитами, клетки (106/мл) инкубировали с меченым пептидом (5 нМ) и одним из потенциальных конкурентов (диапазон концентраций 10–10–10–5 М, три повтора для каждой концентрации), как описано выше. Константу ингибирования (Ki) определяли по формуле: Ki = [IC]50/(1 + [L]/Kd) [18], где [L] – молярная концентрация [3H]Np5; Kd – равновесная константа диссоциации комплекса [3H]Np5–рецептор; [IC]50 – концентрация немеченого лиганда, вызывающая 50%-ное ингибирование специфического связывания меченого пептида, Величину [IC]50 определяли графически на основании кривой ингибирования. Значение Kd измеряли предварительно, как описано выше.
Для определения активности растворимой (sGC) и мембраносвязанной (pGC) гуанилатциклазы в кератиноцитах, их ресуспендировали в 10 мМ Tris-HCl-буферном растворе, pH 7.5, содержащем 1 мМ MgCl2, 1 мМ дитиотреитол, 5 мкМ пепстатин A, 50 мкМ PMSF, 10 мкМ ингибитор трипсина из сои и 1 мМ бензамидин. Полученную суспензию (2.5 × 108 клеток/мл) гомогенизировали в ледяной бане и гомогенат центрифугировали при 100 000 g, (10 мин, 4°C). Супернатанты отбирали, а осадки ресуспендировали в равных объемах буферного раствора. Супернатанты и ресуспендированные осадки использовали для определения активности sGC и pGC соответственно. Гуанилатциклазную активность определяли путем мониторинга превращения α-[32P]GTP в [32P]cGMP и выражали в нмоль cGMP, образовавшегося за 10 мин в расчете на 1 мг белка [19], продукт выделяли преципитацией с карбонатом цинка и хроматографией на колонке с окисью алюминия [20]. Концентрацию белка определяли с помощью метода Лоури, используя в качестве стандарта бычий сывороточный альбумин [21]. Для ингибирования активности sGC использовали ингибитор фермента ODQ (1H-[1,2,4]оксадиазол[4,3-α]хиноксалин-1-он) в диапазоне концентраций 5–100 мкМ [14]. Для оценки достоверности различий между средними значениями в контроле и опыте использовали t‑критерий Стьюдента.
Для определения продукции кератиноцитами цитокинов клетки гомогенизировали в тройном объеме ледяного натрий-фосфатного буферного раствора (PBS, pH 7.4), содержащего 1 мМ PMSF, апротинин, лейпептин, пепстатин А (10 мкг/мл каждого, и центрифугировали при 12 000 g (10 мин, 4°C). Концентрацию белка определяли по Лоури, используя в качестве стандарта бычий сывороточный альбумин [21]. Иммуноферментный анализ проводили с помощью ELISA Kits (BD Biosciences, San Jose, CA) в соответствии с прилагаемой инструкцией.
Список литературы
Breitkreutz D., Mirancea N., Nischt R. // Histochem. Cell. Biol. 2009. V. 132. P. 1–10. https://doi.org/10.1007/s00418-009-0586
Guilloteau K., Paris I., Pedretti N., Boniface K., Juchaux F., Huguier V., Guillet G., Bernard F.-X., Lecron J.-C., Morel F. // J. Immunol. 2010. V. 184. P. 5263–5270. https://doi.org/10.4049/jimmunol.0902464
Robeony H., Petit-Paris I., Garnier J., Barrault C., Pedretti N., Guilloteau K., Jegou J.-F., Guillet G., Huguier V., Lecron J.-C., Bernard F.-X., Morel F. // PLoS One. 2014. V. 9. e101 937. https://doi.org/10.1371/journal.pone.0101937
Наволоцкая Е.В., Зинченко Д.В., Золотарев Ю.А., Колобов А.А., Липкин В.М. // Биохимия. 2016. Т. 81. С. 1109–1114. [Navolotskaya E.V., Zinchenko D.V., Zolotarev Y.A., Kolobov A.A., Lipkin V.M. // Biochemistry (Moscow). 2016. V. 81. P. 871–875.] https://doi.org/10.1134/S0006297916080071
Navolotskaya E.V., Sadovnikov V.B., Zinchenko D.V., Lipkin V.M., Zav’yalov V.P. // Int. Immunopharmacol. 2017. V. 50. P. 279–282. https://doi.org/10.1016/j.intimp.2017.07.011
Наволоцкая Е.В., Садовников В.Б., Зинченко Д.В., Владимиров В.И., Золотарев Ю.А., Колобов А.А. // Биоорган. химия. 2016. Т. 42. С. 533–538. [Navolotskaya E.V., Sadovnikov V.B., Zinchenko D.V., Vladimirov V.I., Zolotarev Y.A., Kolobov A.A. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 479–483.] https://doi.org/10.1134/S1068162016050137
Наволоцкая Е.В., Садовников В.Б., Зинченко Д.В., Владимиров В.И., Золотарев Ю.А // Биоорган. химия. 2017. Т. 43. С. 655–660. [Navolotskaya E.V., Sadovnikov V.B., Zinchenko D.V., Vladimirov V.I., Zolotarev Y.A. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 673–677.] https://doi.org/10.1134/S1068162017060115
Наволоцкая Е.В., Садовников В.Б., Зинченко Д.В., Владимиров В.И., Золотарев Ю.А., Липкин В.М. // Биоорган. химия. 2018. Т. 44. С. 401–406. [Navolotskaya E.V., Sadovnikov V.B., Zinchenko D.V., Vladimirov V.I., Zolotarev Y.A., Lipkin, V.M. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 403–407.] https://doi.org/10.1134/S1068162018030123
Navolotskaya E.V., Sadovnikov V.B., Lipkin V.M., Zav’yalov V.P. // Toxicology in Vitro. 2018. V. 47. P. 269–273. https://doi.org/10.1016/j.tiv.2017.12.010
Наволоцкая Е.В., Садовников В.Б., Зинченко Д.В., Владимиров В.И., Золотарев Ю.А., Липкин В.М., Мурашев А.Н. // Биоорган. химия. 2019. Т. 45. С. 288–294. [Navolotskaya E.V., Sadovnikov V.B., Zinchenko D.V., Vladimirov V.I., Zolotarev Y.A., Lipkin V.M., Murashev A.N. // Rus. J. Bioorg. Chem. 2019. V. 45. P. 122–128.] https://doi.org/10.1134/S1068162019020092
Cuatrecasas P. // Biochemistry. 1973. V. 12. P. 3558–3566.
Holmgren J., Lönnroth I., Svennerholm L. // Infect. Immun. 1973. V. 8. P. 208–214.
Navolotskaya E.V., Sadovnikov V.B., Lipkin V.M., Zav’yalov V.P. // J. Clin. Exp. Immunol. 2019. V. 4. P. 1–6. https://doi.org/10.33140/JCEI.04.04.03
Feelisch M.1., Kotsonis P., Siebe J., Clement B., Schmidt H.H. // Mol. Pharmacol. 1999. V. 56. P. 243–253. https://doi.org/10.1124/mol.56.2.243
Chorachoo J., Lambert S., Furnholm T., Roberts L., Reingold L., Auepemkiate S., Voravuthikunchai S.P., Johnston A. // PLoS One. 2018. V. 13. P. e0205 340. https://doi.org/10.1371/journal.pone.0205340
Zolotarev Y.A., Dadayan A.K., Bocharov E.V., Borisov Y.A., Vaskovsky B.V., Dorokhova E.M., Myasoedov N.F. // Amino Acids. 2003. V. 24. P. 325–333. https://doi.org/10.1007/s00726-002-0404-7
Pennock B.E. // Anal. Biochem. 1973. V. 56. P. 306–309.
Cheng Y.C., Prusoff W. // Biochem. Pharmacol. 1973. V. 22. P. 3099–3108.
Schultz G., Buhme E. Methods of Enzymatic Analysis. Weinheim, Germany: Verlag Chemie, 1984. P. 379–389.
Southam E. // Curr. Protoc. Toxicol. 2001. V. 10. P. 10.5. https://doi.org/10.1002/0471140856.tx1005s04
Lowry O.H., Rosebbrough N.J., Farr O.L., Randal R.J. // J. Biol. Chem. 1951. V. 193. P. 265–275.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


