Биоорганическая химия, 2020, T. 46, № 6, стр. 701-707
Доставка барназы к клеткам в составе липосом, функционализированных HER2-специфичным модулем DARPin
В. О. Шипунова 1, Е. И. Шрамова 1, А. А. Шульга 1, М. В. Шилова 1, С. М. Деев 1, Г. М. Прошкина 1, *
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: gmb@ibch.ru
Поступила в редакцию 09.04.2020
После доработки 19.04.2020
Принята к публикации 21.04.2020
Аннотация
Впервые показана возможность липосомальной формы доставки рибонуклеазы барназы к HER2-положительным раковым клеткам человека с целью их селективного уничтожения. Принцип загрузки липосом рибонуклеазой основан на электростатическом взаимодействии белка с внутренней поверхностью липосом. Специфичность липосом к поверхностному клеточному рецептору HER2 определяется наличием анти-HER2-адресного модуля DARPin на внешней мембране липосом. Показано, что специфическая в отношении HER2-положительных клеток цитотоксичность определяется именно наличием адресного HER2-специфичного модуля на поверхности липосом, а выраженность цитотоксического эффекта коррелирует с уровнем экспрессии рецептора HER2 на клеточной мембране.
ВВЕДЕНИЕ
По данным ВОЗ, в структуре смертности населения планеты смерть от онкологических заболеваний занимает вторую строчку, являясь причиной каждой шестой смерти на земле. Именно поэтому, несмотря на большое количество подходов к терапии онкологических заболеваний, поиск новых форм цитотоксических агентов, обладающих минимальными побочными эффектами при максимальной цитотоксичности, равно как и поиск способов снижения вводимых доз цитотоксического агента, продолжает оставаться актуальной задачей.
В этом свете терапия, основанная на белковых препаратах (антителах, белковых токсинах, ферментах, цитокинах), приобретает ведущую роль в современных медико-биологических исследованиях [1]. Неразрывно с этим встает вопрос доставки белкового препарата к клетке-мишени, поскольку, находясь в кровотоке, препарат может проявлять низкую стабильность, подвергаться быстрому протеолизу в плазме, обладать ограниченной способностью проникать через клеточную мембрану и т.д. Благодаря бурному развитию нанотехнологических подходов, для доставки белков к мишеням организма в руках ученых появились такие наноносители, как липосомы, полимерные наногели, наночастицы различного состава [2–6]. Несомненным лидером среди наноносителей по доставке лекарств являются липосомы. Способность липосом инкапсулировать белки, их высокая биосовместимость, низкая токсичность, регулируемый размер, определяют их уникальные свойства в качестве носителя для доставки биологически активных соединений. Кроме того, ковалентное присоединение лигандов (антител, белков, углеводов) к липосомной мембране обеспечивает специфическую доставку липидных везикул к клеткам-мишеням.
В качестве адресов, специфичных к определенным поверхностным рецепторам раковых клеток, сегодня все большее внимание уделяется инновационным рецептор-спецфичным скаффолдным белкам неиммуноглобулиновой природы – аффибоди, авимеры, аднектины, антикалины, аптамеры и DARPins-белки [7]. DARPins-белки (Design Ankyrin Repeat Proteins) являются альтернативой антителам, не уступают им в аффинности, не содержат остатков цистеина в своей структуре, отличаются высоким уровнем экспрессии в бактериальной системе, являются мономерами в растворе, не склонны к агрегации и характеризуются высокой устойчивостью к протеазам [8].
В качестве токсического компонента в противораковой терапии одними из наиболее перспективных средств на сегодняшний день являются белки различного происхождения, нарушающие метаболические процессы непосредственно внутри клетки-мишени, такие как рибонуклеазы, рицин, лектин и т.д. [9, 10]. Так, например, на основе рибонуклеазы барназы из Bacillus amyloliquefaciens получено большое количество адресных иммунотоксинов, эффективных in vitro и in vivo [11, 12].
В данной работе были получены липосомы, нагруженные рибонуклеазой барназой, обладающие специфичностью по отношению к поверхностному клеточному рецептору HER2 за счет наличия анти-HER2-адресного модуля DARPin на внешней мембране липосом. На сегодняшний день это первая работа по доставке барназы к раковым клеткам в составе липосомального препарата.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее мы разработали методику синтеза моноламилярных липосомальных HER2-специфичных препаратов диаметром 100 нм, нагруженных цитотоксическим компонентом – фрагментом А псевдомонадного экзотоксина [3]. Данная методика позволяет включать в липосому большое количество молекул белка (порядка 2000) за счет электростатического взаимодействия между белком и внутренней поверхностью липосомы, а функционализация внешней поверхности липосомы HER2-специфичным модулем DARPin обеспечивает избирательную цитотоксичность препарата.
Поверхностный клеточный рецептор HER2 сверхэкспрессируется в 20–30% опухолей молочной железы и яичников [13–15]. Как правило, сверхэкспрессия этого рецептора коррелирует с агрессивным фенотипом опухоли и активным метастазированием [16, 17].
Сверхэкспрессия HER2 при злокачественной трансформации клетки делает его привлекательной мишенью для адресной терапии рака [18], поскольку в норме HER2 экспрессируется на поверхности эпителиальных клеток в небольших количествах.
В данной работе было показано, что принцип загрузки липосом белком, основанный на электростатическом взаимодействии, эффективен, в частности, для рибонуклеазы барназы.
Гены белков DARPin и барназы экспрессировали в штамме E. coli BL21(DE3) по методу автоиндукции. Автоиндукционная среда, благодаря наличию эквимолярных концентраций гидрофосфата натрия и дигидрофосфата калия, препятствует закислению культуральной среды в результате метаболизма бактерий и обеспечивает поддержание нейтрального рН даже при достижении культурой высоких плотностей (OD600 ~ 10). Сбалансированные концентрации глюкозы, лактозы и глицерина, а также высокая интенсивность перемешивания культуры (~250 об./мин) позволяют индуцировать экспрессию гена целевого белка автоматически (при истощении в среде глюкозы), не прибегая к контролю плотности культуры.
Белки очищали с использованием металл-хелатной аффинной хроматографии, как описано в “Экспериментальной части”. Электрофоретический анализ очищенных белков показал, что их молекулярная масса соответствует расчетной (18 кДа для DARPin и 12 кДа барназы), а чистота белка удовлетворяет требованиям работы с культурами клеток эукариот (рис. 1а).
Рис. 1.
Характеристика белков DARPin и барназы. (а) результат электрофоретического разделения белков в 13.5% ПААГ после металл-хелатной аффинной хроматографии. Дорожки: 1 – маркер молекулярных масс Page Ruler Prestained Protein (“Thermo Fisher”, США), 2 – DARPin, 3 – барназа. (б) РНКазная активность барназы, определенная методом кислотно-нерастворимого осадка. Большим значениям оптической плотности (OD260) соответствует большая ферментативная активность белка.
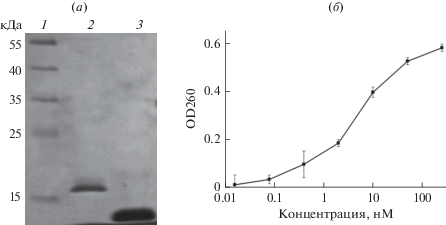
Поскольку методика очистки барназы включает этап денатурации и рефолдинга (для разрушения комплекса барназа-барстар), о сохранении функциональной активности барназы судили по ее способности гидролизовать РНК. РНКазную активность барназы определяли методом кислотно-нерастворимого осадка РНК [19]. Согласно [19], 1 единица рибонуклеазной активности в исследуемой пробе вызывает приращение OD260 на 1 единицу. Таким образом, энзиматическая активность очищенного препарата барназы, определенная данным методом, составляет 93.5 × 106 ед. акт./М.
Как отмечалось выше, принцип загрузки липосом белками основан на электростатическом взаимодействии положительно заряженного белка (для барназы pI 9.4, рабочий буфер для загрузки – рН 7.5) с отрицательно заряженной поверхностью мембраны липосомы. Метод инкапусляции белка в липосому включал: электростатическое связывание белка с фосфолипидами, процедуру 5-кратного замораживания-оттаивания, экструзию суспензии через 100-нм поликарбонатный фильтр, хроматографическую очистку протеолипосом от невключенного белка при умеренно щелочном рН и высокой ионной силе (рН 7.5, 200 мМ NaCl). В этих условиях молекулы белка диссоциируют от внешней поверхности липосом.
Функционализацию протеолипосом адресным модулем DARPin осуществляли в три стадии как описано в “Экспериментальной части”: 1. Введение с помощью реагента Траута (2-иминотиолан) SH-групп в липиды, содержащие первичные амины (фосфатидиламин); 2. Модификация аминогрупп DARPin кросс-сшивающим реагентом сульфо-EMCS (N-ε-малеимидокапроил-оксисульфосукцинимидный эфир); 3. Ковалентное присоединение Траут-модифицированных липосом к сульфо-EMCS-модифицированному белку.
Размер и поверхностный заряд адресных (DARPin-Lip-Bn) и безадресных (Lip-Bn) липосом, нагруженных барназой, определяли методом динамического и электрофоретического светорассеяния (рис. 2а–2в). Гидродинамический размер составил 108 ± 36 нм для Lip-Bn и 117 ± 41 нм для DARPin-Lip-Bn (рис. 2а, 2б), ζ-потенциал: ‒35.9 ± 0.3 мВ для Lip-Bn и –49.5 ± 2 мВ для DARPin-Lip-Bn (рис. 2в). Эти данные однозначно доказывают высокую эффективность химической конъюгации адресного модуля DARPin с поверхностью липосом (незначительное увеличение размера и уменьшение ζ-потенциала), а также свидетельствуют о сохранении коллоидной стабильности полученных конъюгатов в солевых растворах.
Рис. 2.
Функциональная характеристика липосомных комплексов. (а) распределение по размерам адресных и безадресных липосом, нагруженных барназой, полученное методом динамического светорассеяния. (б) распределение по ζ-потенциалам адресных и безадресных липосом, нагруженных барназой, полученное методом электрофоретического светорассеяния. (в) гидродинамический размер и ζ-потенциал адресных и безадресных липосом, нагруженных барназой. (г, д) относительная жизнеспособность клеток с различным уровнем экспрессии рецептора HER2 после их обработки липосомальными препаратами в течение 72 ч.
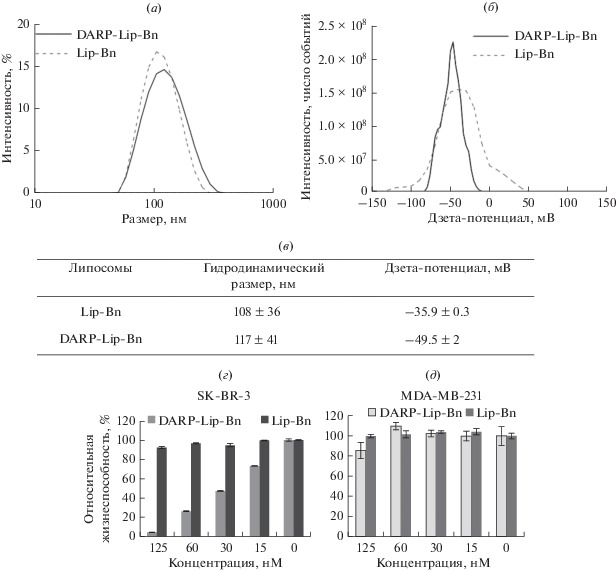
Способность моноламилярных липосом, загруженных барназой и функционализированных адресным модулем DARPin, селективно взаимодействовать с рецептором HER2 на поверхности HER2-положительных клеток и вызывать их гибель была изучена стандартным методом МТТ in vitro на двух клеточных линиях аденокарциномы молочной железы человека, характеризующихся различным уровнем экспрессии рецептора HER2: SK-BR-3 − высокий уровень экспрессии, MDA-MB-231 − низкий уровень экспрессии.
Показано, что адресные липосомы, нагруженные барназой, эффективно подавляют жизнеспособность HER2-положительных клеток SK-BR-3 (IC50 = 47.5 нМ) (рис. 2г). Жизнеспособность клеток MDA-MB-231, характеризующихся нормальным уровнем экспрессии рецептора HER2, в проанализированном диапазоне концентраций отличается слабой чувствительностью к препарату (14.5% смертности при максимально использованной концентрации адресных липосом, нагруженных барназой). Отметим, что безадресные липосомы, нагруженные барназой, цитотоксичностью не обладают (рис. 2д). Полученные результаты позволяют сделать вывод о том, что специфическая в отношении HER2-положительных клеток цитотоксичность определяется именно наличием адресного HER2-специфичного модуля на поверхности липосом, а выраженность цитотоксического эффекта коррелирует с уровнем экспрессии рецептора HER2 на клеточной мембране.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспрессия, выделение и очистка белков. Экспрессию целевых белков DARPin и барназы проводили в штамме BL21(DE3) E. coli по методу автоиндукции [20]. Свежие трансформанты (из расчета одна колония на 1 мл среды) инокулировали в 50 мл среды, содержащей 1% дрожжевого экстракта, 1% триптона, 25 мM Na2HPO4, 25 мM KH2PO4, 100 мM NaCl, 2 мM MgCl2 и 0.1 г/л ампициллина. Растили 24 ч при 25°C в условиях интенсивной аэрации. Клетки осаждали центрифугированием в течение 10 мин при 6000 g и 4°С. Для того, чтобы иметь возможность очистить белки с помощью металл-аффинной хелатной хроматографии, в последовательностях белков была предусмотрена гексагистидиновая метка.
Выделение барназы проводили следующим образом. Осадок клеток ресуспендировали в буфере Т2 (200 мM NaCl, 30 мM NaH2PO4, 2 мM Tris-HCl, pH 8.3), клетки разрушали на ледяной бане с помощью ультразвукового дезинтегратора. Клеточный дебрис удаляли центрифугированием при 15 000 g в течение 30 мин. Супернатант пропускали через фильтр с диаметром пор 0.22 мкм и наносили на колонку Ni2+-NTA Sepharose (GE Healthcare Life Sciences) согласно протоколу производителя. Белки, не связавшиеся с сорбентом, удаляли при промывании колонки буфером Т2. Ингибитор барназы барстар, сопутствующий всем рекомбинантным белкам, содержащим барназный модуль, удаляли раствором 6 М гуанидинхлорида в буфере Т2. Ренатурацию проводили в нисходящем градиенте гуанидинхлорида. После полного замещения буфера с гуанидинхлорида на буфер Т2, белки элюировали буфером Т2 с 150 мМ имидазолом.
Для выделения DARPin клеточный осадок ресуспендировали в буфере, содержащем 0.3 M NaCl, 20 мM Na-фосфат, 30 мM имидазол, 0.5 мг/мл лизоцим (pH 8.0). Клетки разрушали ультразвуком на ледяной бане. Клеточный дебрис удаляли центрифугированием при 15 000 g, 25 мин, 4°C. Супернатант пропускали через 0.22-мкм фильтр и наносили на колонку Ni2+-NTA HisTrap column (GE Healthcare, USA), уравновешенную связывающим буфером (0.3 M NaCl, 30 мM имидазол, 20 мM Na-фосфат, pH 8.0). Колонку промывали 20 объемами связывающего буфера, после чего проводили элюцию целевого белка градиентом имидазола от 0.1 до 0.5 M.
Аутентичность полученных белков доказывали с помощью электрофореза в ПААГ.
Характеристика РНКазной активности баранзы. Энзиматическую активность барназы определяли методом кислотно-нерастворимого осадка РНК [19]. Исследуемую пробу белка растворяли в концентрации 1.25 мкМ в 0.125 М Tris-HCl, pH 8.5 и затем получали серию последовательных 5-кратных разведений образца в том же буфере. В качестве контрольного образца использовали раствор 0.125 М Tris-HCl, pH 8.5. К 40 мкл каждого образца добавляли 160 мкл раствора дрожжевой РНК (в концентрации 2 г/л) в 0.125 М Tris-HCl, pH 8.5 на льду. Реакционную смесь инкубировали 15 мин при 37°С. Если исследуемая проба обладала рибонуклеазной активностью, то в реакционной смеси образовывалась смесь фрагментов РНК различной длины: в образцах с высокой концентрацией РНКазы преобладали мононуклеотиды, в образцах с низкой концентрацией РНКазы – нерасщепленные полинуклеотиды. Реакцию останавливали добавлением 200 мкл холодной 6% хлорной кислоты и инкубировали смесь 15 мин при 0°С. При инкубации с хлорной кислотой большие фрагменты РНК образуют осадок, который осаждали центрифугированием при 16 000 g в течение 10 мин при 0°С. Супернатанты разбавляли в 10 раз и измеряли оптическую плотность при 260 нм (OD260) относительно контрольного образца. Большим значениям оптической плотности соответствовала большая рибонуклеазная активность.
Получение липосом, нагруженных барназой и модифицированных адресным модулем DARPin по внешней поверхности липидной мембраны. Для приготовления суспензии липидов 0.2 г L-α-фосфатидилхолина (Avanti Polar Lipids, Soy 40%), содержащего 16% фосфатидилэтаноламина, растворяли в 10 мл воды и выдерживали 16–20 ч при комнатной температуре. Затем суспензию пропускали через 0.8 мкм фильтр и хранили при 4°C.
0.5 мл суспензии фосфолипидов смешивали с 0.5 мл барназы (40 мг/мл) в буфере 20 мM Na-фосфат (pH 7.5). Белково-липидную суспензию подвергали пятикратной процедуре замораживания-оттаивания, после чего, используя экструдер Avanti Mini Extruder, 19 раз пропускали через поликарбонатный фильтр с диаметром пор 100 нм. Липосомы отделяли от избытка барназы на колонке Sepharose CL-2B (10 × 35 мм), уравновешенной 10 мM Na-фосфатным буфером (pH 7.5), содержащим 0.2 M NaCl.
Ковалентное присоединение DARPin к внешней поверхности липосом. Ковалентное присоединение DARPin к внешней поверхности мембраны липосом включало присоединение SH-групп к первичным аминам фосфатидилэтаноламина с использованием реагента Траута (2-иминотиолан) и последующую кросс-сшивку с адресным модулем DARPin, модифицированного по аминогруппам билинкером сульфо-EMCS (N-ε-малеимидокапроил-оксисульфосукцинимидный эфир). Липосомы, нагруженные барназой, инкубировали с 6 М реагентом Траута в 100 мМ Na-фосфатном буфере (pH 8.0) в течение часа при комнатной температуре. Инкубационную смесь очищали от избытка реагента на колонке NAP-5 (GE Healthcare, USA), уравновешенной 100 мM Na-фосфатным буфером (pH 7.5).
DARPin (5 мг/мл) инкубировали с 3-кратным избытком сульфо-EMCS в течение 45 мин при комнатной температуре. От избытка сульфо-EMCS избавлялись, пропуская смесь через колонку NAP-5 (GE Healthcare, USA), уравновешенную 100 мM Na-фосфатным буфером (pH 7.5). DARPin, конъюгированный с сульфо-EMCS, смешивали с липосомами, модифицированными реагентом Траута, и инкубировали 1 ч при комнатной температуре. От не связавшегося с поверхностью липосом DARPin, смесь очищали с использованием колонки Sepharose CL-2B (10 × 35 мм), уравновешенной 20 мM Na-фосфатным буфером (pH 7.5).
Измерение размера и ζ-потенциала липосом. Гидродинамический размер и ζ-потенциал адресных и безадресных липосом, нагруженных барназой, определяли с использованием анализатора Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания) в 10 мМ KNO3 при температуре 25°C. Измерения проводили в триплетах.
Культивирование эукариотических линий. В работе использовали следующие клеточные линии: SK-BR-3 (аденокарцинома молочной железы человека, номер по каталогу ATCC – HTB-30), MDA-MB-231 (карцинома молочной железы человека, номер по каталогу ATCC – HTB-26).
Клетки культивировали в среде RPMI-1640 (ПанЭко, Россия), содержащей 10% эмбриональной бычьей сыворотки (HyClone, США) и 2 мМ L-глутамин (ПанЭко, Россия), при 37°С в атмосфере 5% СО2.
Изучение цитотоксичности HER2-специфичного токсина in vitro. Для изучения цитотоксичности адресных и безадресных липосом, нагруженных барназой, клетки высевали по 100 мкл на лунку в 96-луночные планшеты (Eppendorf) из стока 3.5 × 104 (SK-BR-3) или 2 × 104 (MDA-MB-231) клеток/мл и культивировали в течение ночи. После этого ростовую среду в лунках заменяли на свежую, содержащую различные концентрации липосомальных препаратов, клетки инкубировали при 37°С в атмосфере 5% СО2 в течение 72 ч.
Жизнеспособность клеток оценивали методом МТТ [21]. Относительную жизнеспособность клеток рассчитывали как отношение усредненной оптической плотности в лунках с обработанными клетками к усредненной оптической плотности в лунках с необработанными клетками (контроль), выраженное в процентах. Расчет IC50 (концентрация препарата, снижающая жизнеспособность клеток в 2 раза относительно контроля) определяли методом нелинейной регрессии с использованием программы Excel.
Список литературы
Leader B., Baca Q.J., Golan D.E. // Nat. Rev. Drug Discov. 2008. V. 7. P. 21–39. https://doi.org/10.1038/nrd2399
Gu Z., Biswas A., Zhao M., Tang Y. // Chem. Soc. Rev. 2011. V. 40. P. 3638–3655. https://doi.org/10.1039/c0cs00227e
Deyev S., Proshkina G., Baryshnikova O., Ryabova A., Avishai G., Katrivas L., Giannini C., Levi-Kalisman Y., Kotlyar A. // Eur. J. Pharm. Biopharm. 2018. V. 130. P. 296–305. https://doi.org/10.1016/j.ejpb.2018.06.026
Zelepukin I.V., Yaremenko A.V., Shipunova V.O., Babenyshev A.V., Balalaeva I.V., Nikitin P.I., Deyev S.M., Nikitin M.P. // Nanoscale. 2019. V. 11. P. 1636–1646. https://doi.org/10.1039/c8nr07730d
Belogurov A.A., Jr., Stepanov A.V., Smirnov I.V., Melamed D., Bacon A., Mamedov A.E., Boitsov V.M., Sashchenko L.P., Ponomarenko N.A., Sharanova S.N., Boyko A.N., Dubina M.V., Friboulet A., Genkin D.D., Gabibov A.G. // FASEB J. 2013. V. 27. P. 222–231. https://doi.org/10.1096/fj.12-213975
Durova O.M., Vorobiev I.I., Smirnov I.V., Reshetnyak A.V., Telegin G.B., Shamborant O.G., Orlova N.A., Genkin D.D., Bacon A., Ponomarenko N.A., Friboulet A., Gabibov A.G. // Mol. Immunol. 2009 V. 47. P. 87–95. https://doi.org/10.1016/j.molimm.2008.12.020
Vazquez-Lombardi R., Phan T.G., Zimmermann C., Lowe D., Jermutus L., Christ D. // Drug Discov. Today. 2015. V. 20. P. 1271–1283. https://doi.org/10.1016/j.drudis.2015.09.004
Shilova O.N., Deyev S.M. // Acta Naturae. 2019. V. 11. P. 42–53. https://doi.org/10.32607/20758251-2019-11-4-42-53
Frankel A.E., Woo J.-H., Neville D.M. // Principles of Cancer Biotherapy. 2009. P. 407–449. https://doi.org/10.1007/978-90-481-2289-9_11
Шрамова Е.И., Деев С.М., Прошкина Г.М. // Биоорган. химия. 2018. Т. 44. С. 664–668. [Shramova E.I., Deyev S.M., Proshkina G.M. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 755–758.] https://doi.org/10.1134/S0132342318060106
Edelweiss E., Balandin T.G., Ivanova J.L., Lutsenko G.V., Leonova O.G., Popenko V.I., Sapozhnikov A.M., Deyev S.M. // PLoS One. 2008. V. 3. P. e2434. https://doi.org/10.1371/journal.pone.0002434
Balandin T.G., Edelweiss E., Andronova N.V., Treshalina E.M., Sapozhnikov A.M., Deyev S.M. // Invest New Drugs. 2011. V. 29. P. 22–32. https://doi.org/10.1007/s10637-009-9329-2
Slamon D.J., Clark G.M., Wong S.G., Levin W.J., Ullrich A., McGuire W.L. // Science. 1987. V. 235. P. 177–182.https://doi.org/10.1126/science.3798106
Slamon D.J., Godolphin W., Jones L.A., Holt J.A., Wong S.G., Keith D.E., Levin W.J., Stuart S.G., Udove J., Ullrich A., et al. // Science. 1989. V. 244. P. 707–712. https://doi.org/10.1126/science.2470152
Шрамова Е.И., Прошкина Г.М., Деев С.М. // Биоорган. химия. 2018. Т. 44. С. 267–277. [Shramova E.I., Proshkina G.M., Deyev S.M. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 279–288.] https://doi.org/10.7868/S0132342318030028
Holbro T., Hynes N.E. // Annu. Rev. Pharmacol. Toxicol. 2004. V. 44. P. 195–217. https://doi.org/10.1146/annurev.pharmtox.44.101802. 121440
Yan M., Schwaederle M., Arguello D., Millis S.Z., Gatalica Z., Kurzrock R. // Cancer Metastasis Rev. 2015. V. 34. P. 157–164. https://doi.org/10.1007/s10555-015-9552-6
Kuzichkina E.O., Shilova O.N., Deyev S.M. // Acta Naturae. 2018. V. 10. P. 87–94. https://doi.org/10.32607/20758251-2018-10-4-87-94
Rushizky G.W., Greco A.E., Hartley R.W., Sober H.A. // Biochemistry. 1963. V. 2. P. 787–793. https://doi.org/10.1021/bi00904a028
Studier F.W. // Protein Expr. Purif. 2005. V. 41. P. 207–234. https://doi.org/10.1016/j.pep.2005.01.016
Mosmann T. // J. Immunol. Methods. 1983. V. 65. P. 55–63. https://doi.org/10.1016/0022-1759(83)90303-4
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


