Биоорганическая химия, 2020, T. 46, № 6, стр. 693-700
“Сдвоенные” производные пиримидина: синтез и первичная оценка гепатопротекторных свойств in vitro
А. Б. Выштакалюк 1, *, В. Э. Семенов 1, **, А. А. Парфенов 1, М. С. Шашин 1, Г. П. Беляев 1, И. В. Галяметдинова 1, В. В. Зобов 1
1 Институт органической и физической химии им. А.Е. Арбузова КазНЦ РАН
420088 Казань, ул. Арбузова, 8, Россия
* E-mail: alex.vysh@mail.ru
** E-mail: sve@iopc.ru
Поступила в редакцию 09.04.2020
После доработки 19.04.2020
Принята к публикации 24.04.2020
Аннотация
Разработан синтез “сдвоенных” производных лекарственного препарата Ксимедон (1,2-дигидро-4,6-диметил-1-N-(2-гидроксиэтил)пиримидона-2), далее пиримидин (I), в которых молекулы пиримидина (I) соединены алкил(ксилиленил)дионатным мостиком. На клеточной линии нормальных гепатоцитов человека Chang Liver получены первичные данные по гепатопротекторной активности пяти “сдвоенных” производных пиримидина (I) с различным числом метиленовых групп и мета-ксилиленовым фрагментом в сложноэфирном мостике. Определены цитотоксичность, цитопротекторные свойства новых соединений на фоне воздействия d-галактозамина в концентрации 150 ммоль/л и изучено их влияние на клеточный цикл в сравнении с исходным пиримидином I, установлена зависимость биологических свойств изучаемых производных от их структуры.
ВВЕДЕНИЕ
Восстановление и регенерация органов, в том числе печени, является значимой проблемой. Печень – уникальный орган в своей способности восстанавливаться после повреждений. Однако печень постоянно подвержена значительным пагубным влияниям различного характера (от механических повреждений, до интоксикаций). Примерами поражений печени являются неалкогольный стеатоз, гепатиты, цирроз и гепатоцеллюлярный рак (третья по значимости причина смертности от рака в мире [1]). Поэтому поиск новых потенциальных гепатопротекторов способных ускорить восстановление печени является важной задачей.
Ксимедон (1,2-дигидро-4,6-диметил-1-N-(2-гидроксиэтил)пиримидона-2) соединение (I) – лекарственный препарат широкого спектра действия, обладающий высоким регенеративным потенциалом [2]. Было показано влияние пиримидинов на посттравматическую регенерацию миелиновых волокон [3] и восстановление периферических аксонов сенсорных нейронов [4]. Кроме того, производные пиримидинов улучшают регенерацию печени и ослабляют фиброгенез ткани печени [5]. Поэтому не угасает интерес к синтезу новых производных пиримидина (I), которые бы улучшили его свойства. В предыдущих наших исследованиях для некоторых производных пиримидина (I) также были показаны гепатопротекторный, антиоксидантный и нейропротекторные эффекты [6–8].
Целью настоящего исследования являлись синтез новых производных Ксимедона, представляющих собой “сдвоенные” молекулы пиримидина (I), в которых два 1,2-дигидро-4,6-диметил-1-N-(2-этокси)пиримид-2-оновых фрагмента молекулы Ксимедона связаны друг с другом дикарбоксоалкильным или дикарбоксоксилиленовым мостиком, проведение первичной оценки in vitro их гепатопротекторных свойств и установление зависимости структура-активность.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
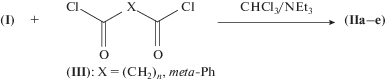
“Сдвоенные” соединения (IIа–е) получали взаимодействием Ксимедона (I) c соответствующим дихлорангидридом (III). Выходы целевых соединений невелики из-за потерь, связанных с проблемой отделения продукта реакции от образующегося в ходе ее гидрохлорида триэтиламина. Соединения (IIа–е) также как и исходный (I) растворимы в воде, что делает возможным определение их гепатопротекторной активности.
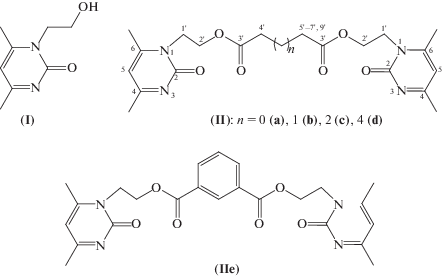
Новые производные Ксимедона содержат различное число метиленовых групп, а также ксилиленовый фрагмент в составе сложноэфирного мостика между пиримидиновыми кольцами. Структурные формулы Ксимедона – 1,2-дигидро-4,6-диметил-1-N-(2-гидроксиэтил)пиримид-2-она (соединение (I)), а также его “сдвоенных” производных (соединения (IIа–е)), в которых молекулы Ксимедона соединены алкил(мета-ксилиленил)дионатным мостиком, приведены на рис. 1. Схема синтеза “сдвоенных” молекул Ксимедона – соединений (IIа–е) приведена на рис. 2.
Рис. 1.
Структуры Ксимедона (I) и его “сдвоенных производных” (IIa–e). Указана нумерация пиримидинового кольца и алкильного фрагмента при атоме N пиримидинового кольца.
Первичную оценку гепатопротекторных свойств новых синтезированных соединений – производных пиримидина (I) проводили in vitro, в соответствии с [9], на клеточной линии нормальных гепатоцитов человека Chang Liver.
Результаты оценки цитотоксичности синтезированных соединений приведены в табл. 1. Из приведенных результатов следует, что цитотоксичность Ксимедона для Chang Liver не установлена, и проявляется при концентрациях вещества более 200 ммоль/л, в больших концентрациях исследование не проводилось. При этом следует отметить, что в исследованном диапазоне концентраций пиримидина (I) (от 3.1 мкмоль/л до 200 ммоль/л) количество живых клеток достоверно не отличалось от референсной интактной выборки. Лишь при 200 ммоль/л наблюдалось незначительное уменьшение количества живых клеток (93.7 ± 0.67% против интактной выборки 98.2 ± 0.38%), при остальных исследованных концентрациях пиримидина (I) количество живых клеток не отличалось от интактной группы. То есть, препарат (I) не токсичен для клеток печени.
Таблица 1.
Цитотоксичность “сдвоенных” пиримидинов для клеток нормальных гепатоцитов человека Chang Liver
| Соединение | Средняя концентрация IC50, мМ | Доверительный интервал IC50, мМ |
|---|---|---|
| (I) | >200.0 | – |
| (IIa) | >8.0 | – |
| (IIb) | 1.8 | 1.0–2.5 |
| (IIc) | 6.6 | 6.4–6.8 |
| (IId) | 2.7 | 2.5–2.9 |
| (IIe) | 13.8 | 10.0–17.5 |
Из вновь синтезированных соединений наименьшую цитотоксичность по отношению к гепатоцитам человека линии Chang Liver проявили соединения (IIa) и (IIe) с сукцинатным и изофталатным мостиком между фрагментами Ксимедона соответственно (табл. 1), и адипинат (IIc). Концентрация IC50, приводящая к гибели 50% клеток, для сукцината (IIa) не установлена. Показано, что IC50 для (IIa) превышает значение 8 ммоль/л, предельной концентрацией сукцината в водном растворе. Ввиду ограниченной растворимости в воде, данное соединение не было исследовано в больших концентрациях. Для изофталата (IIe) IC50 составила в среднем 13.8 мммоль/л, для адипината (IIc) – 6.6 мммоль/л. Глутарат (IIb) и суберат (IId) оказались наиболее токсичными для гепатоцитов, их IC50 составила в среднем 1.8 и 2.7 ммоль/л соответственно (табл. 1).
Результаты оценки цитопротекторных свойств синтезированных соединений при различных концентрациях на фоне токсического воздействия d-ГЛА (концентрация 150 ммоль/л) приведены в табл. 2, график зависимости жизнеспособности клеток от концентрации веществ – на рис. 3.
Таблица 2.
Количество жизнеспособных клеток (средние ± стандартная ошибка) при различных концентрациях исследуемых соединений на фоне токсического воздействия d-ГЛА в сравнении с контролем d-ГЛА
| Концентрация, мкмоль/л | (I) | (IIa) | (IIb) | (IIc) | (IId) | (IIe) |
|---|---|---|---|---|---|---|
| 3.5 | 2.2 ± 0.5 | – | – | – | – | – |
| 6.25 | – | 3.9 ± 0.10 | – | 3.5 ± 0.5 | 2.7 ± 0.40 | – |
| 17.5 | 2.7 ± 0.9 | 2.3 ± 0.92 | – | 4.5 ± 0.01 | 3.3 ± 1.4 | – |
| 25 | – | 4.0 ± 0.98* | – | – | 13.2 ± 7.3* | – |
| 35 | 31.0 ± 6.6* | – | – | – | – | – |
| 50 | – | 6.1 ± 0.85* | – | – | – | – |
| 62.5 | – | 15.6 ± 3.3 | – | 39.3 ± 4.6* | 22.5 ± 9.8* | – |
| 125 | 48.2 ± 5.2* | 11.6 ± 1.4 | – | 42.1 ± 2.7* | 13.9 ± 8.9 | – |
| 250 | 56.3 ± 7.1* | – | 8.11 ± 5.7* | 22.9 ± 7.7* | 3.2 ± 3.3 | 5.4 ± 0.8 |
| 500 | 52.7 ± 4.4* | 17.5 ± 2.1 | 22.7 ± 2.4 | 2.1 ± 0.5 | 0.0 ± 0.0* | 18.3 ± 2.2 |
| 1000 | – | – | 18.0 ± 2.9 | – | – | 16.5 ± 1.9 |
| Контроль d-ГЛА | 1.4 ± 0.41 | 1.8 ± 0.71 | 5.2 ± 0.31 | 1.8 ± 0.71 | 1.8 ± 0.71 | 5.2 ± 0.31 |
| 6.7 ± 4.22 | 16.2 ± 3.32 | 18.1 ± 1.52 | 6.7 ± 4.22 | 6.7 ± 4.22 | 18.1 ± 1.52 | |
| Интактные клетки | 47.5 ± 1.11 | 88.5 ± 1.51 | 98.5 ± 0.31 | 88.5 ± 1.51 | 88.5 ± 1.51 | 98.5 ± 0.31 |
| 90.9 ± 3.62 | 97.0 ± 0.32 | 95.6 ± 0.42 | 90.9 ± 3.62 | 90.9 ± 3.62 | 95.6 ± 0.42 |
* – различия с соответствующим контролем d-ГЛА статистически достоверны при p < 0.05 (тест Манн–Уитни); жирным шрифтом выделены значения, демонстрирующие положительный эффект веществ. 1 показатели контрольной группы d-ГЛА и интактной группы клеток без воздействия для низких концентраций веществ: для (I), (IIa), (IIc), (IId) в диапазоне от 3.5 до 50 мкмоль/л, для IIb, IIe – 250 мкмоль/л. 2 показатели контрольной группы d-ГЛА и интактной группы клеток без воздействия для высоких концентраций веществ: для (I), (IIa), (IIc), (IId) в диапазоне от 62.5 до 500 мкмоль/л, для (IIb), (IIe) – 500–1000 мкмоль/л.
Рис. 3.
Зависимость цитопротекторной активности (жизнеспособности клеток Chang Liver на фоне токсического воздействия d-ГЛА) исследуемых соединений от концентрации.
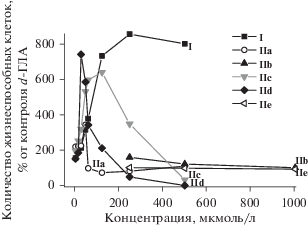
Из данных табл. 2 следует, что в низких концентрациях Ксимедон (I) проявляет тенденцию к повышению количества живых клеток относительно контроля d-ГЛА. Статистически достоверный протекторный эффект пиримидин (I) проявил в диапазоне концентраций от 35 до 500 мкмоль/л. Максимальный эффект пиримидина I, приводящий к увеличению количества живых клеток в 8.4 раза, наблюдался при концентрации 250 мкмоль/л (табл. 2, рис. 3).
Среди “сдвоенных” производных Ксимедона наименьший протекторный эффект проявили соединения (IIb) и (IIe) (табл. 2, рис. 3), причем изофталат (IIe) не оказал какого-либо эффекта, а глутарат (IIb) в условиях токсического воздействия d-ГЛА оказал протекторный эффект лишь в концентрации 250 мкмоль/л, приводя к увеличению количества живых клеток на 56% по отношению к контролю d-ГЛА.
Адипинат (IIc) среди новых производных Ксимедона оказался наиболее эффективным в качестве гепатопротектора, т.к. под его влиянием (концентрация 125 мкмоль/л) увеличилось количество живых клеток в 6.3 раза по сравнению с контролем d-ГЛА (табл. 2, рис. 3). Однако, данное соединение проявило чуть меньший эффект по сравнению с аналогичной концентрацией пиримидина (I), приводящего к повышению количества живых клеток в тех же условиях в 7.2 раза. Менее выраженный гепатопротекторный эффект проявили соединения (IIa) и (IId), приводя к повышению количества живых клеток в условиях воздействия d-ГЛА при концентрации 25 мкмоль/л в 2.2 и 7.3 раз соответственно. Сукцинат (IIa) в концентрации 50 мкмоль/л и суберат (IId) в концентрации 62.5 мкмоль/л повышают количество живых клеток в 3.4 раза (табл. 2, рис. 3). В больших концентрациях сукцинат (IIa) и суберат (IId) не проявили цитопротеторного эффекта, что может быть связано с ингибирующим действием самих веществ.
Результаты исследования клеточного цикла, представленные на рис. 4 и 5, показали, что пиримидин (I) оказало эффект через 24 часа инкубации, приводя к достоверному увеличению количества клеток в фазе покоя/пресинтетическая фаза (G0/G1) и уменьшению количества клеток в синтетической фазе S и в фазе постсинтетическая/митотическая (G2/M) (рис. 4а). Через 72 часа, наоборот, наблюдали уменьшение количества клеток в фазе G0/G1 и увеличение количества клеток в фазе S, что свидетельствует о стимуляции репликации ДНК (рис. 4б). Количество клеток в фазе G2/M через 72 часа инкубации не отличалось от контрольных интактных клеток.
Рис. 4.
Зависимость количества клеток в определенных фазах клеточного цикла от концентрации соединения (I) через 24 (а) и 72 (б) часа инкубации. * – различия с интактными клетками (на графике – концентрация 0 мкмоль/л) статистически достоверное при p < 0.05 (тест Манн–Уитни).
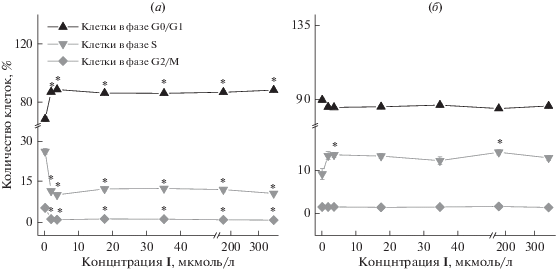
Рис. 5.
Зависимость количества клеток в определенных фазах клеточного цикла от концентрации соединения (IIa), (IIc) и (IId) через 24 часа (а, в, д соответственно) и 48 часов инкубации (б, г, е соответственно). * – различия с интактными клетками (на графике – концентрация 0 мкмоль/л) статистически достоверное при p < 0.05 (тест Манн–Уитни).
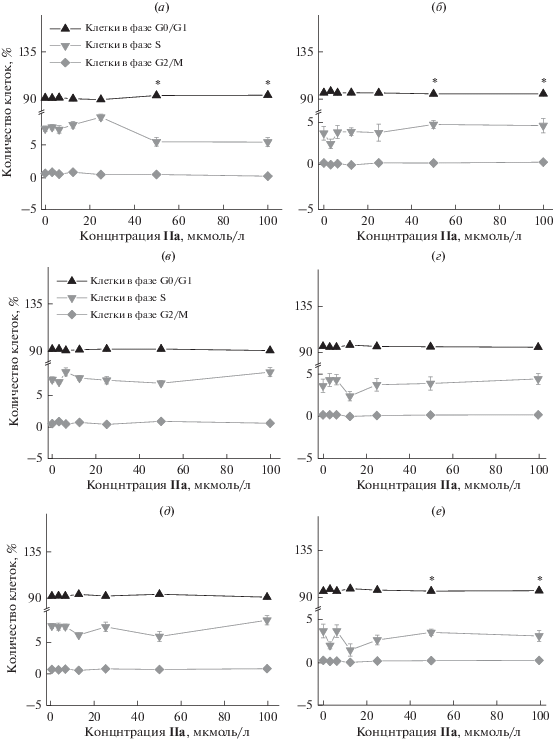
Результаты исследования влияния вновь синтезированных соединений на клеточный цикл показали, что сукцинат (IIa) вызывает увеличение количества клеток в фазе G0/G1 в высоких концентрациях 50 и 100 мкмоль/л через 24 часа инкубации и в низкой концентрации 3.125 мкмоль/л через 48 часов инкубации (рис. 5а, 5б). При этом увеличение количества клеток в фазе G0/G1 через 72 часа сопровождалось достоверным снижением количества клеток в фазе S при концентрации сукцината (IIa) 3.125 мкмоль/л. В свою очередь адипинат (IIc) не действует на клеточный цикл (рис. 5в, 5г). Суберат (IId) не оказал влияния на клеточный цикл через 24 часа (рис. 5д). Через 48 часов наблюдали увеличение количества клеток в фазе G0/G1 и уменьшение в фазе S при его добавлении в ростовую среду в концентрации 12.5 мкмоль/л (рис. 5е).
Результаты проведенных исследований показали, что лекарственный препарат на основе производного пиримидина Ксимедон (соединение I) проявляет отсутствие цитотоксичности и выраженные цитопротекторные свойства в условиях токсического воздействия d-галактозамина по отношению к гепатоцитам человека клеточной линии Chang Liver. На поздней стадии инкубации клеток (72 часа) Ксимедон оказывает стимулирующее влияние на репликацию ДНК, увеличивая количество клеток в синтетической фазе клеточного цикла. “Сдваивание” молекул Ксимедона посредством алкил(ксилиленил)дионатного мостика привело к повышению токсичности и менее выраженным гепатопротекторным свойствам по сравнению с исходным препаратом (I). Среди новых производных наибольший гепатопротекторный эффект, сопоставимый с Ксимедоном, проявило соединение (IIc), с адипинатным мостиком между фрагментами Ксимедона, в концентрации 125 мкмоль/л. Учитывая, что механизмом токсического влияния d-галактозамина является нарушение синтеза белка, следует предположить, что гепатопротекторный эффект Ксимедона и его производных связан с восстановлением белок-синтетической функции гепатоцитов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н, 13С регистрировали на спектрометре Avance-400 (Bruker, Германия) с рабочими частотами 400 МГц (1Н) и 100.6 МГц (13С), калибровали по использованному растворителю (CDCl3 и DMSO-d6, 7.26, 2.50 в спектрах 1Н, и 77.0, 44.0 в спектрах 13С соответственно). ИК-спектры соединений (νmax, см–1) записаны в тонком слое или в таблетках с KBr на Фурье-спектрометре Vector 22 (Bruker) при стандартных условиях в диапазоне 4000–400 см–1 при разрешении 4 см–1. Масс-спектры матрично-активированной лазерной десорбции/ионизации (МАLDI-TOF) получали на масс-спектрометре UltraFlex III фирмы Bruker. Матрица – п-нитроанилин. Элементный анализ проводили на C,H,N-анализаторе EuroVector.
1,2-Дигидро-4,6-диметил-1-(2-гидроксиэтил)пиримидон-2 (Ксимедон, (I)) синтезировали, исходя из 1,2-дигидро-4,6-диметилпиримидона-2 и 2-хлорэтанола по известной методике [10]. Сукцинилдихлорид, глутарилдихлорид, адипинилдихлорид, изофталилдихлорид (Acros Organics) и суберилдихлорид (Sigma) использовали продажные.
Общая методика получения соединений (IIа–е). К раствору 5.90 г (35.0 ммоль) Ксимедона (I) в 250 мл хлороформа добавляли 3.60 г (35.6 ммоль) триэтиламина, и в течение 1 ч и перемешивании прикапывали раствор 72.0 ммоль дихлорангидрида в 50 мл хлороформа. Реакционную массу перемешивали при 50–55°С в течение 10 ч. По охлаждении до комнатной температуры реакционную смесь концентрировали до 20–25 мл и хроматографировали на колонке с нейтральной Al2O3, активность II. Колонку последовательно элюировали петролейным эфиром, этилацетатом, смесью растворителей этилацетат–метанол (20 : 1) и этилацетат–метанол (4 : 1). Из фракций смеси растворителей этилацетат–метанол (4 : 1) получали смесь целевых соединений (IIа–е) с гидрохлоридом триэтиламина, которую растворяли в 150 мл хлороформа и промывали водой (3 × 200 мл). Органический слой отделяли и сушили над MgSO4, отфильтровывали, растворитель отгоняли, и получали целевые соединения (IIа–е).
1,4-Бис[2-(1,2-дигидро-4,6-диметил-2-оксопиримидин-1-ил)этил]бутан-дионат (сукцинат) (IIa). Выход соединения (IIа) 2.50 г (34%), красные кристаллы, т. пл. 143–144°С. ИК-спектр: 3052, 2961, 1736, 1649, 1608, 1541, 1305, 1151, 1042, 1025, 931, 796. ЯМР 1Н: 6.10 (с, 1Н, H5), 4.40–4.36 (м, 4Н, H2'), 4.24–4.20 (м, 4Н, H1'), 3.13–3.05 (м, 4Н, H4', H5'), 2.39 (с, 6Н, H6), 2.33 (с, 6Н, H4). ЯМР 13C (CDCl3): 175.0 (C3'), 172.3 (C4), 157.4 (C6), 155.7 (C2), 105.9 (C5), 60.7 (C2'), 45.9 (C1'), 35.0 (C4', C5'), 25.0 (C4 С), 24.4 (C6С). Масс-спектр MALDI-TOF, m/z: 418.8 [M + H]+, 440.8 [M + Na]+, 456.8 [M + K]+; вычислено для C20H26N4O6 419.2, 441.2, 457.2. Найдено, %: C, 57.52; H, 6.19; N, 13.43. C20H26N4O6. Вычислено, %: C, 57.41; H, 6.26; N, 13.39.
1,5-Бис[2-(1,2-дигидро-4,6-диметил-2-оксопиримидин-1-ил)этил]пентан-дионат (глутарат) (IIb). Выход соединения (IIb) 2.27 г (30%), красное масло. ИК-спектр: 2971, 1737, 1656, 1610, 1543, 1253, 934, 796. ЯМР 1Н (CDCl3): 6.08 (с, 1Н, H5), 4.45–4.41 (м, 4Н, H2'), 4.33–4.30 (м, 4Н, H1'), 2.37 (с, 6Н, H6), 2.30 (с, 6Н, H4), 2.29–2.26 (м, 4Н, H4', H6'), 1.72–1.69 (м, 2Н, H5'). ЯМР 13C (CDCl3): 174.1 (C3'), 174.0 (C4), 157.3 (C6), 155.2 (C2), 105.7 (C5), 61.57 (C2'), 46.2 (C1'), 33.3 (C4', C6'), 24.9 (C4С), 24.1 (C6С), 20.8 (C5'). Масс-спектр MALDI-TOF, m/z: 433.3 [M + H]+, 455.2 [M + Na], 471.2 [M + K]; вычислено для C21H28N4O6 433.2, 455.2, 471.2. Найдено, %: C, 58.22; H, 6.69; N, 12.93. C21H28N4O6. Вычислено, %: C, 58.32; H, 6.53; N, 12.96.
1,6-Бис[2-(1,2-дигидро-4,6-диметил-2-оксопиримидин-1-ил)этил]гексан-дионат (адипинат) (IIc). Выход соединения (IIc) 2.70 г (35%), красное масло. ИК-спектр: 2970, 1736, 1654, 1606, 1543, 1176, 1040, 941, 795. ЯМР 1Н (CDCl3): 6.06 (с, 1Н, H5), 4.40–4.35 (м, 4Н, H2'), 4.22–4.17 (м, 4Н, H1'), 2.37 (с, 6Н, H6), 2.30 (с, 6Н, H4), 2.26–2.23 (м, 4Н, H4', H9'), 1.59–1.56 (м, 4Н, H5', H6'). ЯМР 13C (CDCl3): 174.8 (C3'), 173.0 (C4), 157.1 (C6), 155.1 (C2), 105.8 (C5), 61.5 (C2'), 46.0 (C1'), 33.6 (C4', C7'), 24.9 (C4С), 24.4 (С5', С6'), 24.0 (C6С). Масс-спектр MALDI-TOF, m/z: 447.2 [M + H]+, 469.2 [M + Na]; вычислено для C22H30N4O6 447.2, 469.2. Найдено, %: C, 59.22; H, 6.89; N, 12.43. C22H30N4O6. Вычислено, %: C, 59.18; H, 6.77; N, 12.55.
1,8-Бис[2-(1,2-дигидро-4,6-диметил-2-оксопиримидин-1-ил)этил]октан-дионат (суберат) (IId). Выход соединения (IId) 3.75 г (47%), красные кристаллы, т. пл. 105–106°С. ИК-спектр: 2978, 1737, 1656, 1608, 1543, 1172, 1037, 939, 796. ЯМР 1Н: 6.09 (с, 1Н, H5), 4.41–4.37 (м, 4Н, H2'), 4.25–4.21 (м, 4Н, H1'), 2.39 (с, 6Н, H6), 2.32 (с, 6Н, H4), 2.28–2.25 (м, 4Н, H4', H9'), 1.60–1.50 (м, 4Н, H5', H8'), 1.26–1.21 (м, 4Н, H6', H7'). ЯМР 13C (CDCl3): 175.2 (C3'), 173.1 (C4), 156.9 (C6), 156.0 (C2), 106.2 (C5), 61.2 (C2'), 45.9 (C1'), 33.6 (C4', C9'), 28.6 (С5', С8'), 25.1 (C4С), 24.4 (C6С), 20.3 (С6', С7'). Масс-спектр MALDI-TOF, m/z: 475.0 [M + H]+, 497.0 [M + Na], 512.9 [M + Na]; вычислено для C24H34N4O6 475.3, 497.2, 513.2. Найдено, %: C, 60.82; H, 7.29; N, 11.73. C24H34N4O6. Вычислено, %: C, 60.74; H, 7.22; N, 11.81.
1,3-Бис[2-(1,2-дигидро-4,6-диметил-2-оксопиримидин-1-ил)этил]бенз-диоат (изофталат) (IIe). Выход соединения (IIe) 2.85 г (35%), желтые кристаллы, т. пл. 63–65°С. ИК-спектр: 3050, 2970, 1736, 1656, 1609, 1542, 1346, 1167, 1042, 1028, 938, 795. ЯМР 1Н (DMSO-d6): 8.13 (c, 1H, HAr), 8.05–8.02 (м, 2Н, HAr), 7.54–7.51 (м, 1Н, HAr), 6.43 (с, 1Н, H5), 4.47–4.40 (м, 8Н, H2', H1'), 2.41 (с, 6Н, H6), 2.27 (с, 6Н, H4). ЯМР 13C (DMSO-d6): 171.8 (C3'), 162.3 (C4), 156.2 (C6), 154.0 (C2), 129.8, 125.8, 124.5 (СAr), 105.0 (C5), 58.2 (C2'), 40.3 (C1'), 19.2 (C4 С), 15.4 (C6С). Масс-спектр MALDI-TOF, m/z: 467.2 [M + H]+, 480.2 [M + Na]+, 505.1 [M + K]+; вычислено для C24H26N4O6 467.2, 480.2, 505.1. Найдено, %: C, 61.77; H, 5.52; N, 12.11. C24H26N4O6. Вычислено, %: C, 61.72; H, 5.62; N, 12.01.
Определение цитотоксичности и цитопротекторных свойств in vitro. Эксперименты проводили на клеточной линии нормальных гепатоцитов человека Chang Liver, полученных из коллекции клеточных культур НИИ вирусологии им. Д.И. Ивановского РАМН. Культивирование клеток осуществляли в среде ИГЛА-МЕМ с добавлением 10% бычьей сыворотки FBS, 1% незаменимых аминокислот и антибиотика гентамицина (Freshney, 2016).
Клетки открепляли от флакона смесью трипсина и версена в соотношении 1 : 3 и готовили клеточную суспензию с концентрацией 105 клеток на мл, раскапывали по 200 мкл суспензии в 96-ти луночный планшет и инкубировали 24 часа. Для исследования цитотоксичности в ростовую среду вносили исследуемые соединения. Цитотоксичность соединений IIa–e исследовали в концентрациях от 3.115 мкмоль/л до 25 ммоль/л, соединения I – в диапазоне концентраций от 3.1 мкмоль/л до 200 ммоль/л. Для исследования гепатопротекторного эффекта, согласно [9], вместе с исследуемым соединением вносили токсикант – d-галактозамин (d-ГЛА) в концентрации 150 ммоль/л. Цитопротекторный эффект соединений исследован в диапазоне концентраций от 6.25 до 500 мкмоль/л. В качестве референсного контроля интактной группы использованы клетки, в ростовую среду которых при культивировании не вносили исследуемых соединений и d-ГЛА. В ростовую среду контрольной группы клеток (контроль d-ГЛА) вносили только d-ГЛА в концентрации 150 ммоль/л.
Для определения количества жизнеспособных клеток готовили полную ростовую среду с флуоресцентными красителями из расчета на одну лунку 198 мкл полной ростовой среды + 2 мкл DAPI (концентрация 1 мг/мл) + 0.5 мкл йодида пропидия. Далее, культуральную жидкость заменяли на приготовленную ростовую среду с красителями и инкубировали в течении 45 минут. После инкубирования проводили подсчет живых и мертвых клеток на клеточном анализаторе CyTell Cell Imaging System фирмы GE Healthcare с использованием стандартного протокола.
Исследовали влияние веществ (IIa), (IIc), (IId), проявивших наиболее выраженные цитопротекторные свойства и наименьшую токсичность, на клеточный цикл клеток Chang Liver. Для исследования клеточного цикла в ростовую среду добавляли исследуемые соединения в концентрациях 3.125–100 мкмоль/л и инкубировали 24 ч. Затем культуральную жидкость заменяли на приготовленную ростовую среду с Hoechst 33342 (концентрация 1 мг/мл) при внесении на лунку 196 мкл ростовой среды и 4 мкл Hoechst 33342 соответственно, и инкубировали в течение 45 минут. Определение клеточного цикла проводили по специальному протоколу на Cytell Cell Imaging System.
Каждый тип воздействия на клетки выполняли в трех повторах. Сравнивали полученные результаты с интактными клетками, не подвергавшимися воздействиям, и с контролем d-ГЛА. Рассчитывали средние значения и стандартную ошибку, сравнения между группами клеток, подвергавшимся различным воздействиям, выполняли по тесту Манн–Уитни.
Список литературы
Kim M.N., Kim B.K., Han K.H. // J. Gastroenterol. 2013. V. 48. P. 681–688. https://doi.org/10.1007/s00535-013-0770-9
Измайлов С.Г., Паршиков В.В. //Нижегородский медицинский журнал. 2002. № 3. С. 81–87.
Raginov I.S., Egorov V.I., Valiullin L.R., Watanabe D., Balakin K.V., Murinov Y.I.-// Neuroscience Letters. 2019. V. 706. P. 110–113. https://doi.org/10.1016/j.neulet.2019.05.008
Wu D., Lee S., Luo J., Xia H., Gushchina S., Richardson P.M., Yeh J., Krügel U., Franke H., Zhang Y., Bo X. // J. Neurosci. 2018. V. 38. P. 1351–1365. https://doi.org/10.1523/JNEUROSCI.1660-17.2017
Kuo W.L.,Yu M.C., Lee J.F., Tsai C.N., Chen T.C., Chen M.F. // J. Gastrointest. Surg. 2012. V. 16. P. 361–369. https://doi.org/10.1007/s11605-011-1764-7
Выштакалюк А.Б., Семенов В.Э., Зобов В.В., Галяметдинова И.В., Гумарова Л.Ф., Парфенов А.А., Назаров Н.Г., Ленина О.А., Кондрашова С.А., Латыпов Ш.К., Черепнев Г.В., Шашин М.М., Резник В.С. // Биоорган. химия. 2017. Т. 43. С. 572–580. [Vyshtakalyuk A.B., Semenov V.E., Zobov V.V., Galyametdinova I.V., Gumarova L.F., Parfenov A.A., Nazarov N.G., Lenina O.A., Kondrashova S.A., Latypov Sh.K., Cherepnev G.V., Shashin M.S., Reznik V.S. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 604–611.] https://doi.org/10.1134/S106816201704015X
Парфенов А.А., Выштакалюк А.Б., Гумарова Л.Ф., Хасаншина Л.Р., Беляев Г.П., Назаров Н.Г., Кондрашина Д.А, Галяметдинова И.В., Зобов В.В., Семенова В.Э. // Изв. АН. Сер. хим. 2019, С. 2307–2315. [Parfenov A.A., Vyshtakalyuk A.B., Gumarova L.F., Khasanshina L.R, Belyaev G.P., Nazarov N.G., Kondrashina D.A., Galyametdinova I.V., Zobov V.V., Semenov V.E. // Russ. Chem. B+. 2019. Vol. 68. P. 2307–2315.] https://doi.org/10.1007/s11172-019-2704-z
Выштакалюк А.Б., Семенов В.Э., Судаков И.А., Бушмелева К.Н., Гумарова Л.Ф., Парфенов А.А., Назаров Н.Г., Гиляметдинова И.В., Зобов В.В. // Изв. АН. Сер. хим. 2018. С. 705–711. [Vyshtakalyuk A.B., Semenov V.E., Sudakov I.A., Bushmeleva K.N., Gumarova L.F., Parfenov A.A., Nazarov N.G., Galyametdinova I.V., Zobov V.V. // Russ. Chem. B+. 2018. V. 67. P. 705–711.] https://doi.org/10.1007/s11172-018-2126-3
Миронов А.Н. и др. Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. Миронова А.Н., М.: Гриф и К, 2012. 944 с.
Reznik V.S., Pashkurov N.G. // Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science. 1965. V. 15. P. 1554–1557.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия