Биоорганическая химия, 2021, T. 47, № 1, стр. 29-56
Гликоконъюгатные вакцинные препараты для иммунопрофилактики заболеваний, вызываемых Haemophilus influenzae типа b
Е. А. Хатунцева 1, Н. Э. Нифантьев 1, *
1 Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский проспект, 47, Россия
* E-mail: nen@ioc.ac.ru
Поступила в редакцию 27.07.2020
После доработки 10.08.2020
Принята к публикации 11.08.2020
Аннотация
Обзор посвящен лабораторному и промышленному синтезу гликоконъюгатных вакцин, направленных на профилактику заболеваний, вызываемых бактерией Haemophilus influenzae типа b, с применением линейного капсулярного полисахарида поли-3-β-D-рибозил-(1→1)-D-рибит-5-фосфата (PRP) или синтетических олигосахаридных лигандов, структурно родственных фрагментам PRP. Также рассмотрены методы синтеза указанных олигосахаридных производных и результаты исследований влияния их длины на иммунные свойства соответствующих конъюгатов с белками-носителями.
ВВЕДЕНИЕ
Синтетические углеводные вакцины на основе конъюгатов адъювантных белков-носителей с бактериальными полисахаридами (углеводные вакцины второго поколения [1, 2]) или синтетическими олигосахаридами (углеводные вакцины третьего поколения), структурно родственными иммунодетерминантным фрагментам антигенных полисахаридов, находят в настоящее время все более широкое применение для профилактики бактериальных инфекций [3–9]. К этому типу препаратов относится одна из наиболее важных вакцин в истории здравоохранения – вакцина против опасного бактериального патогена Haemophilus influenzae типа b (Hib, гемофильная палочка). Заболевания, вызываемые Hib, являются главной причиной бактериальных менингитов и пневмоний у детей младшего возраста. Для борьбы с Hib-инфекциями создан ряд вакцин, включение которых в календарь прививок позволило практически полностью исключить вызываемые этой бактерией заболевания из статистики смертности и инвалидизации. По оценке ВОЗ, конъюгированные вакцины против Hib относятся к наиболее безопасным и эффективным, предотвращая до 90% инвазивных случаев гемофильной инфекции.
В России вакцинопрофилактика инфекций, вызываемых Hib, с 2011 г. введена в национальный календарь профилактических прививок. На сегодняшний день предусматривается трехкратная вакцинация для детей, входящих в группы риска, в 3, 4, 5 месяцев и ревакцинация в возрасте 18 месяцев [10]. Это связано с опасностью, которую данный патоген представляет для детей младшего возраста, вызывая у них инвазивные инфекционные состояния: гнойный менингит (до 55% от всех инвазивных форм), эпиглоттит, пневмонию, бактериемию и сепсис [11]. Наиболее тяжелым заболеванием, вызванным Hib-инфекцией, является гнойный менингит. При этом заболевании средний мировой показатель летальности достигает 43% [12], а у 14.5% переболевших детей наблюдаются долгосрочные неврологические осложнения, такие как ментальные расстройства (до 13%), нарушения моторики (до 8%) и глухота (до 8%) [13].
По данным ВОЗ, в довакцинный период у детей от 0 до 5 лет среднемировой и европейский показатели доли гнойных менингитов, вызванных Hib, среди всех гнойных менингитов выявленной этиологии составляли 38–40%, при этом в Европе их годовая частота составляла 11–40 случаев на 100 тыс. детей в возрасте до одного года [14]. К настоящему времени мировому сообществу удалось существенно уменьшить [12] количество инвазивных Hib-инфекций благодаря широкому распространению конъюгированных вакцин, которые успешно применяются во всем мире уже более 30 лет. Во всех странах, включивших Hib-вакцину в национальный календарь обязательных прививок, наблюдалось резкое сокращение случаев инвазивных заболеваний [12, 15].
Внесение рутинной Hib-вакцинации в национальный календарь прививок началось в 1986 г. с Канады, к 2002 г. вакцинацией против Hib были охвачены страны Северной и Южной Америки, а к 2014 г. вакцинопрофилактика Hib была введена на практически всем африканском континенте, как и в странах Западной и Восточной Европы. К концу 2018 г. более 190 стран-участниц ВОЗ внесли вакцинацию против Hib в национальные программы иммунизации, причем 72% реципиентов были привиты трехкратно [16]. Исключение составили две большие территории евразийского континента: Российская Федерация и Китайская Народная Республика (КНР), в которых эпидемическая ситуация по Hib существенно различается. Так, в КНР годовая летальность заболеваний Hib у детей до 5 лет составляет 10–25 случаев на 100 тыс. детей, и по данным на 2018 г. только ~30% детей младшего возраста получают три дозы вакцины против Hib [17].
В России показатель годовой смертности от инвазивных Hib-инфекций составляет в среднем менее 10 случаев на 100 тыс. детей этой возрастной группы [18]. Как показал микробиологический анализ 89 штаммов H. influenzae, выделенных из крови и спинномозговой жидкости больных инвазивной гемофильной инфекцией из лечебно-профилактических учреждений ряда российских городов, 95.5% этих случаев вызвано именно Hib [19]. Показатель годовой заболеваемости менингитом гемофильной этиологии на территории России в 2017 г. составлял 5.0–16.9 случаев [20], а по другим данным – 3–20 случаев на 100 тыс. детей первых пяти лет жизни [11, 21, 22]. Для Москвы этот показатель в 2005 г. составлял 5.7 случаев [23], по другим данным – 6.5 случаев на 100 тыс. детей до 5 лет [11]. Эти цифры можно было бы существенно уменьшить путем внесения обязательной вакцинации против Hib в национальный календарь прививок. Опыт зарубежных стран свидетельствует о том, что частота инвазивных заболеваний, вызванных Hib, может быть снижена до 0.2 случаев на 100 тыс. детей [14, 24].
Гемофильные палочки входят в состав биоценоза носоглотки у здоровых взрослых и детей, которая, таким образом, является естественным резервуаром для этих бактерий, способных долгое время присутствовать в организме человека как сапрофиты. В России уровень носительства бактерией H. influenzae типа b у детей находится обычно в диапазоне 1–10%, а в условиях скученности и в младших классах школы возрастает до 40% [11]. У взрослого населения носительство может достигать 10% [25]. На фоне вирусных инфекций или сниженного иммунитета эти бактерии вызывают острые респираторные заболевания. Характерный для таких заболеваний воздушно-капельный путь передачи обеспечивает их широкое распространение. Анализ фарингеального носительства H. influenzae у детей дошкольного возраста с диагнозами аденоиды, хронические тонзиллит и фарингит показали, что оно составляет 11–12% микрофлоры ротоглотки [26].
ОСОБЕННОСТИ ИММУННОГО ОТВЕТА НА ИММУНИЗАЦИЮ КАПСУЛЯРНЫМ ПОЛИСАХАРИДОМ (КПС) Hib И СООТВЕТСТВУЮЩИМИ КОНЪЮГИРОВАННЫМИ ВАКЦИНАМИ
Главным фактором вирулентности Hib является полисахаридная капсула, препятствующая фагоцитозу [12]. Ее ключевой компонент – линейный капсулярный полисахарид PRP (поли-3-β-D-рибозил-(1→1)-D-рибит-5-фосфат), строение повторяющегося звена которого показано на рис. 1. В организме человека PRP, как и КПС других патогенов человека (например, Neisseria meningitidis и Streptococcus pneumoniae), индуцирует преимущественно Т-независимый иммунный ответ 2-го типа (TI-2), который не предполагает презентацию пептидов в составе белков главного комплекса гистосовместимости (MHC-II) и стимулирует выработку защитных антител без участия Т-хелперов.
Основная задача TI-2-ответа – распознавание в кровотоке КПС, свидетельствующих о начале бактериемии, и быстрая выработка защитных антител изотипа IgM. Иммунный ответ такого типа обеспечивают расположенные в маргинальной зоне селезенки В-клетки, на поверхности которых экспрессируются специальные рецепторы BCR, включающие в себя мембранные антитела изотипа IgM. Попавшие в кровоток КПС образуют комплекс с элементом врожденной иммунной системы – белковым фактором C3d. Ключевой стадией захвата КПС рецептором BCR является взаимодействие фактора C3d с корецептором CR2, который в больших количествах экспрессируется на В-клетках селезенки взрослого человека. В то же время у детей в возрасте до 2 лет этот ключевой для детекции бактериальных КПС корецептор экспрессируется слабо [27], тем самым снижая эффективность иммунного ответа по типу TI-2 и ослабляя защиту от инвазий бактерий, имеющих полисахаридную капсулу. Высокий уровень материнских антигемофильных антител, защищающий детей первых двух месяцев жизни, снижается к 3-месячному возрасту, и только к 4–5 годам иммунитет TI-2 достигает взрослого уровня, обеспечивая защитный уровень антител к КПС. Таким образом, целевой группой населения для вакцинации против Hib являются дети от 2 месяцев до 2 лет, наиболее подверженные инвазивным заболеваниям, вызванным данной инфекцией.
T-Зависимый иммунный ответ (TD) у детей младшего возраста развивается быстрее [28], чем TI-2, и задача профилактических вакцин против заболеваний, вызываемых бактериями с полисахаридной капсулой, состоит в том, чтобы направить иммунный ответ по Т-зависимому пути [6]. Эту задачу решило появление конъюгированных вакцин, состоящих из КПС или их фрагментов, ковалентно связанных с адъювантным белком-носителем [29].
Механизм формирования T-зависимого иммунного ответа представляет собой сложный процесс последовательных и параллельных событий [30], конкретные детали которого на современном этапе развития иммунологии невозможно однозначно запрограммировать на уровне физико-химических свойств конъюгированных вакцинных препаратов, но ключевые факторы, определяющие иммунный ответ к конъюгированным вакцинам, уже исследованы [31, 32].
После инъекции моновалентные конъюгированные вакцины, которые рекомендуется [33–36] растворять в изотоническом растворе, в значительных количествах попадают в кровоток и лимфатическую систему. В селезенке и лимфатических узлах резидентные В-клетки поглощают углевод-белковый конъюгат, расщепляют белок-носитель до пептидов и презентируют их в составе MHС-II для рецептора αβ-TCR белкового комплекса CD4+ на поверхности Т-хелперов [37]. Стимулированные этим воздействием Т-клетки продуцируют цитокин IL-4, который катализирует созревание В-клеток, поглотивших антиген.
Другой путь формирования иммунного ответа на иммунизацию конъюгированными вакцинами реализуется с участием дендритных клеток. Инъекция Hib-вакцин проводится в четырехглавую мышцу бедра, а у более старших детей – в дельтовидную мышцу плеча, т.е. в скелетные мышцы, в которых присутствуют три типа дендритных клеток: незрелые дендритные клетки моноцитарного происхождения (Mo-DC) и два подтипа обыкновенных дендритных клеток, происходящие из общего моноцитарного предшественника Gr1+Ly-6Chigh. При микробной инфекции эти моноциты в больших количествах рекрутируются к месту воспаления, где превращаются в макрофаги с фенотипами CD11b+CD11c–2MHCII+ и CD11b+CD11c+MHCII+ [31]. Такие же процессы инициирует в месте инъекции гликан-белковый конъюгат. Макрофаги захватывают белковые антигены, деполимеризуют их с сохранением гликан-пептидных связей [38] и доставляют в лимфоузлы для презентации CD4+-Т-клеткам. Праймированные Т-клетки далее инициируют созревание поглотивших антиген В-клеток с последующей пролиферацией и дифференцировкой [39]. Этот этап является ключевым для развития антиген-специфичного иммунного ответа и формирования иммунной памяти. На втором этапе созревшие В-клетки частично превращаются в плазматические клетки с развитыми эндоплазматическим ретикулумом и аппаратом Гольджи, которые начинают интенсивно синтезировать иммуноглобулины изотипов IgG1 и IgE, и частично – в В-клетки памяти [39]. Таким образом, дополнительный положительный эффект от иммунизации конъюгированными гликан-белковыми вакцинами состоит в том, что об эффективности формирования иммунной памяти можно судить по постиммунизационной концентрации антител изотипа IgG в сыворотке крови.
Рекрутирование предшественника дендритных клеток Gr1+Ly-6Chigh в мышцы многократно усиливается при использовании адъювантов [40]. Большинство современных конъюгированных поливалентных вакцин с Hib-компонентом используются в виде смеси с нерастворимыми адъювантами, представляющими собой гидроксид или фосфаты алюминия [41]. Известно, что, будучи введенными в организм в виде суспензии, адъюванты не только выполняют роль депо для адсорбированной на них вакцины, но и активируют систему врожденного иммунитета таким образом, что стимулируют иммунный ответ c участием TH2-хелперов. В то же время адсорбция конъюгированных Hib-вакцин на солях алюминия не является обязательным условием эффективной иммунизации, включающей индукцию антител изотипа IgG и формирование иммунной памяти [42].
ИНДУКЦИЯ PRP-СПЕЦИФИЧНЫХ АНТИТЕЛ КАК КРИТЕРИЙ ЭФФЕКТИВНОСТИ Hib-ВАКЦИНАЦИИ
Клинические испытания, проведенные в Финляндии в 1977 г. [43, 44], продемонстрировали положительную связь между повышением уровня антител к PRP и защитным действием конъюгированной вакцины против Hib. Многочисленные исследования эффективности вакцинации конъюгированными Hib-вакцинами указывают на важность высоких постиммунизационных титров антител к PRP у детей младшего возраста [45–47]. В частности, это подтвердил 8-летний опыт Hib-иммунизации в Великобритании, в которой с 1992 г. введена обязательная трехкратная вакцинация детей в возрасте 2, 3 и 4 месяцев. После резкого снижения заболеваемости инвазивными формами Hib к 1994 г., она начала расти в 1999 г., при этом 85% заболевших детей были вакцинированными. Это связано с тем, что с 1996 г. для вакцинации начали использовать менее иммуногенную комбинированную вакцину, включающую не только Hib-компонент, но и вакцину АКДС c коклюшным ацеллюлярным компонентом [48, 49], что привело к образованию низкоавидных антител [50, 51]. Эта проблема была решена с помощью дополнительной иммунизации моновакциной Hib, существенно поднявшей концентрацию Hib-защитных антител [52].
В настоящее время критерием уровня эффективности применения вакцины против Hib служит количество пациентов, у которых в крови обнаруживаются специфичные к PRP антитела в низкой (менее 0.15 мкг/мл, не обеспечивают защиты от инфекции), средней (0.15–1.00 мкг/мл, обеспечивают неполную защиту) и высокой концентрации (более 1.0 мг/мл, обеспечивают надежную защиту от инфицирования) через месяц после первичного курса трехкратной иммунизации и через месяц после ревакцинации [45, 53].
Исследование эффективности образования PRP-специфичных антител у детей [54], которых вакцинировали конъюгатом PRP-CRM197 (синтез рассмотрен ниже), показало, что для формирования иммунной памяти необходимо провести как минимум две иммунизации конъюгированной вакциной. Стандартная схема иммунизации для вакцинопрофилактики Hib-заболеваний включает трехкратную иммунизацию конъюгированной вакциной в 3, 4 и 5 месяцев и, в ряде случаев, еще одну бустерную иммунизацию в 18 месяцев. Временные точки для трехкратной иммунизации выбраны таким образом, чтобы синхронизировать Hib-иммунизацию со схемой вакцинации и ревакцинации АКДС. Для эффективной иммунизации конъюгированными Hib-препаратами важно, чтобы ей не предшествовала преиммунизация белком-носителем, которая снижает концентрацию анти-PRP-антител в 2–3 раза [55].
Эффективность описанной выше схемы иммунизации подтверждена в ходе соответствующих клинических испытаний. Например, проведенные фирмой GSK (производитель Hib-вакцины Hiberix®) клинические испытания, включавшие трехкратную иммунизацию и бустерную дозу в 15–18 месяцев, показали, что у 95–100% младенцев через месяц после трехкратной иммунизации титр PRP-специфичных антител составил 0.15 мкг/мл. Через месяц после бустерной иммунизации титр антител 0.15 мкг/мл был выявлен у 100% детей, а титр 1 мкг/мл – у 94.7% детей [35]. Это позволило сделать вывод, что данная вакцина обеспечивают надежную защиту от инфицирования Hib. Схема вакцинации, включающая бустерную дозу, дороже, но существенно эффективнее в сравнении с трехкратной вакцинацией. Так, в США использование этой схемы иммунизации с 2002 г. привело к 99%-ному сокращению случаев инвазивных Hib-заболеваний у детей до 5 лет [24].
ИСТОРИЯ СОЗДАНИЯ КОНЪЮГИРОВАННЫХ Hib-ВАКЦИН
Вакцинология заболеваний бактериальной природы, активное развитие которой началось в 30-х гг. ХХ века, уже в 60–70-х гг. получила новый импульс после длительного перерыва, связанного с открытием антибиотиков. В числе первых ее успехов была разработка вакцины против Hib-инфекции [56]. В 1977 г. в Финляндии были проведены масштабные клинические испытания [43, 44], в ходе которых 50 000 детей в возрасте от 3 месяцев до 5 лет были вакцинированы очищенным полисахаридом PRP и еще 50 000 детей наблюдали в качестве контрольной группы. У всех получивших вакцину детей старше 18 месяцев выработались антитела и сформировался защитный иммунитет против Hib, тогда как в контрольной группе 11 детей заболели. В то же время эта вакцинация не оказала защитного действия на детей младше 18 месяцев (наиболее подверженную опасным состояниям возрастную группу) – для них PRP оказался слабым иммуногеном. Кроме того, полисахарид PRP не обеспечивал бустерного эффекта [57] и не оказывал влияния на микрофлору носоглотки [58]. Выводы о низкой иммуногенности PRP у детей до 18 месяцев подтвердило 4-летнее применение лицензированной в 1985 г. в США полисахаридной вакцины [59, 60]. Таким образом, вакцинопрофилактика заболеваний, вызываемых Hib, проводившаяся с использованием вакцины 1-го поколения – КПС PRP, оказалась неэффективной [61].
Логичным методом преодоления недостаточной иммуногенности полисахарида PRP является его замена на конъюгат с адъювантным белком-носителем, опираясь на пионерские работы лабораторий W.F. Goebel и K. Landsteiner, выполненные еще в 20–30-е гг. прошлого века [62–64]. Следуя этой логике, в лаборатории J.B. Robbins [65] была синтезирована серия ковалентно связанных конъюгатов PRP с белками BSA, HSA, гемоцианином мечехвоста Limulus polyphemus и дифтерийным токсином (Т). Было показано, что иммунизация такими препаратами стимулирует образование антител, специфичных к Hib и обладающих бактерицидной активностью. Сравнение эффективности иммуностимулирующей способности этих белков исследователи не проводили. Аналогичный продукт был создан P. Anderson et al. [66], которые в 1985 г. опубликовали данные об успешной иммунизации младенцев конъюгированной Hib-вакциной, состоящей из PRP и дифтерийного анатоксина. Клинические испытания созданной вслед за этим конъюгированной вакцины, проводившиеся с участием 61 080 детей в 1988 и 1990 гг. в штате Северная Каролина в США, подтвердили 100%-ную эффективность вакцинации при введении двух или более доз [61]. С этих пионерских работ фактически началась новая эра в вакцинопрофилактике бактериальных заболеваний – эра конъюгированных вакцин, состоящих из бактериальных полисахаридов или синтетических олигосахаридов, структурно родственных иммунодетерминантным фрагментам полисахаридов, ковалентно связанных с адъювантными белками-носителями.
С 1980-х гг. резко возросло количество публикаций [3, 4, 37, 67, 68], описывающих синтез и иммуногенность конъюгированных Hib-вакцин, наиболее эффективные из которых начали выпускаться в промышленных масштабах [5, 69]. Но одна из первых коммерческих конъюгированных моновалентных вакцин против Hib, включающая дифтерийный анатоксин (DT) в качестве носителя – ProHIBiT® (PRP-DT, Connaught Laboratories Inc.), зарегистрированная в США в 1987 г., оказалась малоэффективной. Однако ей на смену была получена вакцина HibTITER® (PRP-CRM197, Wyeth Pharmaceuticals Inc.) на основе белка-носителя CRM197 и низкомолекулярного полисахарида PRP. HibTITER® была разрешена к применению Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 1990 г. и снята с производства только в 2007 г. В 1989 г. в США была зарегистрирована моновалентная вакцина PedvaxHIB® (PRP-OMP, MSD), которая содержала в качестве адъювантного носителя белок внешней мембраны менингококка группы B (сейчас ее производство тоже остановлено), конъюгированный также с низкомолекулярным PRP. На основе столбнячного анатоксина (TT) были созданы моновалентная вакцина PRP-TT (Pasteur Merieux) [70], зарегистрированная в 1993 г. в США как ActHIB® (Sanofi), и вакцина OmniHIB® (SmithKline Beecham Pharmaceuticals), зарегистрированная в 1996 г., но в настоящее время снятая с производства.
Значительным событием в области исследования углеводных конъюгированных вакцин явилось создание кубино-канадским коллективом исследователей, возглавляемых V. Verez-Bencomo и R. Roy, конъюгированной вакцины на основе TT и олигомерной смеси спейсерированных олигосахаридов, соответствующих фрагментам полисахарида PRP [71], которая фактически является одним из первых примеров углеводных вакцин третьего поколения [2] (ниже рассмотрен синтез этой вакцины, см. схему 13 ). Данный продукт был зарегистрирован на Кубе в 2003 г. под торговым названием Quimi-Hib® (Heber Biotec S.A.) и сегодня используется в ряде стран мира.
КОММЕРЧЕСКИЕ КОНЪЮГИРОВАННЫЕ Hib-ВАКЦИНЫ НА ОСНОВЕ PRP
В настоящее время для профилактики Hib-инфекции применяются моно- и поливалентные Hib-вакцины. На рынке присутствуют следующие моновалентные конъюгированные Hib-вакцины: VaxemHIB® (GSK, представляет собой конъюгат низкомолекулярного PRP и CRM197), Hiberix® (PRP-ТТ, GSK, зарегистрирована в 2009 г.), Sii HibPRO® (PRP-ТТ, Serum Institute of India Ltd.) и PedvaxHIB® (PRP-OMPC, MSD). Они поставляются в виде раствора или лиофилизата, который перед использованием необходимо растворить в изотоническом растворе или суспензии других вакцинных препаратов.
Все большее распространение получают комбинированные вакцины, включающие конъюгированные вакцинные препараты против Hib, что связано в первую очередь с экономической целесообразностью. Помимо Hib-компонента они содержат комплекс АКДС, а также один или два регионально-ориентированных вакцинных компонента (HBV или IPV). При формулировании таких вакцин необходимо учитывать химические и иммунологические свойства Hib-конъюгатов. Конъюгаты PRP нестабильны в водных растворах и в присутствии адъювантов на основе алюминия, поэтому в большинстве случаев лиофильно высушенный Hib-компонент поливалентной вакцины упакован отдельно от остальных компонентов, которые представляют собой водную суспензию гидроксида или фосфата алюминия с адсорбированными на них белковыми иммуногенами. Кроме того, исследователи неоднократно отмечали [72], что включение конъюгированной Hib-вакцины в состав поливалентных вакцин, содержащих АКДС с бесклеточным коклюшным компонентом, при введении в одном шприце приводит к индукции низкоавидных к PRP антител, в связи с чем рекомендовано проводить инъекции препаратов АКДС и Hib-вакцины в разные части тела [33, 34].
Как правило, конъюгированные вакцинные препараты против Hib в составе комбинированных вакцин поставляются в виде лиофилизата Hib-субстанции в смеси со вспомогательными веществами. Лиофилизат PRP-TT входит в состав следующих комбинированных вакцинных препаратов: TETRAct–HIB® (АКДС–Hib; Sanofi), ComBE Five® (АКДС–HBV–Hib; Biological E Ltd.), Quadrovax® (АКДС–Hib; Serum Institute of India Ltd.), Pentaxim® (АКДС–IPV–Hib; Sanofi) [73], Pentacel® (АКДС–IPV–Hib; Sanofi) [74], Pentavac®SD/PFS (АКДС–HBV–Hib; Serum Institute of India Ltd.), Tritanrix HB–Hib® (АКДС–HBV–Hib; GSK), EasySix® (АКДС–IPV–Hib; Panacea Biotec), Infanrix–IPV/Hib® (АКДС–IPV–Hib; GSK) и Infanrix Hexa® (АКДС–IPV–HBV–Hib; GSK).
Удобство поливалентных вакцин для массовой вакцинации стимулирует дальнейшие научные изыскания, направленные на разработку более безопасных компонентов, удобных форм и более эффективных методов применения. Так, были созданы полностью жидкие пентавалентная вакцина Pediacel® (АКДС–IPV–PRP-TT; Sanofi) [75, 76], EasyFour® (АКДС–PRP-TT; Panacea Biotec), EasyFive–TT® (АКДС–IPV–PRP-TT; Panacea Biotec), Quinvaxem® (АКДС–HBV–PRP-CRM197; GSK) [77] и гексавалентная вакцина Hexaxim® (АКДС–IPV–HBV–PRP-TT; GSK).
Иммуногенность и безопасность жидкой пентавалентной вакцины Pediacel® (Sanofi) соответствуют уровню других коммерческих поливалентных формулировок, таких как Quadracel® + + ActHIB® (АКДС–IPV–PRP-TT) [75], а также Infanrix–IPV/Hib® (GSK), а полностью жидкая форма существенно упрощает вакцинацию [76, 78].
Практическую целесообразность использования поливалентных вакцинных препаратов при иммунизации против Hib подтверждают многочисленные данные исследования результатов применения соответствующих вакцин в перенаселенных мегаполисах с невысоким уровнем жизни. Так, в Ченнайе (Тамил Наду, Индия) всего за три года (2012–2014 гг.) применения пентавалентной вакцины Pentavac® PFS (Serum Institute of India) [79], включающей Hib-компонент, количество опосредованных Hib менингитов, составлявшее в 2008 г. 19 случаев на 100 тыс. жителей в год [80], сократилось на 79% при охвате вакцинацией 69% детей до 2 лет [81]. Аналогично, начавшееся в 1998 г. применение тетравалентной вакцины АКДС–Hib в Йоханнесбурге (Южная Африка) за 6 лет позволило снизить количество случаев Hib-менингитов у детей до 1 года на 65% при том, что всего за 1994 г. регистрировалось в среднем 170 случаев этого заболевания на 100 тыс. детей [82].
Эффективность Hib-компонента пентавалентной вакцины АКДС–HepB–Hib подтвердило [83] ее применение в Бамако (~2 млн жителей), столице одной из беднейших стран мира Мали, в которой в довакцинный период регистрировали более 200 случаев инвазивных Hib-инфекций на 100 тыс. детей младшего возраста в год. Начавшаяся в 2002 г. вакцинация детей до двух лет к 2006 г. охватила 94% населения, что привело к 80%-ному сокращению частоты инвазивных Hib-заболеваний.
В России зарегистрированы две моновакцины против гемофильной инфекции, содержащие конъюгированные препараты (табл. 1): вакцина гемофильная тип b конъюгированная® (ФБУН “Ростовский НИИ микробиологии и паразитологии” Роспотребнадзора, Россия) и Hiberix® (GSK). Отечественная вакцина гемофильная тип b конъюгированная, зарегистрированная в 2011 г., производится в количестве 200 тыс. доз в год, что позволяет привить не более 5% российских младенцев. Некоторое время назад широко применялась вакцина ActHIB® (Aventis Pasteur), однако сейчас государственная регистрация в России на этот препарат отменена.
Таблица 1.
Гемофильные вакцины, регистрировавшиеся на территории Российской Федерации
| Вакцина | Субстанция Hib и лекарственная форма | Содержание КПС в активном веществе, мкг | Содержание белка-носителя в субстанции Hib, мкг | Вспомогательные вещества (мг на 1 дозу) | Регистрация в России, номер регистрационного удостоверения |
|---|---|---|---|---|---|
| Вакцина гемофильная тип b конъюгированная® (ФБУН “Ростовский НИИ микробиологии и паразитологии” Роспотребнадзора России) | PRP-ТT, лиофилизат для приготовления раствора* | 9.5–14.3 | 19.0–28.6 | Сахароза (20–30) | ЛП-000499 от 23.03.11 – действующее |
| Hiberix® (Хиберикс®, GSK) | PRP-ТT, лиофилизат для приготовления раствора** | 10 | ~30 | Лактоза (10.08) | П N015829/01 от 18.05.09 – действующее, бессрочно |
| Act-Hib® (Акт-Хиб®, Aventis Pasteur) | PRP-ТT, лиофилизат для приготовления раствора** | 10 | 18–30 | Сахароза (42.5) Трометамол (0.6) |
П N013850/01 от 11.12.08 – отмена гос. регистрации |
| Pentaxim® (Пентаксим®, Sanofi) | PRP-ТT, лиофилизат для приготовления суспензии*, вводится в смеси с вакциной АКДС–IPV | 10 | Не определено | Сахароза (42.5) Трометамол (0.6) | ЛСР-005121/08 от 01.07.08 – действующее, бессрочно; дата перерегистрации: 09.09.15 |
| Infanrix Hexa® (Инфанрикс Гекса®, GSK) | PRP-ТT, лиофилизат для приготовления суспензии*, вводится в смеси с вакциной АКДС–IPV–HBV | 10 | 25 | Лактоза (12.6) Алюминия фосфат (0.12) |
ЛП-000877 от 18.10.11 – действующее |
| АКДС-ГепВ+Hib® (Пермское НПО “Биомед”, АО “Национальная иммунобиологическая компания”, ГК “Ростех”) | PRP-ТT, лиофилизат для приготовления суспензии*, вводится в смеси с вакциной АКДС–HBV | 10 | 21–31 | Сахароза (42.5) Натрия дигидрофосфат (0.16) Динатрия гидрофосфат (0.5) |
ЛП-005412 от 20.03.19 – действующее |
На российском рынке присутствуют также комбинированные вакцинные препараты Pentaxim® (АКДС–IPV–Hib; Sanofi) [73] и Infanrix Hexa® (GSK) (табл. 1). Недавно в России зарегистрирована отечественная пентавалентная комбинированная вакцина АКДС–ГепВ–Hib® [84, 85] (Пермское НПО “Биомед”, входящее в состав АО “Национальная иммунобиологическая компания” – подразделение ГК “Ростех”), в состав которой в качестве Hib-компонента входит вакцина Quimi-Hib® (см. выше) [84]. Эффективность этого препарата подтверждена в ходе клинических испытаний [86].
СОСТАВ КОММЕРЧЕСКИХ КОНЪЮГИРОВАННЫХ Hib-ВАКЦИН НА ОСНОВЕ PRP
Коммерческие конъюгированные Hib-вакцины различаются между собой размером поли- или олигомерных цепей PRP, белком-носителем, методом конъюгации, а также наличием и строением спейсера. Структурные характеристики Hib-вакцин включены в Европейскую Фармакопею – периодическое издание, которое является руководящим документом, регламентирующим производство фармацевтических продуктов в странах Европейского сообщества. Рекомендованы к использованию следующие белки: дифтерийный анатоксин (DT), столбнячный анатоксин (ТT), дифтерийный рекомбинантный белок CRM197 [87] и белок OMPC.
Сравнительный анализ эффективности конъюгированных вакцин, состоящих из PRP с разными белками-носителями, проведенный в 1992 г. M.D. Decker et al. [88], показал, что вакцинация конъюгатом на основе DT привела к образованию защитных антител, специфичных к PRP, только у 39% детей, а конъюгаты, включавшие TT, CRM197 и OMPC, показали существенно более высокую иммуногенность. Именно белки-носители TT, CRM197 [89] и OMPC [90] сегодня наиболее широко используются в современных коммерческих вакцинах, включая Hib-вакцины.
В связи с тем, что эффективность Hib-вакцины определяется не только белком-носителем, но и типом конъюгации и технологическими методами, применяемыми при производстве вакцин, многочисленные исследования эффективности этих белков в качестве носителей не привели к однозначному выбору. Так, при сравнении иммуногенности коммерческих вакцин PRP-CRM197 (HibTITER®) и PRP-OMPC (PedvaxHIB®) на животной модели (макака резус) выяснилось, что конъюгат PRP-OMPC обладает существенно большей иммуногенностью по сравнению с конъюгатом PRP-CRM197 [91]. На этой модели PRP-CRM197 индуцировал PRP-специфичные антитела только при одновременной инъекции с DT. Сопоставление конъюгатов PRP с белками-носителями TT и CRM197, проводившееся в ходе клинических испытаний, показало отсутствие существенных различий в иммуногенности таких продуктов [92, 93]. В то же время недавно полученные данные продемонстрировали преимущество конъюгатов PRP-СRM197 по сравнению с конъюгатами PRP-ТT [94].
МЕТОДЫ ПОЛУЧЕНИЯ КОНЪЮГИРОВАННЫХ Hib-ВАКЦИН НА ОСНОВЕ PRP
Для производства вакцин на базе PRP используется как получаемый биотехнологическим способом высокомолекулярный полисахарид, включая продукты его деполимеризации средней или высокой степени, так и синтетические олигосахариды, структурно родственные фрагментам PRP. На сегодняшний день разработано значительное количество методов конъюгации [95], которые позволяют эффективно связывать эти олиго- и полисахариды с белками-носителями.
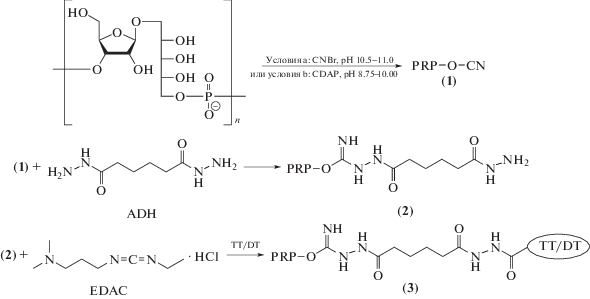
Получение конъюгатов на основе нативного PRP или частично гидролизованного PRPlmw основано на введении в молекулу полисахарида активных групп, позволяющих провести конденсацию с карбоксилами или аминогруппами белка-носителя. Один из первых подходов данного типа был реализован в работах J.B. Robbins et al. [65, 96–98], которые активировали PRP бромцианом с последующей конъюгацией с белком-носителем.
Так, под действием бромциана на PRP образуется его активированное производное (1) со случайным образом распределенными в полисахаридной цепи цианатными группами (схема 1 , условия а). При взаимодействии продукта (1) с ADH образуется изомочевина (2). Конъюгация последней с белком-носителем проводится в присутствии водорастворимого конденсирующего агента EDAC за счет образования амидных связей между остатками гидразида и карбоксильными группами, что приводит к образованию кросс-сшитого высокомолекулярного продукта (3) с молекулярной массой до 5 МДа [99]. Процесс такого типа лежит в основе технологий производства конъюгированных вакцин против Hib на основе DT (ProHIBiT®) и ТT (ActHIB®, OmniHIB®) [100, 101].
Схема 1 . Конъюгация PRP с белком с предварительной активацией PRP.
Вместо ADH может быть использована 6-аминокапроновая кислота [102, 103]. В этом случае для конъюгации с белком также применяют EDAC. Процесс такого типа применяется при производстве другой вакцины строения PRP-ТT–Hiberix® (GSK) [5].
К технологическим недостаткам бромцианового метода можно отнести необходимые для эффективной функционализации PRP щелочные условия (при рН 10.5–11.0), при которых протекает неконтролируемая деструкция фосфодиэфирных связей полисахарида. Кроме того, бромциан также имеет плохую растворимость в водных средах, что делает необходимым использование органических растворителей, в которых, однако, нерастворим PRP. Кроме того, бромциан высокотоксичен и легко гидролизуется в используемых условиях реакции. Структура полученного таким методом PRP-белкового конъюгата вследствие неконтролируемой деструкции и полимеризации не может быть надежно охарактеризована физико-химическими методами и стандартизирована.
В полученном бромциановым методом конъюгате высокомолекулярного PRP с DТ номинальное содержание PRP в дозе составляло 25 мкг, а белка – 18 мкг [5]. Очевидным достоинством этого метода является высокое содержание PRP в конъюгате – до 58%. Однако этот препарат имеет относительно низкую иммуногенность, из-за чего он должен применяться в более высокой дозе (25 мкг по PRP), чем современные вакцины, в которых содержится только 10 мкг PRP.
Альтернативой бромциану является более технологичный [104] и водорастворимый реагент CDAP (схема 1 , условия b), предложенный A. Lees et al. в 1996 г. [105]. Однако этот метод не нашел практического применения для промышленного выпуска вакцин из-за недостаточной активности конъюгатов цианированных производных PRP (см. выше).
Известно, что примесь неконъюгированного PRP может снижать эффективность иммунизации PRP-белковыми конъюгатами. Для удобства очистки вакцинных конъюгатов P. Anderson et al. в 1985 г. [106] предложили использовать низкомолекулярный PRPlmw (4) (схема 2 ), состоящий из 3–10 повторяющихся звеньев 3-β-D-рибозил-(1→1)-D‑рибит-5-фосфата со свободным остатком рибозы на восстанавливающем конце, образующийся при частичном гидролизе нативного полисахарида 0.1 М водным раствором HCl. Аналогичную смесь олигомеров можно получить и частичным гидролизом PRP в присутствии водной AcOH [107]. Конъюгацию олигомеров (4) проводят после предварительного восстановительного аминирования действием NaCNBH3 в присутствии NH4Cl [95] (показано на схеме 2 ) или этилендиамина [101]. При этом образуются гликозиламины (5) (или N-замещенные гликозиламины), которые непосредственно и вводятся в реакцию конъюгации с D, DT или CRM197 в присутствии EDAC, что приводит к образованию конъюгатов общей формулы (6) [106]. Процесс такого типа применяется при производстве вакцины VaxemHIB® (GSK), которая содержит CRM197 в качестве белка-носителя [5, 95].
Схема 2 . Получение низкомолекулярного PRP (4) (n = 3–8) и его конъюгатов (6) с белками-носителями с использованием восстановительного аминирования.
Для конъюгации PRP с другим адъювантным белком-носителем – OMPC – также применяют частично гидролизованный PRPlmw (4) (схема 3 ). Для лучшей растворимости в ДМФ или ДМСО его переводят в тетрабутиламмонийную соль и подвергают взаимодействию с CDD, который превращает часть ОН-групп PRPlmw в олиго-имидазолилуретан (7) [108], как предложено S. Marburg et al. в 1986 г. (схема 3 ). Олиго-имидазолилуретан (8) действием избытка 1,4-бутандиамина переводят в амин, который далее обрабатывают бромацетилхлоридом (9) или п-нитрофенилбромацетатом (10) с получением бромацетильного производного (11). OMPC, представляющий собой кластер из 3–7 субъединиц сo средней массой 40 000 Да, обрабатывают подходящим тиоилирующим агентом, например, N-ацетилгомоцистеинтиолактоном (12), с получением тиоилированного производного (13). Последующая конъюгация осуществляется при взаимодействии бромацетильных групп модифицированного производного (11) с тиогруппами (13) с образованием конъюгата (14). Процесс такого типа используется компанией MSD при производстве вакцины PedvaxHIB® [101].
Схема 3 . Синтез конъюгата OMPC c низкомолекулярным PRP – соединение (14). Использованные реагенты: a – 1,4-бутандиамин.
Другой способ получения функционализированных производных низкомолекулярного PRPlmw для конъюгации с белками, предложенный в 1986 г. P. Anderson et al. [109], основан не на гидролитическом расщеплении полисахарида (см. выше на схеме 2 ), а на периодатном окислительном расщеплении (схема 4 ). Образующиеся в результате альдегидные продукты общей формулы (15) далее подвергают конденсации с белком-носителем по схеме восстановительного аминирования с участием аминогрупп аминокислот (например, лизина), входящих в состав белка-носителя. При этом образуются основания Шиффа, которые восстанавливают цианоборогидридом натрия с образованием конъюгатов общей формулы (16). Например, при использовании CRM197 образуется конъюгат, в котором к каждой молекуле белка присоединяется в среднем 6–20 олигосахаридных лигандов [110]. Этот метод успешно применяется компанией Pfizer при производстве вакцины HibTITER®, в которой Hib-олигосахариды фактически конъюгированы с CRM197 непосредственно, без каких-либо спейсерных вставок (схема 4 ) [95].
Для того чтобы ускорить процесс образования оснований Шиффа, метод был усовершенствован введением дополнительной стадии превращения карбоксильных групп белка в гидразиды, которые реагируют с альдегидными группами более эффективно и полно, чем с ε-аминогруппами остатков лизина [111].
Схема 4 . Получение Hib-вакцины с использованием PRPlmw, образующегося при периодатном расщеплении нативного PRP. Использованные реагенты: а – NaIO4; b – белок, NaCNBH3.
Использование низкомолекулярного PRPlmw существенно упростило очистку, стерилизующую фильтрацию и определение физико-химических характеристик гликан-белкового конъюгата. Это важно для подтверждения идентичности вакцин при промышленном производстве. В то же время в ходе расщепления PRP для понижения молекулярного веса, так же как и при выделении и очистке, могут происходить дальнейшие структурные изменения [112], что затрудняет контроль и стандартизацию как исходного PRP, так и конъюгатов на его основе.
МЕТОДЫ ПОЛУЧЕНИЯ КОНЪЮГИРОВАННЫХ Hib-ВАКЦИН НА ОСНОВЕ СИНТЕТИЧЕСКИХ ФРАГМЕНТОВ PRP
Для исключения всех технологических проблем при работе с нативным PRP и его низкомолекулярными фракциями была начата разработка препаративного синтеза спейсерированных олигосахаридных производных, структурно родственных иммунодоминантным фрагментам PRP. В качестве преимуществ синтетических аналогов PRP нужно отметить наличие в их структурах оптимальных спейсерных групп в требуемых положениях. Это важно для обеспечения эффективной конъюгации с белком-носителем и надежного подтверждения чистоты и структуры конечных конъюгатов и промежуточных продуктов методами углеводного анализа, ЯМР-спектроскопии и масс-спектрометрии, что в итоге позволяет применять высокие стандарты для контроля качества. Кроме того, синтез вакцинных олигосахаридных лигандов исключает необходимость культивирования патогенных штаммов H. influenzae, трудоемкого выделения PRP и отделения примесей бактериального происхождения, например, токсичных липоолигосахаридов.
Первые примеры синтеза спейсерированных олигосахаридов, родственных PRP и предназначенных для конъюгации с белками-носителями, были опубликованы в 1987–1989 гг. Так, для синтеза спейсерированных олигосахаридов, состоящих из повторяющихся дисахаридных фрагментов 3-β-D-рибозил-(1→1)-D-рибит-5-фосфата, были разработаны три принципиальные схемы, включающие следующие три этапа: 1) удлинение цепи в жидкофазном процессе с выделением промежуточных олигомеров; 2) последовательное наращивание цепи на твердой (полимерной или стеклянной) подложке; 3) поликонденсацию с получением смеси олигомеров. Значительные усилия сразу нескольких ведущих научных групп, сконцентрированные на поиске удобных и экономичных методов синтеза спейсерированных олигосахаридов, родственных PRP, были простимулированы очевидными технологическими и иммунологическими преимуществами, которые имеют конъюгаты синтетических вакцинных лигандов по сравнению с конъюгатами нативного и низкомолекулярного PRP.
Первая серия спейсерированных олигосахаридов, родственных PRP, была синтезирована J.H. van Boom et al. при сборке олигосахаридных цепей последовательным наращиванием с фосфорилированием в качестве ключевой стадии. Так, димер (17), тример (18) [113, 114] и тетрамер (19) [115], содержащие N-глицил-тетраметиленаминовый спейсер, были получены линейным блочным синтезом из избирательно защищенного дисахарида (20) (схема 5 ). Для наращивания цепи использовали дисахаридный блок (21), который в присутствии N-метилимидазола присоединялся по свободной гидроксильной группе остатка рибита. Повторяющейся последовательностью реакций, включавших удаление пропенильной защитной группы и присоединение нового звена, получали тример и тетрамер, а спейсерный остаток вводили в конце синтетических схем при действии производного (22). После удаления всех защитных групп получали спейсерированные олигомеры (17–19).
Схема 5 . Ключевые синтетические блоки для синтеза спейсерированных олигомеров PRP (17–19). Использованные реагенты: а – N-метилимидазол/пиридин, (21), выход 72%; b – HgO, HgCl2, ацетон, вода, выход 82%; c – N-метилимидазол, пиридин, (22), выход 50%; d – удаление защитных групп.
Одним из важнейших факторов, ограничивающих эффективность масштабирования синтезов спейсерированных олигосахаридов, родственных PRP, является необходимость хроматографического выделения промежуточных продуктов. Для того чтобы сократить количество стадий хроматографической очистки полупродуктов, в лаборатории J.H. van Boom был разработан твердофазный синтез [116] в условиях, используемых для твердофазного синтеза олигонуклеотидов. При отработке данной стратегии была также проведена оптимизация тактики использования защитных групп и разработан более удобный, чем в предыдущих работах этой лаборатории [113–115], способ образования фосфодиэфирной связи. Проведенный в результате синтез гексамера (23) [117] с гексаметиленаминовым спейсером на восстанавливающем конце начинался с получения избирательно защищенного дисахарида (24), иммобилизованного на аминированном пористом стекле (схема 6 ). Далее в присутствии 1H-тетразола присоединяли фосфорамидит (25) [116, 117], окисляли фосфит в фосфат и удаляли диметокситритильную группу. Последовательность этих реакций повторяли еще 4 раза, а затем вводили спейсерную группу при обработке 2-цианоэтил-6-[4-монометокситритил)-амино]гексил-N,N-диизопропилфосфорамидитом (соединение (26)). Удаление с подложки и деблокирование привели к образованию гексамера (23).
Схема 6 . Ключевые синтетические блоки для синтеза спейсерированного гексамера PRP (23) [117]. Использованные реагенты: a –1H-тетразол/ацетонитрил, (25); b – 0.02 M I2, ацетонитрил, вода, 2,4,6-триметилпиридин; c – 2%-ная CCl3COOH в CH2Cl2; d – 1H-тетразол, ацетонитрил, (26), 0.02 M I2, ацетонитрил, вода, 2,4,6-триметилпиридин; 2%-ная CCl3COOH в CH2Cl2; e – NH3, H2O, диоксан, 12 ч, 50°C; f – 0.5 M (n-Bu)4NF, диоксан, 10% Pd/C.
Серия из четырех гомологичных спейсерированных олигомеров (27–30) с альтернативным расположением спейсерного фрагмента – на невосстанавливающем конце – была получена L. Chan и G. Just [118] c использованием не только мономерного (31), но и димерного (32) фосфорамидитных блоков (рис. 2). В качестве спейсера применяли терминальный остаток рибозы с незащищенной ОН-группой при С1.
Существенным ограничением при масштабировании синтеза олигосахаридов, родственных PRP, являлась невысокая емкость стеклянной подложки [117]. В качестве альтернативы A.A. Candil et al. [119, 120] (схема 7 ) использовали растворимую полимерную подложку на основе полиэтиленгликоля (ПЭГ), которую можно осаждать из реакционных смесей добавлением диэтилового эфира. Оптимальным образом функционализированный блок (33), иммобилизованный на ПЭГ-подложке через линкер на основе янтарной кислоты, наращивали дисахаридным фосфорамидитом (34) с последующим окислением фосфита трет-бутилгидропероксидом и детритилированием. Данные этапы повторяли необходимое число раз, а последний цикл наращивания цепи проводили с присоединением спейсерного реагента (35) с последующим удалением защитных групп и подложки. Таким образом были синтезированы димер (36), тример (37), пентамер (38) и гексамер (39).
Схема 7 . Ключевые синтетические блоки, использованные в синтезе спейсерированных олигомеров (36–39) [119]. Использованные реагенты: а – 1H-тетразол, ацетонитрил (34); b – t-BuOOH; c – pTsOH; d – 1H-тетразол, ацетонитрил, (35), t-BuOOH; e – NH4OH, THF; f – 10% Pd/C.
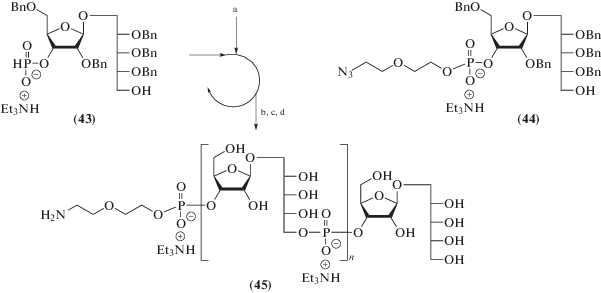
Еще один вариант твердофазного синтеза спейсерированного олигоcахарида, родственного PRP, был предложен S. Nilsson et al. [121] (схема 8 ). В этой работе к дисахариду (33) (схема 7 ), закрепленному на полистирольной подложке через сукцинатный линкер, присоединяли блок (40) в присутствии пивалоилхлорида с последующим детритилированием под действием 0.5%-ной трифторуксусной кислоты в дихлорметане. После четырех циклов на последнем этапе присоединяли фосфонат (41), содержащий преспейсерную группу. После окисления фосфоната до фосфата, восстановления азидной группы и удаления защит получали пентамер (42).
Схема 8 . Ключевые синтетические блоки для синтеза пентамера (42) [121]. Использованные реагенты: а – PivCl, CH2Cl2, пиридин, (40); b – 0.5%-ная CF3COOH в CH2Cl2; c – PivCl, CH2Cl2, пиридин, (41); d – 1% I2, пиридин, вода, NaOMe, MeOH, диоксан; e – 10% Pd/C.
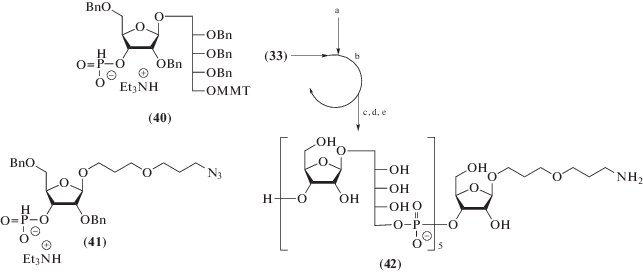
Из приведенных выше примеров видно, что оптимизация синтезов спейсерированных олигосахаридов сопровождалась усовершенствованием синтетических приемов и сокращением количества хроматографических стадий, но степень конвергентности, являющаяся одним из самых важных параметров для успешного многостадийного синтеза, оставалась практически неизменной. Принципиально иной высококонвергентный подход к синтезу рассматриваемого типа соединений, основанный на поликонденсации гетеробифункционального мономера (43) (схема 9 ), содержащего свободную ОН-группу при О5 рибита и фосфонатную группу при О3 рибозы, был разработан под руководством V. Verez-Bencomo и R. Roy [71, 122–124]. В предложенной схеме катализируемый пивалоилхлоридом процесс поликонденсации мономера (43) терминируется добавлением мономера (44), к которому фосфодиэфирной связью присоединен диэтиленгликольный спейсер. Окисление фосфита до фосфата, восстановление азидогруппы и деблокирование приводят к образованию смеси олигомеров (45), содержащих в среднем 8–11 повторяющихся звеньев. Оптимизированный одностадийный синтез спейсерированных олигомеров из мономерных предшественников был масштабирован до объемов промышленного производства, а полученный на их основе конъюгат входит в состав вакцины Quimi-Hib® (Heber Biotec S.A.).
Схема 9 . Ключевые синтетические блоки для синтеза [71] олигомеров (45), n = 8–11. Использованные реагенты: а – PivCl, пиридин, (43); b – PivCl, пиридин, (44); c – I2, пиридин; d – Pd/C.
Один из последних подходов к синтезу спейсерированных олигосахаридов, родственных PRP (схема 10 ), предложен P. Seeberger et al. [125]. Реализованная схема характеризуется высокой степенью конвергентности и в качестве базового исходного соединения использует избирательно защищенный тетрамер (46) с ортогональными защитными группами – левулиновой группой при О3 остатка рибозы на невосстанавливающем конце и 4,4'-диметокситритильной группы при О5 рибитного звена на восстанавливающем конце. Наращивание цепи осуществлялось присоединением димерных блоков (47), далее цепь терминировали спейсером (48). После удаления защитных групп получали спейсерированные производные тетра- (49), гекса- (50), окта- (51) и декамера (52).
Схема 10 . Ключевые синтетические блоки для синтеза олигомеров (49–52) [125]. Использованные реагенты: а – PivCl, пиридин, (47), 0°С; b – I2, пиридин, H2O, 20°С; с – CCl3COOH/CH2Cl2, 0°С; d – PivCl, пиридин, (48), 0°С; e – гидразина ацетат, CH2Cl2, 20°C; f – Pd/C, H2, EtOAc, MeOH, AcOH, вода.
СИНТЕЗ КОНЪЮГАТОВ СПЕЙСЕРИРОВАННЫХ ОЛИГОСАХАРИДОВ, РОДСТВЕННЫХ PRP, В КАЧЕСТВЕ КАНДИДАТНЫХ ВАКЦИН
На основе синтетических олигосахаридов (17–19) в 1992 г. были получены первые конъюгаты спейсерированных олигосахаридов, родственных PRP, с белком внешней мембраны Hib (hibOMP) [126], TT [126] и CRM197 [115] (схема 11 ). Входящий в состав спейсера остаток глицина ацилировали SATA с получением S-ацетилированных продуктов (53–55), а белки-носители hibOMP и ТТ активировали действием SPDP. Активированные таким образом белки (56) и (57) вводили в реакцию с тиолами, получаемыми in situ при дезацетилировании соединений (53) и (54). Мольное соотношение PRP : hibОМР в конъюгатах (58) и (59) составило 5 : 1, а соотношение PRP : TT – 20 : 1 для конъюгата (60) и 13 : 1 для конъюгата (61).
Схема 11 . Синтез конъюгатов олигосахаридов (17–19) c белками-носителями hibOMP, TT и DT.
Для присоединения олигосахаридов (54) и (55) к токсоидам TT и DT эти белки предварительно бромацетилировали действием N-сукцинимидилбромацетата (62) [115]. Активированные таким образом производные (63) и (64) конъюгировали с олигосахаридами (54) и (55) в присутствии гидроксиламина. Мольное соотношение олигосахарид : белок для конъюгатов (65), (66), (67) и (68) составило 9.9 : 1; 6.5 : 1; 21 : 1 и 5.3 : 1 соответственно.
Конъюгаты олигосахаридных лигандов (17) и (18) с ТT получали также с использованием глутарового альдегида в качестве гомобифункционального сшивающего агента [126]. В результате кроме присоединения олигосахаридных лигандов протекала также трудно контролируемая кросс-сшивка белка-носителя с образованием продуктов с большим разбросом молекулярных масс – от 160 до 1000 кДа, но весьма низким включением олигосахаридных лигандов. Их весовое содержание в конъюгатах составляло только 0.5–4.0%.
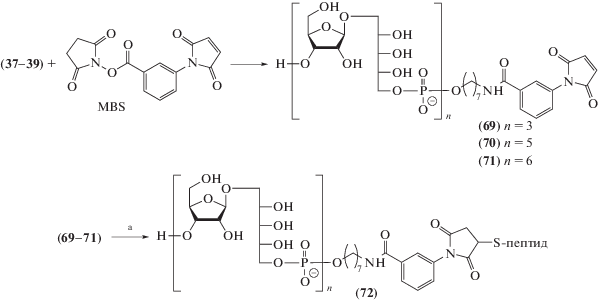
Другие химические методы конъюгации с белками использованы в случае олигосахаридных лигандов (37–39) с гептаметиленаминовым спейсером (схема 12 ). Сначала эти соединения были ацилированы с помощью MBS с образованием малеимидных производных (69–71) (схема 12 ) [119, 120]. Последние далее конъюгировали с тремя содержащими концевой остаток цистеина синтетическими олигопептидами, родственными белкам P1, P2 и P6 внешней мембраны Hib, что привело к получению конъюгатов общей формулы (72) (схема 12 ) [127].
Схема 12 . Синтез конъюгатов спейсерированных олигосахаридов (37–39) с синтетическими пептидами. Использованные реагенты: а – синтетические пептиды P1, P2 и P6 внешней мембраны Hib с концевым остатком цистеина [127].
Иная схема двухстадийной углевод-белковой конъюгации реализована для соединения смеси спейсерированных олигосахаридов (45) (схема 9 ) с анатоксином ТТ [71]. Сначала продукт (45) действием SMP переводили в малеимидные производные общей формулы (73) (схема 13 ). Конъюгация этого продукта с тиоилированным производным ТТ (74) по реакции Михаэля приводила к образованию смеси конъюгатов общей формулы (75), в которых к одной белковой единице присоединены олигосахаридные остатки разной длины. Этот продукт далее был использован в качестве основного компонента первой коммерческой Hib-вакцины Quimi-Hib® (Heber Biotec S.A.) с полностью синтетической углеводной составляющей.
Схема 13 . Общая схема синтеза конъюгата (75) – субстанции вакцины Quimi-Hib® (Heber Biotec S.A.) [71].
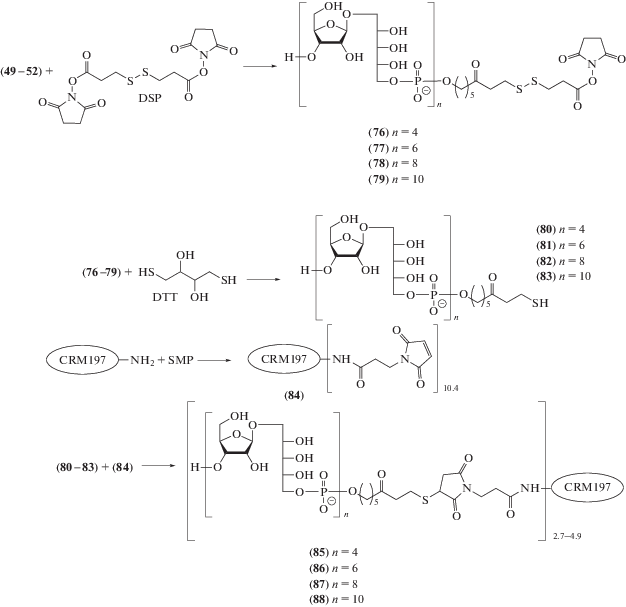
Аналогичный процесс присоединения тиола к двойной связи малеимида использован в работе P. Seeberger et al. для получения конъюгатов индивидуальных олигосахаридов (49–52) [125]. При действии DSP их сначала переводили в производные тиопропионовой кислоты (76–79), далее восстанавливали с помощью DTT до тиолов (80–83), как показано на схеме 14 , а затем конъюгировали с активированным белком (84), который получали N-ацилированием адъювантного белка-носителя CRM197 с помощью SMP. В полученных в результате конъюгатах (85), (86), (87) и (88) содержание олигосахаридных лигандов составляло 4.9, 4.0, 3.1 и 2.7 соответственно.
Схема 14 . Синтез конъюгатов (85–88) из спейсерированных олигосахаридов (49–52) и CRM197.
ВЛИЯНИЕ РАЗМЕРА ОЛИГОСАХАРИДОВ, РОДСТВЕННЫХ PRP, НА ИХ ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА
Ключевыми структурными факторами, которые могут влиять на иммуногенность и протективные свойства индуцируемых антител при использовании конъюгатов олигосахаридных лигандов, родственных PRP, и адъювантными белками-носителями являются длина используемых олигосахаридных компонентов [109, 128, 129], степень конъюгации, а также тип использованного белка-носителя. К сожалению, из-за весьма большой сложности и относительно малой доступности олигосахаридных производных рассматриваемого типа опубликованы только фрагментарные данные об их иммунологических свойствах, что ограничивает возможности для систематических исследований и заключений о взаимосвязи структур и биологических свойств обсуждаемых соединений. Тем не менее известные сегодня данные позволяют сделать некоторые выводы.
Длину В-эпитопа, т.е. минимальную длину олигосахаридной цепи, необходимой для связывания с PRP-специфичными антителами, можно определять с помощью конкурентного ИФА. Для проведения такого эксперимента гипериммунную сыворотку, полученную при иммунизации белковым конъюгатом полисахарида PRP или при заражении животных Hib, выдерживают с синтетическими гликоконъюгатами, содержащими родственные PRP олигосахариды известной длины и строения, либо непосредственно с олигосахаридами. При этом исследуется способность иммуноглобулинов сыворотки связываться с PRP-антигенами, иммобилизованными на поверхности полистирольных планшетов. Так, C.C. Peeters et al. при сравнении результатов ингибирования сывороточных антител с помощью олигосахаридных производных, родственных тримеру (18) и тетрамеру (19) повторяющегося звена PRP, а также их конъюгатов с белком-носителем ТТ (соединения (67, 68)), показали, что как тетрамер (19), так и его конъюгат (68), но не производные тримера (18) и (67), эффективно ингибировали взаимодействие гипериммунной сыворотки человека с полисахаридом PRP, нанесенным на планшет в качестве покрывающего антигена [115].
В подобных экспериментах при ингибировании связывания полисахарида PRP (иммобилизован на планшете для ИФА) с PRP-специфическими поли- и моноклональными антителами человека с помощью олигомеров (15) (схема 4 ) повторяющегося звена PRP со средней степенью полимеризации 1, 2, 7, 21, 47, 80 и 262 ожидаемо показали [130], что степень ингибирования возрастает с увеличением длины олигосахаридных гаптенов. Однако такие исследования не дали представления об интенсивности потенциальной иммуногенности олигомеров, а также типе и протективных свойствах индуцируемых антител, как и о возможности формирования иммунной памяти.
Для выявления оптимальной величины гаптена для индукции антител, специфичных к PRP, проводились клинические эксперименты по иммунизации гликан-белковыми конъюгатами с олигосахаридными цепями разной длины. Для проведения такого исследования Anderson et al. получили конъюгаты DT с олигосахаридными фракциями PRP (5) со средним количеством повторяющихся звеньев 8 и 20 [109]. Степень конъюгации для конъюгата с октамером PRP составила 3.3 моль олигосахарида на моль DT, а для конъюгата с 20-мером – 2.1 моль/моль. Клинические испытания этих препаратов показали, что конъюгат с октамерным лигандом оказался слабым иммуногеном для детей 9–15 месяцев, тогда как использование вакцины, содержащей конъюгаты низкомолекулярного PRP со степенью полимеризации ~20, дало высокие титры PRP-специфичных антител уже после второй иммунизации. В то же время обе вакцины индуцировали интенсивный иммунный ответ у взрослых.
Аналогичное исследование было проведено на другой серии синтетических иммуногенов на основе олигосахаридных фрагментов PRP с остатком рибита на невосстанавливающем конце [128] и средней степенью полимеризации 4, 6 и 12. Для изучения иммуногенности использовали их конъюгаты с CRM197 с низким содержанием гаптена. Клинические испытания, проводившиеся с участием детей в возрасте 1 года, показали, что все эти препараты формировали иммунную память к PRP, но не позволили выявить зависимость иммуногенности от длины олигосахаридных лигандов. Для исследования влияния на иммуногенность других структурных факторов были получены аналогичные конъюгаты с олигосахаридами PRP, имеющие на невосстанавливающем конце остаток фосфата или рибозы, со средней степенью полимеризации 7 и более высоким содержанием олигосахаридных гаптенов. Иммуногенность этих соединений была в 20 раз выше, чем для конъюгатов с низким содержанием гаптена, но не зависела от структуры остатка на невосстанавливающем конце.
Преимущество более длинных лигандов подтвердили данные, которые были получены с использованием конъюгатов синтетических олигосахаридных лигандов с одинаковой невысокой степенью конъюгации. Иммунизация лабораторных животных полученными с использованием 0.1%-ного глутарового альдегида конъюгатами белка-носителя ТТ с синтетическими димером (36) и тримером (37) (схема 7 ), в которых мольное соотношение PRP : TT составляло 2 : 1, показала, что иммунный ответ на вакцинацию конъюгатом тримера (37) был до 200 раз выше, чем для конъюгата димера (36) [131].
Одна из самых последних опубликованных работ, посвященных созданию вакцины третьего поколения против Hib [125], суммирует результаты исследований конъюгатов (85–88) на основе белка-носителя CRM197, содержащих в качестве углеводных лигандов тетра- (49), гекса- (50), окта- (51) и декамер (52) повторяющегося звена PRP. При иммунизации лабораторных животных конъюгатами (85) и (87) наблюдали существенно более высокий уровень антител к PRP, чем в случае конъюгатов (86) и (88). На основании этих данных авторы предположили, что минимальным фрагментом PRP, включающим В-эпитоп анти-PRP-антител, является тетрамер, что можно принимать только как качественный результат, т.к. исследованные конъюгаты имели разную степень конъюгации лигандов, и их иммуногенность может из-за этого сопоставляться лишь условно.
ЗАКЛЮЧЕНИЕ
Рассмотренные выше работы убедительно свидетельствуют о том, что вакцины против Hib являются важным компонентом иммунопрофилактики населения. Несмотря на присутствие на рынке целого ряда достаточно эффективных вакцин на основе полисахарида PRP, которые используются и индивидуально, но обычно в составе комбинированных вакцин, актуальной задачей является разработка вакцин третьего поколения, основанных на синтетических олигосахаридных лигандах, структурно родственных фрагментам полисахарида PRP. Такие работы активно ведутся в специализированных лабораториях в разных странах мира, в том числе и авторами настоящего обзора. Применение синтетических олигосахаридных лигандов для получения вакцины против Hib позволяет исключить присутствие в конечных продуктах примесей биогенного происхождения, образующихся при биотехнологическом получении полисахарида PRP. Кроме того, использование синтетических олигосахаридных лигандов позволяет более точно и воспроизводимо получать конъюгированные препараты с заранее заданными структурными характеристиками, отвечающими современным высоким стандартам качества фармацевтического производства GMP.
Единственная на сегодняшний день коммерческая вакцина Quimi-Hib® против Hib, которую условно можно отнести к третьему поколению вакцин, содержит не один тип олигосахаридного лиганда, а набор гомологов с различным числом повторяющихся звеньев. Из-за этого вакцина Quimi-Hib® не обладает важным преимуществом данного класса продуктов – точно определенной структурой вакцинного лиганда. Тем не менее пионерские исследования, проведенные при создании вакцины Quimi-Hib®, и другие работы, рассмотренные выше, показали, что длина оптимального олигомера лежит в области небольших степеней полимеризации. Использование коротких олигомеров PRP (например, тетрамерного, а может быть, и меньших лигандов) для изготовления конъюгированных вакцин против Hib позволит существенно снизить затраты на их промышленное производство.
Таким образом, имеющиеся на сегодняшний день эффективные синтетические подходы к получению конъюгатов синтетических олигосахаридов, соответствующих фрагментам полисахарида PRP, и результаты оптимизации структуры углеводного вакцинного лиганда создали фундамент для разработки конъюгированных Hib-вакцин третьего поколения с заранее заданными структурными характеристиками, в которых практически не присутствуют примеси биогенного происхождения. Кроме того, синтетическая природа антигенного лиганда в составе таких конъюгированных препаратов позволяет оптимизировать строение лиганда, внося в него структурные изменения, направленные на улучшение физико-химических характеристик и иммунологических свойств. Первый шаг в этом направлении был сделан P. Seeberger et al., которые предложили введение метильной группы при О2 остатков рибозы для повышения устойчивости структуры вакцинного лиганда, как, например, в конъюгате (89) (рис. 3) [132].
Рис. 3.
Строение конъюгата CRM197 и тетрамерного лиганда с 2-O-метилированными рибозными звеньями [132].

Еще одним преимуществом синтетического подхода при создании вакцины против Hib является возможность варьирования структуры олигосахаридного лиганда, что присуще химическим схемам, но не микробиологическим процессам, жестко ограниченным штаммом-продуцентом КПС. Это означает, что только в химической схеме получения вакцины можно с минимальными затратами заменить часть ключевых синтетических блоков с целью оптимизации структуры вакцинного лиганда. Такая необходимость может возникать в связи с изменением эпидемиологически значимых штаммов гемофильной палочки. Это явление уже сейчас наблюдается в ряде стран, в которых широко применяются Hib-вакцины. Например, в последние 30 лет патоген H. influenzae типа a (Hia) все чаще является причиной инвазивных инфекций в Канаде, США, Австралии и Бразилии [133, 134]. В этой связи возник интерес к разработке Hia-вакцины на базе соответствующего КПС [134, 135], для чего потребуется создать ресурсоемкую микробиологическую технологию для наработки патогена. Благодаря тому, что КПС патогена H. influenzae типа a имеет структуру →4)-β-D-Glcp-(1→1)-D-рибит-5-OPO2HO→, которая отличается от структуры только наличием остатка β-D-глюкозы на месте рибозы (рис. 4) [136], можно разработать универсальный подход к синтезу Hib- и Hia-олигосахаридов, что позволит получать конъюгированные вакцинные препараты против двух штаммов гемофильной палочки в рамках одного технологического процесса.
Вакцина против Hib была первой коммерческой конъюгированной углеводной вакциной и может стать первой конъюгированной вакциной, включающей синтетический олигосахаридный лиганд строго определенной структуры, эффективное применение которой даст импульс к развитию перспективной области вакцин третьего поколения. На сегодняшний день опубликовано множество работ, направленных на синтез антигенных олигосахаридов и создание на их основе вакцин для профилактики опасных инфекционных заболеваний человека, вызываемых бактериями Streptococcus pneumoniae [1–5, 8, 14, 137–141], Enterococcus faecalis [142, 143], Shigella flexneri серотипа 2a [144], Neisseria meningitidis серотипа X [145], Klebsiella pneumoniae [146–148], Clostridium difficile [149], Staphylococcus aureus [150–153], а также грибами Aspergillus fumigatus (на основе олигосахаридных лигандов, родственных α-глюкану [154–157], галактоманнану [158–162] и α‑(1→4)-галактозаминогалактану [163–165]), Candida albicans [166–170] и др. патогенами [171–173].
В Российской Федерации гемофильная вакцина внесена в национальный календарь прививок пока только для детей из групп риска, и эти потребности удовлетворяются в основном за счет импортируемых препаратов (табл. 1). Возможно, это связано с тем, что по сравнению со многими другими странами, уровень инвазивных Hib-инфекций в России невысок (см. выше). Однако экономические исследования показывают, что расширение охвата программ иммунизации против гемофильной инфекции до тотальной вакцинации новорожденных экономически выгодно даже в случае импорта вакцины, хотя и менее выгодно, чем при применении национальной вакцины, т.к. потребность в ней достигает сегодня уже очень больших величин. Проведенная с применением имитационной ретроспективной модели оценка социально-экономического ущерба от пяти вакциноуправляемых инфекций (коклюш, дифтерия, столбняк, полиомиелит и заболевания, вызванные инвазивными формами Hib-инфекции) на территории России и затрат на вакцины при варьировании доли вакцинного препарата АКДС–IPV–Hib, включающего бесклеточный коклюшный компонент, в общем объеме вакцинации АКДС–полиомиелит 28–100%, показала 15‑кратное снижение таких ключевых экономических показателей эффективности вакцинных программ, как суммарный ущерб от потерянных лет жизни и суммарный монетарный эквивалент ущерба [174]. Это исследование подтверждает необходимость введения вакцины против Hib, например, в качестве компонента поливакцин на базе АКДС, в график обязательной вакцинации для всей популяции, а не только для групп риска.
Экономическую эффективность программ вакцинации современными вакцинами против Hib можно существенно повысить путем замещения импортируемого сегодня Hib-компонента в используемых в России комбинированных вакцинах на отечественный препарат, производимый по технологии полного цикла. Объединенные усилия научно-исследовательских организаций, располагающих требуемым арсеналом методов и технологий, применяемых в современной химии углеводов, и биотехнологических российских предприятий с необходимым производственным потенциалом, без сомнений, могут привести к появлению отечественной вакцины третьего поколения против Hib. Освоение ее производства позволит создать технологическую базу и для разработки других углеводных конъюгированных вакцин, требуемых сегодня для решения задач национальной безопасности и иммунопрофилактики.
Список литературы
Генинг М.Л., Курбатова Е.А., Цветков Ю.Е., Нифантьев Н.Э. // Успехи химии. 2015. Т. 84. С. 1100–1113. [Gening M.L., Tsvetkov Y.E., Nifantiev N.E., Kurbatova E.A. // Russ. Chem. Rev. 2015. V. 84. P. 1100–1113.] https://doi.org/10.1070/RCR4574
Tsvetkov Y.E., Gening M.L., Kurbatova E.A., Akhmatova N.K., Nifantiev N.E. // Pure Appl. Chem. 2017. V. 89. P. 1403–1411. https://doi.org/10.1515/pac-2016-1123
Mettu R., Chen C.-Y., Wu C.-Y. // J. Biomed. Sci. 2020. V. 27. P. 9–30. https://doi.org/10.1186/s12929-019-0591-0
Micoli F., Del Bino L., Alfini R., Carboni F., Romano M.R., Adamo R. // Expert Rev. Vaccines. 2019. V. 18. P. 881–895. https://doi.org/10.1080/14760584.2019.1657012
Khatun F., Stephenson R.J., Toth I. // Chem. Eur. J. 2017. V. 23. P. 4233–4254. https://doi.org/10.1002/chem.201603599
Rappuoli R. // Sci. Transl. Med. 2018. V. 10. Article eaat4615.https://doi.org/10.1126/scitranslmed.aat4615
Berti F., Adamo R. // Chem. Soc. Rev. 2018. V. 47. P. 9015–9025. https://doi.org/10.1039/C8CS00495A
Cavallari M., De Libero G. // Vaccines. 2017. V. 5. Article 4. https://doi.org/10.3390/vaccines5010004
Micoli F., Costantino P., Adamo R. // FEMS Microbiol. Rev. 2018. V. 42. P. 388–423. https://doi.org/10.1093/femsre/fuy011
Национальный календарь профилактических прививок. Приложение № 1 к приказу Министерства здравоохранения РФ от 21 марта 2014 г. № 125н. URL: http://base.garant.ru/70647158/ 53f89421bbdaf741eb2d1ecc4ddb4c33/ (Accessed: 25.04.2020).
Эпидемиология и вакцинопрофилактика инфекции, вызываемой Haemophilus influenzae типа b: Методические рекомендации. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. 32 с. URL: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID= 4604 (Accessed: 25.04.2020).
Watt J.P., Wolfson L.J., O’Brien K.L., Henkle E., Deloria-Knoll M., McCall N., Lee E., Levine O.S., Hajjeh R., Mulholland K., Cherian T. // Lancet. 2009. V. 374. P. 903–911. https://doi.org/10.1016/S0140-6736(09)61203-4
Edmond K., Clark A., Korczak V.S., Sanderson C., Griffiths U.K., Rudan I. // Lancet Infect. Dis. 2010. V. 10. P. 317–328. https://doi.org/10.1016/S1473-3099(10)70048-7
Peltola H. // Clin. Microbiol. Rev. 2000. V. 13. P. 302–317. https://doi.org/10.1128/CMR.13.2.302
Абрамцева М.В., Тарасов А.П., Немировская Т.И., Ковтун В.П., Волков В.А., Мовсесянц А.А. // БИОпрепараты. Профилактика, диагностика, лечение. 2017. Т. 17. С. 78–86.
Охват иммунизацией в мире в 2019 г. URL: https://www.who.int/news-room/fact-sheets/detail/ immunization-coverage (Accessed: 25.04.2020).
Yang Y., Yang Y., Scherpbier R.W., Zhu X., Chen Y., Zhou Y., Jiang Q. // Pediatr. Infect. Dis. J. 2019. V. 38. P. 248–252. https://doi.org/10.1097/INF.0000000000002132
Демина А.А. // Международный медицинский журнал. 1998. Т. 4. С. 315–322.
Королева М.А., Королева И.С., Грубер И.М., Черкасова Л.С. // Эпидемиология и вакцинопрофилактика. 2017. Т. 16. С. 36–43.
Харченко Г.А., Кимирилова О.Г. Вопр. совр. педиатрии. 2017. Т. 16. С. 241–245. [Kharchenko G.A., Kimirilova O.G. // Vopr. sovr. pediatr. 2017. V. 16. P. 241–245.] https://doi.org/10.15690/vsp.v16i3.1735
Платонов А.Е., Николаев М.К., Королева И.С., Миронов К.О., Платонова О.В., Яковенко М.Л., Кошелева Л.П., Честнова Т.В., Княгина О.Н., Корсакова Т.Г., Кириллова Т.А., Демин С.И., Тарасов М.Ю., Ибрагимова Е.М. // Эпидемиология и инфекционные болезни. 2009. Т. 4. С. 33–42.
Баранов А.А., Горелов А.В., Задорожная В.И., Идрисова Р.С., Матвеев В.А., Намазова Л.С., Платонов А.Е., Таточенко В.К., Фролов А.Ф., Шамшева О.В. // Вопр. совр. педиатрии. 2006. Т. 5. С. 6–11. [Baranov A., Gorelov A., Zadorozhnaya V., Idrisova R., Matveev V., Namazova L., Platonov A., Tatochenko V., Frolov A., Shamsheva O. // Vopr. sovr. pediatr. 2006. V. 5. P. 6–11.]
Platonov A.E., Griffiths U.K., Voeykova M.V., Platonova O.V., Shakhanina I.L., Chistyakova G.G., Robertson S.E. // Vaccine. 2006. V. 24. P. 2367–2376. https://doi.org/10.1016/j.vaccine.2005.11.054
Briere E.C., Jackson M., Shah S.G., Cohn A.C., Anderson R.D., MacNeil J.R., Coronado F.M., Mayer L.W., Clark T.A., Messonnier N.E. // Pediatrics. 2012. V. 130. P. 414–420. https://doi.org/10.1542/peds.2012-0266
Measuring impact of Streptococcus pneumoniae and Haemophilus influenzae type b conjugate vaccination. WHO: WHO/IVB/12.08. World Health Organization, 2012. URL: https://apps.who.int/iris/handle/10665/ 75835 (accessed: 25.04.2020).
Маркелова Н.Н., Хотько Н.И. // Медицинские науки. 2013. Т. 1. С. 110–113.
Zandvoort A., Timens W. // Clin. Exp. Immunol. 2002. V. 130. P. 4–11. https://doi.org/10.1046/j.1365-2249.2002.01953.x
Blanchard-Rohner G., Pollard A.J. // Expert Rev. of Vaccines. 2011. V. 10. P. 673–684. https://doi.org/10.1586/erv.11.14
Pérez-Melgosa M., Ochs H.D., Linsley P.S., Laman J.D., van Meurs M., Flavell R.A., Ernst R.K., Miller S.I., Wilson C.B. // Eur. J. Immunol. 2001. V. 31. P. 2373–2381. https://doi.org/10.1002/1521-4141(200108)31:8<2373:: aid-immu2373>3.0.co;2-g
Basha S., Surendran N., Pichichero M. // Expert Rev. Clin. Immunol. 2014. V. 10. P. 1171–1184. https://doi.org/10.1586/1744666X.2014.942288
Langlet C., Tamoutounour S., Henri S., Luche H., Ardouin L., Grégoire C., Malissen B., Guilliams M. // J. Immunol. 2012. V. 188. P. 1751–1760. https://doi.org/10.4049/jimmunol.1102744
Zimmermann S., Lepenies B. // Carbohydrate-Based Vaccines: Methods and Protocols / Ed. Lepenies B. New York, NY: Springer, 2015. P. 11–26.
Haemophilus influenzae type b (Hib): the green book, chapter 16. https://www.gov.uk/government/publications/haemophilus-influenzae-type-hib-the-green-book-chapter-16 (accessed: 26.04.2020).
Озерецковский Н.А., Немировская Т.И.: 1 (86) // Эпидемиология и вакцинопрофилактика. 2016. Т. 15. С. 61–66. https://doi.org/10.31631/2073-3046-2016-15-1-61-66
HIBERIX®Haemophilus influenzae type b (Hib) conjugate vaccine (Tetanus Protein – Conjugate). Product monograph. 2019.
ActHib®Haemophilus b Conjugate Vaccine (Tetanus Protein – Conjugate). Product monograph. 2019.
Micoli F., Adamo R., Costantino P. // Molecules. 2018. V. 23. Article 1451. https://doi.org/10.3390/molecules23061451
Avci F.Y., Li X., Tsuji M., Kasper D.L. // Semin. Immunol. 2013. V. 25. P. 146–151. https://doi.org/10.1016/j.smim.2013.05.005
Jha V., Janoff E.N. // Vaccines. 2019. V. 7. Article 18. https://doi.org/10.3390/vaccines7010018
Kool M., Soullié T., van Nimwegen M., Willart M.A.M., Muskens F., Jung S., Hoogsteden H.C., Hammad H., Lambrecht B.N. // J. Exp. Med. 2008. V. 205. P. 869–882. https://doi.org/10.1084/jem.20071087
Marrack P., McKee A.S., Munks M.W. // Nat. Rev. Immunol. 2009. V. 9. P. 287–293. https://doi.org/10.1038/nri2510
Kanra G., Viviani S., Yurdakok K., Ozmert E., Anemona A., YalcIn S., Demiralp O., Bilgili N., Kara A., Cengiz A.B., Mutlu B., Baldini A., Marchetti E., Podda A. // Pediatr. Int. 2003. V. 45. P. 314–318. https://doi.org/10.1046/j.1442-200X.2003.01706.x
Mäkelä P.H., Peltola H., Käyhty H., Jousimies H., Pettay O., Ruoslahti E., Sivonen A., Renkonen O.-V. // J. Infect. Dis. 1977. V. 136. P. S43–S50. https://doi.org/10.1093/infdis/136.Supplement.S43
Peltola H., Käyhty H., Sivonen A., Mäkelä H. // Pediatrics. 1977. V. 60. P. 730–737.
Käyhty H., Peltola H., Karanko V., Mäkelä P.H. // J. Infect. Dis. 1983. V. 147. Article 1100. https://doi.org/10.1093/infdis/147.6.1100
Claesson B.A., Schneerson R., Robbins J.B., Johansson J., Lagergard T., Taranger J., Bryla D., Levi L., Cramton T., Trollfors B. // Pediatrics. 1989. V. 114. P. 97–100. https://doi.org/10.1016/S0022-3476(89)80611-0
McVernon J., Ramsay M.E., McLean A.R. // Epidemiol. Infect. 2008. V. 136. P. 800–812. https://doi.org/10.1017/S0950268807009168
McVernon J., Andrews N., Slack M.P.E., Ramsay M.E. // Lancet. 2003. V. 361. P. 1521–1523. https://doi.org/10.1016/s0140-6736(03)13171-6
McVernon J., Mitchison N.A., Moxon E.R. // Lancet Infect. Dis. 2004. V. 4. P. 40–43. https://doi.org/10.1016/S1473-3099(03)00859-4
Pichichero M.E., Voloshen T., Zajac D., Passador S. // J. Infect. Dis. 1999. V. 180. P. 1390–1393. https://doi.org/10.1086/314989
Lee Y.C., Kelly D.F., Yu L.-M., Slack M.P.E., Booy R., Heath P.T., Siegrist C.-A., Moxon R.E., Pollard A.J. // Clin. Infect. Dis. 2008. V. 46. P. 186–192. https://doi.org/10.1086/524668
Trotter C.L., McVernon J., Andrews N.J., Burrage M., Ramsay M.E. // Lancet. 2003. V. 361. P. 1523–1524. https://doi.org/10.1016/s0140-6736(03)13172-8
Anderson P. // J. Infect. Dis. 1984. V. 149. P. 1034–1035. https://doi.org/10.1093/infdis/149.6.1034
Rothstein E.P. // Arch. Pediatr. Adolesc. Med. 1991. V. 145. P. 898–900. https://doi.org/10.1001/archpedi.1991.02160080076024
Barington T., Skettrup M., Juul L., Heilmann C. // Infect. Immun. 1993. V. 61. P. 432–438. https://doi.org/10.1128/IAI.61.2.432-438.1993
Robbins J.B. // JAMA. 1996. V. 276. P. 1181–1185. https://doi.org/10.1001/jama.1996.03540140069031
Käyhty H., Karanko V., Peltola H., Mäkelä P.H. // Pediatrics. 1984. V. 74. P. 857–865.
Takala A.K., Eskola J., Leinonen M., Käyhty H., Nissinen A., Pekkanen E., Mäkelä P.H. // J. Infect. Dis. 1991. V. 164. P. 982–986. https://doi.org/10.1093/infdis/164.5.982
Ward J. // Vaccine. 1991. V. 9. P. S17–S24. https://doi.org/10.1016/0264-410X(91)90175-6
Adams W.G., Deaver K.A., Cochi S.L., Plikaytis B.D., Zell E.R., Broome C.V., Wenger J.D. // JAMA. 1993. V. 269. P. 221–226. https://doi.org/10.1002/cbic.201300785
Black S.B., Shinefield H.R., Fireman B., Hiatt R., Polen M., Vittinghoff E. // Pediatr. Infect. Dis. J. 1991. V. 10. P. 97–104. https://doi.org/10.1097/00006454-199102000-00004
Goebel W.F. // J. Exp. Med. 1936. V. 64. P. 29–38. https://doi.org/10.1084/jem.64.1.29
Avery O.T., Goebel W.F. // J. Exp. Med. 1929. V. 50. P. 533–550. https://doi.org/10.1084/jem.50.4.533
Landsteiner K., van der Scheer J. // J. Exp. Med. 1931. V. 54. P. 295–305.
Schneerson R., Barrera O., Sutton A., Robbins J.B. // J. Exp. Med. 1980. V. 152. P. 361–376. https://doi.org/10.1084/jem.152.2.361
Anderson P., Pichichero M.E., Insel R.A. // Pediatrics. 1985. V. 107. P. 346–351. https://doi.org/10.1016/S0022-3476(87)80237-8
Zarei A.E., Almehdar H.A., Redwan E.M. // J. Immunol. Res. 2016. V. 2016. Article 7203587. https://doi.org/10.1155/2016/7203587
Colombo C., Pitirollo O., Lay L. // Molecules. 2018. V. 23. Article 1712. https://doi.org/10.3390/molecules23071712
Ravenscroft N., Costantino P., Talaga P., Rodriguez R., Egan W. // Vaccine Analysis: Strategies, Principles, and Control / Eds. Nunnally B.K., Sitrin R. D., Turula V.E. Berlin Heidelberg: Springer-Verlag, 2015. P. 301–381.
Greenberg D.P., Vadheim C.M., Partridge S., Chang S.-J., Chiu C.-Y., Ward J.I. // J. Infect. Dis. 1994. V. 170. P. 76–81. https://doi.org/10.1093/infdis/170.1.76
Verez-Bencomo V., Fernández-Santana V., Hardy E., Toledo M.E., Rodríguez M.C., Heynngnezz L., Rodriguez A., Baly A., Herrera L., Izquierdo M., Villar A., Valdés Y., Cosme K., Deler M.L., Montane M., Garcia E., Ramos A., Aguilar A., Medina E., Toranõ G., Sosa I., Hernandez I., Martínez R., Muzachio A., Carmenates A., Costa L., Cardoso F., Campa C., Diaz M., Roy R. // Science. 2004. V. 305. P. 522–525. https://doi.org/10.1126/science.1095209
Denoël P.A., Goldblatt D., de Vleeschauwer I., Jacquet J.-M., Pichichero M.E., Poolman J.T. // Clin. Vaccine Immunol. 2007. V. 14. P. 1362–1369. https://doi.org/10.1128/CVI.00154-07
Плоткин С.А., Лизе Й., Мадхи Ш.А., Ортис E. // Вопр. совр. педиатрии. 2012. Т. 11. С. 18–36. [Plotkin S.A., Liese J., Madhi S.A., Ortiz E. // Vopr. sovr. pediatr. 2012. V. 11. P. 18–36.] https://doi.org/10.1586/erv.11.72
Guerra F.A., Blatter M.M., Greenberg D.P., Pichichero M., Noriega F.R., Pentacel Study Group // Pediatrics. 2009. V. 123. P. 301–312. https://doi.org/10.1542/peds.2007-3317
Lin T.Y., Wang Y.-H., Chang L.-Y., Huang Y.-C., Kao H.-T., Lin P.-Y., Lu H.-K., Chavand P., Ortiz E. // Int. J. Infect. Dis. 2007. V. 11. P. 129–136. https://doi.org/10.1016/j.ijid.2005.10.014
Frampton J.E. // Pediatr. Drugs. 2011. V. 13. P. 401–415. https://doi.org/10.2165/11608730
Capeding M.R.Z., Alberto E., Versteilen A., Rauscher M., Bagchi P., de Palacios P.I. // Int. J. Infect. Dis. 2016. V. 46. P. 71–78. https://doi.org/10.1016/j.ijid.2016.02.015
Reynolds D.L., Vidor E. // Expert Rev. Vaccines. 2014. V. 13. P. 943–968. https://doi.org/10.1586/14760584.2014.933674
Sharma H.J., Patil V.D., Lalwani S.K., Manglani M.V., Ravichandran L., Kapre S.V., Jadhav S.S., Parekh S.S., Ashtagi G., Malshe N., Palkar S., Wade M., Arunprasath T.K., Kumar D., Shewale S.D. // Vaccine. 2012. V. 30. P. 510–516. https://doi.org/10.1016/j.vaccine.2011.11.067
Minz S., Balraj V., Lalitha M., Murali N., Cherian T., Manoharan G., Kadirvan S., Joseph A., Steinhoff M. // Indian J. Med. Res. 2008. V. 128. P. 57–64.
Fitzwater S.P., Ramachandran P., Kahn G.D., Nedunchelian K., Suresh S., Santosham M., Chandran A. // Vaccine. 2019. V. 37. P. 1608–1613. https://doi.org/10.1016/j.vaccine.2019.01.080
von Gottberg A., de Gouveia L., Madhi S.A., du Plessis M., Quan V., Soma K., Huebner R., Flannery B., Schuchat A., Klugman K. // Bull. World Health Organ. 2006. V. 84. P. 811–818. https://doi.org/10.2471/blt.06.030361
Sow S.O., Tapia M.D., Diallo S., Keita M.M., Sylla M., Onwuchekwa U., Pasetti M.F., Kotloff K.L., Levine M.M. // Am. J. Trop. Med. Hyg. 2009. V. 80. P. 1033–1038. https://doi.org/10.4269/ajtmh.2009.80.1033
Николаева А.М., Петровских В.П., Соснина О.Ю., Белякова О.В., Вязникова Т.В., Афанасьева Т.М. // Биопрепараты. 2013. Т. 3. С. 41–44.
Белякова О.В., Николаева А.М., Соснина О.Ю., Дрожжачих О.С. // Пермский медицинский журнал. 2014. V. 31. P. 102–108.
Фельдблюм И.В., Романенко В.В., Николаева А.М., Субботина К.А., Соснина О.Ю., Перминова О.А., Белякова О.В., Данилина Т.В., Ершов А.Е., Трофимов Д.М., Быкова Е.А., Мартиросян С.В., Анкудинова А.В. // Журнал микробиологии, эпидемиологии и иммунобиологии. 2018. Т. 2. С. 68–75. [Feldblyum I.V., Romanenko V.V., Nikolaeva A.M., Subbotina K.A., Sosnina O.Yu., Perminova O.A., Belyakova O.V., Danilina T.V., Ershov A.E., Trofimov D.M., Bykova E.A., Martirosyan S.V., Ankudinova A.V. // Zh. Mikrobiol. Epidemiol. Immunobiol. 2018. P. 68–75.]
Bröker M., Costantino P., DeTora L., McIntosh E.D., Rappuoli R. // Biologicals. 2011. V. 39. P. 195–204. https://doi.org/10.1016/j.biologicals.2011.05.004
Decker M.D., Edwards K.M., Bradley R., Palmer P. // Pediatrics. 1992. V. 120. P. 184–189. https://doi.org/10.1016/S0022-3476(05)80424-X
Bröker M., Berti F., Schneider J., Vojtek I. // Vaccine. 2017. V. 35. P. 3286–3294. https://doi.org/10.1016/j.vaccine.2017.04.078
Donnelly J.J., Deck R.R., Liu M.A. // J. Immunol. 1990. V. 145. P. 3071–3079.
Vella P.P., Ellis R.W. // Pediatr. Res. 1991. V. 29. P. 10–13. https://doi.org/10.1203/00006450-199101000-00003
Peltola H., Eskola J., Käyhty H., Takala A.K., Mäkelä P.H. // Arch. Pediatr. Adolesc. Med. 1994. V. 148. P. 620–625. https://doi.org/10.1001/archpedi.1994.02170060074015
Togashi T., Mitsuya N., Kogawara O., Sumino S., Takanami Y., Sugizaki K. // Vaccine. 2016. V. 34. P. 4635–4641. https://doi.org/10.1016/j.vaccine.2016.05.050
Akeda Y., Koizumi Y., Takanami Y., Sumino S., Hattori Y., Sugizaki K., Mitsuya N., Oishi K. // Vaccine. 2018. V. 36. P. 1528–1532. https://doi.org/10.1016/j.vaccine.2018.02.011
Costantino P., Rappuoli R., Berti F. // Expert Opin. Drug Discov. 2011. V. 6. P. 1045–1066. https://doi.org/10.1517/17460441.2011.609554
Chu C., Schneerson R., Robbins J.B., Rastogi S.C. // Infect. Immun. 1983. V. 40. P. 245–256. https://doi.org/10.1128/IAI.40.1.245-256.1983
Biemans R.L., Boutriau D., Capiau C., Denoël P.A., Duvivier P., Poolman J.T. // Рat. US9358279B2, 2016. 36 pp.
Gordon L.K. Pat. US4496538A, 1985. 9 pp.
Jones C. // An. Acad. Bras. Ciênc. 2005. V. 77. P. 293–324. https://doi.org/10.1590/S0001-37652005000200009
Fernandez Santana V., Peña Icart L., Beurret M., Costa L., Verez Bencomo V. // Methods in Enzymology. Elsevier, 2006. V. 415. P. 153–163.
Rodríguez Montero M.C., Ruíz García J.A., Valdés Balbín Y., Vérez Bencomo V. // Drug Discovery / Eds. Jimenez-Barbero J., Canada F.J., Martin-Santamaria S. Cambridge: Royal Society of Chemistry, 2015. P. 286–307.
Tai J.Y., Vella P.P., McLean A.A., Woodhour A.F., McAleer W.J., Sha A., Dennis-Sykes C., Hilleman M.R. // Exp. Biol. Med. 1987. V. 184. P. 154–161. https://doi.org/10.3181/00379727-184-42460
Hilleman M.R., Tai J.Y., Tolman R.L., Vella P.P. // Рat. US4459286, 1984. 19 pp.
Shafer D.E., Toll B., Schuman R.F., Nelson B.L., Mond J.J., Lees A. // Vaccine. 2000. V. 18. P. 1273–1281. https://doi.org/10.1016/s0264-410x(99)00370-9
Lees A., Nelson B.L., Mond J.J. // Vaccine. 1996. V. 14. P. 190–198. https://doi.org/10.1016/0264-410X(95)00195-7
Anderson P., Pichichero M.E., Insel R.A. // J. Clin. Invest. 1985. V. 76. P. 52–59. https://doi.org/10.1172/JCI111976
Costantino P., Norelli F., Giannozzi A., D’Ascenzi S., Bartoloni A., Kaur S., Tang D., Seid R., Viti S., Paffetti R., Bigio M., Pennatini C., Averani G., Guarnieri V., Gallo E., Ravenscroft N., Lazzeroni C., Rappuoli R., Ceccarini C. // Vaccine. 1999. V. 17. P. 1251–1263. https://doi.org/10.1016/S0264-410X(98)00348-X
Marburg S., Jorn D., Tolman R.L., Arison B., McCauley J., Kniskern P.J., Hagopian A., Vella P.P. // J. Am. Chem. Soc., 1986. V. 108. P. 5282–5287.https://doi.org/10.1021/ja00277a037
Anderson P.W., Pichichero M.E., Insel R.A., Betts R., Eby R., Smith D.H. // J. Immunol. 1986. V. 137. P. 1181–1186.
Anderson P., Pichichero M., Edwards K., Porch C.R., Insel R. // Pediatrics. Elsevier, 1987. V. 111. P. 644–650. https://doi.org/10.1016/S0022-3476(87)80237-8
Laferriere C., Ravenscroft N., Wilson S., Combrink J., Gordon L., Petre J. // Glycoconj. J. 2011. V. 28. P. 463–472. https://doi.org/10.1007/s10719-011-9344-3
Zon G., Robbins J.D. // Carbohydr. Res. 1983. V. 114. P. 103–121. https://doi.org/10.1016/0008-6215(83)88177-4
Hoogerhout P., Evenberg D., van Boeckel C.A.A., Poolman J.T., Beuvery E.C., van der Marel G.A., van Boom J.H. // Tetrahedron Lett. 1987. V. 28. P. 1553–1556. https://doi.org/10.1016/S0040-4039(01)81040-6
Hoogerhout P., Funke C.W., Mellema J.-R., Wagenaars G.N., A. van Boeckel C.A., Evenberg D., Poolman J.T., Lefeber A.W.M., Van Der Marel G.A., Van Boom J.H. // J. Carbohydr. Chem. 1988. V. 7. P. 399–416. https://doi.org/10.1080/07328308808058933
Peeters C.C., Evenberg D., Hoogerhout P., Käyhty H., Saarinen L., van Boeckel C.A., van der Marel G.A., van Boom J.H., Poolman J.T. // Infect. Immun. 1992. V. 60. P. 1826–1833.
Hermans J.P.G., Poot L., van der Marel G.A., Hoogerhout P., Kloosterman M., van Boom J.H., van Boeckel C.A.A., Evenberg D., Poolman J.T. // Recl. Trav. Chim. Pays-Bas. 2010. V. 106. P. 498–504. https://doi.org/10.1002/recl.19871060905
Elie C.J.J., Muntendam H.J., van den Elst H., van der Marel G.A., van Boom J.H., Hoogerhout P. // Recl. Trav. Chim. Pays-Bas. 2010. V. 108. P. 219–223. https://doi.org/10.1002/recl.19891080604
Chan L., Just G. // Tetrahedron Lett. 1990. V. 46. P. 151–162. https://doi.org/10.1016/S0040-4039(00)80414-1
Kandil A.A., Chan N., Chong P., Klein M. // Synlett. 1992. V. 1992. P. 555–557. https://doi.org/10.1055/s-1992-21412
Chong P., Hill R., Sia C., Klien M. // Рat. US5679352, 1997. 59 pp.
Nilsson S., Bengtsson M., Norberg T. // J. Carbohydr. Chem. 1992. V. 11. P. 265–285. https://doi.org/10.1080/07328309208017993
Chiu Machado I., Madrazo Alonso O., Verez Bencomo V. // J. Carbohydr. Chem. 1994. V. 13. P. 465–474. https://doi.org/10.1080/07328309408009207
Chiu-Machado I., Castro-Palomino J.C., Madrazo-Alonso O., Lopetegui-Palacios C., Verez-Bencomo V. // J. Carbohydr. Chem. 1995. V. 14. P. 551–561. https://doi.org/10.1080/07328309508005357
Verez Bencomo V., Roy R. // Рat. US6765091, 2004. 21 pp.
Baek J.Y., Geissner A., Rathwell D.C.K., Meierhofer D., Pereira C.L., Seeberger P.H. // Chem. Sci. 2018. V. 9. P. 1279–1288. https://doi.org/10.1039/C7SC04521B
Evenberg D., Hoogerhout P., van Boeckel C.A.A., Rijkers G.T., Beuvery E.C., van Boom J.H., Poolman J.T. // J. Infect. Dis. 1992. V. 165. P. S152–S155. https://doi.org/10.1093/infdis/165-Supplement_1-S152
Kandil A.A., Chan N., Klein M., Chong P. // Glycoconj. J. 1997. V. 14. P. 13–17. https://doi.org/10.1023/A:1018500712733
Anderson P.W., Pichichero M.E., Stein E.C., Porcelli S., Betts R.F., Connuck D.M., Korones D., Insel R.A., Zahradnik J.M., Eby R. // J. Immunol. 1989. V. 142. P. 2464–2468.
Rana R., Dalal J., Singh D., Kumar N., Hanif S., Joshi N., Chhikara M.K. // Vaccine. 2015. V. 33. P. 2646–2654. https://doi.org/10.1016/j.vaccine.2015.04.031
Pillai S., Ciciriello S., Koster M., Eby R. // Infect. Immun. 1991. V. 59. P. 4371–4376. https://doi.org/10.1128/IAI.59.12.4371-4376.1991
Chong P., Chan N., Kandil A., Tripet B., James O., Yang Y.P., Shi S.P., Klein M. // Infect. Immun. 1997. V. 65. P. 4918–4925. https://doi.org/10.1128/IAI.65.12.4918-4925.1997
Seeberger P.H., Pereira C.L. // Pat. US20190153015A1, 2019.
Ribeiro G.S., Reis J.N., Cordeiro S.M., Lima J.B.T., Gouveia E.L., Petersen M., Salgado K., Silva H.R., Zanella R.C., Almeida S.C.G., Brandileone M.C., Reis M.G., Ko A.I. // J. Infect. Dis. 2003. V. 187. P. 109–116. https://doi.org/10.1086/345863
Boisvert A.-A., Moore D. // Can. J. Infect. Dis. Med. Microbiol. 2015. V. 26. P. 291–292. https://doi.org/10.1155/2015/613820
Cox A., Barreto L., Ulanova M., Bruce M., Tsang R. // Can. Commun. Dis. Rep. 2017. V. 43. P. 89–95. https://doi.org/10.14745/ccdr.v43i05a02
Jin Z., Romero-Steiner S., Carlone G.M., Robbins J.B., Schneerson R. // Infect. Immun. 2007. V. 75. P. 2650–2654. https://doi.org/10.1128/IAI.01774-06
Akhmatova N.K., Kurbatova E.A., Akhmatov E.A., Egorova N.B., Logunov D.Yu., Gening M.L., Sukhova E.V., Yashunsky D.V., Tsvetkov Yu.E., Nifantiev N.E. // Front. Immunol. 2016. V. 7. Article 248. https://doi.org/10.3389/fimmu.2016.00248
Kochetkov N.K., Nifant’ev N.E., Backinowsky L.V. // Tetrahedron. 1987. V. 43. P. 3109–3121. https://doi.org/10.1016/S0040-4020(01)86852-6
Kurbatova E.A., Akhmatova N.K., Akhmatova E.A., Egorova N.B., Yastrebova N.E., Sukhova E.V., Yashunsky D.V., Tsvetkov Y.E., Gening M.L., Nifantiev N.E. // Front. Immunol. 2017. V. 8. Article 659. https://doi.org/10.3389/fimmu.2017.00659
Kaplonek P., Khan N., Reppe K., Schumann B., Emmadi M., Lisboa M.P., Xu F.-F., Calow A.D.J., Parameswarappa S.G., Witzenrath M., Pereira C.L., Seeberger P.H. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. P. 13 353–13 358. https://doi.org/10.1073/pnas.1811862115
Генинг М.Л., Курбатова Е.А., Нифантьев Н.Э. // Биоорг. химия. 2021. Т. 47. С. 3–28. [Gening M.L., Kurbatova E.A., Nifantiev N.E. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 1–24.] https://doi.org/10.31857/S0132342321010073
Krylov V.B., Gerbst A.G., Argunov D.A., Dmitrenok A.S., Shashkov A.S., Kaczynski Z., Huebner J., Holst O., Nifantiev N.E. // Chem. Eur. J. 2015. V. 21. P. 1749–1754. https://doi.org/10.1002/chem.201405857
Laverde D., Romero-Saavedra F., Argunov D.A., Enotarpi J., Krylov V.B., Kalfopoulou E., Martini C., Torelli R., van der Marel G.A., Sanguinetti M., Codée J.D.C., Nifantiev N.E., Huebner J. // ACS Infect. Dis. 2020. V. 6. P. 1816–1826. https://doi.org/10.1021/acsinfecdis.0c00063
van der Put R.M.F., Kim T.H., Guerreiro C., Thouron F., Hoogerhout P., Sansonetti P.J., Westdijk J., Stork M., Phalipon A., Mulard L.A. // Bioconjug. Chem. 2016. V. 27. P. 883–892. https://doi.org/10.1021/acs.bioconjchem.5b00617
Harale K.R., Dumare N.B., Singh D., Misra A.K., C-hhikara M.K. // RSC Adv., 2015. V. 5. P. 41332–41340. https://doi.org/10.1039/c5ra02993g
Seeberger P.H., Pereira C.L., Khan N., Xiao G., Diago-Navarro E., Reppe K., Opitz B., Fries B.C., Witzenrath M. // Angew. Chem. Int. Ed. Engl. 2017. V. 56. P. 13 973–13 978. https://doi.org/10.1002/anie.201700964
Verkhnyatskaya S.A., Krylov V.B., Nifantiev N.E. // Eur. J. Org. Chem. 2017. V. 2017. P. 710–718. https://doi.org/10.1002/ejoc.201601413
Argunov D.A., Trostianetskaia A.S., Krylov V.B., Kurbatova E.A., Nifantiev N.E. // Eur. J. Org. Chem. 2019. V. 2019. P. 4226–4232. https://doi.org/10.1002/ejoc.201900389
Oberli M.A., Hecht M.-L., Bindschädler P., Adibekian A., Adam T., Seeberger P.H. // Chem. Biol. 2011. V. 18. P. 580–588. https://doi.org/10.1016/j.chembiol.2011.03.009
Gening M., Tsvetkov Y., Titov D., Gerbst A., Yudina O., Grachev A., Shashkov A., Vidal S., Imberty A., Saha T., Kand D., Talukdar P., Pier G., Nifantiev N. // Pure A-ppl. Chem. 2013. V. 85. P. 1879–1891. https://doi.org/10.1351/PAC-CON-12-09-06
Gening M.L., Maira-Litrán T., Kropec A., Skurnik D., Grout M., Tsvetkov Y.E., Nifantiev N.E., Pier G.B. // Infect. Immun. 2010. V. 78. P. 764–772. https://doi.org/10.1128/IAI.01093-09
Gening M.L., Tsvetkov Y.E., Pier G.B., Nifantiev N.E. // Carbohydr. Res. 2007. V. 342. P. 567–575. https://doi.org/10.1016/j.carres.2006.08.010
Cywes-Bentley C., Skurnik D., Zaidi T., Roux D., DeOliveira R.B., Garrett W.S., Lu X., O’Malley J., Kinzel K., Zaidi T., Rey A., Perrin C., Fichorova R.N., Kayatani A.K.K., Maira-Litran T., Gening M.L., Tsvetkov Y.E., Nifantiev N.E., Bakaletz L., Pelton S.I., Golenbock D., Pier G.B. // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. E2209–E2218. https://doi.org/10.1073/pnas.1303573110154
Komarova B.S., Orekhova M.V., Tsvetkov Y.E., Nifantiev N.E. // Carbohydr. Res. 2014. V. 384. P. 70–86. https://doi.org/10.1016/j.carres.2013.11.016
Komarova B.S., Orekhova M.V., Tsvetkov Y.E., Beau R., Aimanianda V., Latgé J.-P., Nifantiev N.E. // Chem. Eur. J. 2015. V. 21. P. 1029–1035. https://doi.org/10.1002/chem.201404770
Komarova B.S., Tsvetkov Y.E., Nifantiev N.E. // Chem. Rec. 2016. V. 16. P. 488–506. https://doi.org/10.1002/tcr.201500245
Komarova B.K., Wong S.S., Orekhova M.V., Tsvetkov Y.E., Krylov V.B., Beauvais A., Bouchara J.-P., Kearney J., Aimanianda V., Latgé J.-P., Nifantiev N.E. // J. Org. Chem. 2018. V. 83. P. 12 965–12 976. https://doi.org/10.1021/acs.joc.8b01142
Argunov D.A., Krylov V.B., Nifantiev N.E. // Org. Biomol. Chem. 2015. V. 13. P. 3255–3267. https://doi.org/10.1039/c4ob02634a
Paulovičová E., Paulovičová L., Hrubiško M., Krylov V.B., Argunov D.A., Nifantiev N.E. // Front. Immunol. 2017. Article 1273. https://doi.org/10.3389/fimmu.2017.01273
Крылов В.Б., Петрук М.И., Григорьев И.В., Лебедин Ю.С., Глушко Н.И., Халдеева Е.В., Аргунов Д.А., Хатунцева Е.А., Топлишек М.В., Комарова Б.С., Карелин А.А., Юдина О.Н., Меньшов В.М., Яшунский Д.В., Цветков Ю.Е., Нифантьев Н.Э. // Биоорг. химия. 2018. Т. 44. С. 80–89. [Krylov V.B., Petruk M.I., Grigoryev I.V., Lebedin Y.S., Glushko N.I., Khaldeeva E.V., Argunov D.A., Khatuntseva E.A., Toplishek M.V., Komarova B.S., Karelin A.A., Yudina O.N., Menshov V.M., Yashunskii D.V., Tsvetkov Y.E., Nifantiev N.E. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 80–89.] https://doi.org/10.1134/S1068162017060073
Krylov V.B., Argunov D.A., Solovev A.S., Petruk M.I., Gerbst A.G., Dmitrenok A.S., Shashkov A.S., Latgé J.-P., Nifantiev N.E. // Org. Biomol. Chem., 2018. V. 16. P. 1188–1199. https://doi.org/10.1039/c7ob02734f
Wong S.S.W., Krylov V.B., Argunov D.A., Karelin A.A., Bouchara J.-P., Fontaine T., Latgé J.-P., Nifantiev N.E. // mSphere. 2020. V. 5. Article e5:e00688-19. https://doi.org/10.1128/mSphere.00688-19
Mironov Y., Sherman A., Nifantiev N. // Tetrahedron Lett. 2004. V. 45. P. 9107–9110. https://doi.org/10.1016/j.tetlet.2004.10.022
Khatuntseva E.A., Sherman A.A., Tsvetkov Y.E., Nifantiev N.E. // Tetrahedron Lett. 2015. V. 57. P. 708–711. https://doi.org/10.1016/j.tetlet.2016.01.013
Kazakova E.D., Yashunsky D.V., Krylov V.B., Bouchara J.-P., Cornet M., Valsecchi I., Fontaine T., Latgé J.-P., Nifantiev N.E. // J. Am. Chem. Soc. 2020. V. 142. P. 1175–1179. https://doi.org/10.1021/jacs.9b11703
Карелин А.А., Цветков Ю.Е., Коган Г., Быстрицки С., Нифантьев Н.Э. // Биоорган. химия. 2007. Т. 33. С. 119–130. [Karelin A.A., Tsvetkov Yu.E., Kogan G., Bystricky S., Nifantiev N.E. // Russ. J. Bioorg. Chem. 2007. V. 33. P. 110–121.] https://doi.org/10.1134/S106816200701013X
Карелин А.А., Цветков Ю.Е., Нифантьев Н.Э. // Успехи химии. 2017. Т. 86. С. 1073–1126. [Karelin A.A., Tsvetkov Y.E., Nifantiev N.E. // Russ. Chem. Rev., 2017. V. 86. P. 1073–1126.] https://doi.org/10.1070/RCR4750
Karelin A.A., Tsvetkov Y.E., Paulovičova L., Bystricky S., Paulovičova E., Nifantiev N.E. // Carbohydr. Res. 2009. V. 344. P. 29–35. https://doi.org/10.1016/j.carres.2008.09.016
Paulovičová E., Paulovičová L., Pilišiová R., Jančinová V., Yashunsky D.V., Karelin A.A., Tsvetkov Y.E., Nifantiev N.E. // Cell. Microbiol. 2016. V. 18. P. 1294–1307. https://doi.org/10.1111/cmi.12631
Bundle D.R., Nycholat C., Costello C., Rennie R., Lipinski T. // ACS Chem. Biol. 2012. V. 7. P. 1754–1763. https://doi.org/10.1021/cb300345e
Adamo R., Nilo A., Castagner B., Boutureira O., Berti F., Bernardes G.J.L. // Chem. Sci. 2013. V. 4. P. 2995–3008. https://doi.org/10.1039/C3SC50862E
Hu Q.-Y., Berti F., Adamo R. // Chem. Soc. Rev. 2016. V. 45. P. 1691–1719. https://doi.org/10.1039/c4cs00388h
MacCalman T.E., Phillips-Jones M.K., Harding S.E. // Biotechnol. Genet. Eng. Rev. 2019. V. 35. P. 93–125. https://doi.org/10.1080/02648725.2019.1703614
Брико Н.И., Попович Л.Д., Миндлина А.Я., Волкова О.И., Курилович Е.О.// Эпидемиология и вакцинопрофилактика. 2020. Т. 19. С. 4–13. https://doi.org/10.31631/2073-3046-2020-19-1-4-13
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия