Биоорганическая химия, 2021, T. 47, № 1, стр. 144-152
Влияние субхронического введения пептида HLDF-6 на эффективность исследовательского поведения мышей линий Balb/c и C57Bl/6
Г. И. Ковалев 1, *, Е. В. Васильева 1, Р. М. Салимов 1, Ю. А. Золотарев 2, А. К. Дадаян 2, А. П. Богачук 3, В. М. Липкин 3
1 ФГБНУ НИИ фармакологии имени В.В. Закусова
125315 Москва, ул. Балтийская, 8, Россия
2 ФГБУН Институт молекулярной генетики РАН
123182 Москва, пл. акад. Курчатова, 2, Россия
3 ФГБУН Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: kovalev@academpharm.ru
Поступила в редакцию 06.05.2020
После доработки 21.05.2020
Принята к публикации 23.05.2020
Аннотация
Проведен сравнительный анализ психотропной активности пептида HDLF-6 в кислотной (TGENHR) и амидной (HLDF-6-амид, TGENHR-NH2) формах с использованием метода оценки поведения мышей аутбредных линий Balb/c (обладающей исходным дефицитом ориентировочно-исследовательской активности) и С57Bl/6 (линия сравнения) в тесте “закрытый крестообразный лабиринт” (ЗКЛ) при внутрибрюшинном (в дозе 100 мкг/кг в сутки, пятикратно) и интраназальном (в ежедневных дозах 30, 100 и 300 мкг/кг в сутки) введении в течение 5 суток. Введение амидной защиты по С‑концу пептида HDLF-6 приводило к развитию селективного ноотропного эффекта у HLDF-6-амида (но не у HLDF-6) у мышей линии Balb/c как при интраназальном, так и при внутрибрюшинном применении пептида. Напротив, у мышей С57Bl/6 этот эффект не воспроизводился. При этом двигательная активность и уровень тревожности не изменялись у мышей этих генетических линий при использовании обеих форм пептида. На основании результатов поведенческих экспериментов в ЗКЛ сделан вывод о наличии у пептида HLDF-6-амида избирательного фармакологического эффекта, проявляющегося в повышении исследовательской активности только у животных с исходным когнитивным дефицитом, что является характерным для ноотропных препаратов. С помощью радиорецепторного анализа впервые установлено, что у пептида HLDF-6 и его производных обнаруживается общая мишень для высокоаффинного специфического связывания на мембранных препаратах головного мозга крыс. Таким образом, представляется перспективной дальнейшая разработка на основе пептида HLDF-6-амида оригинального ноотропного препарата для интраназального применения.
ВВЕДЕНИЕ
Ранее из клеток HL-60 промиелоцитарного лейкоза человека был выделен новый фактор дифференцировки лейкоцитов (HLDF), который является гликозилированным белком, содержащим 54 а.о. В составе фактора HLDF был идентифицирован шестичленный фрагмент HLDF-6 (41TGENHR46), полностью воспроизводящий дифференцирующую активность полноразмерного белка [1, 2]. Были определены уровни белкового фактора HLDF в отделах мозга и показано положительное влияние гексапептида HLDF-6 на биосинтез de novo ДНК и белка в гомогенизатах мозга [3]. В условиях бета-амилоидной токсичности пептид HLDF-6 проявляет антиапоптотическую активность на первичных культурах нейронов мозжечка и гиппокампа. Показано, что нейропротекторный пептид HLDF-6 в дозах 1–50 мкг/кг предотвращает нейродегенерацию в гиппокампе, а также потерю долговременной памяти и снижение ориентировочно-исследовательской активности у крыс на экспериментальной модели болезни Альцгеймера [4]. Установлено, что пептид HLDF-6 обладает антиишемическим эффектом на модели хронической церебральной ишемии, обеспечивая как защиту нейронов, так и восстановление когнитивных способностей животных в поведенческих тестах [5]. Ранее было показано, что замещение в пептиде HLDF-6 С‑концевой карбоксильной группы на амидную повышает протеолитическую стабильность модифицированного пептида HLDF-6-амида в плазме крови крыс [6]. Также на токсических моделях болезни Альцгеймера было показано, что пептид HLDF-6-амид обладает более высокой ноотропной и нейропротекторной активностью по сравнению с пептидом HLDF-6, не содержащим амидной защиты [7]. Установлено, что фармакологические эффекты пептида HLDF-6-амида реализуются с участием NMDA-глутаматергической системы гиппокампа [8].
Известно, что ноотропная активность препаратов наиболее специфично проявляется в условиях создания когнитивного дефицита [9]. Один из оптимальных способов его моделирования – применение неинвазивных методов оценки дефицита исследовательского поведения в ранее незнакомой обстановке, в частности метода “закрытый крестообразный лабиринт” (ЗКЛ) [10]. Другая существенная особенность препаратов с ноотропной активностью – их способность проявлять специфическую фармакологическую активность после неоднократного системного введения [11, 12]. Для моделирования сниженной эффективности исследовательского поведения в ЗКЛ были использованы мыши инбредной линии Balb/c, обладающие исходным дефицитом исследовательской активности; в качестве линии сравнения использовали мышей линии С57Bl/6 [10].
Целью данного исследования стал сравнительный анализ ноотропной активности пептида HDLF-6 в кислотной (TGENHR) и амидной (пептид HLDF-6-амид, TGENHR-NH2) формах с применением неинвазивного поведенческого теста “закрытый крестообразный лабиринт” для оценки способности к пространственной ориентации без предварительного обучения, уровня тревожности и двигательной активности, а также поиск предполагаемых мест специфического связывания этого гексапептида.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительное изучение влияния пептидов HLDF-6 и HLDF-6-амида на поведение мышей линий Balb/c и С57Bl/6 в тесте ЗКЛ. Ранее установлено, что специфическое действие ноотропных препаратов проявляется преимущественно в условиях когнитивного дефицита и сниженной восстановительной способности мозга [9, 13]. Предполагаемое воздействие на когнитивное поведение изучали в неинвазивном тесте ЗКЛ на мышах. Данный тест основан на использовании врожденных индивидуальных способностей животных по пространственной ориентации в новой обстановке без предшествующего обучения, что принципиально отличает его от методов условного рефлекса пассивного избегания и условного рефлекса активного избегания, в основе которых лежит предварительное обучение. Тест способен выявлять воздействие психотропных препаратов на когнитивную активность, тревожность, вызванную новизной обстановки, а также на двигательную активность. Для сравнительного анализа ноотропной активности пептидов HLDF-6 и HLDF-6-амида были использованы инбредные мыши линий Balb/c и С57Bl/6, различающиеся как по эффективности исследовательского поведения в лабиринте, так и по уровню тревожности и двигательной активности [10]. Инбредные мыши Balb/c служили моделью для оценки состояния когнитивного дефицита и повышенной тревожности, а мыши линии C57Bl/6 – в качестве линии сравнения.
Внутрибрюшинное введение пептидов. Пептиды HLDF-6 и HLDF-6-амид вводили внутрибрюшинно в ежедневной дозе 100 мкг/кг в течение 5 суток. Последнее введение осуществляли за 30 мин до поведенческой сессии. Избирательный фармакологический эффект, связанный с ноотропной активностью пептидов, оценивали по двум параметрам эффективности ориентировочно-исследовательского поведения – “длина первого цикла патрулирования”, отражающей количество заходов, затрачиваемых на первый полный обход всех четырех боковых отсеков лабиринта, и “число циклов патрулирования” – количеству полных обходов тупиков за сессию [14].
Результаты компьютерной обработки исследовательской активности животных представлены на рис. 1а, 1б. Из них следует, что плацебо-группа линии Balb/c (белые столбцы) уступает плацебо-группе линии C57Bl/6 (сплошные серые столбцы) по ряду поведенческих актов: мыши линии С57Bl/6 превосходят животных Balb/c по параметру “длина первого цикла патрулирования” (F_PtrN) на 14% (р < 0.05), а по параметру “число циклов патрулирования” (PtrN) – на 11% (р < 0.05).
Рис. 1.
Влияние субхронического внутрибрюшинного введения пептидов HLDF-6-амида (а) и HLDF-6 (б) в дозе 100 мкг/кг в сутки на эффективность исследовательской активности мышей линий Balb/c и C57Bl/6 в тесте “закрытый крестообразный лабиринт”. Обозначения: * – статистически значимые отличия от мышей Balb/c по t-критерию Стьюдента; + – статистически значимые отличия от контроля по U-критерию Манна–Уитни; F_PtrN – длина первого цикла патрулирования; PtrN – число циклов патрулирования; F_ChTm – латентное время до 1-го захода в боковой отсек; F_GITm – время пребывания в первом боковом отсеке; Т_ChTm – общее время пребывания животного в центральном отсеке лабиринта; Т_GlTm – общее время, проведенное в боковых отсеках.
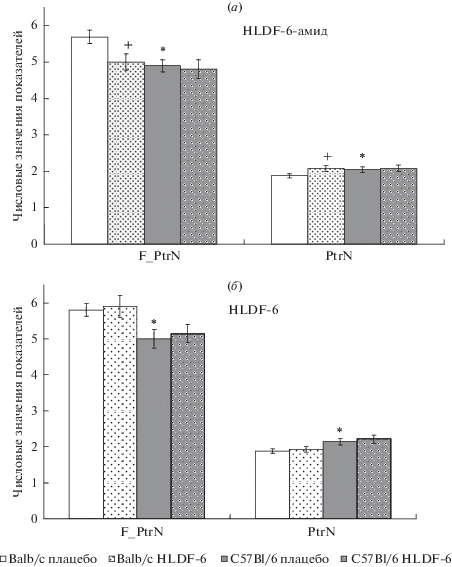
У мышей опытной группы C57Bl/6 после субхронического внутрибрюшинного введения пептида HLDF-6-амид в ежедневной дозе 100 мкг/кг в течение 5 суток оба показателя эффективности исследовательского поведения не отличаются от значений в контроле, тогда как у мышей линии Balb/c наблюдается повышение эффективности исследовательского поведения до значений, характерных для соответствующих групп линии C57Bl/6 (рис. 1а).
После введения по аналогичному протоколу пептида HLDF-6 (рис. 1б) значимых изменений эффективности исследовательского поведения не отмечено ни у мышей Balb/c, ни у мышей С57Bl/6. Таким образом, субхроническое внутрибрюшинное введение пептида HLDF-6 в дозе 100 мкг/кг в сутки оказывается неэффективным в отношении показателей исследовательского поведения, соответствующих ноотропной активности, присущей амидной форме пептида (рис. 1а).
На рис. 2 представлены результаты сравнительного анализа влияния пептидов на двигательную активность и уровень тревожности у двух линий мышей. Из них следует, что по исходному показателю тревожности – “латентное время до 1-го захода в боковой отсек” (F_ChTm) – мыши плацебо-группы линии Balb/c (белые столбцы) вдвое превосходят мышей плацебо-группы линии C57Bl/6 (сплошные серые столбцы). Субхроническое введение как пептида HLDF-6, так и HLDF-6-амида к существенным сдвигам в этих элементах поведения не приводит, т.е. анксиолитическая активность обоих пептидов не развивается. Этот результат согласуется с данными, полученными ранее в тесте “открытое поле”, по которым анксиолитический эффект пептида HLDF-6-амида развивался не ранее трех недель внутрибрюшинного введения [8]. Можно предположить, что ноотропный эффект пептида HLDF-6-амид проявляется значительно быстрее анксиолитического.
Рис. 2.
Влияние субхронического внутрибрюшинного введения пептидов HLDF-6-амида (а) и HLDF-6 (б) в дозе 100 мкг/кг в сутки на уровень тревожности и двигательную активность мышей линий Balb/c и C57Bl/6 в тесте “закрытый крестообразный лабиринт”. Обозначения: *, + – статистически значимые отличия от мышей BALB/c по t-критерию Стьюдента и U-критерию Манна–Уитни соответственно; F_PtrN – длина первого цикла патрулирования; PtrN – число циклов патрулирования; F_ChTm – латентное время до 1-го захода в боковой отсек; F_GITm – время пребывания в первом боковом отсеке; Т_ChTm – общее время пребывания животного в центральном отсеке лабиринта; Т_GlTm – общее время, проведенное в боковых отсеках.

Кроме того, приведенные на рис. 2 данные свидетельствуют о том, что при 5-кратном введении обеих форм пептида HLDF-6 в дозе 100 мкг/кг в сутки изменений двигательной активности у мышей обеих линий не наблюдается.
Сравнительный анализ влияния пептидов HLDF-6-амида и HLDF-6 на ряд показателей поведения мышей инбредных линий Balb/c и С57Bl/6, исходно различающихся по эффективности исследовательского поведения и уровню тревожности, свидетельствует о том, что пептид HLDF-6-амид избирательно улучшает когнитивное поведение мышей линии Balb/c с исходным дефицитом исследовательской активности, не изменяя поведения мышей линии сравнения С57Bl/6. Селективность относительно когнитивного дефицита присуща и традиционным ноотропам – пирацетаму [11], фенотропилу [15], пантогаму [12], используемым в более высоких дозах (50–200 мг/кг), а также пептидным препаратам семаксу и ноопепту в дозах 0.6 и 1.0 мг/кг соответственно [16, 17]. Не содержащий амидной защиты пептид HLDF-6 при субхроническом внутрибрюшинном введении в дозе 100 мкг/кг в сутки оказался неактивным и не улучшал когнитивный компонент поведения в условиях данного эксперимента.
Интраназальное введение пептидов. Вторая часть исследования выполнена с применением интраназального введения пептидов как адекватного пути введения препаратов пептидной природы, позволяющего исключить пресистемный метаболизм в желудочно-кишечном тракте и печени, вследствие чего ускоряется достижение терапевтического эффекта. Пептиды HLDF-6-амид и HLDF-6 в дозах 30, 100 и 300 мкг/кг в сутки или физиологический раствор вводили мышам линий Balb/c и С57Bl/6 в течение 5 суток.
Результаты компьютерной обработки исследовательской поведенческой активности мышей обеих линий представлены в табл. 1 и 2. Показано, что мыши линии Balb/c плацебо-группы уступают мышам линии С57Bl/6 из соответствующей группы в эффективности исследовательского поведения в незнакомой обстановке – длина первого цикла патрулирования (F_PtrN) у мышей линии Balb/c была на 13% больше, чем у C57Bl/6 (p < 0.05).
Таблица 1.
Влияние субхронического интраназального введения пептида HLDF-6-амида на исследовательское поведение мышей в тесте “закрытый крестообразный лабиринт”
| Линия мышей | Группы (мкг/кг в сутки) | Длина первого цикла патрулирования, число заходов (F_PtrN) | Число циклов патрулирования (PtrN) |
|---|---|---|---|
| Balb/c | Плацебо (физ. раствор) | 6.18 ± 1.32 | 1.72 ± 0.66 |
| HLDF-6-амид (30) | 6.33 ± 2.61 | 1.60 ± 0.69 | |
| HLDF-6-амид (100) | 5.83 ± 1.95 | 1.91 ± 0.67 | |
| HLDF-6-амид (300) | 5.24 ± 1.12* | 2.00 ± 0.53* | |
| C57Bl/6 | Плацебо (физ. раствор) | 5.45 ± 1.30# | 1.98 ± 0.49 |
| HLDF-6-амид (30) | 5.84 ± 0.8 | 2.14 ± 0.55 | |
| HLDF-6-амид (100) | 5.58 ± 1.24 | 2.00 ± 0.58 | |
| HLDF-6-амид (300) | 5.77 ± 2.01 | 2.01 ± 0.48 |
Таблица 2.
Влияние субхронического интраназального введения пептида HLDF-6 на исследовательское поведение мышей в тесте “закрытый крестообразный лабиринт”
| Линия мышей | Группы (мкг/кг в сутки) | Длина первого цикла патрулирования (F_PtrN) | Число циклов патрулирования (PtrN) |
|---|---|---|---|
| Balb/c | Плацебо (физ. раствор) | 6.18 ± 2.32 | 1.72 ± 0.66 |
| HLDF-6 (30) | 5.97 ± 2.10 | 1.67 ± 0.64 | |
| HLDF-6 (100) | 6.08 ± 1.67 | 1.62 ± 0.65 | |
| HLDF-6 (300) | 5.34 ± 1.33* | 1.81 ± 0.47 | |
| C57Bl/6 | Плацебо (физ. раствор) | 5.45 ± 1.30# | 1.98 ± 0.49 |
| HLDF-6 (30) | 5.91 ± 1.31 | 2.15 ± 0.38 | |
| HLDF-6 (100) | 6.08 ± 1.98 | 2.00 ± 0.71 | |
| HLDF-6 (300) | 5.64 ± 1.12 | 2.08 ± 0.51 |
Субхроническое 5-кратное введение пептида HLDF-6-амида в ежедневной дозе 30 мкг/кг не оказывало положительного эффекта. При введении в дозе 100 мкг/кг в сутки проявлялась выраженная тенденция к улучшению (p = 0.058), тогда как в дозе 300 мкг/кг в сутки улучшение наступало сразу по двум параметрам исследовательского поведения: длина первого цикла (F_PtrN) сокращалась на 15%, а общее число полных циклов (PtrN) увеличивалось на 16%. Напротив, у мышей линии сравнения C57Bl/6 аналогичное введение пептида HLDF-6-амида не оказывало достоверного влияния на эффективность исследовательского поведения ни в одной из доз (табл. 1).
Как и в случае с HLDF-6-амидом, изменений в исследовательском поведении у мышей линии сравнения C57Bl/6 в результате 5-кратного интраназального введения пептида HLDF-6 не отмечено. У мышей линии Balb/c, обнаруживающей когнитивный дефицит, после интраназального введения пептида HLDF-6 в дозе 300 мкг/кг в сутки эффективность исследовательского поведения улучшалась лишь по одному параметру – снижалась длина первого цикла патрулирования (F_PtrN) (табл. 2).
Ранее на примере пептидов семакса и ноопепта нами было показано, что выраженное ноотропное действие пептидных препаратов при интраназальном введении мышам Balb/c может означать, что при экстранейрональном пути поступления пептиды через обонятельный эпителий попадают в большей степени в области мозга, связанные с процессами памяти и обучения, тогда как при внутрибрюшинном введении – преимущественно в структуры мозга, ответственные за эмоциональный статус (передний мозг и лимбические области), вследствие чего преобладает анксиолитический эффект [17]. Следовательно, дальнейшая разработка ноотропного фармакологического препарата с интраназальным способом введения на основе пептида HLDF-6-амид представляется перспективной.
Радиорецепторный анализ связывания меченного тритием пептида [3H]Ac-HLDF-6-NH2 с мембранными препаратами головного мозга крыс. В проведенных ранее экспериментах исследователям не удавалось обнаружить специфического связывания пептида HLDF-6 на поверхности клеток, хотя было установлено, что даже однократные замены аминокислотных остатков в его структуре приводят к потере дифференцирующей активности [2]. В нашей работе с использованием меченного тритием пептида [3H]Ac-HLDF-6-NH2 было впервые продемонстрировано, что на мембранных препаратах, приготовленных из головного мозга самцов крыс Вистар, имеются места высокоаффинного специфического связывания пептида HLDF-6 и его производных (рис. 3). Показано, что величина IC50 для исходного пептида HLDF-6 составляет 1813 ± 0.19 нМ, тогда как у его содержащих защитные группировки производных HLDF-6-амид, HLDF-6-АА (ацетил-амидная форма пептида HLDF-6) и HLDF-6-H (TGEXHR-NH2, где Х = Hse) эта величина составляет 531 ± 0.15, 754 ± 0.18 и 574 ± 0.14 нМ соответственно. Таким образом, у пептида HLDF-6 и его производных обнаружена общая мишень специфического связывания на мембранах головного мозга крыс. Введение амидной и ацетильной защиты в пептид не только не лишило этих производных сродства к местам специфического связывания на мембранах мозга, но и привело к увеличению сродства к местам связывания [3H]Ac-TGENHR-NH2 в 3.4 и 2.4 раза соответственно. Можно предположить, что в дальнейших экспериментах специфические фармакологические эффекты, установленные для незащищенной формы пептида HLDF-6, будут подтверждены и для других исследованных форм пептида.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные животные. Для in vivo исследований использовали самцов мышей инбредных линий Balb/c (n = 160) и C57Bl/6 (n = 108), полученных из питомника лабораторных животных ФИБХ РАН “Пущино”, массой 23–25 г. Для радиолигандного анализа in vitro применяли мембранные препараты мозга самцов аутбредных крыс Вистар (питомник “Столбовая”, n = 8, масса 200–220 г), приготовленные по стандартной методике, описанной ниже.
Содержание животных соответствовало Правилам лабораторной практики при проведении доклинических исследований в Российской Федерации (ГОСТ 351.000.3-96 и 51000.4-96) и Правилам надлежащей лабораторной практики (утв. приказом Министерства здравоохранения Российской Федерации от 1 апреля 2016 г. № 199н). Мышей содержали по 8 особей в клетке, крыс – по 4 особи, всех в условиях свободного доступа к воде и корму при температуре 21°С и постоянном световом дне 14 ч (включение света в 8 ч утра). Факторы внешней среды (температура, влажность, освещенность, состав подстила) соответствовали требованиям по содержанию лабораторных животных.
Изучение влияния пептидов HLDF-6-амида и HLDF-6 на поведение мышей линий Balb/c и С57Bl/6 в тесте ЗКЛ. Пептиды HLDF-6-амид и HLDF-6 в дозах 30, 100 и 300 мкг/кг (опытные группы) или физиологический раствор (плацебо-группы) вводили внутрибрюшинно (100 мкг/кг, по весу животного) или интраназально (30, 100 и 300 мкг/кг, в объеме 10 мкл) ежедневно в течение 5 суток. Количество животных в каждой группе – от 10 до 15. Для оценки исследовательского поведения животных использовали закрытый крестообразный лабиринт, который состоял из четырех прозрачных пластмассовых закрытых пустых отсеков, соединявшихся с таким же центральным отсеком с помощью входных отверстий [18]. Тупиковые отсеки размером 14 × 14 × 14 см были пронумерованы по часовой стрелке от 1 до 4. Пол лабиринта очищали влажным ватным тампоном перед каждым опытом. Мышь помещали в центральный отсек, после чего лабиринт накрывали прозрачной крышкой. Животное могло свободно перемещаться по его отделениям, а экспериментатор синхронно фиксировал номера посещаемых отделений, используя компьютерную программу, регистрирующую последовательность и продолжительность переходов. Критерием захода в отсек лабиринта считалось наличие всех четырех лап животного внутри этого помещения. Эксперимент продолжался до тех пор, пока животное не совершит 12 переходов из одного бокового отсека в другой (т.е. пока оно не совершит 13 визитов в боковые отсеки).
Последующий компьютерный анализ данных позволил выделить следующие показатели:
1) “длина первого цикла патрулирования” (F_PtrN) и “число циклов патрулирования” (PtrN), совершенных за время эксперимента. Показатель “длина первого цикла патрулирования” исчисляется числом заходов животного в боковые отсеки лабиринта до момента, когда животное побывает во всех четырех боковых отсеках лабиринта хотя бы один раз. Чем меньше число заходов в боковые отсеки при первом цикле патрулирования и чем больше выполнено циклов патрулирования, тем более упорядоченно и эффективно происходит исследование лабиринта. Эти показатели могут быть использованы для оценки ноотропного действия вещества;
2) “общее время пребывания животного в центральном отсеке лабиринта” (Т_ChTm) и “общее время, проведенное в боковых отсеках” (Т_GlTm) в секундах, не считая 1-го захода в боковой отсек. Эти показатели отражают уровень двигательной активности животного, а также характеризуют интенсивность обследования ими новой среды и могут быть использованы для оценки стимулирующего/тимолептического или, наоборот, седативного эффекта вещества;
3) “латентное время до 1-го захода в боковой отсек” (F_ChTm) и “время пребывания в нем” (F_GITm). Эти показатели отражают баланс между любопытством и настороженностью животного при первом контакте с новой обстановкой. Если их величины значимо превышают, соответственно, показатели п. 2, то это может рассматриваться как признак настороженности и тревоги.
Статистическую обработку экспериментальных данных проводили с помощью программы Statistica 6.0.
Радиорецепторный анализ связывания меченного тритием пептида [3H]Ac-HLDF-6-NH2 с мембранами головного мозга крыс Вистар in vitro. После декапитации выделяли головной мозг, ткань немедленно замораживали в жидком азоте и хранили в низкотемпературной морозильной камере при –80°C для последующих экспериментов в условиях in vitro. В день эксперимента ткань мозга измельчали в гомогенизаторе Поттера “тефлон–стекло” в 25 объемах буфера (50 мМ Tris-HCl, 10 мM EDTA, pH 7.1). Гомогенат центрифугировали 10 мин при 48 000 g. Полученный осадок гомогенизировали в буфере и инкубировали 10 мин при 37°C, затем центрифугировали 10 мин при 48 000 g. Осадок ресуспендировали в 5 объемах буфера и замораживали в криопробирках при –80°C.
В день анализа ткань размораживали, разбавляли в 100 объемах буфера (50 мМ Tris-HCl, pH 7.1), центрифугировали 3 раза по 10 мин при 48 000 g. Осадок ресуспендировали в необходимом количестве буфера (50 мМ Tris-HCl, pH 7.1).
В экспериментах по радиолигандному связыванию использовали меченый тритием пептид [3H]Ac-HLDF-6-NH2 с удельной активностью 22 Кюри/ммоль. Инкубационная смесь (конечный объем 0.5 мл) содержала 50 мкл [3H]Ac-HLDF-6-NH2, 200 или 250 мкл буфера (50 мМ Tris-HCl, pH 7.1) и 200 мкл белковой суспензии мембран, для неспецифического связывания добавляли 50 мкл немеченого пептида (HLDF-6-АА). Реакционную смесь инкубировали при 4°C в течение 30 мин. По окончании инкубации пробы фильтровали через стекловолоконные фильтры GF/С (Whatman, Великобритания), предварительно выдержанные в течение 2 ч в 0.3%-ном полиэтиленимине при 4°C. Каждую пробирку промывали 2 раза холодным буфером (50 мМ Tris-HCl, pH 7.1), затем фильтры промывали 2 раза тем же объемом буфера. Фильтры просушивали на воздухе и переносили в сцинтилляционные флаконы, содержавшие по 5 мл сцинтилляционной жидкости на основе толуола (4 г PPO, 0.2 г POPOP на 1 л толуола). Определение радиоактивности проб осуществляли на сцинтилляционном счетчике Tri-Carb 2900TR (Perkin Elmer, США) с эффективностью счета 42–46%. Результаты измерений по радиорецепторному связыванию проводили с помощью пpoгpaммы GraphPad Prism 4.
Список литературы
Kostanyan I.A., Astapova M.V., Starovoytova E.V., Dranitsyna S.M., Lipkin V.M. // FEBS Letters. 1994. V. 356. P. 327–329. https://doi.org/10.1016/0014-5793(94)01306-3
Костанян И.А., Астапова М.В., Наволоцкая Е.В., Лепихова Т.Н., Драницина С.М., Телегин Г.Б., Родионов И.Л., Байдакова Л.К., Золотарев Ю.А., Молотковская И.М., Липкин В.М. // Биоорг. химия. 2000. Т. 26. С. 505–511. [Kostanyan I.A., Astapova M.V., Navolotskaya E.V., Lepikhova T.N., Dranitsyna S.M., Telegin G.B., Rodionov I.L., Baidakova L.K., Zolotarev Yu.A., Molotkovskaya I.M., Lipkin V.M. // Russ. J. Bioorg. Chem. 2000. V. 26. P. 505–511.] https://doi.org/10.1007/BF02758614
Sewell R.D., Gruden M.A., Pache D.M., Storogeva Z.I., Kostanyan I.A., Proshin A.T., Yurasov V.V., Sherstnev V.V. // J. Psychopharmacol. 2005. V. 19. P. 602–608. https://doi.org/10.1177/0269881105056645
Костанян И.А., Жохов С.С., Сторожева З.И., Прошин А.Т., Сурина Е.А., Бабиченко И.И., Шерстнев В.В., Липкин В.М. // Биоорг. химия. 2006. Т. 32. С. 399–407. [Kostanyan I.A., Zhokhov S.S., Storozheva Z.I., Proshin A.T., Surina E.A., Babichenko I.I., Sherstnev V.V., Lipkin V.M. // Russ. J. Bioorg. Chem. 2006. V. 32. P. 360–367.] https://doi.org/10.1134/S1068162006040066
Костанян И.А., Сторожева З.И., Семенова Н.А., Липкин В.М. // Доклады Академии наук. 2009. Т. 428. С. 565–569. [Kostanyan I.A., Storozheva Z.I., Semenova N.A., Lipkin V.M. // Doklady Biol. Sci. 2009. V. 428. P. 418–422.] https://doi.org/10.1134/S0012496609050081
Золотарев Ю.А., Дадаян А.К., Кост Н.В., Воеводина М.Э., Соколов О.Ю., Козик В.С., Шрам С.И., Азев В.Н., Бочаров Э.В., Богачук А.П., Липкин В.М., Мясоедов Н.Ф. // Биоорг. химия. 2015. Т. 41. С. 644–656. [Zolotarev Yu.A., Dadayan A.K., Kost N.V., Voevodina M.E., Sokolov O.Y., Kozik V.S., Shram S.I., Bocharov E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 578–589.] https://doi.org/10.1134/S1068162015060205
Bogachouk A.P., Storozheva Z.I., Solovjeva O.A., Sherstnev V.V., Zolotarev Yu.A., Azev V.N., Rodionov I.L., Surina E.A., Lipkin V.M. // J. Psychopharmacol. 2016. V. 30. P. 78–92. https://doi.org/10.1177/0269881115616393
Zolotarev Yu.A., Kovalev G.I., Kost N.V., Voevodina M.E., Sokolov O.Y., Dadayan A.K., Kondrakhin E.A., Vasileva E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // J. Psychopharmacol. 2016. V. 30. P. 922–935. https://doi.org/10.1177/0269881116660705
Ковалев Г.И., Фирстова Ю.Ю. // Клиническая фармакология и терапия. 2010. Т. 19. С. 72–73.
Ковалев Г.И., Васильева Е.В., Салимов Р.М. // Журнал высшей нервной деятельности им. И.П. Павлова. 2019. Т. 69. С. 123–130. https://doi.org/10.1134/S0044467719010064
Ковалев Г.И., Кондрахин Е.А., Салимов Р.М., Незнамов Г.Г. // Экспер. и клин. фармакол. 2014. Т. 77. С. 49–55.
Кондрахин Е.А., Салимов Р.М., Ковалев Г.И., Незнамов Г.Г. // Фармакокинетика и фармакодинамика. 2015. № 1. С. 44–51.
Васильева Е.В., Салимов Р.М., Ковалев Г.И. // Экспер. и клин. фармакол. 2012. Т. 75 С. 32–37.
Salimov R.M. // Alcohol. 1999. V. 17. P. 157–162.
Фирстова Ю.Ю., Абаимов Д.А., Капица И.Г., Воронина Т.А., Ковалев Г.И. // Нейрохимия. 2011. Т. 28. С. 130–141.
Ковалев Г.И., Фирстова Ю.Ю., Салимов Р.М., Кондрахин Е.А. // Психиатрия. 2010. Т. 3. С. 23–27.
Васильева Е.В., Салимов Р.М., Ковалев Г.И. // Фармакокинетика и фармакодинамика. 2016. № 2. С. 31–36.
Салимов Р.М. // Журнал высшей нервной деятельности. 1988. Т. 38. С. 569–571.
Национальный стандарт Российской Федерации, ГОСТ Р 53434 – (2009).
Миронов А.Н. Бунятян Н.Д., Васильев А.Н. // Руководство по проведению доклинических исследований лекарственных средств / Под ред. Миронова А.Н. Часть первая. М.: Гриф и К., 2012. 944 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



