Биоорганическая химия, 2021, T. 47, № 2, стр. 250-258
Сравнительное исследование гибридизационных свойств фосфорилгуанидиновых олигонуклеотидов с ДНК и РНК
А. А. Ломзов 1, *, М. С. Купрюшкин 1, Е. С. Дюдеева 1, Д. В. Пышный 1, **
1 ФГБУН “Институт химической биологии и фундаментальной медицины” СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 8, Россия
* E-mail: lozmov@niboch.nsc.ru
** E-mail: pyshnyi@niboch.nsc.ru
Поступила в редакцию 23.09.2020
После доработки 12.10.2020
Принята к публикации 13.10.2020
Аннотация
Проведено исследование структуры и термической стабильности комплексов РНК и ДНК с фосфорилгуанидиновыми олигонуклеотидами (ФГО), содержащими модифицированные фосфатные группы, в которых по атому фосфора введены остатки 1,3-диметилимидазолидин-2-имина. Замещение отрицательно заряженного атома кислорода в структуре межнуклеозидного фосфатного остатка олигодезоксирибонуклеотида электронейтральным остатком тетраалкил-замещенного гуанидина не приводит к значительному изменению конформации ФГО/РНК-дуплекса в сравнении с нативным ДНК/РНК-комплексом. Вторичная структура типична для А-формы двойной спирали гибридных комплексов и отличается от таковой РНК/РНК-дуплекса. Введение модификаций приводит к снижению термостабильности ФГО/РНК-комплексов в стандартных условиях (1.01 М Na+, нейтральные значения рН). Величина дестабилизации слабо зависит от нуклеотидного контекста, в котором находится модификация, и в среднем снижает термостабильность на 1.2°С при модификации одного остатка фосфорной кислоты. Дуплексы полностью замещенных ФГО с ДНК обладают термостабильностью, не зависящей от концентрации катионов в растворе, а в случае ФГО/РНК наблюдается значимое снижение термостабильности (~6°С) при переходе от стандартных условий к деионизованной воде (Milli-Q). Для сравнения, нативные дуплексы при таком изменении буферных условий снижают термостабильность более чем на 40°С. Изменения в термостабильности при введении модификаций обусловлены изменениями в величинах энтальпии и энтропии комплексообразования.
ВВЕДЕНИЕ
Производные и аналоги нуклеиновых кислот активно разрабатывают и используют уже более четырех десятилетий [1–3]. Фосфорилгуанидиновые олигонуклеотиды (ФГО) [4, 5] показали себя как перспективные аналоги нуклеиновых кислот в различных областях применения [6–11]. Их использовали для изучения молекулярно-биологических процессов [6–8], в качестве сенсорных элементов биосенсоров [9], а также потенциальных терапевтических агентов [10, 11]. Широкое применение ФГО основано на способности формировать комплексы с комплементарными последовательностями ДНК или РНК. Эффективность их комплексообразования с ДНК нами была исследована ранее [12, 13]. Было установлено, что термостабильность модифицированных дуплексов зависит от таких факторов, как число модификаций, нуклеотидная последовательность, ионная сила раствора. В случае полностью модифицированной цепи гибридизационные свойства ФГО практически не зависят от ионной силы раствора. Было показано, что не происходит изменения вторичной структуры как олигодезоксирибонуклеотида, так и его комплекса даже при полной модификации всех фосфатных остатков в дуплексе. С использованием методов молекулярного моделирования мы показали, что главным движущим фактором, вызывающим изменения в эффективности комплексообразования ФГО, является изменение сольватации модифицированного фосфатного остатка [13]. Для комплексов ФГО/РНК ранее не было проведено исследований, направленных на изучение влияния ФГ-групп на эффективность формирования дуплексных структур с РНК.
В данной работе методом спектроскопии кругового дихроизма проведена сравнительная характеризация комплексов фосфорилгуанидиновых олигонуклеотидов с РНК. Показано, что структура А-формы двойной спирали не изменяется даже при полной модификации олигодезоксирибонуклеотидов. Установлено эффективное формирование комплексов ФГО с РНК. Методом термической денатурации с оптической регистрацией сигнала показано, что влияние модификации на термическую стабильность дуплексов слабо зависит от нуклеотидной последовательности. Введение модификаций в структуру дуплекса приводит к снижению зависимости его термостабильности от ионной силы раствора. В отличие от полностью модифицированного ФГО-дуплекса с ДНК, для комплексов с РНК наблюдается заметное снижение термостабильности при понижении ионной силы раствора. Изменения в величинах термодинамических параметров имеют как энтропийный, так и энтальпийный вклад.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Модельная система. Проведенные ранее исследования показали зависимость термической стабильности комплексов ФГО с ДНК от количества модификаций и нуклеотидной последовательности, в которую они введены. Поэтому для исследований был выбран набор из одного нативного и 13 модифицированных олигонуклеотидов с одинаковой нуклеотидной последовательностью, содержащих модифицированные фосфатные группы, в которых по атому фосфора введен остаток N,N,N ′,N ′-замещенного гуанидина (1,3-диметилимидазолидин-2-имина, DMI). Рассматривали их взаимодействие с комплементарными последовательностями ДНК и РНК. Нуклеотидные последовательности использованных в работе олигомеров представлены в табл. 1.
Таблица 1.
Нуклеотидные последовательности исследованных олигонуклеотидов и термодинамические параметры формирования комплексов в стандартных условиях (1 М NaCl, 10 мМ какодилат натрия, нейтральные значения рН)
| Код | Последовательность (5' → 3') | n | ΔH°, ккал моль–1 | ΔS°, ккал моль–1 K–1 | $\Delta G_{{37}}^{^\circ },$ ккал моль–1 | Tпл, °C | ΔH°, ккал моль–1 | ΔS°, ккал моль–1 K–1 | $\Delta G_{{37}}^{^\circ },$ ккал моль–1 | Tпл, °C |
|---|---|---|---|---|---|---|---|---|---|---|
| rM | dM | |||||||||
| N | d(GCGCCAAACA) | 0 | –71.7 | –196 | –11.0 | 52.7 | –78.2 | –211 | –12.6 | 58.6 |
| N31 | d(G*CGC*CAA*ACA) | 3 | –74.9 | –205 | –11.5 | 54.4 | –75.9 | –207 | –11.6 | 54.8 |
| N32 | d(G*CGCC*AAAC*A) | 3 | –72.6 | –201 | –10.2 | 49.1 | –74.9 | –203 | –11.9 | 56.2 |
| N4 | d(GC*GC*CA*AA*CA) | 4 | Н/а | Н/а | Н/а | Н/а | –76.0 | –208 | –11.5 | 53.9 |
| N51 | d(G*CG*CC*AA*AC*A) | 5 | –73.5 | –206 | –9.7 | 46.3 | –86.2 | –238 | –12.4 | 55.6 |
| N52 | d(G*C*GCCAA*A*C*A) | 5 | –64.6 | –178 | –9.5 | 46.7 | –85.8 | –236 | –12.5 | 55.9 |
| N53 | d(G*C*G*C*C*AAACA) | 5 | Н/а | Н/а | Н/а | Н/а | –84.5 | –233 | –12.1 | 54.6 |
| N54 | d(GCGCC*A*A*A*C*A) | 5 | –64.5 | –177 | –9.6 | 47.1 | –85.0 | –234 | –12.2 | 55.2 |
| N55 | d(G*C*GCC*AAA*C*A) | 5 | –71.5 | –200 | –9.6 | 46.4 | –72.5 | –201 | –10.1 | 48.3 |
| N56 | d(G*CG*CC*AA*AC*A) | 5 | Н/а | Н/а | Н/а | Н/а | –77.7 | –214 | –11.4 | 53.5 |
| N57 | d(G*C*GCC*A*AAC*A) | 5 | Н/а | Н/а | Н/а | Н/а | –73.6 | –201 | –11.2 | 53.4 |
| N61 | d(G*C*G*CCAA*A*C*A) | 6 | –65.5 | –182 | –9.1 | 44.6 | –77.5 | –214 | –11.2 | 52.5 |
| N62 | d(GC*G*CC*A*AA*C*A) | 6 | Н/а | Н/а | Н/а | Н/а | –75.9 | –209 | –11.1 | 52.5 |
| N9 | d(G*C*G*C*C*A*A*A*C*A) | 9 | –65.0 | –183 | –8.3 | 40.9 | –70.7 | –196 | –10.0 | 48.4 |
| rN | r(GCGCCAAACA) | 0 | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а |
| dM | d(TGTTTGGCGC) | 0 | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а |
| rM | r(UGUUUGGCGC) | 0 | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а | Н/а |
Характеризация вторичной структуры комплексов ФГО с РНК и ДНК. Исследование влияние DMI-модификаций на структуру комплексов ФГО с ДНК (dM) и РНК (rM) методом спектроскопии кругового дихроизма проводили с использованием нативных (N или rN) и полностью модифицированного (N9) олигонуклеотидов. Регистрировали спектры отдельных олигонуклеотидов и их смесей при температурах 15 и 95°С в стандартных условиях (1 М NaCl, 10 мМ какодилат натрия, нейтральные значения рН). КД-спектры смеси олигонуклеотидов при высокой температуре совпадали с суммой спектров отдельных олигонуклеотидов (данные не приведены). Это свидетельствует об отсутствии взаимодействия олигонуклеотидов при 95°С.
При низкой температуре амплитуды полос КД-спектров как смеси олигонуклеотидов, так и отдельных олигомеров существенно увеличиваются (рис. 1). В случае суммы спектров отдельных олигомеров N и N9 с РНК (rM) наблюдается увеличение амплитуды как положительной (максимум ~270 нм), так и отрицательной полосы (минимум ~245 нм) в 1.5–2 раза. Для двух цепей РНК наблюдается более существенное увеличение амплитуды сигнала КД – в 3 раза. Спектры смеси олигонуклеотидов обладают более высокой амплитудой сигнала, нежели сумма спектров олигомеров при низкой температуре. Для комплексов ДНК и ФГО амплитуда положительной полосы в 2.5 раза больше, а для РНК/РНК – на ~1/4 больше. Это свидетельствует об образовании межмолекулярных комплексов. Спектры КД всех комплексов при низкой температуре характерны для А-формы двойной спирали [14, 15]. Наблюдается положительная полоса с максимумом в районе 260 нм, отрицательная полоса существенно меньшей амплитуды в районе 240 нм и отрицательная полоса высокой интенсивности в районе 210 нм. Формирование двойной спирали ДНК/РНК-гибридами, с конформацией, типичной для А-формы, хорошо известно [13, 14]. Спектры РНК-комплексов нативного (rM/N) и модифицированного (rM/N9) олигонуклеотидов близки между собой при 15 и 95°С. Небольшое отличие наблюдается только в области длин волн <250 нм, где свой вклад может вносить ФГ-группировка [12, 13, 16]. Такое совпадение говорит о близости вторичных структур нативных и модифицированных ДНК/РНК-дуплексов. Спектры РНК/РНК характерны для семейства А-форм и отличаются от ДНК/РНК как при низких, так и при высоких значениях температур. В спектрах ДНК/РНК гибридных комплексов rM/N и rM/N9 наблюдается “плечо” в области 270–280 нм, которое в случае РНК/РНК-комплекса rM/rN существенно менее выражено. Это свидетельствует скорее о нуклеотидной природе данных особенностей КД-спектров, а не о существовании смеси А- и B-форм для гибридных комплексов. Для строгого доказательства данного утверждения необходимы дополнительные исследования.
Рис. 1.
Спектры кругового дихроизма смеси олигонуклеотидов (rM/N, rM/N9, rM/rN) и сумма спектров одноцепочечных олигонуклеотидов (rM + N, rM + N9, rM + rN) при 15 и 95°С.

Ранее мы показали, что в случае как одноцепочечных ФГО, так и их комплексов с ДНК значимых изменений В-формы двойной спирали при введении модификации не происходит [12, 13, 16]. Таким образом, при формировании комплексов полностью замещенных ФГО с нуклеиновыми кислотами происходит формирование дуплексов, конформация которых близка к A-форме двойной спирали немодифицированных комплексов.
Гибридизационные свойств ФГО в стандартных условиях. Первичную характеризацию термостабильности комплексов производных нуклеиновых кислот проводили в стандартных условиях (1 М NaCl, буфер с нейтральным значением рН). Это связано с необходимостью экранировать отрицательный заряд остатков фосфорной кислоты нативных олигомеров с помощью катионов. При таких условиях наблюдается максимальная термостабильность межмолекулярных комплексов нуклеиновых кислот. Мы исследовали термостабильность ДНК/РНК- и ФГО/РНК-дуплексов декамеров, несущих различное число модификаций в различных положениях (табл. 1), в стандартных условиях методом термической денатурации с оптической регистрацией сигнала. Значения термодинамических параметров, определенных в соответствии с моделью двух состояний, приведены в табл. 1. Термическая стабильность модифицированных ДНК/РНК- и ДНК/ДНК-дуплексов ниже, чем нативного дуплекса, и зависит от числа модификаций в цепи и их положения. Максимальное снижение термостабильности наблюдается для полностью модифицированного дуплекса и составляет 11.7 и 10.2°С, а в терминах свободной энергии Гиббса (при 37°С, $\Delta G_{{37}}^{^\circ }$) – по 2.6 ккал/моль для ДНК/РНК- и ДНК/ДНК-дуплексов соответственно. В зависимости от нуклеотидного контекста наблюдается незначительная вариация термостабильности. Например, для ФГО/РНК-комплексов, содержащих пять модификаций в различных положениях (олигомеры N51–N57), температура плавления находится в пределах 46.3–47.1°С. Эта разница в 2 раза выше величины экспериментальной ошибки, что свидетельствует о достоверности наблюдаемой зависимости от нуклеотидного состава. В случае ДНК/ДНК-дуплексов вариации в термостабильности несколько выше (48.3–55.9°С). Температура плавления комплексов и свободная энергия Гиббса комплексообразования линейно зависят от числа модификаций для обоих типов дуплексов (рис. 2). В среднем уменьшение термостабильности в расчете на одну модификацию происходит на (–1.2 ± 0.1)°С и (+0.28 ± 0.16) ккал/моль в ДНК/РНК-дуплексах, а также на (–1.0 ± 0.4)°С и (+0.22 ± 0.13) ккал/моль в ДНК/ДНК-аналогах. Ранее определенные величины для полностью замещенных окта-, дека- и додекамеров показывали увеличение $\Delta G_{{37}}^{^\circ }$ на 0.26–0.40 ккал/моль для ФГО/ДНК-дуплексов [13].
Рис. 2.
Зависимость температуры плавления (а) и свободной энергия Гиббса формирования комплексов (б) нативного и ФГ-олигонуклеотидов с ДНК (окружности) и РНК (залитые окружности) от числа модификаций в цепи в стандартных условиях. Концентрация дуплекса 10 мкМ.

В обоих типах комплексов введение модификаций приводит к изменению как энтропии, так и энтальпии гибридизации. При этом незначительно превалирует изменение энтальпийного вклада, что коррелирует с полученными ранее данными для ДНК/ДНК-дуплексов различной длины и GC-состава [13]. Для исследованных дуплексов не удалось выявить достоверной зависимости дестабилизирующего вклада модификации от динуклеотидного шага, в который она введена. Необходим скрининг большего числа различных модифицированных олигомеров с увеличенной представленностью модифицированных динуклеотидов для статистически достоверного определения величин энергетических поправок, связанных с введением ФГ-групп.
Полученные результаты показывают, что введение ФГ-модификаций приводит к снижению термостабильности их дуплексов и незначительно зависит от нуклеотидного контекста, в который помещены модификации. Данный эффект более выражен в случае гибридных ФГО/РНК-, чем ФГО/ДНК-дуплексов: разница в снижении свободной энергии Гиббса от введения каждой модификации в среднем ниже на 25%. Он обусловлен как энтропийным, так и энтальпийным вкладами, с незначительным превалированием последнего.
Влияние ионной силы на гибридизационные свойства ФГО. Зачастую использование модифицированных олигонуклеотидов происходит в буферных условиях, значительно отличающихся от стандартных. Например, в биосенсорах на основе структур “кремний на изоляторе” (КНИ-транзисторы) для детекции РНК было предложено использовать деионизованную (Milli-Q) воду [9]. Изучение работы ферментов проводят в условиях, близких к физиологическим [6–8]. Мы провели сравнительное исследование термостабильности комплексов ФГО с ДНК и РНК при различных буферных условиях и определили величины термодинамических параметров (ΔH°, ΔS°, $\Delta G_{{37}}^{^\circ }$ и Tпл). Анализ величин температур плавления комплексов ФГО с РНК и ДНК показывает, что для каждого из типов условий (вода Milli-Q, 10 мМ, 110 мМ или 1.01 М Na+) наблюдается близкая к линейной зависимость температуры плавления от числа модификаций в цепи (рис. 3). В стандартных условиях термостабильность ФГО-комплексов ниже, чем нативных. При концентрации ионов натрия 110 мМ модификация сахарофосфатного остова приводит к слабой дестабилизации комплексов с РНК, а в случае с ДНК термостабильность практически не зависит от наличия ФГ-групп. В растворах с более низкой ионной силой нейтрализация остова приводит к меньшему отталкиванию взаимодействующих цепей при комплексообразовании и, как следствие, к увеличению термостабильности ДНК- и РНК-дуплексов с ФГО относительно немодифицированных комплексов.
Рис. 3.
Зависимость температуры плавления комплексов нативного и ФГ-олигонуклеотидов с РНК (а) и ДНК (б) от числа модификаций в цепи при различной концентрации ионов натрия. Концентрация дуплекса 10 мкМ.
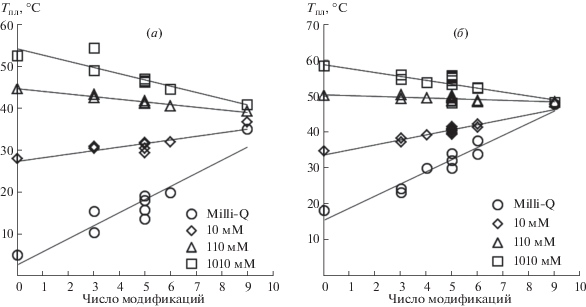
Термостабильность нативных РНК/ДНК- и ДНК/ДНК-дуплексов сильно снижается при переходе от стандартных условий к деионизованной воде, и падение температур плавления составляет 47.1 и 40.1°С соответственно (рис. 4). Для полностью модифицированной цепи в комплексе с ДНК (dM/N9) такое изменение несущественно и составляет всего 0.8°С. В противоположность этому олигомер N9 с РНК имеет значимую зависимость от ионной силы раствора: термостабильность комплекса с РНК (rM/N9) понижается на 5.8°С при переходе от стандартных условий (1.01 М Na+) к деионизованной воде. Общий анализ показывает, что в случае частично или полностью модифицированной цепи температура плавления ФГО/ДНК-комплекса близка к таковой при 110 мМ Na+ в растворе (рис. 3 и пересечение графиков на рис. 4). Комплексы ФГО/РНК также имеют подобную точку. Ее можно определить путем экстраполяции кривых зависимости термостабильности от концентрации катионов на рис. 4. В этом случае точка пересечения зависимостей для нативного и модифицированного дуплексов окажется в районе 50 мМ Na+.
Рис. 4.
Зависимость температуры плавления комплексов от концентрации ионов натрия в растворе для комплексов dM/N (синие квадраты), dM/N9 (залитые синие квадраты), rM/N (красные окружности) и rM/N9 (залитые красные окружности).

Анализ величин энтальпии и энтропии комплексообразования показывает, что при 0.11 и 1.01 М Na+ в растворе преобладает изменение первой из данных компонент при введении модификаций в дуплекс. При более низкой ионной силе раствора происходит снижение термостабильности нативных комплексов, главным образом за счет увеличения энтропийной составляющей. В совокупности с уменьшенной или отсутствующей зависимостью термостабильности ФГО-содержащих комплексов от ионной силы раствора, это приводит к тому, что энтропийный вклад оказывается доминирующим. Вместе с тем наблюдаются компенсаторные эффекты обоих типов вкладов – линейная зависимость величин изменения термодинамических параметров гибридизации при введении модификации при каждой ионной силе раствора (рис. 5) [17, 18]. Несколько больший по амплитуде энтальпийный эффект наблюдается для ФГО/ДНК-дуплексов (12%), чем для ФГО/РНК-дуплексов (4%).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез олигонуклеотидов. Синтез олигонуклеотидов проводили на автоматическом синтезаторе ASM800 (Биосcет, Россия) согласно стандартному протоколу 2-цианэтильного фосфитамидного метода, используя коммерческие дезоксирибонуклеозидные мономеры и соответствующие пористые стекла (Glen Research, США). Олигорибонуклеотиды (rM и rN) были любезно предоставлены М.И. Мещаниновой (лаборатория химии РНК, Институт химической биологии и фундаментальной медицины СО РАН). Олигонуклеотиды, содержащие ФГ-звенья, синтезированы по ранее опубликованному протоколу [4, 5] и любезно предоставлены ООО “Нооген” (Россия).
Хроматография. Выделение олигонуклеотидов осуществляли методом офВЭЖХ на хроматографе Agilent 1200 series (Agilent, США), как описано ранее [12]. Для элюции использовали колонку (4.6 × 150 мм) с сорбентом Eclipse XDB-C18 (5 мкм) (Agilent, США) и линейный градиент концентрации ацетонитрила (0–90%) в 0.02 М водном растворе триэтиламмоний ацетата за 30 мин, скорость потока 1.5 мл/мин. Детекцию интенсивности оптического поглощения осуществляли на длинах волн 280 и 600 нм (в качестве базовой линии).
Измерение концентрации олигонуклеотидов. Концентрацию олигонуклеотидов определяли спектрофотометрическим методом, измеряя оптическое поглощение водных растворов на спектрофотометре UV-2100 (Shimadzu, Япония) в диапазоне длин волн 200–400 нм при комнатной температуре. Коэффициент молярного поглощения нативных и модифицированных олигонуклеотидов определяли, используя значения коэффициентов молярного поглощения моно- и динуклеотидов, входящих в состав последовательности [19]. Коэффициенты молярного поглощения на длине волны 260 нм для ДНК и ФГО считали равными [13].
Спектроскопия кругового дихроизма. КД-спектры регистрировали, используя спектрополяриметр J-600 (Jasco, Япония) в диапазоне длин волн от 200–330 нм с разрешением 0.2 нм, шириной щели 1 нм, временем интегрирования 1 с, скоростью сканирования 50 нм/мин. Пять повторных измерений были усреднены. Для измерений использовали растворы олигонуклеотидов и их комплексов в концентрации 10 мкМ в буфере, содержавшем 10 мМ какодилат натрия (CH3)2AsO2Na (сокр. CacNa), 1 М NaCl (pH 7.2). Образцы помещали в кварцевую терморегулируемую кювету с длиной оптического пути 1 см. Температуру образцов регулировали, прокачивая через кювету носитель жидкостного термостата-циркулятора LKB 2219 Multiterm II Water Bath (LKB, Швеция).
Термическая денатурация комплексов нуклеиновых кислот. Термическую денатурацию олигонуклеотидных комплексов проводили, используя спектрофотометр Cary 300 Bio (Varian, Австралия), оснащенный терморегулируемым шестисекционным кюветодержателем. Термическую стабильность комплексов определяли в водных растворах одного из следующих составов: 1) деионизованная вода (Milli-Q, 18 МОм); 2) 10 мМ CacNa, pH 7.2; 3) 10 мМ CacNa, 100 мМ NaCl, pH 7.2; 4) 10 мМ CacNa, 1 М NaCl, pH 7.2.
Олигонуклеотиды смешивали в эквимолярном количестве, помещали в буферный раствор (концентрация дуплекса 10 мкМ), после чего осуществляли нагрев и охлаждение в диапазоне 5–95°С со скоростью 0.5°С/мин, регистрируя изменение оптического поглощения растворов на длинах волн 260, 270 и 300 нм с шагом 0.1°С. Оптическое поглощение на длине волны 300 нм использовали в качестве контрольного и вычитали данную “базовую линию” [20]. Термодинамические параметры – изменения энтропии (ΔS°), энтальпии (ΔH°) и свободной энергии Гиббса (при 37°С, $\Delta G_{{37}}^{^\circ }$) определяли в соответствии с моделью двух состояний [21–23], используя методы нелинейной аппроксимации теоретической кривой к экспериментальным значениям. Температуру плавления (Tпл) определяли как температуру, при которой доли одно- и двухцепочечного состояния равны между собой, и рассчитывали, используя значения термодинамических параметров. Полученные данные на разных длинах волн и при нагреве/ охлаждении усредняли. Величины ошибки определения ΔH° и ΔS° не превышали 10%, $\Delta G_{{37}}^{^\circ }$ – 7%, Тпл – 0.2°C.
ЗАКЛЮЧЕНИЕ
В данной работе впервые проведены изучение структуры и детальный термодинамический анализ гибридизационных свойств фосфорилгуанидиновых олигонуклеотидов с РНК. Показано, что замещение отрицательно заряженного атома кислорода в структуре межнуклеозидного фосфата электронейтральным остатком тетраалкил-замещенного гуанидина – 1,3-диметилимидазолидин-2-имина (DMI) – не приводит к изменению конформации ФГО/ДНК-дуплекса в сравнении с нативным гибридным ДНК/РНК-аналогом. Вторичная структура типична для А-формы двойной спирали гибридных комплексов и отличается от РНК/РНК-дуплекса.
Введение модификаций приводит к снижению термостабильности ФГО/РНК-комплексов в стандартных условиях (1.01 М Na+, нейтральные значения рН). Величина дестабилизации слабо зависит от нуклеотидного контекста, в котором находится модификация, и в среднем снижает термостабильность на 1.2°С на один модифицированный фосфатный остаток. Аналогичная величина для ДНК составляет 1.0°С. ФГ-олигомеры обладают менее выраженной зависимостью гибридизационных свойств от ионной силы раствора, чем их ДНК-предшественники. Дуплексы полностью замещенных олигомеров с ДНК обладают термостабильностью, не зависящей от наличия и концентрации катионов в растворе. В случае ФГО/ РНК-комплексов наблюдается значимое снижение термостабильности (~6°С) при переходе от стандартных условий к деионизованной воде (Milli-Q). Для сравнения, нативные дуплексы при таком изменении буферных условий снижают термостабильность более чем на 40°С. Изменения в термостабильности ФГО-дуплексов имеют как энтальпийный, так и энтропийный вклады. Анализ показывает, что изменения энтальпии гибридизации несколько больше по амплитуде, чем энтропии, несмотря на то, что значимых изменений в структуре не происходит. Наблюдается общая тенденция незначительного изменения термостабильности комплексов ФГО с нуклеиновыми кислотами при увеличении числа модификаций в цепи в буферных условиях, близких к физиологическим.
Полученные результаты показывают перспективность использования частично и полностью модифицированных фосфорилгуанидиновых олигонуклеотидов в различных приложениях, в том числе в тех, где существует необходимость модулирования термостабильности комплексов без изменения заданной нуклеотидной последовательности.
Список литературы
Chernikov I.V., Vlassov V.V., Chernolovskaya E.L. // Front. Pharmacol. 2019. V. 10. P. 444. https://doi.org/10.3389/fphar.2019.00444
Shen W., De Hoyos C.L., Migawa M.T., Vickers T.A., Sun H., Low A., Bell M. // Nat. Biotechnol. 2019. V. 37. P. 640–650. https://doi.org/10.1038/s41587-019-0106-2
Benizri S., Gissot A., Martin A., Vialet B., Grinstaff M.W., Barthélémy P. // Bioconjugate Chem. 2019. V. 30. P. 366–383. https://doi.org/10.1021/acs.bioconjchem.8b00761
Купрюшкин М.С., Пышный Д.В., Стеценко Д.А. // Acta Naturae. 2014. V. 6. P. 123–125.
Stetsenko D.A., Kupryushkin M.S., Pyshnyi D.V. // Patent WO2016028187A1, 2016.
Kuznetsov N.A., Kupryushkin M.S., Abramova T.V., Kuznetsova A.A., Miroshnikova A.D., Stetsenko D.A., Pyshnyi D.V., Fedorova O.S. // Mol. BioSyst. 2016. V. 12. P. 67–75. https://doi.org/10.1039/C5MB00692A
Lebedeva N.A., Anarbaev R.O., Kupryushkin M.S., Rechkunova N.I., Pyshnyi D.V., Stetsenko D.A., Lavrik O.I. // Bioconjug. Chem. 2015. V. 26. P. 2046–2053. https://doi.org/10.1021/acs.bioconjchem.5b00451
Garafutdinov R.R., Sakhabutdinova A.R., Kupryushkin M.S., Pyshnyi D.V. // Biochimie. 2020. V. 168. P. 259–267. https://doi.org/10.1016/j.biochi.2019.11.013
Dmitrienko E., Naumova O., Fomin B., Kupryushkin M., Volkova A., Amirkhanov N., Semenov D., Pyshnaya I., Pyshnyi D. // Nanomedicine. 2016. V. 11. P. 2073–2082. https://doi.org/10.2217/nnm-2016-0071
Epanchintseva A., Dolodoev A., Grigor’eva A., Chelobanov B., Pyshnyi D., Ryabchikova E., Pyshnaya I. // Nanotechnology. 2018. V. 29. P. 355 601. https://doi.org/10.1088/1361-6528/aac933
Markov A.V., Kupryushkin M.S., Goncharova E.P., Amirkhanov R.N., Vasilyeva S.V., Pyshnyi D.V., Zenkova M.A., Logashenko E.B. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 774–782.
Dyudeeva E.S., Kupryushkin M.S., Lomzov A.A., Pyshnaya I.A., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 709–718. https://doi.org/10.1134/S1068162019060153
Lomzov A.A., Golyshev V.M., Dyudeeva E.S., Kupryushkin M.S., Pyshnyi V.P. // Journal of Biomolecular Structure and Dynamics. 2019. V. 37. P. 83–84. https://doi.org/10.1080/07391102.2019.1604468
Ivanov V.I., Minchenkova L.E., Schyolkina A.K., Poletayev A.I. // Biopolymers. 1973. V. 12. P. 89–110. https://doi.org/10.1002/bip.1973.360120109
Kypr J., Kejnovská I., Renčiuk D., Vorlíčková M. // Nucl. Acids Res. 2009. V. 37. P. 1713–1725. https://doi.org/10.1093/nar/gkp026
Lomzov A.A., Kupryushkin M.S., Shernyukov A.V., Nekrasov M.D., Dovydenko I.S., Stetsenko D.A., Pyshnyi D.V. // Biochem. Biophys. Res. Commun. 2019. V. 513. P. 807–811. https://doi.org/10.1016/j.bbrc.2019.04.024
Searle M.S., Williams D.H. // Nucl. Acids Res. 1993. V. 21. P. 2051–2056. https://doi.org/10.1093/nar/21.9.2051
Vargas-Lara F., Starr F.W., Douglas J.F. // Soft Matter. 2017. V. 13. P. 8309–8330. https://doi.org/10.1039/C7SM01220A
Tataurov A.V., You Y., Owczarzy R. // Biophys. Chem. 2008. V. 133. P. 66–70. https://doi.org/10.1016/j.bpc.2007.12.004
Lokhov S.G., Pyshnyi D.V. // FEBS Lett. 1998. V. 420. P. 134–138. https://doi.org/10.1016/S0014-5793(97)01502-0
Marky L.A., Breslauer K.J. // Biopolymers. 1987. V. 26. P. 1601–1620. https://doi.org/0.1002/bip.360260911
Schroeder S.J., Turner D.H. // Methods Enzymol. 2009. V. 468. P. 371–387. https://doi.org/10.1016/S0076-6879(09)68017-4
Lomzov A.A., Pyshnyi D.V. // Biophysics (Oxf.). 2012. V. 57. P. 19–34. https://doi.org/10.1134/S0006350912010137
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



