Биоорганическая химия, 2021, T. 47, № 2, стр. 218-227
Новые двухкомпонентные пиренильные зонды на основе олиго(2'-О-метилрибонуклеотидов) для детекции микроРНК
О. А. Семиколенова 1, 2, В. М. Голышев 1, Б. Х. Ким 3, А. Г. Веньяминова 1, Д. С. Новопашина 1, 2, *
1 ФГБУН “Институт химической биологии и фундаментальной медицины” СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 8, Россия
2 Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
3 Пхоханский университет науки и технологии
77 Cheongam-ro, Hyogok-dong, Nam-gu, Pohang-si, Gyeongsangbuk-do, Republic of Korea
* E-mail: danov@niboch.nsc.ru
Поступила в редакцию 14.09.2020
После доработки 26.09.2020
Принята к публикации 29.09.2020
Аннотация
Созданы новые двухкомпонентные флуоресцентные зонды для детекции микроРНК на основе олиго(2'-O-метилрибонуклеотидов), формирующие в присутствии РНК-мишени 3WJ-структуру из трех олигонуклеотидных дуплексов (3WJ – three-way junction) со вставкой PyA-модифицированного аденинового кластера, представляющего собой пентааденозиновый фрагмент, содержащий в центре 8-(1-этинилпирен)-дезоксирибоаденозин. В качестве РНК-мишени выбрана микроРНК let-7a-3p, уровень которой в клетке коррелирует с возникновением и развитием онкологических заболеваний. Проведено сравнительное исследование термической стабильности и флуоресценции двухкомпонентных зондов на основе олиго(2'-O-метилрибонуклеотидов), в составе которых имеется дезоксирибоаденозиновый (dAdAPyAdAdA) или (2'-O-метилрибо)аденозиновый фрагмент (AmAm PyAAmAm), содержащий в центре 8-(1-этинилпирен)-дезоксирибоаденозин, и аналогичного олигодезоксирибонуклеотидного зонда. Обнаруженное изменение спектров флуоресценции созданных зондов при гибридизации с РНК-мишенью потенциально может быть использовано при разработке систем детекции микроРНК.
ВВЕДЕНИЕ
Детекция и визуализация биомолекул in vitro и in vivo, в частности клеточных и внеклеточных РНК, необходимы для решения целого ряда задач молекулярной биологии и биомедицины, биохимии и клеточной биологии. Актуальной проблемой является повышение чувствительности систем, используемых для детекции и визуализации биомолекул, а именно увеличение соотношения сигнал/шум, а также повышение предела обнаружения [1, 2]. Флуоресцентные зонды представляют собой перспективную основу для создания высокочувствительных систем детекции биомолекул. Для сиквенс-специфической детекции нуклеиновых кислот используют флуоресцентные гибридизационные зонды [3–5]. Интересным вариантом зондов являются тандемные флуоресцентные зонды, сигнал от которых возникает только при одновременной гибридизации компонентов зонда на НК-мишени за счет сближения пары флуорофоров. Флуоресцентные олигонуклеотидные зонды, содержащие остатки пирена в качестве флуорофора, являются перспективными инструментами для детекции нуклеиновых кислот благодаря высокой чувствительности флуоресценции пирена к окружению [6–9].
Одними из наиболее перспективных инструментов для детекции РНК являются флуоресцентные зонды на основе олиго(2'-O-метилрибонуклеотидов). Олиго(2'-O-метилрибонуклеотиды) обладают определенными преимуществами перед стандартно используемыми для создания олигонуклеотидных зондов олигодезоксирибонуклеотидами, а именно большей термической стабильностью дуплексов с комплементарной РНК, способностью разворачивать структурированную РНК, а также большей устойчивостью к действию нуклеаз [10, 11].
Относительно недавно был предложен новый вариант эксимерных зондов для детекции микроРНК, представляющий собой двухкомпонентный олигодезоксирибонуклеотидный зонд, способный образовывать в присутствии РНК-мишени 3WJ-структуру (3WJ – three-way junction), содержащую в одном из стеблей так называемые PyA-модифицированные адениновые кластеры в обеих цепях [12].
В данной работе мы провели дизайн, синтез и изучение свойств новых двухкомпонентных зондов на основе олиго(2'-O-метилрибонуклеотидов), формирующих в присутствии РНК-мишени 3WJ-структуру. Каждый из компонентов зонда содержит PyA-модифицированный адениновый кластер, представляющий собой пентааденозиновый фрагмент, содержащий в центре 8-(1-этинилпирен)-дезоксирибоаденозин.
В качестве РНК-мишени нами была выбрана микроРНК let-7a-3p (miR let-7a-3p). Уровень этой микроРНК в клетке коррелирует с возникновением и развитием онкологических заболеваний, в связи с этим она рассматривается как диагностический биомаркер онкологических заболеваний и является объектом исследований при создании новых усовершенствованных систем детекции.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее были предложены и исследованы различные варианты пиренильных флуоресцентных зондов на основе олиго(2'-O-метилрибонуклеотидов) для детекции РНК, в том числе биспиренильные линейные зонды [13–16], биспиренильные “молекулярные маяки” [17, 18] и тандемные биспиренильные зонды [19, 20].
В данной работе для детекции miR let-7a-3p нами были сконструированы двухкомпонентные зонды, формирующие в присутствии РНК-мишени 3WJ-структуру из трех олигонуклеотидных дуплексов (рис. 1). Каждый из компонентов зонда содержит PyA-модифицированный адениновый кластер, представляющий собой (2'-О-метил-рибо)аденозиновый фрагмент (AmAm PyAAmAm) (Lmf + Rmf) или дезоксирибоаденозиновый фрагмент (dAdAPyAdAdA) (Lm + Rm), содержащий в центре 8-(1-этинилпирен)-дезоксирибоаденозин.
Рис. 1.
(a) – Структуры 3WJ-комплексов, образующихся при гибридизации двухкомпонентных олиго(2'-О-метилрибонуклеотидных) зондов (Lmf + Rmf и Lm + Rm) с РНК-мишенью. PyA-модифицированный адениновый кластер – (2'‑О-метилрибо)аденозиновый фрагмент (AmAm PyAAmAm) (Lmf + Rmf) или дезоксирибоаденозиновый фрагмент (dAdAPyAdAdA) (Lm + Rm), содержащий в центре 8-(1-этинилпирен)-дезоксирибоаденозин. Nm – 2'-О-метилрибонуклеозид, dA – дезоксирибоаденозин. Обозначения компонентов зондов см. в табл. 1; (б) – структура 8-(1-этинилпирен)-дезоксирибоаденозина (PyA).

Для синтеза компонентов олигонуклеотидных зондов использовали специально полученный фосфитамид аденозина, содержащего пирен в 8-м положении гетероциклического основания. Для его введения автоматический твердофазный фосфитамидный синтез прерывали и проводили цикл присоединения модифицированного фосфит-амидного звена в “ручном” варианте с использованием 5-этилтиотетразола в качестве активатора. Время конденсации увеличивали до 30 мин. Проводили остальные стадии цикла в “ручном” варианте и продолжали синтез в автоматическом режиме.
По окончании синтеза удаляли 5'-О-диметокситритильную группу и проводили деблокирование олиго(2'-О-метилрибонуклеотидов), содержащих PyA, в стандартных условиях. Модифицированные олигонуклеотиды выделяли методом препаративного гель-электрофореза. Строение конъюгатов подтверждали методом MALDI-TOF-масс-спектрометрии. Таким образом были получены PyA-содержащие компоненты олиго(2'-О-метилрибонуклеотидных) зондов (Lmf + Rmf) и (Lm + Rm), отличающиеся природой аденозинов в составе кластера, а также их олигодезоксирибонуклеотидные аналоги (L + R) (табл. 1). Для исследования влияния PyA на время удерживания при офВЭЖХ и термическую стабильность комплексов с РНК-мишенью были также синтезированы контрольные олиго(2'-О-метилрибонуклеотиды) (Lmc и Rmc), не содержащие PyA.
Таблица 1.
Последовательности и характеристики компонентов зондов, содержащих PyA, и контрольных олиго(2'-О-метилрибонуклеотидов)
| Шифр | Последовательность (5′ → 3′) | Время удерживания*, мин | Молекулярная масса | |
|---|---|---|---|---|
| рассчитанная | полученная** | |||
| Lmf | CmAmUmCmCmAmAmPyAAmAmGmAmUmUmGmUmAmUmAmGm | 10.2 | 6858.7 | 6865.9 |
| Rmf | GmAmAmAmGmAmCmAmGmUmAmAmAmPyAAmAmGmGmAmUmGm | 10.1 | 7367.0 | 7375.7 |
| Lm | CmAmUmCmCmdAdAPyAdAdAGmAmUmUmGmUmAmUmAmGm | 12.4 | 6738.6 | 6746.1 |
| Rm | GmAmAmAmGmAmCmAmGmUmAmdAdAPyAdAdAGmGmAmUmGm | 12.7 | 7247.0 | 7255.7 |
| L | d(CATCCAAPyAAAGATTGTATAG) | 11.0 | 6334.3 | 6357.3*** |
| R | d(GAAAGACAGTAAAPyAAAGGATG) | 10.7 | 6770.6 | 6794.3*** |
| Lmc | CmAmUmCmCmAmAmAmAmAmGmAmUmUmGmUmAmUmAmGm | 10.5 | 6663.4 | 6668.6 |
| Rmc | GmAmAmAmGmAmCmAmGmUmAmAmAmAmAmAmGmGmAmUmGm | 10.4 | 7171.8 | 7178.6 |
* По данным офВЭЖХ, условия см. в “Эксперим. части”. ** По данным MALDI-TOF-масс-спектрометрии. *** Содержит дополнительно ион Na+. Nm – 2′-O-метилрибонуклеозид; d – олигодезоксирибонуклеотид; dA – дезоксирибоаденозин в составе олиго(2′-O-метилрибонуклеотида); PyA – 8-(1-этинилпирен)-дезоксирибоаденозин.
Гомогенность выделенных PyA-модифицированных олигонуклеотидов подтверждали методами офВЭЖХ (рис. 2) и электрофореза в денатурирующем 15%-ном ПААГ.
Рис. 2.
Нормализированные профили аналитической офВЭЖХ при анализе PyA-содержащих и контрольных (не содержащих PyA) олигонуклеотидов. (а) – L, Lm, Lmc, Lmf; (б) – R, Rm, Rmc, Rmf. Последовательности олигонуклеотидов см. в табл. 1. Условия: градиент концентрации 0–50% (20 мин) и 50% (5 мин) CH3CN в буфере, содержавшем 0.02 М TEAAc, pH 7.0, скорость потока – 100 мкл/мин.

Введение модифицированного PyA в полностью 2'-O-метилированные олигорибонуклеотиды приводило к незначительному (0.3 мин) уменьшению времени удерживания при офВЭЖХ (Lmf и Rmf). Время удерживания модифицированных олигодезоксирибонуклеотидов L и R, содержащих PyA, было незначительно больше (0.6–0.8 мин) времени удерживания их 2'-О-метилированных аналогов Lmf и Rmf. Дополнительная замена в Lmf и Rmf двух нуклеотидов с 3'- и 5'-стороны от PyA на дезоксирибоаденозины (Lm и Rm) приводила к увеличению времени удерживания (1.8–2.6 мин) при офВЭЖХ. Таким образом, химерные олиго(2'-О-метилрибонуклеотиды) (Lm и Rm), содержащие пентадезоксирибоаденозиновый фрагмент, являются наиболее гидрофобными.
В электронных спектрах поглощения всех конъюгатов, содержащих PyA, наблюдали максимум поглощения на длине волны 260 нм и два пика поглощения в области 360–430 нм. На рис. 3 приведены примеры спектров поглощения PyA-содержащих олигонуклеотидов. Два пика с максимумами на 380 и 420 нм соответствуют поглощению этинилпирена, введенного в аденин [12].
Рис. 3.
Спектры поглощения водных растворов PyA-модифицированных олигонуклеотидов: (а) – олигодезоксирибонуклеотидов (L и R), (б) – олиго-(2'-O-метилрибонуклеотидов) (Lm и Rm). Концентрация олигонуклеотидов 10 мкМ, температура 25°С.

В спектрах флуоресценции компонентов олигодезоксирибонуклеотидных (L и R) и олиго(2'-O-метилрибонуклеотидных) (Lmf, Rmf, Lm и Rm) зондов наблюдали флуоресценцию в диапазоне 440–460 нм, характерном для флуоресценции этинилпирена (рис. 4а–4в).
Рис. 4.
Нормализованные спектры флуоресценции зондов: (a) – олигодезоксирибонуклеотидных (L и R); (б) – олиго(2'-O-метилрибонуклеотидных) (Lm и Rm); (в) – олиго(2'-O-метилрибонуклеотидных) (Lmf и Rmf). Условия: 2 мкМ олигонуклеотиды; длина оптического пути 4 мм; 0.1 М NaCl, 50 мМ Tрис-HCl буфер (pH 7.5), 10 мМ MgCl2; длина волны возбуждения 385 нм; температура 25°С.
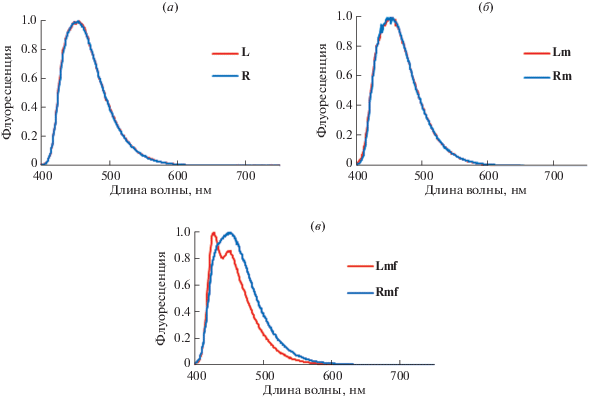
Во флуоресцентном спектре олигонуклеотида Lmf – компонента полностью 2'-O-метилированного зонда – регистрировали дополнительный пик на меньшей длине волны (рис. 4в). Проанализировав вероятность образования внутри- и межмолекулярных комплексов для этой последовательности, мы выяснили, что этот олигонуклеотид способен образовывать самокомплементарные комплексы, в которых остатки PyA в составе разных цепей будут расположены на различном расстоянии друг от друга в составе комплекса, что и может быть причиной возникновения второго пика флуоресценции. Аналогичный эффект наблюдали в работе Cummins et al. [10] при исследовании различных типов комплексов с PyA-модифицированными адениновыми кластерами.
Ранее было продемонстрировано, что двухкомпонентные олигодезоксирибонуклеотидные зонды, формирующие 3WJ-комплексы с РНК-мишенью и содержащие PyA-модифицированные адениновые кластеры в обеих цепях, обладают уникальными флуоресцентными свойствами [12]. При гибридизации с РНК пирен-модифицированные аденины (PyA) в составе РуА-модифицированных адениновых кластеров взаимодействуют между собой с образованием структуры с отличными от исходных олигонуклеотидных компонентов флуоресцентными свойствами, что позволяет проводить детекцию РНК-мишеней.
Нами были получены спектры флуоресценции двухкомпонентных зондов и их комплексов с РНК-мишенью (рис. 5). Анализируя спектры флуоресценции двухкомпонентных зондов в отсутствие РНК-мишени и при добавлении РНК-мишени, можно заключить, что в случае олигодезоксирибонуклеотидного зонда (L + R) в присутствии РНК-мишени в спектрах увеличивается интенсивность излучения флуоресценции в более длинноволновой области относительно флуоресценции исходных компонентов зонда (рис. 5а). Аналогичные изменения спектра наблюдали и в работах [12, 21, 22]. В случае зонда (Lm + Rm) в спектрах флуоресценции с РНК-мишенью таких изменения не регистрировали, но при этом максимум основного пика несколько сдвигался в более длинноволновую область (с 453 до 460 нм) (рис. 5б). В случае зонда (Lmf + Rmf) в спектрах флуоресценции как в отсутствие, так и в присутствии РНК-мишени максимум флуоресценции регистрировали в еще более длинноволновой области при 495 нм, при этом в спектрах флуоресценции зонда в присутствии РНК-мишени регистрировали относительное увеличение интенсивности флуоресценции в области 420–440 нм (рис. 5в). Появление отличий в спектрах флуоресценции при гибридизации двухкомпонентных зондов с РНК-мишенью позволяет говорить о потенциальной возможности разработки систем детекции РНК с использованием этих зондов.
Рис. 5.
Нормализованные спектры флуоресценции двухкомпонентных зондов и их комплексов с РНК-мишенью. (а) – Олигодезоксирибонуклеотидный зонд (L + R) и его комплекс с РНК-мишенью (L + R + T); (б) – олиго(2'-O-метилрибонуклеотидный) зонд (Lm + Rm) и его комплекс с РНК-мишенью (Lm + Rm + T); (в) – олиго(2'-O-метилрибонуклеотидный) зонд (Lmf + Rmf) и его комплекс с РНК-мишенью (Lmf + Rmf + Т). Т – РНК-мишень miR let-7a-3p. Условия: 2 мкМ олигонуклеотиды и РНК-мишень; длина оптического пути 4 мм; 50 мМ Tрис-HCl буфер (pH 7.5), 10 мМ MgCl2, 0.1 M NaCl; длина волны возбуждения 385 нм; температура 25°С.

Методом термической денатурации была исследована стабильность комплексов двухкомпонентных зондов, содержащих PyA-модифицированный адениновый кластер, с РНК-мишенью. Для зондов в отсутствие мишени не наблюдали значительных изменений в оптической плотности растворов при изменении температуры, что, вероятно, свидетельствует об отсутствии взаимодействия между компонентами зонда (рис. 6).
Рис. 6.
Дифференциальные кривые термической денатурации компонентов тандемных зондов (L + R, Lm + Rm) и их комплексов с РНК-мишенью (L + R + T, Lmf + Rmf + T). Условия термической денатурации: буфер (25 мМ Tрис-НСl (pH 7.2), 50 мМ NaCl, 5 мМ MgCl2), концентрации олигонуклеотидных компонентов 1 мкМ. Т – РНК-мишень miR let-7a-3p.

Температура плавления комплекса зонда, состоящего из олиго(2'-O-метилрибонуклеотидов) (Lm + Rm), с РНК-мишенью составила 57.3°С и была выше температуры аналогичного комплекса зонда, состоящего из олигодезоксирибонуклеотидов (L + R), с РНК-мишенью, которая составила 39.1°С, что согласуется с литературными данными [23]. Видимо, изменение максимума флуоресценции зонда (Lm + Rm) при гибридизации с РНК, по сравнению с зондом (L + R) (рис. 5а, 5б), может быть частично объяснено более высокой стабильностью комплекса. Другим объяснением отличий в спектрах флуоресценции может быть другая конформация химерного 2'-O-метил-РНК/ДНК-дуплекса (скорее всего, промежуточная форма между A- и В-формами двойной спирали), содержащего PyA-модифицированный адениновый кластер, по сравнению с аналогичным ДНК-дуплексом (близкая к B-форме двойной спирали).
Таким образом, нами продемонстрирована способность двухкомпонентных зондов олиго(2'-O-метилрибонуклеотидов), содержащих РyA-модифицированный адениновый кластер, формировать более стабильные 3WJ-комплексы с РНК-мишенью, чем аналогичные олигодезоксирибонуклеотидные зонды.
Предложенные в данной работе новые двухкомпонентные флуоресцентные зонды на основе олиго(2'-О-метилрибонуклеотидов), формирующие с РНК-мишенью 3WJ-структуру, изменяют свои флуоресцентные свойства при формировании комплекса с РНК-мишенью и в перспективе могут быть использованы в качестве зондов для детекции РНК-мишеней, в том числе микроРНК. Требуются дополнительные исследования влияния структуры зондов, а именно положения PyA в составе кластера и протяженности самого кластера, на их свойства для улучшения специфичности флуоресцентного сигнала и увеличения чувствительности к РНК-мишени.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. В работе были использованы следующие реактивы: перхлорат натрия, дисукцинимидилкарботат, пиренметиламин, N-метилимидазол (Acros Organics, США); 4,4'-диметокситритилхлорид (Alfa Aesar, США); 5‑этилтио-1H-тетразол (Biosset, Россия); 2-цианоэтил-N,N,N',N'-тетраизопропилфосфитамид, полимеры с присоединенным первым нуклеозидным звеном – 5'-O-(4,4'-диметокситритил)-2'-O-третбутилдиметилсилил-N2-ацетилгуанозин-CPG, 5'-O-(4,4'-диметокситритил)-2'-O-третбутилдиметилсилил-уридин-CPG, фосфитамиды N-ацетилзащищенных 5'-O-(4,4'-диметокситритил)-2'-O-метилрибонуклеозидов, N-ацетилзащищенных 5'-O-(4,4'-диметокситритил)-2'-O-третбутилдиметилсилил-рибонуклеозидов, N-ацетилзащищенных 5'‑O-(4,4'-диметокситритил)-2'-дезоксирибонуклеотидов (ChemGenes, США); краситель “Stains-all”, персульфат аммония, дихлоруксусная кислота, акриламид, N,N'-метиленбисакриламид, 2,6‑лутидин, Трис-гидроксиметиламинометан (Fluka, Швейцария); мочевина, 40%-ный водный раствор метиламина (Merck, Германия); молекулярные сита “Trap-PacTM Molecular Sieve Bag” 3 Å (Millipore, США); пиридин, ацетон, тетрагидрофуран, 15%-ный раствор уксусного ангидрида в тетрагидрофуране (PanReac, Испания); ксиленцианол FF, бромфеноловый синий, N,N,N ',N '-этилендиаминтетрауксусная кислота (Serva, Германия); триэтиламин, триэтиламинтригидрофторид, гексаметилендиамин, этокситриметилсилан (Sigma-Aldrich, США); хлористый метилен, йод кристаллический, ацетонитрил (Криохром, Россия).
N6-бензоил-5'-O-[бис(4-метоксифенил)фенилметил]-8-(1-этинилпиренил)-2'-деоксиаденозин) был синтезирован и выделен в лаборатории профессора Б.Х. Кима (B.H. Kim, Пхоханский университет науки и технологии, Пхохан, Южная Корея) по методике Hwang et al. [24].
Олигонуклеотиды были получены на автоматическом ДНК/РНК-синтезаторе ASM-800 (Биоссет, Россия) твердофазным фосфитамидным методом в условиях, оптимизированных нами для этого прибора. Все водные растворы были приготовлены с использованием деионизованной воды, полученной с помощью прибора Millipore Simplicity System (Millipore, США).
Строение полученных олигонуклеотидов и конъюгатов подтверждали методом MALDI-TOF-масс-спектрометрии с использованием масс-спектрометра REFLEX III (Bruker Daltonics, Германия) (Центр коллективного пользования Центр масс-спектрометрического анализа Института химической биологии и фундаментальной медицины СО РАН).
Для анализа возможности образования внутри- и межмолекулярных комплексов олигонуклеотидов использовали програмное обеспечение OligoAnalyzer 3.1. (Integrated DNA Technologies, США).
Расчет коэффициентов молярного поглощения. Оптическую плотность растворов олигонуклеотидов измеряли на спектрофотометре NanoDrop 1000 (Thermo Scientific, США). Молярные коэффициенты поглощения немодифицированных олигонуклеотидов при 260 нм рассчитывали по данным работы Marti et al. [19]. Значения молярных коэффициентов поглощения для 2'-O-метилрибонуклеотидов принимали равными соответствующим молярным коэффициентам поглощения для рибонуклеотидов. При расчете коэффициентов молярного поглощения олигонуклеотидов, содержащих PyA, влияние пирена не учитывали.
Регистрация спектров флуоресценции. Флуоресценцию PyA-содержащих олиго(2'-O-метилрибонуклеотидов) и олигодезоксирибонуклеотидов регистрировали на спектрофлуориметре Carry Eclipse (Varian Inc., США) в кварцевых кюветах (длина оптического пути 4 мм) при комнатной температуре в буфере, содержавшем 50 мМ Tрис-HCl (рН 7.5), 10 мМ MgCl2, 100 мкМ NaCl или в буфере, содержавшем 10 мМ какодилат натрия (pH 7.4), 0.1 М NaCl, 1 мМ трилон Б, при концентрации олигонуклеотидных компонентов 2 мкМ.
Регистрация спектров поглощения. Поглощение PyA-содержащих олиго(2'-O-метилрибонуклеотидов) и олигодезоксирибонуклеотидов регистрировали на спектрофотометре BioSpectrometer (Eppendorf, Германия) в кварцевых кюветах (длина оптического пути 1 мм) при комнатной температуре при концентрации олигонуклеотидных компонентов 10 мкМ в воде.
Аналитическая обращенно-фазовая хроматография. Аналитическую офВЭЖХ проводили на жидкостном микроколоночном хроматографе Милихром A-O2 (ЭкоНова, Россия) с использованием колонки ProntoSil (75 × 2 мм) в градиенте концентрации 0–50% (20 мин) и 50% (5 мин) CH3CN в буфере, содержавшем 0.02 М TEAAc, pH 7.0, скорость потока 100 мкл/мин. Измерения проводили на трех длинах волн 260, 300 и 346 нм спектрофотометрического детектора хроматографа (Альфахром, Россия) при 40°С. Полученные данные обрабатывали в программе Мультихром OC (Эконова, Россия) и в Microsoft Excel (Microsoft Corporation, США).
Термическая денатурация дуплексов. Дифференциальные кривые термической денатурации дуплексов были получены на установке с терморегулируемой оптической кюветой на базе спектрофотометра Cary 300 BioMelt (Varian Inc., Австралия). Изменение температуры проводили со скоростью 0.5°С/мин. Детекцию поглощения осуществляли на двух длинах волн (260 и 270 нм). Обработку кривых термической денатурации и ренатурации проводили с использованием программного обеспечения Microsoft Office 2010 (Microsoft Corporation, США). Температуры плавления были определены как максимумы первых производных кривых плавления.
Синтез N6-бензоил-5'-O-[бис(4-метоксифенил)фенилметил]-8-(1-этинилпиренил)-3'-{бис[1-(метилэтил)фосфорамидил]цианоэтил}-2'-дезокси-аденозина (PyA). Синтез проводили по аналогии с работой Ji et al. [25] с небольшими изменениями. К раствору 200 мг (0.23 ммоль) соединения (N6‑бензоил-5'-O-[бис(4-метоксифенил)фенилметил]-8-(1-этинилпиренил)-2'-деоксиаденозина) в 0.7 мл хлористого метилена добавляли 69 мкл (0.40 ммоль) N,N-диизопропилэтиламина и раствор, содержавший 44.9 мг (0.35 ммоль) 5‑этилтиотетразола в 0.28 мл CH3CNабс. Затем добавляли 144 мкл (0.45 ммоль) 2-цианоэтил-N,N,N ',N '-тетраизопропилфосфитамида. За прохождением реакции следили с помощью ТСХ (система гексан : этилацетат, 1 : 2). По окончании реакции реакционную смесь растворяли в EtOAc (3–4 мл), отделяли раствор от осадка, образовавшегося в результате реакции, и переносили в пробирку на 50 мл, промывали осадок этилацетатом (6 мл × 4) и экстрагировали объединенный раствор насыщенным водным раствором NaHCO3. Водный слой трижды промывали этилацетатом, объединенные органические слои сушили безводным Na2SO4, фильтровали и упаривали досуха. Продукт выделяли из реакционной смеси методом колоночной хроматографии на силикагеле (230–400 меш, 60 Å) (Sigma, США). Смесь, растворенную в 2 мл 50%‑ного раствора этилацетата в гексане, наносили на колонку. Проводили элюцию в градиенте концентрации этилацетата в гексане (50–60%) и упаривали соответствующие фракции. Rf 0.76, система ТСХ гексан : этилацетат, 1 : 2. Выход фосфитамида PyA составил 56%.
Получение PyA-модифицированных олигонуклеотидов (L, R, Lm, Rm, Lmf, Rmf) в “ручном” варианте твердофазного фосфитамидного синтеза. Полимер-связанный 3'-концевой фрагмент олигонуклеотида, полученный автоматическим твердофазным фосфитамидным методом, переносили из реактора в пробирку на 1.5 мл и добавляли раствор, содержавший 22 мг фосфитамида PyA в смеси 100 мкл хлористого метилена и 100 мкл CH3CNабс (0.1 М). Затем добавляли 200 мкл 0.25 М раствора активатора 5-этилтиотетразола в CH3CNабс, перемешивали 30 мин при 37°С, раствор отбирали. Полимерный носитель промывали CH3CNабс (200 мкл × 3) и абсолютным тетрагидрофураном (200 мкл × 2).
К полимер-связанному олигонуклеотиду добавляли 100 мкл CpA (10%-ный уксусный ангидрид, 10%-ный 2,6-лутидин в THF), затем 100 мкл CpB (16%-ный N-метилимидазол в THF), перемешивали 5 мин при 37°С, раствор отбирали. Повторяли процедуру еще раз. Полимерный носитель промывали тетрагидрофураном (200 мкл × 2). Затем добавляли 200 мкл раствора окислителя (0.02 М I2 в THF : Py : H2O, 45 : 0.5 : 4.5 (v/v/v)), перемешивали 5 мин при 37°С, раствор отбирали. Полимерный носитель промывали тетрогидрофураном (200 мкл × 3) и хлористым метиленом (200 мкл × 2).
Для удаления 5'-О-диметокситритильной группы добавляли 300 мкл деблокирующего агента (3%-ный раствор дихлоруксусной кислоты в хлористом метилене), перемешивали 1 мин, раствор отбирали. Повторяли процедуру еще 2 раза. Полимер промывали хлористым метиленом (200 мкл × 2) и ацетоном (200 мкл × 2). Полимер высушивали, помещали в реактор и продолжали автоматический твердофазный фосфитамидный синтез. Конъюгаты деблокировали в стандартных условиях. Выделение конъюгатов проводили в 15%-ном ПААГ (акриламид : N,N'-метиленбисакриламид, 29 : 1) в денатурирующих условиях (8 М мочевина, 50 мМ Tрис-H3BO3, pH 8.3, 0.1 М трилон Б). Последовательности и характеристики конъюгатов приведены в табл. 1.
Список литературы
Bao G., Rhee W.J., Tsourkas A. // Annu. Rev. Biomed. Eng. 2009. V. 11. P. 25–47. https://doi.org/10.1146/annurev-bioeng-061008-124920
Guo J., Ju J., Turro N.J. // Anal. Bioanal. Chem. 2012. V. 402. P. 3115–3125. https://doi.org/10.1007/s00216-011-5526-x
Hwang G.T. // Molecules. 2018. V. 23. P. 124. https://doi.org/10.3390/molecules23010124
Boutorine A.S., Novopashina D.S., Krasheninina O.A., Nozeret K., Venyaminova A.G. // Molecules. 2013. V. 18. P. 15 357–15 397. https://doi.org/10.3390/molecules181215357
Wang K., Huang J., Yang X., He X., Liu J. // Analyst. 2013. V. 138. P. 62–71. https://doi.org/10.1039/c2an35254k
Birks J.B., Dyson D.J., Munro I.H. // Proc. R. Soc. A. Math. Phys. Eng. Sci. 1963. V. 275. P. 575–588. https://doi.org/10.1098/rspa.1963.0187
Krasheninina O.A., Novopashina D.S., Apartsin E.K., Venyaminova A.G. // Molecules. 2017. V. 22. P. 2108. https://doi.org/10.3390/molecules22122108
Astakhova I.V., Korshun V.A., Wengel J. // Chem. Eur. J. 2008. V. 14. P. 11 010–11 026. https://doi.org/10.1002/chem.200801077
Astakhova I.K., Lindegaard D., Korshun V.A., Wengel J. // Chem. Commun. 2010. V. 46. P. 8362–8364. https://doi.org/10.1039/c0cc03026k
Cummins L.L., Owens S.R., Risen L.M., Lesnik E.A., Freier S.M., McGee D., Guinosso C.J., Cook P.D. // Nucl. Acids Res. 1995. V. 23. P. 2019–2024. https://doi.org/10.1093/nar/23.11.2019
Boutorine A.S., Venyaminova A.G., Repkova M.N., Sergueyeva Z.A., Pyshnyï D.V. // Biochimie. 1994. V. 76. P. 23–32. https://doi.org/10.1016/0300-9084(94)90059-0
Kim K.T., Heo W., Joo T., Kim B.H. // Org. Biomol. Chem. 2015. V. 13. P. 8470–8478. https://doi.org/10.1039/C5OB01159K
Sakamoto T., Kobori A.,Murakami A. // Bioorg. Med. Chem. Lett. 2008. V. 18. P. 2590–2593. https://doi.org/10.1016/j.bmcl.2008.03.040
Waki R., Yamayoshi A., Kobori A., Murakami A. // Chem. Commun. 2011. V. 47. P. 4204–4206. https://doi.org/10.1039/c0cc04639f
Новопашина Д.С., Тоцкая О.С., Холодарь С.А., Мещанинова М.И., Веньяминова А.Г. // Биоорг. химия. 2008. Т. 34. С. 671–682. [Novopashina D.S., Totskaya O.S., Kholodar S.A., Meschaninova M.I., Venya-minova A.G. // Russ. J. Bioorg. Chem. 2008. V. 34. P. 602–612.] https://doi.org/10.1134/S1068162008050105
Krasheninina O.A., Novopashina D.S., Lomzov A.A., Venyaminova A.G. // Chembiochem. 2014. V. 15. P. 1939–1946. https://doi.org/10.1002/cbic.201402105
Крашенинина О.А., Фишман В.С., Новопашина Д.С., Веньяминова А.Г. // Биоорг. химия. 2017. Т. 43. С. 261–272. [Krasheninina O.A., Fishman V.S., Novopashina D.S., Venyaminova A.G. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 259–269.] https://doi.org/10.1134/S1068162017030086
Pasternak A., Kierzek E., Pasternak K., Fratczak A., Turner D.H., Kierzek R. // Biochemistry. 2008. V. 47. P. 1249–1258. https://doi.org/10.1021/bi701758z
Marti A.A., Li X., Jockusch S., Li Z., Raveendra B., Kalachikov S. // Nucl. Acids Res. 2006. V. 34. P. 3161–3168. https://doi.org/10.1093/nar/gkl406
Krasheninina O.A., Lomzov A.A. Fishman V.S., Novopashina D.S., Venyaminova A.G. // Bioorg. Med. Chem. 2017. V. 25. P. 2244–2250. https://doi.org/10.1016/j.bmc.2017.02.042
Ro J.J., Lee H.J., Kim B.H. // Chem. Commun. 2018. V. 54. P. 7471–7474. https://doi.org/10.1039/C8CC03982H
Seo Y.J., Ryu J.H., Kim B.H. // Org. Lett. 2005. V. 7. P. 4931–4933. https://doi.org/10.1021/ol0518582
Inoue H., Hayase Y., Imura A., Iwai S., Miura K., Ohtsuka E. // Nucl. Acids Res. 1987. V. 15. P. 6131–6148. https://doi.org/10.1093/nar/15.15.6131
Hwang G.T., Seo Y.J., Kim B.H. // Tetrahedron Lett. 2005. V. 46. P. 1475–1477. https://doi.org/10.1016/j.tetlet.2005.01.015
Ji Y., Yang J., Wu L., Yu L., Tang X. // Angew. Chemie Int. Ed. 2016. V. 55. P. 2152–2156. https://doi.org/10.1002/anie.201510921
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


