Биоорганическая химия, 2021, T. 47, № 3, стр. 315-326
Синтетические антимикробные пептиды. III. Влияние катионных групп лизина, аргинина и гистидина на антимикробную активность пептидов с “линейным” типом амфипатичности
Н. В. Амирханов 1, *, А. В. Бардашева 1, Н. В. Тикунова 1, Д. В. Пышный 1
1 ФГБУН “Институт химической биологии и фундаментальной медицины” СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 8,
Россия
* E-mail: nariman@niboch.nsc.ru
Поступила в редакцию 04.07.2020
После доработки 16.07.2020
Принята к публикации 18.07.2020
Аннотация
Исследована антимикробная и гемолитическая активность синтетических антимикробных пептидов (САМП) Arg9Phe2 (P1-Arg), Lys9Phe2 (P2-Lys) и His9Phe2 (P3-His), обладающих “линейным” типом амфипатичности и содержащих катионные аминокислотные остатки аргинина, лизина или гистидина. На примере различных патогенных штаммов микроорганизмов – грамотрицательных бактерий Pseudomonas aeruginosa, Escherichia coli, Salmonella enterica и грамположительных бактерий Staphylococcus aureus, а также условно-патогенного дрожжеподобного гриба Candida albicans – показано, что замена остатков аргинина на остатки лизина или гистидина в исследованных САМП значительно ухудшает антибактериальные свойства таких САМП в ряду: P1-Arg > P2-Lys $ \gg $ P3-His. Катионный аналог САМП P1-Arg обладает наибольшей антибактериальной активностью (минимальная подавляющая концентрация пептида (МПК50) от 43 до 76 мкМ), а пептид P3-His фактически не проявляет антибактериальную активность (МПК50 >100 мкМ). По отношению к условно-патогенной дрожжевой культуре C. albicans пептиды P1-Arg и P2-Lys в целом проявили более чем в 6–10 раз (МПК50 = 6.7 и 10.9 мкМ), а пептид P3-His – более чем в 100 раз (МПК50 = 0.6 мкМ) повышенную антимикотическую активность по сравнению с аналогичным их действием на бактериальные клетки. Все исследуемые нами пептиды с “линейным” типом амфипатичности P1-Arg, P2-Lys и P3-His, имеющие в своем составе лишь два остатка Phe и обладающие низкой гидрофобностью, независимо от их катионного состава аминокислот (Arg, Lys или His) проявляют относительно низкую гемолитическую активностью (не более 4% гемолиза при 1000 мкМ концентрации пептидов). Таким образом, принимая во внимание одинаковую эффективность синтеза (56–63%) и примерно одинаковую низкую токсичность исследованных пептидов, для создания антибактериальных препаратов на основе САМП с “линейным” типом амфипатичности рекомендуется использовать пептиды, содержащие в качестве катионных групп аминокислотные остатки аргинина, а для создания антигрибковых препаратов – пептиды с остатками гистидина.
ВВЕДЕНИЕ
Антимикробные пептиды (АМП) – наиболее многочисленный и хорошо изученный класс биологически активных пептидов, синтезирующихся в ответ на внедрение чужеродных микроорганизмов [1–3]. Несмотря на то, что лишь немногие АМП нашли применение в медицинской практике, изучение этого класса соединений продолжает привлекать внимание значительного числа исследователей в мире [2–9]. Повышенное внимание к АМП обусловлено редким развитием резистентности к ним у микроорганизмов, особенно у бактерий, что делает весьма привлекательным дизайн новых антибиотиков на основе антимикробных пептидов [5–7, 10–12].
Ранее для конструирования и поиска АМП с новыми свойствами нами было предложено использовать синтетические антимикробные пептиды (САМП) [13, 14], которые должны отличаться от природных АМП [2, 8, 9] тем, что они сконструированы независимо от структуры многочисленных известных природных АМП. Конструирование таких САМП основано на общих принципах воздействия АМП на микробные клетки, а именно на принципах амфифильности пептида, т.е. наличия в молекуле пептида одновременно гидрофобных и гидрофильных положительно заряженных групп. В зависимости от взаимного расположения полярных амфифильных аминокислот АМП относительно друг друга в пространстве такие пептиды также могут быть разделены на два подтипа или класса по типу их амфипатичности – пептиды с классическим “круговым” (спиральный или кольцевой) типом амфипатичности (КТА) [2, 8, 9, 15, 16] (рис. 1а) и пептиды с новым, “линейным” типом амфипатичности (ЛТА) (рис. 1б) [13, 14].
Рис. 1.
Гипотетическое представление классического “кругового” (а) и “линейного” (б) типов амфипатичности α-спиральных пептидов. Прямоугольниками обозначены гидрофильные или катионные остатки аминокислот, треугольниками – гидрофобные остатки. В случае классического “кругового” типа амфипатичности (КТА) [2, 8, 9] гидрофобные и гидрофильные полярные поверхности α-спиральной молекулы пептида разделены продольной осевой линией (а). На рисунке верхняя поверхность гидрофильная, нижняя – гидрофобная (амфипатичность по типу “спинка–животик”). В случае линейного типа амфипатичности (ЛТА) гидрофобные и гидрофильные (катионные) остатки аминокислот разнесены на противоположных концах вдоль линейной оси пептида. Гидрофобная и гидрофильная полярные области в этом случае разделены поперечной линией перпендикулярной продольной оси пептида (б), где левый конец молекулы имеет гидрофильный “хвостик”, правый – гидрофобную “головку”. Справа представлены двумерные проекции “спиральных колес” Шиффер и Эдмундсона [15, 16] этих же пептидов. Видно, что полярная однородность гидрофобных и гидрофильных групп в случае линейного типа амфипатичности (б) в проекции, представленной слева, гораздо выше, чем когда та же молекула представлена в классическом виде в виде двумерных проекций “спиральных колес” (справа).

В этих же работах было показано, что САМП с так называемым “линейным” типом амфипатичности (САМП-ЛТА) обладают повышенными антимикробными свойствами по сравнению с САМП с классическим, так называемым “круговым”, типом антипатичности (САМП-КТА). По сравнению с пептидами с КТА, у которых амфифильные гидрофобные и/или гидрофильные катионные группы расположены в противоположных сторонах α-спирали, пептиды с ЛТА обладают меньшей гидрофобностью и, как следствие, меньшей гемолитической активностью, что существенно повышает индекс селективности таких препаратов на основе САМП [13, 14].
В ранее представленных работах исследования биологической активности таких пептидов проводились на основе аргинин-содержащего катионного пептида R9F2 (P1-Arg) АМП [13, 14]. Однако далее важно было получить ответ на ряд вопросов. Во-первых, связана ли ранее обнаруженная повышенная антимикробная активность САМП-ЛТА P1-Arg с содержанием в качестве катионных групп именно остатков аргинина (pKa ~ 12) (по сравнению с САМП-КТА [13, 14]) или такой же эффект может быть получен и с другими катионными остатками, такими как лизин (pKa ~ 10), и/или условно катионными остатками, такими как гистидин (pKa ~ 6)? Во-вторых, из-за разной химической природы катионных остатков аргинина, лизина и гистидина и, соответственно, разных химические свойств защитных групп боковых цепей этих аминокислот в ходе синтеза и деблокирования синтез таких пептидов может проходить с разной эффективностью. Если имеются различия в эффективности синтеза пептидов с разными катионными остатками, то какова величина или степень таких различий? И далее, если допустить одинаковую эффективность синтеза, а также одинаковую антимикробную активность таких пептидов независимо от их катионного состава, преимущество в выборе в качестве эффективного антимикробного препарата может быть оказано тем пептидам, которые имеют меньшую гемолитическую активность или токсичность. Следовательно, в-третьих, необходимо было выяснить, зависит ли гемолитическая активность пептидов САМП-ЛТА от их катионного состава (остатки аргинина, лизина или гистидина).
Очевидно, что при разных антимикробных свойствах и разных гемолитических активностях преимущество в качестве потенциального антимикробного препарата могло бы быть предоставлено пептиду, обладающему более высоким индексом селективности или терапевтическим индексом (ТИ), т.е. высоким значением минимальной гемолитической концентрации (МГК) и низким значением минимальной подавляющей концентрации (МПК50) (ТИ = МГК/МПК50).
Для оптимизации структуры САМП и поиска наиболее активных антимикробных препаратов на основе САМП с “линейным” типом амфипатичности были изучены три типа таких пептидов общей структуры X9Phe2, где X = Arg, Lys или His.
Целью настоящей работы было исследование зависимости эффективности синтеза САМП с так называемым “линейным” типом амфипатичности от состава катионных аминокислотных составляющих (аргинина, лизина или гистидина), а также выявление их антимикробной и гемолитической активности.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
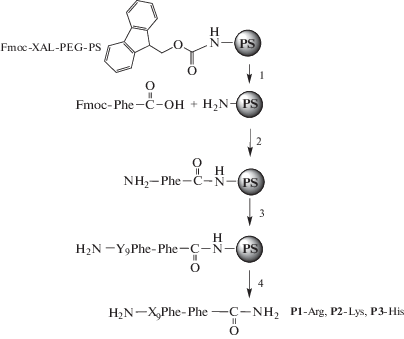
Синтез пептидов P1-Arg, P2-Lys и P3-His. Синтез пептидов проводили стандартным твердофазным методом с использованием Fmoc-стратегии [17] согласно приведенной схеме 1 , на пептидном синтезаторе PS3, который ранее был приспособлен для масштабного препаративного синтеза в реакторном варианте [18, 19]. Структура синтезированных пептидов P1-Arg, P2-Lys и P3-His включала в себя 11-звенную последовательность аминокислот, содержащую свободную N-концевую аминогруппу (придающую дополнительный положительный заряд пептиду) и амидную группу на C-конце цепи, нейтрализующую отрицательный заряд свободной концевой карбоксильной группы (схема 1 ). Эффективность присоединения одного аминокислотного мономерного звена, определенные путем измерения количества удаляемых Fmoc-групп на каждой стадии конденсации, для пептидов P1-Arg, P2-Lys и P3-His в среднем составили 96.9–99.8% (табл. 1). Конечные выходы пептидов после 11 шагов конденсации на твердофазном носителе, деблокирования и удаления с полимерного носителя, а также очистки методом офВЭЖХ составили 56–63%. По данным офВЭЖХ и МС все выделенные пептиды соответствовали ожидаемой структуре и были гомогенными с содержанием основного вещества не менее 95% (табл. 1).
Таблица 1.
Структура, выходы продуктов синтеза и физико-химические характеристики синтетических антимикробных пептидов, полученных в настоящей работе
| Пептид | Структураа | Выходы по Fmocб | Выход по ВЭЖХв | Общий выход синтезаг, % | Время удерживанияд, мин | Молекулярная масса [M + H] | |||
|---|---|---|---|---|---|---|---|---|---|
| средний | суммар-ный | ||||||||
| 80% CH3CN | 50% CH3CN | расч. | эксп. | ||||||
| P1-Arg | H-R9F2-NH2 | 96.9 | 70.2 | 85.0 | 56.0 | 15.5 | 20.4 | 1717.0 | 1716.5 |
| P2-Lys | H-K9F2-NH2 | 97.5 | 75.5 | 80.0 | 57.8 | 14.6 | 18.2 | 1465.0 | 1465.3 |
| P3-His | H-H9F2-NH2 | 99.8 | 98.2 | 70.5 | 62.9 | 15.6 | 20.0 | 1545.7 | 1545.8 |
б Средний и суммарный выход конденсации на полимерном носителе, определенный по измерению деблокированной Fmoc-группы, соответственно, после каждой или последней (11-й) конденсации на полимерном носителе.
в Выход, определенный измерением количества пептида до хроматографии и после очистки методом ВЭЖХ (см. “Эксперим. часть”).
Схема 1 . Синтез пептидов P1-Arg, P2-Lys и P3-His с C-концевыми амидными группами твердофазным методом с использованием Fmoc-стратегии. Y = ArgPbf, LysBoc или His соответственно; X = Arg, Lys или His; PS – полистирольный полимер; 1. пиперидин/DMF (1 : 5). 2. а) HATU. NMM. DMF; б) Ac2O/NMM/DMF; в) пиперидин/DMF (1 : 5); 3. повторяющиеся циклы: а) Fmoc-Phe-OH, Fmoc-ArgPbf-OH, Fmoc-LysBoc-OH или Fmoc-His-OH, HATU, NMM, DMF; б) Ac2O/NMM/DMF; в) пиперидин/DMF (1 : 5); 4. TFA/м-крезол.
Таким образом, синтез пептидов P1-Arg, P2-Lys и P3-His в указанном режиме проходит достаточно эффективно с относительно высокими выходами независимо от состава аминокислот в структуре пептида.
Основной проблемой в пептидном синтезе может оказаться очистка сырой реакционной смеси, получаемой после синтеза, деблокирования и снятия с полимерного носителя, которая содержит примеси модифицированных или более коротких пептидов, появляющихся из-за недостаточно высокой эффективности конденсаций мономерных звеньев аминокислот на полимерном носителе или модификации аминокислотных остатков при синтезе и деблокировании защитных групп. В этом случае в виде примесей могут появиться последовательности пептидов с меньшей длиной цепи, которые по подвижности на офВЭЖХ мало отличаются от целевого продукта. Как видно из данных табл. 1, эффективность присоединения мономерных звеньев в нашем случае оказалась достаточно высокой для всех исследованных пептидов, а для гистидин-содержащего пептида P3-His выход, определяемый по измерению Fmoc-групп, был особенно высоким и составил в среднем 99.8% на каждую стадию, суммарный выход для этого пептида составил 98.2% (табл. 1). Тем не менее, несмотря на относительно высокую эффективность конденсаций между аминокислотными мономерами, выходы пептида P3-His, содержащего остатки гистидина, по ВЭЖХ наиболее низкие по сравнению с пептидами P1-Arg или P2-Lys, содержащими, соответственно, остатки аргинина или лизина (рис. 2). Вероятно, это происходит из-за того, что в ходе реакции активации и присоединения мономерных звеньев гистидина образуется ряд побочных продуктов, что сказывается, скорее всего, на относительной чистоте целевого соединения в сыром неочищенном продукте до его выделения и при очистке методом офВЭЖХ. Несмотря на такое различие в промежуточных выходах этих трех пептидов, конечные выходы очищенных целевых продуктов относительно одинаковые. Скорее всего, в данном случае недостаточно высокая эффективность очистки пептида P3-His методом офВЭЖХ нивелируется высокой эффективностью конденсаций между аминокислотами на полимерном носителе (табл. 1). Тем не менее конечные выходы очищенных пептидов P1-Arg, P2-Lys и P3-His оказались примерно равными и составили 56, 58 и 63% соответственно (табл. 1).
Рис. 2.
Профили офВЭЖХ реакционных смесей пептидов P1-Arg (а), P2-Lys (б) и P3-His (в), полученных после синтеза и деблокирования с полимерного носителя. Представлены данные детекции при длине волны 220 нм (условия хроматографии – см. “Эксперим. часть”).

Резюмируя все сказанное выше относительно синтеза исследуемых нами пептидов P1-Arg, P2-Lys и P3-His, можно заключить, что эффективность синтеза этих пептидов практически не зависит от состава используемых катионных аминокислот – аргинина, лизина или гистидина.
Антимикробная активность синтетических пептидов P1-Arg, P2-Lys и P3-His. В качестве исследуемых микроорганизмов при испытании антимикробной активности пептидов P1-Arg, P2-Lys и P3-His были использованы грамотрицательные бактерии Pseudomonas aeruginosa, Escherichia coli и Salmonella enterica, грамположительные бактерии Staphylococcus aureus и штамм условно-патогенного дрожжеподобного гриба Candida albicans.
Каждый из пептидов в конечных концентрациях 0.3–100 мкМ добавляли к растущим культурам клеток микроорганизмов и наблюдали за ростом клеток. Влияние присутствия пептидов в культуральной среде на рост самой культуры клеток контролировали измерением оптической плотности (оптического поглощения при 595 нм) суспензии растущих клеток во времени в течение 24 ч. Для количественной оценки антимикробной активности пептидов удобным оказалось одновременное построение на одном графике двух дозозависимых кривых: 1) зависимости относительной степени роста микробных культур (Nр/N0) от концентрации пептида и 2) зависимости относительной степени подавления роста этих же культур клеток (1 – Nр/N0), где Nр – оптическая плотность (концентрация) микробных частиц после добавления пептидного препарата, N0 – оптическая плотность микробных частиц в контрольной культуре (рис. 3). По месту пересечения этих двух кривых на одном и том же графике можно сразу определить минимальную подавляющую концентрацию препарата в среде (МПК50, мкМ), при которой концентрация микробных частиц, инкубированных в присутствии пептидной пробы, после 24 ч при 37°С составляет половину концентрации клеточных частиц культур, инкубированных в среде без препарата. В качестве примера на рис. 3 приведены данные зависимости степени роста и степени подавления роста культуры клеток C. albicans исследуемыми пептидами P1-Arg, P2-Lys и P3-His от концентрации этих пептидов в среде. Аналогичные графики по ингибированию роста были получены и для остальных культур клеток (данные не приведены), по которым, исходя из трехкратных повторов, нами были определены соответствующие усредненные значения МПК50 для всех исследованных пептидов по отношению к каждой из культур клеток (табл. 2).
Рис. 3.
Зависимость относительной степени роста (Nр/N0) клеточных культур C. albicans или степени ингибирования их роста (1 – Nр/N0) от воздействия различных концентраций антимикробных пептидов P1-Arg (а), P2-Lys (б) и P3-His (в) после 24 ч инкубации, где Np/N0 – отношение оптической плотности (концентрации) микробных частиц после добавления пептидного препарата (Np) к оптической плотности (концентрации) в контрольной культуре (N0).

Таблица 2.
Антимикробная активность пептидов P1-Arg, P2-Lys и P3-His
| Пептиды | МПК50, мкМ | ||||
|---|---|---|---|---|---|
| Candida albicans | Staphylococcus aureus | Escherichia coli | Salmonella enterica | Pseudomonas aeruginosa | |
| P1-Arg | 6.7 | 42.8 | 48.2 | 59.4 | 76.0 |
| P2-Lys | 10.9 | >100.0 | 77.5 | 100.0 | 80.0 |
| P3-His | 0.6 | >100.0 | >100.0 | >100.0 | >100.0 |
| AgNO3* | 48.0 | 26.6 | 18.6 | 22.2 | 22.1 |
| ХГ* | 9.7 | 1.8 | 1.7 | 7.7 | 9.4 |
* AgNO3 – водный раствор нитрата серебра [14], а также хлоргексидин (ХГ) были использованы в качестве внутренних контролей для сравнения относительной антимикробной активности пептидных препаратов.
По отношению к исследованным бактериальным культурам клеток наибольшую активность проявил пептид P1-Arg, содержащий катионные остатки аргинина (табл. 2). Пептид P3-His, содержащий остатки гистидина, по отношению к бактериальным культурам в пределах максимально используемой концентрации в среде 100 мкМ не проявил вообще никакой активности. Пептид P2-Lys, содержащий катионные остатки лизина, проявил фиксируемую активность по отношению лишь к двум бактериальным культурам – E. coli и P. aeruginosa (МПК50 = 77.5 и 80.0 мкМ соответственно).
Таким образом, замена остатков аргинина в ранее исследованном пептиде H-R9F2-NH2 на остатки лизина или гистидина в рамках наших исследований не привела к улучшению их антибактериальной активности. В случае же гистидинового аналога такого пептида, напротив, после замены остатков аргинина на гистидин пептид потерял какую-либо заметную антибактериальную активность (табл. 2).
Тем не менее неожиданным оказалось воздействие пептидов P1-Arg, P2-Lys и P3-His по отношению к условно-патогенной дрожжевой культуре C. albicans (рис. 3, табл. 2). Эффективность воздействия этих пептидов на культуры клеток C. albicans в среднем оказалась в 6–10 раз выше, чем аналогичная эффективность их воздействия на бактериальные клетки. Однако действие пептида P3-His наряду с пептидами P1-Arg и P2-Lys оказалось уникальным не только по сравнению с их действием на бактериальные клетки, но и по сравнению с действием самих пептидов P1-Arg и P2-Lys на саму культуру дрожжевых клеток C. albicans. Пептид P3-His, содержащий остатки гистидина, по отношению к C. albicans оказался наиболее активным (МПК50 = 0.6 мкМ) по сравнению с двумя другими пептидами P1-Arg и P2-Lys, содержащими катионные остатки аргинина или лизина (МПК50 = 6.7 и 10.9 мкМ соответственно).
Таким образом, антимикробная активность пептида P3-His по отношению к C. albicans более чем в 10 раз превышала антимикробную активность пептидов P1-Arg и P2-Lys, а при сравнении действия на C. albicans и клетки бактерий тот же пептид P3-His проявил антигрибковую активность, превышающую антибактериальную активность более чем в 100 раз (табл. 2).
Такое избирательное действие пептида P3-His, содержащего остатки гистидина, по отношению к грибковым культурам подтверждается литературными данными, в которых указывается на целый класс гистидин-содержащих природных АМП, так называемых гистатинов (Hst) – богатых гистидином (катионных) антимикробных белков, которые содержатся в слюне [20] и проявляют избирательную активность как к условно-патогенным дрожжевым культурам, таким как C. albicans [20], так и к другим дрожжевым культурам [21]. Так, например, известно, что среди всех Hst гистатин 5 (Hst 5) обладает наиболее сильным фунгицидным действием против патогенных грибов, включающих не только C. albicans [22], но и другие важные с медицинской точки зрения виды Candida, такие как Candida kefyr, Candida krusei и Candida parapsilosis (МПК50 = 3–7 мкМ), а также Cryptococcus neoformans и Aspergillus fumigatus (МПК50 = 1.5–2.0 мкМ) [23]. Известно также, что Hst 5 может ингибировать трансформацию почти 100% клеток C. albicans в более патогенные гифы [24, 25].
Участие Hst в антимикробной активности делает их частью врожденной иммунной системы [26]. Гистатины (Hst-1, Hst-3 и Hst-5) были впервые выделены в 1988 г. как пептиды, принимающие участие в поддержании гомеостаза в полости рта и связывании ионов металлов [20, 22]. Более ранние исследования указывали на мембранолитические механизмы для Hst, вызывающие гибель грибковых клеток. Однако более поздние исследования показали, что множественные внутриклеточные мишени – более вероятные участки воздействия Hst, т.е. механизм действия Hst скорее метаболический, чем мембранолитический. Например, известно, что Hst 5, попав внутрь грибковых клеток, может влиять на функционирование митохондрий и вызывать окислительный стресс, а конечная причина гибели клеток – дисбаланс ионов, вызванный осмотическим стрессом [27]. Помимо этих разнообразных механизмов воздействия на внутриклеточные мишени обсуждаются также механизмы, основанные на способности Hst связываться с ионами металлов меди и/или цинка.
Метаболический путь воздействия АМП на микробные клетки при его сравнении с мембранолитическим более эффективен, поскольку позволяет запускать каскад процессов, приводящих к опосредованному нарушению нормального метаболизма клеток и, в конечном итоге, к гибели самих клеток, тогда как мембранолитический путь воздействия АМП на микробные клетки – непосредственный, прямой и в какой-то мере “механистический” – воздействие происходит лишь на мембрану клеток, что приводит к механистической деструкции мембраны и ее дальнейшему разрушению и требует, вследствие этого, большего в статистическом плане количества молекул самого воздействующего пептидного препарата. Вероятно, вследствие именно этих причин исследованный нами пептид P3-His (обладающий, как и многие гистидин-содержащие АМП, метаболическим характером воздействия) проявляет повышенную противогрибковую активность (более чем в 10 раз) в сравнении с другими исследованными нами пептидами P1-Arg и P2-Lys, которые оказывают, вероятно, как и все катионные АМП, преимущественно мембранолитическое воздействие. Более того, как мы предполагаем, за счет существования специфических рецепторов на поверхности дрожжевых клеток к гистидин-богатым пептидам пептид P3-His к тому же обладает активностью по отношению к C. albicans, более чем в 100 раз превышающей его активность по отношению к исследованным нами бактериальным клеткам.
Согласно литературным данным (см., например, обзор [27] и приведенные в нем ссылки), Hst 5 связывается с белками клеточной стенки C. albicans (Ssa1/2) и гликанами и поглощается клетками посредством переносчиков грибковых полиаминов. Попав внутрь грибковых клеток, Hst 5 может влиять на функции митохондрий и вызывать окислительный стресс; однако конечная причина гибели клеток – дисрегуляция объема и дисбаланс ионов, вызванный осмотическим стрессом. Но поскольку специфической активностью по отношению к C. albicans обладают не только Hst 5, но и остальные гистатины, содержащие в своем составе остатки гистидинов, вполне уместно предположить, что на поверхности дрожжевых клеток C. albicans имеются специфические рецепторы к гистидин-богатым пептидам. Причина проникновения гистатинов, как мы предполагаем, – не их катионный состав (у гистидин-содержащего пептида P3-His один положительный заряд, образованный за счет открытой концевой аминогруппы, и слабый положительный заряд за счет остатков гистидина), а наличие рецепторов, специфических к гистидин-богатым пептидам. Проникновение в клетку в данном случае, скорее всего, должно идти не по электростатическому, а по рецептор-опосредованному механизму, хотя электростатическое взаимодействие также играет немаловажную роль в первоначальном связывании с отрицательно заряженной поверхностью клетки C. albicans.
Гемолитическая активность. При создании САМП в качестве потенциальных лекарственных препаратов одним из важных факторов, помимо высокой эффективности синтеза и повышенной антимикробной активности, выступает их относительно низкая токсичность по отношению к высшим организмам, в частности низкая гемолитическая активность создаваемых САМП. В большей части работ, посвященных созданию и конструированию модифицированных природных АМП путем изменения структуры, в основном удавалось уменьшить их гемолитическую активность, тогда как попытки каким-либо образом направленно увеличить антимикробную активность модифицируемых АМП не всегда приводили к желаемому результату [6, 25, 26]. Вероятно, природа уже выбрала свою оптимальную максимально эффективную структуру соответствующего АМП. Тем не менее уменьшение гемолитической активности видоизмененного или модифицированного природного АМП, даже при сохранении прежней его антимикробной активности, приводило в некоторых случаях к значительному (до 50 раз) увеличению индекса селективности модифицированного природного АМП [6]. При всем этом показатель гемолитической активности, когда гемолиз не превышает 10% при 100–125 мкМ концентрации пептида в среде, считается приемлемым [6, 11, 12]. Следует отметить, что, в большинстве своем, уменьшение гемолитической активности достигалось простым уменьшением общей гидрофобности модифицируемых природных АМП путем замены в их составе гидрофобных аминокислотных остатков на какие-либо нейтральные, гидрофильные или катионные аминокислотные остатки, что в некоторых случаях существенно не влияло на их антимикробную активность, однако значительно уменьшало их гемолитическую активность [11, 12].
На рис. 4 приведены результаты исследования гемолитической активности пептидов P1-Arg, P2-Lys и P3-His в зависимости от их концентрации в среде. Видно, что гемолитическая активность всех исследуемых пептидов даже при достаточно высокой их концентрации в среде (до 1000 мкМ), содержащей эритроциты, не превышает 4% – это относительно низкая величина по сравнению с известными в литературе данными для природных АМП, показатель гемолитической активности которых составлял 10% при 100–125 мкМ концентрации АМП [6, 11, 12].
Таким образом, все исследуемые нами пептиды P1-Arg, P2-Lys и P3-His независимо от их катионного состава аминокислот (Arg, Lys или His) обладают низкой гемолитической активностью (не более 4% гемолиза при 1000 мкМ концентрации пептидов), причем по своим гемолитическим свойствам мало отличаются друг от друга (в пределах 2–4% при той же концентрации пептидов 100–1000 мкМ).
Тем не менее следует отметить некоторое несущественное различие между гемолитическими свойствами, проявляемыми под воздействием пептида P1-Arg и пептидов P2-Lys и P3-His. Так, например, гидрофобность пептидов P1-Arg, P2-Lys и P3-His примерно одинакова за счет того, что все пептиды содержат в своем составе одинаковое число гидрофобных (два остатка Phe) и одинаковое число гидрофильных катионных остатков (по 9 остатков Arg, Lys или His в каждом из соответствующих пептидов) (табл. 1). Поэтому справедливо было ожидать, что гемолитические свойства исследуемых пептидов не будут существенно отличаться друг от друга. Тем не менее, как указывалось выше, гидрофобность аргинин- или гистидин-содержащих пептидов P1-Arg и P3-His (определяемая по времени их удерживания на колонке при офВЭЖХ, табл. 1) немного выше, чем гидрофобность лизин-содержащего пептида P2-Lys. Гемолитические свойства этих пептидов, определенные нами в данной работе, также пропорционально изменяются в соответствии с их гидрофобными свойствами. Как видно из рис. 4, наибольшую и примерно одинаковую гемолитическую активность проявили аргинин- или гистидин-содержащие пептиды P1-Arg и P3-His (при концентрации пептида 500 мкМ, гемолиз для которых составляет 2.4 и 2.7% соответственно), тогда как пептид P2-Lys, содержащий в своем составе остатки лизинов, проявил наименьшую гемолитичекую активность (1.0% при такой же концентрации пептида, равной 500 мкМ). Таким образом, как гемолитическую активность исследованных пептидов, так и их гидрофобность можно расположить в одном ряду по возрастанию их гемолитической активности и гидрофобности: P3-His > P1-Arg > P2-Lys.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использовали реактивы для пептидого синтеза фирм Sigma, Fisher Scientific, Bachem, Protein Technologies (США); полистирольный полимер 855013 Novabiochem® NovaSyn®TG Sieber resin, функционализированный 9-Fmoc-аминоксантен-3-илоксильным фрагментом, 200 ммоль/г (Merck Schuchardt OHG, Германия); защищенные аминокислотные мономеры фирмы Protein Technologies (США); конденсирующий реагент HATU – 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (Cat. № 023926, Oakwood Products Inc., США).
Синтез пептидов. Пептиды были синтезированы твердофазным методом с использованием Fmoc-стратегии [17] согласно приведенной схеме 1 на пептидном синтезаторе PS3 (Protein Technologies, США), который ранее был приспособлен нами для масштабного препаративного синтеза в реакторном варианте [18, 19]. Содержание основного вещества в синтезированных пептидах по данным офВЭЖХ составляло не менее 95%.
Штаммы микроорганизмов. Штаммы патогенных бактерий Pseudomonas aeruginosa ATCC 9027, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, Salmonella enterica ATCC 14028 и условно-патогенного гриба Candida albicans ЭМТК 34 поддерживали и нарабатывали в Коллекции экстремофильных микроорганизмов и типовых культур Института химической биологии и фундаментальной медицины СО РАН.
Аналитическую офВЭЖХ проводили на хроматографе LC-20 AD (Shimadzu, Япония) с использованием детектора SPD-M20A (Shimadzu, Япония) на колонке Gemini 5 µm NX-C18, 110 Å, 4.6 × × 250 мм (Phenomenex Inc., США), уравновешенной 0.1%-ным раствором TFA, в линейном градиенте концентрации ацетонитрила 0–80% в течение 30 мин при скорости потока 1 мл/мин, УФ-детекция при длине волны 210, 220, 240 и 260 нм.
Молекулярные массы пептидов (табл. 1) определяли с помощью масс-спектрометрии MALDI-TOF (REFLEX III, Bruker Daltonics, Германия) и ESI-MS (LC/MS XCT Ultra, Agilent Technologies, США) в Центре масс-спектрометрического анализа Института химической биологии и фундаментальной медицины СО РАН.
Растворы пептидов для определения антимикробной активности определенной концентрации готовили по сухим навескам непосредственно перед проведением эксперимента. Для всех пептидов P1-Arg, P2-Lys и P3-His, которые содержали по два остатка фенилаланина, дополнительно проводили определение концентрации путем измерения поглощения в ближней УФ-области спектра с использованием значений молярных коэффициентов поглощения при длине волны 260 нм 330 л моль–1 см–1, молярные коэффициенты которых ранее были определены, исходя из соответствующих растворов пептидов, приготовленных из сухих навесок. Исходные растворы пептидов с концентрацией 1–2 мМ хранили при –15°С в темноте не более месяца. Непосредственно перед экспериментом растворы разводили до нужной концентрации водой или средой Мюллера–Хинтона. Исходная концентрация пептидов для приготовления проб для дальнейшего испытания их гемолитической активности составляла 10 мМ в воде.
Определение антимикробной активности пептидных препаратов. Для работы использовали взвесь ночных бульонных культур, выращенных на стандартных питательных средах. Количество микроорганизмов (титр) во взвеси определяли по оптической плотности при длине волны 595 нм. Для оценки антибактериального действия пептидов проводили совместное инкубирование клеточных культур с исследуемыми препаратами в 96-луночных планшетах для культивирования. Ночные бульонные культуры ресуспендировали в среде Мюллера–Хинтона (для C. albicans – в среде Сабуро), доводя количество микроорганизмов до посевной дозы ~5 × 105 КОЕ/мл. В лунки последовательно вносили раствор исследуемых препаратов, а затем клеточную суспензию в соотношении 1 : 9 по объему (общий объем 200 мкл) в конечных концентрациях 0.3–100 мкМ. В качестве отрицательного контроля вместо тестируемого пептида вносили аналогичный объем среды Мюллера–Хинтона (для C. albicans – среды Сабуро). В качестве положительного контроля вместо тестируемого пептида вносили аналогичный объем растворов AgNO3 или хлоргексидина в соответствующих разведениях, так же как и для пептидов, в конечных концентрациях 0.3–100 мкМ. Инкубацию проводили в течение 24 ч при 37°С и 560 об/мин на шейкер-инкубаторе (Kuhner LT-X, АБТЕК, Россия). В нулевой точке и через 2, 4, 5, 6, 7, 8 и 24 ч после начала инкубирования измеряли оптическую плотность суспензии на планшетном спектрофотометре iMark™ (Bio-Rad, США) при длине волны 595 нм. Результаты выражали в виде среднего значения оптической плотности клеточной суспензии в трех независимых экспериментах, выполненных в двух повторах. Среднестатистическая ошибка (или стандартное отклонение значений экспериментальных данных) при этом не превышала 15–30%. Стандартное отклонение (S) рассчитывали по формуле:
где n – число измерений, xi – i-тый элемент выборки, xср – среднее арифметическое значение выборки.Методика расчета МПК50. Исходя из полученных средних значений оптической плотности суспензий клеточных культур, определяли величины относительной степени роста культуры микробных клеток (Np/N0) в виде отношения оптической плотности (концентрации) микробных частиц после добавления пептидного препарата (Np) к оптической плотности (концентрации) в контрольной культуре (N0). Концентрацию пептида, при которой величина относительной степени роста культуры микробных клеток составляла 50%, определяли по кривым зависимости величины относительной степени роста культуры микробных клеток (Np/N0) в процентах от концентрации пептидов.
Фотометрический метод оценки гемолитической активности антимикробных пептидов в отношении эритроцитов человека. Гемолитическую активность исследуемых пептидов тестировали в отношении свежих эритроцитов человека согласно ранее опубликованным методикам [6, 28]. Метод основан на измерении оптической плотности при длине волны 540 нм в надосадочной жидкости, полученной после центрифугирования суспензии эритроцитов, поскольку при разрушении эритроцитов вышедший из клеток гемоглобин придает среде характерную красную окраску, сохраняющуюся после осаждения эритроцитов. Свежие эритроциты человека трижды промывали фосфатно-солевым буфером (PBS: 10 мМ Na2HPO4, 1.76 мМ K2HPO4, pH 7.4), содержащим 173 мМ NaCl и 2.7 мМ KCl. К 50 мкл суспензии эритроцитов в PBS добавляли растворы пептидов в виде двукратных серийных разведений до конечного объема 100 мкл и концентрации суспензии эритроцитов 4% (по объему, за 100% принимали объем суспензии осажденных центрифугированием эритроцитов) и инкубировали в течение 30 мин при 37°С. После центрифугирования и отделения осадка измеряли оптическую плотность надосадочной жидкости при длине волны 540 нм. За 100% гемолиза принимали оптическую плотность раствора, полученную при действии на эритроциты 10%-ного раствора тритона Х-100. За 0% принимали оптическую плотность, полученную при действии на эритроциты “холостого” буферного раствора, не содержащего пептидных проб. Гемолитический анализ проводили дважды с использованием одного образца крови человека. Данные представлены как среднее значение ± стандартные отклонения трех независимых экспериментов. Средняя ошибка эксперимента при этом не превышала 15–20%.
ЗАКЛЮЧЕНИЕ
С синтетической точки зрения синтез катионных пептидов общей формулы X9Phe2, где X – это остатки аргинина, лизина или гистидина, проходит с примерно одинаковой эффективностью и практически не зависит от их катионного состава:
Замена остатков аргинина на остатки лизина или гистидина в исследованных САМП значительно ухудшает антибактериальные свойства таких САМП в ряду:
т.е. катионный аналог САМП P1-Arg, содержащий остатки аргинина, в этом ряду обладает наибольшей антибактериальной активностью (МПК50 = = 43–76 мкМ), а пептид, содержащий остатки гистидина P3-His, фактически не проявляет антибактериальную активность (МПК50 >100 мкМ).По отношению к условно-патогенной дрожжевой культуре C. albicans все пептиды в целом проявляют более высокую активность, чем к бактериальным культурам, их воздействие в среднем оказалось в 6–10 раз выше, чем такое же воздействие на бактериальные клетки.
Однако порядок эффективности противогрибкового воздействия исследованных пептидов P1-Arg, P2-Lys и P3-His на C. albicans совершенно другой, чем в случае воздействия их на бактериальные культуры клеток. По эффективности воздействия на дрожжевые культуры C. albicans исследованные пептиды расположены в следующем ряду:
Принимая во внимание одинаковую эффективность синтеза и примерно одинаковую низкую токсичность исследованных САМП, для создания антибактериальных препаратов на основе САМП с “линейным” типом амфипатичности рекомендуется использовать САМП, содержащие в качестве катионных групп аминокислотные остатки аргинина, а для создания антигрибковых препаратов необходимо использовать пептиды с остатками гистидина.
Список литературы
Peschel A., Sahl H.G. // Nat. Rev. Microbiol. 2006. V. 4. P. 529–536. https://doi.org/10.1038/nrmicro1441
Bahar A.A., Ren D. // Pharmaceuticals (Basel). 2013. V. 6. P. 1543–1575. https://doi.org/10.3390/ph6121543
Chung P.Y., Khanum R.J. // Microbiol. Immunol. Infect. 2017. V. 50. P. 405–410. https://doi.org/10.1016/j.jmii.2016.12.005
Overton K., Greer H.M., Ferguson M.A., Spain E.M., Elmore D.E., Nunez M.E., Volle C.B. // Langmuir. 2020. V. 36. P. 650–659. https://doi.org/10.1021/acs.langmuir.9b02726
Bílikova K., Huang S.C., Lin I.P., Šimuth J., Peng C.C. // Peptides. 2015. V. 68. P. 190–196. https://doi.org/10.1016/j.peptides.2015.03.001
Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. // J. Pept. Sci. 2015. V. 21. P. 105–113. https://doi.org/10.1002/psc.2732
Vlieghe P., Lisowski V., Martinez J., Khrestchatisky M. // Drug Discov. Today. 2010 V. 15. P. 40–56. https://doi.org/10.1016/j.drudis.2009.10.009
Jiang Z., Vasil A.I., Hale J.D., Hancock R.E., Vasil M.L., Hodges R.S. // Biopolymers. 2008. V. 90. P. 369–383. https://doi.org/10.1002/bip.20911
Huang Y.B., Huang J.F., Chen Y.X. // Protein Cell. 2010. V. 1. P. 143–152. https://doi.org/10.1007/s13238-010-0004-3
Bechinger B., Gorr S.U. // J. Dent. Res. 2017. V. 96. P. 254–260. https://doi.org/10.1177/0022034516679973
Matsuzaki K., Sugishita K., Harada M., Fujii N., Miyajima K. // Biochim. Biophys. Acta. 1997. V. 1327. P. 119−130. https://doi.org/10.1016/s0005-2736(97)00051-5
Смирнова М.П., Афонин В.Г., Шпень В.М., Тяготин Ю.В., Колодкин Н.И. // Биоорг. химия. 2004. Т. 30. С. 458–465. [Smirnova M.P., Afonin V.G., Shpen’ V.M. Tyagotin Yu.V., Kolodkin N.I. // Russ. J. Bioorg. Chem. 2004. V. 30. P. 409–416.] https://doi.org/10.1023/B:RUBI.0000043782.21640.c2
Амирханов Н.В., Тикунова Н.В., Пышный Д.В. // Биоорг. химия. 2018. Т. 44. С. 492–505. https://doi.org/10.1134/S0132342318050032 [Amirkhanov N.V., Tikunova N.V., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2018. V 44. P. 492–503.] https://doi.org/10.1134/S1068162018050035
Amirkhanov N.V., Tikunova N.V., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 833–841. https://doi.org/10.1134/S1068162019060037
Chen Y., Mant C.T., Farmer S.W., Hancock R.E., Vasil M.L. Hodges R.S. // J. Biol. Chem. 2005. V. 280. P. 12316–12329. https://doi.org/10.1074/jbc.m413406200
Schiffer M., Edmundson A.B. // Biophys. J. 1967. V. 7. P. 121–135. https://doi.org/10.1016/S0006-3495(67)86579-2
Chan W.C., White P.D. // Fmoc Solid Phase Peptide Sythesis: a Practical Approach / Eds. Chan W.C., White P.D. Oxford: IRL Press, 2000. P. 64–66.
Amirkhanov N.V., Zhang K., Aruva M.R., Thakur M.L., Wickstrom E. // Bioconjug. Chem. 2010. V. 21. P. 731–740. https://doi.org/10.1021/bc900523c
Амирханов Н.В., Амирханов Р.Н., Зарытова В.Ф. // Биоорг. химия. 2012. Т. 38. С. 692–705. [Amirkhanov N.V., Amirkhanov R.N., Zarytova V.F. // Russ. J. Bioorg. Chem. 2012. V. 38. P. 613–624.] https://doi.org/10.1134/s1068162012060027
Khurshid Z., Najeeb S., Mali M., Moin S.F., Raza S.Q., Zohaib S., Sefat F., Zafar M.S. // Saudi Pharm. J. 2017. V. 25. P. 25–31. https://doi.org/10.1016/j.jsps.2016.04.027
Tsai H., Bobek L.A. // Biochim. Biophys. Acta. 1997. V. 1336. P. 367–369. https://doi.org/10.1016/s0304-4165(97)00076-7
Oppenheim F.G., Xu T., McMillian F.M., Levitz S.M., Diamond R.D., Offner G.D., Troxler R.F. // J. Biol. Chem. 1988. V. 263. P. 7472–7477. https://doi.org/10.1016/S0021-9258(18)68522-9
Helmerhorst E.J., Reijnders I.M., van’t Hof W., Simoons-Smit I., Veerman E.C., Amerongen A.V. // Antimicrob. Agents Chemother. 1999. V. 43. P. 702–704. https://doi.org/10.1128/aac.43.3.702
Xu T., Levitz S.M., Diamond R.D., Oppenheim F.G. // Infect. Immun. V. 1991. V. 59. P. 2549–2554. https://doi.org/10.1128/iai.59.8.2549-2554.1991
Lin A.L., Shi Q., Johnson D.A., Patterson T.F., Rinaldi M.G., Yeh C.K. // Clin. Diagn. Lab. Immunol. 1999. V. 6. P. 851–855.
Qin Y., Zhang L., Xu Z., Zhang J., Jiang Y.Y., Cao Y., Yan T. // Virulence. 2016. V. 7. P. 512–526. https://doi.org/10.1080/21505594.2016.1138201
Puri S., Edgerton M. // Eukaryot. Cell. 2014. V. 13. P. 958–964. https://doi.org/10.1128/ec.00095-14
Jacobsen F., Mohammadi-Tabrisi A., Hirsch T., Mittler D., Mygind P.H., Sonksen C.P., Raventos D., Kristensen H.H., Gatermann S., Lehnhardt M., Daigeler A., Steinau H.U., Steinstraesser L. // J. Antimicrob. Chemother. 2007. V. 59. P. 493–498. https://doi.org/10.1093/jac/dkl513
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия