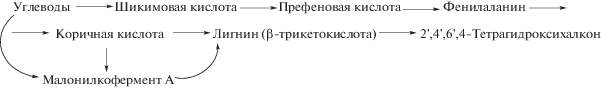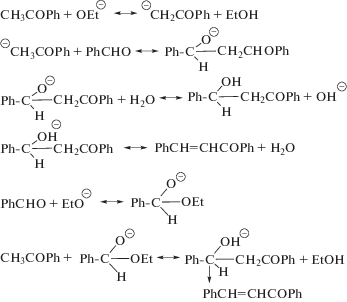Биоорганическая химия, 2021, T. 47, № 3, стр. 304-314
Биологически активные природные 2'-гидроксихалконы
Г. О. Исмаилова 1, *, Н. М. Юлдашев 1, Х. Н. Акбарходжаева 1, М. М. Шертаев 1, З. К. Зиямутдинова 1
1 Ташкентский педиатрический медицинский институт
100140 Ташкент, ул. Богишамол, 223, Узбекистан
* E-mail: gulzira@mail.ru
Поступила в редакцию 27.05.2020
После доработки 06.10.2020
Принята к публикации 17.10.2020
Аннотация
Приведены современные данные литературы о результатах исследований в области флавоноидов лекарственных растений, данные об особенностях биогенеза, общая характеристика, возможные функции, биологические свойства и аспекты практического применения 2′-гидроксихалконов. Систематизация проведена по наиболее распространенным структурам выделенных 2′-гидроксихалконов и их производных из 59 источников природного сырья.
ВВЕДЕНИЕ
Повышенный интерес к изучению флавоноидов, проявляемый учеными и специалистами различных направлений, объясняется важной ролью, которую играют эти соединения в жизнедеятельности растительных и животных организмов, а также их высокой и разноплановой биологической активностью. По сравнению с другими типами флавоноидов, халконам свойствен более широкий диапазон физиологических воздействий на организм.
Халконы – α,β-ненасыщенные кетоны, состоящие из двух ароматических колец (A и B), имеющих различные заместители. Химия халконов изучается уже не одно десятилетие, и интерес к этой области продолжает расти.
Халконы придают желтый цвет некоторым декоративным растениям, таким как георгин, Coreopsis, Cosmos (Asteraceae) и львиный зев (Antirrhinum majus, Scrophulariaceae). Желтая окраска цветков Dahlia variabilis, в основном, обусловлена наличием 4'-малонилглюкозидов 6'-дезоксихалконов, изоликвиритигенина и бутеина (3,4,2',4'-тетрагидроксихалкона). Они содержатся во многих фруктах (цитрусовые, яблоки, помидоры и т.д.), овощах (лук-шалот, ростки фасоли, картофель и т.д.), а также в некоторых съедобных растениях (солодкa) из нашего повседневного рациона. Эта группа природных соединений обладает широким спектром биологической активности, совместимой с антиканцерогенной активностью, включая антиоксидантную, противовоспалительную и стимуляцию остановки клеточного цикла и апоптоза [1].
В растениях семейства бобовых чаще всего встречаются 2'-гидроксихалконы. Эти соединения практически лишены токсичности. Сочетание малой токсичности и высокой биологической активности делает 2'-гидроксихалконы перспективными для использования в медицинской практике в качестве препаратов для профилактики и лечения ряда серьезных заболеваний.
Цель работы – обобщить и систематизировать данные литературы для разработки новых подходов в области синтеза новых производных 2'-гидроксихалконов с разнообразным набором функциональных групп как перспективных биологически активных соединений.
БИОГЕНЕЗ ХАЛКОНОВ
Нумерация 2'-гидроксихалконов производится согласно схеме 1 .
Схема 1 . 2'-Гидроксихалкон.
Разнообразие халконов обусловлено, прежде всего, различными заместителями в кольцах А и В. Практически каждый атом этих колец может иметь гидроксильную группу. Кроме того, каждый гидроксил может быть метилирован с образованием метоксильной группы. Халконы могут присутствовать в растениях как в свободном, так и в связанном виде.
Классификация халконов основывается на современных представлениях о биосинтезе фенольных соединений. C помощью меченых атомов 14С было показано, что важным звеном в биосинтезе халконовых соединений выступает коричная кислота, образующаяся в растениях из фенилаланина. Следующее звено биосинтеза – образование 2'‑гидроксихалкона.
Флороглюциновое ядро А образуется по ацетатному механизму – конденсацией трех молекул уксусной кислоты с участием ацетилкофермента А или малонилкофермента А. Звено С6-С3 (цикл В) происходит от шикимовой кислоты. Радиоизотопный метод указывает на то, что биогенетический путь образования этой части молекулы протекает через шикимовую и префеновую кислоты с образованием фенилаланина и коричной кислоты, которая присоединяет триацетатное производное (цикл А), образуя халкон (схема 2 ).
Схема 2 . Получение флавоноидов из халкона (биогенез).
При биогенезе предшественниками флавоноидов различных типов с различной степенью окисления выступают халконы, а не флаваноны. Значит, фенилаланин внедряется через халкон как во флаваноиды, так и в изофлаваноиды. Обрабатывая различные растения меченым халконом, удаeтся получать флаваноиды различных типов, как показано на схеме 2 .
Исследования с мечеными изотопами подтвердили, что в биогенезе различных флавоноидов центральное положение занимают первично образующиеся халконы, из них образуются различные дифенилпропаноиды.
В соответствии с классификацией приведены данные литературы о синтезе важнейших халконов и их распространении в растениях [2]. Флавоноиды и изофлавоноиды, биогенетическими предшественниками которых являются халконы, целесообразно рассматривать в рамках общей классификации лишь с точки зрения биосинтеза. 2'-Гидроксихалконы также являются биогенетическими предшественниками ауроновых соединений [3].
Применение меченых предшественников позволяет выяснить, на каких стадиях биогенеза происходит гидроксилирование, метилирование, глюкозилирование и пренилирование природных изофлаваноидов.
Для синтеза флавоноидов халконы обычно получают щелочной конденсацией Кляйзена–Шмидта 2-гидроксиацетофенонов с ароматическими альдегидами в спирте в классическом варианте. Механизм образования халконов в присутствии основного катализатора представлен на схеме 3, в кислотном катализе – на схеме 4.
Таким образом, применение изотопной техники позволяет выяснить, что общим генетическим носителем для флавоноидов и изофлавоноидов является первично образующийся халкон.
Схема 3 . Механизм образования халконов в присутствии основного катализатора.
Схема 4 . Механизм образования халконов в кислотном катализе.
ОБЩАЯ ХАРАКТЕРИСТИКА 2′-ГИДРОКСИХАЛКОНА
У названия 2'-гидроксихалконов есть следующие синонимы: (2Е)-1-(2-гидроксифенил)-3-фенилпроп-2-ен-1-он; О-гидроксихалкон; бензилиден-(2-гидроксиацетофенон); бензилиден-2'-гидроксиацетофенон; 2-бензал-2'-гидроксиацетофенон; 2-бензилиден-2'-гидроксиацетофенон; 2‑гидроксибензалацетофенон.
С15H12O2; Mr 224; цвет кристаллов ярко-желтый; т. пл. 144–150°С; плотность 1.191 ± ± 0.060 г/см3 (20°C, 760 мм рт. ст.); показатель преломления 1.654; Rf 0.78 (толуол : этилацетет 1 : 1). УФ-спектр (λ-максимум, нм), полученный на приборе СФ-2000 в кислой среде (рН 4) – 330, нейтральной (рН 7) – 248, 320, щелочной (рН 11) – 294, 400. Полосы поглощения длинноволновой части спектра 331–428 нм обусловлены π → π* электронными переходами в циннамоильной части молекул халконов по схеме 5 а. Полосы поглощения в более коротковолновой части спектра (200–300 нм) соответствуют электронным переходам с участием карбонильной группы (бензоильная часть молекул) по схеме 5 б.
Схема 5 . УФ-спектр 2'-гидроксихалкона.
2'-Гидроксихалконы окисляются быстро при температуре 20°С.
МС: тип прибора IT/ионная ловушка; энергия столкновения 0; масс-спектр типа MS2; тип прекурсора [М + Н]+; прекурсор m/z 225.091; всего пиков 14; m/z вершина пика 210.1; m/z 2‑й наивысший 207.1; m/z 3-й наивысший 121.1 (схема 6 ) [4].
Схема 6 . Масс-спектр 2'-гидроксихалкона. Фрагменты МС/МС, отображаются верхние пики.
ПРИРОДНЫЕ 2'-ГИДРОКСИХАЛКОНЫ
За последнeе десятилетие из природного сырья (98 источников) нами были изучены новые производные халконов [2]. Большая часть их была обнаружена у растений семейств Myristicaceae, Angiosperm, Moraceae, Fabaceae и Annonaceae. Данный обзор является дополнительным изучением производных 2'-гидроксихалконов, выявленных в листьях, стеблях, древесине, корнях, цветках и семенах лекарственных растений (табл. 1).
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ПРИРОДНЫХ 2'-ГИДРОКСИХАЛКОНОВ
Известно, что многие соединения халконовой структуры выполняют защитную функцию [5], функции дыхательных катализаторов, участвуют в окислительно-восстановительных процессах при дыхании растительных клеток.
Халконы, содержащие в бензольном кольце ацетамидную группу в положении 4, проявляют значительную антиноцицептивную активность [6]. Дигидроксопроизводные халконов с о- и п‑расположением ОН-групп проявляют высокую антиоксидантную активность [7]. Положение двух гидроксильных групп в бензольном кольце В халкона является важным структурным фактором их антирадикальной активности [8]. Вицинально диоксигенированные халконы, а также халконы с цепью пропаноламина в п-положении проявляют высокую антигипергликемическую активность [9], хлорсодержащие халконы – антипротозойную [10, 11] и антиплазмодиальную активность [12, 13], а халконы с триазольным, пиррольным и бензотриазольным кольцами – антипаразитарную активность [8]. Присутствие 1,4-диоксанового цикла в структуре приводит к появлению антигепатотоксической активности [14], которая усиливается наличием в положении 2 диоксанового цикла 2-гидроксиметильной группы. Кроме того, халконы проявляют свойства, схожие с инсулином, что говорит о возможности применения халконов в качестве противодиабетических средств. Так, исследования метилгидроксихалкона, выделенного из корицы (Cinnamomum verum, Lauraceae), показали, что этот халкон способствует снижению темпов развития диабета и его осложнений [9]. Антилейшманиальная активность [15, 16] характерна для халконов с более гидрофильным характером, т.е. для НО-производных халконов, а также для халконов с нафталиновым и пиридиновым фрагментами в ядре А.
Исследован ряд халконов, содержащих бор, в качестве противораковых средств и выяснены механизм их действия [17–19]. Изучена ингибирующая активность тиразиназы ряда халконов в отношении реакций образования меланина и их антиоксидантные возможности [20]. Исследована активность производных 2′,5′-дигидроксихалконов и обнаружено, что большинство халконов проявляют цитотоксическую активность против различных линий опухолевых клеток [13, 21]. К интересным свойствам халконов относятся инициирование апоптоза раковых клеток [13, 22] и угнетение их митохондриального дыхания.
Помимо указанных видов активности, выявлены ларвицидная [23], иммуномодулирующая [24], антимитотическая активности [11] халконов. Показано также ингибирующее действие на ферменты α-амилазы млекопитающих [25], циклооксигеназы [26], моноаминоксидазы [27], тирозиназы [28, 29] и др. Халконы обладают антибактериальной [30–35], противовирусной [36], антиплазматической [37–39], противогрибковой [40, 41], эстрогенной [13, 42–49], противовоспалительной [41, 50], антиишемической, антиспазматической [50], ингибиторной [48, 51–53], ферментативной [54] и фитохимической активностью [31]. Показано наличие антипролиферативной активности [49, 55] при высоких концентрациях (10, 50 мкМ), а при низких концентрациях (0.01–1.00 мкМ) халконы ускоряли клеточный рост. За проявление противовоспалительной активности халконов ответственна α,β‑ненасыщенная карбонильная функциональная группа. Халконы обладают способностью укреплять капилляры и могут использоваться в качестве противовоспалительных средств [56, 57].
Сравнительно недавно показано, что 1,3-дифенил-2-пропен-1-оны с оксатиолоновым циклом помимо цитотоксичности проявляют активность в отношении Micobacterium tuberculosis H37Rv [9, 13, 31, 58, 59].
Халконы используются как ингибиторы агрегации тромбоцитов, липоксигеназ и ароматаз [44], как светочувствительные компоненты в фоторезистах, флуоресцентные зонды в медицинской диагностике, органические материалы для нелинейных оптических кристаллов [31]. Показано, что халконы вносят преобладающий вклад в ингибирование ВАСЕ1 со значениями IC50 = 6.03 мкМ из этилацетатной фракции, значит, обладая низкой молекулярной массой и липофильными фрагментами (пренильные и лавандулильные группы), халконы могут быть сильными профилактическими и терапевтическими кандидатами для лечения болезни Альцгеймера [60].
Обоватахалкон, выделенный из Tephrosia obovata, проявил умеренную пищеварительную активность против гольца Misgurnus angullicaudatus [13]. Тефрозон из Tephrosia purpurea был оценен на предмет потенциальных химиопрофилактических свойств при раке с использованием анализа клеточной индукции хинонредуктазы [13]. Тефропурпурин был получен как активное соединение из Tephrosia purpurea и использован для анализа индукции активности хинонредуктазы (QR) с использованием культивированных клеток гепатомы мыши Hepa 1c1c7 [13].
Изобавахалкон, ксантоангелол и 4-гидроксидерицин, выделенные из надземных частей листа Angelica keiskei, проявили сильную ингибирующую активность в отношении мальтазы дрожжей со значениями IC50 = 20, 32, 11.54 и 33.76 мкМ соответственно [61]. Брусохалкон A и брусохалкон B, выделенные из корней Broussonetia papyrifera, оказывали дозозависимое ингибирующее действие на дрожжевую α-глюкозидазу со значениями IC50 = 5.3 и 11.1 мкМ [61].
2',4,4',2''-Тетрагидрокси-3'-(3''-метилбут-3''-енил)халкон, выделенный из этанольного экстракта листьев Maclura tinctoria (L.) Gaud., был оценен против оппортунистических грибковых патогенов, связанных со СПИДом [29]. Ксантоангелол и 4-гидроксидерицин из Angelica keinskei проявили антибактериальную (против грамположительных патогенных бактерий) и противоязвенную активность [29]. Ксантоангелол из коры стебля Artocarpus kemando проявляет активность разрыва цепи ДНК [29]. Ксантохумол и пять других родственных веществ из Humulus lupulus – 2',4,4',6-тетрагидрокси-3'-пренилхалкон, 2',4,4',6-тетрагидрокси-3'-геранилхалкон, дегидроциклоксантохумол, ксантогумол B и изоксантогумол – прошли испытания на их антипролиферативную активность в клетках ракa груди человека (MCF-7), рака толстой кишки (HT-29) и рака яичников (A-2780) in vitro [29]. Изокордоин и 2',4'-дигидроксихалкон из Monotes africanus проявляли ингибирующую активность в отношении ВИЧ [29].
ЗАКЛЮЧЕНИЕ
Обобщение и систематизация литературных данных показали, что ценные фармакологические свойства 2'-гидроксихалконов, обладающих широким спектром биологического действия, позволяют использовать результаты исследований последнего десятилетия для разработки новых подходов к решению задачи повышения биологической активности этого класса соединений. Появляются возвожности для разработки подходов к синтезу как природных 2'-гидроксихалконов, так и их модифицированных аналогов с прогнозируемой биологической активностью.
Путем изменения строения молекул халконов можно увеличить абсолютные показатели их активности в биологических тестах. Данные этой статьи о биологической активности и химическом составе могут возобновить интерес фармакологов и фитохимиков к этому классу соединений.
Таблица 1.
Природные производные 2'-гидроксихалконов (данные литературы с 2000 г.)
| № | Источники | Халконы и их производные |
|---|---|---|
| 1 | Averrhoa carambola L. (Oxalidaceae), листья [62] | C-гликозиды дигидрохалкона |
| 2 | Angelica keiskei (Umbelliferae), листья и корни [29, 61, 63] | Изобавахалкон; ксантоангелол F и G; 4-гидроксидерицин; 2',4',4-тригидрокси-3'-[2-гидрокси-7-метил-3-метилен-6-октаенил]халкон; 2',4',4-тригидрокси-3'-генарилхалкон; 2',4',4-тригидрокси-3'-[6-гидрокси-3,7-диметил-2,7-октаенил]халкон; 2',4-дигидрокси-4'-метокси-3'-[2-гидроперокси-3-метил-3-бутенил]халкон; 2',4-дигидрокси-4'-метокси-3'-генарилхалкон; 2',4-дигидрокси-4'-метокси-3'-[3-метил-3-бутенил]халкон |
| 3 | Anthyllis hermanniae, надземные части [29] | Антиллизон; антиллин |
| 4 | Artocarpus kemando, кора стебля [29] | Ксантоангелол; изоликвиритигенин (2',4,4'-тригидроксихалкон) |
| 5 | Artocarpus nobilis (Moraceae) [64] | 2',4',4-Тригидрокси-3'-геранилхалкон; 2',4',4-тригидрокси-3'-[6-гидрокси-3,7-диметил)-2′(Е),7-этадиенил]халкон; 2',4',4-тригидрокси-3'-[2′-гидрокси-7-метил-3-метилен-6-этаенил]халкон; 2',3,4,4'-тетрагидрокси-3'-геранилхалкон; 2',3,4,4'-тетрагидрокси-3'-[6-гидрокси-3,7-диметил-2(Е),7-октадиенил]халкон |
| 6 | Broussonetia papyrifera (Moraceae), корни [29, 61, 65] | Брусохалкон A и В; изогемихалкон C; 3'-[γ-гидроксиметил-(E)-γ-диметилаллил]-2,4,2',4'-тетрагидроксихалкон 11'-окумарат |
| 7 | Carthamus arborescens [64] | 2',4'-Диацетоксихалкон |
| 8 | Calea uniflora [66] | Бутеин; α-гидроксибутеин; бутеин-4'-O-глюкопиранозил |
| 9 | Cedrelopis grevei (Ptaeroxylaceae), фрукты и семена [64] | Флавокавин B; 2'-метоксигеликраузихалкон; цедредипренон |
| 10 | Cinnamomum verum (Lauraceae) [9] | Метилгидроксихалкон |
| 11 | Coreopsis tinctoria, цветы [67] | Оканин; оканин-4'-глюкозид |
| 12 | Cleistocalyx operculatus, почва [64, 68] | 2',4'-Дигидрокси-6'-метокси-3',5'-диметилхалкон |
| 13 | Cryptocarya konishii, древесина [69] | 2'-Гидроксихалкон; десметилинфектокарион |
| 14 | Dahlia variabilis, цветы [67] | 4'-Малонилглюкозид-6'-дезоксихалкон; изоликвиритигенин; бутеин-(3,4,2',4'-тетрагидроксихалкон) |
| 15 | Dalea versicolor [64] | 2',4'-Дигидрокси-3',5'-диметил-6'-метоксихалкон |
| 16 | Derodendron phlomidis (Verbenaceae), корни и цветки [70] | 4,4'-бис-α-D-глюкозил-4,2',4'-тригидрокси-6'-метоксихалкон (агликон) |
| 17 | Derris indica, корни [61] | Понгамол; овалитенон |
| 18 | Dorstenia kameruniana, листья [29] | 3,4-4',5'-бис(2,2-диметилхромано)-2'-гидроксихалкон |
| 19 | Dorstenia prorepens, ветки [29] | 5,3'-Ди-(3,7-диметил-2,6-октадиенил)-3,4,2',4'-тетрагидроксихалкон |
| 20 | Dorstenia zenkeri [29] | 3',4'-(3-Гидрокси-2,2-диметилдигидропирано)-4,2'-дигидроксихалкон |
| 21 | Dorstenia barteri [29] | Изобавахалкон; 4,2',4'-тригидрокси-3,3'-дипренилхалкон |
| 22 | Empetrum nigrum L. (Empetraceae) [71] | 2'-Метокси-4'-гидрокси-α,β-дигидрохалкон |
| 23 | Guibourtia tessmanii, кора ствола [72] | Дигидрохалконглюкозид; 2',4-дигидрокси-4'-метокси-6'-O-β-глюкопиранозид-дигидрохалкон |
| 24 | Glycyrrhiza glabra [29] | 2',4,4'-Тригидрокси-3-(3-метилбут-2-енил)-халкон (ликоагрохалкон A); ликоагрохалконы B, C и D |
| 25 | Glycyrrhiza inflata, корни [64] | Лакохалкон А и E; 5-фенилбутеин; изоликвиритигенин; ликоагрохалкон А; канзонол С |
| 26 | Helichrysum gymnocephalum (DC) Humbert. [12] | Гимнохалкон (α-терпинеол-пиноцембрин-халкон) |
| 27 | Helichrysum gymnocomum, цветы [64] | 4',6',8-Тригидроксихалкон; 2-гидрокси-4',6'-дибензилоксихалкон |
| 28 | Humulus lupulus [29, 64] | Ксантогумол B; 2',4,4'-тригидрокси-6'-метокси-3'-(γ,γ-диметилаллил)-халкон (ксантохумол); дегидроциклоксантохумол; пренилксантогумол; десметилксантогумол; 2',4,4',6-тетрагидрокси-3'-геранилхалкон; 2',4,4',6-тетрагидрокси-3'-пренилхалкон |
| 29 | Iryanthera juruensis (Myristicaceae) [64] | 2',4'-Дигидрокси-4,6'-диметоксидигидрохалкон |
| 30 | Lindera umbellata var. membranacea и lancea (Lauraceae), листья или кopa [12] | Линдератин; линдерахалкон; метиллиндератин |
| 31 | Litsea rubescens [64] | Лицейон A |
| 32 | Lonchocarpus subglaucecscens, корни [29] | Глабрахромен (халкон с группой ахромена в кольце A) |
| 33 | Maclura tinctoria (L.) Gaud., листья [29, 64] | 2',4,4',2''-Тетрагидрокси-3'-(3''-метилбутил-3''-енил)халкон; изовахалкон; бакухалкон; 4'-О-β-D-(2''-p-кумароил)гликопиранозил-4,2',3'-тригидроксихалкон; 4'-О-β-D-(2''-p-кумароил)-6''-ацетилгликопиранозил-4,2',3'-тригидроксихалкон; 3'-(3-метил-2 бутенил)-4'-О-β-D-гликопиранозил-4,2'-дигидроксихалкон; 4'-О-β-D-(2''-ацети-6''-циннамоил)гликопиранозил-4,2',3'-тригидроксихалкон |
| 34 | Malotus filippinensis [64] | Маллотофилиппены С, D, E; ксантохумол |
| 35 | Mitrella kentii (Annonaceae), кора ствола [12] | Линдератин |
| 36 | Millettia erythrocalyx, корни [73] | 3,4-Метилендиокси-2',4'-диметоксихалкон |
| 37 | Morus alba, кора [29] | Канзонол C; кураридин |
| 38 | Monotes africanus [29] | Изокордоин; 2',4'-дигидроксихалкон |
| 39 | Morus nigra [29] | 2',4'-Дигидроксихалкон |
| 40 | Psoralea corylifolia Linn., корни, листья, семена [74] | Псорахалкон A; бавахалкон; необавахалкон; изобавахалкон; бакухалкон; бавахроманол; бавахромен; изобавахромен; хроменофлаванон; гидроксилонкокарпин |
| 41 | Pichia membranifaciens [29] | 2'-(2''-Гидроксиизопропил)дигидрофурано [4',5':3',4']-2',4-дигидрокси-6'-метоксихалкон; 2'-(2''-гидроксиизопропил)- дигидрофурано [5',4':2',3']-4,4'-дигидрокси-6'-метоксихалкон |
| 42 | Poinsettifolia engler, трава [29] | Пуансеттифолин A |
| 43 | Plasmodium falciparum (Leguminosae), корни [75] | E-2',6'-Диметокси-3',4'-(2'',2''-диметил)пираноретрохалкон (эквихалкон A); Z-2',6'-диметокси-3',4'-(2'',2''-диметил)пираноретрохалкон (эквихалкон B); 4''-этокси-3''-гидроксипракансон B (эквихалкон C) |
| 44 | Sophora tonkinensis (Fabaceae) [76] | 2',4,4'-Тригидрокси-3,3',5-трис(3-метил-2-бутенил)халкон (софорадин) |
| 45 | Sophora flavescens (Fabaceae) [29, 60, 77] | 2',4',2,4-Тетраокси-6'-метокси-3'-лавандулилхалкон (кураридин) |
| 46 | Solanum lycopersicum (Solanaceae) [78] | Нарингенин халкон; эриодиктиола халкон; флоретин-30,50-ди-C-глюкозид; дигидроксидиметоксихалкон-C-диглюкозид |
| 47 | Tephrosia major Micheli, корни и надземные части [79] | 2',6'-Дигидрокси-3'-пренил-4'-метокси-β-гидроксихалкон |
| 48 | Tephrosia сandida (Leguminosae) [13] | Кандидахалкодин; тефрон |
| 49 | Tephrosiapurpurea [13] | О-Метилпонгамол; (+)-тефрозон; (+)-тефропурпурин; пурпуритенин; 6'-деметоксипракансон B |
| 50 | Tephrosia pulcherrima [13] | (+)-Тефрозон; (+)-тефропурпурин; фрозон; 2',6'-диметокси-4',5'-(2''2'-диметил)пиранохалкон |
| 51 | Tephrosia elata [13] | (+)-Тефропурпурин; (S)-елатадигидрохалкон |
| 52 | Tephrosia praecans [13] | 2',6'-Диметокси-4',5'-(2'',2'-диметил)пиранохалкон; прекансон А и B |
| 53 | Tephrosia obovata [13] | Обоватахалкон |
| 54 | Tephrosia spinosa [13] | Спинохалкон С, А и В; 3',5'-диизопентенил-2',4'-дигидроксихалкон |
| 55 | Tephrosia crassifolia [13] | (4'',5''-Дигидро-3'-гидрокси-6'-метокси-изопропенилдигидрофуран(2'',3'',4',3')-халкон)крассихалкон |
| 56 | Tephrosia woodii [13] | Оахакацин |
| 57 | Tephrosia tunicate, корни [13, 29] | 3',3'-Ди-(γ-диметилаллил)-2',4'-ди-оксо-енол-халкон(туникатахалкон) |
| 58 | Tephrosia carrollii [13] | Эпоксидная смола обоватахалкон |
| 59 | Zuccagnia punctate [64] | 2',4'-Дигидрокси-3'-метоксихалкон; 2',4'-дигидроксихалкон |
Список литературы
Michael S., Marc D. // Epigenetic Cancer Therapy. 2015. P. 393–425. https://doi.org/10.1016/B978-0-12-800206-3.00018-5
Исмаилова Г.О., Каримова Ш.Ф., Зиямутдинова З.К., Баходирова М. А. // Альманах современной науки и образования. 2016. № 10 (112). Тамбов: Грамота. С. 36–45.
Попова А.В., Бондаренко С.П., Фрасинюк М.С. // Химия гетер. соедин. 2019. Т. 55(4/5). С. 285–299.
Панасенко А.И. // Вестник ТГУ. 2010. Т. 15. Вып. 1. С. 62–64.
Бондакова М.В. // Разработка рецептуры и технологии производства косметических изделий с использованием экстракта винограда: Дис. канд. техн. наук: 05.18.06. Защищена 14.03.2014. Утв. 2014; 04201456077. М., 2014. 171 с.: ил. Библиогр.: С. 25–26.
Gouveia M.G., Xavier M.A., Barreto A.S., Gelain D.P., Santos J.P., Araújo A.A., Silva F.A., Quintans J.S., Agra M.F., Cabral A.G., Tavares J.F., Silva M.S., Quintans-Júnior L.J. // J. Med. Food. 2011. V. 14. № 11. P. 1389–1396. https://doi.org/10.1089/jmf.2010.0212
Anderson A. // J. Am. Coll. Nutr. 2001. V. 20. № 4. P. 327–336.
Степкина Н.Н., Великородов А.В. // Фундаментальные исследования. 2015. № 11. Ч. 3. Россия. С. 505–510. https://doi.org/10.17513/fr.39449
Satyanarayama M., Tiwari P., Tripathi K., Srivastava A.K., Pratap R. // Bioorg. Med. Chem. 2004. V. 12. P. 883–889. https://doi.org/10.1016/j.bmc.2003.12.026
Ramirez I., Carabot A., Melendez P., Carmona J., Jimenez M., Patel A.V., Crabb T.A., Blunden G., Cary P.D., Croft S.L., Costa M. // Phytochemistry. 2003. V. 64. P. 645–647. https://doi.org/10.1016/s0031-9422(03)00241-3
Lunardi F., Guzela M., Rodrigues A.T., Corre R., Eger- Mangrich I., Steindel M., Grisard E.C., Assreuy J., Calixto J.B., Santos A.R. // Antimicrobial Agents and Chemotherap. 2003. V. 47. P. 1449–1451.
Фабр П., Пуани С., Белобр Ф., Мандо А. Монотерпеновые производные халькона или дигидрохалькона и их применение в качестве депигментирующих агентов. № 0002595860; № 216.015.509E. Заявлено 27.08.2016. Опубл. 13.01.2020 // Открытия. Изобретения. 2020.
Yinning C., Tao Y., Chenghai G., Wenhao C., Riming H. // Molecules J. 2014. V. 19. P. 1432–1458. https://doi.org/10.3390/molecules19021432
Khan S.A., Ahmed B., Alam T. // Pak. J. Pharm. Sci. 2006. V. 19. P. 290–294.
Jun N., Hong G., Jun K. // Bioorg. Med. Chem. 2007. V. 15. P. 2396–2402. https://doi.org/10.1016/j.bmc.2007.01.017
Liu M., Wiliarat P., Croft S.L. // Bioorg. Med. Chem. 2003. V. 11. P. 2729–2738. https://doi.org/10.1016/S0968-0896(03)00233-5
Achanta G., Modzelewska A., Feng L., Khan S.R., Huang P.A. // Mol. Pharmacol. 2006. V. 70. P. 426–433. https://doi.org/10.1124/mol.105.021311
Echeverria C., Santibanez J.F., Donoso-Tauda O., Escobar C.A., Tagle R.R. // Int. J. Mol. Sci. 2009. V. 10. P. 221–231. https://doi.org/10.3390/ijms10010221
Romagnoli R., Baraldi P.G., Carrion M.D., Cara C.L., Cruz-Lopez O., Preti D. // Bioorg. Med. Chem. 2008. V. 16. P. 5367–5376. https://doi.org/10.1016/j.bmc.2008.04.026
Meng C.Q., Zheng X.S., Ni L., Ye Z., Simpson J.E., Worsencroft K.J., Hotema M.R., Weingarten M.D., Skudlarek J.W., Gilmore J.M., Hoong L.K., Hill R.R., Marino E.M., Suen K.L., Kunsch C., Wasserman M.A., Sikorski J.A. // Bioorg. Med. Chem. Lett. 2004. V. 14. P. 1513–1517. https://doi.org/10.1016/j.bmcl.2004.01.021
Nam N.H., Kim Y., You Y.J., Hong D.H., Kim H.M., Ahn B.Z. // Eur. J. Med. Chem. 2003. V. 38. P. 179–187. https://doi.org/10.1016/S0223-5234(02)01443-5
Sabzevarib O., Galati G., Moridani M.Y. Siraki A., O’Brien P.J. // Chem.-Biol. Interactions. 2004. V. 148. P. 57–67.
Begum N.A., Roy N., Laskar R.A., Roy K. // Med. Chem. Res. 2011. V. 20. P. 184–191. https://doi.org/10.1007/s00044-010-9305-6
Barford L., Kemp K., Hansen M., Kharazmi A. // Int. Immunopharmacol. 2002. V. 2. P. 545–550.
Najafian M., Ebrahim-Habibi A., Hezareh N., Yaghmaei P., Parivar K., Larijani B. // Mol. Biol. Rep. 2010. V. 10. P. 271–274.
Zarghi A., Zebardast T., Hakimion F., Shirazi F.H., Rao P.N.P., Knaus E.E. // Bioorg. Med. Chem. 2006. V. 14. P. 7044–7050. https://doi.org/10.1016/j.bmc.2006.06.022
Chimenti F., Fioravanti R., Bolasco A., Chimenti P., Secci D., Rossi F., Yanez M., Francisco O.F., Ortuso F., Alcaro S. // J. Med. Chem. 2009. V. 49. P. 4912–4925.
Khatib S., Nerua O., Musa R., Shmnell M., Tamir S., Vaya J. // Bioorg. Med. Chem. 2005. V. 13. P. 433–441.
Bruno B., Alberto V., Pilar M., Domenico M., Giuliano D.M. // Curr. Med. Chem. 2005. V. 12. № 6. P. 713–739. https://doi.org/10.2174/0929867053202241
Hatano T., Kusudo M., Inada K., Ogawa T., Shiota S., Tsuchiya T., Yoshida T. // Phytochemistry. 2005. V. 66. P. 2047–2055.
Шмуйлович К.С. // Взаимодействие полифторированных халконов с бинуклеофильными реагентами: Дис… канд. хим. наук: 02.00.03. Защищена 27.06.2014. Утв. 2014. Новосибирск. 2014. 117 с.: ил. Библиогр.: С. 4–5.
Tiwari K.N., Monserrat J.-P., Arnaud Hequet A., Ganem-Elbaz C., Cresteil T., Jaouen G., Vessières A., Hillard E.A., Jolivalt C. // Dalton Trans. 2012. V. 41. P. 6451–6457.
Bhatia N.M., Mahadik K.R., Bhatia M.S. // Chem. Papers. 2009. V. 63. P. 456–463. https://doi.org/10.2478/s11696-009-0026-6
Hamdi N., Fischmeister C., Puerta M.C., Valerga P. // Med. Chem. Res. 2011. V. 20. P. 522–530. https://doi.org/10.1007/s00044-010-9326-1
Bonakdar A.P.S., Sadeghi A., Aghaei H.R., Beheshtimaal K., Nazifi S.M.R., Massah A.R. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 371–381.https://doi.org/10.1134/S1068162020030048
Dao T.T., Nguyen P.H., Lee H.S., Kim E., Park J., Lim S., Oh W.K. // Bioorg. Med. Chem. Lett. 2011. V. 21. P. 294–298. https://doi.org/10.1016/j.bmcl.2010.11.016
Yenesew A., Induli M., Derese S., Midiwo J.O., Heydenreich M., Peter M.G., Akala H., Wangui J., Liyala P., Waters N.C. // Phytochemistry. 2004. V. 65. P. 3029–3032. https://doi.org/10.1016/j.phytochem.2004.08.050
Portet B., Fabre N., Roumy V., Gornitzka H., Bourdy G., Chevalley S., Sauvain M., Valentin A., Moulis C. // Phytochemistry. 2007. V. 68. P. 1312–1320. https://doi.org/10.1016/j.phytochem.2007.02.006
Yenesew A., Derese S., Midiwo J.O., Oketch-Rabah H.A., Lisgarten J., Palmer R., Heydenreich M., Peter M.G., Akala H., Wangui J., Liyala P., Waters N.C. // Phytochemistry. 2003. V. 64. P. 773–779. https://doi.org/10.1016/s0031-9422(03)00373-x
Jayasinghe L., Balasooriya B.A.I.S., Padmini W.C., Hara N., Fujimoto Y. // Phytochemistry. 2004. V. 65. P. 1287–1290.
Epifano F., Genovese S., Menghini L., Curini M. // Phytochemistry. 2007. V. 68. P. 939–953. https://doi.org/10.1016/j.phytochem.2007.01.019
Jayasinghe L., Rupasinghe G., Hara N., Fujimoto Y. // Phytochemistry. 2006. V. 67. P. 1353–1358.
Apak R., Guclu K., Demirata B., Ozyurek M., Celik S.E., Bektasoglu B., Berker K.I., Ozyurt D. // Mol. J. 2007. V. 12. P. 1496–1547. https://doi.org/10.3390/12071496
Bajgai E.S., Prachyawarakarn V., Mahidol C., Ruchirawat S., Kittakoop P. // Phytochemistry. 2011. V. 72. P. 2062–2067.
Stevens J.F., Page J.E. // Phytochemistry. 2004. V. 65. P. 1317–1330. https://doi.org/10.1016/j.phytochem.2004.04.025
Prachayasittikul S., Buraparuangsang P., Worachartcheewan A., Isarankura-Na-Ayudhya C., Ruchirawat S., Prachayasittikul V. // Mol. J. 2008. V. 13. P. 904–921. https://doi.org/10.3390/molecules13040904
Куркин В.А., Куркина А.В., Авдеева Е.В. // Рациональное питание, пищевые добавки и биостимуляторы. 2014. № 4. С. 26.
Nerya O., Musa R., Khatib S., Tamir S., Vaya J. // Phytochemistry. 2004. V. 65. P. 1389–1395. https://doi.org/10.1016/j.phytochem.2004.04.016
Calliste C.A., Le Bail J.C., Trouilas P., Pouget C., Habrioux G., Chulia A.J. // Anticancer Res. 2001. V. 21. P. 3949–3956.
Bo Han, Zheng Q., Wang J., Chen W., Tang H., Qi Wang, Wang X., Ji Li. // XПC. 2010. № 4. C. 443–446.
Martinez-Luis S., Perez-Vasquez A., Mata R. // Phytochemistry. 2007. V. 68. P. 1882–1903. https://doi.org/10.1016/j.phytochem.2007.02.025
Meazza G., Scheffler B.E., Tellez M.R., Rimando A.M., Romagni J.G., Duke S.O., Nanayakkara D., Khan I.A., Abourashed E.A., Dayan F.E. // Phytochemistry. 2002. V. 59. P. 281–288.
Haraguchi H., Tanaka Y., Kabbash A., Fujioka T., Ishizu T., Yagi A. // Phytochemistry. 2004. V. 65. P. 2255–2260. https://doi.org/10.1016/j.phytochem.2004.06.025
Eckermann C., Matthes B., Nimtz M., Reiser V., Lederer B., Boger P., Schroder J. // Phytochemistry. 2003. V. 64. P. 1045–1054. https://doi.org/10.1016/s0031-9422(03)00516-8
dos Santos M.B., Anselmo D.B., de Oliveira J.G., Jardim-Perassi B.V., Monteiro D.A., Silva G., Gomes E., Fachin A.L., Marins M., de Campos Zuccari D.A.P., Regasini L.O. // J. Enzime Inhib. Med. Chem. 2019. V. 34. P. 1093–1099.https://doi.org/10.1080/14756366.2019.1615485
Hsieh H.K., Tsao L.T., Wang J.P., Lin C.N. // J. Pharm. Pharmacol. 2000. V. 52. P. 163–171. https://doi.org/10.1211/0022357001773814
Won S.J., Liu C.T., Tsao L.T., Weng J.R., Ko H.H., Wang J.P., Lin C.N. // Eur. J. Med. Chem. 2005. V. 40. P. 103–112. https://doi.org/10.1016/j.ejmech.2004.09.006
Okunade A.L., Elvin-Lewis M.P.F., Lewis W.H. // Phytochemistry. 2004. V. 65. P. 1017–1032. https://doi.org/10.1016/j.phytochem.2004.02.013
Айтмамбетов А., Ибрагимова З.Ю., Хожамбергенов К., Ибрагимов М.Ю. // Теорет. и клин. медицина. Ташкент. 2006. № 5. С. 184.
Hyun Ah J., Takako Y., Byung-Woo K., Jee H.J., Jae S.Ch. // Am. J. Chin. Med. 2010. V. 38 (2). P. 415–429. https://doi.org/10.1142/S0192415X10007944
Hongyu W., Tingting L., Dejian H. // Adv. Food Nut. Res. 2013. V. 70. P. 103–136. https://doi.org/10.1016/B978-0-12-416555-7.00003-5
Yue Y., Xuchao J., Haihui X., Xiaoyi W. // Phytochemistry. 2020. 174:112364. https://doi.org/10.1016/j.phytochem.2020.112364
Toshihiro A., Harukuni T., Motohiko U., Masao I., Stefan S., Kazuya O., Teruo M., Kenji I., Takashi S., Hoyoku N. // Cancer Lett. 2003. V. 201. P. 133–137. https://doi.org/10.1016/S0304-3835(03)00466-X
Rosa M.P.G., Alethia M.-R., Jahel V.S. // African J. Pharm. Pharm. 2015. V. 9(8). P. 237–257. https://doi.org/10.5897/AJPP2015.4267
Hyung W.R., Mi H.P., Ok-Kyoung K., Doo-Young K., Jung-Yeon H., Yang H. Jo, Kyung-Seop A., Bang Y.H. // Bioorg. Chem. 2019. V. 92. 103233. https://doi.org/10.1016/j.bioorg.2019.103233
Tamires C.L., Rafaela J.S., Alan D.C.S., Milene H.M., Nicole E.B., Andersson B., Mário S., Maique W.B. // Nat. Product Res. 2015. V. 30(5). P. 1–7. https://doi.org/10.1080/14786419.2015.1030740
Øyvind M.A., Monica J. // Comprehensive Nat. Products II. 2010. V. 3. P. 547–614. https://doi.org/10.1016/B978-008045382-8.00086-1
Dykens J.A. // Comprehensive Med. Chem. II. 2007. V. 2. P. 1053–1087. https://doi.org/10.1016/B0-08-045044-X/00071-7
Fera K., Lia D.J., Yana M.S., Sjamsul A.A., Euis H.H., Kiyotaka K., Kaoru K., Kunio T. // J. Nat. Med. 2010. V. 64. P. 121–125. https://doi.org/10.1007/s11418-009-0368-y
Anam Edet M. // Indian J. Chem. B. 1997. V. 36 (10). P. 897–900.
Краснов Е.А., Ермилова Е.В., Кадырова Т.В., Ралдугин В.А., Багрянская И.Ю., Гатилов Ю.В., Друганов А.Г., Семенов А.А., Толстиков Г.А. // ХПС. 2000. № 5. С. 389–391.
Fuendjiep V., Wandji J., Tillequin F., Mulholland D.A., Budzikiewicz H., Fomum Z.T., Nyemba A.M., Koch M. // Phytochemistry. 2002. V. 60(8). P. 803–806. https://doi.org/10.1016/s0031-9422(02)00108-5
Boonchoo S., Kittisak L., Jürgen C., Wolfgang K. // Phytochemistry. 2002. V. 61(8). P. 943–947. https://doi.org/10.1016/s0031-9422(02)00337-0
Lim S.H., Ha T.Y., Ahn J., Kim S. // Phytomedicine. 2011. V. 18. P. 425–430. https://doi.org/10.1016/j.phymed.2011.02.002
Yoseph A., Sandra D., Matthias H., Lois M.-M., Vicky M.A., Máté E., Abiy Y. // Molecules. 2017. V. 22(2). P. 318. https://doi.org/10.3390/molecules22020318
Panthati M.K., Rao K.N.V., Sandhya S., David B. // Brazil. J. Pharmacognosy. 2012. V. 22. P. 1145–1154.
Motahare B., Saba S., Mehrdad I. // Phytother Res. 2019. V. 33(3). P. 546–560. https://doi.org/10.1002/ptr.6265
Handbook of Dietary Phytochemicals / Eds. Xiao J. et al. Springer Nature Singapore Pte Ltd., 2020. https://doi.org/10.1007/978-981-13-1745-3_10-1
Federico G-G., Oswaldo T-V., Gregorio M-T., José S.C. // Zeitschrift für Naturforschung C. 2014. V. 57(7–8). P. 579–583. https://doi.org/10.1515/znc-2002-7-805
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия