Биоорганическая химия, 2021, T. 47, № 3, стр. 365-372
Олигонуклеотидные зонды типа “молекулярный маяк” с флуоресцеиновым бифлуорофором
В. А. Брылёв 1, *, И. Л. Лысенко 2, Е. А. Кокин 1, Ю. В. Мартыненко-Макаев 2, Д. Ю. Рязанцев 1, В. В. Шманай 2, В. А. Коршун 1, 4, 3
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Институт физико-органической химии Национальной академии наук Беларуси
220072 Минск, ул. Сурганова, 13, Республика Беларусь
3 Национальный исследовательский университет “Высшая школа экономики”
117312 Москва, ул. Вавилова, 7, Россия
4 Институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, ул. Б. Пироговская, 11, Россия
* E-mail: v.brylev@yandex.ru
Поступила в редакцию 19.10.2020
После доработки 26.10.2020
Принята к публикации 31.10.2020
Аннотация
Получено азидопроизводное флуоресцеинового бифлуорофора и использовано для синтеза олигонуклеотидных флуорогенных зондов типа “молекулярный маяк” для ПЦР в реальном времени (ПЦР-РВ). На основе оптимизированной последовательности синтезированы восемь вариантов зондов: с одним или двумя остатками тушителя на 3'-конце, с одиночной либо бифлуорофорной флуоресцеиновой меткой, присоединенной с помощью модифицирующих фосфамидитов (короткий линкер) или “клик-реакции” (длинный линкер). Сравнение зондов в ПЦР-РВ показало, что зонды с удвоенным тушителем (одиночный флуоресцеин на коротком линкере) и удвоенным красителем на коротком линкере (одиночный тушитель) несколько превосходят по чувствительности стандартный зонд (одиночный тушитель, одиночный краситель на коротком линкере) на величину ΔCt = 1–2.
ВВЕДЕНИЕ
Флуоресцентные ДНК-зонды, входящие в состав наборов реагентов для качественной и количественной детекции ДНК и РНК, продолжают оставаться мощным инструментом исследований и средством диагностики [1–4]. Одной из наиболее важных областей применения таких зондов выступает полимеразная цепная реакция в реальном времени (ПЦР-РВ) [5]. Данный метод служит для экспресс-детекции и полуколичественного (по порядку величины) анализа генетического материала; наиболее актуально применение ПЦР-РВ в молекулярной диагностике наследственных патологий, генетически модифицированных организмов, микробных и вирусных патогенов, например, ВИЧ [6] и SARS-CoV-2 [7]. В ПЦР-РВ применяют различные типы флуорогенных ДНК-зондов, способных к усилению флуоресценции при взаимодействии с накапливающимся ПЦР-продуктом; флуорогенный эффект достигается в результате взаимодействия двух красителей, один из которых может быть нефлуоресцентным (тушителем) [5, 8]. Для флуорогенных зондов изучается взаимосвязь типа красителя и структуры зонда [9], разрабатываются новые красители [10–12], исследуются зонды с двумя остатками флуоресцентного красителя и/или тушителя флуоресценции [13–15]. Наиболее популярным красителем для ДНК-зондов остается флуоресцеин, присоединяемый в виде карбоксильного производного по аминогруппе того или иного линкера; такой флуоресцеинамид обозначают аббревиатурой FAM. Введение в биоконъюгат нескольких остатков флуоресцеина может привести к значительному самотушению флуоресценции [16]; с другой стороны, прикрепление флуоресцеинов с помощью жесткого линкера предотвращает самотушение [17]. Ранее мы получили FAM-бифлуорофоры на основе 3,5-диаминобензойной кислоты [18, 19]. Целью данной работы стало исследование FAM-бифлуорофора на различных линкерах в сравнении с одиночной флуоресцеиновой меткой в составе флуорогенных олигонуклеотидных зондов типа “молекулярный маяк” для ПЦР-РВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ДНК-зонды типа “молекулярный маяк” (рис. 1) представляют собой олигонуклеотид, несущий на 5'- и 3'-концах флуоресцентный краситель (F) и тушитель (Q), причем 5'- и 3'-концевые области зонда (5–7 нуклеотидов) комплементарны. В результате в водном растворе при комнатной температуре зонд существует преимущественно в виде шпилечной структуры, состоящей из стебля и петли, причем флуорофор и тушитель сближены. Петлевая часть “молекулярного маяка” комплементарна целевой последовательности – мишени (в ПЦР-РВ – продукт ПЦР), и в результате гибридизации с ней шпилька разрушается, красители разобщаются, и происходит разгорание флуоресценции (рис. 1). Мониторинг интенсивности флуоресценции проводят на каждом цикле ПЦР, регистрируя в результате зависимость эмиссии от числа циклов ПЦР.
Рис. 1.
Принцип действия флуорогенного ДНК-зонда “молекулярный маяк”. F – флуоресцентный краситель, Q – тушитель.

В данной работе был использован оптимизированный шпилечный зонд, комплементарный участку амплифицируемого фрагмента гена фактора трансляции 1α гриба Fusarium avenaceum [14]. Нуклеотидная последовательность зонда, структуры его химических модификаций и подходы к синтезу 5-FAM-бифлуорофорных зондов приведены на рис. 2. Зонды MB3 и MB4 (табл. 1) синтезировали с использованием фосфорамидитного реагента (I) [18]. В данной работе получен азидный реагент (V) на основе 5-FAM-бифлуорофора для мечения алкин-модифицированных олигонуклеотидов с помощью Cu(I)-катализируемой реакции циклоприсоединения (“клик-реакция”). Исходную 3,5-ди(трифторацетиламино)бензойную кислоту (II) [20] конденсировали с 3-азидопропиламином [21] с последующим деблокированием аминогрупп аммиаком. Полученный диамин (III) ацилировали пентафторфениловым эфиром дипивалоил-защищенного 5-карбоксифлуоресцеина (IV) [22]. Удаление пивалоильных защитных групп привело к образованию азидного производного 5-FAM-бифлуорофора (V). Последний использовали для модификации алкиновых олигонуклеотидов в растворе с помощью “клик-реакции”; таким образом получены зонды MB7 и MB8 (табл. 1). Зонды с одиночным флуоресцеином получали с помощью 5-FAM-фосфамидита [22] (MB1 и MB2) или “клик”-модификацией алкиновых олигонуклеотидов 5-FAM-азидным реагентом [23] (MB5 и MB6) (табл. 1). Терминальный алкин вводили в олигонуклеотиды с помощью фосфамидитного реагента [24]. Удвоенный тушитель BHQ1 (Q2) вводили в олигонуклеотиды, как описано ранее [13]. Все компоненты зондов представлены на рис. 2. На 3'-конце располагается один или два тушителя BHQ1 (Q), а на 5'-конце могут находиться один или два флуорофора (5-FAM), присоединенные с помощью фосфамидитов или “клик-реакции” с азидными реагентами.
Рис. 2.
Синтез олигонуклеотидных зондов с 5-FAM-бифлуорофором. Pv – пивалоил, Pfp – пентафторфенил, FAM – 5-FAM-флуорофор. (а) – Схема синтеза зондов MB3 и MB4 амидофосфитным способом; (б) – синтез азидопроизводного (V) и зондов MB7 и MB8; (в) – основные компоненты зонда, Q – тушитель, L – линкер, B – разветвляющий фрагмент на основе 3,5-диаминобензойной кислоты. Подчеркнута последовательность зонда, комплементарная мишени; жирным выделены фрагменты, образующие стебель шпильки; (г) – детектируемая последовательность фрагмента гена, кодирующего фактор элонгации трансляции 1α длиной 290 п.н. из Fusarium avenaceum. Подчеркнуты участки, комплементарные праймерам Fat65R и Fat65F; жирным выделен участок гена, связывающийся с зондами MB1–MB8.
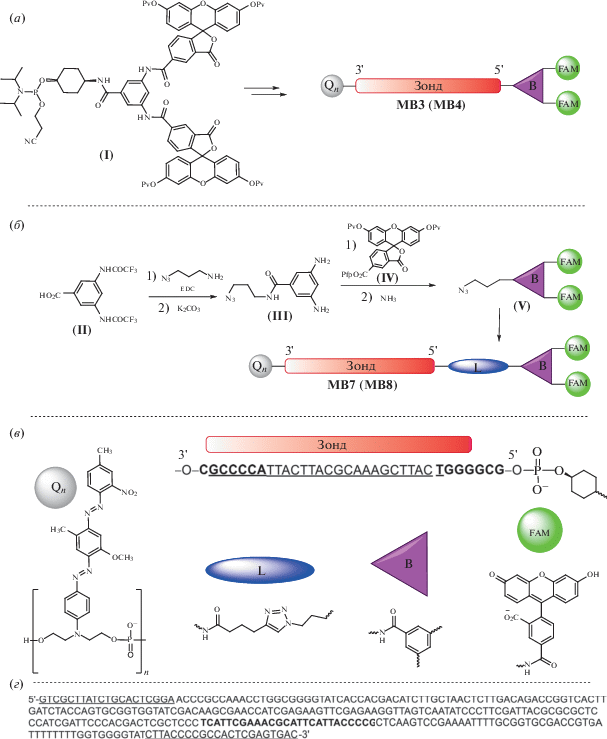
Таблица 1.
Основные характеристики флуорогенных зондов для ПЦР-РВ
| Схема зонда, 3'→5' | Шифр | n | Плавление флуоресцентного зонда | ПЦР-РВ | ||||
|---|---|---|---|---|---|---|---|---|
| детекция при 55°C | детекция при 64°C | |||||||
| Tпл , °C | SBR | относительная фоновая флуоресценция, I0MBi/I0MB1 | относительное усиление флуоресценции, IfMBi/I0MBi | относительная фоновая флуоресценция, I0MBi/I0MB1 | относительное усиление флуоресценции, IfMBi/I0MBi | |||
 |
MB1 | 1 | 65.3 | 10.4 | 1.00 | 2.69 | 1.00 | 1.35 |
| MB2 | 2 | 70.9 | 11.3 | 0.74 | 2.97 | 0.89 | 1.63 | |
 |
MB3 | 1 | 65.6 | 21.6 | 1.31 | 3.17 | 1.17 | 1.72 |
| MB4 | 2 | 71.8 | 7.7 | 1.31 | 1.49 | 0.75 | 1.21 | |
 |
MB5 | 1 | 66.9 | 8.5 | 0.94 | 2.32 | 0.92 | 1.30 |
| MB6 | 2 | 68.5 | 9.1 | 0.88 | 2.07 | 0.52 | 1.40 | |
 |
MB7 | 1 | 66.6 | 3.0 | 2.91 | 1.26 | – | – |
| MB8 | 2 | 73.3 | 4.6 | 0.95 | 1.60 | 0.57 | 1.26 | |
Примечание: температуры плавления зондов (Tпл) определяли с использованием нагревания в термоциклере (20°C→95°C, см. “Эксперим. часть”) как значение в точке максимума первой производной. Значения отношения сигнал/фон (SBR) рассчитаны, как описано в “Эксперим. части”. I0MB1 – начальная (фоновая) интенсивность флуоресценции зонда MB1; I0MBi – начальная (фоновая) интенсивность флуоресценции зондов MB1–MB8; IfMBi – конечная (плато) интенсивность флуоресценции зондов MB1–MB8; значения рассчитаны на основе экспериментов ПЦР-РВ (условия см. в “Эксперим. части”). Все значения приведены как средние величины параметров, полученных в трех повторах каждого эксперимента. Прочерк – данные отсутствуют. Qn – тушитель (один или два – см. значение n), L – линкер, B – разветвляющий фрагмент на основе 3,5-диаминобензойной кислоты.
При нагревании шпилечных зондов в растворе происходит “плавление” стебля, сопровождающееся разгоранием флуоресценции. По максимуму первой производной функции зависимости интенсивности флуоресценции от температуры можно определить температуру плавления зонда (табл. 1). Видно, что структура модификации 5'‑концевой области (линкер и число остатков 5‑FAM) практически не влияет на температуру плавления зонда. Напротив, введение дополнительного остатка тушителя BHQ1 (Q) в 3'-концевую область увеличивает температуру плавления шпильки на 4–5°C, что согласуется с ранее опубликованными данными [14]. Для разгорания флуоресценции зондов при плавлении сложно выделить какие-то закономерности, можно лишь отметить, что зонды с короткими линкерами дают большее увеличение интенсивности эмиссии (табл. 1).
В условиях ПЦР-РВ при накоплении ПЦР-продукта все большая доля зонда образует с ним дуплекс, и при нагревании происходит плавление комплекса зонд–мишень. Поэтому было также изучено изменение флуоресценции при плавлении дуплекса зонда с мишенью (см. дополнительные материалы к публикации). При плавлении как шпильки, так и дуплекса с мишенью наилучшую кооперативность плавления показал зонд MB2 с двумя тушителями.
Далее зонды сравнивали в условиях ПЦР-РВ, причем детекцию флуоресценции в каждом цикле проводили при двух температурах (55 и 64°C). Были получены значения относительной фоновой флуоресценции по сравнению с контрольным зондом MB1, а также относительное усиление флуоресценции в конечной точке ПЦР по сравнению с исходной флуоресценцией зонда (табл. 1). Видно, что дополнительный остаток тушителя во всех случаях приводит к некоторому уменьшению исходной (фоновой) флуоресценции (табл. 1), но снижает конечное разгорание эмиссии в случае зондов MB4 и MB6 (рис. 3б).
Рис. 3.
Профили разгорания флуоресценции в количественной ПЦР-РВ; детекция флуоресценции при 55°C. (а) – Детекция различного количества молекул мишени с помощью зонда MB1; (б) – сравнение зондов MB1–MB8 в ПЦР-РВ с 2.7 × 107 (слева) и 2.7 × 108 молекул мишени (справа).

Для проверки применимости зондов для количественной детекции генетического материала использовали серию 10-кратных разведений мишени. Зонд MB1 позволяет детектировать мишень в диапазоне 50 зептомоль – 0.5 фемтомоль (рис. 3а). Наилучшую чувствительность продемонстрировали зонды MB2 (удвоенный тушитель и единичный остаток 5-FAM на коротком линкере) и MB3 (единичный тушитель и FAM-бифлуорофор на коротком линкере) – они разгорались примерно на один цикл раньше, чем стандартный зонд MB1. Остальные зонды по чувствительности уступали MB1 (рис. 3б).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все растворители и реагенты использовали без дополнительной очистки. 3-Азидопропиламин [21], а также соединения (II) и (IV) синтезировали, как описано ранее [20, 22]. 1H- и 13C-спектры ЯМР были получены на ЯМР-спектрометре DRX-500 (500 МГц; Bruker, Германия) с отнесением сигналов по пикам остаточных протонов в DMSO-d6 (2.50 м.д. для 1H и 39.52 м.д. для 13C). КССВ приведены в герцах (Гц) для соответствующих мультиплетов. Тонкослойную хроматографию выполняли на алюминиевых пластинах TLC Silica gel 60 F254 (Merck, Германия).
3-Азидопропил-3,5-бис(3',6'-дигидрокси-3-оксо-3H-спиро(изобензо-фуран-1,9'-ксантен)-5-илкарбоксиамидо)бензоат (V). К раствору кислоты (II) (2.00 г, 5.8 ммоль) в ДМФА (15 мл) добавляли 3‑азидопропиламин (700 мг, 6.9 ммоль), EDC·HCl (1.67 г, 8.7 ммоль), HOBt (1.18 г, 8.7 ммоль), Et3N (2.42 мл, 17.4 ммоль) и перемешивали 12 ч при комнатной температуре в атмосфере аргона. Разбавляли AcOEt (50 мл), промывали водой (2 × × 30 мл), 10%-ным раствором лимонной кислоты (3 × 30 мл), 5%-ным раствором NaHCO3 (3 × 30 мл), насыщенным раствором NaCl (30 мл), сушили над Na2SO4, упаривали, остаток перекристаллизовывали из метиленхлорида. Получили 3-азидопропиламид 3,5-ди(трифторацетиламино)бензойной кислоты (2.00 г, 81%) в виде белого порошка. Rf 0.6 (метанол–дихлорметан 5 : 95 (v/v)). Спектр для промежуточного соединения (II) 1H‑ЯМР (DMSO-d6), δ, м.д.: 11.54 (с, 2H), 8.62 (т, J 5.6, 1H), 8.24 (т, J 2.0, 1H), 7.94 (д, J 2.0, 2H), 3.41 (т, J 6.8, 2H), 1.78 (квинтет, J 6.8, 2H).
К раствору бистрифторацетамида (II) (500 мг, 1.2 ммоль) в метаноле (15 мл) добавляли K2CO3 (842 мг, 6.1 ммоль), воду (4 мл) и перемешивали 1.5 ч при кипячении в атмосфере аргона. Упаривали досуха, упаривали с ацетонитрилом (4 × 20 мл), растворяли в AcOEt (30 мл), сушили над Na2SO4, упаривали. Получили соединение (III) в виде желтоватого масла, которое далее использовали без дополнительной очистки и характеризации. Rf 0.32 (метанол–дихлорметан 1 : 9 (v/v)).
Соединение (III) растворяли в DMF (20 мл), добавляли DMAP (428 мг, 3.5 ммоль), Et3N (488 мкл, 3.5 ммоль), пентафторфениловый эфир пивалат-защищенного карбоксифлуоресцеина (IV) (2.08 г, 2.9 ммоль) и перемешивали 7 сут при 50°C в атмосфере аргона. Затем реакционную смесь упаривали досуха, разбавляли AcOEt (50 мл), промывали водой (2 × 30 мл), 10%-ной лимонной кислотой (2 × 30 мл), 5%-ным раствором NaHCO3 (3 × 30 мл), насыщенным раствором NaCl (30 мл). Органическую фазу сушили над Na2SO4, упаривали, остаток хроматографировали на силикагеле в системе дихлорметан/ацетон (100 : 0 → 75 : 25 (v/v)). Целевые фракции объединяли, упаривали, остаток растворяли в ацетоне (15 мл), добавляли 25%-ный водный раствор аммиака (2 мл), перемешивали 1 ч при комнатной температуре. Избыток аммиака и ацетон упаривали, раствор разбавляли до 10 мл водой и добавляли 10%-ный раствор HCl до pH 2; осадок фильтровали, промывали водой. Перекристаллизовывали из смеси метанол–ацетонитрил (1 : 9 (v/v)). Получили соединение (V) в виде желтоватого порошка (645 мг, 58%). Rf 0.7 (метанол–этилацетат 1 : 3 (v/v)). Спектр 1H-ЯМР (DMSO-d6), δ, м.д.: 10.82 (с, 2H), 8.69–8.65 (м, 2H), 8.62–8.57 (м, 2H), 8.40 (дд, J 8.1, 1.7, 2H), 8.02 (д, J 1.9, 2H), 7.47 (д, J 8.1, 2H), 6.75 (д, J 2.3, 2H), 6.64 (д, J 8.7, 4H), 6.62–6.58 (м, 4H), 3.44 (т, J 6.8, 2H), 3.36 (кварт, J 6.4, 2H), 1.82 (квинтет, J 6.8, 2H). Спектр 13C-ЯМР (DMSO-d6), δC, м.д.: 168.15, 166.62, 164.12, 159.91, 154.93, 151.97, 139.14, 136.42, 135.96, 135.23, 129.22, 126.61, 124.55, 124.11, 115.56, 115.46, 112.90, 109.14, 102.40, 48.62, 36.83, 28.47.
Количественную ПЦР-РВ проводили на детектирующем амплификаторе ДТпрайм (ДНК-технология, Россия) с использованием пары праймеров Fat65R–Fat65F и плазмиды pTZ-Fat, содержащей фрагмент гена, кодирующего фактор элонгации трансляции 1α длиной 290 п.н. из Fusarium avenaceum (рис. 2г).
Реакционная смесь (35 мкл) содержала 83.75 мМ Трис-HCl, 20.75 мМ сульфат аммония, 3.125 мМ хлорид магния, 0.003% Тween-20, 0.003% NP-40, 6.25% глицерина, 0.17 мМ каждого dNTP, 0.36 мкМ праймеров, 0.2 мкМ каждого зонда из набора MB1–MB8, 2.5 МЕ Taq-полимеразы и ДНК-матрицу (плазмида pTZ-Fat, 2.7 × 104–2.7 × × 108 копий), pH 8.8. Эксперименты повторяли трижды и анализировали геометрическим методом (Cq) с использованием программного обеспечения Real-time PCR 7.9 (ДНК-технология, Россия). Учитывали фоновую флуоресценцию каждой лунки с образцом. Для количественной детекции разных концентраций матрицы зондом MB1 соблюдалась прямая зависимость количества циклов от содержания матрицы в образце, а величина R2 ≥ 0.99. Для количественной ПЦР использовали раствор матрицы с заранее определенной концентрацией (спектрофотометрически при длине волны 260 нм). Из этого раствора отбирали аликвоты и последующим разведением получали образцы с известным количеством молекул мишени. Программа ПЦР-РВ: 80°C – 60 с; 94°С – 90 с (1 цикл); затем 94°C – 30 с, 64°C – 15 с (5 циклов) и 94°C – 10 с, 64°C – 15 с (45 циклов) (флуоресценцию регистрировали при 55 или 64°C с помощью детектора в FAM-канале).
Эксперименты по плавлению зондов MB1–MB8 проводили в трех повторах на том же приборе (канал обнаружения FAM) с каждым зондом из ряда MB1–MB8 по отдельности в буфере для ПЦР без dNTP, праймеров, Taq-полимеразы и плазмидной матрицы. Концентрация каждого зонда составляла 0.2 мкМ. Температуру повышали с 20 до 95°C с шагом 0.5°C в 15 с. Для каждого шага измеряли уровень флуоресценции. Дуплексы MBi/мишень предварительно отжигали с двукратным избытком короткой 26-мерной комплементарной последовательности и плавили в тех же условиях. Затем строили график зависимости интенсивности флуоресценции от температуры в диапазоне 20–95°C. Температуры плавления рассчитывали как максимумы первой производной с использованием программы OriginPro 8. Отношение сигнал/фон (SBR) для зондов MB1–MB8 рассчитывали по формуле:
ЗАКЛЮЧЕНИЕ
В данной работе была исследована эффективность FAM-бифлуорофора на основе 3,5-диаминобензойной кислоты на различных линкерах в сравнении с одиночной флуоресцеиновой меткой в составе флуорогенных олигонуклеотидных зондов типа “молекулярный маяк” для ПЦР-РВ. Показано, для таких шпилечных ПЦР-РВ-зондов предпочтительно присоединение флуоресцеина (как одиночной метки, так и бифлуорофора) через короткий линкер с помощью амидофосфитных реагентов. Наибольшая чувствительность зонда в ПЦР-РВ достигается при введении нестандартных модификаций – удвоенного тушителя либо удвоенного красителя, но не обеих модификаций одновременно.
Список литературы
Vilaivan T. // Beil. J. Org. Chem. 2018. V. 14. P. 253–281. https://doi.org/10.3762/bjoc.14.17
Chen J., Shi C., Kang X., Shen X., Lao X., Zheng H. // Anal. Meth. 2020. V. 12. P. 884–893. https://doi.org/10.1039/c9ay02332a
Michel B.Y., Dziuba D., Benhida R., Demchenko A.P., Burger A. // Front. Chem. 2020. V. 8. P. 112. https://doi.org/10.3389/fchem.2020.00112
Quan K., Yi C., Yang X., He X., Huang J., Wang K. // Tr. Anal. Chem. 2020. V. 124. P. 115784. https://doi.org/10.1016/j.trac.2019.115784
Navarro E., Serrano-Heras G., Castaño M.J., Solera J. // Clin. Chim. Acta. 2015. V. 439. P. 231–250. https://doi.org/10.1016/j.cca.2014.10.017
Farzan V.M., Kvach M.V., Aparin I.O., Kireev D.E., Prikazchikova T.A., Ustinov A.V., Shmanai V.V., Shipulin G.A., Korshun V.A., Zatsepin T.S. // Talanta. 2019. V. 194. P. 226–232. https://doi.org/10.1016/j.talanta.2018.10.043
Vogels C.B.F., Brito A.F., Wyllie A.L., Fauver J.R., Ott I.M., Kalinich C.C., Petrone M.E., Casanovas-Massana A., Muenker M.C., Moore A.J., Klein J., Lu P., Lu-Culligan A., Jiang X., Kim D.J., Kudo E., Mao T., Moriyama M., Oh J.E., Park A., Silva J., Song E., Takahashi T., Taura M., Tokuyama M., Venkataraman A., Weizman O.-E., Wong P., Yang Y., Cheemarla N.R., White E.B., Lapidus S., Earnest R., Geng B., Vijayakumar P., Odio C., Fournier J., Bermejo S., Farhadian S., Dela Cruz C.S., Iwasaki A., Ko A.I., Landry M.L., Foxman E.F., Grubaugh N.D. // Nature Microbiol. 2020. V. 5. P. 1299–1305. https://doi.org/10.1038/s41564-020-0761-6
Ranasinghe R.T., Brown T. // Chem. Commun. 2005. P. 5487–5502. https://doi.org/10.1039/b509522k
Farzan V.M., Aparin I.O., Veselova O.A., Podkolzin A.T., Shipulin G.A., Korshun V.A., Zatsepin T.S. // Anal. Meth. 2016. V. 8. P. 5826–5831. https://doi.org/10.1039/c6ay01304j
Aparin I.O., Farzan V.M., Veselova O.A., Chistov A.A., Podkolzin A.T., Ustinov A.V., Shipulin G.A., Formanovsky A.A., Korshun V.A., Zatsepin T.S. // Analyst. 2016. V. 141. P. 1331–1338. https://doi.org/10.1039/c5an01767j
Натыров А.Н., Власова Н.А., Матвиенко И.В., Волков Е.М., Байрамов В.М., Курочкин В.Е., Алексеев Я.И. // Биоорг. химия. 2018. Т. 44. С. 570–580. [Natyrov A.N., Matvienko I.V., Bayramov V.M., Alexeev J.I., Vlasova N.A., Volkov E.M., Kurochkin V. E. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 562–571.] https://doi.org/10.1134/S1068162018040131
Матвиенко И.В., Байрамов В.М., Парыгина Н.А., Курочкин В.Е., Алексеев Я.И. // Биоорг. химия. 2020. Т. 46. С. 310–321. [Matvienko I.V., Bayramov V.M., Parygina N.A., Kurochkin V.E., Alekseev Y.I. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 349–359.] https://doi.org/10.1134/S1068162020030127
Ryazantsev D.Y., Tsybulsky D.A., Prokhorenko I.A., Kvach M.V., Martynenko Y.V., Philipchenko P.M., Shmanai V.V., Korshun V.A., Zavriev S.K. // Anal. Bioanal. Chem. 2012. V. 404. P. 59–68. https://doi.org/10.1007/s00216-012-6114-4
Ryazantsev D.Y., Kvach M.V., Tsybulsky D.A., Prokhorenko I.A., Stepanova I.A., Martynenko Y.V., Gontarev S.V., Shmanai V.V., Zavriev S.K., Korshun V.A. // Analyst. 2014. V. 139. P. 2867–2872. https://doi.org/10.1039/c4an00081a
Tsybulsky D.A., Kvach M.V., Ryazantsev D.Y., Aparin I.O., Stakheev A.A., Prokhorenko I.A., Martynenko Y.V., Gontarev S.V., Formanovsky A.A., Zatsepin T.S., Shmanai V.V., Korshun V.A., Zavriev S.K. // Mol. Cell. Probes. 2016. V. 30. P. 285–290. https://doi.org/10.1016/j.mcp.2016.10.003
Haralambidis J., Angus K., Pownall S., Duncan L., Chai M., Tregear G.W. // Nucl. Acids Res. 1990. V. 18. P. 501–505. https://doi.org/10.1093/nar/18.3.501
Martin V.V., Alferiev I.S., Weis A.L. // Tetrahedron Lett. 1999. V. 40. P. 223–226. https://doi.org/10.1016/S0040-4039(98)02280-1
Мартыненко-Макаев Ю.В., Брылёв В.А., Удодова В.В. // Вес. Нац. акад. навук Беларусi. Сер. хiм. навук. 2017. Т. 3. С. 72–78.
Povedailo V.A., Lysenko I.L., Tikhomirov S.A., Yakovlev D.L., Tsybulsky D.A., Kruhlik A.S., Fan F., Martynenko-Makaev Y.V., Sharko O.L., Duong P.V., Minh P.H., Shmanai V.V. // J. Fluoresc. 2020. V. 30. P. 629–635. https://doi.org/10.1007/s10895-020-02535-w
Washio I., Shibasaki Y., Ueda M. // Org. Lett. 2007. V. 9. P. 1363–1366. https://doi.org/10.1021/ol0702425
Knör S., Modlinger A., Poethko T., Schottelius M., Wester H.-J., Kessler H. // Chem. Eur. J. 2007. V. 13. P. 6082–6090. https://doi.org/10.1002/chem.200700231
Kvach M.V., Tsybulsky D.A., Ustinov A.V., Stepanova I.A., Bondarev S.L., Gontarev S.V., Korshun V.A., Shmanai V.V. // Bioconjugate Chem. 2007. V. 18. P. 1691–1696. https://doi.org/10.1021/bc7001874
Wang Q., Chan T.R., Hilgraf R., Fokin V.V., Sharpless K.B., Finn M.G. // J. Am. Chem. Soc. 2003. V. 125. P. 3192–3193. https://doi.org/10.1021/ja021381e
Farzan V.M., Ulashchik E.A., Martynenko-Makaev Y.V., Kvach M.V., Aparin I.O., Brylev V.A., Prikazchikova T.A., Maklakova S.Y., Majouga A.G., Ustinov A.V., Shipulin G.A., Shmanai V.V., Korshun V.A., Zatsepin T.S. // Bioconjugate Chem. 2017. V. 28. P. 2599–2607. https://doi.org/10.1021/acs.bioconjchem.7b00462
Дополнительные материалы
- скачать ESM_1.tiff
- Рис. S1. 5'-Модификации, использованные в этой работе.
- скачать ESM_2.tiff
- Рис. S2. Кривые плавления зондов MB1–MB8 в форме шпильки (нагревание от 20 до 95°C).
- скачать ESM_3.tiff
- Рис. S3. Кривые плавления зондов MB1–MB8 (сплошная линия – дуплекс с 26-звенной матрицей, пунктирная линия – шпилька).
Инструменты
Биоорганическая химия


