Биоорганическая химия, 2021, T. 47, № 3, стр. 373-381
Оценка антимикробной активности пептида C3f – производного белка C3 человека
В. А. Позолотин 1, 2, Е. С. Умнякова 1, П. М. Копейкин 1, А. С. Комлев 1, Я. А. Дубровский 2, 3, И. А. Кренев 1, 2, О. В. Шамова 1, М. Н. Берлов 1, *
1 ФГБНУ “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. акад. Павлова, 12, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская набережная, 7–9, Россия
3 ФГБУ “Национальный медицинский исследовательский центр им. В.А. Алмазова” Минздрава России
197341 Санкт-Петербург, ул. Аккуратова, 2, Россия
* E-mail: berlov.mn@iemspb.ru
Поступила в редакцию 12.07.2020
После доработки 28.07.2020
Принята к публикации 29.07.2020
Аннотация
Система комплемента играет важную роль в защите организма от инфекции. Ключевой этап активации комплемента – протеолитическое расщепление белка C3 с образованием растворимого пептида анафилатоксина C3a и белка C3b, способного к формированию ковалентной связи с поверхностными молекулами микробных клеток. Активность C3b регулируется его дальнейшим ограниченным протеолизом с высвобождением пептида C3f, который, как считается, не обладает собственной функциональной активностью. На основании физико-химических свойств C3f мы предположили, что этот пептид может проявлять антимикробную активность. Активация комплемента, как правило, осуществляется на поверхности патогенов, в частности бактериальных клеток, и локальная генерация антимикробных пептидов может вносить существенный вклад в их нейтрализацию. Из литературы уже известна антимикробная активность производных комплемента – пептидов C3a и C4a. Для исследования антимикробных свойств C3f данный пептид был получен методом твердофазного синтеза. Показано, что пептид C3f человека обладает умеренной антимикробной активностью in vitro в отношении некоторых грамположительных бактерий (Listeria monocytogenes, Micrococcus luteus, Enterococcus faecium) с минимальными ингибирующими концентрациями 70 мкМ (для L. monocytogenes) и выше. Выявленная антимикробная активность пептида C3f существенно уступает описанной в литературе активности C3a. Ряд микроорганизмов (Bacillus cereus, Escherichia coli, Candida albicans) оказался устойчив к действию пептида C3f.
ВВЕДЕНИЕ
Система комплемента представляет собой важный компонент врожденного иммунитета позвоночных животных. Следствиями активации комплемента на поверхности микроорганизмов становятся продукция анафилатоксинов (C3a, C5a), привлекающих и активирующих различные виды лейкоцитов, опсонизация микробных клеток, способствующая их последующему фагоцитозу (C3b, C4b и продукты их деградации), а также непосредственный лизис клеток грамотрицательных бактерий в результате формирования на их поверхности мембраноатакующего комплекса (МАК) (C5b, C6, C7, C8, C9) [1–4]. Имеются данные, что гуморальная инактивация микроорганизмов в результате функционирования системы комплемента может осуществляться не только благодаря действию МАК, но и за счет продукции антимикробных пептидов – производных белков комплемента. Было показано, что пептид C3a, образующийся из белка C3 при активации комплемента, проявляет свойства не только анафилатоксина, но и антимикробного пептида, активного против широкого спектра микроорганизмов, включая грамположительные и грамотрицательные бактерии, а также дрожжевой гриб Candida albicans [5, 6]. Более слабая антимикробная активность была показана и для пептида C4a [7]. Мы предположили, что пептид C3f, являющийся, как и C3a, производным белка C3, тоже может обладать антимикробными свойствами.
Белок C3 представляет собой ключевой компонент системы комплемента, на котором сходятся все три пути активации (классический, лектиновый и альтернативный) [2, 3, 8]. В результате расщепления белка C3-конвертазами, формирующимися в ходе активации комплемента, образуются растворимый пептид C3a и белок C3b, который способен к формированию ковалентной связи с молекулами, содержащими гидроксильную группу и, в меньшей степени, аминогруппу, за счет своей тиоэфирной группировки. В случае связывания C3b с поверхностными молекулами микробных клеток он функционирует как регуляторная субъединица C3- и C5-конвертаз, а также как опсонин. Функционирование C3b регулируется его дальнейшим протеолитическим расщеплением фактором I с образованием связанного с поверхностью iC3b (инактивированный C3b) и высвобождаемого в циркуляцию пептида C3f с молекулярной массой ~2 кДа. Хотя iC3b более не способен поддерживать работу C3- и C5-конвертаз, он, вопреки своему названию, сохраняет и даже усиливает присущую C3b опсоническую активность.
Принято считать, что второй продукт расщепления C3b – пептид C3f – не обладает собственной функциональной активностью [9]. Тем не менее опубликованы единичные работы, посвященные возможной биологической роли C3f. Было показано, что C3f человека частично напоминает пептид C3a по своим свойствам: он проявляет спазмогенную активность, стимулируя сокращение гладких мышц подвздошной кишки морской свинки, а также увеличивает проницаемость сосудов в коже. Однако пептид C3f оказался значительно менее активным, чем C3a. Так, сравнимая с C3a спазмогенная активность наблюдалась только при достижении молярного избытка C3f на три порядка [10]. Было показано, что продукт деградации C3f – гексапептид HWESAS – может функционировать в качестве кофактора инсулиноподобных факторов роста I и II [11]. Также C3f стимулирует продукцию трансформирующего фактора роста β1 эндотелиальными клетками микрососудов кожи и пролиферацию этих клеток [12].
Учитывая наблюдения Ganu et al. о перекрывании функциональной активности C3a и C3f [10], мы предположили, что оно может распространяться и на антимикробную активность. Активация комплемента, как правило, осуществляется на поверхности патогенов, в частности бактериальных клеток, и локальная генерация антимикробных пептидов может вносить существенный вклад в их нейтрализацию.
Цель данной работы – исследование антимикробных свойств синтетического пептида C3f человека.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для исследования антимикробной активности C3f данный пептид (17 а.о.) был получен методом твердофазного синтеза на 2-хлортритилхлоридной смоле по Fmoc/tBu-стратегии путем наращивания пептидной цепи карбодиимидным методом, начиная с C-конца. Очистку полученного после синтеза пептида от побочных продуктов производили методом офВЭЖХ. В результате был получен электрофоретически гомогенный пептид, соответствующий C3f по молекулярной массе по данным масс-спектрометрии (рис. 1).
Рис. 1.
Анализ качества препарата синтетического пептида C3f. (а) – Анализ пептида C3f методом электрофореза в ПААГ в присутствии SDS (1 – C3f, 2 – стандарты молекулярной массы); (б) – MALDI-масс-спектр пептида C3f. Указан наиболее интенсивный сигнал с m/z 2022.14262, соответствующий второму сигналу в изотопном распределении. Расчетная моноизотопная масса однозарядного иона пептида [M + H]+ – 2021.10; найденная экспериментально [M + H]+ – 2021.14.

Методами in silico были оценены некоторые физико-химические свойства пептида (табл. 1). По расчетным данным, изоэлектрическая точка C3f составляет 10.83. Заряд пептида при нейтральном pH равен +2.4, в связи с наличием в молекуле двух остатков гистидина он может заметно увеличиваться при незначительном закислении. Доля остатков с неполярными боковыми группами в аминокислотной последовательности C3f составляет 35%. Известно, что основная мишень действия антимикробных пептидов – цитоплазматическая мембрана бактериальных клеток. Большинство изученных антимикробных пептидов характеризуется высоким содержанием и положительно заряженных, и гидрофобных аминокислот, что позволяет им взаимодействовать как с анионными головками, так и с жирнокислотными хвостами фосфолипидов бактериальной мембраны [13–17]. Таким образом, по своему аминокислотному составу пептид C3f соответствует типичному антимикробному пептиду.
Таблица 1.
Аминокислотная последовательность и расчетные физико-химические свойства пептида C3f
| Аминокислотная последовательность | SSKITHRIHWESASLLR | |
|---|---|---|
| Число аминокислотных остатков | 17 | |
| Молекулярная масса, Да | 2021 | |
| pI | 10.83 | |
| Заряд при различных значениях pH | 7.0 | +2.4 |
| 6.5 | +3.0 | |
| 6.0 | +3.5 | |
| Доля неполярных остатков, % | 35 | |
Многие антимикробные пептиды, не содержащие дисульфидных связей или значительного количества остатков пролина, формируют структуру амфипатической α-спирали, в которой пространственно разобщены остатки катионных и гидрофобных аминокислот. Часто α-спиральная конформация антимикробных пептидов стабилизируется при их взаимодействии с цитоплазматической мембраной бактерий [15, 16]. С помощью программы PEP-FOLD-3 были построены десять наиболее вероятных моделей трехмерной структуры C3f, все они содержат α-спиральный участок (в одной из моделей – два участка). Модель с максимальной протяженностью спирали представлена на рис. 2а. Визуализация ориентации аминокислотных остатков пептида C3f при формировании α-спиральной конформации по всей длине полипептидной цепи (проекция Эдмундсона [18]) (рис. 2б) показывает, что в этом случае все три остатка с положительно заряженными радикалами (два аргинина и лизин) локализуются на одной стороне спирали. Это свидетельствует в пользу потенциальной антимикробной активности пептида. В то же время остатки гидрофобных аминокислот не формируют единого кластера на поверхности молекулы, а остаток триптофана располагается в непосредственном соседстве с катионными остатками.
Рис. 2.
Третичная структура пептида C3f. (а) – Модель трехмерной структуры пептида C3f; (б) – предсказанное расположение аминокислотных остатков пептида C3f при формировании α-спиральной конформации.
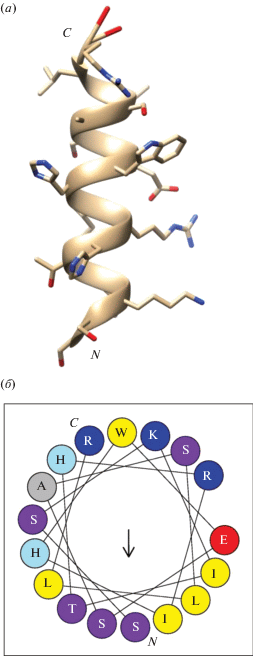
Хотя линейные антимикробные пептиды обычно превышают по размеру C3f (17 а.о.), известны и обратные примеры. Так, триптофан-богатые антимикробные пептиды – индолицидин коровы и тритрптицин свиньи – содержат по 13 а.о. [19, 20]. Многие изоформы таких пептидов амфибий, как темпорины и ауреины, содержат по 13–17 и даже 10 а.о. Примечательно, что для темпоринов и ауреинов (как, вероятно, и для C3f) характерна α-спиральная конформация [21–23].
Таким образом, совокупность физико-химических свойств пептида C3f позволила ожидать проявление им антимикробных свойств.
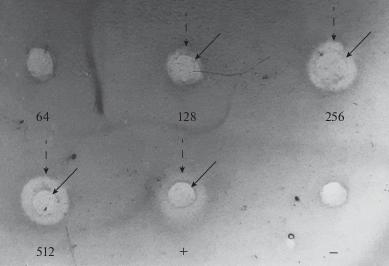
Экспериментальную оценку антимикробной активности синтетического пептида C3f проводили методом радиальной диффузии. Для определения минимальных ингибирующих концентраций (МИК) использовали серии двукратных разведений пептида, начиная с максимальной концентрации 1024 мкМ. В табл. 2 приведены полученные значения МИК пептида C3f в отношении различных микроорганизмов. Согласно нашим результатам, пептид C3f человека обладает антимикробной активностью в отношении некоторых грамположительных бактерий (Listeria monocytogenes, Micrococcus luteus, Enterococcus faecium). На рис. 3 в качестве примера приведена фотография участка чашки Петри с L. monocytogenes, в отношении которой пептид C3f проявляет наибольшую антимикробную активность (МИК 70 мкМ). Грамотрицательная бактерия Escherichia coli и гриб Candida albicans оказались нечувствительны к антимикробному действию C3f, так же как и еще один грамположительный микроорганизм – Bacillus cereus. Следует отметить, что выявленная нами антимикробная активность пептида C3f существенно уступает описанной в литературе активности другого производного комплемента – пептида C3a. С использованием того же метода радиальной диффузии была показана выраженная антимикробная активность C3a против ряда микроорганизмов, включая резистентные к действию пептида C3f виды (E. coli, C. albicans), при этом значения МИК в отношении бактерий не превышали 1 мкМ [5, 6]. Подобные различия по степени биологической активности между пептидами C3a и C3f были описаны ранее и для их спазмогенной активности [10].
Таблица 2.
Минимальные ингибирующие концентрации (МИК) пептида C3f в отношении различных микроорганизмов
| Вид | Штамм | Принадлежность | МИК, мкМ |
|---|---|---|---|
| Escherichia coli | ML-35p | Грам (–) | >1024 |
| Listeria monocytogenes | EGD | Грам (+) | 70 |
| Micrococcus luteus | A270 | Грам (+) | 161 |
| Enterococcus faecium | L3 | Грам (+) | 192 |
| Bacillus cereus | 10702 | Грам (+) | >1024 |
| Candida albicans | 820 | Дрожжевой гриб | >1024 |
Рис. 3.
Антимикробная активность пептида C3f в отношении L. monocytogenes, определенная методом радиальной диффузии. Цифры – концентрации (мкМ) пептида C3f в пробах; “+” – положительный контроль (дефенсины человека HNP-1–3); “–” – отрицательный контроль. Сплошными стрелками обозначены границы лунок, пунктирными – границы зон ингибирования роста.
Полученные результаты не дают основания оценивать выявленную in vitro антимикробную активность пептида C3f человека как физиологически значимую. Таким образом, вопрос о собственной функциональной активности пептида остается открытым. Аргументом в пользу ее наличия могла бы быть консервация в эволюции аминокислотной последовательности или физико-химических свойств пептида. Для оценки консервативности структуры C3f мы провели сравнение аминокислотных последовательностей пептида у разных представителей позвоночных животных (табл. 3).
Таблица 3.
Аминокислотные последовательности пептида C3f у различных представителей позвоночных животных
| Вид | UniProt ID | Аминокислотная последовательность | Расчетная pI |
|---|---|---|---|
| Человек (Homo sapiens) | >P01024|1304-1320 | SSKITHRIHWESASLLR | 10.83 |
| Кролик (Oryctolagus cuniculus) | >P12247|367-383 | SSPVKHRIVWDSASLLR | 10.83 |
| Мышь (Mus musculus) | >P01027|1304-1320 | SSATTFRLLWENGNLLR | 9.31 |
| Крыса (Rattus norvegicus) | >P01026|1304-1320 | SSPTVFRLLWESGSLLR | 9.31 |
| Морская свинка (Cavia porcellus) | >P12387|1309-1325 | SSPSKFRLVWEAGSLLR | 10.83 |
| Собака (Canis lupus familiaris) | >F1PIX8|1305-1321 | STEIKHHIVWDSPSLQR | 6.66 |
| Тихоокеанский морж (Odobenus rosmarus divergens) | >A0A2U3VK97|1303-1319 | NSIIKHLILWESASLLR | 8.75 |
| Свинья (Sus scrofa) | >P01025|1302-1318 | SAPVRHRILWESASLLR | 11.70 |
| Корова (Bos taurus) | >Q2UVX4|1303-1319 | NSAVRHRILWESASLLR | 11.70 |
| Африканский слон (Loxodonta africana) | >G3T5N8|1284-1300 | SSLIKHRIVWESASLLR | 10.83 |
| Домовый опоссум (Monodelphis domestica) | >F6ZDV8|1308-1324 | SSAINYRINYESDSLLR | 5.79 |
| Утконос (Ornithorhynchus anatinus) | >F6WUL9|1296-1312 | QSIVKFRIDTKNSQLLR | 11.00 |
| Китайский аллигатор (Alligator sinensis) | >A0A1U7S0C0|1295-1311 | ATPVKIRIENSNAFLSR | 10.84 |
| Индийская кобра (Naja naja) | >Q01833|1291-1307 | EVPERYSINDRNAVQAR | 6.28 |
| Курица (Gallus gallus) | >Q90633|1293-1309 | ANAITYRIENNNALVAR | 8.79 |
| Когтистая шпорцевая лягушка (Xenopus tropicalis) | >F7CXW4|1298-1314 | QQPLTYRINHENALLAR | 8.75 |
| Атлантический лосось (Salmo salar) | >P98093|1279-1295 | ASVTKWSINNKNQFHTR | 11.17 |
Видно, что структура пептида C3f проявляет высокую эволюционную вариабельность в аминокислотной последовательности, несмотря на идентичный размер пептида – 17 а.о. у всех видов. Единственным инвариантным остатком выступает C-концевой остаток аргинина, необходимый для взаимодействия с фактором I и катализируемого им ограниченного протеолиза. Еще один высококонсервативный остаток – изолейцин в позиции 8 (в редких случаях заменен лейцином), которому в большинстве последовательностей предшествует аргинин. У плацентарных млекопитающих в первичной структуре C3f можно выделить высококонсервативный C-концевой участок молекулы, представленный в большинстве случаев мотивом A(G)SLLR. Если предположить, что у плацентарных пептид C3f выполняет какую-либо консервативную функцию, следует ожидать участие этого мотива в ее реализации. Между тем, пептид HWESAS (соответствующий позициям 9–14 в последовательности C3f человека) заметно менее консервативен. Таким образом, описанная для этого гексапептида биологическая активность [11] не отражает, по всей видимости, эволюционно консервативную функцию.
Пептиды C3f различных видов характеризуются в большинстве случаев положительным зарядом, что рассматривается как главная структурная детерминанта антимикробной активности пептидов [14–16]. Тем не менее как минимум у представителей трех видов (собака, опоссум, кобра) C3f имеет изоэлектрическую точку менее 7, т.е. С3f – анионная молекулa, что говорит о низкой вероятности его функционирования в качестве антимикробного пептида.
Не исключено, что у разных видов животных биологические свойства C3f могут различаться. У таких животных, как корова и свинья, пептиды C3f имеют более высокую изоэлектрическую точку (11.70 в обоих случаях), нежели C3f человека, и, вероятно, могут проявлять более высокую антимикробную активность. Необходимы дальнейшие исследования, чтобы проверить эти предположения экспериментально. В то же время выявленная по результатам наших экспериментов антимикробная активность пептида C3f человека недостаточно высока, чтобы иметь физиологическую значимость. Можно предположить, что реализация потенциальных антимикробных свойств пептида C3f возможна в условиях локального закисления среды либо в кооперации с другими антимикробными факторами сыворотки крови.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение пептида C3f. Твердофазный синтез. Для химического синтеза пептида C3f использовали аминокислоты, 2-хлортритилхлоридную смолу, диизопропилэтиламин, этил-(гидроксиимино)цианоацетат OxymaPure и 1,3-диизопропилкарбодиимид (Iris Biotech GmbH, Германия). Были использованы аминокислоты с защищенными флуоренилметилоксикарбонильной (Fmoc) группой α-аминогруппами и защищенными функциональными группами боковых радикалов. Боковые цепи аминокислот были защищены 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонильной (Arg), трет-бутильной (Glu, Ser), трет-бутоксикарбонильной (Lys, Trp) и трифенилметильной (His) группами. Синтез проводили твердофазным методом на 2-хлортритилхлоридной смоле по Fmoc/tBu-стратегии путем наращивания пептидной цепи карбодиимидным методом, начиная с C-конца. C-Концевую аминокислоту присоединяли к смоле в реакции с 0.24 мM диизопропилэтиламином в хлористом метилене, содержавшем 5% диметилсульфоксида, в течение 2 ч при комнатной температуре. Деблокирование α-аминогрупп аминокислотных остатков проводили 25%‑ным раствором диэтиламина в N,N-диметилформамиде. Конденсацию последующих аминокислот производили в N,N-диметилформамиде с добавлением 0.4 мM OxymaPure и 0.4 мM 1,3-диизопропилкарбодиимида в течение 2 ч при комнатной температуре. После завершения синтеза для отщепления пептида от полимерного носителя и удаления защитных групп боковых радикалов смолу инкубировали в растворе, содержавшем 95% TFA, 2.5% триизопропилсилана и 2.5% H2O, в течение 60 мин.
Очистка синтетического пептида. Очистку полученного после синтеза пептида от побочных продуктов производили методом офВЭЖХ на колонке C18 25 × 1 см (Waters, США) с размером гранул сорбента 10 мкм. Элюцию проводили линейным градиентом ацетонитрила (5–70%) в присутствии 0.1% TFA в течение 60 мин со скоростью 1.5 мл/мин.
Электрофорез. Электрофорез в ПААГ в присутствии SDS проводили по методу Schägger et al. [24].
Масс-спектрометрия. Для проведения масс-спектрометрического анализа на поверхность мишени наносили 0.5 мкл раствора матрицы (5 мг/мл α-циано-4-гидроксикоричной кислоты в 50%-ном ацетонитриле с 0.1% TFA) и 0.5 мкл пробы, высушивали при комнатной температуре. Анализ проводили с помощью масс-спектрометра ионного циклотронного резонанса с Фурье-преобразованием Solarix XR (Bruker Daltonics, США), оснащенного ячейкой с динамической гармонизацией, сверхпроводящим магнитом напряженностью 7 Т и MALDI-источником. Ионы детектировали в диапазоне m/z от 70 до 5000.
Определение концентрации C3f. Концентрацию C3f в растворах оценивали по поглощению при 280 нм с учетом молярного коэффициента поглощения, равного 5500 М–1 см–1, определенного с помощью программы ProtParam (https://web.expasy.org/protparam/) [25] в соответствии с содержанием остатков ароматических аминокислот по формуле Pace et al. [26].
Оценка физико-химических свойств пептида C3f. Расчетные значения молекулярной массы и изоэлектрической точки пептида определяли в программе ProtParam. Заряд пептида при различных значениях pH оценивали в программе Protein Calculator (http://protcalc.sourceforge.net/). Расположение аминокислотных остатков пептида C3f при формировании α-спиральной структуры, а также долю неполярных остатков оценивали с помощью программы HeliQuest (http://heliquest.ipmc.cnrs.fr/cgi-bin/ComputParams.py) [27]. Трехмерная структура C3f была предсказана программой PEP-FOLD3 (https://bioserv.rpbs.univ-paris-diderot.fr/ services/PEP-FOLD3/) [28], визуализацию осуществляли с помощью программы Chimera 1.14 (https://www.cgl.ucsf.edu/chimera/) [29].
Аминокислотные последовательности пептидов C3f разных видов животных находили, используя первичные структуры белка C3, полученные из базы данных UniProt (https://www.uniprot.org/). Для установления границ последовательности, соответствующей C3f, осуществляли выравнивание аминокислотной последовательности белков C3 разных видов и пептида C3f человека в программе ClustalW [30]. Ключевым критерием установления границ C3f считали наличие остатков аргинина в C-концевом положении пептида и в позиции, непосредственно предшествующей N-концевому остатку, формирующих, таким образом, два сайта протеолитического расщепления R-X. Последовательность C3f была обнаружена во всех проанализированных структурах белка C3 за исключением C3 миноги Lethenteron camtschaticum (Q00685).
Антимикробная активность. Для оценки антимикробных свойств синтетического пептида C3f использовали культуры следующих микроорганизмов: грамотрицательной бактерии Escherichia coli (штамм ML-35p); грамположительных бактерий Listeria monocytogenes (штамм EGD), Micrococcus luteus (штамм A270), Enterococcus faecium (штамм L3), Bacillus cereus (штамм 10702); гриба Candida albicans (штамм 820). Для анализа антимикробной активности пептида применяли метод радиальной диффузии [31]. К аликвотам суспензий, содержавших по 4 × 106 бактериальных клеток в логарифмической (экспоненциальной) фазе роста или клеток ночной культуры C. albicans, добавляли по 12 мл расплавленной 1%-ной агарозы в 0.01 М натрий-фосфатном буфере (рН 7.4), термостатированной при 42°С. Полученные смеси наносили на чашки Петри диаметром 90 мм, оставляли до застывания агарозы. Затем в агарозе делали лунки диаметром 2–3 мм и вносили в них анализируемые пробы в 5 мкл 0.01%-ной уксусной кислоты. В качестве отрицательного контроля использовали растворитель (0.01%-ная уксусная кислота), а в качестве положительного контроля – α-дефенсины человека HNP-1–3 в концентрации 60 мкМ. Чашки Петри с внесенными пробами инкубировали при 37°С в течение 2.5 ч, после чего добавляли по 12 мл термостатированной при 42°С расплавленной 1%‑ной агарозы, содержавшей 6% питательной среды Soyabean Casein Digest Medium – Tryptone Soya Broth (для чашек с C. albicans – 6% Sabouraud Dextrose Broth), и инкубировали 15–18 ч при 37°С. Рост микроорганизмов останавливали добавлением 5%-ной уксусной кислоты.
Антимикробную активность пробы определяли как разность диаметра зоны ингибирования роста и диаметра лунки. Для определения минимальной ингибирующей концентрации (МИК) пептида строили график зависимости антимикробной активности от десятичного логарифма его концентрации (без учета проб с нулевой активностью). Методом линейной регрессии проводили прямую линию, соответствующую экспериментальным точкам, и определяли точку ее пересечения с осью абсцисс. Значение концентрации для этой точки принимали за МИК [32]. Значения МИК пептида C3f в отношении различных микроорганизмов были получены как медианы по результатам трех независимых экспериментов.
В качестве положительного контроля в антимикробных тестах использовали тотальный дефенсин из нейтрофилов человека (HNP-1–3). Для получения препарата дефенсинов из нейтрофилов экстрагировали катионные белки и пептиды с помощью бромистого цетилтриметиламмония путем последовательной экстракции, как описано ранее [33, 34]. Экстракты, содержавшие дефенсины согласно данным аналитического электрофореза, фракционировали методами твердофазной экстракции на картридже C-18 (дефенсины элюировали 13%-ным раствором ацетонитрила в отсутствие TFA) и офВЭЖХ на колонке C-18 с помощью изократической элюции раствором, содержавшим 0.1% TFA и 23% ацетонитрила.
ЗАКЛЮЧЕНИЕ
Были исследованы антимикробные свойства синтетического пептида C3f человека – производного белка комплемента C3. Мы показали, что C3f обладает антимикробной активностью в условиях in vitro в отношении некоторых грамположительных бактерий, однако она существенно уступает описанной в литературе антимикробной активности другого производного белка C3 – пептида C3a. Низкий уровень антимикробной активности пептида C3f не позволяет сделать вывод о ее физиологической значимости, хотя нельзя исключать участие C3f в противомикробной защите организма в кооперации с другими факторами сыворотки крови. Вопрос о собственной биологической активности пептида C3f остается открытым, а его решение требует дальнейших исследований.
Список литературы
Ricklin D., Hajishengallis G., Yang K., Lambris J.D. // Nat. Immunol. 2010. V. 11. P. 785–797. https://doi.org/10.1038/ni.1923
Merle N.S., Church S.E., Fremeaux-Bacchi V., Roumenina L.T. // Front. Immunol. 2015. V. 6. Article 262. https://doi.org/10.3389/fimmu.2015.00262
Barnum S.R. // Pharmacol. Ther. 2017. V. 172. P. 63–72. https://doi.org/10.1016/j.pharmthera.2016.11.014
Умнякова Е.С., Пашинская Л.Д., Кренев И.А., Легковой С.В., Кокряков В.Н., Берлов М.Н. // Мед. акад. журн. 2018. Т. 18. С. 7–16. https://doi.org/10.17816/MAJ1837-16
Nordahl E.A., Rydengård V., Nyberg P., Nitsche D.P., Mörgelin M., Malmsten M., Björck L., Schmidtchen A. // Proc. Natl. Acad. Sci. USA. 2004. V. 48. P. 16879–16884. https://doi.org/10.1073/pnas.040667810
Sonesson A., Ringstad L., Nordahl E.A., Malmsten M., Mörgelin M., Schmidtchen A. // Biochim. Biophys. Acta. 2007. V. 1768. P. 346–353. https://doi.org/10.1016/j.bbamem.2006.10.017
Pasupuleti M., Walse B., Nordahl E., Mörgelin M., Malmsten M., Schmidtchen A. // J. Biol. Chem. 2007. V. 282. P. 2520–2528. https://doi.org/10.1074/jbc.M607848200
Ricklin D., Reis E.S., Mastellos D.C., Gros P., Lambris J.D. // Immunol. Rev. 2016. V. 274. P. 33–58. https://doi.org/10.1111/imr.12500
Barnum S.R. // The Complement FactsBook. 2nd ed. / Eds. Barnum S., Schein T. Acad. Press, 2018. P. 157–170. https://doi.org/10.1016/B978-0-12-810420-0.00016-X
Ganu V.S., Müller-Eberhard H.J., Hugli T.E. // Mol. Immunol. 1989. V. 10. P. 939–948. https://doi.org/10.1016/0161-5890(89)90112-0
Dousset B., Straczek J., Maachi F., Nguyen D.L., Jacob C., Capiaumont J., Nabet P., Belleville F. // Biochem. Biophys. Res. Commun. 1998. V. 247. P. 587–591. https://doi.org/10.1006/bbrc.1998.8834
Xiang Y., Matsui T., Matsuo K., Shimada K., Tohma S., Nakamura H., Masuko K., Yudoh K., Nishioka K., Kato T. // Arthritis Rheum. 2007. V. 56. P. 2018–2030. https://doi.org/10.1002/art.22645
Teixeira V., Feio M.J., Bastos M. // Prog. Lipid Res. 2012. V. 51. P. 149–177. https://doi.org/10.1016/j.plipres.2011.12.005
Кокряков В.Н., Алешина Г.М., Берлов М.Н., Янкелевич И.А., Умнякова Е.С., Леонова Л.Е., Цветкова Е.В., Колобов А.А., мл., Меньшенин А.В., Курдюмова И.В. // Росс. иммун. журн. 2014. Т. 8. С. 325–328.
Kumar P., Kizhakkedathu J.N., Straus S.K. // Biomolecules. 2018. V. 8. Article 4. https://doi.org/10.3390/biom8010004
Rončević T., Puizina J., Tossi A. // Int. J. Mol. Sci. 2019. V. 20. Article 5713. https://doi.org/10.3390/ijms20225713
Ajingi Y.S., Jongruja N. // Биоорг. химия. 2020. Т. 46. С. 339. [Ajingi Y.S., Jongruja N. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 463–479.] https://doi.org/10.1134/S1068162020040044
Schiffer M., Edmundson A.B. // Biophys. J. 1967. V. 7. P. 121–135. https://doi.org/10.1016/S0006-3495(67)86579-2
Selsted M.E., Novotny M.J., Morris W.L., Tang Y.Q., Smith W., Cullor J.S. // J. Biol. Chem. 1992. V. 267. P. 4292–4295.
Lawyer C., Pai S., Watabe M., Borgia P., Mashimo T., Eagleton L., Watabe K. // FEBS Lett. 1996. V. 390. P. 95–98. https://doi.org/10.1016/0014-5793(96)00637-0
Simmaco M., Mignogna G., Canofeni S., Miele R., Mangoni M.L., Barra D. // Eur. J. Biochem. 1996. V. 242. P. 788–792. https://doi.org/10.1111/j.1432-1033.1996.0788r.x
Rozek T., Wegener K.L., Bowie J.H., Olver I.N., Carver J.A., Wallace J.C., Tyler M.J. // Eur. J. Biochem. 2000. V. 267. P. 5330–5341. https://doi.org/10.1046/j.1432-1327.2000.01536.x
Manzo G., Ferguson P.M., Gustilo V.B., Hind C.K., Clifford M., Bui T.T., Drake A.F., Atkinson R.A., Sutton J.M., Batoni G., Lorenz C.D., Phoenix D.A., Mason A.J. // Sci. Rep. 2019. V. 9. Article 1385. https://doi.org/10.1038/s41598-018-37630-3
Schägger H., von Jagow G. // Anal. Biochem. 1987. V. 166. P. 368–379. https://doi.org/10.1016/0003-2697(87)90587-2
Gasteiger E., Hoogland C., Gattiker A., Duvaud S., Wilkins M.R., Appel R.D., Bairoch A. // Proteomics Protocols Handbook / Ed. Walker J.M. Totowa. NJ: Humana Press, 2005. P. 571–607. https://doi.org/10.1385/1-59259-890-0:571
Pace C.N., Vajdos F., Fee L., Gimsley G., Gray T. // Protein Sci. 1995. V. 4. P. 2411–2423. https://doi.org/10.1002/pro.5560041120
Gautier R., Douguet D., Antonny B., Drin G. // Bioinformatics. 2008. V. 24. P. 2101–2102. https://doi.org/10.1093/bioinformatics/btn392
Lamiable A., Thévenet P., Rey J., Vavrusa M., Derreumaux P., Tufféry P. // Nucleic Acids Res. 2016. V. 44. P. W449–W454. https://doi.org/10.1093/nar/gkw329
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Comput. Chem. 2004. V. 25. P. 1605–1612. https://doi.org/10.1002/jcc.20084
Sievers F., Wilm A., Dineen D.G., Gibson T.J., Karplus K., Li W., Lopez R., McWilliam H., Remmert M., Söding J., Thompson J.D., Higgins D.G. // Mol. Syst. Biol. 2011. V. 7. Article 539. https://doi.org/10.1038/msb.2011.75
Lehrer R.I., Rosenman M., Harwig S.S., Jackson R., Eisenhauer P. // J. Immunol. Meth. 1991. V. 137. P. 167–173. https://doi.org/10.1016/0022-1759(91)90021-7
Qu X.-D., Harwig S.S.L., Oren A., Shafer W.M., Lehrer R.I. // Infect. Immun. 1996. V. 64. P. 1240–1245.
Берлов М.Н., Лодыгин П.А., Андреева Ю.В., Кокряков В.Н. // Биохимия. 2001. Т. 66. С. 1238–1244. [Berlov M.N., Lodygin P.A., Andreeva Yu.V., Kokryakov V.N. // Biochemistry (Mosc.). 2001. V. 66. P. 1008–1013.] https://doi.org/10.1023/a:1012325810788
Берлов М.Н., Кораблева Е.С., Андреева Ю.В., Овчинникова Т.В., Кокряков В.Н. // Биохимия. 2007. Т. 72. С. 551–559. [Berlov M.N., Korableva E.S., Andreeva Yu.V., Ovchinnikova T.V., Kokryakov V.N. // Biochemistry (Mosc.). 2007. V. 72. P. 445–451.] https://doi.org/10.1134/S0006297907040128
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


