Биоорганическая химия, 2021, T. 47, № 3, стр. 382-390
Синтез, антимикробные и противоопухолевые свойства производных 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-она
В. Я. Горишний 1, В. С. Матийчук 2, *
1 Львовский национальный медицинский университет имени Данила Галицкого
79010 Львов, ул. Пекарская, 69, Украина
2 Львовский национальный университет имени Ивана Франко
79005 Львов, ул. Кирилла и Мефодия, 6, Украина
* E-mail: v_matiychuk@ukr.net
Поступила в редакцию 29.06.2020
После доработки 11.07.2020
Принята к публикации 14.07.2020
Аннотация
Взаимодействием тиофен-2-карбальдегида с производными роданина произведен синтез 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-онов. Полученные в том числе (4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)алканкарбоновые кислоты использованы для ацилирования биогенного амина триптамина и его производных. В результате синтезирован ряд новых N-[2-(5-[R-1H-индол-3-ил)-этил]-2-(4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)карбамидов. Исследованы антимикробные и противоопухолевые свойства полученных соединений. Идентифицированы соединения с высокой антимикробной активностью относительно Staphylococcus aureus и Cryptococcus neoformans.
ВВЕДЕНИЕ
Антимикробные средства – одна из наиболее важных и обширных групп биологически активных веществ, имеющих практическое значение в современной медицине. Арсенал применяемых антимикробных препаратов требует постоянного обновления, поскольку микроорганизмы постоянно мутируют, в результате чего появляются штаммы, устойчивые к существующим антимикробным средствам. Остро стоит и проблема наличия эффективных противоопухолевых средств. На сегодняшний день многие виды рака неизлечимы, а количество онкобольных постоянно растет.
Одно из перспективных направлений современной медицинской химии – дизайн новых соединений, сочетающих в своем составе несколько фармакофоров, с целью получения биоактивных молекул с широким спектром фармакологического действия. Как известно, производные роданина (2-тионтиазолидин-4-она) и тиофена обладают широким спектром биологического действия. Среди них выявлены соединения-лидеры с антимикробной, противотуберкулезной, противовирусной, антидиабетической, противовоспалительной, противоопухолевой, противосудорожной и другими видами активности, в связи с чем роданиновый и тиофеновый циклы принято считать фармакофор-образующими структурами в медицинской химии [1–3].
Настоящая работа – продолжение наших исследований по дизайну биологически активных гетероциклических соединений [4–13]. Нами представлен синтез и исследование антимикробных и противоопухолевых свойств производных 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-она. Следует отметить, что среди подобного рода соединений уже найдены вещества с противоопухолевым [14, 15], антимикробным [16–19], а также антиоксидантным [20], цитотоксическим [20], анальгетическим [21] и противовоспалительным [21] действием. Они выступают ингибиторами киназ [22–24], протеазы сибирской язвы [25], HCV NS5B полимеразы [26], тирозинфосфатазы [27], альдозоредуктазы [28] и других ферментов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С целью получения комбинаторной библиотеки производных 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-онов изучено взаимодействие тиофен-2-карбальдегида (I) с роданинами (II–V). Установлено, что оптимальная среда для прохождения этой реакции – кипящая уксусная кислота в присутствии ацетата натрия или аммония. Таким образом синтезированы 5-тиофен-2-илметилен-2-тиоксо-4-тиазолидоны (VI–IX) (схема 1 ).
Схема 1 . Синтез 5-тиенилиденроданинов (VI–IX).
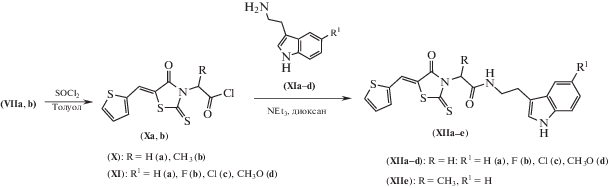
Кислоты (VIIа, b) были превращены в соответствующие хлорангидриды (Xa, b) при действии хлористого тионила. Реакцию проводили в среде толуола, а ее окончанием считали полное растворение исходной кислоты. Целевые амиды (XIIa–е) получали классическим способом – взаимодействием хлорангидридов (Xa, b) с соответствующими триптаминами (XIa–d) (схема 2 ). Реакцию проводили в среде безводного диоксана в присутствии триэтиламина.
Схема 2 . Синтез триптамидов (XIIа–е).
Строение соединений (VI–IX) и (XIIа–е) подтверждено при помощи 1Н-ЯМР-спектроскопии. В спектрах присутствуют сигналы всех протонов в областях, которые однозначно согласуются со строением исследуемых веществ. В частности, в области 8.06–8.28 м.ч. находятся сигналы 5-метилиденового протона, что указывает на Z-конфигурацию синтезированных веществ.
Таблица 1.
Антимикробная активность синтезированных соединений (GI, %)*
| Соединение | S. aureus | E. coli | K. pneumoniae | P. aeruginosa | A. baumannii | C. albicans | C. neoformans |
|---|---|---|---|---|---|---|---|
| (VI) | 25.0 | 5.7 | 2.3 | 4.1 | 20.0 | 30.0 | 24.2 |
| (VIIс) | 86.6 | 5.7 | 6.4 | 5.2 | 14.9 | 21.7 | 40.8 |
| (VIIIa) | 56.6 | 1.9 | 9.0 | 11.3 | 3.2 | 15.5 | 12.7 |
| (VIIIb) | 29.0 | 4.4 | 7.1 | 0.2 | 13.7 | 12.5 | 30.8 |
| (IXa) | 94.7 | –0.2 | –2.9 | 9.6 | 37.8 | 77.7 | 60.2 |
| (IXb) | 92.7 | –10.6 | –3.6 | –2.5 | –7.2 | 38.0 | 92.7 |
| (XIIa) | 35.9 | –5.4 | 9.1 | –4.2 | 16.0 | 44.3 | 97.3 |
| (XIIb) | 8.3 | 6.1 | –7.1 | 11.0 | 12.3 | 34.0 | 99.0 |
| (XIIc) | –5.6 | –1.0 | –2.5 | 13.7 | –1.9 | 55.3 | 101.5 |
| (XIId) | 33.8 | 8.1 | 7.7 | 11.5 | 9.1 | 66.6 | 87.2 |
| (XIIe) | 27.7 | 3.5 | 9.7 | 3.1 | 24.7 | 55.4 | 90.5 |
Таблица 2.
Антимикробная, цитотоксическая и гемолитическая активность соединений (VIIс), (IXa, b) и (XIIa–e)
| Соединение | MIC, мкг/мл | Hk СС50, мкг/мл | Hm HC10, мкг/мл | |
|---|---|---|---|---|
| S. aureus | C. neoformans | HEK293 | RBC | |
| (VIIc) | 4 | >32 | >32 | >32 |
| (IXa) | 16 | >32 | >32 | >32 |
| (IXb) | 4 | >32 | >32 | >32 |
| (XIIa) | >32 | 8 | >32 | >32 |
| (XIIb) | >32 | 4 | 19.6 | >32 |
| (XIIc) | >32 | 4 | 26.2 | >32 |
| (XIId) | >32 | 32 | >32 | >32 |
| (XIIе) | >32 | 16 | >32 | >32 |
| Цефтриаксон | 32 | NT | NT | NT |
| Амфотерицин В | NT | 1.46 | NT | NT |
Антимикробная активность синтезированных соединений. Исследование антимикробной активности синтезированных соединений (VI–IX) и (XIIа–е) осуществлено в рамках проекта “The Community for Antimicrobial Drug Discovery” (CO-ADD) при поддержке Wellcome Trust (Великобритания) и университета Квинсленда (Австралия) [29]. В качестве тестовых микроорганизмов использовали пять штаммов бактерий: Staphylococcus aureus ATCC 43300, Escherichia coli ATCC 25922, Klebsiella pneumoniae ATCC 700603, Pseudomonas aeruginosa ATCC 27853 и Acinetobacter baumannii ATCC 19606, а также два штамма дрожжеподобных грибов: Candida albicans ATCC 90028 и Cryptococcus neoformans ATCC 208821. Результаты исследований антимикробной активности приведены в табл. 1.
Как видно из табл. 1, большинство тестируемых соединений проявило отчетливую или высокую антимикробную активность исключительно относительно грамположительных микроорганизмов, а именно устойчивого к метициллину штамма S. aureus ATCC 43300. Грамотрицательные бактерии оказались нечувствительными к тестируемым соединениям. Особенность строения всех соединений, обнаруживших высокую антистафилококковую активность, заключается в наличии гидрофильных заместителей в положении 3 роданинового цикла, таких как карбоксильная группа (VIIс), фенольный гидроксил (VIIIа, IXа) или гидрофильный по своей природе амидный фрагмент (IXa, b). Причем соединение (IXа), содержащее фенольный гидроксил в амидном фрагменте, характеризуется широким спектром действия, демонстрируя высокие показатели антибактериальной активности в отношении S. аureus ATCC 43300 и противогрибковой – относительно C. albicans ATCC 90028 и C. neoformans ATCC 208821.
Все триптамиды (XIIа–е) проявляют высокую противогрибковую активность в отношении штаммов C. albicans ATCC 90028 и C. neoformans ATCC 208821, причем опять же стоит отметить наличие в их составе гидрофильного амидного фрагмента. Этот фрагмент содержится и в 3-ароильних замещенных (IXa, b), которые кроме высокой антистафилококковой активности проявляют также выраженную противогрибковую активность.
Соединения (VIIс) и (IXa, b) были отобраны для второго этапа исследований антибактериальной активности, а соединения (XIIа–e) – для анализа противогрибковой активности, который заключался в нахождении минимальной ингибирующей концентрации (MIC) и определении цитотоксичности (СС50 и HC10) относительно эмбриональных клеток почек (human embryonic kidney cells) и эритроцитов человека (human red blood cells). Результаты исследований антибактериальной активности в отношении S. aureus ATCC 43300 приведены в табл. 2. Проведенные исследования подтвердили антимикробную активность указанных соединений. Установлено, что самое сильное антибактериальное действие продемонстрировали соединения (VIIc) и (IXb). Для них минимальная ингибирующая концентрация составляла 4 мкг/мл. Наиболее отчетливая противогрибковая активность относительно C. neoformans наблюдалась у соединений (XIIb, c) (MIC = = 4 мкг/мл). Особенность их строения заключается в наличии галогена в индольном фрагменте молекулы. Однако для этих соединений характерна относительная токсичность по отношению к эмбриональным клеткам почек человека. Все остальные тестируемые соединения вышеуказанного вида токсичности не проявили.
Противоопухолевая активность синтезированных соединений. Противоопухолевую активность синтезированных соединений в концентрации 10 мкМ изучали методом высокоэффективного биологического скрининга согласно международной научной программе Национального института здоровья США – DTP (Developmental Therapeutic Program) Национального института рака (Бетезда, Мэриленд, США) [30–33] in vitro на 60 линиях клеток, охватывающих практически весь спектр раковых заболеваний. Количественным критерием активности соединений был рассчитанный процент роста клеток линий рака (GP, %) по сравнению с контролем [25–28]. Результаты исследования приведены в табл. 3.
Таблица 3.
Цитотоксичность синтезированных соединений в концентрации 10 мкМ на 60 линиях раковых клеток
| Соединение | Митотическая активность на 60 линиях, GP, % | Наиболее чувствительные линии | ||
|---|---|---|---|---|
| средняя | диапазон | линия рака/тип | GP, % | |
| (VIIc) | 101.71 | 80.66–121.12 | UO-31 (рак почек) | 80.66 |
| (VIIIa) | 96.96 | 71.14–123.55 | MDA-MB-468 (рак молочной железы) | 71.14 |
| (IXa) | 101.58 | 78.88–117.79 | UO-31 (рак почек) | 78.88 |
| (IXb) | 100.18 | 73.74–113.57 | UO-31 (рак почек) RPMI-8226 (лейкемия) |
73.74 82.75 |
| (XIIa) | 98.04 | 52.09–144.10 | UO-31 (рак почек) | 52.09 |
| (XIIb) | 101.51 | 59.28–146.38 | UO-31 (рак почек) CAKI-1 (рак почек) NCI-H522 (немелкоклеточный рак легких) SNB-75 (рак ЦНС) UACC-62 (меланома) |
59.28 77.45 79.82 80.53 85.21 |
| (XIIc) | 100.69 | 71.89–147.13 | UO-31 (рак почек) CCRF-CEM (лейкемия) NCI-H522 (немелкоклеточный рак легких) A498 (рак почек) CAKI-1 (рак почек) SNB-75 (рак ЦНС) |
71.89 76.35 78.48 80.95 82.37 82.40 |
| (XIId) | 101.48 | 69.99–129.25 | UO-31 (рак почек) NCI-H522 (немелкоклеточный рак легких) SNB-75 (рак ЦНС) CAKI-1 (рак почек) |
69.99 81.88 82.59 85.99 |
| (XIIe) | 96.16 | 50.05–120.29 | UO-31 (рак почек) CAKI-1 (рак почек) SNB-75 (рак ЦНС) UACC-62 (меланома) NCI-H226 (немелкоклеточный рак легких) CCRF-CEM (лейкемия) NCI-H522 (немелкоклеточный рак легких) SF-268 (рак ЦНС) |
50.05 64.40 73.69 76.83 82.73 83.96 84.46 87.38 |
Установлено, что синтезированные соединения проявляют среднюю или низкую противоопухолевую активность. Наиболее чувствительной практически ко всем тестируемым соединениям оказалась линия UO-31 рака почек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1H-ЯМР-спектры растворов веществ в ДМСО-d6 регистрировали на спектрометре Mercury VX-400 (400 МГц, Varian, США), внутренний стандарт – ТМС. Температуры плавления синтезированных соединений определяли в открытых капиллярных трубках на электротермическом приборе ПТП-М (АО “ЛОиП”, Россия). Контроль за ходом реакций осуществляли методом ТСХ на пластинах Silica gel 60 F254 (Merck, Германия). В качестве исходных соединений использовали коммерчески доступные реагенты.
Cинтез 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-онов (VI–IX). В круглодонную колбу с обратным холодильником помещали 3 ммоль соответствующего роданина (II–V), 0.4 г (3.6 ммоль) тиофен-2-карбальдегида (І), 0.25 г (3 ммоль) ацетата натрия и 5 мл уксусной кислоты. Реакционную смесь кипятили 1.5–2 ч, охлаждали, осадок отфильтровывали (соединение (VI) выделяли подщелачиванием реакционной смеси 5%-ным раствором NаОН до pH ~ 8 при перемешивании и охлаждении с последующим отфильтровыванием осадка и промыванием его водой), промывали уксусной кислотой, водой, высушивали и перекристаллизовывали из уксусной кислоты или смеси ДМФА с уксусной кислотой.
(5Z)-3-(3-Морфолин-4-илпропил)-5-тиофен-2-илметилен-2- тиоксотиазолидин-4-он (VI). Выход 92%. Т. пл. 114–115°С. Спектр 1Н-ЯМР, δ, м.д.: 8.11 (с, 2H, СН= + 3-Н, тиофен), 7.77 (с, 1H, 5-Н, тиофен), 7.33 (с, 1H, 4-Н, тиофен), 4.11 (с, 2H, 1-СН2), 3.46 (с, 4H, (СН2)2O, морфолин), 2.38–2.18 (м, 6H, 3СН2, (CH2)2N, морфолин + 3-CH2), 1.87–1.79 (м, 2H, 2-CH2). Найдено, %: C 50.96; H 5.19; N 7.81. C15H18N2O2S3. Вычислено, %: C 50.82; H 5.12; N 7.90.
[(5Z)-4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]уксусная кислота (VIIа). Выход 97%. Т. пл. 236–237°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 13.36 (с, 1H, СООН), 8.19 (с, 1H, СН=), 8.15 (д, J 5.0, 1H, 3-Н, тиофен), 7.81 (д, J 3.7, 1H, 5-Н, тиофен), 7.35 (т, J 4.8, 4-Н, 1H, тиофен), 4.73 (с, 2H, CH2). Найдено, %: C 41.96; H 2.42; N 4.99. C10H7NO3S3. Вычислено, %: C 42.09; H 2.47; N 4.91.
2-[(5Z)-4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]пропановая кислота (VIIb). Выход 93%. Т. пл. 178–180°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 13.24 (с, 1H, COOH), 8.15 (д, J 5.1, 1H, 3-Н, тиофен), 8.13 (с, 1H, CH=), 7.87–7.68 (м, 1H, 5-Н, тиофен), 7.34 (дд, J 4.9, 3.8, 1H, 4-Н, тиофен), 5.59 (кв, J 7.1, 1H, CH), 1.54 (д, J 7.1, 3H, CH3). Найдено, %: C 44.02; H 2.97; N 4.61. C11H-9NO3S3. Вычислено, %: C 44.13; H 3.03; N 4.68.
3-[(5Z)-4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]пропановая кислота (VIIc). Выход 92%. Т. пл. 200–201°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 12.53 (с, 1H, СООН), 8.14–8.10 (м, 2H, СН= + 3-Н, тиофен), 7.78 (д, J 3.6, 1H, 5-Н, тиофен), 7.32 (дд, J 4.8, 3.9, 1H, 4-Н, тиофен), 4.22 (д, J 7.7, 2H, СН2CO), 2.64 (т, J 7.9, 2H, СН2N). Найдено, %: C 44.25; H 2.99; N 4.75. C11H9NO3S3. Вычислено, %: C 44.13; H 3.03; N 4.68.
(5Z)-3-(4-Гидроксифенил)-5-тиофен-2-илметилен-2-тиоксотиазолидин-4-он (VIIIa). Выход 90%. Т. пл. 229–231°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 9.89 (с, 1H, ОН), 8.17–8.10 (м, 2H, СН= + 3-Н, тиофен), 7.80 (д, J 3.5, 1H, 5-Н, тиофен), 7.44 (т, J 3.5, 1Н, 4-Н, тиофен), 7.17 (д, J 8.7, 2H, 3-Н + 5-Н, C6H4OH), 6.88 (д, J 8.7, 2H, 2-Н + 6-Н, C6H4OH). Найдено, %: C 52.51; H 2.77; N 4.32. C14H9NO2S3. Вычислено, %: C 52.64; H 2.84; N 4.38.
(5Z)-3-(4-Диэтиламинофенил)-5-тиофен-2-илметилен-2-тиоксотиазолидин-4-он (VIIIb). Выход 91%. Т. пл. 209–210°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 8.14–8.06 (м, 2H, СН= + 3-Н, тиофен), 7.76 (д, J 3.3, 1H, 5-Н, тиофен), 7.34 (т, J 4.5, 1H, 4-Н, тиофен), 7.09 (д, J 8.9, 2H, 2-Н + 6-Н, С6Н4), 6.74 (д, J 8.4, 2H, 3-Н + 5-Н, С6Н4), 3.39 (кв, J 6.9, 4H, 2СН2СН3), 1.14 (т, J 6.8, 6H, 2СН2СН3). Найдено, %: C 57.86; H 4.77; N 7.55. C18H18N2OS3. Вычислено, %: C 57.72; H 4.84; N 7.48.
4-Гидрокси-N-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]бензамид (IXа). Выход 91%. Т. пл. 238–240°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 11.52 (с, 1H, NH), 10.35 (с, 1H, OH), 8.28 (с, 1H, CH=), 8.20 (д, J 4.9, 1H, 3-Н, тиофен), 7.88–7.81 (м, 3H, 2-Н + 6-Н, C6H4 + 5-Н, тиофен), 7.37 (т, J 4.0, 1H, 4-Н, тиофен), 6.90 (д, J 8.5, 2H, 3-Н + 5-Н, C6H4). Найдено, %: C 49.69; H 2.84; N 7.78. C15H10N2O3S3. Вычислено, %: C 49.71; H 2.78; N 7.73.
N-[(5Z)-4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]никотинамид (IXb). Выход 96%. Т. пл. 228–230°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 11.97 (с, 1H, NH), 9.13 (с, 1H, 2-Н, пиридин), 8.85 (д, J 4.8, 1H, 4-Н, пиридин), 8.31 (д, J 8.0, 1H, 6-Н, пиридин), 8.26 (с, 1H, СН=), 8.18 (д, J 5.0, 1H, 3-Н, тиофен), 7.83 (с, 1H, 5-Н, тиофен), 7.63 (дд, J 7.8, 4.9, 1H, 5-Н, пиридин), 7.37 (т, J 4.7, 1H, 4-Н, тиофен). Найдено, %: C 48.29; H 2.67; N 12.16. C14H9N3O2S3. Вычислено, %: C 48.40; H 2.61; N 12.09.
Cинтез (4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)-алканхлоридов (Xa, b). В круглодонную колбу с обратным холодильником помещали 20 ммоль кислоты (VIIa) или (VIIb), 0.7 г (60 ммоль тионилхлорида) и 5–10 мл безводного толуола. Реакционную смесь кипятили 10–20 мин до полного растворения кислоты, добавляли 15–30 мл петролейного эфира, охлаждали, осадок отфильтровывали и перекристаллизовывали из смеси бензол–гексан или толуол–петролейный эфир.
(4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)-ацетилхлорид (Xa). Выход 78%. Т. пл. 138–140°С.
2-(4-Оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)-пропионилхлорид (Xb). Выход 90%. Т. пл. 104–106°С.
Общая методика синтеза триптамидов (XIIа–е). К раствору 2 ммоль соответствующего триптамина (XIa–d), 0.2 г (2 ммоль) триэтиламина в 5 мл безводного диоксана добавляли раствор 2 ммоль (4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил)-алканхлорида (Xa) или (Xb) в 5 мл горячего диоксана и оставляли на 30 мин. Реакционную смесь разбавляли 100 мл воды. Осадок отфильтровывали, высушивали и перекристаллизовывали из уксусной кислоты.
N-[2-(1H-Индол-3-ил)этил]-2-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]ацетамид (XIIa). Выход 81%. Т. пл. 217–220°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 10.85 (с, 1H, C(O)NH), 8.42 (т, J 5.5, 1H, 1-Н, индол), 8.17 (с, 1H, CH=), 8.15 (д, J 5.0, 1H, 3-Н, тиофен), 7.81 (д, J 3.5, 1H, 5-Н, тиофен), 7.53 (д, J 7.8, 1H, 2-H, индол), 7.37–7.31 (м, 2H, 4-Н, индол + 4-Н, тиофен), 7.15 (д, J 2.2, 1H, 7-H, индол), 7.06 (т, J 7.5, 1H, 5‑Н, индол), 6.98 (т, J 7.4, 1H, 6-Н, индол), 4.63 (с, 2H, СН2СО), 3.42–3.25 (м, 2H, CH2NH), 2.82 (т, J 7.3, 2H, NHCH2СН2). Найдено, %: C 56.29; H 4.11; N 9.76. C20H17N3O2S3. Вычислено, %: C 56.18; H 4.01; N 9.83.
N-[2-(5-Фторо-1H-индол-3-ил)этил]-2-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]ацетамид (XIIb). Выход 82%. Т. пл. 212–214°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): δ 10.95 (с, 1H, C(O)NH), 8.40 (с, 1H, 1-Н, индол), 8.16 (с, 2H, СН= + 3-Н, тиофен), 7.80 (с, 1H, 5-Н, тиофен), 7.43–7.17 (м, 4H, 2-Н + 4Н + 6-Н, индол + 4-Н, тиофен), 6.90 (с, 1H, 6-H, индол), 4.63 (с, 2H, CH2СО), 3.35–3.28 (м, 2H, CH2NH), 2.78 (т, J 7.2, 2H, NHCH2CH2). Найдено, %: C 54.03; H 3.57; N 9.36. C20H16FN3O2S3. Вычислено, %: C 53.91; H 3.62; N 9.43.
N-[2-(5-Хлоро-1H-индол-3-ил)этил]-2-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]ацетамид (XIIc). Выход 78%. Т. пл. 223–226°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 11.06 (с, 1H, C(O)NH), 8.40 (т, J 5.5, 1H, 1-Н, индол), 8.17–8.13 (м, 2H, СН= + 3-Н, тиофен, 7.80 (д, J 3.5, 1H, 5-Н, тиофен), 7.56 (с, 1H, 2-H, индол), 7.36 (с, 1H, 4-Н, индол), 7.34 (с, 1H, 4-Н, тиофен), 7.23 (с, 1H, 7-H, индол), 7.06 (дд, J 8.6, 1.8, 1H, 6-Н, индол), 4.63 (с, 2H, CH2СО), 3.36–3.29 (м, 2H, CH2NH), 2.79 (т, J 7.2, 2H, NHCH2CH2). Найдено,%: C 51.78; H 3.55; N 9.02. C20H16ClN3O2S3. Вычислено, %: C 51.99; H 3.49; N 9.09.
N-[2-(5-Метокси-1H-индол-3-ил)этил]-2-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]ацетамид (XIId). Выход 77%. Т. пл. 226–229°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 10.66 (с, 1H, C(O)NH), 8.38 (с, 1H, 1-Н, индол), 8.14 (д, J 7.5, 2H, СН= + 3-Н, тиофен), 7.80 (д, J 3.6, 1H, 5-Н, тиофен), 7.37–7.32 (м, 1H, 4-Н, тиофен), 7.22 (д, J 8.7, 1H, 2-H, индол), 7.11 (д, J 2.1, 1H, 4-Н, индол), 7.00 (д, J 2.2, 1H, 7-H, индол), 6.71 (дд, J 8.7, 2.3, 1H, 6-Н, индол), 4.64 (с, 2H, CH2СО), 3.77 (с, 3H, СН3), 3.35 (т, 6.0, 2H, CH2NH), 2.79 (т, J 7.3, 2H, NHCH2CH2). Найдено,%: C 55.24; H 4.08; N 9.11. C21H19N3O3S3. Вычислено, %: C 55.12; H 4.19; N 9.18.
N-[2-(1H-Индол-3-ил)этил]-2-[(5Z)-4-оксо-5-тиофен-2-илметилен-2-тиоксотиазолидин-3-ил]пропанамид (XIIe). Выход 92%. Т. пл. 112–115°С. Спектр 1Н-ЯМР (δ, м.д., J, Гц): 10.81 (с, 1H, C(O)NH), 8.20–8.11 (м, 2H, 1-Н, индол + 3-Н, тиофен), 8.10 (с, 1H, CH=), 7.78 (д, J 3.1, 1H, 5-Н, тиофен), 7.53 (д, J 7.9, 1H, 2-H, индол), 7.38–7.28 (м, 2H, 4-Н, индол + 4-Н, тиофен), 7.14 (с, 1H, 7-Н, индол), 7.05 (т, J 7.2, 1H, 5-Н, индол), 6.97 (т, J 7.4, 1H, 6-Н, индол), 5.45 (д, J 6.9, 1H, CH), 3.42–3.25 (м, 2H, CH2NH), 2.88–2.74 (м, 2H, NHCH2CH2), 1.57 (д, J 6.9, 3H, CH3). Найдено, %: C 57.02; H 4.27; N 9.60. C21H19N3O2S3. Вычислено, %: C 57.12; H 4.34; N 9.52.
Антимикробная активность. Для определения ингибирования роста бактерий (S. aureus ATCC 43300, E. coli ATCC 25922, K. pneumoniae ATCC 700603, P. aeruginosa ATCC 27853 и A. baumannii ATCC 19606) планшеты с исследуемыми веществами и бактериальными культурами инкубировали при 37°С в течение 18 ч без встряхивания и измеряли поглощение при 600 нм (OD600) с использованием автоматизированного монохроматора/спектрографа M1000 Pro (Tecan, Швейцария). Для определения ингибирования роста грибка C. albicans ATCC 90028 планшеты с исследуемыми веществами и грибковой суспензией инкубировали при 35°С в течение 36 ч без встряхивания и измеряли поглощение при 530 нм (OD530) с помощью спектрофотометра Synergy HTX (Biotek, США). Ингибирование в аналогичных условиях роста грибка C. neoformans ATCC 208821 определяли, измеряя разницу между поглощением при 600 и 570 нм (OD600–570) после добавления резазурина (конечная концентрация 0.001%) и инкубации в течение дополнительных 2 ч при 35°С.
Процент ингибирования роста (GI, %) рассчитывали для каждой ячейки микротитрационного планшета, используя отрицательный контроль (только среда) и положительный контроль (бактериальная/грибковая среда без ингибиторов) в тех же условиях.
Цитотоксический эффект in vitro оценивали на эмбриональной клеточной линии почек HEK293 в концентрации исследуемых веществ, которая вызвала 50%-ную гибель клеток (СС50). Ингибирование роста клеток оценивали по флуоресценции после добавления резазурина (5 мкл, 25 мкг/мл; конечная концентрация 2.3 мкг/мл) и инкубации в течение 3 ч при 37°С и 5% СО2. Интенсивность флуоресценции измеряли на приборе M1000 Pro (Tecan, Швейцария) монохромным считывателем микропланшетов с использованием автоматического расчета данных.
Гемолитический эффект оценивали по поглощению при 405 нм супернатанта, образованного после инкубации пластинок (37°С, 1 ч), содержащих исследуемые соединения вместе с промытыми клетками крови человека с последующим центрифугированием (1000 об/мин, 10 мин). Поглощение измеряли измеряли на приборе M1000 Pro (Tecan, Швейцария) монохромным считывателем планшетов. В качестве положительного гемолитического стандарта использовали меллитин.
Противоопухолевая активность. Противоопухолевая активность синтезированных соединений в отношении 60 линий раковых клеток, представляющих девять онкологических заболеваний (лейкемия, немелкоклеточный рак легких, рак ЦНС, яичников, молочной железы, простаты, почек, эпитилиальный рак кишечника, меланома), исследовали в National Cancer Institute of Health (США) в рамках Development Therapeutic Program по стандартной процедуре [27]. Определение противоопухолевой активности проводили высокочувствительным флуорометрическим методом посредством количественной оценки интенсивности цвета флуоресцентного излучения (краситель – сульфородамин Б) через 48 ч после обработки клеток тестируемыми соединениями. Процент ингибирования роста рассчитывали по формулам:
ЗАКЛЮЧЕНИЕ
Изучено взаимодействие тиофен-2-карбальдегида с производными роданина, в результате чего получена комбинаторная библиотека производных 5-тиофен-2-илметилен-2-тиоксотиазолидин-4-она. Исследованы антимикробные и противоопухолевые свойства синтезированных соединений, обнаружены определенные закономерности взаимосвязи “структура–действие”. Идентифицированы соединения с высокой антибактериальной активностью относительно штамма Staphylococcus aureus ATCC 43300 и противогрибковой активностью в отношении штамма Cryptococcus neoformans ATCC 208821. Полученные результаты свидетельствуют о перспективах дальнейших исследований в направлении поиска эффективных антимикробных средств.
Список литературы
Tomasić T., Masic L.P. // Curr. Med. Chem. 2009. V. 16. P. 1596–1629. https://doi.org/10.2174/092986709788186200
Kaminskyy D., Kryshchyshyn A., Lesyk R. // Expert Opin. Drug Discov. 2017. V. 12. P. 1233–1252. https://doi.org/10.1080/17460441.2017.1388370
Keri R.S., Chand K., Budagumpi S., Balappa Somappa S., Patil S.A., Nagaraja B.M. // Eur. J. Med. Chem. 2017. V. 138. P. 1002–1033. https://doi.org/10.1016/j.ejmech.2017.07.038
Походыло Н.Т., Матийчук В.С., Обушак Н.Д. // Хим. гетероцикл. соед. 2009. Т. 45. С. 140–142. [Pokhodylo N.T., Matiychuk V.S., Obushak N.D. // Chem. Heterocycl. Comp. 2009. V. 45. P. 121–122.] https://doi.org/10.1007/s10593-009-0238-2
Bazel Y., Tupys A., Ostapiuk Y., Tymoshuk O., Matiychuk V.J. // Mol. Liq. 2017. V. 242. P. 471–477. https://doi.org/10.1016/j.molliq.2017.07.047
Обушак Н.Д., Горак Ю.И., Матийчук B.C., Лытвын Р.З. // ЖОрХ. 2008. Т. 44. С. 1712–1716. [Obushak N.D., Gorak Yu.I., Matiichuk V.S., Lytvyn R.Z. // Russ. J. Org. Chem. 2008. V. 44. P. 1689–1694.] https://doi.org/10.1134/S1070428008110213
Походыло Н.Т., Матийчук В.С., Обушак Н.Д. // Хим. гетероцикл. соед. 2009. Т. 45. С. 612–618. [Pokhodylo N.T., Matiychuk V.S., Obushak N.D. // Chem. Heterocycl. Comp. 2009. V. 45. P. 483–488.] https://doi.org/10.1007/s10593-009-0287-6
Pokhodylo N.T., Teslenko Y.O., Matiychuk V.S., Obushak M.D. // Synthesis. 2009. V. 16. P. 2741–2748. https://doi.org/10.1055/s-0029-1216875
Pokhodylo, N.T., Matiychuk, V.S. // J. Heterocyclic Chem. 2010. V. 47. P. 415–420. https://doi.org/10.1002/jhet.321
Chaban T.I., Ogurtsov V.V., Matiychuk V.S., Chaban I.G., Demchuk I.L., Nektegayev I.A. // Acta Chim. Slov. 2019. V. 66. P. 103–111. https://doi.org/10.17344/acsi.2018.4570
Obushak M.D., Matiychuk V.S., Turytsya V.V. // Tetrahedron Lett. 2009. V. 50. P. 6112–6115. https://doi.org/10.1016/j.tetlet.2009.08.024
Pokhodylo N.T., Teslenko Y.O., Matiychuk V.S., Obushak M.D. // Synthesis. 2009. V. 16. P. 2741–2748. https://doi.org/10.1055/s-0029-1216875
Tupys A., Kalembkiewicz J., Ostapiuk Y., Matiichuk V., Tymoshuk O., Woźnicka E., Byczyński Ł. // J. Therm. Anal. Calorim. 2017. V. 127. P. 2233–2242. https://doi.org/10.1007/s10973-016-5784-0
Walaa I. El-Sofany, Othman D.A.A., Mahran A.M., El-Manawaty A. May, Wael A. El-Sayed // Russ. J. Bioorg. Chem. 2020. V. 46. P. 393–402. https://doi.org/10.1134/S106816202003005X
El-Helw E.A.E., Derbala H.A., El-Shahawi M.M., Salem M.S., Ali M.M. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 42–53. https://doi.org/10.1134/S1068162019010047
Cai M.G., Wu Y., Chang J. // Bioorg. Med. Chem. Lett. 2016. V. 26. P. 2517–2520. https://doi.org/10.1016/j.bmcl.2016.03.089
Ponnuchamy S., Kanchithalaivan S., Kumar R.R., Ali M.A., Choon T.S. // Bioorg. Med. Chem. Lett. 2014. V. 24. P. 1089–1093. https://doi.org/10.1016/j.bmcl.2014.01.007
Remon M. Zaki, Adel M. Kamal El-Dean, Shaban M. Radwan, Mahmoud A. Ammar // Russ. J. Bioorg. Chem. 2020. V. 46. P. 85–96. https://doi.org/10.1134/S1068162020010148
Safaa I. Elewa, Eman Mansour, Ibrahim F. Nassar, Amal A.I. Mekawey // Russ. J. Bioorg. Chem. 2020. V. 46. P. 382–392. https://doi.org/10.1134/S1068162020030061
Shi F., Li C., Xia M., Miao K., Zhao Y., Tu S., Zheng W., Zhang G., Ma N. // Bioorg. Med. Chem. Lett. 2009. V. 19. P. 5565–5568. https://doi.org/10.1016/j.bmcl.2009.08.046
Sarigol D., Uzgoren-Baran A., Tel B.C., Somuncuoglu E.I., Kazkayasi I., Ozadali-Sari K., Unsal-Tan O., Okay G., Ertan M., Tozkoparan B. // Bioorg. Med. Chem. 2015. V. 23. P. 2518–2528. https://doi.org/10.1016/j.bmc.2015.03.049
Pomel V., Klicic J., Covini D., Church D.D., Shaw J.P., Roulin K., Burgat-Charvillon F., Valognes D., Camps M., Chabert C., Gillieron C., Françon B., Perrin D., Leroy D., Gretener D., Nichols A., Vitte P.A., Carboni S., Rommel C., Schwarz M.K., Rückle T. // J. Med. Chem. 2006. V. 49. P. 3857–3871. https://doi.org/10.1021/jm0601598
Li S.N., Xu Y.Y., Gao J.Y., Yin H.R., Zhang S.L., Li H.Q. // Bioorg. Med. Chem. 2015. V. 23. P. 3221–3227. https://doi.org/10.1016/j.bmc.2015.04.065
Bataille C.J., Brennan M.B., Byrne S., Davies S.G., Durbin M., Fedorov O., Huber K.V., Jones A.M., Knapp S., Liu G., Nadali A., Quevedo C.E., Russell A.J., Walker R.G., Westwood R., Wynne G.M. // Bioorg. Med. Chem. 2017. V. 25. P. 2657–2665. https://doi.org/10.1016/j.bmc.2017.02.056
Johnson S.L., Jung D., Forino M., Chen Y., Satterthwait A., Rozanov D.V., Strongin A.Y., Pellecchia M. // J. Med. Chem. 2006. V. 49. P. 27–30. https://doi.org/10.1021/jm050892j
Ding Y., Smith K.L., Varaprasad C.V., Chang E., Alexander J., Yao N. // Bioorg. Med. Chem. Lett. 2007. V. 17. P. 841–845. https://doi.org/10.1016/j.bmcl.2006.08.104
Xie Y., Liu Y., Gong G., Rinderspacher A., Deng S.X., Smith D.H., Toebben U., Tzilianos E., Branden L., Vidović D., Chung C., Schürer S., Tautz L., Landry D.W. // Bioorg. Med. Chem. Lett. 2008. V. 18. P. 2840–2844. https://doi.org/10.1016/j.bmcl.2008.03.079
Stephen Kumar Celestina, Sundaram K., Ravi S. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 405–415. https://doi.org/10.1134/S1068162019050066
Open-access antimicrobial screening program, https://www.co-add.org/
Monks A., Scudiero D., Skehan P., Shoemaker R., Paull K., Vistica D., Hose C., Langley J., Cronise P., Vaigro-Wolff A., Gray-Goodrich M., Campbell H., Joseph Mayo, Boyd M. // J. Nat. Cancer Inst. 1991. V. 83. P. 757–766. https://doi.org/10.1093/jnci/83.11.757
Boyd M.R., Paull K.D. // Drug Dev. Res. 1995. V. 34. P. 91–109. https://doi.org/10.1002/ddr.430340203
Boyd M.R. // In: Anticancer Drug Development Guide: Preclinical Screening, Clinical Trials, and Approval / Ed. Teicher B.A. Humana Press: Totowa, NJ, USA, 1997. P. 23–42.
Shoemaker R.H. // Nat. Rev. Cancer. 2006. V. 6. P. 813–823. https://doi.org/10.1038/nrc1951
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия