Биоорганическая химия, 2021, T. 47, № 4, стр. 495-505
Производное нейротоксина скорпиона BeM9, селективное в отношении потенциал-чувствительных натриевых каналов насекомых
М. А. Черных 1, Н. А. Кульдюшев 1, С. Пеньёр 2, А. А. Беркут 1, Я. Титгат 2, Р. Г. Ефремов 1, 3, А. А. Василевский 1, 3, *, А. О. Чугунов 1, 3
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 KU Leuven, ON II
3000 Leuven, Herestraat 49, box 922, Belgium
3 Московский физико-технический институт (национальный исследовательский университет)
141701 Долгопрудный, Институтский пер., 9, стр. 3, Россия
* E-mail: avas@ibch.ru
Поступила в редакцию 01.10.2020
После доработки 23.10.2020
Принята к публикации 25.10.2020
Аннотация
α-Нейротоксины скорпионов – небольшие белки, способные ингибировать инактивацию потенциал-чувствительных натриевых каналов. Они могут селективно действовать на каналы млекопитающих (млекотоксины), каналы насекомых (инсектотоксины) либо на оба типа каналов (α-подобные токсины). Модель, полноценно объясняющая селективность исходя из аминокислотной последовательности, еще не предложена, однако уже установлены некоторые закономерности. Так, у большей части млекотоксинов имеется остаток D8, участвующий в формировании так называемого мотива гнезда, но до сих пор не ясно, участвует ли этот остаток во взаимодействии с каналами. Задачей нашего исследования было получить производное α-подобного токсина BeM9 с заменой лизина в 8-м положении на глутамат (K8E), изменив заряд, но при этом исключив образование мотива гнезда. Кроме того, мы заменили тирозин в 17-м положении на характерный для млекотоксинов глицин (Y17G). Неожиданно оказалось, что производное с двумя заменами BeM9EG утратило активность на каналах млекопитающих, став инсектотоксином. Чтобы объяснить эти изменения, мы построили пространственные модели комплексов BeM9 и BeM9EG с каналами, а также провели расчеты молекулярной динамики изолированных токсинов. Анализ межмолекулярных контактов в комплексах не позволил объяснить причину изменения селективности. Тем не менее структура внутримолекулярных контактов и данные по молекулярной подвижности указывают на важную роль остатков K8 и Y17 в стабилизации определенной конформации петель BeM9. Мы предполагаем, что замена этих остатков аллостерически влияет на эффективность связывания токсинов с каналами.
ВВЕДЕНИЕ
В настоящее время продолжается разработка соединений, способных избирательно воздействовать на мишени в нервной системе насекомых, такие как потенциал-чувствительные натриевые каналы (ПЧНК). ПЧНК – трансмембранные белки, состоящие из четырех гомологичных повторов (D I–IV). Первые четыре спирали (S1–S4) каждого повтора и петли между ними составляют потенциал-чувствительный домен (ПЧД), реагирующий на изменение трансмембранного потенциала; еще две спирали (S5 и S6) входят в состав единого пóрового домена (ПД), пропускающего ионы. Активация ПЧД I–III необходима для открытия ПД, в то время как активация ПЧД IV приводит к быстрой инактивации каналов [1, 2].
Среди природных нейротоксинов находят модуляторы и блокаторы ионных каналов, зачастую имеющие белковую природу и селективно действующие на определенный вид каналов у определенных организмов. В частности, в яде скорпионов найдены так называемые α-токсины (α-NaTx), ингибирующие инактивацию ПЧНК за счет связывания с ПЧД IV (петли S1–S2 и S3–S4) и ПД I (петля S5–S6) каналов [3]. Некоторые α‑NaTx могут избирательно воздействовать на каналы млекопитающих (их называют млекотоксинами), другие – на каналы насекомых (инсектотоксины), а третьи (α-подобные) характеризуются широким спектром активности [4, 5]. Изучение природы селективности α-NaTx может помочь не только в фундаментальных исследованиях: специфичные инсектотоксины, по-видимому, могут использоваться в качестве инсектицидов, безопасных для позвоночных [6].
В 2013 г. после сравнительного анализа свойств молекулярной поверхности разных групп α-NaTx была выдвинута гипотеза, что их селективность определяется прежде всего модулем специфичности – частью токсина, образованной N-концевой областью (называемой также RT‑петлей), петлей в шпильке β2–β3 и C-концевой областью токсина, скрепленной с N-концевой частью дисульфидной связью (рис. 1а) [7]. Исследованная недавно с помощью криоэлектронной микроскопии структура комплекса млекотоксина Aah2 из яда скорпиона Androctonus australis с химерным ПЧНК показала, что модуль специфичности действительно формирует контакты с каналом, тогда как остальная часть токсина (сердцевинный модуль) практически не взаимодействует с каналом [3].
Рис. 1.
Структура α-NaTx. (a) – Общий план строения на примере α-подобного токсина BeM9 (PDB ID: 5MOU [11]). Зеленым цветом выделен модуль специфичности согласно гипотезе [7], состоящий из RT-петли, β2–β3-петли и С‑концевого участка, тогда как остальная часть называется сердцевинным модулем; голубым цветом показан β-лист из трех β-тяжей (β1–β3), оранжевым – α-спираль, желтым – связи атомов серы, участвующих в построении дисульфидных мостиков, фиолетовым – аминокислотные остатки, подверженные заменам; (б, в) – строение RT-петли у BeM9 и типичного млекотоксина Aah2 (PDB ID: 1PTX [14]). У Aah2 наблюдается мотив гнезда: боковая цепь остатка D8 ориентирована внутрь RT-петли и образует водородные связи (показаны красным пунктиром) с –NH-группами основной цепи остатков V10 и N11, тогда как у BeM9 K8 ориентирован наружу и систему связей не образует; (г) – сравнение аминокислотных последовательностей BeM9, его двойного мутанта BeM9EG и Ааh2. Цветовые обозначения аналогичны панели (а).

α-Подобный токсин M9 (BeM9) из яда скорпиона Mesobuthus eupeus (ранее назывался Buthus eupeus) – один из наиболее изученных α-NaTx; его пространственная структура была исследована в Институте биоорганической химии еще в 1980-х гг., став первой изученной структурой α‑NaTx [8, 9]. Ранее мы использовали этот α‑NaTx для получения на его основе специфичного млекотоксина: на каркас BeM9 был перенесен модуль специфичности токсина Aah2; кроме того, потребовалась замена нескольких аминокислотных остатков сердцевинного модуля [10]. Внимательное изучение пространственного строения BeM9 выявило ключевое значение остатка R60 в C-концевой области токсина для организации модуля специфичности за счет формирования сети водородных связей с образованием особого варианта мотива “ниши” – так называемой “аргининовой руки” [11]. Мутант R60K теряет возможность взаимодействовать с каналами млекопитающих, становясь инсектотоксином.
В данном исследовании мы сосредоточились на роли другой части модуля специфичности (RT-петле; рис. 1б) и получили новое производное BeM9, обладающее избирательностью в отношении ПЧНК насекомых.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор аминокислотных замен для модификации BeM9. Сравнение аминокислотных последовательностей α-NaTx показало, что у млекотоксинов в RT-петле присутствует высококонсервативный остаток аспарагиновой кислоты в 8-м положении. У инсектотоксинов и α-подобных токсинов в этом положении обычно имеется нейтральный (Q) или положительно заряженный остаток (K, как у BeM9). Интересно при этом, что у классического инсектотоксина BjαIT из яда Hottentotta judaicus здесь, как и у млекотоксинов, находится остаток аспарагиновой кислоты [12]. Внимательный анализ пространственной структуры различных α-NaTx показал, что у млекотоксинов данный остаток участвует в поддержании определенной конформации RT-петли за счет формирования множества водородных связей с ‒NH-группами основной цепи (так называемый мотив гнезда [13], рис. 1в). Мы решили узнать, играет ли непосредственно отрицательный заряд остатка в 8-м положении важную роль во взаимодействии с каналами млекопитающих. Чтобы при этом предотвратить образование мотива гнезда, мы провели замену K8 у BeM9 на остаток не аспаргиновой, а глутаминовой кислоты, длина боковой цепи которой не оптимальна для этого мотива.
Как было обнаружено ранее [7], RT-петля у млекотоксинов характеризуется сравнительно высокой подвижностью. Отчасти это объясняется тем, что на участке, соединяющем RT-петлю с α-спиралью, у млекотоксинов встречается характерный остаток глицина G17 (по нумерации Aah2). На основании анализа аминокислотных последовательностей и пространственной структуры α-NaTx мы предположили, что изменение заряда и подвижности RT-петли за счет двух мутаций (K8E и Y17G, рис. 1г) придаст α-подобному токсину BeM9 специфичность к каналам млекопитающих. Для проверки этого предположения мы приступили к получению производных BeM9 с указанными заменами.
Получение рекомбинантного BeM9 и его производных. Для получения достаточного материала для исследования активности мы использовали бактериальную экспрессионную систему и плазмиду, кодирующую BeM9, полученную в предыдущем исследовании [7, 11]. ДНК, кодирующая BeM9-K8E (BeM9E) и BeM9-K8E,Y17G (BeM9EG), была получена с помощью ПЦР с перекрывающимися синтетическими олигонуклеотидами. Гены целевых полипептидов клонировали в одной рамке считывания с геном белка-носителя тиоредоксина (Trx). Слитные белки Trx-BeM9, Trx-BeM9E и Trx-BeM9EG выделяли из общего лизата бактериальных клеток с помощью металл-хелатной хроматографии. Целевые полипептиды отделяли от Trx с использованием бромциана. Хроматографическая чистота полипептидов более 95% была достигнута с помощью двух раундов ВЭЖХ.
Корректный синтез целевых полипептидов с образованием дисульфидных связей был подтвержден путем измерения молекулярной массы очищенных продуктов методом MALDI-масс-спектрометрии: измеренные массы BeM9, BeM9E и BeM9EG составляли 7335.1, 7336.1 и 7230.1 Да соответственно (расчетные массы 7335.2, 7336.2 и 7230.0 Да); выход – 2 мг с 1 л среды LB. Существенная проблема при гетерологической экспрессии белков – правильное формирование дисульфидных связей. В случае BeM9 и его производных эта проблема решается за счет Trx: известно, что он способствует корректному фолдингу дисульфид-содержащих белков [15]. Недавно решенная с помощью спектроскопии ЯМР пространственная структура рекомбинантного BeM9 подтверждает корректность образования S–S-мостиков [11].
Изучение активности производных BeM9 на ПЧНК. Эффекты производных BeM9 были изучены в сравнении с исходным токсином в концентрации 1 мкМ в отношении ряда ПЧНК. Был применен стандартный подход, подразумевающий экспрессию генов каналов (α-субъединиц и соответствующих вспомогательных β-субъединиц) в ооцитах Xenopus laevis (рис. 2). Как и исходный токсин, BeM9E и BeM9EG не проявляли активности в отношении Nav1.2, но были активны на канале таракана BgNav1, хотя активность стала менее выраженной (табл. 1). В отличие от BeM9, у BeM9E была резко снижена активность на Nav1.5 и Nav1.6, тогда как BeM9EG не проявил активности на этих каналах вообще. Таким образом, BeM9EG не был активен на всех протестированных каналах млекопитающих и был классифицирован как инсектотоксин.
Рис. 2.
Активность токсина BeM9 и его производных на изоформах потенциал-чувствительных натриевых каналов. Показаны токи через мембрану ооцитов, экспрессирующих клонированные изоформы ПЧНК, в контроле и после инкубации с токсинами в концентрации 1 мкМ. Пунктирная линия показывает нулевой уровень тока. Амплитуда тока приведена в условных единицах I/(|Imin|) (см. пояснения в “Эксперим. части”). Представлены репрезентативные записи по крайней мере трех независимых экспериментов.

Таблица 1.
Активность токсина BeM9 и его производных в отношении потенциал-чувствительных натриевых каналов
| Токсин | Nav1.2 | Nav1.4 | Nav1.5 | Nav1.6 | BgNav1 |
|---|---|---|---|---|---|
| BeM9 | Н/а (3) | 0.23 ± 0.03 (4) | 0.46 ± 0.03 (3) | 0.60 ± 0.04 (8) | 1.93 ± 0.05 (7) |
| BeM9E | Н/а (3) | Н/а (4) | 0.05 ± 0.01 (4) | 0.05 ± 0.04 (3) | 1.16 ± 0.03 (5) |
| BeM9EG | Н/а (3) | Н/а (4) | Н/а (4) | Н/а (4) | 0.56 ± 0.06 (6) |
В 2019 г. была определена пространственная структура комплекса химерного канала hNav1.7-NavPas (фрагменты аминокислотной последовательности канала таракана Periplaneta americana NavPas, включая внеклеточные петли ПЧД IV и контактирующий участок ПД I, были заменены на соответствующие участки канала человека Nav1.7) с млекотоксином Aah2 (PDB ID: 6NT4 [3]). Мы предположили, что модели комплексов BeM9 с ПЧНК млекопитающих и насекомых, построенные на ее основе, могут объяснить природу селективности BeM9EG. Для этого были построены статичные модели BeM9 и BeM9EG с каналами Nav1.4 человека и BgNav таракана и изучены межмолекулярные контакты в них (подробности моделирования см. в “Эксперим. части”). Мы ожидали увидеть явное изменение межмолекулярных контактов, способствующее потере аффинности BeM9EG к каналам млекопитающих, однако результаты простейшего моделирования этого не показали. Согласно полученной модели, остатки Y17/G17 не формируют контакты с каналом и не могут напрямую влиять на активность токсина. K8 в BeM9 не участвует во взаимодействии с каналами, в то время как в BeM9EG Е8 образует межмолекулярную ионную связь с остатком К1439/1705 (номер остатка у hNav1.4/BgNav) (рис. 3в, 3г). Однако в случае BeM9 с К1439/1705 аналогичный контакт тоже имеет место, но его образует другой остаток – Е15.
Рис. 3.
Модели комплексов потенциал-чувствительных натриевых каналов с α-токсином BeM9 и его мутантом BeM9EG. (а) – Общий вид комплекса ПЧНК с α-NaTx с внеклеточной стороны. ПЧНК изображен цветной поверхностью с индивидуально раскрашенными гомологичными повторами: D I (фиолетовый), D II (синий), D III (голубой), D IV (зеленый). Расположенные в центре части каждого повтора формируют ПД, дистальные части образуют ПЧД I–IV. Токсин (показан оранжевым) связывается с каналом в области ПЧД IV, частично захватывая ПД I; (б) – сайт связывания токсина (увеличен). Петля S3–S4 обозначена светло-зеленым, S1–S2 – темно-зеленым, ПД I – фиолетовым, C-конец токсина отмечен синей сферой; (в, г) – ионные связи RT-петли BeM9 c S3–S4-петлей ПЧНК. Желтым показана молекула токсина (BeM9 на панели (в) и BeM9EG на панели (г)), голубым – Nav1.4, зеленым – BgNav. Оранжевым выделены ключевые аминокислотные остатки токсина, участвующие во взаимодействии с каналами или подверженные мутагенезу.

Анализ комплексов не позволяет сказать, почему изменяется селективность BeM9EG, поскольку структура петли S3–S4 крайне консервативна. Мы предположили, что причина этого явления кроется прежде всего в аллостерических эффектах, что привело нас к анализу изменения структуры и внутримолекулярных контактов у токсина после внесения мутаций.
Анализ изменений структуры BeM9, вызванных мутациями. Поскольку мы не смогли объяснить изменения специфичности, моделируя статичные комплексы BeM9/ПЧНК, было решено изучить динамические свойства молекулы токсина BeM9 и его производного BeM9EG. Для этого мы рассчитали для каждого из них молекулярную динамику длительностью 100 нс в трех повторностях, а затем провели поиск структурных изменений с помощью анализа внутримолекулярных контактов нескольких типов: водородных связей, гидрофобных взаимодействий, солевых мостиков, стэкинга и π-катионных взаимодействий, представляя их в виде карты контактов – массива точек 66 × 66 (рис. 4).
Рис. 4.
Карты внутримолекулярных контактов токсина BeM9 и его мутанта BeM9EG. Координаты каждой точки соответствуют номерам остатков, которые могут образовывать контакт. Интенсивность окраски точек для водородных связей и гидрофобных контактов (см. шкалу справа) пропорциональна доле времени от суммарной длительности трех траекторий молекулярной динамики (3 × 100 нс), в течение которой этот контакт существует. Остальные типы контактов показаны качественно: если контакт существует более 10% времени, он выделен точкой, если менее – не показан. Контакты, находящиеся в окрестностях RT-петли, обведены красной рамкой и представлены более крупными точками. Красными рамками выделены области наиболее значимых отличий между BeM9 и BeМ9EG, отражающие эффекты мутаций К8Е и Y17G. Для π-катионных взаимодействий и солевых мостиков приведена одна карта: сверху над диагональю изображены солевые мостики, снизу – π-катионные взаимодействия.

Анализ внутримолекулярных контактов, а также вычисление значений среднеквадратичных флуктуаций (Root Mean Square Fluctuation, RMSF) показали, что одна из мутаций (Y17G) повышает подвижность петли перед α-спиралью за счет потери гидрофобных взаимодействий и стэкинга Y17–Y23, а также увеличения гибкости основной цепи за счет введения остатка глицина. Новообразовавшийся в BeМ9EG контакт Y14–Y23, по-видимому, не оказывает стабилизирующего действия на данный участок токсина. Ключевые эффекты мутации Y17G показаны на рис. 5.
Рис. 5.
Влияние мутации Y17G на структуру BeM9EG. (а) – Дифференциальная карта гидрофобных контактов между BeМ9 и BeМ9EG в окрестностях RT-петли и α-спирали, полученная вычитанием карт гидрофобных (нижняя левая часть карты) и стэкинговых (верхняя правая часть) контактов BeM9 из BeМ9EG (рис. 4). Голубым показана потеря гидрофобных контактов у BeМ9EG по сравнению с BeM9, коричневым – их приобретение; интенсивность цвета отражает потерю или приобретение контактов между соответствующими остатками в долях времени от траектории (согласно шкале справа). Синим показана потеря стэкинг-взаимодействия Y17–Y23 у BeM9, красным – формирование стэкинг-взаимодействия Y14–Y23 у BeМ9EG; на панелях (б, в) приведены типичные конформации, выбранные из расчетов молекулярной динамики; (б) – структура BeM9: зеленым показаны остатки, участвующие в стэкинг-взаимодействиях; оранжевым – не участвующие в данной структуре, но участвующие в BeМ9EG; фиолетовым – остатки, у которых возрастает подвижность после мутации; серым – все другие остатки; (в) – структура BeМ9EG: окраска аналогична BeM9, но оранжевым обозначены остатки, не участвующие в стэкинг-взаимодействиях у BeМ9EG, но участвующие у BeM9; (г) – значения RMSF BeM9 (желтый) и BeМ9EG (зеленый), усредненные по трем траекториям. Черная линия под графиком соответствует сердцевинному модулю, синим обозначены β-тяжи, красным – α-спираль, фиолетовым – окрестности замены Y17G, где после мутации возрастает подвижность (та же область, что и на панелях (б, в)).
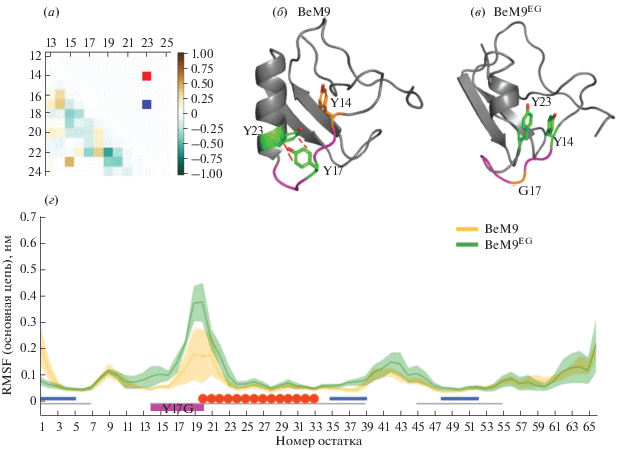
Влияние ключевой мутации К8Е раскрывается через изменение системы солевых мостиков и π-катионных взаимодействий (рис. 6). Мотив гнезда, как и предполагалось, у мутанта не наблюдается (рис. 6б). Кроме того, в BeM9 существует стабильная система взаимодействующих пар остатков K8–Y14 и K8–E15, смена заряда в 8-й позиции на противоположный разрушает ее за счет отталкивания одноименных зарядов E8–E15. Также у мутанта утрачивается контакт Е15–К20, что может объясняться эффектом обеих замен. K8 может балансировать между Y14 и Е15, а E15 – между K8 и K20, что может обеспечивать переход между двумя стабильными конформациями BeM9, тогда как в BeM9EG структура в целом более подвижна и менее упорядочена.
Рис. 6.
Влияние мутации K8E на структуру BeM9. Зеленым показаны остатки К8, Y14, E15 и K20, участвующие в ионных и π-катионных взаимодействиях, оранжевым – они же, но не участвующие, серым – другие остатки. Красным пунктиром показаны взаимодействия между остатками. Приведенные конформации взяты из расчетов молекулярной динамики. (а) – Структура BeM9. Сверху показан солевой мостик K8–E15, снизу – солевой мостик Е15–К20 и π-катионное взаимодействие K8–Y14. Слева от структур показаны доли времени моделирования, в течение которых наблюдаются соответствующие контакты, усредненные по трем траекториям; (б) – структура BeМ9EG. Сверху показана структура RT-петли аналогично рис. 1б и 1в, снизу – общий вид структуры.

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение рекомбинантных производных BeM9. Синтез нуклеотидных последовательностей, кодирующих BeM9E и BeM9EG, был проведен с помощью лигирования олигонуклеотидных фрагментов (табл. 2) и ПЦР аналогично описанной ранее процедуре для BeM9 [7, 16]. Полученные полноразмерные последовательности были клонированы в экспрессионный вектор pET-32b (Novagen, США) по сайтам рестрикции KpnI и BamHI. В результате в составе вектора были получены химерные гены слитных белков, состоящих из Trx и токсина: Trx-BeM9E и Trx-BeM9EG.
Таблица 2.
Последовательности синтетических олигонуклеотидов для конструирования ДНК, кодирующей производные токсина BeM9
| Название | Последовательность олигонуклеотида (5'–3') |
|---|---|
| M9f1 | ATATGGTACCATGGCTCGTGACGCTTACATCGCTG |
| M9f2* | AACCGCACAACTGCGTTTACGAATGCTACAACCCGAAAGGTTCTT |
| M9f2-2* | AACCGCACAACTGCGTTTACGAATGCGGCAACCCGAAAGGTTCTT |
| M9f3 | ACTGCAACGACCTGTGCACCGAAAACGGTGCTGAATCTGGTTACT |
| M9f4 | GCCAGATCCTGGGTAAATACGGTAACGCTTGCTGGTGCATCCA |
| M9f5 | GCTGCCGGACAACGTTCCGATCCGTATCCCGGGTAAATGCC |
| M9r1/2 | AAACGCAGTTGTGCGGTTCAGCGATGTAAGCGTCAC |
| M9r2/3* | TGCACAGGTCGTTGCAGTAAGAACCTTTCGGGTTGT |
| M9r2/3-2* | TGCACAGGTCGTTGCAGTAAGAACCTTTCGGGTTGC |
| M9r3/4 | ATTTACCCAGGATCTGGCAGTAACCAGATTCAGCAC |
| M9r4/5 | GAACGTTGTCCGGCAGCTGGATGCACCAGCAAGC |
| M9r | GCATGGATCCCTAGTGGCATTTACCCGGGATAС |
Примечание: сайты рестрикции (KpnI в M9f1 и BamHI в M9r) выделены курсивным шрифтом, кодон метионина – жирным курсивным шрифтом, стоп-кодон – жирным шрифтом. Подчеркнуты нуклеотиды, отличающиеся от последовательности гена BeM9.
* M9f2 и M9r2/3 использовали для синтеза гена BeM9E, M9f2-2 и M9r2/3-2 – для синтеза гена BeM9EG.
Экспрессию химерных генов проводили в штамме Escherichia coli BL21(DE3) [17]. Культуру бактерий, трансформированных с использованием экспрессионного вектора, выращивали в среде LB с добавлением ампициллина (100 мкг/мл) при 37°C и интенсивном перемешивании. Индукцию экспрессии целевых генов осуществляли добавлением в среду 0.2 мМ изопропил-β-D-1-тиогалактопиранозида, после чего культуру инкубировали еще 4 ч. По истечении этого времени бактерии осаждали, ресуспендировали в стартовом буфере для аффинной хроматографии (300 мМ NaCl, 20 мМ Трис-HCl, pH 7.5) и лизировали с помощью ультразвука.
Слитные белки имели в своем составе гексагистидиновую последовательность, которая позволяет проводить их очистку с помощью металл-хелатной хроматографии [18] на сорбенте TALON Superflow Metal Affinity Resin (Clontech, США). Элюцию сорбированных белков проводили буфером, содержащим имидазол (150 мМ имидазол, 300 мМ NaCl, 20 мМ Трис-HCl, pH 7.5). Последовательность производных BeM9 не содержит остатков метионина, поэтому целевые токсины отщепляли от Trx с помощью бромциана по описанной методике [19]. Для этого в последовательность химерных генов был специально введен метиониновый кодон непосредственно перед геном токсина. Очистку отщепленных от Trx производных BeM9 проводили с помощью офВЭЖХ.
Масс-спектрометрия. Полипептиды анализировали с помощью времяпролетной MALDI-масс-спектрометрии с использованием спектрометра Ultraflex TOF-TOF (Bruker Daltonics, США), анализ проводили, как описано ранее [20]. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту (Sigma-Aldrich, США). Измерения проводили как в линейном, так и в рефлекторном режимах. Масс-спектры анализировали с помощью программного обеспечения Data Analysis 4.3 и Data Analysis Viewer 4.3 (Bruker, США).
Электрофизиология. Активность полученных производных сравнивали с исходным токсином BeM9 по эффекту в отношении ПЧНК, экспрессированных в ооцитах лягушки X. laevis. Выделение ооцитов, получение РНК, а также сбор и анализ данных проводили, как описано ранее [7, 10]. Мы использовали гены ряда изоформ ПЧНК млекопитающих: Nav1.2 и 1.4 крысы (r), Nav1.5 человека (h), Nav1.6 мыши (m), вспомогательных субъединиц rβ1 и hβ1, а также α-субъединицы BgNav1 и вспомогательной субъединицы TipE, клонированных из генома таракана Blattella germanica и дрозофилы. Для оценки эффективности токсинов мы использовали величину, равную отношению регистрируемой величины тока через мембрану ооцита спустя 30 мс после подачи тестового импульса к пиковому току (I30 мс/Imin). В случае канала Nav1.5 из-за быстрой кинетики его работы использовали отношение тока через 5 мс после тестового импульса к пиковому току (I5 мс/Imin). Все данные анализировали с помощью программного обеспечения pClamp Clampfit версии 10.4 (Molecular Devices, США) и Origin Pro версии 8.0 (OriginLab, США).
Молекулярное моделирование. Для сравнительного анализа использовали комплексы токсинов BeM9 и BeM9EG с каналами человека Nav1.4 и таракана BgNav. Основой для моделирования стал комплекс химерного канала hNav1.7-NavPas с Aah2 (PDB ID: 6NT4 [3]), куда путем пространственного совмещения на место Aah2 вставили исследуемые токсины, а на место hNav1.7-NavPas – исследуемые каналы. Структуры hNav1.4 и BgNav получили на основе hNav1.7-NavPas при помощи моделирования по гомологии в программе MODELLER v. 9.19 [21]. На основе шаблона построили 20 моделей и выбрали 3 модели с лучшим показателем оценивающей функции. Для минимизации энергии комплексов использовали вакуумные кубические ячейки (160 × 160 × 160 Å3), программу GROMACS 5.1.2 [22] и силовое поле amber99sb-ildn.ff [23].
Внутримолекулярные эффекты от мутаций в BeM9 оценивали с помощью сравнительного моделирования α-подобного токсина BeM9 дикого типа (PDB ID: 5MOU) и его двойного мутанта, специфичного к ПЧНК насекомых, – BeM9EG. Модель BeM9EG построили на основе гомологии с BeM9 в программе MODELLER v. 9.19 [21].
Для сравнения динамики молекул использовали метод молекулярной динамики. Радиус отсечки ван-дер-ваальсовых и электростатических взаимодействий составил 10 и 12 Å соответственно. Для расчетов молекулярной динамики токсинов построили кубические ячейки (55 × 55 × 55 Å3) c моделью воды SPC [24], содержащие противоионы для электронейтральности и уравновешенные по энергии путем нагревания до 300 К в течение 100 пс. Молекулярную динамику проводили в периодических граничных условиях при Т = 300 К и P = 1 бар, поддерживаемых при помощи термостата V-rescale [25] и баростата Берендсена [26] соответственно. Длина и шаг траектории составили 100 нс и 2 фс соответственно. Для каждой изучаемой молекулы было проведено по три независимых расчета для статистического сравнения.
Молекулярные контакты. Для расчета внутри- и межмолекулярных контактов использовали программное обеспечение IMPULSE (разработано Н.А. Крыловым, статья готовится к публикации). Все парные взаимодействия, обнаруженные в траекториях, классифицировали как водородные связи, гидрофобные контакты, солевые мостики (ионные связи), параллельный и Т-образный стэкинг на основании взаимного расположения, энергии взаимодействия и типа контактирующих остатков. Полученные данные перевели в формат точечных карт размером 66 × 66, где координаты точек соответствуют номерам остатков, а интенсивность окраски отражает долю времени существования контакта от времени моделирования (100 нс), собственным скриптом Python.
ЗАКЛЮЧЕНИЕ
В рамках выполненной работы мы попытались выяснить, какие механизмы стоят за наблюдаемым изменением селективности α-подобного токсина BeM9 при внесении двух замен (K8E и Y17G) в его структуру. Мутации привели к неожиданному результату: BeM9EG потерял активность на каналах млекопитающих, оставшись активным на каналах насекомых, тогда как мы ожидали обратного эффекта. Чтобы выяснить причину такого изменения активности, мы сравнили модели комплексов ПЧНК млекопитающих и насекомых с BeM9 и BeM9EG, а также провели при помощи метода молекулярной динамики сравнительный анализ внутримолекулярных контактов в этих токсинах.
Анализ комплексов показал, что характер взаимодействия с ПЧНК изменяется: остаток K1439/1705 каналов формирует ионную связь с E15 у BeM9, а К8 во взаимодействии не участвует, тогда как в случае BeM9EG с K1439/1705 контактирует остаток Е8. Однако петля S3–S4 и, в частности, остаток K1439/1705 консервативны, поэтому построенные модели могут объяснить изменение активности по отношению ко всем ПЧНК, но не изменение селективности токсина. Это показывает, что простые модели комплексов неинформативны, а причина изменения селективности может заключаться в аллостерических эффектах.
Анализ молекулярной динамики изолированных токсинов показал, что в области замены Y17G BeМ9EG имеет бóльшую подвижность. Это может объясняться потерей стэкингового контакта Y17–Y23, а также гибкостью основной цепи в области остатка глицина. Замена K8E разрушает переключаемую систему связей K8–E15–K20 и Y14–K8–E15, что может уменьшить стабильность RT-петли и ее окружения. В BeМ9EG эти связи утеряны, поэтому RT-петля и ее окрестность становятся более подвижными, и система из двух стабильных конформаций исчезает. Мы предполагаем, что такая перестройка токсина в результате внесения мутаций и приводит в конечном итоге к нарушению стабильности его комплекса с ПЧНК млекопитающих. Дальнейшее детальное изучение структуры и конформационной мобильности модуля специфичности α-NaTx может раскрыть природу “двойной” активности α-подобных токсинов и способствовать созданию селективных лигандов на различные типы ПЧНК.
Список литературы
Catterall W.A. // Neurochem. Res. 2017. V. 42. P. 2495–2504. https://doi.org/10.1007/s11064-017-2314-9
Capes D.L., Goldschen-Ohm M.P., Arcisio-Miranda M., Bezanilla F., Chanda B. // J. Gen. Physiol. 2013. V. 142. P. 101–112. https://doi.org/10.1085/jgp.201310998
Clairfeuille T., Cloake A., Infield D.T., Llongueras J.P., Arthur C.P., Li Z.R. // Science. 2019. V. 363. Р. eaav8573. https://doi.org/10.1126/science.aav8573
Bosmans F., Tytgat J. // Toxicon. 2007. V. 49. P. 142–158.
Gordon D., Karbat I., Ilan N., Cohen L., Kahn R., Gilles N. // Toxicon. 2007. V. 49. P. 452–472. https://doi.org/10.1016/j.toxicon.2006.09.023
King G.F. // Pest Manag. Sci. 2019. V. 75. P. 2437–2445. https://doi.org/10.1016/j.toxicon.2006.11.016
Chugunov A.O., Koromyslova A.D., Berkut A.A., Peigneur S., Tytgat J., Polyansky A.A. // J. Biol. Chem. 2013. V. 288. P. 19014–19027. https://doi.org/10.1002/ps.5452
Pashkov V.S., Anh Hoang N., Maiorov V.N., Bystrov V.F. // Peptides. 1988. P. 77–78. https://doi.org/10.1074/jbc.M112.431650
Pashkov V.S., Khoang N.A., Maiorov V.N., Bystrov V.F. // Bioorg. Khim. 1986. V. 12. P. 1306–1316. https://doi.org/10.1007/978-94-010-9595-2_21
Kuldyushev N.A., Berkut A.A., Peigneur S., Tytgat J., Grishin E.V., Vassilevski A.A. // FEBS Lett. 2017. V. 591. P. 3414–3420. https://doi.org/10.1002/1873-3468.12839
Kuldyushev N.A., Mineev K.S., Berkut A.A., Peigneur S., Arseniev A.S., Tytgat J. // Proteins. 2018. V. 86. P. 1117–1122. https://doi.org/10.1002/prot.25583
Arnon T., Potikha T., Sher D., Elazar M., Mao W., Tal T. // Insect Biochem. Mol. Biol. 2005. V. 35. P. 187–195. https://doi.org/10.1016/j.ibmb.2004.11.005
Watson J.D., Milner-White E.J. // J. Mol. Biol. 2002. V. 315. P. 171–182. https://doi.org/10.1006/jmbi.2001.5227
Housset D., Habersetzer-Rochat C., Astier J.P., Fontecilla-Camps J.C. // J. Mol. Biol. 1994. V. 238. P. 88–103. https://doi.org/10.1006/jmbi.1994.1270
LaVallie E.R., DiBlasio E.A., Kovacic S., Grant K.L., Schendel P.F., McCoy J.M. // Biotechnology. 1993. V. 11. P. 187–193. https://doi.org/10.1038/nbt0293-187
Shlyapnikov Y.M., Andreev Y.A., Kozlov S.A., Vassilevski A.A., Grishin E.V. // Protein Expr. Purif. 2008. V. 60. P. 89–95. https://doi.org/10.1016/j.pep.2008.03.011
Studier F.W., Moffatt B.A. // J. Mol. Biol. 1986. V. 189. P. 113–130. https://doi.org/10.1016/0022-2836(86)90385-2
Hochuli E., Bannwarth W., Döbeli H., Gentz R., Stüber D. // Nat. Biotechnol. 1988. V. 6. P. 1321–1325. https://doi.org/10.1038/nbt1188-1321
Andreev Y.A., Kozlov S.A., Vassilevski A.A., Grishin E.V. // Anal. Biochem. 2010. V. 407. P. 144–146. https://doi.org/10.1016/j.ab.2010.07.023
Kuzmenkov A.I., Sachkova M.Y., Kovalchuk S.I., Grishin E.V., Vassilevski A.A. // Biochem. J. 2016. V. 473. P. 2495–2506. https://doi.org/10.1042/BCJ20160436
Webb B., Sali A. // Curr. Protoc. Bioinformatics. 2016. V. 54. P. 5.6.1–5.6.37. https://doi.org/10.1002/cpbi.3
Abraham M.J., Murtola T., Schulz R., Páll S., Smith J.C., Hess B. // SoftwareX. 2015. V. 1–2. P. 19–25. https://doi.org/10.1016/j.softx.2015.06.001
Lindorff-Larsen K., Piana S., Palmo K., Maragakis P., Klepeis J.L., Dror R.O. // Proteins. 2010. V. 78. P. 1950–1958. https://doi.org/10.1002/prot.22711
Jorgensen W.L., Chandrasekhar J., Madura J.D., Impey R.W., Klein M.L. // J. Chem. Phys. 1983. V. 79. P. 926–935. https://doi.org/10.1063/1.445869
Bussi G., Donadio D., Parrinello M. // J. Chem. Phys. 2007. V. 126. P. 014101. https://doi.org/10.1063/1.2408420
Berendsen H.J.C., Postma J.P.M., van Gunsteren W.F., DiNola A., Haak J.R. // J. Chem. Phys. 1984. V. 81. P. 3684–3690. https://doi.org/10.1063/1.448118
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


