Биоорганическая химия, 2021, T. 47, № 4, стр. 486-494
Получение модифицированной гиалуроновой кислоты с контролируемым содержанием винильных групп с целью создания скаффолдов методом фотоиндуцируемой реакции сшивки
А. В. Сочилина 1, 2, *, А. Г. Савельев 2, 3, Р. А. Акасов 1, 3, 2, В. П. Зубов 1, Е. В. Хайдуков 1, 3, 2, А. Н. Генералова 1
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Федеральный научно-исследовательский центр “Кристаллография и фотоника” РАН
119333 Москва, Ленинский просп., 59, Россия
3 Первый Московский государственный медицинский университет имени И.М. Сеченова
119991 Москва, ул. Трубецкая, 8/2, Россия
* E-mail: ddraig@yandex.ru
Поступила в редакцию 17.08.2020
После доработки 20.08.2020
Принята к публикации 26.08.2020
Аннотация
Материалы на основе гиалуроновой кислоты (ГК) активно используют в качестве скаффолдов для решения задач тканевой инженерии. Один из способов их получения – реакция фотоиндуцируемой сшивки, которая требует модификации ГК винильными группами, способными вступать в радикальную реакцию под действием света. Важная характеристика модифицированной ГК (мГК) – количество привитых винильных групп, представленное в виде степени замещения (СЗ), отвечающей за механические, химические и биологические свойства скаффолдов. В данной работе показана возможность контролируемого управления СЗ путем изменения параметров реакции (состава и концентрации компонентов, условий реакции), а также влияние СЗ на вязкость растворов мГК. Продемонстрирован пример фотоиндуцированной реакции мГК в присутствии флавинмононуклеотида в качестве инициатора для создания методом 3D-печати скаффолдов, которые не проявляют цитотоксических свойств. Изучен характер роста фибробластов на поверхности скаффолда.
ВВЕДЕНИЕ
В настоящее время активно развивается такое инновационное направление науки, как тканевая инженерия, цель которой – создание конструкций, способных поддерживать, восстанавливать и замещать поврежденные ткани и органы. Основой таких конструкций служат скаффолды, представляющие собой трехмерные каркасные структуры, на поверхности и внутри которых могут закрепляться и пролиферировать клетки [1–3]. После имплантации скаффолдов в месте дефекта формируется новая биоткань, а изначальный каркас деградирует или удаляется хирургически. Для применения в сфере тканевой инженерии скаффолды должны удовлетворять ряду требований [4, 5]: 1) биосовместимость, отсутствие цитотоксичности, иммуногенности и пирогенности как самих изделий, так и продуктов их распада; 2) биодеградируемость, которая определяет возможность замещения искусственных конструкций собственными тканями организма; 3) свойства поверхности, способствующие адгезии, пролиферации и сохранению функций клеток; 4) механическая прочность, аналогичная таковой у замещаемой ткани; 5) оптимальная пористость для свободного распределения клеток и вырабатываемого ими межклеточного матрикса, а также для эффективного обмена веществ; при этом должен соблюдаться баланс между пористостью и механической прочностью.
Помимо перечисленных требований, методика изготовления скаффолдов должна быть хорошо воспроизводимой, масштабируемой и экономически целесообразной. Скаффолды могут быть изготовлены на основе металлов, керамики, синтетических и природных полимеров, а также их композитов. Скаффолды на основе металлов и керамики не подвергаются деградации, что может вызывать осложнения при длительном применении. Использование для формирования скаффолдов синтетических полимеров, имеющих преимущественно гидрофобную поверхность, затрудняет прикрепление клеток, а также приводит к появлению токсичных продуктов деградации, как, например, в случае сополимера лактида с гликолидом, допущенного FDA к применению [4–6]. В последнее время большое внимание уделяют материалам на основе природных полимеров и их производных, особенно эндогенным соединениям, поскольку они a priori обладают хорошей биосовместимостью и способностью к ферментативной деградации в организме. Один из таких полимеров – линейный полисахарид – гиалуроновая кислота (ГК), состоящая из повторяющихся неразветвленных звеньев глюкуроновой кислоты и N-ацетилглюкозамина. ГК – один из основных компонентов внеклеточного матрикса, входит в состав соединительной, эпителиальной и нервной тканей, содержится во многих биологических жидкостях (слюне, синовиальной жидкости и др.), а также принимает активное участие в пролиферации и миграции клеток [7, 8]. Однако изготовление скаффолдов на ее основе затруднено из-за чрезвычайно высокого коэффициента набухания и неспособности полисахарида удерживать заданную форму гидрогеля.
Разработаны методы получения композитных скаффолдов на основе ГК за счет образования нековалентных связей, например, с коллагеном, фиброином шелка, комплементарной ДНК или поливиниловым спиртом [9–12], а также за счет модификации ГК термочувствительными полимерами [13]. Однако нековалентная сшивка не способна решить проблему слабой механической прочности гидрогелей ГК, поэтому перспективное направление – разработка методов получения скаффолдов ГК за счет реакции ковалентной внутри- и межмолекулярной сшивки цепей ГК. Один из подходов – модификация ГК путем введения винильных групп и проведение радикальной реакции сшивки, которая может быть реализована не только с участием химических реагентов, но и под действием света. Фотоиндуцированные реакции сшивки позволяют создавать материалы с требуемыми физико-химическими свойствами при сохранении биосовместимости и способности к биодеградации. Изготовление скаффолдов может проводиться методом микромолдинга или лазерной 3D-печати [14–17], кроме того, формирование конструкции может быть реализовано непосредственно в живом организме без предварительной стадии in vitro [18].
Для получения производных ГК, содержащих винильные группы, активно используют реакции полимераналогичных превращений с участием ангидрида метакриловой кислоты или глицидилметакрилата (ГМА) [19–22]. Ключевой параметр при получении таких производных – концентрация винильных групп, которая может быть представлена в виде степени замещения (СЗ) групп полимера остатками ГМА. СЗ влияет не только на степень сшивки, но и на цитотоксичность, биодеградируемость и механические свойства получаемых скаффолдов. Управление СЗ – настраиваемый инструмент для получения скаффолдов с заданными свойствами. СЗ может быть оценена с помощью ИК- [23] и 1H-ЯМР-спектроскопии [20, 22], однако точное определение СЗ такими методами затруднено вследствие высокой гигроскопичности и полимерной природы модифицированной ГК (мГК), что приводит к уширению пиков и появлению многочисленных шумов. В данной работе количественное определение СЗ проводили с помощью разработанного ранее [24] титриметрического анализа при участии перманганата калия. СЗ использовали в качестве параметра, позволяющего сравнивать образцы мГК и, соответственно, влияние условий на протекание реакции полимераналогичных превращений.
Цель данной работы – анализ влияния параметров реакции ГК с ГМА (условия и состав реакционной смеси) на СЗ, которая определяет свойства мГК и скаффолдов на ее основе. В работе продемонстрирован способ получения скаффолдов в процессе фотоотверждаемой реакции при использовании в качестве инициатора эндогенного нетоксичного соединения флавинмононуклеотида. Исследованы цитотоксические свойства полученных скаффолдов и возможность культивирования клеток на их поверхности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полимераналогичная реакция ГК с ГМА для введения звеньев с двойной связью может проходить как гетерофазная реакция в водной среде со слабо растворимым в воде ГМА [19], гомофазная реакция в органических растворителях после замены иона натрия в ГК на липофильный ион тетрабутиламмония [20] или гомофазная реакция в водно-органической среде [21]. В данной работе для модификации ГК с помощью ГМА была выбрана простая и легко управляемая реакция в водно-органической среде [21]. В результате проведения данной реакции в среде вода/ДМФА = 1.6 : 1 (ГК 0.36 мас. %, тетраэтиламмоний бромид (ТЭАБ) 0.36 мас. %, 18 мл ГМА на 1 г ГК) при 25°C в течение 4 сут были получены образцы, в которых степень замещения групп ГК звеньями с двойной связью (СЗ) составила 40%. Для анализа влияния параметров реакции ГК с ГМА на СЗ и использование их в качестве инструмента управления СЗ исследовали изменение pH, времени проведения реакции, температуры и соотношения ГК/ГМА в реакционной смеси, а также роль катализатора межфазового переноса.
Влияние рН на СЗ в мГК. Влияние pH на СЗ в мГК оценивали в исходной реакционной смеси при нейтральном pH 6–7, в щелочной среде (pH 12), полученной при замене катализатора ТЭАБ на триэтиламин (ТЭА), и кислой среде (pH 4.5), полученной при добавлении HCl к исходной реакционной смеси. Показано, что в щелочной среде СЗ в образцах была в 2 раза ниже (21%), чем в кислой и нейтральной средах (~40–41%) при остальных одинаковых условиях. Согласно литературным данным [21], полимераналогичная реакция ГК с ГМА в водно-органической среде может протекать по двум основным механизмам: за счет обратимой переэтерификации остатка метакриловой кислоты ГМА и за счет необратимой реакции с раскрытием эпоксидного кольца глицидила (рис. 1). Подтверждение таких механизмов представлено в работе Reis et al. [25] на примере модельных полимеров, содержащих только гидроксильные функциональные группы (поливиниловый спирт) или только карбоксильные группы (полиакриловая кислота). Было показано, что при pH 3.5 ГМА взаимодействует как с гидроксильными, так и с карбоксильными группами через раскрытие эпоксидного кольца, а при pH 10.5 ГМА подвергается гидролизу и реагирует лишь с гидроксильными группами по обоим механизмам, при этом предпочтительным механизмом выступает раскрытие эпоксидного цикла. Сложный механизм реакции полисахаридов с ГМА рассмотрен в работе Li et al. [26]. Авторы исследовали реакцию хондроитинсульфата с ГМА, в результате которой при щелочных (pH 8.5) и близких к нейтральным (рН 6.4) условиям образуются различные продукты благодаря одновременному протеканию нескольких процессов: сначала проходят переэтерификация и модификация через раскрытие эпоксидного кольца, затем полученные продукты могут подвергаться гидролизу с образованием немодифицированного полисахарида, полисахарида со звеньями глицерина, метакриловой кислоты и глицидила. Следует отметить, что гидролиз и переэтерификация протекают в меньшей степени при pH 6.4, чем при pH 8.5, а при pH 3.0 гидролиз сложноэфирных связей практически отсутствует, поэтому модификация преимущественно протекает через раскрытие эпоксигруппы.
Рис. 1.
Схема реакции модификации гиалуроновой кислоты с помощью глицидилметакрилата: 1 – необратимая реакция раскрытия эпоксидного кольца; 2 – обратимая реакция переэтерификации; 3 – гидролиз. R1 = CH2, R2 = C=O.
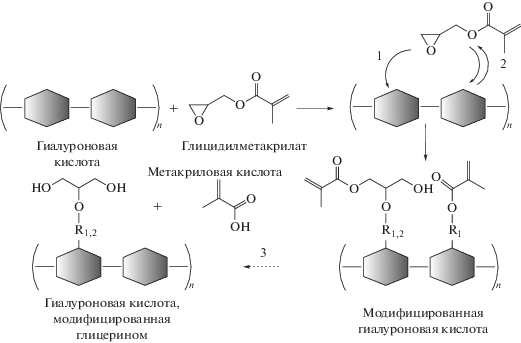
С учетом описанных механизмов можно сделать вывод, что при щелочном pH наряду с реакцией присоединения винильных групп протекает гидролиз, что снижает СЗ в конечном продукте. Кроме того, практически одинаковые значения СЗ, полученные в нейтральных и кислых условиях (~40–41%), свидетельствуют о незначительном гидролизе при нейтральном pH. Таким образом, оптимальный процесс реализуется при проведении реакции модификации ГК в нейтральной среде, в которой возможно контролируемо управлять СЗ благодаря минимизации вклада побочных реакций. В случае данного процесса наиболее подходящий катализатор – ТЭАБ, не повышающий рН среды и служащий катализатором фазового переноса, позволяющим проводить процесс как в водной, так и органической среде.
Влияние времени и температуры на СЗ в мГК. Реакцию модификации ГК проводили в течение 4 сут, в отличие от описанных в литературе процессов, время проведения которых составляло 5–10 сут при рН 12 [21]. Такой протокол был выбран, исходя из результатов измерения СЗ в продукте каждые сутки в течение 6 сут реакции, которые опубликованы нами ранее [24]. Выявлено, что после 4 сут СЗ значительно не изменялась при дальнейшем протекании реакции. Результаты имели хорошую воспроизводимость по СЗ и обеспечивали требуемую сшивку при фотоиндуцированном формировании гидрогелей. Проведение реакции при нейтральном pH значительно снижает гидролиз, а значит, повышает СЗ, поэтому время проведения реакции в течение 4 сут – оптимально при температуре 25°С.
Повышение температуры проведения процесса с 25 до 40°С позволило уменьшить время реакции и повысить СЗ (рис. 2). Так, для получения 40% СЗ в ГК при 25°C требуется проведение реакции в течение 4 сут, а при 40°C – в течение 2 сут. Это может быть связано с тем, что при более высокой температуре соблюдается принцип Вант-Гоффа, и происходит увеличение скорости необратимой реакции раскрытия эпоксидного кольца, кроме того, может увеличиваться растворимость ГМА в реакционной смеси. Дальнейшее увеличение температуры реакции может приводить к термогидролизу ГК и снижать молекулярную массу продуктов [27].
Рис. 2.
Зависимость степени замещения в мГК от времени проведения реакции с глицидилметакрилатом (18 мл на 1 г ГК) при 25 и 40°С, а также при соотношении вода/ДМФА = 1.6 : 1 (с ТЭАБ) и вода/ДМФА = = 1.2 : 1 (без ТЭАБ). Приведены усредненные значения трех независимых измерений.

Влияние соотношения компонентов и времени на СЗ в мГК. Один из эффективных инструментов управления СЗ при проведении реакции полимераналогичных превращений ГК – изменение концентрации компонентов в исходной смеси. Показано, что увеличение концентрации органической фазы от соотношения вода/ДМФА = 1.6 : 1 до 1.2 : 1 позволяет получать мГК практически с тем же содержанием винильных групп на 4-е сут при 25°C (~40%) без добавления ТЭАБ (рис. 2). Такой эффект может быть связан с увеличением содержания ДМФА, который повышает растворимость ГМА и, соответственно, приводит к получению более гомогенной системы, в которой не требуется участие катализатора фазового переноса ТЭАБ.
Изменение концентрации ГМА в реакционной смеси при прочих равных условиях позволяет эффективно управлять СЗ. Как видно на рис. 3, повышение концентрации ГМА в системе приводит к увеличению СЗ, которая может достигать 64%. Эксперимент проводили при 40°С и соотношении фаз вода/ДМФА = 1.2 : 1.
Рис. 3.
Зависимость степени замещения от количества глицидилметакрилата в реакционной смеси и времени проведения реакции (все реакции проводились при 40°С и соотношении вода/ДМФА = 1.2 : 1). Приведены усредненные значения трех независимых измерений.

При этом важно отметить, что повышение концентрации ГМА > 18 мл на 1 г ГК не приводит к значительному росту СЗ в данном временном интервале, что делает неэффективным дальнейшее увеличение количества ГМА в реакционной смеси. Также стоит отметить, что увеличение концентрации ГК с 0.36 до 0.56 мас. % при неизменности всех остальных параметров значительно не влияет на конечную СЗ, однако позволяет снизить расход всех остальных реагентов в реакционной смеси.
Таким образом, для получения мГК с максимальной СЗ необходимо проводить реакцию в нейтральной среде при повышенной температуре (40°C) с содержанием ГМА ≥ 18 мл на 1 г ГК не менее 4 сут.
Влияние СЗ на вязкость растворов модифицированной ГК. Важная характеристика мГК – вязкость ее растворов, оказывающая сильное влияние на подвижность радикалов при проведении реакции фотоиндуцируемой сшивки. Была измерена кинематическая вязкость разбавленных растворов мГК (0.5 мас. %) в зависимости от СЗ (рис. 4) с использованием метода капиллярной вискозиметрии. Снижение вязкости при повышении СЗ может быть связано с увеличением количества гидрофобных звеньев ГМА. В результате происходит снижение числа водородных связей, что, соответственно, приводит к уменьшению гидратных оболочек молекул ГК и снижению межмолекулярного трения. Несмотря на то что измерение проводили для разбавленных растворов мГК, данная тенденция, связанная со снижением вязкости при повышении СЗ, сохраняется и для фотоотверждаемых композиций (ФОК) с высоким содержанием мГК (20 мас. %), что оказывает большое влияние на параметры 3D-печати.
Рис. 4.
Кинематическая вязкость водных растворов мГК (0.5 мг/мл) в зависимости от степени замещения. Приведены усредненные значения трех независимых измерений.

Скаффолды на основе мГК. Определено, что для экструзионной 3D-печати оптимальный диапазон СЗ мГК – 30–55%, что соответствует вязкости, необходимой для получения скаффолдов с требуемыми свойствами. При СЗ < 30% высокая вязкость образцов затрудняет экструзию и не позволяет получать скаффолды требуемой степени сшивки. При СЗ > 55% невозможно получить образцы, сохраняющие форму при экструзии. В качестве оптимального варианта СЗ для экструзии была выбрана мГК с содержанием винильных групп 40%; на ее основе были получены ФОК для 3D-печати, как описано в работе Savelyev et al. [15]. В качестве фотоинициатора для данных ФОК использовали флавинмононуклеотид (также известный как витамин B2), который, как и ГК, – эндогенный биосовместимый компонент в композиции. В ФОК также добавляли диакрилат полиэтиленгликоля (ПЭГДА) как инструмент для тонкой настройки свойств скаффолдов – для уменьшения набухания и деформации формы готовых скаффолдов после контакта с водными растворами, в частности с клеточной средой [17]. Следует отметить, что при использовании ГК с СЗ > 60% коэффициент набухания значительно снижается, и в этом случае скаффолды могут быть получены без участия ПЭГДА. Были напечатаны 7-слойные скаффолды в виде решетки с периодом 1.9 мм (рис. 5).
Рис. 5.
Изображение скаффолда из мГК, полученное методом сканирующей электронной микроскопии. Масштабный отрезок – 1 мм.

Полученные решетчатые скаффолды были проинкубированы с культурой фибробластов человека Bj-5ta в течение 14 сут. На 7-е и 14-е сут с некоторыми образцами был проведен МТТ-тест. Он показал не только отсутствие цитотоксичности, но и значительный прирост количества клеток во времени (рис. 6).
Рис. 6.
Рост иммортализованных фибробластов человека Bj-5ta на поверхности скаффолдов. Представлены результаты МТТ-теста. Приведены усредненные значения пяти независимых измерений.

Как видно из микрофотографий, приведенных на рис. 7, прикрепление клеток к скаффолдам происходит неравномерно, как правило – в виде клеточных агрегатов в узлах решетки, что согласуется с данными о слабой адгезии клеток к немодифицированной ГК [28, 29]. Однако за 14 сут клетки способны колонизировать поверхность скаффолдов не только на узлах, но и на балках решетки.
Рис. 7.
Оптическая микроскопия скаффолдов с культурой фибробластов человека Bj-5ta в течение 1 сут (а), 6 сут (б), 9 сут (в) и 14 сут (г) инкубации. Стрелки указывают на клеточные агрегаты. Масштабный отрезок – 300 мкм.
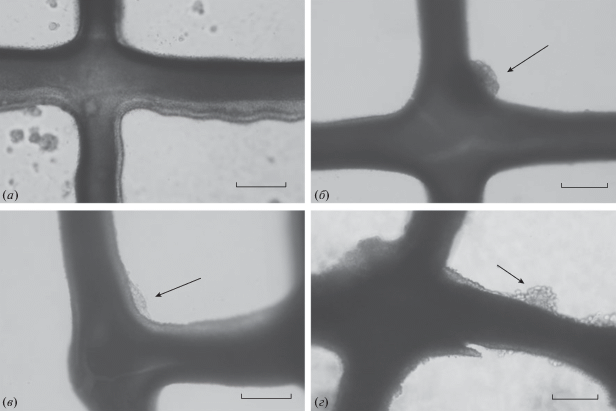
Данные микроскопии и МТТ-теста показывают отсутствие цитотоксичности, умеренную адгезию клеток к поверхности скаффолдов и рост клеток в течение 14 сут инкубирования. Адгезия клеток к поверхности скаффолдов может быть повышена за счет ее покрытия другими биосовместимыми веществами, формирующими полиэлектролитный комплекс с ГК, например, коллагеном, хитозаном или поли-L-лизином [30].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Натриевую соль гиалуроновой кислоты (ГК, ~100 кДа), глицидилметакрилат (ГМА), триэтиламин (ТЭА), тетраэтиламмоний бромид (ТЭАБ), перманганат калия (KMnO4) и полиэтиленгликоль диакрилат (ПЭГДА, ~575 Да) (Merck, Германия), а также ацетон, диметилформамид (ДМФА), диметилсульфоксид, концентрированную соляную кислоту (Химмед, Россия) применяли без дополнительной очистки. Использовали коммерческие препараты флавинмононуклеотид (Фармстандарт, Россия) и Амфотерицин B (ОАО “Синтез”, Россия). Пенициллин-стрептомицин, фосфатно-солевой буфер (pH 7.4), среда DMEM с 10% фетальной бычьей сыворотки и 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид (краситель MTT) были получены из ПанЭко (Россия).
Получение мГК. Для проведения реакции ГК растворяли в дистиллированной воде в концентрации 0.50 или 0.77 мас. %. После полного растворения ГК добавляли ДМФА в объемном соотношении вода/ДМФА = 1.6 : 1 (или 1.2 : 1) для получения водно-органической среды для растворения ГМА. Для предотвращения роста микроорганизмов в реакционную смесь также добавляли на 100 мл воды 500 мкл пенициллин-стрептомицина (5000 ед./мл пенициллина G и 5000 мкг/мл стрептомицина) и 128 мкл амфотерицина B (5 мг/мл). Для изучения влияния катализаторов межфазного переноса в реакционную смесь добавляли ТЭА или ТЭАБ в массовом соотношении ГК/катализатор = 1 : 4.2 или 1 : 0.64 соответственно. После тщательного перемешивания всех компонентов вводили ГМА в различном соотношении ГК/ГМА (г/мл): 1 : 6, 1 : 8, 1 : 12, 1 : 14, 1 : 18 и 1 : 24. После растворения ГМА реакционную смесь оставляли при постоянном перемешивании при 25 или 40°С на 1, 2, 3 или 4 сут. Для остановки реакции и выделения мГК продукт осаждали в 7-кратном избытке ацетона и отделяли осадок центрифугированием. Для очистки продукта осадок растворяли в дистиллированной воде и диализовали против 10-кратного избытка дистиллированной воды в течение 3 сут с ежедневной сменой воды. После очистки продукт замораживали и лиофильно высушивали в течение 2 сут до полного удаления воды.
Определение степени замещения мГК реакцией Вагнера. Для количественного определения привитых винильных групп использовали реакцию KMnO4 с двойными связями мГК, контролируемую по изменению цвета. Для этого 1 мл 0.025%-ного водного раствора KMnO4 (стандарт) титровали 0.5%-ным водным раствором мГК до полного изменения окраски (от фиолетовой к желтой). Окончание реакции подтверждали спектрофотометрически по исчезновению пиков поглощения KMnO4 в области 450–600 нм. Все спектры поглощения регистрировали на УФ-ВИД-спектрофотометре Evolution 201 (Thermo Fisher Scientific, США).
Степень замещения (СЗ) ГК винильными группами определяли как отношение количества привитых звеньев с двойной связью к суммарному количеству дисахаридных звеньев в исследуемых образцах. Количество двойных связей, которое необходимо для полного восстановления стандартного раствора KMnO4, определяли титрованием этого стандарта водным раствором свободного ГМА, как описано в работе Sochilina et al. [24]. Количество дисахаридных звеньев определяли по тому количеству аналита мГК, которое требовалось для полного восстановления стандартного раствора KMnO4.
Вискозиметрия растворов мГК. Для измерения кинематической вязкости разбавленных растворов мГК (0.5%) использовали вискозиметры ВПЖ-2 0.34 и ВПЖ-2 0.56 (ЭКРОСХИМ, Россия). Для подсчета вязкости высчитывали время истечения жидкости из камеры вискозиметра при 37°С, затем использовали следующую формулу:
где V – кинематическая вязкость жидкости, мм/с2; g – ускорение свободного падения в месте измерений, м/с2; K – постоянная вискозиметра, мм2/с2; T – время истечения жидкости, с. Константы вискозиметров составляли 0.003410 мм2/с2 для ВПЖ-2 0.34 и 0.008745 мм2/с2 для ВПЖ-2 0.56. Ввиду широкого разброса вязкостей образцов мГК для СЗ > 45% использовали вискозиметр ВПЖ-2 0.34, а для СЗ < 45% и немодифицированной ГК – ВПЖ-2 0.56.Получение фотоотверждаемых композиций (ФОК) и скаффолдов на основе мГК. Для приготовления композиций, способных к фотоотверждению, мГК, ПЭГДА и флавинмононуклеотид смешивали вместе в фосфатно-солевом буфере и обрабатывали в ультразвуковой ванне в течение 1 ч. Затем смесь оставляли на 24 ч в темноте и снова обрабатывали в ультразвуковой ванне 1 ч до приготовления гомогенной ФОК. Манипуляции при необходимости повторяли, если композиции не сразу получались гомогенными. Конечные соотношения компонентов составляли: 20 мас. % мГК, 5 мас. % ПЭГДА и 0.01 мас. % флавинмононуклеотида, аналогично работе Savelyev et al. [15]. Все манипуляции с ФОК проводили при желтом свете, чтобы избежать преждевременного фотоотверждения. Скаффолды печатали на 3D-принтере в виде решетчатых структур. Сначала ФОК загружали в шприц с фильерой в виде капилляра длиной 5 мм и диаметром 250 мкм. Экструзию ФОК запускали поршнем шприца. Скорость движения поршня, как и позицию шприца X-Y-Z, контролировали G-кодом в программе Repetier. Фотоотверждение экструдируемой ФОК проводили лазерным облучением синим светом при 450 нм (интенсивность облучения составляла 70 мВ/см2). После изготовления скаффолды дополнительно оставляли в герметичной емкости под лазерным облучением 450 нм интенсивностью 5 мВт/см2 на 3 ч для обеспечения полного протекания кросс-сшивки.
Испытания мГК скаффолдов с клетками in vitro. Скаффолды мГК помещали на неадгезивную (агарозную) поверхность 24-луночного планшета и вносили в каждую лунку по 105 клеток иммортализованных фибробластов человека Bj-5ta (клетки были получены из Банка опухолевых штаммов ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России) в 1 мл среды DMEM, содержащей 10% фетальной бычьей сыворотки. Клетки инкубировали при 37°С и 5% СО2 в течение 14 сут, каждые 3 сут проводили полную замену среды. Прикрепление и рост клеток контролировали с использованием инвертированного микроскопа Olympus CKX53 (Olympus, Япония).
МТТ-тест. Количественную оценку роста клеток на поверхности скаффолдов, а также исследование динамики колонизации матриксов проводили с помощью МТТ-теста. Для этого в лунки 24-луночного планшета, содержащие скаффолды с прикрепленными к ним клетками, добавляли краситель МТТ до финальной концентрации 0.5 мг/мл и инкубировали при 37°С и 5% СО2 в течение 3 ч. Затем скаффолды с окрашенными клетками переносили в чистые лунки, промывали в фосфатно-солевом буфере для удаления неприкрепившихся клеток и элюировали образовавшийся формазан с использованием диметилсульфоксида (400 мкл на лунку, 20 мин при комнатной температуре). Концентрацию формазана определяли спектрофотометрически (Multiskan FC, США) при длине волны 570 нм. Скаффолды, не заселенные клетками, использовали в качестве контроля.
ЗАКЛЮЧЕНИЕ
В данной работе предложен подход для эффективного управления степенью замещения гиалуроновой кислоты, модифицированной глицидилметакрилатом, путем изменения различных параметров реакции (pH, время, температура, тип катализатора, соотношение ГК/ГМА). Такой подход позволяет точно контролировать свойства получаемых производных гиалуроновой кислоты в зависимости от конечных целей использования. В результате проведенного исследования были получены фотоотверждаемые композиции, оптимизированные под 3D-печать, и изготовлены скаффолды, способные обеспечивать адгезию, рост и пролиферацию клеток на своей поверхности.
Проведенное исследование – базовая платформа для дальнейшего развития технологии получения скаффолдов на основе гиалуроновой кислоты, в том числе создаваемых in situ в живом организме. Кроме того, разработанный подход позволяет получать скаффолды уникальной архитектуры, например, в виде полых цилиндров для замещения поврежденных сосудов, что открывает новые возможности их использования в регенеративной медицине.
Список литературы
Langer R., Vacanti J. // Science. 1993. V. 260. P. 920–926. https://doi.org/10.1126/science.8493529
Howard D., Buttery L.D., Shakesheff K.M., Roberts S.J. // J. Anat. 2008. V. 213. P. 66–72. https://doi.org/10.1111/j.1469-7580.2008.00878.x
Almouemen N., Kelly H.M., O’Leary C. // Comput. Struct. Biotechnol. J. 2019. V. 17. P. 591–598. https://doi.org/10.1016/j.csbj.2019.04.008
Collins M.N., Birkinshaw C. // Carbohydr. Polym. 2013. V. 92. P. 1262–1279. https://doi.org/10.1016/j.carbpol.2012.10.028
Nikolova M.P., Chavali M.S. // Bioact. Mater. 2019. V. 4. P. 271–292. https://doi.org/10.1016/j.bioactmat.2019.10.005
Qu H., Fu H., Han Z., Sun Y. // RSC Adv. 2019. V. 9. P. 26252–26262. https://doi.org/10.1039/C9RA05214C
Хвостов М.В., Толстикова Т.Г., Борисов С.А., Душкин А.В. // Биоорг. химия. 2019. Т. 46. С. 563–575. [Khvostov M.V., Tolstikova T.G., Borisov S.A., Dushkin A.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 438–450.] https://doi.org/10.1134/S1068162019060219
Kim H., Jeong H., Han S., Beack S., Hwang B.W., Shin M., Oh S.S., Hahn S.K. // Biomaterials. 2017. V. 123. P. 155–171. https://doi.org/10.1016/j.biomaterials.2017.01.029
Mohammadi F., Samani S.M., Tanideh N., Ahmadi F. // Adv. Pharm. Bull. 2018. V. 8. P. 11–19. https://doi.org/10.15171/apb.2018.002
Guan Y., You H., Cai J., Zhang Q., Yan S., You R. // Carbohydr. Polym. 2020. V. 239. P. 116232. https://doi.org/10.1016/j.carbpol.2020.116232
Fujita S., Hara S., Hosono A., Sugihara S., Uematsu H., Suye S. // Adv. Polym. Technol. 2020. V. 2020. P. 1–7. https://doi.org/10.1155/2020/1470819
Fahmy A., Kamoun E.A., El-Eisawy R., El-Fakharany E.M., Taha T.H., El-Damhougy B.K., Abdelhai F. // J. Braz. Chem. Soc. 2015. V. 26. P. 1466–1474. https://doi.org/10.5935/0103-5053.20150115
Khunmanee S., Jeong Y., Park H. // J. Tissue Eng. 2017. V. 8. P. 204173141772646. https://doi.org/10.1177/2041731417726464
Poldervaart M.T., Goversen B., de Ruijter M., Abbadessa A., Melchels F.P.W., Öner F.C., Dhert W.J.A., Vermonden T., Alblas J. // PLoS One. 2017. V. 12. P. e0177628. https://doi.org/10.1371/journal.pone.0177628
Savelyev A.G., Sochilina A.V., Akasov R.A., Mironov A.V., Semchishen V.A., Generalova A.N., Khaydukov E.V., Popov V.K. // Sovrem. Tehnol. Med. 2018. V. 10. P. 88. https://doi.org/10.17691/stm2018.10.1.11
Lam T., Dehne T., Krüger J.P., Hondke S., Endres M., Thomas A. // J. Biomed. Mater. Res. Part B Appl. Biomater. 2019. V. 107. P. 2649–2657. https://doi.org/10.1002/jbm.b.34354
Savelyev A.G., Bardakova K.N., Khaydukov E.V., Generalova A.N., Popov V.K., Chichkov B.N., Semchishen V.A. // J. Photochem. Photobiol. A Chem. 2017. V. 341. P. 108–114. https://doi.org/10.1016/j.jphotochem.2017.03.026
Guo C., Qu X., Rangaswamy N., Leehy B., Xiang C., Rice D. // PLoS One. 2018. V. 13. P. e0196529. https://doi.org/10.1371/journal.pone.0196529
Baier L.J., Bivens K.A., Patrick C.W., Jr., Schmidt C.E. // Biotechnol. Bioeng. 2003. V. 82. P. 578–589. https://doi.org/10.1002/bit.10605
Oudshoorn M.H.M., Rissmann R., Bouwstra J.A., Hennink W.E. // Polymer. 2007. V. 48. P. 1915–1920. https://doi.org/10.1016/j.polymer.2007.01.068
Bencherif S.A., Srinivasan A., Horkay F., Hollinger J.O., Matyjaszewski K., Washburn N.R. // Biomaterials. 2008. V. 29. P. 1739–1749. https://doi.org/10.1016/j.biomaterials.2007.11.047
Tsanaktsidou E., Kammona O., Kiparissides C. // Eur. Polym. J. 2019. V. 114. P. 47–56. https://doi.org/10.1016/j.eurpolymj.2019.02.024
Yousefi F., Kandel S., Pleshko N. // Appl. Spectrosc. 2018. V. 72. P. 1455–1466. https://doi.org/10.1177/0003702818785353
Sochilina A.V., Savelyev A.G., Demina P.A., Sizova S.V., Zubov V.P., Khaydukov E.V., Generalova A.N. // Meas. Sci. Technol. 2019. V. 30. P. 075102. https://doi.org/10.1088/1361-6501/ab0fb4
Reis A.V., Fajardo A.R., Schuquel I.T.A., Guilherme M.R., Vidotti G.J., Rubira A.F., Muniz E.C. // J. Org. Chem. 2009. V. 74. P. 3750–3757. https://doi.org/10.1021/jo900033c
Li Q., Wang D., Elisseeff J.H. // Macromolecules. 2003. V. 36. P. 2556–2562. https://doi.org/10.1021/ma021190w
Lowry K.M., Beavers E.M. // J. Biomed. Mater. Res. 1994. V. 28. P. 1239–1244. https://doi.org/10.1002/jbm.820281014
Pavesio A., Renier D., Cassinelli C., Morra M. // Med. Device Technol. 1997. V. 8. No 7. P. 20–21, 24–27.
Morra M., Cassineli C. // J. Biomater. Sci. Polym. Ed. 1999. V. 10. P. 1107–1124. https://doi.org/10.1163/156856299X00711
Yamanlar S., Sant S., Boudou T., Picart C., Khademhosseini A. // Biomaterials. 2011. V. 32. P. 5590–5599. https://doi.org/10.1016/j.biomaterials.2011.04.030
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


