Биоорганическая химия, 2021, T. 47, № 5, стр. 622-631
Внутриклеточная локализация и механизмы фотодинамического действия диметилового эфира 131-[2-(гуанидинил)этиламино]хлорина e6
А. В. Ефременко 1, 2, Е. Д. Дьякова 1, 3, П. В. Островерхов 3, Н. С. Кирин 3, А. Ф. Миронов 3, М. А. Грин 3, А. В. Феофанов 1, 3, *
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет
119234 Москва, Ленинские горы, 1/12, Россия
3 МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, просп. Вернадского, 86, Россия
* E-mail: avfeofanov@yandex.ru
Поступила в редакцию 08.11.2020
После доработки 19.11.2020
Принята к публикации 26.11.2020
Аннотация
Установлено, что фотосенсибилизатор диметиловый эфир 131-[2-(гуанидинил)этиламино]хлорина e6 накапливается преимущественно в лизосомах, частично в эндосомах и не накапливается в митохондриях клеток аденокарциномы легкого человека А549. Первичный фотоцитотоксический эффект данного фотосенсибилизатора связан с повреждением лизосом и его высвобождением в цитоплазму. В цитоплазме формируется однородное распределение фотосенсибилизатора в комплексах с мембранными структурами, которые служат вторичными мишенями его фотоиндуцированного действия. Обнаружены зависимые от времени морфологические признаки развития параптоза, которые указывают на фотодинамическое повреждение эндоплазматического ретикулума как на вторичный механизм фотоцитотоксического действия исследуемого фотосенсибилизатора. На этой стадии происходит еще одно изменение потенциальных клеточных мишеней фотосенсибилизатора: он концентрируется в цитоплазматической и ядерной мембранах, в мембранах многочисленных вакуолей, а также в лизосомах, которые, по-видимому, продолжают образовываться в процессе развития параптоза. Таким образом, исследуемое производное хлорина е6, как представитель гидрофобных фотосенсибилизаторов с внутриклеточным нацеливанием на лизосомы, обладает двух- или трехстадийным механизмом фотодинамического действия с последовательным изменением клеточных мишеней.
ВВЕДЕНИЕ
Как показывают результаты клинических исследований, активно развивающаяся фотодинамическая терапия (ФДТ) эффективна при лечении многих типов рака и различных незлокачественных образований [1–8]. ФДТ основана на местном или системном применении фотосенсибилизатора (ФС) – соединения, которое накапливается в опухоли и при локальном облучении светом соответствующей длины волны продуцирует активные формы кислорода, приводящие к селективному разрушению опухолевых клеток [3, 9]. Преимущественное накопление ФС в опухоли дает возможность избирательно повреждать злокачественные новообразования с минимальным воздействием на окружающие здоровые ткани, а также позволяет сочетать лечение с диагностикой на основе флуоресценции ФС [4].
В качестве ФС могут выступать различные соединения: порфирины и их аналоги, ксантеновые, тиазиновые, ксазиновые, полициклохиноновые и триарилметановые красители, а также некоторые флуоресцирующие белки [6, 10]. Производные порфиринов – наиболее многочисленная группа соединений, используемых для ФДТ. Производные природных порфиринов, хлорины и бактериохлорины, обладают интенсивным поглощением, соответственно, в дальней красной и ближней инфракрасной спектральных областях. Свет с этими длинами волн глубже проникает в биологические ткани, что обеспечивает более эффективное фотодинамическое воздействие на большие или глубоко расположенные злокачественные новообразования [11].
Совершенствование ФДТ требует разработки улучшенных по свойствам и эффективности ФС. При разработке новых ФC важное значение имеют их нацеленность на опухолевые клетки (так называемая таргетность), высокое внутриклеточное накопление и оптимальная внутриклеточная локализация [8]. Внутриклеточная локализация ФС сложным образом зависит от его структуры, гидрофобности/полярности, присутствия в составе молекулы заряженных групп и их количества, распределения и знака заряда, а также наличия заместителей, влияющих на сродство ФС к определенным клеточным органеллам. В зависимости от структуры ФС на основе порфиринов могут накапливаться в цитоплазме в липидных каплях, эндоплазматическом ретикулуме (ЭР), аппарате Гольджи, лизосомах или митохондриях [12–17]. Поскольку фотоиндуцированные АФК обладают высокой реакционной способностью, а следовательно, и короткими временами жизни, то органеллы с преимущественным накоплением ФС выступают первичными мишенями фотодинамического воздействия, а их повреждение определяет механизмы развития фотоиндуцированной цитотоксичности.
Митохондрии считаются предпочтительной внутриклеточной мишенью для накопления ФС [14, 17]. ФС, нацеленные на митохондрии, могут снижать потенциал митохондриальной мембраны, ингибировать клеточное дыхание и окислительное фосфорилирование, высвобождать цитохром с и другие проапоптотические белки в цитоплазму, активируя апоптоз [18–20]. При накоплении ФС в лизосомах световое воздействие может разрушать лизосомы, вызывая диффузию ФС в цитоплазму [14]. В результате повреждения лизосом происходит утечка гидролитических ферментов [21–24]. В этом случае фотодинамическое воздействие приводит к клеточному апоптозу или некрозу, в зависимости от интенсивности светового воздействия и активности освобожденных из поврежденных лизосом протеолитических ферментов [19]. Установлено, что эффективность фотоцитотоксического действия ФС, локализованных в лизосомах, при сходных средних концентрациях в клетках заметно ниже, чем у ФС, накапливающихся в митохондриях и других органеллах [14, 18, 21].
Таким образом, определение внутриклеточной локализации ФС важно для понимания эффективности и механизмов его действия при ФДТ.
Недавно в работе Gao et al. [25] при изучении нового эффективного ФС, диметилового эфира 131-[2-(гуанидинил)этиламино]хлорина e6 (соединение (II), рис. 1), был сделан вывод о том, что введение гуанидинового заместителя улучшает “нацеливание” соединения (II) в митохондрии. В то же время исследуемое нами аналогичное производное хлорина е6, но с 2-(гуанидинил)бутиламино-заместителем в положении 131 характеризуется преимущественным накоплением в лизосомах (данные не представлены). Возможность внутриклеточного перенацеливания за счет небольшого изменения структуры заместителя представляет интерес для направленного дизайна ФС с заданными характеристиками, но заявленные в работе Gao et al. [25] свойства соединения (II) вызвали у нас сомнения. Мы синтезировали соединение (II) для уточнения его свойств и изучили локализацию в клетках аденокарциномы легкого человека А549, как и в работе Gao et al. [25]. Установлено, что соединение (II) не обладает митохондриальной локализацией, а накапливается преимущественно в лизосомах клеток А549. Выявлено фотоиндуцированное разрушение лизосом с сопутствующим перераспределением соединения (II) в клетках, которое выступает первичным механизмом фотоцитотоксического действия соединения (II), а также источником ошибок при исследовании внутриклеточной локализации соединения (II) и подобных ему ФС. Обнаруженные морфологические признаки развития параптоза указывают на фотодинамическое повреждение ЭР как на вторичный механизм фотоцитотоксического действия соединения (II), развивающийся после его высвобождения из лизосом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез диметилового эфира 131-[2-(гуанидинил)этиламино]хлорина e6 (соединение (II)). Для получения соединения (II) в качестве стартового соединения был использован аминоэтиламид метилового эфира феофорбида а (соединение (I)). Синтез соединения (II) осуществляли действием на исходное соединение (I) пиразол-1Н-карбоксиамидина (рис. 1). Полученное соединение (II) было выделено с помощью препаративной ТСХ, а его структура доказана методами ЯМР-спектроскопии (1Н и 13С) и масс-спектрометрии (MALDI).
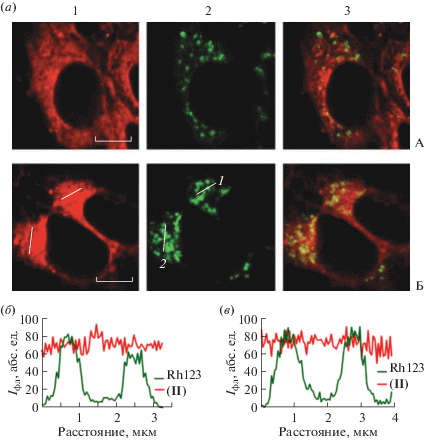
Внутриклеточная локализация соединения (II). Исследуемое соединение (II) (рис. 1) – гидрофобное, поэтому в качестве его солюбилизатора была выбрана эмульсия полиэтоксилированного касторового масла – Кремофора EL (CrEL), которая стабилизирует мономерную форму тетрапиррольных соединений в водных растворах, и ее использование разрешено в клинической практике [15, 16, 24, 26, 27]. Методом лазерной сканирующей конфокальной микроскопии (ЛСКМ) установлено, что соединение (II) проникает в клетки аденокарциномы легкого человека А549 и накапливается в цитоплазматической области с преимущественным гранулярным распределением (рис. 2, колонка 1). Соединение (II) не накапливается в цитоплазматической мембране клетки и не проникает в ядро (рис. 2, колонка 1).
Рис. 2.
Определение клеточных органелл, в которых происходит преимущественное накопление соединения (II), методом лазерной сканирующей конфокальной микроскопии. Клетки аденокарциномы легкого человека А549 инкубировали с 0.5 мкМ соединения (II) в течение 2 ч. Колонка 1 – внутриклеточное распределение соединения (II). Колонка 2 – внутриклеточное распределение селективных зондов клеточных органелл: LTG, окрашивающих лизосомы (панель 2А); ТOG488, окрашивающих эндосомы (панель 2Б); Rh123, окрашивающих митохондрии (панель 2В). Колонка 3 – наложение изображений 1 и 2, желтый цвет указывает на солокализацию соединения (II) с селективным зондом. Масштабный отрезок – 5 мкм.

Для идентификации клеточных структур, накапливающих соединение (II), были проведены исследования с использованием флуоресцентных зондов клеточных органелл: LysoTracker Green (LTG), родамина 123 (Rh123) и конъюгата трансферрина с красителем Oregon Green 488 (TOG488), окрашивающих, соответственно, лизосомы, митохондрии и эндосомы, содержащие рецептор трансферрина.
Исследования, выполненные методом ЛСКМ, выявили, что наблюдаемое в клетках гранулярное распределение соединения (II) отражает его преимущественное накопление в лизосомах (рис. 2, ряд А) и менее выраженное – в эндосомах (рис. 2, ряд Б). Коэффициент солокализации соединения (II) с лизосомами составляет 0.7 ± 0.2, а с эндосомами – 0.4 ± 0.1. В митохондриях клеток А549 соединение (II) не накапливается (рис. 2, ряд В). Коэффициент солокализации соединения (II) с митохондриями не превышает 0.012 ± 0.002. Данная внутриклеточная локализация сохранялась в широком диапазоне концентраций соединения (II) (0.25–2 мкМ), с которыми инкубировали клетки, и ее характер не зависел от времени инкубации клеток с соединением (II) в диапазоне 1–4 ч.
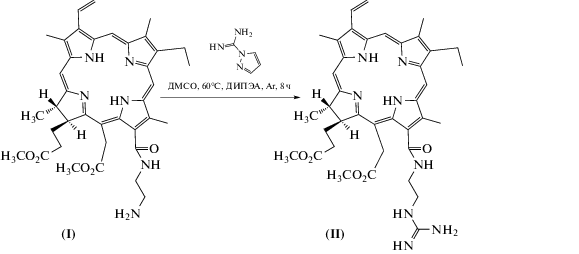
В то же время при увеличении концентрации соединения (II) до 8–10 мкМ на изображениях, полученных методом ЛСКМ, наблюдали преимущественно диффузное внутриклеточное распределение этого соединения с незначительным количеством гранул, отличных от митохондрий (рис. 3). Наблюдавшееся концентрационно-зависимое изменение внутриклеточного распределения соединения (II), по-видимому, связано с фотоиндуцированным повреждением лизосом в процессе измерения изображений клеток методом ЛСКМ при высоких внутриклеточных концентрациях фотосенсибилизатора (II). Разрушение лизосом сопровождается вытеканием соединения (II) и его равномерным распределением по цитоплазме. При этом в областях расположения митохондрий не обнаружено увеличения флуоресценции соединения (II), которое могло бы указывать на усиленное связывание соединения (II) с митохондриями (рис. 3б, 3в). В то же время митохондрии в клетках меняют свою морфологию, приобретая округлую форму вместо вытянутой (рис. 3а, колонка 2), что подтверждает развитие фотоцитотоксического эффекта и косвенно указывает на деполяризацию мембраны митохондрий.
Рис. 3.
(а) – Изображения клеток аденокарциномы легкого человека А549, полученные методом лазерной сканирующей конфокальной микроскопии. Клетки А549 инкубировали с 8 мкМ (ряд А) или 10 мкМ (ряд Б) соединения (II) в течение 2 ч. За 10 мин до окончания инкубации к клеткам добавляли Rh123 в концентрации 50 мкг/л. Показано внутриклеточное распределение соединения (II) (колонка 1) и Rh123, флуоресцентного маркера митохондрий (колонка 2). Колонка 3 – наложение изображений из колонок 1 и 2. Масштабный отрезок – 5 мкм. Диффузное распределение соединения (II) при высокой концентрации вызвано светоиндуцированным разрушением лизосом и высвобождением из них соединения (II) в процессе измерения изображений; (б, в) – профили распределения интенсивностей флуоресценции соединения (II) и Rh123 вдоль отмеченных на панели 2Б линий 1 (б) и 2 (в).
В условиях, когда соединение (II) почти равномерно распределено по цитоплазме клетки, делать заключение о его преимущественной локализации в каких-либо клеточных органеллах не представляется корректным.
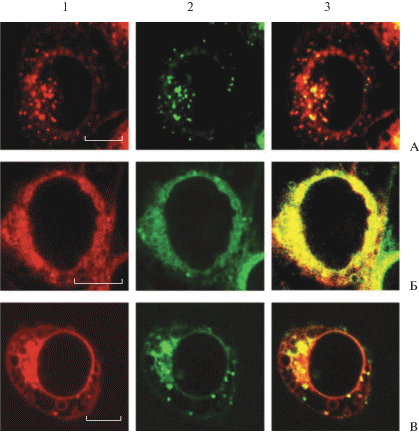
Внутриклеточное распределение соединения (II) после фотодинамического воздействия на клетки. Для проверки гипотезы о светоиндуцированном перераспределении соединения (II) из лизосом в цитоплазму было исследовано внутриклеточное распределение соединения (II) после облучения светом клеток А549, прединкубированных с этим соединением в низкой концентрации (0.3 мкМ). Установлено, что световое облучение клеток, содержащих соединение (II), приводит к значительному уменьшению количества лизосом, в которых исходно накапливается соединение (II) (рис. 4), а цитоплазматическое распределение соединения (II) становится практически однородным (рис. 4, панель 1Б), как и в случае, представленном на рис. 3. Это указывает на фотоиндуцированное повреждение лизосом, содержащих соединение (II), и высвобождение соединения в цитоплазму. Отметим, что распределение флуоресцентного зонда лизосом LTG также становится диффузным, свидетельствуя об отсутствии интактных везикул с пониженным внутренним рН.
Рис. 4.
Изображения клеток аденокарциномы легкого человека А549, полученные методом лазерной сканирующей конфокальной микроскопии. Клетки А549 инкубировали с 0.3 мкМ соединения (II) в течение 2 ч (ряд А), после чего облучали галогенной лампой (световая доза 20 Дж/см2) (ряды Б, В). За 40 мин до окончания инкубации клеток с соединением (II) (ряды А, Б) или после облучения клеток (ряд В) к клеткам добавляли LTG в концентрации 50 нМ. Показано внутриклеточное распределение соединения (II) (колонка 1) и LTG, флуоресцентного маркера лизосом (колонка 2), без облучения (ряд А), сразу после облучения (ряд Б) и через 40 мин после облучения (ряд В). Колонка 3 – наложение изображений из колонок 1 и 2. Масштабный отрезок – 5 мкм.
Учитывая гидрофобный характер соединения (II) и его агрегацию в полярном окружении с полным тушением флуоресценции, наблюдаемое диффузное распределение должно формироваться в результате связывания соединения (II) с мембранными структурами клетки, среди которых могут быть мембраны ЭР, аппарата Гольджи и митохондрий.
Полученный результат свидетельствует о том, что диффузное распределение соединения (II) в цитоплазме клеток следует рассматривать как результат фотодинамического воздействия на клетки, в которых исходно соединение (II) было локализовано преимущественно в лизосомах. Подчеркнем, что фотоиндуцированное диффузное распределение соединения (II) в клетках может возникать и в процессе сканирования клеток лазером при исследованиях методом ЛСКМ (рис. 3). Однако оно не отражает исходной картины накопления соединения (II) в клетках и не указывает на первичные клеточные мишени, которые определяют механизм, лежащий в основе фотоцитотоксичности соединения (II).
Спустя несколько десятков минут после облучения клеток с соединением (II) в цитоплазме клеток было обнаружено образование многочисленных крупных вакуолей и перераспределение соединения (II). В этих условиях наблюдалось концентрирование соединения (II) в цитоплазматической и ядерной мембранах, в мембранах, ограничивающих образовавшиеся вакуоли, а также в лизосомах, которые, по-видимому, вновь начинали формироваться в поврежденных фотодинамическим воздействием, но еще живых клетках (рис. 4, ряд В).
Формирование большого числа крупных вакуолей в цитоплазме без образования пузырей на плазматической мембране, сжатия клеток и фрагментации ядра – характеристичный признак развития запрограммированной гибели клеток по механизму параптоза [28–30]. Опубликованные данные свидетельствуют о том, что при ФДТ параптоз активируется в результате интенсивного фотодинамического повреждения ЭР, что в свою очередь подразумевает связывание ФС с мембранами ЭР [29, 30]. Можно заключить, что вторичная мишень соединения (II), определяющая дальнейшее развитие фотоцитотоксического эффекта – мембраны ЭР, доступ к которым соединение (II) получает после фотоиндуцированного высвобождения из лизосом.
Соединение (II) нацелено в митохондрии или в лизосомы? Полученные нами данные о преимущественно лизосомальном накоплении соединения (II) в клетках А549 и отсутствии накопления в митохондриях противоречат выводам работы Gao et al. [25] о нацеливании соединения (II) в митохондрии за счет введения гуанидинового заместителя. Причина этого противоречия, по-видимому, – ошибка авторов работы Gao et al. [25], допущенная при анализе внутриклеточной локализации соединения (II). Внутриклеточное распределение соединения (II) на изображениях, представленных в статье Gao et al. [25], имеет диффузный характер, очень схожий с тем, что наблюдается после облучения клеток (рис. 4, панель 1В), а также при очень высоких концентрациях соединения (II), когда происходит его фотоиндуцированное перераспределение в процессе сканирования лазерным лучом под микроскопом (рис. 3). При этом выводы о солокализации соединения (II) с клеточными органеллами сделаны в статье Gao et al. [25] на основе нетипичных диффузных внутриклеточных распределений флуоресцентных зондов клеточных органелл MitoTracker Green и LysoTracker Blue. Очевидно, что некорректно делать выводы о солокализации с клеточными органеллами в отсутствие характеристичной картины их окрашивания: гранулярной для лизосом, нитевидной или гранулярной, соответственно, для активных или деполяризованных митохондрий.
Существует мнение, что введение положительно заряженного заместителя в гидрофобный ФС способствует его накоплению в митохондриях [18]. Однако результаты, представленные в настоящей работе, и данные опубликованных исследований свидетельствуют о том, что такого рода модификация ФС во многих случаях не приводит к нацеливанию катионных ФС на митохондрии, и они накапливаются в лизосомах и других органеллах клетки, отличных от митохондрий [16, 21, 31–33].
Механизмы фотодинамического действия соединения (II). Хотя одинаковая концентрация ФС при накоплении в лизосомах дает заметно меньшую фотоцитотоксичность, чем при накоплении ФС в ЭР, липидных каплях, аппарате Гольджи или в митохондриях [11, 17, 21], соединение (II), согласно работе Gao et al. [25], обладает высокой фотоиндуцированной цитотоксичностью, вызывая in vitro 50%-ную гибель клеток А549 при концентрации 0.545 мкМ (световая доза 2 Дж/см2). Соединение (II) вызывает эффективное торможение роста перевиваемой опухоли A549 у мышей при дозе 0.15 мг/кг и полное прекращение ее роста при 0.4 мг/кг (световая доза 120 Дж/см2) [25].
Наши исследования показали, что при первичном накоплении соединения (II) в лизосомах и эндосомах механизм фотоиндуцированной цитотоксичности – как минимум двухстадийный. На первой стадии облучение клеток светом вызывает фотодинамическое повреждение лизосом с выходом соединения (II) из лизосом в цитоплазму. Вместе с соединением (II) из поврежденных лизосом, очевидно, высвобождаются гидролитические ферменты, которые могут способствовать развитию апоптоза, расщепляя в цитоплазме белок Bid до проапоптозного продукта tBit [34, 35]. Признаки развития апоптоза после ФДТ с соединением (II) были обнаружены в срезах опухоли [25]. Разрушение лизосом, как полагают, затрудняет развитие аутофагии, которая может помогать клеткам бороться с повреждениями, вызванными ФДТ [30, 36].
На второй стадии соединение (II), получившее после выхода из лизосом доступ к новым мишеням в цитоплазме, вызывает каскад фотоиндуцированных повреждений, которые по морфологическим признакам приводят к развитию параптоза. Как отмечалось выше, мишенями гидрофобного соединения (II) в цитоплазме могут быть различные мембранные структуры, включая ЭР. Именно фотоиндуцированное повреждение ЭР, как полагают, запускает параптоз при ФДТ, способствуя гибели опухолевых клеток даже с блокированным развитием апоптоза [30].
Изменения, обнаруженные нами во внутриклеточной локализации соединения (II) при развитии пароптоза, выявили дополнительные потенциальные мишени его действия – плазматическую и ядерную мембраны, а также мембраны вакуолей. Эти мишени могут быть задействованы на третьей стадии фотоиндуцированного воздействия в случае быстрого развития параптоза в процессе облучения или при повторном сеансе облучения, проводимом с задержкой, для полноценного развития параптоза и соответствующих изменений в локализации соединения (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез метилового эфира аминоэтиламида феофорбида а. Соединение (I) получали по методике Gao et al. [25], действуя на исходный метиловый эфир феофорбида а избытком 1,2-диаминоэтана при добавлении основания диизопропилэтиламина (ДИПЭА).
Синтез диметилового эфира 131-[2-(гуанидинил)этиламино]хлорина e6. К 70 мг аминоэтиламида метилового эфира феофорбида а, растворенного в 3 мл диметилсульфоксида (ДМСО), добавляли 130 мг пиразол-1Н-карбоксиамидина и 15 мкл ДИПЭА для придания основности среде. Реакцию проводили в течение 8 ч при интенсивном перемешивании при 60°С в инертной среде аргона с обратным холодильником. Ход реакции контролировали спектрофотометрически и хроматографически. Из реакционной смеси целевой продукт выделяли при помощи жидкостной экстракции в системе дистиллированная вода/хлороформ. Экстракт сушили над безводным сульфатом натрия, а затем растворитель удаляли при пониженном давлении на роторном испарителе. Целевой продукт очищали от родственных примесей методом колоночной хроматографии, используя в качестве элюента смесь хлороформа и метилового спирта. Соединение было получено в количестве 54 мг. Выход составил 77%. Хроматографию в тонком слое осуществляли на пластинках Kieselgel 60 F254 (Merck, Германия) 20 × 20 мм с толщиной слоя сорбента 1 мм.
Масс-спектры получены на времяпролетном масс-спектрометре Ultraflex (Bruker, Германия) методом матрично-активированной лазерной десорбции и ионизации (MALDI) с использованием в качестве матрицы дигидроксибензола. ЯМР регистрировали в дейтерохлороформе на спектрометре DPX-300 (Bruker, Германия) с рабочей частотой 300 МГц.
ЯМР-спектроскопия соединения (I). 1H-ЯМР (300 МГц, СDCl3, δ, м.д., J, Гц): 9.67 (Н, с, 10-Н), 9.62 (Н, с, 5-Н), 8.82 (1Н, с, 20-Н), 8.04 (H, дд, J 17.8, 11.5, 31-Н), 6.93 (H, т, J 5.2, 132 -NH), 6.30 (H, дд, J 17.8, 1.4, Е-32-Н), 6.08 (Н, дд, J 11.5, 1.4, Z‑32-Н), 5.53 (Н, д, J 18.9, 15-СН2а), 5.26 (Н, д, J 18.9, 15-СН2b), 4.48 (Н, м, 18-Н), 4.36 (Н, м, 17-Н), 3.82 (2H, м, 81-СН2), 3.77 (3Н, с, 152-СОOСН3), 3.63 (3Н, с, 121-СН3), 3.49 (3Н, с, 173-СОOСН3), 3.47 (3Н, с, 21-СН3), 3.48 (2H, м, 133-CH2), 3.29 (3Н, с, 71-СН3), 2.71 (2Н, м, 134-СН2), 2.55 (Н, м, 172-СН2а), 2.24 (Н, м, 171-СН2а), 2.19 (Н, м, 172-СН2b), 1.8 (Н, м, 171-СН2b), 1.72 (3H, д, J 7.1, 181-CH3), 1.69 (3H, т, J 7.6, 82-СН3), –1.63 (Н, шир.с, I-NH), –1.86 (Н, шир.с, III-NH).
13C-ЯМР (300 МГц, CDCl3, δ, м.д.): 174 (С, с, 152-С), 173.7 (С, с, 173-С), 169 (С, с, 131-С), 168.8 (С, с, 19-С), 166.7 (С, с, 16-С), 154 (С, с, 6-С), 149 (С, с, 9-С), 144.8 (С, с, 8-С), 138.8 (С, с, 2-С), 136 (С, с, 7-С), 135.2 (С, с, 4-С), 134.8 (С, с, 12-С), 134.6 (С, с, 14-С), 134,4 (С, с, 3-С), 130.1 (С, с, 11-С), 129.9 (С, с, 1-С), 129.2 (С, с, 31-С), 128.3 (С, с,13-С), 121.5 (С, с, 32-С), 102.3 (С, с, 15-С), 101.3 (С, с, 10-С), 98.8 (С, с, 5-С), 93.7 (С, с, 20-С), 53.2 (С, с, 17-С), 52.2 (С, с, 174-С), 49.3 (С, с, 18-С), 39.7 (С, с, 134-C), 37.7 (С, с, 151-С), 31.7 (С, с, 172-С), 31.3 (С, с, 171-С), 29.7 (С, с, 133-C), 23.1 (С, с, 181-С), 19.7 (С, с, 81-С), 17.9 (С, с, 82-С), 12.4 (С, с, 21-С), 11.9 (С, с, 121-С), 11.3 (С, с, 71-С)
ЯМР-спектроскопия соединения (II). 1Н-ЯМР (300 МГц, СDCl3, δ, м.д., J, Гц): 9.68 (Н, с, 10-Н), 9.63 (Н, c, 5-Н), 9.41 (3H, шир.с, 137-NH2, 138-NH), 8.81 (Н, с, 20-Н), 8.07 (H, дд, J 17.8, 11.5, 31-Н), 7.40 (Н, м, 135-NH), 6.98 (H, т, J 5.2, 132-NH), 6.33 (H, дд, J 17.8,1.4, Е-32-Н), 6.11 (Н, дд, J 11.5, 1.4, Z-32-Н), 5.55 (Н, д, J 18.9, 15-СН2а), 5.25 (Н, д, J 18.9, 15-СН2b), 4.47 (Н, м, 18-Н), 4.35 (Н, м, 17-Н), 3.80 (2H, м, 81-СН2), 3.79 (3Н, с, 152-СОOСН3), 3.61 (3Н, с, 121-СН3), 3.54 (3Н, с, 173-СОOСН3), 3.49 (3Н, с, 21-СН3), 3.48 (2H, м, 133-CH2), 3.30 (3Н, с, 71-СН3), 2.78 (2Н, м, 134-СН2), 2.53 (Н, м, 172-СН2а), 2.23 (Н, м, 171-СН2а), 2.17 (Н, м, 172-СН2b), 1.81 (Н, м, 171-СН2b), 1.70 (3H, д, J 7.1, 18-CH3), 1.62 (3H, т, J 7.6, 82-СН3), –1.63 (Н, шир.с, I-NH), –1.85 (Н, шир.с, III-NH).
13С-ЯМР (300 МГц, CDCl3, δ, м.д.): 173.8 (С, с, 152-С), 173.6 (С, с, 173-С), 168.9 (С, с, 131-С), 168.3 (С, с, 19-С), 167.1 (С, с, 16-С), 156.8 (С, с, 136-С), 153.7 (С, с, 6-С), 148.9 (С, с, 9-С), 144.6 (С, с, 8-С), 138.7 (С, с, 2-С), 135.9 (С, с, 7-С), 135.1 (С, с, 4-С), 134.3 (С, с, 12-С), 134.2 (С, с, 3-С), 129.9 (С, с, 11-С), 129.7 (С, с, 1-С), 128.5 (С, с, 31-С), 127.5 (С, с,13-С), 121.2 (С, с, 32-С), 102.1 (С, с, 15-С), 101.4 (С, с, 10-С), 98.6 (С, с, 5-С), 93.8 (С, с, 20-С), 53.1 (С, с, 17-С), 51.9 (С, с, 174-С), 49,3 (С, с, 18-С), 38.9 (С, с, 134-С), 37.4 (С, с, 151-С), 32.1 (C, с, 172-C), 31.3 (С, с, 171-С), 29.6 (С, с, 133-C), 23.8 (С, с, 181-С), 19.4 (С, с, 81-С), 17.8 (С, с, 82-С), 11.9 (С, с, 21-С), 11.3 (С, с, 121-С), 10.9 (С, с, 71-С).
Масс-спектрометрия соединения (II). MALDI, m/z: 709.0 (M+).
Реагенты. В экспериментах использовали фосфатно-солевой буфер (рН 7.4), глутамин и среду DМЕМ/F12 (ПанЭко, Россия); эмбриональную телячью сыворотку HyClone defined (GE Healthcare Life Sciences, США); CrEL и Rh123 (Sigma, США); LTG и TOG488 (Invitrogen, США).
Стоковый раствор соединения (II) с концентрацией 1 мМ готовили втиранием сухой навески в CrEL с дальнейшим доведением фосфатным буфером (рН 7.4) до конечного объема. Концентрация CrEL в стоковом растворе составила 5%.
Эксперименты на культуре клеток А549. Клетки аденокарциномы легкого человека А549 (получены из коллекции клеток Института вирусологии им. Д.И. Ивановского) выращивали в среде DМЕМ/F12 с добавлением 10% эмбриональной телячьей сыворотки и 2 мМ глутамина. Пересевы клеток проводили 2 раза в неделю. Клетки на логарифмической фазе роста отсевали на покровные стекла в 24-луночные планшеты в концентрации 5 × 105 клеток на лунку и выращивали сутки при 37°C, 5% СО2.
В экспериментах по изучению внутриклеточной локализации соединения (II) клетки инкубировали с исследуемым соединением (0.25–10 мкМ) в течение 1–4 ч с внесением в среду в конце инкубации одного из флуоресцентных зондов: LTG (50 нМ, 40 мин), TOG488 (50 мкг/мл, 30 мин) или Rh123 (50 мкг/л, 10 мин).
При исследовании внутриклеточного распределения соединения (II) после фотодинамического воздействия клетки А549 инкубировали с 0.3 мкМ соединения (II) в течение 2 ч. Далее клетки облучали 15 мин с помощью галогеновой лампы (500 Вт) через водный фильтр толщиной 5 см и широкополосный фильтр КС-13 с пропусканием 660–1000 нм. Плотность мощности света составляла 10–12 мВт/см2 (световая доза 20 Дж/см2). Флуоресцентный маркер лизосом LTG добавляли к клеткам в концентрации 50 нМ либо за 40 мин до облучения клеток, либо сразу после облучения. Внутриклеточное распределение соединения (II) анализировали методом ЛСКМ сразу после облучения клеток и через 40 мин.
Внутриклеточное распределение соединения (II) и его солокализацию с клеточными органеллами изучали с помощью конфокального лазерного сканирующего микроскопа Leica-SP2 (Leica, Германия). Конфокальные флуоресцентные изображения были получены с использованием водно-иммерсионного объектива 63×/1.2 HCX PL APO с латеральным и аксиальным разрешением 0.25 и 0.7 мкм соответственно. Флуоресценцию соединения (II) возбуждали лазером с длиной волны 633 нм и регистрировали в диапазоне 650–800 нм. Флуоресценцию красителей LTG, TOG488 и Rh123 возбуждали лазером с длиной волны 488 нм и регистрировали в диапазоне 500–600 нм. В контрольных экспериментах подтверждено, что при используемых параметрах измерений сигнал флуоресценции красителей LTG, TOG488 и Rh123 в спектральной области 650–800 нм (диапазон измерения флуоресценции соединения (II)) не регистрируется. Для оценки солокализации соединения (II) с органеллами полученные изображения распределения соединения (II) и флуоресцентного зонда органелл совмещали в программе ImageJ (National Institute of Health, США), а также рассчитывали коэффициенты солокализации, используя встроенную функцию этой программы.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что высокая фотоиндуцированная цитотоксичность соединения (II) для раковых клеток in vitro и in vivo [25] определяется воздействием на несколько внутриклеточных мишеней, доступ к которым меняется в процессе облучения клеток светом. Преимущественное накопление соединения (II) в лизосомах и частично в эндосомах создает основу для повреждения этих везикул на начальном этапе фотодинамического воздействия, которое сопровождается неизбирательным внутриклеточным перераспределением соединения (II) в различные мембранные структуры. Эти структуры становятся следующими мишенями для фотосенсибилизатора (II), а их повреждение (в первую очередь, по-видимому, повреждение мембран ЭР) по выявленным признакам вызывает развитие параптоза. При этом наблюдается усиленное накопление соединения (II) в мембранах образующихся вакуолей, в ядерной и цитоплазматической мембранах и в лизосомах, которые в свою очередь становятся предпочтительными мишенями усиленного фотодинамического воздействия.
Список литературы
Allison R.R. // Future Oncol. 2014. V. 10. P. 123–124. https://doi.org/10.2217/fon.13.176
Rkein A.M., Ozog D.M. // Dermatol. Clin. 2014. V. 32. P. 415–425. https://doi.org/10.1016/j.det.2014.03.009
Abrahamse H., Hamblin M.R. // Biochem. J. 2016. V. 473. P. 347–364. https://doi.org/10.1042/BJ20150942
Rumyantseva V.D., Shchelkunova A.E., Gorshkova A.S., Alekseev Yu.V., Shilov I.P., Ivano A.V., Davydov E.V., Mironov A.F. // Fine Chem. Technol. 2017. V. 12. P. 72–80. https://doi.org/10.32362/2410-6593-2017-12-2-72-80
Allison R.R., Downie G.H., Cuenca R., Hu X.-H., Childs C.J.H., Sibata C.H. // Photodiagn. Photodynam. Ther. 2004. V. 1. P. 27–42. https://doi.org/10.1016/S1572-1000(04)00007-9
Chilakamarthi U., Giribabu L.// Chem. Rec. 2017. V. 17. P. 775–802. https://doi.org/10.1002/tcr.201600121
Truchuelo M.T., Perez B., Fernandez-Guarino M., Moreno C., Jaén-Olasolo P. // J. Eur. Acad. Dermatol. Venereol. 2014. V. 28. P. 86–93. https://doi.org/10.1111/jdv.12064
Gao M., Yu F., Lv C., Choo J., Chen L. // Chem. Soc. Rev. 2017. V. 46. P. 2237–2271. https://doi.org/10.1039/c6cs00908e
Shlapakova T.I., Kostin R.K., Tyagunova E.E. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 657–674. https://doi.org/10.1134/S1068162020050222
Kwiatkowski S., Knap B., Przystupski D., Saczko J., Kędzierska E., Knap-Czop K., Kotlińska J., Michel O., Kotowski K., Kulbaska J. // Biomed. Pharmacother. 2018. V. 106. P. 1098–1107. https://doi.org/10.1016/j.biopha.2018.07.049
Nyman E.S., Hynninen P.H. // Photochem. Photobiol. 2004. V. 73. P. 1–28. https://doi.org/10.1016/j.jphotobiol.2003.10.002
Feofanov A., Sharonov G., Grichine A., Karmakova T., Pljutinskaya A., Lebedeva V., Ruziyev R., Yakubovskaya R., Mironov A., Refregier M., Maurizot J.-C., Vigny P. // Photochem. Photobiol. 2004. V. 79. P. 172–188. https://doi.org/10.1562/0031-8655(2004)079<0172: csoppo>2.0.co;2
Назарова А.И., Феофанов А.В., Кармакова Т.А., Шаронов Г.В., Плютинская А.Д., Якубовская Р.И., Лебедева В.С., Миронов А.Ф., Моризо Ж.-К., Вини П. // Биоорг. химия. 2005. Т. 31. С. 535–548. [Nazaro-va A.I., Feofanov A.V., Karmakova T.A., Sharonov G.V., Plyutinskaya A.D., Yakubovskaya R.I., Lebedeva V.S., Mironov A.F., Maurizot J.C., Vigny P. // Russ. J. Bioorg. Chem. 2005. V. 31. P. 482–494.] https://doi.org/10.1007/s11171-005-0066-9
Castano A.P., Demidova T.N., Hamblin M.R. // Photodiagn. Photodynam. Ther. 2004. V. 1. P. 279–293. https://doi.org/10.1016/S1572-1000(05)00007-4
Feofanov A., Grichine A., Karmakova T., Pljutinskaya A., Lebedeva V., Filyasova A., Yakubovskaya R., Mironov A., Egret-Charlier M., Vigny P. // Photochem. Photobiol. 2002. V. 75. P. 633–643. https://doi.org/10.1562/0031-8655(2002)075<0633: nipboa>2.0.co;2
Sharonov G.V., Karmakova T.A., Kassies R., Pljutinskaya A.D., Grin M.A., Refregiers M., Yakubovskaya R.I., Mironov A.F., Maurizot J.-C., Vigny P., Otto C., Feofanov A.V. // Free Radic. Biol. Med. 2006. V. 40. P. 407–419. https://doi.org/10.1016/j.freeradbiomed.2005.08.028
Chiaviello A., Postiglione I., Palumbo G. // Cancers. 2011. V. 3. P. 1014–1041. https://doi.org/10.3390/cancers3011014
Dabrowski J.M., Arnaut L.G. // Photochem. Photobiol. Sci. 2015. V. 14. P. 1765–1780. https://doi.org/10.1039/c5pp00132c
Узденский А.Б. // Биофизика. 2016. Т. 61. № 3. С. 547–557.
Kessel D. // J. Porphyr. Phthalocyan. 2004. V. 8. P. 1009–1014. https://doi.org/10.1142/S1088424604000374
Nazarova A., Ignatova A., Feofanov A., Karmakova T., Pljutinskaya A., Mass O., Grin M., Yakubovskaya R., Mironov A., Maurizot J.-C. // Photochem. Photobiol. Sci. 2007. V. 6. P. 1184–1196. https://doi.org/10.1039/b706921a
Moan J., Berg K., Kvam E., Western A., Malik Z., Ruck A., Schneckenburger H. // Ciba Found Symp. 1989. V. 146. P. 95–111. https://doi.org/10.1002/9780470513842.ch7
Гельфонд М.Л. // Практическая онкология. 2007. Т. 8. № 4. С. 204–210.
Efremenko A.V., Ignatova A.A., Grin M.A., Sivaev I.B., Mironov A.F., Bregadze V.I., Feofanov A.V. // Photochem. Photobiol. Sci. 2014. V. 13. P. 92–102. https://doi.org/10.1039/c3pp50226k
Gao Y.-H., Lovreković V., Kussayeva A., Chen D.-Y., Margetić D., Chen Z.-L. // Eur. J. Med. Chem. 2019. V. 177. P. 144–152. https://doi.org/10.1016/j.ejmech.2019.05.050
Efremenko A.V., Ignatova A.A., Borsheva A.A., Grin M.A., Bregadze V.I., Sivaev I.B., Mironov A.F., Feofanov A.V. // Photochem. Photobiol. Sci. 2012. V. 11. P. 645–652. https://doi.org/10.1039/c2pp05237g
Grin M.A., Reshetnikov R.I., Yakubovskay R.I., Plotnikova E.A., Morozova N.B., Tsigankov A.A., Efremenko A.V., Ermakova D.E., Feofanov A.V., Mironov A.F. // J. Porphyr. Phthalocyan. 2014. V. 18. P. 129–138. https://doi.org/10.1142/S1088424613501265
Fontana F., Raimondi M., Marzagalli M., Di Domizio A., Limonta P. // Biochim. Biophys. Acta Rev. Cancer. 2020. V. 1873. P. 188338. https://doi.org/10.1016/j.bbcan.2020.188338
Kessel D. // Photochem. Photobiol. 2019. V. 95. P. 119–125. https://doi.org/10.1111/php.12952
Kessel D. // Apoptosis. 2020. V. 25. P. 611–615. https://doi.org/10.1007/s10495-020-01634-0
Brilkina A.A., Dubasova L.V., Sergeeva E.A., Pospelov A.J., Shilyagina N.Y., Shakhova N.M., Balalaeva I.V. // J. Photochem. Photobiol. B. 2019. V. 191. P. 128–134. https://doi.org/10.1016/j.jphotobiol.2018.12.020
Kessel D., Luguya R., Vicente M.G.H. // Photochem. Photobiol. 2003. V. 78. P. 431–435. https://doi.org/10.1562/0031-8655(2003)078<0431: lapeot>2.0.co;2
Carneiro J., Gonçalves A., Zhou Z., Griffin K.E., Kaufman N.E.M., Vicente M.G.H. // Lasers Surg. Med. 2018. V. 50. P. 566–575. https://doi.org/10.1002/lsm.22824
Stoka V., Turk B., Schendel S.L., Kim T.H., Cirman T., Snipas S.J., Ellerby L.M., Bredesen D., Freeze H., Abrahamson M., Bromme D., Krajewski S., Reed J.C., Yin X.M., Turk V., Salvesen G.S. // J. Biol. Chem. 2001. V. 276. P. 3149–3157. https://doi.org/10.1074/jbc.M008944200
Reiners J.J., Jr., Caruso J.A., Mathieu P., Chelladurai B., Yin X.M., Kessel D. // Cell. Death Differ. 2002. V. 9. P. 934–944. https://doi.org/10.1038/sj.cdd.4401048
Kessel D., Vicente M.G., Reiners J.J., Jr. // Lasers Surg. Med. 2006. V. 38. P. 482–488. https://doi.org/10.1002/lsm.20334
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия