Биоорганическая химия, 2021, T. 47, № 5, стр. 632-641
Влияние экспериментальных конъюгатов антигенов БЦЖ и дериватов бетулина на иммунные реакции у морских свинок
И. Н. Кошкин 1, В. С. Власенко 2, *, И. В. Кулаков 3
1 Омский государственный аграрный университет им. П.А. Столыпина
644008 Омск, Институтская пл., 2, Россия
2 Омский аграрный научный центр
644012 Омск, просп. Королева, 26, Россия
3 Институт химии, Тюменский государственный университет
625003 Тюмень, ул. Перекопская, 15а, Россия
* E-mail: vvs-76@list.ru
Поступила в редакцию 14.10.2020
После доработки 26.10.2020
Принята к публикации 28.10.2020
Аннотация
Представлены результаты оценки иммуностимулирующих свойств конъюгатов на основе антигенов вакцинного штамма БЦЖ с производными бетулина. Эксперименты проводили на морских свинках линии агути (n = 20). Животных опытных групп (n = 5) иммунизировали противотуберкулезными препаратами: 1-я группа – антигенами вакцинного штамма БЦЖ, конъюгированными с бетулиновой кислотой; 2-я группа – антигенами БЦЖ, конъюгированными с бетулоновой кислотой; 3-я группа – вакциной БЦЖ. Животным контрольной группы (n = 5) вводили физиологический раствор. На 30-е сут после введения противотуберкулезных препаратов всех животных инфицировали вирулентной культурой Mycobacterium bovis (штамм 8). Отбор проб крови для оценки иммунного статуса проводили на 30-е сут после введения препаратов и 30-е сут после инфицирования M. bovis. Установлено, что сконструированные конъюгаты оказывали иммуностимулирующее действие, которое характеризовалось увеличением в 1.7–3.8 раза числа иммунокомпетентных клеток, а также усилением функциональной активности нейтрофилов, наиболее выраженное у морских свинок 2-й группы. После инфицирования M. bovis такие ключевые параметры иммунной системы, как содержание Т-лимфоцитов и активность ферментной (миелопероксидаза) и неферментной (катионные белки) бактерицидных систем нейтрофильных гранулоцитов, были в значительной степени увеличены у морских свинок 2-й и 3-й групп, что свидетельствовало о наиболее высокой противотуберкулезной активности препаратов, введенных этим животным. Через 45 сут после инфицирования M. bovis морские свинки были подвергнуты эвтаназии. Последующие патологоанатомические исследования подтвердили, что конъюгат на основе вакцинного штамма с бетулоновой кислотой и вакцина БЦЖ индуцируют выраженную устойчивость к патогенным микобактериям. Создаваемый этими препаратами индекс защиты находился приблизительно на одном уровне и составил 66 и 71% соответственно.
ВВЕДЕНИЕ
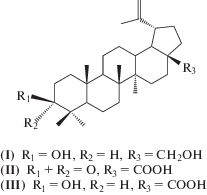
В последние десятилетия все большее внимание исследователей привлекают природные биоактивные соединения. Одну из лидирующих позиций в ряду таких соединений занимает пентациклический тритерпеновый спирт бетулин (I) и его дериваты: бетулоновая (II) и бетулиновая (III) кислоты (схема 1 ), а также их производные [1]. Многочисленными зарубежными и российскими исследованиями доказана высокая биологическая активность бетулина, которая реализуется через ферментативные механизмы (воздействие на активность ферментов) и управляет количеством ферментов в клетке организма (путем их синтеза и распада). При выраженной биологической активности бетулин характеризуется полным отсутствием токсичности. К основным его свойствам относятся: гепатопротекторное, желчегонное, антилитогенное, антиоксидантное, противовоспалительное, противоопухолевое, противовирусное, иммуномодуляторное, гиполипидемическое, гастропротекторное, антисептическое, антимутагенное [2–4]. Помимо наличия разнообразной биологической активности, бетулин, так же как и другие лупановые тритерпеноиды, не обладает аллергенным, канцерогенным, кожнораздражающим, кумулятивным, мутагенным, сенсибилизирующим и эмбриотоксическим действием, имеет очень низкую токсичность (бетулин относится к IV классу опасности веществ, LD50 = = 9000 мг/кг) [1].
Схема 1 . Структурные формулы бетулина (I) и его дериватов: бетулоновой (II) и бетулиновой (III) кислот.
Бетулоновая кислота (II) – продукт окисления бетулина и важное соединение в синтезе высокоактивных тритерпенов лупанового ряда (в том числе бетулиновой кислоты) и их тритерпеноидов (например, аллобетулона).
Бетулиновая кислота (3β-гидрокси-луп-20(29)-ен-28-овая кислота) (III) привлекает в последнее десятилетие внимание многих исследователей в связи с обнаружением у нее ряда полезных биологических свойств. Так, бетулиновая кислота (III) обладает выраженной противоопухолевой активностью [2, 5] и противовоспалительными свойствами [6]. В 1994 г. была обнаружена анти-ВИЧ-активность бетулиновой кислоты [7, 8], что послужило мощным стимулом для синтеза ее производных.
Несмотря на множество публикаций по исследованиям активности бетулина и его дериватов (II), (III), сведения о каких-либо положительных результатах их применения в тестах in vivo практически отсутствуют.
Ранее в исследованиях на животных было показано положительное влияние бетулина на обмен веществ у собак [9], иммуностимулирующее воздействие на организм телят [10] и иммунную систему птиц [11]. Разработаны и испытаны в экспериментальных исследованиях различные схемы применения бетулина для повышения специфической и неспецифической резистентности цыплят-бройлеров при вакцинациях, изучено его влияние на обмен веществ и продуктивность [12]. В испытаниях авторы применяли в основном экстракт, содержащий ~70% бетулина.
Туберкулез крупного рогатого скота, несмотря на существенное снижение распространения, по-прежнему – серьезная проблема. Для некоторых регионов разных стран мира инфекция все еще остается эндемичной [13–16], поэтому важность разработки эффективных и безопасных специфических препаратов для борьбы с этим заболеванием неоспорима.
К настоящему времени разработан ряд противотуберкулезных препаратов для крупного рогатого скота с новыми аттенуированными штаммами микобактерий, а также субъединичные вакцины [17, 18]. Развитие этого направления в основном сосредоточено на создании новых препаратов, способных заменить бациллу Кальметта–Герена (БЦЖ), а также бустерных вакцин, необходимых для усиления или пролонгации защитных эффектов БЦЖ и улучшения ее иммуногенности [19].
Из целого ряда концепций конструирования безопасных вакцин заслуживает внимание конъюгация иммуногенной фракции, выделенной из вакцинных бактерий, с матрицей, формирующей в организме животного депо специфического иммуногена. В системе иммунитета данный комплекс предположительно имитирует живую вакцину, а именно способствует накоплению значительного количества клеток иммунной памяти, которые в дальнейшем и обеспечивают защиту животного от возбудителя [20]. На основе такого принципа создания иммуногенов были сконструированы препараты из отдельных фракций разрушенной ультразвуком культуры БЦЖ, конъюгированной с целлюлозной матрицей, а также с синтетическими полиэлектролитами [21, 22].
Дальнейшее совершенствование изготовления специфических препаратов по этому принципу возможно с помощью поиска новых эффективных средств с адъювантными свойствами, способных повысить иммуногенность вакцин, а также снизить их токсичность. Из такого рода веществ особое внимание привлекает бетулин, содержащийся в экстракте бересты (внешней части коры березы). Некоторыми исследователями показана перспективность применения бетулина в качестве адъюванта вакцинных препаратов [23, 24].
Цель данной работы – изучение иммуностимулирующих свойств препаратов, изготовленных на основе антигенов вакцинного штамма БЦЖ и дериватов бетулина.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Задачи исследования – выделение из бересты основного компонента – тритерпенового спирта бетулина (I) и осуществление химической модификации до бетулоновой (II) и бетулиновой (III) кислот по описанным литературным методикам. На основе полученных бетулоновой (II) и бетулиновой (III) кислот в качестве корпускулярных адъювантов и антигенов вакцинного штамма БЦЖ мы получили соответствующие конъюгаты для последующего исследования, а также провели оценку реакций клеточного иммунитета на введение морским свинкам вновь сконструированных конъюгатов до и после экспериментального инфицирования животных вирулентной культурой Mycobacterium bovis (возбудитель туберкулеза у крупного рогатого скота).
Экстракция бетулина и синтез его дериватов. Способы извлечения бетулина из коры березы, растворители для экстракции, зависимость скорости извлечения бетулина от степени измельчения и других параметров широко обсуждены в литературе [1, 25].
Для выделения бетулина (I) применяли экстрагирование этанолом измельченной бересты в аппарате Сокслета (подробности приведены в “Эксперим. части”).
Необходимые для дальнейших испытаний дериваты бетулина – бетулоновая (II) и бетулиновая (III) кислоты – были получены из выделенного неочищенного бетулина по известным методикам [26–29]. Литературный поиск показал, что лучше всего идет окисление бетулина (схема 2 ) с применением в качестве окислителя реактива Джонса (раствор оксида хрома в серной кислоте) [28]. Температура плавления и спектральные характеристики полученной бетулоновой кислоты (II) совпали с литературными данными [28].
Схема 2 . Окисление бетулина (I) до бетулоновой кислоты (II).
Имеющаяся в составе экстракта бетулина природная бетулиновая кислота (III) находится в примесных концентрациях (не более 1%), что создает огромные трудности в ее выделении и полноценном использовании. Более эффективный подход – получение кислоты (III) синтетическим способом из бетулина и далее бетулоновой кислоты (II). При этом значительно повышается суммарный выход бетулиновой кислоты с сохранением 3β-эпимера, характерного для биологически активного природного изомера бетулиновой кислоты.
Выходы при восстановлении бетулоновой кислоты (II) боргидридом натрия (схема 3 ) варьируются до 90%. При проведении восстановления в 2-пропаноле образуется небольшое количество 3α-эпимера (до 5%), который легко удаляется с помощью перекристаллизации [28].
Схема 3 . Восстановление бетулоновой кислоты (II) до бетулиновой кислоты (III).
Температура плавления и спектральные характеристики полученной бетулиновой кислоты (III) совпали с литературными данными [28].
Получение экспериментальных конъюгатов. Из вакцинного штамма БЦЖ получали антигенные комплексы, доводили в них концентрацию белка до 1000 мкг/мл, затем добавляли бетулоновую кислоту (II) из расчета 500 мкг/мл и размешивали смесь до полного растворения при комнатной температуре. По аналогичной схеме получали конъюгат антигенов БЦЖ с бетулиновой кислотой (III).
Иммунные реакции на введение экспериментальных конъюгатов морским свинкам. Оценку иммуностимулирующих свойств конъюгатов антигенов вакцинного штамма БЦЖ с производными бетулина проводили на морских свинках линии агути (n = 20). Животных опытных групп (n = 5) иммунизировали противотуберкулезными препаратами: 1-я группа – антигенами вакцинного штамма БЦЖ, конъюгированными с бетулиновой кислотой (III); 2-я группа – антигенами БЦЖ, конъюгированными с бетулоновой кислотой (II); 3-я группа – вакциной БЦЖ. Животным контрольной группы (n = 5) вводили физиологический раствор.
На 29-е сут после иммунизации противотуберкулезными препаратами животным внутрикожно вводили туберкулин. Аллергическая реакция развивалась только у морских свинок, иммунизированных вакциной БЦЖ; диаметр припухлости кожи составил 8.8 ± 1.2 мм.
Через 30 сут после введения противотуберкулезных препаратов проводили отбор проб крови для оценки иммунных реакций: определения числа иммунокомпетентных клеток в абсолютном содержании (×109/л) и функциональной активности нейтрофилов, включающей оценку кислород-зависимых (тест с нитросиним тетразолием, определение миелопероксидазы) и кислород-независимых (содержание лизосомально-катионных белков) механизмов бактерицидной системы. Описание иммунного статуса животных опытных групп проводили в сравнении с особями контрольной группы.
Анализ параметров иммунной системы на 30-е сут после введения противотуберкулезных препаратов (табл. 1) показал, что у морских свинок всех опытных групп наблюдалось достоверное увеличение числа лейкоцитов. Так, относительно контрольной группы концентрация белых клеток крови у животных, вакцинированных БЦЖ, возросла на 80%, а после обработки комплексом антигенов БЦЖ с кислотами (II) и (III) – на 28.2 и 41.2% соответственно.
Таблица 1.
Иммунологические параметры крови морских свинок на 30-е сут после введения противотуберкулезных препаратов
| Показатель | Контроль | Опытные группы | ||
|---|---|---|---|---|
| 1-я группа (конъюгат антигенов БЦЖ с бетулиновой кислотой (III)) |
2-я группа (конъюгат антигенов БЦЖ с бетулоновой кислотой (II)) | 3-я группа (вакцина БЦЖ) |
||
| Лейкоциты, ×109/л | 6.60 ± 0.34 | 9.32 ± 1.05* | 8.46 ± 0.62* | 11.90 ± 0.94** |
| Лимфоциты, ×109/л | 4.14 ± 0.27 | 6.06 ± 0.71* | 6.45 ± 0.46** | 6.87 ± 0.72** |
| Нейтрофилы, ×109/л | 2.06 ± 0.15 | 3.03 ± 0.29* | 1.71 ± 0.21 | 4.24 ± 0.49** |
| Т-лимфоциты, ×109/л | 0.68 ± 0.07 | 1.16 ± 0.17* | 2.14 ± 0.26** | 1.30 ± 0.22* |
| В-лимфоциты, ×109/л | 1.13 ± 0.15 | 2.26 ± 0.26** | 1.92 ± 0.09** | 1.45 ± 0.14 |
| Цитотоксические Т-лимфоциты, ×109/л | 0.56 ± 0.13 | 1.54 ± 0.23** | 2.14 ± 0.30** | 1.67 ± 0.16** |
| НСТ-тест, спонт., ед. опт. пл. | 0.73 ± 0.03 | 0.90 ± 0.07 | 0.59 ± 0.05* | 0.78 ± 0.03 |
| НСТ-тест, стимулир., ед. опт. пл. | 0.95 ± 0.02 | 0.94 ± 0.05 | 1.11 ± 0.03** | 1.00 ± 0.06 |
| Функциональный резерв нейтрофилов, у.е. | 1.31 ± 0.08 | 1.05 ± 0.03* | 1.95 ± 0.24* | 1.28 ± 0.10 |
| СЦК ЛКБ, у.е. | 1.08 ± 0.07 | 1.42 ± 0.12* | 1.53 ± 0.04*** | 0.97 ± 0.03 |
| СЦК МПО, у.е. | 0.72 ± 0.07 | 0.90 ± 0.09 | 0.97 ± 0.08 | 0.79 ± 0.09 |
* р < 0.05. ** р < 0.01. *** р < 0.001. Обозначения: НСТ-тест – тест с нитросиним тетразолием; СЦК ЛКБ – средний цитохимический коэффициент содержания лизосомальных катионных белков, СЦК МПО – средний цитохимический коэффициент активности миелопероксидазы. Данные приведены в виде средних значений ± s.d.
Идентичные изменения показателей отмечены в абсолютном содержании лимфоцитов. Средние значения этого параметра у животных опытных групп были увеличены относительно контрольной группы на 46–56% (р < 0.05). Кроме того, наблюдалось достоверное повышение концентрации нейтрофилов у морских свинок, иммунизированных БЦЖ и конъюгатом антигенов БЦЖ с кислотой (III) – в 2.1 раза (р < 0.01) и 1.5 раза (р < 0.05) соответственно. Следует отметить, что после введения конъюгата антигенов БЦЖ с кислотой (II), напротив, прослеживалась тенденция к некоторому снижению количества нейтрофилов.
Рост числа лимфоидных клеток происходил за счет всех популяций. Так, по сравнению с контролем в группе животных, иммунизированных конъюгатами антигенов БЦЖ с кислотами (II) и (III), концентрация Т-лимфоцитов возросла с высокой степенью достоверности в 3.1 и 1.7 раза, В-лимфоцитов – в 1.7 и 2 раза, цитотоксических Т-лимфоцитов – в 3.8 и 2.8 раза соответственно. Вакцинация БЦЖ также способствовала пролиферации иммунокомпетентных клеток, особенно это касалось Т-лимфоцитов и цитотоксических Т-лимфоцитов.
Действие противотуберкулезных препаратов на генерацию активных форм кислорода, в том числе перекиси водорода, носило преимущественно стимулирующий характер, хотя оно не оказывало статистически значимого влияния на показатели тетразолиевой (НСТ-тест) и пероксидазной активности (СЦК МПО). Исключения – особи, иммунизированные конъюгатом антигенов БЦЖ с кислотой (II), у которых отмечалось достоверное снижение спонтанной на 19.2% (р < < 0.05) и повышение индуцированной НСТ-активности на 16.8% (р < 0.01) относительно контрольной группы. Вследствие таких изменений у животных 2-й группы также был существенно увеличен функциональный резерв нейтрофилов (на 48.9%), отражающий эффекторный потенциал системы фагоцитоза. В то же время у морских свинок, иммунизированных конъюгатом антигенов БЦЖ с кислотой (III), резервная активность нейтрофилов, напротив, была снижена на 19.8% (р < < 0.05), а у животных, иммунизированных БЦЖ, находилась приблизительно на одном уровне с контрольной группой.
Неодинаковую тенденцию изменений наблюдали при исследовании другого важного компонента микробицидной системы лейкоцитов – катионных белков. В частности, с помощью цитохимического коэффициента выявлены следующие отличия: введение вакцины БЦЖ сопровождалось незначительным снижением активности катионных белков, тогда как иммунизация конъюгатами на основе антигенов БЦЖ с кислотами (II) и (III) – существенным увеличением относительно контроля: их уровень вырос, соответственно, в 1.4 и 1.3 раза относительно контрольной группы животных.
Таким образом, введение морским свинкам изучаемых противотуберкулезных препаратов – конъюгатов на основе антигенов БЦЖ с кислотами (II), (III) и вакцины БЦЖ – оказывало иммуностимулирующее действие, которое проявлялось в увеличении числа иммунокомпетентных клеток, а также усилении функциональной активности нейтрофилов разной степени выраженности.
Иммунные реакции на инфицирование M. bovis морских свинок, иммунизированных экспериментальными конъюгатами. На 30-е сут после иммунизации противотуберкулезными препаратами животных контрольной и опытных групп инфицировали вирулентной культурой M. bovis (штамм 8).
На 29-е сут после инфицирования животным внутрикожно вводили туберкулин. Наиболее выраженное образование припухлости кожи отмечено у морских свинок контрольной группы – диаметром 9.2 ± 0.58 мм, затем у иммунизированных БЦЖ – 7.0 ± 1.3 мм. Интенсивность кожной реакции у животных, иммунизированных конъюгатами антигенов БЦЖ с кислотами (II) и (III), была ниже – диаметр припухлости кожи составил, соответственно, 5.4 ± 1.53 и 5.6 ± 0.6 мм.
Через 30 сут после инфицирования M. bovis у морских свинок проводили отбор проб крови для оценки иммунных реакций по тем же показателям, которые были использованы в предыдущий срок исследования (табл. 2).
Иммунологическая перестройка на 30-е сут после инфицирования M. bovis у морских свинок, иммунизированных конъюгатами на основе антигенов БЦЖ с кислотами (II) и (III), сопровождалась снижением числа лейкоцитов, соответственно, на 35.6 и 33.6% (р < 0.001), лимфоцитов – на 39.8 и 36.9% (р < 0.001) и нейтрофилов – на 14.3 и 16.8% (р < 0.01) относительно соответствующих значений у животных контрольной группы. Следует отметить, что введение M. bovis особям, вакцинированным БЦЖ, не оказывало статистически значимого влияния на указанные показатели, хотя и прослеживалась тенденция к их повышению.
Снижение концентрации лимфоидных клеток после экспериментального заражения морских свинок, иммунизированных конъюгатами антигенов БЦЖ с кислотами (II) и (III), происходило за счет популяции цитотоксических Т-лимфоцитов и В-лимфоцитов. Так, по сравнению с контрольной группой зарегистрировано уменьшение числа цитотоксических Т-клеток, соответственно, на 62.1 и 60.8% (р < 0.01), а В-клеток – на 33% (р < 0.01). В то же время инфицирование особей, которым предварительно вводили конъюгат антигенов БЦЖ с кислотой (II), индуцировало существенное увеличение концентрации Т-лимфоцитов – на 72.7% (р < 0.05). Последнее изменение также было характерно для животных, иммунизированных БЦЖ, у которых пролиферация Т-клеток носила более выраженный характер (увеличение в 2.7 раза по сравнению с контрольной группой, р < 0.01).
Изменения показателей кислород-зависимой бактерицидной активности нейтрофилов по результатам исследований в НСТ-тесте в анализируемых группах были однонаправленными. При отсутствии значимых отличий был отмечен рост стимулированной и снижение спонтанной тетразолиевой активности. Помимо этого, средние значения функционального резерва нейтрофилов у морских свинок опытных групп были увеличены в 1.18 и 1.2 раза относительно контрольной группы (р < 0.05).
Сходными изменениями характеризовались также СЦК ЛКБ и СЦК МПО: значения этих показателей у животных, иммунизированных БЦЖ, увеличились, соответственно, в 1.7 и 1.9 раза, а у морских свинок, иммунизированных конъюгатом антигенов БЦЖ с кислотой (II) – в 2.1 и 2.3 раза относительно контрольной группы, при этом только у последних наблюдалось статистически значимое повышение показателей. У особей, иммунизированных конъюгатом антигенов БЦЖ с кислотой (III), эти коэффициенты существенно не изменялись, хотя и наблюдалась некоторая тенденция к увеличению СЦК ЛКБ.
Известно, что при туберкулезе возникает дефицит Т-системы иммунитета, выраженность которого усиливается по мере прогрессирования заболевания. Ведущую роль в формировании противотуберкулезного иммунитета играет функциональное состояние фагоцитирующих клеток, особенно их бактерицидных систем. После экспериментального инфицирования вирулентным штаммом микобактерий указанные ключевые параметры иммунной системы у морских свинок, иммунизированных БЦЖ и конъюгатом антигенов БЦЖ с кислотой (II), были существенно выше по сравнению с животными контрольной группы, что свидетельствовало о более высокой противотуберкулезной активности этих препаратов.
Патологоанатомические исследования. Через 45 сут после инфицирования M. bovis морские свинки были подвергнуты эвтаназии. Последующие патологоанатомические исследования также подтвердили высокую эффективность конъюгата антигенов БЦЖ с кислотой (II) и вакцины БЦЖ. Так, показатель степени пораженности органов у особей этих групп был минимальным и в среднем составил 2.4 и 2.0 балла соответственно, при этом у отдельных особей отмечали значительное увеличение регионарных лимфатических узлов, их уплотнение с творожистым распадом. В то же время индекс защиты, напротив, был максимальным – 66 и 71%.
При патологоанатомическом исследовании морских свинок, иммунизированных конъюгатом антигенов БЦЖ с кислотой (III), помимо выраженных изменений лимфатических узлов могли наблюдать незначительное увеличение селезенки и единичные мелкие туберкулезные узелки во внутренних органах. В контрольной группе животных эти изменения сопровождались увеличением лимфатических узлов с наличием казеозных масс в них, заметным увеличением селезенки с крупными туберкулезными узлами, а также наличием единичных крупных очагов в печени и легких. Показатель пораженности органов составил 7.0 баллов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Спектры 1H- и 13С-ЯМР регистрировали на спектрометре ECX 400А (Jeol, Япония) с рабочей частотой 400.13 МГц. Химические сдвиги измеряли по отношению к сигналу внутреннего стандарта – тетраметилсилана. ИК-спектры регистрировали на спектрометре Infralum FT-801 (СИМЕКС, Россия). ВЭЖХ проводили на жидкостном хроматографе Agilent 1100 с диодно-матричным детектором (Agilent, Германия). Контроль за ходом реакции и чистотой полученных соединений осуществляли методом ТСХ на пластинках Sorbfil, проявление парами йода или УФ-светом. Температуру плавления определяли на столике Кофлера.
Экстракт бетулина. Для получения экстракта бетулина 230 г предварительно измельченной (до 2–5 мм в диаметре), промытой водой от луба и высушенной бересты помещали в экстрактор Сокслета и экстрагировали в течение 10 ч этанолом. Выделившийся при охлаждении раствора бетулин отфильтровывали, промывали несколько раз водой и высушивали до постоянной массы. Получили 73.4 г (выход 32%) сухого экстракта с относительным содержанием бетулина 82% (по данным ВЭЖХ).
Бетулоновая кислота (II). В трехгорлую колбу вместимостью 1000 мл, снабженную мешалкой, помещали 73.4 г выделенного экстракта бетулина и 300 мл ацетона. Реакционную смесь охлаждали до 0°С и при перемешивании добавляли по каплям рассчитанное количество оксида хрома(VI) в виде стандартного реактива Джонса в ацетоне. По окончании реакции реакционную смесь (верхний ацетоновый раствор) выливали в 1000 мл смеси воды и льда. Выпавший вязкий осадок постепенно стекловался, его далее растирали в ступке со льдом до порошкообразного состояния и отфильтровывали, промывая холодной водой. Неочищенную бетулоновую кислоту растворяли в 300 мл бензола, органический слой промывали разбавленной соляной кислотой, водой, 5%-ным раствором бикарбоната натрия и снова водой до нейтральной реакции. После сушки на воздухе получили 40.8 г сырой бетулоновой кислоты (выход 55%).
Для дальнейшей очистки в бензольный раствор бетулоновой кислоты добавляли раствор гидроксида натрия до полного выпадения осадка натриевой соли бетулоновой кислоты, который отфильтровывали, промывали сначала водой, затем 10%-ным раствором хлорида натрия, далее диэтиловым эфиром. Для выделения бетулоновой кислоты ее натриевую соль растворяли в водно-спиртовом растворе и обрабатывали разбавленной (1 : 5) соляной кислотой. Выпавшую в осадок бетулоновую кислоту отфильтровывали, промывали водой и высушивали; перекристаллизовывали из 2-пропанола.
Продукт представляет собой порошкообразное вещество белого цвета, т. пл. 245–246°С. ИК- и 1Н-ЯМР-спектры соответствовали представленным в литературе [28].
Бетулиновая кислота (III). В колбу вместимостью 500 мл, снабженную эффективной мешалкой, помещали 25 г (0.055 моль) бетулоновой кислоты, 200 мл 2-пропанола и постепенно частями присыпали 10.6 г (0.28 моль) боргидрида натрия (5-кратный избыток). По окончании реакции в колбу добавляли 50 мл 5%-ного раствора соляной кислоты для разложения остатков боргидрида натрия. По окончании разложения продукт реакции экстрагировали диэтиловым эфиром. Эфирный экстракт промывали водой, содой, затем снова водой, сушили над сульфатом натрия. Эфир отгоняли, получили 22.6 г (выход 90%) белого порошкообразного вещества. После перекристаллизации из 2-пропанола получили белые кристаллы с т. пл. 287–290°С. ИК- и 1Н-ЯМР-спектры соответствовали представленным в литературе [28].
Получение экспериментальных конъюгатов. Для получения антигенных комплексов культуру вакцинного штамма БЦЖ, выращенную на жидкой синтетической среде Сотона, подвергали ультразвуковой дезинтеграции на аппарате УЗДН-1 (22–35 кГц, 60–70 Вт/см2) в течение 30 мин. Для посева на питательную среду использовали суспензию из лиофилизата микобактерий вакцинного штамма БЦЖ-1 (Филиал “Медгамал” ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи” Минздрава России). Полученную взвесь центрифугировали, в надосадочной жидкости определяли содержание белка с помощью красителя бромфенолового синего. Для иммунизации животных использовали конъюгаты, в состав которых входили антигены БЦЖ в комплексе с бетулоновой (II) или бетулиновой (III) кислотами в качестве корпускулярных адъювантов в соотношении 2 : 1. Концентрацию белка в антигенном комплексе доводили до 1000 мкг/мл, затем в препарат добавляли адъювант в количестве 500 мкг/мл и размешивали до полного растворения при комнатной температуре.
Экспериментальные животные и схема опыта. Исследования выполняли на самцах морских свинок линии агути (масса 400–450 г, возраст 4–5 месяцев), содержавшихся в условиях специализированного вивария лаборатории эпизоотологии и мер борьбы с туберкулезом отдела ветеринарии Омского аграрного научного центра. До начала исследований всем животным выстригали боковую поверхность тела и внутрикожно вводили туберкулин очищенный (ППД) для млекопитающих (Курская биофабрика – фирма “БИОК”, Россия) в дозе 25 МЕ в объеме 0.1 мл растворителя. Аллергическую реакцию оценивали через 24 ч. Для проведения исследований были отобраны только особи (n = 20) с отрицательной реакцией на введение туберкулина.
Животных опытных групп иммунизировали противотуберкулезными препаратами: животным 1-й группы (n = 5) подкожно (в область паха справа) вводили конъюгат антигенов БЦЖ с бетулиновой кислотой (III) в дозе 0.5 мл, животным 2-й группы (n = 5) подкожно вводили конъюгат с антигенов БЦЖ бетулоновой кислотой (II) в той же дозе; животным 3-й группы (n = 5) внутрикожно вводили вакцину БЦЖ в дозе 0.1 мг в 0.1 мл физиологического раствора. Животным контрольной группы (n = 5) подкожно вводили физиологический раствор (0.5 мл).
На 29-е сут после введения противотуберкулезных препаратов всем животным внутрикожно вводили туберкулин. Аллергическую реакцию оценивали через 24 ч, затем производили отбор проб крови из сердца для изучения иммунного статуса.
Через 30 сут после иммунизации животным контрольной и опытных групп подкожно (в область паха слева) вводили вирулентную культуру М. bovis (штамм 8) в дозе 1 мкг/мл. В работе использовали культуру из Биоресурсной коллекции патогенных микроорганизмов отдела ветеринарии Омского аграрного научного центра.
На 29-е сут после инфицирования M. bovis всем животным внутрикожно вводили туберкулин. Аллергическую реакцию оценивали через 24 ч, затем производили отбор проб крови из сердца для изучения иммунного статуса по тем же показателям, которые были использованы в предыдущий срок исследования.
За лабораторными животными вели постоянное клиническое наблюдение, которое включало оценку двигательной активности, поведения животного, а также регистрацию частоты пульса, дыхания и температуры тела.
Через 45 сут после инфицирования М. bovis животных подвергали эвтаназии ингаляционным наркозом парами эфира и проводили патологоанатомические исследования: показатель пораженности органов оценивали по методу С.И. Гельберг и Е.А. Финкель [30], индекс защиты – по методике А.И. Тогуновой и Е.Н. Лещинской [31].
Изучение иммунологических параметров. Количественное определение иммунокомпетентных клеток проводили методами спонтанного, комплементарного и глобулинового розеткообразования в соответствии с методическими рекомендациями по оценке иммунного статуса при хронических инфекциях животных [32]. Подсчет лейкоцитов и лейкограммы осуществляли по общепринятым методикам.
Функциональную активность нейтрофилов оценивали в тесте с нитросиним тетразолием (НСТ-тест) в спонтанном и индуцированном (вакцина БЦЖ) вариантах фотометрическим способом. Дополнительно рассчитывали функциональный резерв нейтрофилов как отношение индуцированного варианта НСТ к спонтанному [33]. В нейтрофильных гранулоцитах цитохимическим методом определяли активность миелопероксидазы (МПО) по методу Грэхем–Кнолля с использованием бензидина [34], а также содержание лизосомально-катионных белков (ЛКБ) по методу М.Г. Шубича с бромфеноловым синим [35]. При анализе мазков подсчитывали процент положительно прореагировавших клеток и в соответствии со стандартными методиками рассчитывали средний цитохимический коэффициент (СЦК).
Таблица 2.
Иммунологические параметры крови морских свинок на 30-е сут после инфицирования Mycobacterium bovis (штамм 8)
| Показатель | Контроль | Опытные группы | ||
|---|---|---|---|---|
| 1-я группа (конъюгат антигенов БЦЖ с бетулиновой кислотой (III)) |
2-я группа (конъюгат антигенов БЦЖ с бетулоновой кислотой (II)) | 3-я группа (вакцина БЦЖ) |
||
| Лейкоциты, ×109/л | 10.78 ± 0.34 | 7.16 ± 0.21*** | 6.94 ± 0.18*** | 11.36 ± 0.63 |
| Лимфоциты, ×109/л | 7.43 ± 0.27 | 4.69 ± 0.25*** | 4.47 ± 0.27*** | 7.68 ± 1.05 |
| Нейтрофилы, ×109/л | 2.79 ± 0.13 | 2.32 ± 0.06** | 2.39 ± 0.12 | 3.21 ± 0.62 |
| Т-лимфоциты, ×109/л | 0.99 ± 0.06 | 0.87 ± 0.07 | 1.71 ± 0.23* | 2.69 ± 0.31** |
| В-лимфоциты, ×109/л | 1.06 ± 0.10 | 0.71 ± 0.08* | 0.71 ± 0.10* | 1.22 ± 0.32 |
| Цитотоксические Т-лимфоциты, ×109/л | 3.22 ± 0.47 | 1.26 ± 0.03** | 1.22 ± 0.18** | 2.24 ± 0.36 |
| НСТ-тест, спонт., ед. опт. пл. | 0.65 ± 0.03 | 0.63 ± 0.02 | 0.60 ± 0.03 | 0.60 ± 0.02 |
| НСТ-тест, стимулир., ед. опт. пл. | 0.51 ± 0.02 | 0.59 ± 0.02 | 0.56 ± 0.02 | 0.57 ± 0.02 |
| Функциональный резерв нейтрофилов, у.е. | 0.78 ± 0.05 | 0.94 ± 0.01* | 0.92 ± 0.02* | 0.94 ± 0.01* |
| СЦК ЛКБ, у.е. | 0.83 ± 0.05 | 0.99 ± 0.05 | 1.71 ± 0.18** | 1.40 ± 0.30 |
| СЦК МПО, у.е. | 0.45 ± 0.03 | 0.44 ± 0.02 | 1.04 ± 0.02*** | 0.84 ± 0.19 |
* р < 0.05. ** р < 0.01. *** р < 0.001. Обозначения: НСТ-тест – тест с нитросиним тетразолием; СЦК ЛКБ – средний цитохимический коэффициент содержания лизосомальных катионных белков, СЦК МПО – средний цитохимический коэффициент активности миелопероксидазы. Данные приведены в виде средних значений ± s.d.
Статистический анализ. Достоверность различий между группами оценивали по t-критерию Стьюдента в программе Microsoft Exсel.
ЗАКЛЮЧЕНИЕ
Введение морским свинкам препаратов на основе антигенов БЦЖ и дериватов бетулина оказывает иммуностимулирующее действие, проявляющееся в увеличении числа иммунокомпетентных клеток и усилении бактерицидной функции нейтрофильных гранулоцитов разной степени выраженности в зависимости от используемого в конъюгате производного бетулина.
Конъюгат антигенов вакцинного штамма БЦЖ с бетулоновой кислотой (II) индуцировал наиболее высокую противотуберкулезную устойчивость, сопоставимую с вакциной БЦЖ, о чем свидетельствовали выраженное увеличение в крови концентрации Т-лимфоцитов и усиление активности бактерицидных систем нейтрофилов после введения вирулентного штамма Mycobacterium bovis, а также результаты патологоанатомических исследований.
Полученный конъюгат антигенов вакцинного штамма БЦЖ с бетулоновой кислотой (II) – перспективный препарат для проведения испытаний на крупном рогатом скоте с целью профилактики туберкулеза.
Список литературы
Толстиков Г.А., Флехтер О.Б., Шульц Э.Э., Балтина Л.А., Толстиков А.Г. // Химия в интересах устойчивого развития. 2005. № 13. С. 1–30.
Pisha E., Chai H., Lee I.S., Chagweder I.E., Farnsworth N.R., Cordell G.A., Beecher C.W.W., Fong H.H.S., Kinghorn A.D., Brown D.M., Wani M.C., Wall M.E., Hieken T.J., Das Gupta T.K., Pezzuto J.M. // Nat. Med. 1995. V. 1. P. 1046–1051.
Казакова О.Б., Смирнова И.Е., Балтина Л.А., Бореко Е.И., Савинова О.В., Покровский А.Г. // Биоорг. химия. 2019. Т. 45. С. 69–74. [Kazakova O.B., Smirnova I.E., Baltina L.A., Boreko E.I., Savinova O.V., Pokrovskii A.G. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 740–744.] https://doi.org/10.1134/S1068162018050059
Казакова О.Б., Смирнова И.Е., Медведева Н.И., Лопатина Т.В., Чудов И.В., Шарипов А.Р., Зиганшин А.С., Tran Thi Phuong Thao // Биоорг. химия. 2019. Т. 45. С. 664–672. [Kazakova O.B., Smirnova I.E., Medvedeva N.I., Lopatina T.V., Chudov I.V., Sharipov A.R., Ziganshin A.S., Tran Thi Phuong Thao // Russ. J. Bioorg. Chem. 2019. V. 45. P. 558–565.] https://doi.org/10.1134/S1068162019050030
Selzer E., Thallinger C., Hoeller C., Oberkleiner P., Wacheck V., Pehamberger H., Jansen B. // Mol. Med. 2002. V. 8. P. 877–884.
Recio C.M., Giner R.M., Manez S., Gueho J., Julien H.R., Hostettmann K., Rios J.L. // Planta Med. 1995. V. 61. P. 9–12.
Fujioka T., Kashiwada Y., Kilkuskie R., Cosentino L.M., Ballas L.M., Jiang J.B., Janzen W.P., Chen I.S., Lee K.H. // J. Nat. Prod. 1994. V. 57. P. 243–247.
Kashiwada Y., Hashimoto F., Cosentino L.M., Chen C.H., Garrett P.E., Lee K.H. // J. Med. Chem. 1996. V. 39. P. 1016–1017.
Голдырев А.А., Деев Л.Е., Ситников В.А. // Аграрная наука. 2007. № 11. С. 26–28.
Щегловитова О.Н., Шуляк А.Ф., Величко Г.Н. // РВЖ СХЖ. 2007. № 1. С. 31–33.
Задорожная М.В. // Птицеводство. 2011. № 4. С. 61–62.
Задорожная М.В., Лыско С.Б., Красиков А.П. // Птица и птицепродукты. 2012. № 4. С. 43–45.
Caminiti A., Pelone F., Battisti S., Gamberale F., Colafrancesco R., Sala M., La Torre M., Della Marta U., Scaramozzino P. // Transbound. Emerg. Dis. 2017. V. 64. P. 1493–1504. https://doi.org/10.1111/tbed.12540
Ciaravino G., Ibarra P., Casal E., Pastor Lopez S., Espluga J., Casal J., Napp S., Allepuz A. // Front. Vet. Sci. 2017. V. 4. Article 202. https://doi.org/10.3389/fvets.2017.00202
Allen A.R., Skuce R.A., Byrne A.W. // Front. Vet. Sci. 2018. V. 5. Article 109. https://doi.org/10.3389/fvets.2018.00109
Mingaleev D.N., Hisamutdinov A.G., Efimova M.A., Trubkin A.I., Kamalieva J.R. // BIO Web Conf. 2020. V. 17. Article 00115. https://doi.org/10.1051/bioconf/20201700115
Parlane N.A., Buddle B.M. // Curr. Clin. Microbiol. Rep. 2015. V. 2. P. 44–53. https://doi.org/10.1007/s40588-014-0009-4
Balseiro A., Jobin T., Gortázar C., Risalde M.A. // Pathogens. 2020. V. 9. P. 472. https://doi.org/10.3390/pathogens9060472
Li J., Zhao A., Tang J., Wang G., Shi Y., Zhan L., Qin C. // Eur. J. Clin. Microbiol. Infect. Dis. 2020. V. 39. P. 1405–1425. https://doi.org/10.1007/s10096-020-03843-6
Гурвич А.Е. // Иммуносорбенты и их использование в биотехнологии. М.: АМН СССР, НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи, 1986. С. 3–22.
Бажин М.А., Шамов В.В. // Актуальные проблемы бруцеллеза и туберкулеза животных: сб. науч. тр. ВНИИБТЖ. Омск: Полиграфический центр ЧП Кухар Г.Г., 2000. С. 61–66.
Власенко В.С., Шулико Е.М., Петров С.Ю., Бажин М.А., Новиков А.Н. // Достижения науки и техники АПК. 2009. № 12. С. 47–49.
Красильников И.В., Николаева А.М., Машин В.В. // Сибирский медицинский журнал (г. Томск). 2011. Т. 26. № 2–2. С. 65–67.
Красильников И.В., Аракелов С.А., Петровский С.В. // Медицинский алфавит. 2017. Т. 1. № 8(305). С. 24–29.
Флехтер О.Б., Карачурина Л.Т., Поройков В.В., Нигматуллина Л.Р., Балтина Л.А., Зарудий Ф.С., Давыдова В.А., Спирихин Л.В., Байкова И.П., Галин Ф.З., Толстиков Г.А. // Биоорг. химия, 2000. Т. 26. С. 215–223. [Flekhter O.B., Karachurina L.T., Nigmatullina L.P., Baltina L.A., Zarudii F.S., Davydova V.A., Spirikhin L.V., Baikova I.P., Galin F.Z., Tolstikov G.A., Poroikov V.V. // Russ. J. Bioorg. Chem. 2000. V. 26. P. 192–200.] https://doi.org/10.1007/BF02786345
Barthel A., Stark S., Csuk R.// Tetrahedron. 2008. V. 64. P. 9225–9229.
Флехтер О.Б., Бореко Е.И., Нигматуллина Л.Р., Павлова Н.И., Николаева С.Н., Савинова О.В., Еремин В.Ф., Балтина Л.А., Галин Ф.З., Толстиков Г.А. // Биоорг. химия. 2003. Т. 29. С. 326–332. [Flekhter O.B., Boreko E.I., Nigmatullina L.R., Pavlova N.I., Nikolae-va S.N., Savinova O.V., Eremin V.F., Baltina L.A., Galin F.Z., Tolstikov G.A. // Russ. J. Bioorg. Chem. 2003. V. 29. P. 296–302.] https://doi.org/10.1023/A:1023948919315
Флехтер О.Б., Нигматуллина Л.Р., Балтина Л.А., Карачурина Л.Т., Галин Ф.З., Зарудий Ф.С., Толсти-ков Г.А., Бореко Е.И., Павлова Н.И., Николаева С.Н., Савинова О.В. // Хим.-фарм. журн. 2002. Т. 36. № 9. С. 26–28.
Когай Т.И. // Журнал Сибирского федерального университета. Химия. 2008. № 1. P. 97–104.
Гельберг С.И., Финкель Е.А. // Проблемы туберкулеза. 1959. № 2. С. 80–84.
Тогунова А.И., Лещинская Е.Н. // Бюл. ин-та туберкулеза АМН СССР. 1951. № 1. С. 27–33.
Бажин М.А., Власенко В.С., Новиков А.Н., Пацу-ла Ю.И. // Дискретно-динамический анализ в оценке иммунитета: методические рекомендации. СО РАСХН. Омск, 2005. 24 с.
Власенко В.С., Донченко Н.А., Пацула Ю.И., Бажин М.А., Иванов А.И., Морозова О.В., Дудоладова Т.С. // Методы оценки функциональной активности лейкоцитов при туберкулезе и лейкозе животных (методическое пособие). Омск, 2015. 16 с.
Hrycek A. // Follia Biol. (Praha). 1993. V. 39. № 6. P. 304–310.
Шубич М.Г. // Цитология. 1974. Т. 16. № 10. С. 1321–1322.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия