Биоорганическая химия, 2021, T. 47, № 5, стр. 603-609
Получение и характеристика генетически кодируемых флуоресцентных сенсоров внеклеточного рН
А. Н. Орса 1, 2, *, А. С. Горященко 1, 2, О. В. Серова 1, 2, А. А. Можаев 1, 2, В. И. Мартынов 1, А. А. Пахомов 1, Е. В. Свирщевская 1, А. Г. Петренко 1, И. Е. Деев 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Научно-технологический университет “Сириус”
354340 Сочи, Олимпийский просп., 1, Россия
* E-mail: Saniaorsa@gmail.com
Поступила в редакцию 29.09.2020
После доработки 02.11.2020
Принята к публикации 05.11.2020
Аннотация
Флуоресцентные белки в последнее время стали неотъемлемым инструментом для прижизненной визуализации различных процессов, протекающих в живых системах, начиная от отдельных органелл и заканчивая целыми организмами. Они позволяют наблюдать экспрессию белков, их локализацию, а также осуществлять мониторинг биохимических процессов в клетках. Как правило, флуоресцентные белки имеют рН-зависимые спектральные свойства, что позволяет конструировать на их основе генетически кодируемые рН-сенсоры для решения различных биологических задач. В данной работе мы получили набор сенсоров внеклеточного рН на основе флуоресцентного белка SypHer3S, имеющего рН-чувствительность в диапазоне значений рН от 7.4 до 9.0. Для этого были созданы конструкции, кодирующие химерные белки SypHer3S с различными трансмембранными доменами мембранных рецепторов, позволяющих направлять данный белок на внешнюю сторону цитоплазматической мембраны. Охарактеризована локализация этих химерных белков внутри клетки и подобран наиболее подходящий вариант химерного рН-сенсора для измерения внеклеточного слабощелочного рН.
ВВЕДЕНИЕ
Поддержание гомеостаза (постоянства внутренней среды, в том числе значения рН) имеет жизненно важное значение для организма. Принято считать, что рН крови и внеклеточной среды организма должен быть близким к нейтральным величинам. Значение рН крови в организме должно поддерживаться в достаточно узком диапазоне, а отклонение рН в щелочную или кислую сторону влечет за собой сильные нарушения, что приводит к возникновению различных заболеваний [1, 2]. В то же время в рамках целостного организма выведение части кислот или оснований в малом объеме невозможно без экстремальных изменений рН выводимых экстракорпоральных жидкостей, в частности почечного фильтрата.
Ранее мы показали, что существует несколько рецепторных тирозинкиназ, которые могут активироваться внеклеточной слабощелочной средой. Это рецептор, подобный рецептору инсулина (IRR) [3], рецепторы ERBB2 [4] и c-Met [5]. Наиболее изученный нами рецептор IRR экспрессируется в отдельных клеточных популяциях почек, желудка и поджелудочной железы, где может контактировать с внеклеточными жидкостями со щелочным рН [3, 6]. Также показано, что нокаутные по рецептору IRR мыши имеют отклонения в социальном поведении, а при экспериментальном алкалозе у таких мышей наблюдаются дефекты почечной функции [7, 8].
Поскольку на сегодняшний день нет достоверной информации о распределении внеклеточного рН в различных органах (почки, поджелудочная железа и др.), актуальна разработка генетически кодируемых рН-сенсоров для определения внеклеточного рН, которые в дальнейшем могут применяться в животных моделях.
Цель настоящей работы – получение сенсора внеклеточного слабощелочного рН на основе флуоресцентного белка SypHer3S [9].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Флуоресцентный белок SypHer3S – версия белка SypHer, представляющего собой сенсор перекиси водорода HyPer с мутацией C199S, которая делает белок нечувствительным к перекиси водорода, но сохраняет рН-чувствительность хромофора [9]. Данный белок имеет два максимума возбуждения при 410 и 495 нм и один пик эмиссии при 525 нм [10]. В нашей работе использовались максимально близкие (к оптимальным) параметры измерений из доступных, а именно длины волн возбуждения 408 и 488 нм и регистрация флуоресценции на 515 нм.
Для получения сенсора внеклеточного рН мы разработали пять химерных конструкций, которые кодируют флуоресцентный белок SypHer3S с лидерным пептидом и трансмембранным участком от мембранного рецептора (рис. 1).
Рис. 1.
Схема конструкций, кодирующих химерные белки на основе флуоресцентного белка SypHer3s с лидерным пептидом κ-цепи Ig и трансмембранными доменами различных мембранных рецепторов.

Сначала были созданы четыре конструкции, кодирующие трансмембранные домены от различных рецепторов: рецептора инсулина (IR) [11, 12], тропомиозин-рецепторной киназы A (TrkA) [13], рецептора фактора роста эпидермиса 2 (ErbB2) [14] и латрофилина 2 (CIRL2) [15]. Полученные конструкции экспрессировали в клетках HEK293. С помощью конфокальной микроскопии было показано, что большая часть сенсора локализована в примембранной области (т.е. внутри клетки), а не на внешней стороне клеточной мембраны (рис. 2а–2г). Таким образом, эти химерные белки не могут быть использованы в качестве сенсора внеклеточного рН.
Рис. 2.
Флуоресцентные изображения клеток линии НЕК293, экспрессирующих следующие химерные белки: (а) – SypHer3s с трансмембранным доменом рецептора инсулина (IR); (б) – SypHer3s с трансмембранным доменом тропомиозин-рецепторной киназы A (TrkA); (в) – SypHer3s с трансмембранным доменом рецептора фактора роста эпидермиса 2 (ErbB2); (г) – SypHer3s с трансмембранным доменом рецептора латрофилина (СIRL2); (д) – SypHer3s с трансмембранным доменом рецептора фактора роста тромбоцитов (PDGFR).
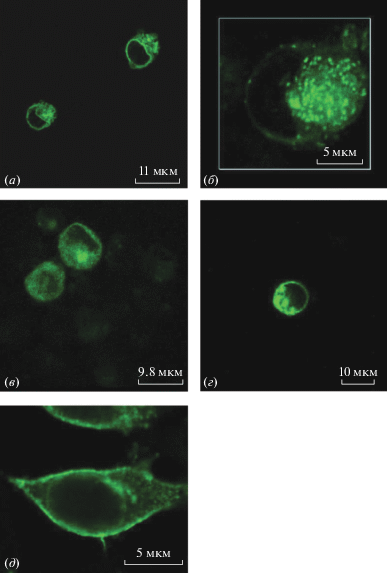
Далее мы получили химерную конструкцию на основе коммерчески доступного вектора pDisplay для эукариотической экспрессии, предназначенного для локализации целевых белков на внеклеточной поверхности цитоплазматической мембраны. Данный вектор имеет в своем составе гены лидерной последовательности и трансмембранного домена рецептора фактора роста тромбоцитов (PDGFR), обеспечивающие необходимую локализацию белка [16]. Кодирующая последовательность белка SypHer3S была клонирована в данный вектор; полученной конструкцией, названной pDisplay-SpH3, трансфицировали клетки линии HEK293. При помощи конфокальной микроскопии было показано, что химерный белок, представляющий собой SypHer3S с трансмембранным доменом рецептора PDGFR, локализован на клеточной мембране (рис. 2д).
Для проверки рН-чувствительности полученного химерного белка клетки, трансфицированные вектором pDisplay-SpH3, фиксировали с помощью среды Mounting media с добавлением до конечной концентрации 100 мM Tris-HCl с рН 7.4, 8.2 и 8.8 (рис. 3а). Сначала анализировали флуоресценцию химерного белка при возбуждении лазером 408 нм. Затем получали изображение при возбуждении лазером 488 нм. Полученные данные обрабатывали в программе ImageJ и из каждой картинки высчитывали средний уровень фона, который принимали за минимальное значение. Далее рассчитывали отношение интенсивностей при возбуждении 488 нм к 408 нм вдоль отмеченных линий при указанных рН c последующей нормализацией в программе Origin. Полученный график (рис. 3б) показал изменение соотношения флуоресценции на мембране с возрастанием рН от 7.4 до 8.8. Таким образом, химерный белок, представляющий собой SypHer3S с трансмембранным доменом рецептора фактора роста тромбоцитов (PDGFR), выступает пригодным для использования в качестве флуоресцентного сенсора внеклеточного слабощелочного рН.
Рис. 3.
(а) – Псевдоцветные изображения клеток линии HEK293, экспрессирующих SypHer3s с трансмембранным доменом рецептора PDGFR. Цвет характеризует величину отношения интенсивностей 488/408 нм для различных рН; (б) – профили распределения отношения интенсивностей 488/408 нм вдоль указанных на рис. 3а линий при различных внеклеточных рН.

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение плазмидных конструкций, кодирующих флуоресцентные рН-сенсоры. Для получения плазмид, кодирующих флуоресцентные рН-сенсоры, использовали вектор pSeсTag B (Invitrogen, США), в который клонировали ген белка SypHer3S [9], используя праймеры Sh3_Bam_fw и RI_Sh2_rev, представленные в табл. 1. Клонирование проводили по сайтам рестрикции BamHI и EcoRI. Далее в эту конструкцию клонировали нуклеотидную последовательность трансмембранного домена с кДНК рецептора инсулина с помощью ПЦР и праймеров из табл. 1 по сайтам рестрикции EcoRI и XhoI. Полученная конструкция была названа pST-SpH3-TM-IR. Аналогичным образом были получены конструкции с нуклеотидными последовательностями трансмембранных доменов тропомиозин-рецепторной киназы A (TrkA), рецептора фактора роста эпидермиса 2 (HER2) и латрофилина 2 (CIRL2). Для этого использовали праймеры Trk_TM_fw_RI и Trk_TM_rev_Xho, Her2_TM_fw_RI и Her2_TM_rev_ Xho, Cl2_TM_fw и Cl2_TM_rev соответственно. Для получения конструкции на основе вектора pDisplay проводили ПЦР с вектора pcDNA-SypHer3s (вектор предоставлен В.В. Белоусовым, ИБХ РАН) с использованием праймеров SH3_Bgl_fw и SH3_Sal_rev, затем полученный ПЦР-фрагмент клонировали в вектор pDisplay (Invitrogen, США) по сайтам рестрикции BglII и SalI.
Таблица 1.
Праймеры, используемые для получения конструкций, кодирующих химерные белки на основе флуоресцентного белка SypHer3S
| Название конструкции | Трансмембранный домен | Праймеры | Последовательность |
|---|---|---|---|
| pST-SpH3 | – | Sh3_Bam_fw RI_Sh2_rev | 5'-AAAGGATCCATGTCCGGACCGCTGCACATT-3' 5'-TTTGAATTCCGCTAACCGCCTGT-TTTAAAACTTTATC-3' |
| pST-SpH3-TM-IR | Рецептор инсулина | tm_RI_fw Xho_tm_rev |
5'-AAAGAATTCAAGACTATTTAGACGT-CCCGTCAAATA-3' 5'-AAACTCGAGCTTTCTCAGGAATAG-ATAAATAC-3' |
| pST-SpH3-TM-TrkA | Тропомиозин-рецепторная киназа A | Trk_TM_fw_RI Trk_TM_rev_Xho |
5'-AAAGAATTCAAATGGACAACCCTT-TCGAGTTC-3' 5'-AAACTCGAGGATCCCAAACTTGTT-TCTCCGT-3' |
| pST-SpH3-TM-ERBB2 | Рецептор эпидермального фактора роста 2 | Her2_TM_fw_RI Her2_TM_rev_Xho |
5'-AAAGAATTCAACTCTCCTACATGCCCATCTG-3' 5'-AAACTCGAGCTTCCGGATCTTCTGCTGCCG-3' |
| pST-SpH3-TM-CIRL2 | Латрофилин 2 | Cl2_TM_fw Cl2_TM_rev |
5'-AAAGAATTCAAGGCGGCTTGCTG-CTGACAGTCATCACC-3' 5'-TTTCTCGAGTTTCCGTACTTTCTT-TTGAAGAGC-3' |
| pDisplay-SpH3 | Рецептор фактора роста тромбоцитов | SH3_Bgl_fw SH3_Sal_rev |
5'-AAAAGATCTATGTCCGGACCGCTGCACATT-3' 5'-AAAGTCGACAACCGCCTGTTTTAA-AACTTTATC-3' |
Иммуноцитохимия и конфокальная микроскопия. Клетки линии HEK293 выращивали в среде DMEM (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (Hyclone, США), 1% пенициллин/стрептомицина и 2 мМ L-глутамина. Трансфекцию клеток НЕК293 полученными конструкциями проводили согласно протоколу [17].
Для анализа субклеточного распределения экспрессированных белков использовали иммунофлуоресценцию. Клетки HEK293 перед трансфекцией рассевали на покровные стекла, помещенные в планшет и обработанные поли-L-лизином (Sigma, США). Через два дня после трансфекции среду DMEM отбирали, клетки дважды промывали раствором PBS и фиксировали раствором (50% ацетона, 50% метанола) при ‒20°С в течение 20 мин. Затем клетки окрашивали первичными антителами. В качестве антител к белку SypHer3S использовали антитела Anti-tRFP (Евроген, Россия), в качестве вторичных антител – антитела Anti Rabbit IgG, конъюгированные с Cy3 (Merck, США).
Также в качестве дополнительного контроля использовали мембранный трекер Wheat Germ Agglutinin, Alexa Fluor™ 594 Conjugate (Thermo Fisher, США). Мембранный трекер добавляли к трансфицированным клеткам в концентрации 25 мкг/мл и инкубировали в течение 10 мин в питательной среде DMEM, содержащей 10% FBS, затем клетки фиксировали. Покровные стекла помещали на предметное стекло и фиксировали средой Mounting Media (Dako, Дания) с добавлением 100 мМ буфера с заданным рН.
Для получения флуоресцентных изображений клеток линии НЕК293, экспрессирующих химерный белок SypHer3s с трансмембранным доменом рецептора инсулина (IR), тропомиозин-рецепторной киназы A (TrkA), рецептора фактора роста эпидермиса 2 (ErbB2), латрофилина 2 (CIRL2) и рецептора фактора роста тромбоцитов (PDGFR), клетки высаживали на флуоресцентные чашки FluoroDish Cell Culture Dish (35 мм) (Thermo Fisher, США) с 3 мл питательной среды DMEM, содержащей 10% FBS, после чего проводили трансфекцию векторами, кодирующими данные конструкции, согласно протоколу [3, 10]. После трансфекции питательную среду отбирали, клетки промывали раствором PBS, затем добавляли питательную среду F-12 (ПанЭко, Россия) без сыворотки FBS, содержащую 50 мМ Tris-HCl-буфера (pH 8.0).
Флуоресцентные изображения клеток получали на конфокальном микроскопе Eclipse TE2000-E (Nikon, Япония) с использованием 60× объектива с масляной иммерсией. Для проверки трансмембранной локализации конструкций в качестве источника возбуждения флуоресценции использовали лазер 488 нм, фильтр эмиссии 515/10 нм. Были получены флуоресцентные изображения клеток с разрешением 512 × 512 пикселей. Для исследования рН-чувствительности данного сенсора клетки фиксировали средой Mounting Media, содержащей 100 мМ буфера с заданным рН, и получали снимки при возбуждении лазером 408 нм и фильтром 515/10 нм в канале детекции. Затем получали изображение при возбуждении лазером 488 нм и фильтром 515/10 нм в канале детекции.
Обработку микрофотографий проводили в программе ImageJ (imagej.nih.gov/ij/). Изображения экспортировали в текстовый документ, где каждому пикселю соответствовала интенсивность флуоресценции. Для каждой картинки рассчитывали средний уровень фоновой флуоресценции, который принимали за минимальное значение интенсивности сигнала. Далее рассчитывали отношение интенсивностей сигнала при возбуждении 488 и 408 нм. Получали текстовый файл (где интенсивности сигнала для каждого пикселя соответствовало рассчитанное отношение), который затем обратно в программе преобразовывали в изображение. Для оценки изменения аналитического сигнала сенсора (отношение флуоресценции при возбуждении на 488 и 408 нм) при варьировании рН через клетку проводили линию и строили профиль изменения сигнала вдоль этой линии.
ЗАКЛЮЧЕНИЕ
Получен набор сенсоров внеклеточного рН на основе флуоресцентного белка SypHer3S с различными трансмембранными доменами мембранных белков, позволяющих направлять данный белок на внешнюю сторону цитоплазматической мембраны. Была охарактеризована их локализация при экспрессии в эукариотических клетках и подобран наиболее успешный вариант химерного рН‑сенсора для измерения внеклеточного слабощелочного рН.
Список литературы
Chesler M. // Physiol Rev. 2003. V. 83. P. 1183–1221. https://doi.org/10.1152/physrev.00010.2003
Серова О.В., Ганцова Е.А., Деев И.Е., Петренко А.Г. // Биоорг. химия. 2020. Т. 46. С. 369–384. [Serova O.V., Gantsova E.A., Deyev I.E., Petrenko A.G. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 506–519.] https://doi.org/10.1134/S1068162020040196
Deyev I.E., Sohet F., Vassilenko K.P., Serova O.V., Popova N.V., Zozulya S.A., Burova E.B., Houillier P., Rzhevsky D.I., Berchatova A.A., Murashev A.N., Chugunov A.O., Efremov R.G., Nikol’sky N.N., Bertelli E., Eladari D., Petrenko A.G. // Cell Metab. 2011. V. 13. P. 679–689. https://doi.org/10.1016/j.cmet.2011.03.022
Serova O.V., Chachina N.A., Gantsova E.A., Popova N.V., Petrenko A.G., Deyev I.E. // Int. J. Mol. Sci. 2019. V. 20. P. 1515. https://doi.org/10.3390/ijms20061515
Serova O.V., Orsa A.N., Chachina N.A., Petrenko A.G., Deyev I.E. // J. Rec. Sign. Trans. Res. 2019. V. 39. P. 67–72. https://doi.org/10.1080/10799893.2019.1620775
Petrenko A.G., Zozulya S.A., Deyev I.E., Eladari D. // Biochim. Biophys. Acta. 2013. V. 1834. P. 2170–2175. https://doi.org/10.1016/j.bbapap.2012.11.011
Зубков Е.А., Морозова А.Ю., Чачина Н.А., Шаяхметова Д.М., Можаев А.А., Деев И.Е., Чехонин В.П., Петренко А.Г. // Журнал высшей нервной деятельности им. И.П. Павлова. 2017. Т. 67. С. 106–112.
Шаяхметова Д.М., Жевленев Е.С., Можаев А.А., Деев И.Е., Петренко А.Г. // Биоорг. химия. 2016. Т. 42. С. 496–500. [Shayahmetova D.M., Zhevlenev E.S., Mozhaev A.A., Deyev I.E., Petrenko A.G. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 449–452.] https://doi.org/10.1134/S1068162016040166
Ermakova Y.G., Pak V.V., Bogdanova Y.A., Kotlobay A.A., Yampolsky I.V., Shokhina A.G., Panova A.S., Marygin R.A., Staroverov D.B., Bilan D.S., Sies H., Belousov V.V. // Chem. Comm. (Camb). 2018. V. 54. P. 2898–2901. https://doi.org/10.1039/c7cc08740c
Martynov V.I., Pakhomov A.A., Deyev I.E., Petrenko A.G. // Biochim. Biophys. Acta Gen. Subj. 2018. V. 1862. P. 2924–2939. https://doi.org/10.1016/j.bbagen.2018.09.013
Menting J.G., Whittaker J., Margetts M.B., Whittaker L.J., Kong G.K.W., Smith B.J., Watson C.J., Zakova L., Kletvikova E., Jiracek J., Chan S.J., Steiner D.F., Dodson G.G., Brzozowski A.M., Weiss M.A., Ward C.W., Lawrence M.C. // Nature. 2013. V. 493. P. 241–245. https://doi.org/10.1038/nature11781
Belfiore A., Frasca F., Pandini G., Sciacca L., Vigneri R. // Endocr. Rev. 2009. V. 30. P. 586–623. https://doi.org/10.1210/er.2008-0047
Benito-Gutierrez E., Garcia-Fernandez J., Comella J.X. // Mol. Cell Neurosci. 2006. V. 31. P. 179–192. https://doi.org/10.1016/j.mcn.2005.09.007
Olayioye M.A. // Breast Cancer Res. 2001. V. 3. P. 385–389. https://doi.org/10.1186/bcr327
Sudhof T.C. // Ann. Rev. Neurosci. 2001. V. 24. P. 933–962. https://doi.org/10.1146/annurev.neuro.24.1.933
Ali M.M., Kang D.K., Tsang K., Fu M., Karp J.M., Zhao W. // Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 2012. V. 4. P. 547–561. https://doi.org/10.1002/wnan.1179
Deyev I.E., Mitrofanova A.V., Zhevlenev E.S., Radionov N., Berchatova A.A., Popova N.V., Serova O.V., Petrenko A.G. // J. Biol. Chem. 2013. V. 288. P. 33884–33893. https://doi.org/10.1074/jbc.M113.483172
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


