Биоорганическая химия, 2021, T. 47, № 5, стр. 593-602
Моделирование регуляции уровня простагландинов нестероидными противовоспалительными препаратами в открытых системах
А. В. Кривошей 1, 2, А. А. Ефремов 2, Е. К. Матвейшина 2, 3, В. В. Панова 2, П. В. Вржещ 1, 2, *
1 ФГБОУ ВО МГУ имени М.В. Ломоносова, Международный учебно-научный биотехнологический центр
119991 Москва, Ленинские горы, 1, Россия
2 **ФГБОУ ВО МГУ имени М.В. Ломоносова, факультет биоинженерии и биоинформатики
119991 Москва, Ленинские горы, 1, Россия
3 ФИЦ Биотехнологии РАН, Институт биоинженерии
119071 Москва, Ленинский просп., 33/2, Россия
* E-mail: biocentr@list.ru
Поступила в редакцию 25.03.2021
После доработки 31.03.2021
Принята к публикации 02.04.2021
Аннотация
Проведено моделирование влияния ингибиторов (нестероидные противовоспалительные препараты) на поток и уровень простагландинов в открытых системах, включающих постоянный приток фермента (простагландин-H-синтаза, PGHS), инактивацию фермента в ходе катализируемой им реакции, деградацию фермента, превращение биологически активного продукта ферментативной реакции (простагландин, PG) в неактивные соединения, различные режимы подачи субстрата (арахидоновая кислота, AA) и ингибиторов. В качестве ингибиторов рассматривали медленный обратимый ингибитор (индометацин) и медленный необратимый ингибитор (аспирин). Получены аналитические выражения для потоков и концентраций в нестационарном режиме и стационарном состоянии. Показано, что в стационарных состояниях системы зависимость потока PG и уровня PG описывается уравнением Михаэлиса–Ментен. Максимальный поток, максимальный уровень и величина наблюдаемой константы Михаэлиса зависят обратно пропорционально от константы скорости инактивации фермента в процессе реакции. Медленные ингибиторы PGHS в традиционных экспериментах в закрытых системах ведут себя как неконкурентные по отношению к AA, однако в стационарных потоках их поведение становится полностью конкурентным, поэтому присутствие ингибитора увеличивает амплитуду изменений уровня PG при изменении концентрации АА. Показано, что обратимый ингибитор (индометацин), в отличие от необратимого ингибитора (аспирин), в потоке проявляет себя как депо для активного фермента за счет образования фермент-ингибиторных комплексов. Возмущение системы при резком повышении концентрации индометацина приводит к двухфазному изменению уровня PG: после первоначального резкого снижения он постепенно повышается до нового стационарного состояния. Возмущение системы в присутствии индометацина при резком повышении концентрации AA приводит к высвобождению фермента из фермент-ингибиторных комплексов, и уровень PG на определенный период существенно увеличивается по сравнению с контролем в отсутствие ингибитора. Результаты моделирования регуляции уровня простагландинов в различных состояниях открытой системы, несомненно, необходимо использовать при исследовании действия нестероидных противовоспалительных препаратов in vivo.
ВВЕДЕНИЕ
Простагландины – группа физиологически активных веществ липидной природы. Они регулируют важнейшие физиологические процессы в организме млекопитающих, в частности выступают медиаторами воспаления [1]. Ключевую роль в регуляции уровня простагландинов играет фермент простагландин-H-синтаза (PGHS; К.Ф. 1.14.99.1), известный также как циклооксигеназа (COX). Фермент катализирует две последовательные реакции – циклооксигеназную (окисление арахидоновой кислоты (AA) кислородом до простагландина G2 [2]) и пероксидазную (восстановление перекисной группы простагландина G2 до спиртовой в присутствии донора электронов [3]). В результате образуется простагландин Н2 [4], который далее под действием специфических ферментов – конвертаз – превращается в другие физиологически активные соединения, такие как простагландины E2, D2, F2α, тромбоксан A2 и простациклин [5–7]. PGHS характеризуется быстрой инактивацией в процессе катализируемых реакций [8–12]. Существуют различные изоформы фермента: PGHS-1 постоянно нарабатывается в клетках и способствует их нормальному функционированию [13], PGHS-2 синтезируется в ответ на определенные стимулы, такие как цитокины или факторы роста [14]. Действие нестероидных противовоспалительных препаратов (НПВП), широко используемых в медицине, направлено на ингибирование PGHS [15–17].
Традиционные эксперименты in vitro по исследованию свойств ферментов проводятся в закрытых системах, не предполагающих приток фермента, субстратов и других участников реакции. Однако организм представляет собой открытую систему, где происходят синтез и деградация фермента, а приток субстрата может регулироваться различными внешними по отношению к ферменту факторами. Кинетические характеристики закрытых систем могут совершенно не соответствовать кинетическому поведению открытых систем и, соответственно, систем in vivo. Тем не менее встречается очень мало исследований ферментов в открытых системах. В работе Gabrielsson et al. [18] рассматривается теоретическая модель, учитывающая факторы синтеза и деградации фермента, а также притока субстрата. В работе Westley et al. [19] исследовали различные типы ингибирования с учетом постоянного притока субстрата. Кинетическое поведение ферментов, подвергающихся инактивации в процессе реакции и действию медленных ингибиторов, до настоящего времени в открытых системах исследовано не было.
Цель настоящего исследования – моделирование кинетического поведения участка синтеза простагландинов в открытой системе при наличии ингибиторов индометацина и аспирина.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние ингибиторов на поток образования и уровень простагландина в открытых системах, содержащих фермент PGHS, представляется целесообразным описать в рамках кинетического механизма, представленного на схеме 1 .
Схема 1 . Общая схема преобразования фермента и продукта реакции в открытой системе. E – свободный фермент (PGHS); ES – комплекс фермента с субстратом (S – арахидоновая кислота, AA); EI и E*I – комплексы фермента с ингибитором (I); E** – инактивированная форма фермента; VE – скорость синтеза (притока) фермента; k1, k–1 – константы скорости образования и диссоциации комплекса ES соответственно; k2 – константа скорости образования продукта реакции; Ki – константа ингибирования для быстрой обратимой стадии взаимодействия фермента с ингибитором; k+ и k– – константы скорости для медленной стадии ингибирования; kP – константа преобразования физиологически активного продукта (P) в неактивные соединения (P*); λ – константа скорости инактивации фермент-субстратного комплекса в процессе реакции; kd – константа скорости деградации фермента (принимаем, что это значение одинаково для всех форм фермента).
Схема предполагает постоянный приток активного фермента и его деградацию, инактивацию фермента в процессе реакции, превращение физиологически активного продукта в неактивные соединения и присутствие ингибитора, работающего по двухстадийному механизму. Полагаем, что концентрация субстрата регулируется внешними по отношению к исследуемой системе факторами, и в первом приближении концентрации субстрата и ингибитора считаем постоянными за время наблюдения (за исключением оговоренных случаев резкого изменения концентрации субстрата или ингибитора).
В механизме реакции присутствуют как быстрые стадии (в ходе измерения или моделирования мы наблюдаем только конечный результат взаимодействия, а не динамику процесса во времени), так и медленные стадии (можно наблюдать динамику процесса во времени). К быстрым стадиям относятся взаимодействие фермента с субстратом и первая стадия взаимодействия с ингибитором, а к медленным стадиям – преобразование продукта, вторая стадия взаимодействия фермента с ингибитором, синтез (приток) фермента, деградация фермента и инактивация фермента в процессе реакции.
Основные характеристики и механизмы действия фермента и ингибиторов получены из традиционных кинетических экспериментов в закрытых системах.
Быстрая инактивация фермент-субстратного комплекса (ES) в процессе реакции приводит к тому, что ферментативное превращение арахидоновой кислоты (S) в продукты ферментативной реакции (P) в условиях малого расходования субстрата в стационарном режиме в закрытых системах описывается следующим уравнением (см. работу Vrzheshch et al. [8]):
где [S]0 – начальная концентрация субстрата, t – время протекания реакции, [S](t) – текущая концентрация субстрата в момент времени t, [P]∞ – предельный выход продукта реакции (сумма концентраций P и продуктов его дальнейших превращений после полной инактивации фермента), Λ = kd + + λ[S]/(Km + [S]) – наблюдаемая константа скорости инактивации фермента в процессе реакции, kd – константа скорости деградации фермента, Km – константа Михаэлиса для реакции ферментативного превращения арахидоновой кислоты.Линейная зависимость начальной скорости (V0) ферментативной реакции и предельного выхода продукта реакции от общей концентрации фермента в закрытых системах позволяет получить число оборотов фермента до полной его инактивации – π∞ (количество молекул продукта на одну молекулу фермента за время его работы до полной инактивации в процессе реакции, безразмерная величина):
где [E]0 – общая концентрация фермента, добавляемого в реакционную систему.В нашем случае с учетом [P]∞ = V0/Λ (см. работу Vrzheshch et al. [8]) и михаэлисовой зависимости V0 от [S] (V0 = k2E0[S]/(Km + S)) получим:
(3)
${{\pi }_{\infty }} = \frac{{{{k}_{2}}}}{{\lambda + {{k}_{{\text{d}}}}\left( {1 + \frac{{{{K}_{{\text{m}}}}}}{{[S]}}} \right)}}$ .Учитывая, что время наблюдения за реакцией в закрытой системе обычно лежит в пределах нескольких минут, и что эксперименты обычно проводятся при [S] ~ Km, фактором деградации фермента можно пренебречь, и формула (3) упрощается:
что позволило нам определить из экспериментов в закрытых системах (см. “Эксперим. часть”) необходимые для моделирования в открытой системе значения Km (6.35 мкМ), k2 (60 с–1), λ (0.084 с–1) и π∞ (714).Наши кинетические эксперименты по ингибированию PGHS индометацином в закрытой системе (см. “Эксперим. часть”) подтвердили двухстадийную модель взаимодействия этого ингибитора с ферментом, в которой быстрая и медленная стадии полностью обратимы. Получены значения констант ингибирования для быстрой стадии (Ki = 27.7 мкМ) и констант скорости для медленной стадии (k+ = 1.83 с–1, k– = 1.71 × 10–3 с–1).
В настоящей работе также моделировали действие необратимого ингибитора аспирина. Его характеристики, определенные в закрытых системах, взяли из работы Liu et al. [20]: константу ингибирования для быстрой обратимой стадии (Ki = = 4200 мкМ) и константу скорости для медленной необратимой стадии (k+ = 0.0135 с–1) при 20°C.
Для моделирования также использовали значения констант скорости первого порядка для процессов деградации фермента (kd = 6.95 × 10–5 с–1) и распада физиологически активного продукта (kP = 2.31 × 10–3 с–1). Эти характеристики были оценены с учетом времени полужизни глутаматдекарбоксилазы in vivo (2.77 ч [21] – наиболее “короткоживущий” фермент из представленных в работах [21–27]) и времени полужизни простагландинов G2 и H2 (~5 мин, [28]).
Моделирование открытой системы (схема 1 ) осуществляли путем аналитического решения соответствующих систем дифференциальных уравнений (см. дополнительные материалы к публикации).
Указанная система всегда стремится к единственному устойчивому стационарному состоянию. Достигшая стационарного состояния система в результате возмущения (изменения концентрации субстрата или ингибитора) переходит в нестационарное (переходное) состояние, и со временем (при указанных характеристиках это часы – рис. 1–3) система всегда приближается к новому стационарному состоянию.
Рис. 1.
Влияние изменения концентрации ингибитора на относительный уровень продукта реакции (Prel) в открытой системе. Концентрация арахидоновой кислоты – 0.01 мкМ (а) и 10 мкМ (б). В момент времени t = 0 концентрация индометацина увеличилась с 0 до 2 мкМ (1), с 0 до 20 мкМ (2); концентрация аспирина увеличилась с 0 до 10 мкМ (3), с 0 до 100 мкМ (4). За единицу принят уровень продукта реакции до возмущения системы.
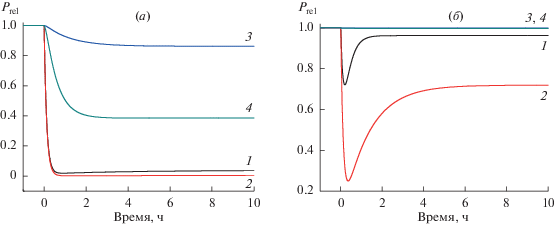
Рис. 2.
Влияние изменения концентрации субстрата на относительный уровень продукта реакции (Prel) в открытой системе – эффект индометацина (а) и аспирина (б). Начальная концентрация арахидоновой кислоты – 0.01 мкМ, а в момент времени t = 0 она увеличилась до 10 мкМ. Концентрация индометацина равна 0 мкМ (1), 2 мкМ (2), 20 мкМ (3); концентрация аспирина – 0 мкМ (1), 10 мкМ (2), 100 мкМ (3). За единицу принят максимальный стационарный уровень продукта реакции (формулы (7), (8)) (при [S] → ∞ и в отсутствие ингибитора).

Рис. 3.
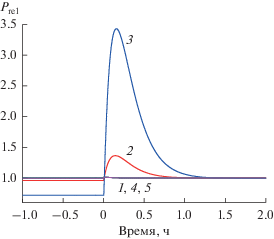
Влияние изменения концентрации субстрата на относительный уровень продукта реакции (Prel) в открытой системе. Начальная концентрация арахидоновой кислоты – 10 мкМ, в момент времени t = 0 она увеличилась до 500 мкМ. Концентрация индометацина – 0 мкМ (1), 2 мкМ (2), 20 мкМ (3); концентрация аспирина – 0 мкМ (1), 10 мкМ (4), 100 мкМ (5). За единицу принят максимальный стационарный уровень продукта реакции (формулы (7), (8)) (при [S] → ∞ и в отсутствие ингибитора).
В стационарном состоянии поток продукта реакции (скорость накопления продукта реакции (Vst)) оказался прямо пропорциональным потоку фермента (скорости синтеза фермента, VE) с коэффициентом пропорциональности π∞, который определен в формуле (2):
В присутствии медленного ингибитора, действующего по двухстадийному механизму (схема 1 ), π∞ определяется следующим выражением:
(6)
${{\pi }_{\infty }} = \,\,\frac{{{{k}_{2}}}}{{\lambda + {{k}_{{\text{d}}}}\left( {1 + \frac{{{{K}_{{\text{m}}}}}}{{[S]}} + \frac{{{{K}_{{\text{m}}}}}}{{[S]}}\frac{{[I]}}{{{{K}_{{\text{i}}}}}}} \right) + \frac{{{{k}_{ + }}{{k}_{{\text{d}}}}}}{{{{k}_{ - }} + {{k}_{{\text{d}}}}}}\frac{{{{K}_{{\text{m}}}}}}{{[S]}}\frac{{[I]}}{{{{K}_{{\text{i}}}}}}}}.$Зависимость стационарного потока от концентрации субстрата принимает форму уравнения Михаэлиса–Ментен:
(7)
$\begin{gathered} {{V}_{{{\text{st}}}}} = \frac{{V_{{\max }}^{*}[S]}}{{K_{{\text{m}}}^{*}\left( {1 + \frac{{[I]}}{{K_{{\text{i}}}^{*}}}} \right) + [S]}},\,\,\,\,V_{{\max }}^{*} = \frac{{{{k}_{2}}{{V}_{{\text{E}}}}}}{{\lambda + {{k}_{{\text{d}}}}}}, \\ K_{{\text{m}}}^{*} = {{K}_{{\text{m}}}}\frac{{{{k}_{{\text{d}}}}}}{{\lambda + {{k}_{{\text{d}}}}}},\,\,\,\,K_{{\text{i}}}^{*} = {{K}_{{\text{i}}}}\frac{{{{k}_{ - }} + {{k}_{{\text{d}}}}}}{{{{k}_{ + }} + {{k}_{ - }} + {{k}_{{\text{d}}}}}}, \\ \end{gathered} $Стационарный уровень продукта реакции (стационарная концентрация продукта реакции) прямо пропорционален его потоку:
Поскольку λ $ \gg $ kd, получаем, что наблюдаемые значения максимального потока ($V_{{\max }}^{*}$) и константы Михаэлиса для потока продукта реакции ($K_{{\text{m}}}^{*}$) обратно пропорциональны значению константы скорости инактивации в процессе реакции. В частности, численное значение $K_{{\text{m}}}^{*}$ для потока продукта реакции в случае открытой системы в рассматриваемом случае на 3 порядка меньше значения Km, определяемого в закрытой системе. Это не означает, что в открытой системе для фермента поменялось значение Km – оно осталось тем же, но кинетическое поведение продуцируемого ферментом потока продукта реакции определяется $K_{{\text{m}}}^{*}$, в выражение для которой, в свою очередь, входит значение Km (7). Величины Km и $K_{{\text{m}}}^{*}$ имеют разный смысл, но их численные значения допустимо сравнивать во избежание недоразумений при интерпретации кинетического поведения фермента. Величина $K_{{\text{m}}}^{*}$ (5.25 × 10–3 мкМ) говорит о том, что при концентрациях АА ~0.1 мкМ и выше поток простагландинов уже не зависит от концентрации АА (в обычных физиологических условиях концентрация АА in vivo составляет не более 0.1 мкМ, а возрастание концентрации до 1–10 мкМ и более – признак выраженного физиологического ответа организма [29]). Очевидно, использование численного значения Km (6.35 мкМ) для интерпретации состояния фермента в организме будет приводить к недоразумениям.
В традиционных экспериментах по определению эффективности ингибиторов в закрытых системах медленные ингибиторы ведут себя как неконкурентные по отношению к AA [30]. Как видно из приведенных решений (7), в открытых системах подобных эффектов не наблюдается: ингибиторы медленного действия в потоке проявляют себя как полностью конкурентные, причем это верно и для обратимых, и для необратимых (k– = 0) ингибиторов.
Анализ уравнений (7) показывает, что наличие ингибитора в открытой системе увеличивает амплитуду изменения стационарного потока продукта реакции (и, соответственно, уровня продукта реакции) в ответ на изменение концентрации AA (табл. 1). Это может играть важную роль в сложных регуляторных процессах в организме.
Таблица 1.
Влияние наличия ингибиторов на амплитуду изменения уровня продукта реакции в стационарных состояниях открытой системы
| Ингибитор | Концентрация ингибитора, мкМ | [P]AA = 10/[P]AA = 0.01 |
|---|---|---|
| Отсутствует | – | 1.52 |
| Индометацин | 2 | 39 |
| 20 | 282 | |
| Аспирин | 10 | 1.77 |
| 100 | 3.95 |
Нестационарные (переходные) состояния после возмущения открытой системы весьма интересны и могут отражать процессы, реально протекающие in vivo (рис. 1–3). Рассматривали варианты возмущения системы, находящейся в стационарном состоянии, при изменении концентрации ингибитора (рис. 1) или концентрации субстрата (рис. 2, 3). Момент возмущения системы во всех случаях соответствовал t = 0.
Концентрации AA для моделирования были подобраны таким образом, чтобы они соответствовали различным состояниям организма: обычным физиологическим условиям (0.01 мкМ [29]), выраженному физиологическому ответу (10 мкМ [29]), патологическому состоянию (500 мкМ [31]). Концентрации ингибиторов для моделирования были подобраны согласно данным фармакологических исследований. При максимальной разовой дозе индометацина (100 мг перорально) его пиковая концентрация в плазме составляла ~8 мкг/мл (~20 мкМ), а при минимальной дозе (25 мг перорально) – в ~10 раз меньше (~2 мкМ) [32]. При низкой разовой дозе аспирина (100 мг перорально) пиковая концентрация в плазме составляла 2.2 мкг/мл (~10 мкМ), а при высокой (1500 мг перорально) – 21.1 мкг/мл (~100 мкМ) [33].
Рис. 1а иллюстрирует влияние ингибиторов на открытую систему при физиологической концентрации АА. Новое стационарное состояние в случае индометацина достигается значительно быстрее, чем в случае аспирина. Это обусловлено разными значениями k+ (1.83 с–1 для индометацина, 0.0135 с–1 для аспирина). При 2 мкМ индометацина (кривая 1) заметен двухфазный характер возмущения открытой системы под действием обратимого ингибитора: после достижения максимального ингибирования уровень продукта реакции повышается и достигает нового стационарного значения (соответствующее точное решение приведено в дополнительных материалах). Двухфазность обусловлена обратимостью медленной стадии ингибирования: возникающий после возмущения дополнительный поток расходования E, обусловленный формированием E*I, исчезает после достижения стационарной концентрации E*I.
Аспирин в выбранных концентрациях также уменьшает уровень продукта реакции, но в существенно меньшей степени. Это обусловлено различными значениями k+, а также тем, что значение Ki для аспирина гораздо выше, чем для индометацина (4200 и 27.7 мкМ соответственно). В случае аспирина двухфазности не наблюдается. Это следствие необратимости данного ингибитора (см. табл. 2 в дополнительных материалах).
При повышении концентрации AA с 0.01 мкМ (рис. 1а) до 10 мкМ (рис. 1б) влияние ингибиторов на открытую систему существенно уменьшается – это следствие конкурентного характера ингибирования фермента в потоке (7). Для индометацина при 10 мкМ AA двухфазность выражена гораздо сильнее, чем при 0.01 мкМ AA, а для аспирина эффект ингибирования при повышенной концентрации субстрата практически отсутствует. При AA = 500 мкМ эффект ингибирования отсутствует и для индометацина, и для аспирина (данные не приведены).
Важная характеристика открытой системы – ее реакция на изменение концентрации субстрата. Уровень арахидоновой кислоты регулируется многими внешними по отношению к простагландиновому участку системами [34]. Повышение концентрации AA – своеобразный “маркер” протекания многих процессов, таких как воспаление [29].
При быстром повышении концентрации AA с физиологического уровня (0.01 мкМ) на 3 порядка (рис. 2) в отсутствие ингибитора наблюдается взрывной рост уровня продукта. Это обусловлено тем, что начальная концентрация AA сравнима с $K_{{\text{m}}}^{*}$ (7), и существенная доля молекул активного фермента при этих концентрациях не связана с субстратом. При увеличении концентрации AA на 3 порядка практически весь активный фермент связывается с субстратом, что приводит к быстрому повышению концентрации ES и, соответственно, повышению уровня продукта. В дальнейшем вследствие инактивации фермента в процессе реакции концентрация ES и, соответственно, уровень продукта снижаются до нового стационарного состояния.
Если же в открытой системе присутствует обратимый ингибитор индометацин (рис. 2а), картина меняется. В начальной фазе не наблюдается взрывного роста уровня продукта. Это обусловлено тем, что в стационарном состоянии значительная часть фермента связана с ингибитором и не может мгновенно катализировать реакцию при повышении уровня субстрата. Однако через несколько минут после возмущения системы уровень продукта реакции в присутствии 2 мкМ индометацина становится выше, чем в отсутствие ингибитора, и этот эффект наблюдается в течение ~1.5 ч (для 20 мкМ индометацина он менее выражен). Этот на первый взгляд парадоксальный факт объясняется тем, что при инкубации фермента с обратимым ингибитором накапливаются фермент-ингибиторные комплексы, и при существенном повышении концентрации субстрата фермент постепенно высвобождается из них, связываясь с субстратом, тем самым увеличивая поток продукта реакции. Таким образом, обратимый ингибитор ведет себя как “депо” для активного фермента. Для необратимого и гораздо более слабого ингибитора аспирина (рис. 2б) подобных эффектов не наблюдается.
Если моделировать ситуацию стремительного развития острого патологического процесса (рис. 3), в которой концентрация AA может достигать значений ~500 мкМ [31] (на рис. 3 предусмотрено возмущение открытой системы путем увеличения концентрации АА с 10 до 500 мкМ), то можно наблюдать следующее. В отсутствие ингибитора (кривая 1) уровень продукта реакции не изменяется в результате возмущения системы, потому что при 10 мкМ АА весь активный фермент уже связан с субстратом. Присутствие аспирина (кривые 4 и 5) не меняет картину. Однако в присутствии индометацина после возмущения системы уровень продукта реакции временно существенно повышается (это продолжается около часа, кривые 2 и 3), при этом эффект повышения более выражен при большей концентрации ингибитора, в отличие от рис. 2а. Это объясняется тем, что при таких высоких концентрациях субстрата индометацин практически не проявляет свои ингибирующие свойства из-за конкурентного характера ингибирования. Поэтому эффект “депо” для активного фермента здесь более выражен, чем при 10 мкМ AA (рис. 2а).
Особого внимания заслуживает зависимость константы Михаэлиса для стационарного потока ($K_{{\text{m}}}^{*}$) (7) от скорости инактивации фермента в процессе реакции. В отсутствие инактивации (λ = 0) $K_{{\text{m}}}^{*}$ равна определяемой в закрытых системах константе Михаэлиса для стационарной ферментативной кинетики (Km). Инактивация PGHS в процессе реакции обусловливает низкое потоковое значение $K_{{\text{m}}}^{*}$, вследствие чего поток PG в рассматриваемом случае перестает зависеть от АА уже при физиологических концентрациях (10$K_{{\text{m}}}^{*}$ соответствуют ~0.05 мкМ АА), и при патологическом возрастании концентрации АА увеличиваться не будет. Следует отметить, что для открытых систем наряду со стационарными значениями потоков и концентраций важно обращать внимание на нестационарные состояния – “всплески” уровня продукта реакции при изменении концентраций ингибитора и субстрата. Как видно из рис. 2а и 3, во время этих нестационарных состояний можно наблюдать кажущееся парадоксальным повышение уровня продукта реакции в присутствии обратимого ингибитора. Также может иметь значение отмеченное увеличение амплитуды изменения уровня продукта реакции в стационарных состояниях открытой системы в присутствии конкурентных ингибиторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Tween-20, Трис, EDTA, диэтилдитиокарбамат натрия (DEDTC) (MP Biomedicals, Германия); индометацин, арахидоновую кислоту, ферроцианид калия, хлорид гемина, гидроксид натрия (Sigma-Aldrich, США); дитионит натрия, гидроксид калия (Panreac, Испания); пиридин (Merck, Германия); DMSO (ICN, Канада); соляную кислоту, этиловый спирт (Химмед, Россия).
Препарат фермента PGHS-1 получали из везикулярных желез барана согласно методике, опубликованной ранее [35], и хранили в специальном буферном растворе (50 мМ Трис-HCl, pH 8.0, 0.5 мМ EDTA, 0.1 мМ DEDTC, 2 мкМ гемина, 0.1% (v/v) Tween-20) при –70°C [30]. Концентрация белка в полученном препарате составляла 0.5 мг/мл (измеряли бицинхониновым методом [36]).
Кинетические эксперименты. Во всех экспериментах по измерению циклооксигеназной активности фермента использовали буферный раствор A (50 мМ Трис-HCl, pH 8.0) c добавлением 0.1% (v/v) Tween-20, 1 мМ ферроцианида калия и 2 мкМ гемина. Ферментативную реакцию проводили в закрытой термостатируемой стеклянной ячейке с постоянным перемешиванием при 25°C. Объем реакционной смеси составлял 1.5 мл, объем добавляемого раствора фермента – 5–30 мкл.
Раствор арахидоновой кислоты (150 мМ) готовили в этиловом спирте и затем разбавляли буферным раствором A, содержащим эквивалент гидроксида калия, до 3.75 мМ; раствор ферроцианида калия (0.1 М) готовили в дистиллированной воде; раствор индометацина (5 мМ) готовили в смеси буферного раствора A и 15%-ного этилового спирта и затем разбавляли буферным раствором A до 0.03 мМ; раствор гемина (10 мМ) готовили в DMSO и разбавляли до 2 мМ буферным раствором A. Точную концентрацию гемина определяли спектрофотометрическим методом с использованием известных коэффициентов поглощения для восстановленного комплекса гемина с пиридином [37].
Эксперименты по взаимодействию фермента и ингибитора проводили согласно следующей схеме: в реакционную ячейку, содержащую буферный раствор A, Tween-20, ферроцианид калия и гемин, последовательно добавляли индометацин, фермент, а через определенный промежуток времени после добавления препарата фермента (время преинкубации) инициировали ферментативную реакцию субстратом (арахидоновой кислотой). В экспериментах, соответствующих нулевому времени преинкубации, изменяли порядок добавления арахидоновой кислоты и фермента.
Измерение параметров ферментативной реакции. Циклооксигеназную реакцию детектировали амперометрическим методом по изменению концентрации растворенного кислорода согласно ранее опубликованной методике [30]. Интегральные кривые (зависимости продукта реакции от времени) получали из исходных зависимостей концентрации кислорода от времени с учетом неферментативной реакции. Скорость неферментативной реакции определяли по линейной аппроксимации участка экспериментальной кривой перед инициацией реакции.
Для расчетов скорости реакции использовали аппроксимацию начального участка интегральной кривой. Диапазон аппроксимации начинался с t = 1 с (из-за фактора “мертвого времени” измерительной системы [30]) и составлял 5–15 с. Начальная скорость соответствует тангенсу угла наклона касательной к интегральной кривой при t = 0, определяемому из параметров аппроксимации.
Для расчета константы скорости инактивации фермента в процессе реакции использовали аппроксимацию первых 20–30 с интегральной кривой при 100 мкМ AA и отсутствии ингибитора по формуле (1).
Математическая обработка данных. Анализ экспериментальных данных и графическое представление теоретических зависимостей проводили с использованием пакета Origin 7.5 (OriginLab Corporation, США).
Совместную аппроксимацию массива экспериментальных данных (зависимостей скорости от времени преинкубации и концентрации ингибитора при различных концентрациях субстрата) проводили с помощью пакета MatLab (MathWorks, США). Значения искомых величин определяли при минимальном значении суммы квадратов отклонений скоростей (Sum):
(9)
$Sum = \sum\limits_{\text{j}} {{{{(V_{{\text{j}}}^{{{\text{theor}}}} - V_{{\text{j}}}^{{\exp }})}}^{2}}} ,$(10)
$\begin{gathered} {{V}_{{{\text{rel}}}}} = \frac{{[S]({{K}_{{\text{m}}}} + 100)}}{{\left( {{{K}_{{\text{m}}}}\left( {1 + \frac{{[I]}}{{{{K}_{i}}}}} \right) + [S]} \right) \times 100}} \\ \times \,\,\left( {1 - \frac{{[I]}}{{K([I] + {{K}_{i}}) + [I]}}} \right. \\ \times \,\,\left. {\left( {1 - \exp \left( { - \left( {{{k}_{ - }} + {{k}_{ + }}\frac{{[I]}}{{[I] + {{K}_{i}}}}} \right)\tau } \right)} \right)} \right), \\ \end{gathered} $Решение системы дифференциальных уравнений. Систему дифференциальных уравнений, соответствующую кинетической схеме 1 , решали аналитически. Правильность полученных решений и графических иллюстраций подтверждали численными расчетами с использованием пакета MatLab (MathWorks, США).
ЗАКЛЮЧЕНИЕ
Показано, что свойства потоков в открытых по ферменту системах синтеза простагландинов (при наличии медленных обратимых ингибиторов и с учетом необратимой инактивации фермента в процессе реакции) демонстрируют качественно иное кинетическое поведение по сравнению со свойствами стационарных процессов в соответствующих закрытых системах. Наиболее значимый параметр, связывающий такие открытые и закрытые системы, – число оборотов фермента до полной его инактивации. Показано, что обратимые медленные ингибиторы в открытых системах могут выступать в роли депо для активного фермента, повышая на длительные периоды уровень простагландинов по сравнению с контролем в отсутствие ингибитора, а также могут существенно увеличивать амплитуду изменения уровня простагландинов в ответ на изменение концентрации арахидоновой кислоты. Эти свойства открытых систем синтеза простагландинов могут быть использованы при разработке стратегии применения нестероидных противовоспалительных препаратов для регуляции уровня и амплитуды модуляции уровня простагландинов.
Список литературы
Ricciotti E., FitzGerald G.A. // Arterioscler. Thromb. Vasc. Biol. 2011. V. 31. P. 986–1000. https://doi.org/10.1161/ATVBAHA.110.207449
Hamberg M., Svensson J., Wakabayashi T., Samuelsson B. // Proc. Natl. Acad. Sci. USA. 1974. V. 71. P. 345–349. https://doi.org/10.1073/pnas.71.2.345
Wu G., Vuletich J.L., Kulmacz R.J., Osawa Y., Tsai A.L. // J. Biol. Chem. 2001. V. 276. P. 19879–19888. https://doi.org/10.1074/jbc.M100628200
Hamberg M., Samuelsson B. // Proc. Natl. Acad. Sci. USA. 1973. V. 70. P. 899–903. https://doi.org/10.1073/pnas.70.3.899
Samuelsson B., Goldyne M., Granström E., Hamberg M., Hammarström S., Malmsten C. // Annu. Rev. Biochem. 1978. V. 47. P. 997–1029. https://doi.org/10.1146/annurev.bi.47.070178.005025
Helliwell R.J., Adams L.F., Mitchell M.D. // Prostaglandins Leukot. Essent. Fatty Acids. 2004. V. 70. P. 101–113. https://doi.org/10.1016/j.plefa.2003.04.002
Watanabe K., Yoshida R., Shimizu T., Hayaishi O. // J. Biol. Chem. 1985. V. 260. P. 7035–7041.
Vrzheshch P.V., Batanova E.A., Mevkh A.T., Varfolomeev S.D., Gazaryan I.G., Thorneley R.N. // Biochem. J. 2003. V. 372. P. 713–724. https://doi.org/10.1042/BJ20030043
Smith W.L., Lands W.E. // Biochemistry. 1972. V. 11. P. 3276–3285. https://doi.org/10.1021/bi00767a024
Egan R.W., Paxton J., Kuehl F.A. // J. Biol. Chem. 1976. V. 251. P. 7329–7335.
Мевх А.Т., Вржещ П.В., Швядас В.Ю.-К., Варфоломеев С.Д., Мягкова Г.И., Якушева Л.А. // Биоорг. химия. 1981. Т. 7. С. 695–702. [Mevkh A.T., Vrzheshch P.V., Svedas V.Y.-K., Varfolomeev S.D., Myagkova G.I., Yakusheva L.A. // Russ. J. Bioorg. Chem. 1981. V. 7. P. 695–702.]
Vrzheshch P.V., Tsaplina L.A., Sakharova I.S. // Biochemistry (Mosc.). 2007. V. 72. P. 828–834. https://doi.org/10.1134/s0006297907080032
Yokoyama C., Tanabe T. // Biochem. Biophys. Res. Commun. 1989. V. 165. P. 888–894. https://doi.org/10.1016/s0006-291x(89)80049-x
Jones D.A., Carlton D.P., McIntyre T.M., Zimmerman G.A., Prescott S.M. // J. Biol. Chem. 1993. V. 268. P. 9049–9054.
Vane J.R. // Nat. New Biol. 1971. V. 231. P. 232–235. https://doi.org/10.1038/newbio231232a0
Smith W.L., Meade E.A., DeWitt D.L. // Ann. N. Y. Acad. Sci. 1994. V. 714. P. 136–142. https://doi.org/10.1111/j.1749-6632.1994.tb12037.x
Bacchi S., Palumbo P., Sponta A., Coppolino M.F. // Antiinflamm. Antiallergy Agents Med. Chem. 2012. V. 11. P. 52–64. https://doi.org/10.2174/187152312803476255
Gabrielsson J., Peletier L.A. // AAPS J. 2018. V. 20. P. 102. https://doi.org/10.1208/s12248-018-0256-z
Westley A.M., Westley J. // J. Biol. Chem. 1996. V. 271. P. 5347–5352. https://doi.org/10.1074/jbc.271.10.5347
Liu W., Poole E.M., Ulrich C.M., Kulmacz R.J. // Pharmacogenet. Genomics. 2012. V. 22. P. 525–537. https://doi.org/10.1097/FPC.0b013e32835366f6
Schlosser M., Walschus U., Klöting I., Walther R. // Dis. Markers. 2008. V. 24. P. 191–198. https://doi.org/10.1155/2008/961421
Pelkonen O., Turpeinen M., Hakkola J., Honkakoski P., Hukkanen J., Raunio H. // Arch. Toxicol. 2008. V. 82. P. 667–715. https://doi.org/10.1007/s00204-008-0332-8
Mathieson T., Franken H., Kosinski J., Kurzawa N., Zinn N., Sweetman G., Poeckel D., Ratnu V.S., Schramm M., Becher I., Steidel M., Noh K.-M., Bergamini G., Beck M., Bantscheff M., Savitski M.M. // Nat. Commun. 2018. V. 9. P. 689. https://doi.org/10.1038/s41467-018-03106-1
Cohen L.D., Zuchman R., Sorokina O., Müller A., Dieterich D.C., Armstrong J.D., Ziv T., Ziv N.E. // PLoS One. 2013. V. 8. P. e63191. https://doi.org/10.1371/journal.pone.0063191
Fowler J.S., Volkow N.D., Logan J., Wang G.J., MacGregor R.R., Schyler D., Wolf A.P., Pappas N., Alexoff D., Shea C. // Synapse. 1994. V. 18. P. 86–93. https://doi.org/10.1002/syn.890180203
Yang J., Liao M., Shou M., Jamei M., Yeo K.R., Tucker G.T., Rostami-Hodjegan A. // Curr. Drug Metab. 2008. V. 9. P. 384–394. https://doi.org/10.2174/138920008784746382
von Bahr C., Steiner E., Koike Y., Gabrielsson J. // Clin. Pharmacol. Ther. 1998. V. 64. P. 18–26. https://doi.org/10.1016/S0009-9236(98)90018-2
Flower R.J. // Biochem. Soc. Trans. 1978. V. 6. P. 713–714. https://doi.org/10.1042/bst0060713a
Brash A.R. // J. Clin. Invest. 2001. V. 107. P. 1339–1345. https://doi.org/10.1172/JCI13210
Filimonov I.S., Berzova A.P., Barkhatov V.I., Krivoshey A.V., Trushkin N.A., Vrzheshch P.V. // Biochemistry (Mosc.). 2018. V. 83. P. 119–128. https://doi.org/10.1134/S0006297918020049
Pompeia C., Lima T., Curi R. // Cell Biochem. Funct. 2003. V. 21. P. 97–104. https://doi.org/10.1002/cbf.1012
Alván G., Orme M., Bertilsson L., Ekstrand R., Palmér L. // Clin. Pharmacol. Ther. 1975. V. 18. P. 364–373. https://doi.org/10.1002/cpt1975183364
Rosenkranz B., Frölich J.C. // Prostaglandins Leukot. Med. 1985. V. 19. P. 289–300. https://doi.org/10.1016/0262-1746(85)90142-8
Murakami M., Nakatani Y., Atsumi G.-I., Inoue K., Kudo I. // Crit. Rev. Immunol. 2017. V. 37. P. 127–195. https://doi.org/10.1615/CritRevImmunol.v37.i2-6.20
Ponomareva O.A., Trushkin N.A., Filimonov I.S., Krivoshey A.V., Barkhatov V.I., Mitrofanov S.I., Vrzheshch P.V. // Biochim. Biophys. Acta. 2016. V. 1858. P. 2199–2207. https://doi.org/10.1016/j.bbamem.2016.06.013
Stoscheck C.M. // Methods Enzymol. 1990. V. 182. P. 50–68. https://doi.org/10.1016/0076-6879(90)82008-p
Falk J.E. // Porphyrins and Metalloporphyrins. Their General, Physical and Coordination Chemistry, and Laboratory Methods. Amsterdam – London – New York: Elsevier Publ. Comp., 1964. P. 181. https://doi.org/10.1002/jobm.19640040512
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы
Инструменты
Биоорганическая химия



