Биоорганическая химия, 2022, T. 48, № 1, стр. 32-52
Гетероциклические аналоги ресвератрола – синтез и физиологическая активность. Часть 2. Аналоги, полученные заменой этиленового фрагмента на гетероциклический
А. В. Семенов 1, *, Е. В. Семенова 1, О. И. Балакирева 1
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва
430005 Саранск, ул. Большевистская, 68, Россия
* E-mail: salexan@mail.ru
Поступила в редакцию 20.02.2021
После доработки 11.03.2021
Принята к публикации 16.03.2021
- EDN: PKGLKU
- DOI: 10.31857/S0132342322010110
Аннотация
В продолжение рассмотрения синтетических аналогов одного из наиболее изученных природных полифенолов – ресвератрола – вторая часть обзора посвящена структурам, полученным благодаря трансформации этиленового фрагмента, соединяющего бензольные кольца в остове природного прототипа. Основное внимание уделено методам синтеза и выявленным физиологическим эффектам структур, в которых кратная связь трансформирована в гетероциклический фрагмент. Модификация такого рода направлена на снижение конформационной подвижности молекулы и способствует жесткой фиксации структуры в той или иной активной конфигурации.
Введение......................................................... 32
Замена этиленового мостика в ресвератроле гетероциклическим фрагментом........................33
Аналоги транс-ресвератрола на основе 1,3-ди-арилзамещенных пятичленных гетероциклов........33
Аналоги транс-ресвератрола на основе конденсированных гетероциклических систем................ 38
Аналоги цис-ресвератрола на основе 1,2-диарилгетероциклических систем................................... 40
Заключение.................................................... 44
Список литературы.........................................51
ВВЕДЕНИЕ
Как отмечалось в первой части обзора [1], ресвератрол благодаря широкому спектру физиологических эффектов (антиоксидантных, антивозрастных, противовоспалительных, противораковых, антидиабетических, кардиозащитных и нейропротекторных), потенциально полезных при профилактике и лечении многих социально значимых заболеваний, стал одним из наиболее изученных природных полифенолов. Однако многообещающие результаты, полученные в исследованиях in vitro и в ряде доклинических испытаний на животных, в случае клинических исследований на людях не нашли однозначного подтверждения [2]. Отчасти это объясняется тремя ключевыми факторами, негативно влияющими на биологическую активность ресвератрола: во-первых, имея pKa = 8.99 и log P = 3.4, он обладает высокой гидрофобностью (растворимость в воде ~30 мг/л); во-вторых, при пероральном введении ресвератрол подвергается быстрому метаболизму по II фазе, преимущественно формируя неактивные ресвератрол-3-O-глюкуронид, ресвератрол-4-О-глюкуронид и ресвератрол 3-O-сульфат [3]; в-третьих, молекула достаточно легко подвергается цис-транс-изомеризации [4], в том числе при действии солнечного света [5], и окислительной трансформации, которая происходит под воздействием повышенной температуры и других факторов окружающей среды [6]. Для решения этих проблем могут быть использованы два подхода: создание новых терапевтических систем (мицеллярные растворы, циклодекстрины, липосомы и т.д.) [3] или модификация структуры ресвератрола, при этом одна из стратегий – получение пролекарств, например, путем метилирования гидроксильных групп. Так, диметилированный аналог ресвератрола – птеростибен – не только обладает повышенной пероральной биодоступностью, но и способен преодолевать гематоэнцефалический барьер и модулировать функции центральной нервной системы [7, 8]. Другой вариант предполагает использование ресвератрола в качестве платформы для создания синтетических аналогов не только с целью преодоления вышеуказанных недостатков, но и увеличения фармакологической активности по отношению к прототипу.
Первая часть обзора [1] была посвящена направлению трансформации, связанному с заменой арильных фрагментов в нативной структуре гетероциклическими. Во второй части обсуждены модификации, связанные с алкеновым фрагментом, соединяющим бензольные кольца в остове ресвератрола. При этом мы сконцентрировали внимание лишь на замене этиленового мостика гетероциклическими фрагментами, не включив в рассмотрение иные варианты трансформации, в частности создание аза- и диазааналогов, достаточно полно обсужденное в обзоре Lizard et al. [9].
ЗАМЕНА ЭТИЛЕНОВОГО МОСТИКА В РЕСВЕРАТРОЛЕ ГЕТЕРОЦИКЛИЧЕСКИМ ФРАГМЕНТОМ
Замена алкенового фрагмента на гетероциклические системы – одна из стратегий, используемых в создании аналогов ресвератрола. Основная идея такого подхода – блокирование характерной для ресвератрола возможности цис-транс-изомеризации, т.е. жесткая фиксация остова в той или иной активной конфигурации, а также устранение некоторых нежелательных путей его метаболической трансформации на основе окислительных превращений с участием двойной связи. Важный критерий выбора таких систем – возможность сохранения сопряжения между арильными фрагментами, наличие которого необходимо для обеспечения антиоксидантных свойств у получаемых производных.
Один из вариантов сохранения геометрии двух фенильных колец относительно неизменной и близкой к таковой для транс-стильбенового скелета – формирование структур, в которых фенильные кольца находятся в положениях 1 и 3 ароматических пятичленных гетероциклов (рис. 1). Другой вариант – арилированные производные конденсированных гетероциклических систем, таких как хинолин, бензофуран, бензотиазол и др. Для фиксации цис-ресвератрольной структуры подходят любые 1,2-диарилзамещенные гетероциклы.
Аналоги транс-ресвератрола на основе 1,3-диарилзамещенных пятичленных гетероциклов
В качестве пятичленных гетероциклических линкеров в литературе представлены имидазольные, триазольные, тиазольные и тиадиазольные фрагменты, подходы к синтезу которых могут быть весьма разнообразными.
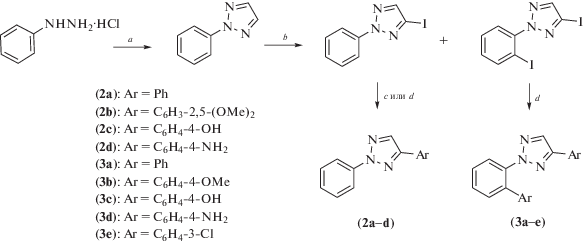
Один из простых и эффективных способов создания триазольных систем – катализируемая медью реакция [3+2]циклоприсоединения между алкинами и азидами. Этот процесс, относящийся к клик-реакциям, был использован для параллельного комбинаторного синтеза гетероциклических аналогов ресвератрола (1a–m) (схема 1 ) [10].
Схема 1 . Синтез соединений (1). Реагенты и условия реакций: a – CuSO4, аскорбат натрия, H2O, t-BuOH.
Предварительный скрининг цитотоксического/антипролиферативного действия полученной библиотеки соединений на клеточных линиях нейробластомы (SH-SY5Y), рака молочной железы (MDA-MB-231), базофильного лейкоза (RBL 2H3) и карциномы поджелудочной железы человека (FG2) показал, что метоксилированные производные (1с–е) были более эффективны, чем ресвератрол.
Альтернативный подход к синтезу триазольных аналогов основан на введении предварительно полученных 4-иод-2-фенил-1,2,3-триазолa и 4-иод-2-(2-иодфенил)-1,2,3-триазола в реакции сочетания Сузуки (схема 2 ) [11]. При оценке биологической активности полученные соединения показали многообещающий антипролиферативный эффект в отношении клеточной линии рака молочной железы (MDA-MB-231). При этом ди-арильные производные (3) в целом обладали более высокой активностью по сравнению с моноарильными соединениями (2). Максимальный эффект наблюдался для производного (3d), у которого значение IC50 = 17.5 ± 0.7 мкM оказалось в 7.5 раз меньше, чем у ресвератрола.
Схема 2 . Синтез соединений (2) и (3). Реагенты и условия реакций: a – NaOH, (CHO)2, Cu(OTf)2, t; b – 1. Z-nCl2·TMEDA, LiTMP, THF, комн. темп., 2 ч; 2. I2, комн. темп., 2 ч; c – ArB(OH)2, Pd(dba)2, PPh3, CsF, диоксан, кипячение; d – ArB(OH)2, PdCl2, PPh3, Na2CO3, H2O, EtOH, DME, кипячение.
Альтернатива триазольному фрагменту – 1,4-, 2,4- и 2,5-диарилимидазолы, в которых две арильные группы связаны с гетероциклическим ядром в положениях 1,3. Одним из вариантов синтеза таких производных стало последовательное арилирование простых, коммерчески доступных предшественников имидазола в условиях палладий-катализируемых реакций кросс-сочетания (схема 3 ) [12, 13]. Противоопухолевая активность полученной библиотеки аналогов была оценена in vitro на панели линий опухолевых клеток человека NCI-60. По результатам скрининга максимальную активность по отношению ко всем исследованным опухолевым линиям продемонстрировал аналог (4f), оказавшийся более эффективным, чем его природный прототип. Примечательно, что его региоизомер (4е) не показал столь же высокой эффективности.
Схема 3 . Синтез соединений (4–6). Реагенты и условия реакций: a – Ar1B(OH)2, PdCl2(dppf), BnEt3NCl, CsF, толуол, H2O, 110°C; b – Ar2Br, (CuOTf)2·PhMe, 1,10-фенантролин, dba, Cs2CO3, ксилол, 110°C; c – Ar2Br, Pd(OAc)2, CuI, DMA, 160°C; d – Ar1Br, Pd(OAc)2, n-Bu4NOAc, DMA, 110°C; e – Ar2Br, CuI, 110°C; f – BBr3, CH2Cl2, –60°C, MeOH.
Далее в более детальном скрининговом исследовании [13] было показано, что синтетические аналоги (4) и (6) проявляют более выраженные антипролиферативные свойства по сравнению с ресвератролом в отношении клеточной линии рака яичников. Было обнаружено, что они также значительно ингибируют передачу сигналов Akt и MAPK и уменьшают миграцию клеток, индуцированную IL-6 и EGF. Наконец, на раковых клетках, полученных из асцитической жидкости, было показано, что исследуемые соединения способны снижать экспрессию маркеров эпителиально-мезенхимального перехода (ЭМП). В качестве лучшего кандидата для дальнейших испытаний позиционируется производное (4а).
Ряд работ посвящен замене этиленового мостика в остове ресвератрола на 1,3-тиазольный или 1,2,4-тиадиазольный гетероцикл с целью создания потенциальных химиопрофилактических агентов – ингибиторов ароматазы и NF-κB, а также индукторов хинонредуктазы 1 (QR1). Ароматаза – известная мишень для химиопрофилактики рака молочной железы, а хинонредуктаза 1 (QR1) относится к классу так называемых цитопротективных ферментов. Она проявляет свою противоопухолевую активность в основном за счет ингибирования продукции внутриклеточных семихиноновых радикалов и образования α‑токоферолгидрохинона, который действует как ловушка свободных радикалов.
Для получения симметричных 1,2,4-тиадиазольных аналогов ресвератрола предложено использовать реакцию метилбромцианоацетата с широким набором тиоамидов в абсолютном метаноле при комнатной температуре (схема 4 ) [14]. Было установлено, что по сравнению с ресвератролом пиридин-содержащие аналоги (7b) и (7c) обладают в 30–125 раз более высокой ингибирующей активностью в отношении ароматазы (IC50 = = 0.2 и 0.8 мкМ соответственно) и большей селективностью. Орто-галогензамещенные производные (7h), (7j) и (7o) проявили свойства высокоселективных индукторов QR1, а мета-метильное и метоксильное производные (7s) и (7ii) показали активность по отношению к NF-κB – несколько большую, чем транс-ресвератрол.
Схема 4 . Синтез соединений (7). Реагенты и условия реакций: a – метанол, 23°C, 1 мин; b – H2/Pd, метанол, 23°C, 24 ч; с – HBr, ледяная уксусная кислота, кипячение 8 ч.
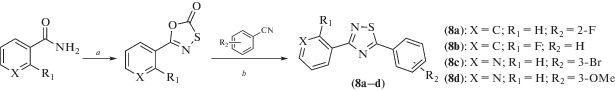
В отличие от эквивалентно замещенных производных, синтез несимметричных 1,2,4-тиадиазолов – более сложная задача. В исследованиях [15, 16] с этой целью был использован двухстадийный процесс, включающий взаимодействие бензамидов с (хлоркарбонил)сульфенилхлоридом с последующим нагреванием промежуточных продуктов с бензонитрилами в декалине (схема 5 ). Авторы отмечают несовершенство данной схемы, выражающееся в низких выходах и сложности очистки целевых продуктов. По этой причине и с учетом того, что тиадиазольный атом азота в положении 2, по-видимому, не играет никакой роли во взаимодействии с фрагментами активного сайта связывания биомишеней, более перспективными представляются аналоги с 2,4-диарил-1,3-тиазоловым скелетом. Для их получения предлагается использовать реакцию арилтиоамидов с α-бромацетофенонами в сухом ДМФА [15–17] (схема 6 ).
Схема 5 . Синтез соединений (8). Реагенты и условия реакций: a – (хлорокарбонил)сульфенилхлорид, толуол, кипячение, 24 ч; b – декалин, 200°C, 20 мин.
Схема 6 . Синтез соединений (9) и (10). Реагенты и условия реакций: a – DMF, Cs2CO3, кипячение, 3–8 ч; b – 1. HBr, уксусная кислота, кипячение; 2. K2CO3, 24 ч; с – NaOMe, MeOH или EtOH, 120°C, 24 ч.
Используемая схема оказалась высокоэффективной и позволила синтезировать большую библиотеку производных. При их последующем скрининге были выявлены высокоэффективные индукторы QR1 – соединения (9o), (9n) и (9e) (CD = 0.087, 0.117 и 0.143 мкМ соответственно, для сравнения у ресвератрола CD = 21 мкМ). Кроме того, производное (10g) ингибировало активность ароматазы в наномолярном диапазоне концентраций (IC50 = 4 нМ) и в дополнение к этому обладало умеренным ингибирующим действием по отношению к NF-κB. Метоксипроизводное (10i) также оказалось высокоселективным ингибитором ароматазы, активным в наномолярном диапазоне (IC50 = 23 нМ).
Поиск эффективных антиоксидантов и ингибиторов NF-κB проводился также в ряду 1,2,4-оксадиазольных аналогов (схема 7 ) [18]. Некоторые соединения показали значительную ингибирующую активность в отношении продукции NF-κB и/или ROS. Соединение (11a), включающее две пара-гидроксифенильные группы, связанные с 1,2,4-оксадиазольным кольцом, было наиболее активным. Его способность ингибировать NF-κB и снижать уровень ROS превосходила таковые у ресвератрола. Кроме того, авторами были установлены механизмы, лежащие в основе ингибирования активности NF-κB соединением (11a). Наконец, в отличие от ресвератрола, соединение (11a) значительно уменьшало вызванное липополисахаридом высвобождение провоспалительных цитокинов, что указывало на его выраженный противовоспалительный потенциал.
Схема 7 . Синтез соединений (11). Реагенты и условия реакций: a – NH2OH·HCl, KOH, EtOH, кипячение 18 ч; b – SOCl2, DMF, CH2Cl2, комн. темп., 1 ч; c – Py, кипячение 5 ч.
Аналоги транс-ресвератрола на основе конденсированных гетероциклических систем
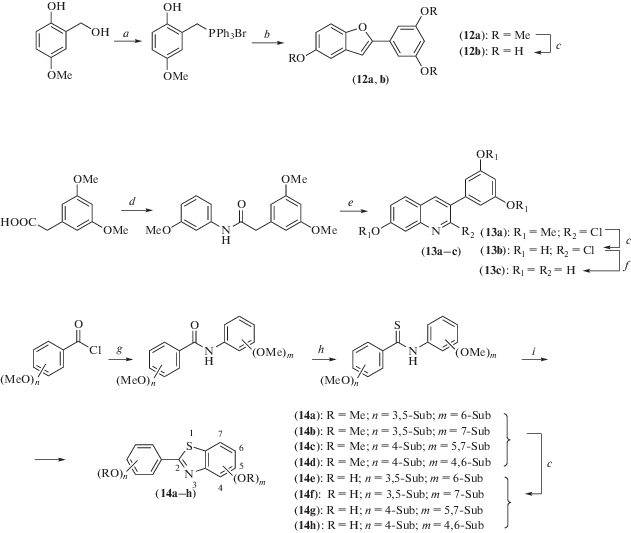
Решения задачи жесткой фиксации транс-ресвератрольного скелета при сохранении максимального соответствия геометрических параметров природному прототипу можно достичь формированием конденсированных гетероциклических систем типа хинолина, бензофурана, бензотиазола и др. Пути синтеза ряда таких аналогов представлены на схеме 8 [19]. У полученных соединений оценивали антипролиферативный и сосудорасширяющий эффекты – два типичные свойства, проявляемые ресвератролом. Наиболее выраженный антипролиферативный эффект продемонстрировал хинолиновый аналог (13с) (IC50 = 17.4 мМ). По влиянию на сосуды наиболее высокие уровни активности (pIC50 = 4.92) и эффективности (Emax = = 88.2%) были выявлены у бензотиазола (14е). Конформационный анализ этих соединений показал, что антипролиферативная активность в отношении раковых клеток рака молочной железы человека (MDA-MB-231) может коррелировать с общим стерическим профилем наиболее активных соединений и, в частности, с пространственным расположением трех фенольных групп. Кроме того, сосудорасширяющие свойства показали хорошую корреляцию с электронными свойствами, оцененными на основе молекулярного электростатического потенциала (ESP).
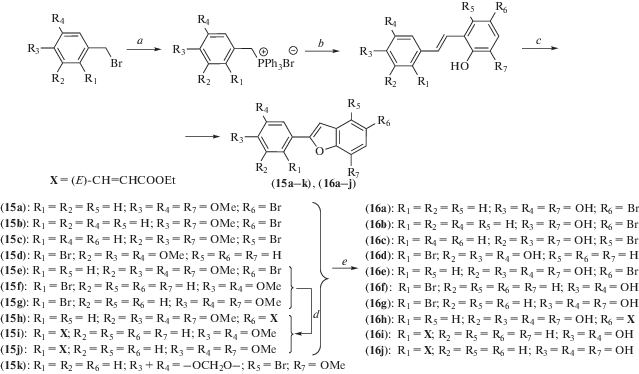
У ряда производных 2-арилбензо[b]фурана, синтезированных по схеме 9 , была изучена нейропротекторная и противовоспалительная активность in vitro и на экспериментальной модели у животных [20]. Проведенный анализ соотношения структура–активность показал, что нейропротекторное и противовоспалительное действие связано с присутствием акрилатной группы в 2‑арилбензо[b]фуране. Согласно полученным результатам, в качестве хит-соединений для разработки средств профилактики и лечения болезни Альцгеймера были выбраны соединения (16h) и (16i), которые в этом исследовании продемонстрировали выраженную нейропротекторную и противовоспалительную активность в отношении нейроглии.
Tanini et al. [21] разработали эффективный способ прямого селенирования ресвератрола, позволивший синтезировать новый класс производных, имеющих не описанный ранее скелет 2‑фенилбензоселенофена и обладающих потенциально более высокой антиоксидантной активностью. В дальнейшем этот подход был реализован и для ряда аналогов ресвератрола (схема 10 ) [22]. Квантово-химические расчеты энергии диссоциации связей О–Н в полученных производных показали, что введение атома Se приводит к значительному ее уменьшению. В результате все бензоселенофеновые производные (17) и (18) оказались более эффективными, чем ресвератрол, в тестах DPPH, при этом активность соединения (17a) была сопоставима с активностью Тролокса – водорастворимого аналога витамина Е. Соединения (17а–с) также оказались более эффективными ингибиторами, чем ресвератрол, в кинетических экспериментах автоокисления стирола. Для производных (17а) и (18а–с) была оценена GPx-подобная активность, которая была максимальной в случае соединения (18b). Соединения (17а–с) не проявляли цитотоксичности при концентрациях 5 мкМ на клеточных линиях кератиноцитов человека (HaCaT) и эпителиальных клетках кишечника (CaCo-2).
Схема 8 . Синтез соединений (12–14). Реагенты и условия реакций: a – PPh3·HBr, CH3CN, кипячение, 1 ч; b – 1. 3,5-диметоксибензойная кислота, DCC, DMAP, CH2Cl2; 2. Et3N, диоксин, кипячение; с – BBr3, CH2Cl2, –78°C; d – 1. SOCl2, CH2Cl2, 60°C, 4 ч; 2. м-анизидин, CH2Cl2, DMAP, PS-DIEA, комн. темп.; e – POCl3, DMF, 75°C, 1.5 ч; f – H2 (1 атм.), Pd–C, Et3N, EtOH, 24 ч; g – соответствующий метоксианилин, CH2Cl2, DMAP, PS-DIEA, комн. темп.; h – реагент Лавессона, 130°C, 3 ч; i – 1. K3[Fe(CN)6], NaOH 30%, EtOH, 85°C, 30 мин; 2. комн. темп.
Схема 9 . Синтез соединений (15) и (16). Реагенты и условия реакций: a – PPh3, PhMe; b – соответствующие замещенные салициловые альдегиды, t-BuOLi, THF; c – I2, K2CO3, THF; d – Pd(OAc)2, этилакрилат, PPh3, Et3N, DMF; e – BBr3, CH2Cl2.
Схема 10 . Синтез соединений (17) и (18). Реагенты и условия реакций: a – 1. Se, SO2Cl2, THF; 2. DMF, комн. темп.
Аналоги цис-ресвератрола на основе 1,2-диарилгетероциклических систем
Хотя в большинстве исследований показана большая активность транс-ресвератрола, изучение цис-изомера и его аналогов [23] представляет интерес, прежде всего, с целью поиска структур, проявляющих противоопухолевую активность по аналогии с обсуждавшимся в первой части обзора природным антимитотическим агентом – комбретастатином А-4. Исследования взаимосвязи структура–активность показали, что наличие 3,4,5-триметоксизамещенного кольца в молекуле комбретастатина А-4 и цис-конфигурация кратной связи имеют решающее значение для оптимальной цитотоксической активности, а изомеризация до биологически менее активной транс-формы представляет собой существенную проблему для применения комбретастатинов в качестве лекарственных средств. Таким образом, во многих исследованиях по получению синтетических аналогов комбретастатина А-4 ключевой задачей стала фиксация метиленового мостика цис-типа между двумя фенильными кольцами. В частности, были получены аналоги комбретастатина А-4, в которых алкенильный фрагмент был заменен изоксазолиновым, изоксазольным или пиридиновым фрагментами (схемы 11 и 12 ) [24].
Схема 11 . Синтез соединений (19–22). Реагенты и условия реакций: a – диазометан, Et2O; b – CH2Cl2, п-TsOH, кипячение; c – TBAF, CH2Cl2; d – Na, CH3OH или MeLi, THF.
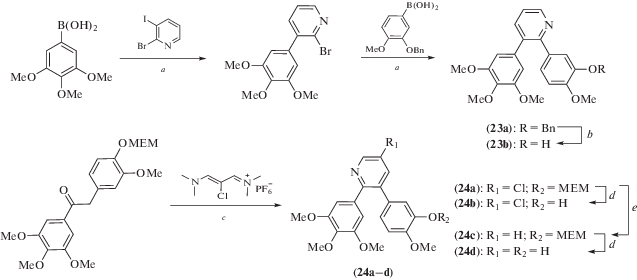
Схема 12 . Синтез соединений (23) и (24). Реагенты и условия реакций: a – Pd(Ph3P)4, Na2CO3 (водн.), толуол/EtOH; b – H2, Pd/C, EtOH; c – t-BuOK, DABCO, NH4OAc, THF, 6 ч, кипячение; d – TFA, CH2Cl2, 5 ч, комн. темп.; e – H2, 10% Pd/CaCO3, 1 н. NaOH/EtOH 1 : 1, комн. темп.
У новых соединений оценивали способность оказывать влияние на сборку тубулина, а также цитотоксическую и проапоптотическую активность. Соединения (19b), (21a), (22a), (24b) и (24d) продемонстрировали благоприятный профиль цитотоксичности (IC50 < 1 мкМ) и значимую проапоптотическую активность, но слабый антитубулиновый эффект. При этом показавшие сильную проапоптотическую активность производные изоксазолина (19b), (21a) и (22a) оказались способными блокировать большинство клеток в фазе G2. Вероятно, помимо митотического веретена эти соединения способны воздействовать и на другие мишени, ответственные за активацию как внутренних, так и внешних апоптотических путей. Полученные данные однозначно свидетельствуют о том, что структурное изменение фрагмента стильбена комбретастатина А-4 может быть чрезвычайно эффективным для получения высокоактивных индукторов апоптоза.
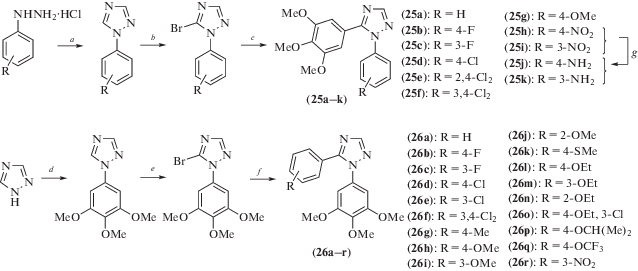
В качестве цис-ограниченных аналогов комбретастатина А-4 по реакции кросс-сочетания (схема 13 ) был синтезирован ряд производных триазола (25a–k) и (26a–r) [25]. У полученных соединений оценивали антипролиферативные эффекты, ингибирующее действие на полимеризацию тубулина, влияние на фазы клеточного цикла и способность индуцировать апоптоз. Было установлено, что активность всех синтезированных соединений была выше или сопоставима с активностью комбретастатина А-4. Исследования с помощью проточной цитометрии показали, что обработка клеток рака шейки матки (HeLa) и T-клеточной лейкемии (Jurkat) наиболее активными соединениями (26l) и (26o) вызывала остановку клеточного цикла в фазе G2/M, причем выраженность эффекта зависела от концентрации соединений. Это сопровождалось апоптозом клеток, деполяризацией митохондрий, генерацией ROS, активацией каспазы-3 и расщеплением PARP. Было также показано, что соединение (26l) обладает потенциальной антиваскулярной активностью, поскольку индуцирует изменение формы эндотелиальных клеток in vitro и нарушает прорастание эндотелиальных клеток по данным исследования на кольцах аорты цыпленка.
Схема 13 . Синтез соединений (25) и (26). Реагенты и условия реакций: a – HCONH2, 120°C, 18 ч; b, e – NBS, бензоилпероксид (кат.), CCl4, кипячение; c, f – Pd(PPh3)4, K2CO3, PhMe, кипячение, 18 ч; d – 1-бром-3,4,5-триметоксибензол, CsCO3, CuI, DMF, 120°C, 18 ч; g – H2, 10% Pd/C, DMF.
Получены аналоги комбретастатина А-4, в которых цис-конфигурация бензольных колец была фиксирована заменой алкенильного линкера оксазольным или N-метилимидазольным фрагментами (схема 14 ) [26]. Полученные производные (27) были изучены на различных линиях раковых клеток и на опухолевых ксенотрансплантатах у мышей. Имидазолы (27q) и (27r), в отличие от комбретастатина A, были эффективны при наномолярных концентрациях в отношении резистентной клеточной линии рака толстого кишечника (HT-29), клеточной линии топокарциномы молочной железы с множественной лекарственной устойчивостью (MCF-7) и резистентной к цисплатину опухоли зародышевых клеток яичка (1411HP). Исследуемые вещества индуцировали апоптоз и ингибировали полимеризацию тубулина, хорошо переносились мышами в высоких дозах, вызывали обширные внутриопухолевые кровоизлияния и регрессию высоковаскуляризированных ксенотрансплантатов опухоли 1411HP.
Схема 14 . Синтез соединений (27). Реагенты и условия реакций: a – HCONH2, CSA, п-толуолсульфиновая кислота, 16 ч, 60°C; b – POCl3, Et3N, DME, 3 ч, –5°C; c – ArCHO, K2CO3, DME/MeOH, 2 ч, кипячение (для X = O) или ArCHO, MeNH2 (33% в EtOH), AcOH, EtOH, 2 ч, кипячение (для X = NMe); d – HCO2NH4, Pd/C (5%), MeOH, 2 ч, кипячение (для соединений (27a–d)) или Zn, HCl, THF, 10 мин, комн. темп. (для соединений (27e–g)).
Также была синтезирована библиотека соединений, где в качестве линкера, соединяющего бензольные фрагменты, выступал 2,3-тиазолидин-4-он (схема 15 ) [27]. Некоторые из этих соединений продемонстрировали более выраженное по сравнению с ресвератролом ингибирующее влияние на рост клеток рака молочной железы. Примечательно, что если соединения (28g) и (28h) проявили сильную противоопухолевую активность по отношению к ER-положительной клеточной линии MCF-7, то производные (28j) и (28k) обладали сильной цитостатической активностью к ER-отрицательной клеточной линии Sk-Br3, т.е. биологическое действие этих молекул может зависеть от различных паттернов эстрогеновых рецепторов.
Схема 15 . Синтез соединений (28) [27].
Реакцией циклоприсоединения иминов к 2-хлорацетилхлориду в присутствии триэтиламина (схема 16 ) синтезирована новая серия структурно жестких производных 1,4-диарил-3-хлорoазетидин-2-она [28], оценено их регуляторное воздействие на рост клеточных линий MCF7 и SkBr3 рака молочной железы человека. Все исследуемые соединения обладали более высокой биодоступностью in vitro по сравнению с ресвератролом и показали противоопухолевую активность от умеренной до высокой (максимальная для соединений (29d) и (29f)) по отношению к тестируемым линиям.
Схема 16 . Синтез соединений (29). Реагенты и условия реакций: a – толуол; b – 2-хлорацетилхлорид, TEA, CH2Cl2, –78°C.
Основываясь на данных о способности ресвератрола ингибировать репликацию ВИЧ-1 в соответствии со схемой 17 , был получен ряд его производных, для которых была оценена способность подавлять репликацию ВИЧ-1 в пределах одного цикла [29]. Показано, что производные (30с, d) и (31с, d) обладают более высокой активностью против ВИЧ-1, чем ресвератрол. Однако только для ресвератрола был выявлен синергетический эффект при совместном применении с известным препаратом децитабином.
Схема 17 . Синтез соединений (30) и (31). Реагенты и условия реакций: a – Pd(PPh3)4, 2 M Na2CO3, толуол/EtOH 3 : 1, кипячение, 6 ч; b – 1 M BBr3, СH2Cl2, комн. темп., 20 ч.
ЗАКЛЮЧЕНИЕ
Модификация структуры ресвератрола продолжает привлекать внимание медицинских химиков. Как видно из табл. 1 , многие исследовательские группы сосредоточили свою работу на получении синтетических аналогов ресвератрола с целью повышения их биологической активности, прежде всего для создания эффективных средств борьбы с онкологическими заболеваниями. В ряде работ была продемонстрирована многообещающая антипролиферативная и цитотоксическая активность новых синтетических аналогов ресвератрола. Тем не менее были выявлены и соединения с иным потенциалом биологического действия, в частности аналоги с противовоспалительным, нейропротективным, противовирусным, сосудорасширяющим и другими эффектами (табл. 2 ). В рамках данного обзора мы постарались обобщить наиболее привилегированные структуры, производные которых показали ряд терапевтических эффектов и могут выступать в качестве хит-соединений при создании новых химиотерапевтических средств. Кроме того, анализ зависимостей структура–эффект для рассматриваемых библиотек аналогов будет способствовать лучшему пониманию молекулярных механизмов действия наиболее перспективных соединений. Мы надеемся, что этот обзор поможет медицинским химикам в рациональном дизайне и разработке новых лекарственных средств, направленных на профилактику и лечение наиболее значимых заболеваний человека.
Таблица 1.
Антипролиферативная и цитотоксическая активность гетероциклических аналогов ресвератрола
| Объект исследования | Метод исследования |
Соединение | Активность IC50, мкМ |
Ссылка |
|---|---|---|---|---|
| Клеточная линия аденокарциномы молочной железы человека MDA-MB-231 | МТТ-тест | (1f) | ≈0.01 | [10] |
| (1g–m) | ≈0.1 | [10] | ||
| (3с) | 40 | [11] | ||
| (3d) | 17.5 | [11] | ||
| (3e) | 45.5 | [11] | ||
| транс-Ресвератрол | 129.9 | [11] | ||
| SRB-тест | (13c) | 17.4 | [19] | |
| (14f) | 18.1 | [19] | ||
| (14e) | 19.4 | [19] | ||
| (12b) | 46.1 | [19] | ||
| (13b) | 47.4 | [19] | ||
| (14c) | 67.6 | [19] | ||
| транс-Ресвератрол | 20.5 | [19] | ||
| Клеточная линия аденокарциномы молочной железы человека MCF7 | МТТ-тест | (26o) | 0.017 | [25] |
| (26l) | 0.05 | [25] | ||
| (26h) | 0.36 | [25] | ||
| (26k) | 0.39 | [25] | ||
| (26g) | 0.54 | [25] | ||
| (26p) | 0.61 | [25] | ||
| (28g) | 2.58 | [27] | ||
| (25g) | 7.4 | [25] | ||
| (28h) | 5.0 | [27] | ||
| (29f) | 11.77 | [28] | ||
| (29d) | 16.72 | [28] | ||
| транс-Ресвератрол | 28.07 | [27] | ||
| цис-Ресвератрол | 28.38 | [28] | ||
| Комбретастатин | 0.37 | [25] | ||
| Клеточная линия аденокарциномы молочной железы человека с множественной лекарственной устойчивостью MCF7/Topo | МТТ-тест | (27l) | 0.00123 | [26] |
| (27q) | 0.32 | [26] | ||
| (27r) | 0.34 | [26] | ||
| Комбретастатин | 0.5 | [26] | ||
| Клеточная линия аденокарциномы молочной железы человека SkBr3 | МТТ-тест | (28g) | 0.23 | [27] |
| (28k) | 0.81 | [27] | ||
| (29f) | 9.51 | [28] | ||
| (29d) | 11.09 | [28] | ||
| транс-Ресвератрол | 41.42 | [27] | ||
| цис-Ресвератрол | 41.22 | [28] | ||
| Клеточная линия Т-клеточного лейкоза человека Jurkat | МТТ-тест | (26o) | 0.003 | [25] |
| (26l) | 0.005 | [25] | ||
| (26h) | 0.05 | [25] | ||
| (26k) | 0.05 | [25] | ||
| (25g) | 0.093 | [25] | ||
| (26g) | 0.3 | [25] | ||
| (26p) | 0.65 | [25] | ||
| Комбретастатин | 0.005 | [25] | ||
| Клеточная линия промиелоцитарного лейкоза человека HL60 | МТТ-тест | (27j) | 0.00005 | [26] |
| (27r) | 0.0001 | [26] | ||
| (27q) | 0.0002 | [26] | ||
| (27k) | 0.0002 | [26] | ||
| (27m) | 0.0009 | [26] | ||
| (26o) | 0.003 | [25] | ||
| (27l) | 0.0038 | [26] | ||
| (26l) | 0.02 | [25] | ||
| (26g) | 0.09 | [25] | ||
| (21a) | 0.1 | [24] | ||
| (26h) | 0.12 | [25] | ||
| (22a) | 0.25 | [24] | ||
| (24d) | 0.3 | [24] | ||
| (24b) | 0.5 | [24] | ||
| (26k) | 0.5 | [25] | ||
| (26p) | 0.7 | [25] | ||
| (19b) | 0.9 | [24] | ||
| (22b) | 2.0 | [24] | ||
| (21b) | 2.0 | [24] | ||
| (27n) | 4.6 | [26] | ||
| (23b) | 5.0 | [24] | ||
| (25g) | 6.2 | [25] | ||
| (27i) | 9.7 | [26] | ||
| (20b) | 15 | [24] | ||
| Комбретастатин | 0.001 | [25] | ||
| транс-Ресвератрол | 5.0 | [30] | ||
| цис-Ресвератрол | 42 | [30] | ||
| Клеточная линия промиелоцитарного лейкоза человека с множественной лекарственной устойчивостью HL60R | МТТ-тест | (22a) | 0.75 | [24] |
| (21a) | 0.25 | [24] | ||
| (19b) | 1.0 | [24] | ||
| транс-Ресвератрол | 60 | [31] | ||
| Клеточная линия хронического миелогенного лейкоза человека K562 | МТТ-тест | (26o) | 0.02 | [25] |
| (26l) | 0.02 | [25] | ||
| (26k) | 0.34 | [25] | ||
| (26p) | 0.8 | [25] | ||
| (26h) | 0.95 | [25] | ||
| Комбретастатин | 0.005 | [25] | ||
| транс-Ресвератрол | 28.0 | [31] | ||
| Клеточная линия хронического миелогенного лейкоза человека K562/Adr, устойчивая к адриамицину | МТТ-тест | (22a) | 0.5 | [24] |
| (21a) | 0.5 | [24] | ||
| Клеточная линия рака легких (карцинома) человека A549 | МТТ-тест | (26o) | 0.01 | [25] |
| (26l) | 0.1 | [25] | ||
| (26h) | 0.52 | [25] | ||
| (26k) | 0.8 | [25] | ||
| (26g) | 1.1 | [25] | ||
| Комбретастатин | 0.18 | [25] | ||
| транс-Ресвератрол | 119.6 | [32] | ||
| Клеточная линия эмбриональной карциномы яичек человека 1411HP, чувствительная к цисплатину | SRB-тест | (27r) | 0.022 | [26] |
| (27q) | 0.03 | [26] | ||
| Комбретастатин | Неактивен | [26] | ||
| Клеточная линия эмбриональной карциномы яичек человека 1411HP, устойчивая к цисплатину | SRB-тест | (27r) | 0.054 | [26] |
| (27q) | 0.06 | [26] | ||
| Комбретастатин | Неактивен | [26] | ||
| Клеточная линия эпителиомы шейки матки человека HeLa | МТТ-тест | (26o) | 0.006 | [25] |
| (26l) | 0.015 | [25] | ||
| (26k) | 0.15 | [25] | ||
| (26g) | 0.25 | [25] | ||
| (26h) | 0.28 | [25] | ||
| (26p) | 0.6 | [25] | ||
| Комбретастатин | 0.004 | [25] | ||
| транс-Ресвератрол | 47.9 | [33] | ||
| Клеточная линия эндоцервикальной аденокарциномы человека KB-V1, устойчивая к винбластину | МТТ-тест | (27l) | 0.00005 | [26] |
| (27s) | 0.3 | [26] | ||
| (27r) | 0.2 | [26] | ||
| (27q) | 0.4 | [26] | ||
| Комбретастатин | 0.0004 | [26] | ||
| Клеточная линия аденокарциномы толстой кишки человека HT29 | МТТ-тест | (27r) | 0.00002 | [26] |
| (27q) | 0.00006 | [26] | ||
| (27j) | 0.0002 | [26] | ||
| (27k) | 0.0043 | [26] | ||
| (27l) | 0.057 | [26] | ||
| (27s) | 0.064 | [26] | ||
| (27i) | 0.51 | [26] | ||
| (27h) | 0.53 | [26] | ||
| Комбретастатин транс-Ресвератрол |
3.6 27 | [26] [34] |
||
| Клеточная линия меланомы человека 518A2 | МТТ-тест | (27l) | 0.002 | [26] |
| (27r) | 0.0064 | [26] | ||
| (27q) | 0.062 | [26] | ||
| (27i) | 0.066 | [26] | ||
| (27m) | 0.11 | [26] | ||
| (27h) | 0.4 | [26] | ||
| (27k) | 0.86 | [26] | ||
| (27j) | 2.3 | [26] | ||
| (27n) | 2.8 | [26] | ||
| Комбретастатин | 0.018 | [26] | ||
| SRB-тест | транс-Ресвератрол | 30.0 | [35] | |
| Головной мозг крупного рогатого скота | Оценка подавления полимеризации тубулина методом турбидиметрии | (26l) | 0.76 | [25] |
| (26o) | 1.5 | [25] | ||
| (26h) | 2.3 | [25] | ||
| (26k) | 3.6 | [25] | ||
| (26g) | 3.9 | [25] | ||
| (26p) | 5.1 | [25] | ||
| (25g) | 16.0 | [25] | ||
| Комбретастатин | 1.2 | [25] |
Таблица 2.
Другие виды биологической активности гетероциклических аналогов ресвератрола
| Объект исследования |
Метод исследования | Соединение | Активность | Ссылка | |
|---|---|---|---|---|---|
| параметр | значение | ||||
| Противовоспалительная активность | |||||
| Клеточная линия мыши RAW264.7 | Оценка ингибирования LPS-индуцированной продукции NO по методу Грисса | (7ll) | IC50, мкМ | 13.5 | [14] |
| (7ff) | 23.27 | [14] | |||
| (7l) | 30.0 | [14] | |||
| (9n) | 45.3 | [14] | |||
| (10i) | 47.8 | [15] | |||
| транс-Ресвератрол | 30.71 | [14] | |||
| Противовирусная активность | |||||
| Инфицированные ВИЧ-1 клетки человека U373-MAGI, экспрессирующие CXCR4 | Анализ однократной репликации | (30d) | EC50, мкМ | 34.4 | [29] |
| (30c) | 35.0 | [29] | |||
| (31d) | 45.1 | [29] | |||
| транс-Ресвератрол | 21.4 | [29] | |||
| Вазорелаксирующая активность | |||||
| Кольца аорты крыс линии Wistar | Оценка снижения тонуса гладкомышечных клеток кольца аорты, вызванного KCl | (14e) | IC50, мкМ | 12.0226 | [19] |
| (14h) | 12.5892 | [19] | |||
| (12b) | 15.4882 | [19] | |||
| (14f) | 15.4882 | [19] | |||
| (13b) | 15.8489 | [19] | |||
| транс-Ресвератрол | 6.91831 | [19] | |||
| Активация хинонредуктазы 1 | |||||
| Клеточная линия мыши Hepa-1c1c7 | МТТ-тест | (7p) | CD, мкМ | 0.059 | [14] |
| (10d) | 0.06 | [15] | |||
| (10e) | 0.08 | [15] | |||
| (9o) | 0.087 | [16] | |||
| (9n) | 0.117 | [16] | |||
| (9e) | 0.143 | [16] | |||
| (9b) | 0.192 | [16] | |||
| (9f) | 0.25 | [16] | |||
| (9a) | 0.32 | [16] | |||
| (9c) | 0.36 | [16] | |||
| (9k) | 0.39 | [16] | |||
| (9j) | 0.39 | [16] | |||
| (7r) | 0.44 | [14] | |||
| (7z) | 0.47 | [14] | |||
| (7bb) | 0.54 | [14] | |||
| (7aa) | 0.57 | [14] | |||
| (9d) | 0.59 | [16] | |||
| (7jj) | 0.98 | [14] | |||
| (9r) | 1.1 | [16] | |||
| (7j) | 1.72 | [14] | |||
| (7h) | 1.73 | [14] | |||
| (7o) | 1.8 | [14] | |||
| (9s) | 1.98 | [16] | |||
| (7q) | 2.0 | [14] | |||
| (7e) | 2.07 | [14] | |||
| (7a) | 2.1 | [14] | |||
| (7t) | 2.1 | [14] | |||
| Клеточная линия мыши Hepa-1c1c7 | МТТ-тест | (7a) | CD, мкМ | 2.1 | [14] |
| (9g) | 2.47 | [16] | |||
| (7m) | 3.1 | [14] | |||
| (7d) | 4.0 | [14] | |||
| (7w) | 4.0 | [14] | |||
| (7s) | 4.0 | [14] | |||
| (7ii) | 4.04 | [14] | |||
| (7n) | 4.9 | [14] | |||
| (7dd) | 5.23 | [14] | |||
| (9u) | 5.52 | [16] | |||
| (9l) | 9.61 | [16] | |||
| (7f) | 16.0 | [14] | |||
| (7y) | 16.0 | [14] | |||
| (7u) | 18.2 | [14] | |||
| (10j) | 20.1 | [15] | |||
| (9t) | 20.3 | [16] | |||
| транс-Ресвератрол | 21.0 | [14] | |||
| Клеточная линия мыши BPrc1с | МТТ-тест | (9k) | CD, мкМ | 2.4 | [16] |
| (7aa) | 2.8 | [14] | |||
| (7z) | 4.4 | [14] | |||
| (9h) | 6.1 | [16] | |||
| (7p) | 6.5 | [14] | |||
| (9g) | 6.8 | [16] | |||
| (7bb) | 8.1 | [14] | |||
| (9j) | 9.2 | [16] | |||
| (9s) | 12.6 | [16] | |||
| (9u) | 16.3 | [16] | |||
| (7j) | 34.6 | [14] | |||
| (9c) | 35.7 | [16] | |||
| (7w) | 38.2 | [14] | |||
| (7u) | 44.5 | [14] | |||
| (7a) | 49.7 | [14] | |||
| цис-Ресвератрол | 49.7 | [14] | |||
| Клеточная линия мыши Hepa, мутантная по TAOc1с | МТТ-тест | (9k) | CD, мкМ | 0.63 | [16] |
| (7z) | 2.0 | [14] | |||
| (7p) | 2.5 | [14] | |||
| (9s) | 2.7 | [16] | |||
| (7r) | 3.8 | [14] | |||
| (9h) | 5.6 | [16] | |||
| (9g) | 5.9 | [16] | |||
| (7bb) | 6.3 | [14] | |||
| (9j) | 7.8 | [16] | |||
| (9u) | 13.4 | [16] | |||
| (7a) | 18.6 | [14] | |||
| (9c) | 33.9 | [16] | |||
| (7u) | 41 | [14] | |||
| (7j) | 44.3 | [14] | |||
| (7w) | 48.7 | [14] | |||
| Ингибирование ароматазы | |||||
| Ароматаза человека (дибензилфлуоресцеин в качестве субстрата) | Флуориметрия | (10g) | IC50, мкМ | 0.004 | [15] |
| (10i) | 0.023 | [15] | |||
| (10h) | 0.078 | [15] | |||
| (10m) | 0.164 | [15] | |||
| (7b) | 0.2 | [14] | |||
| (10a) | 0.59 | [15] | |||
| (7c) | 0.8 | [14] | |||
| (10k) | 0.9 | [15] | |||
| (10l) | 1.04 | [15] | |||
| (10c) | 1.36 | [15] | |||
| (10j) | 2.39 | [15] | |||
| (10d) | 2.68 | [15] | |||
| (10m) | 6.73 | [15] | |||
| (10d) | 7.41 | [15] | |||
| (10f) | 7.92 | [15] | |||
| (10b) | 14.9 | [15] | |||
| (10e) | 18 | [15] | |||
| транс-Ресвератрол | 25 | [15] | |||
| Ингибирование TNF-α-индуцированной активации NF-κB | |||||
| Эмбриональная клеточная линия почек человека HEK 293 | Анализ экспрессии репортерного гена люциферазы | (7ii) | IC50, мкМ | 0.4 | [13] |
| (7s) | 0.8 | [13] | |||
| (10g) | 2.55 | [15] | |||
| (9e) | 2.7 | [16] | |||
| (10c) | 10.35 | [15] | |||
| транс-Ресвератрол | 0.98 | [13] | |||
Список литературы
Семенов А.В., Семенова Е.В., Балакирева О.И. // Биоорг. химия. 2021. Т. 47. С. 111–128. [Semenov A.V., Semenova E.V., Balakireva O.I. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 134–148.] https://doi.org/10.1134/S1068162021010210
Shaito A., Posadino A.M., Younes N., Hasan H., Halabi S., Alhababi D., Al-Mohannadi A., Abdel-Rahman W.M., Eid A.H., Nasrallah G.K., Pintus G. // Int. J. Mol. Sci. 2020. V. 21. P. 2084–2109. https://doi.org/10.3390/ijms21062084
Ruivo J., Francisco C., Oliveira R., Figueiras A. // Braz. J. Pharm. Sci. 2015. V. 51. P. 499–514. https://doi.org/10.1590/S1984-82502015000300002
Wang F., Chatterjee S. // J. Phys. Chem. B. 2017. V. 121. P. 4745–4755. https://doi.org/10.1021/acs.jpcb.7b02115
Tosato M.G., Vicendo P., Thomas A.H., Lorente C. // J. Photochem. Photobiol. A Chem. 2018. V. 367. P. 327–331. https://doi.org/10.1016/j.jphotochem.2018.08.050
Zupančič Š., Lavrič Z., Kristl J. // Eur. J. Pharm. Biopharm. 2015. V. 93. P. 196–204. https://doi.org/10.1016/j.ejpb.2015.04.002
Nieoczym D., Socala K., Gawel K., Esquerra C.V., Wyska E., Wlaź P. // Neurochem. Res. 2019. V. 44. P. 1043–1055. https://doi.org/10.1007/s11064-019-02735-2
Martínez-Márquez A., Morante-Carriel J.A., Ramírez-Estrada K., Cusidó R.M., Palazon J., Bru-Martínez R. // Plant Biotech. J. 2016. V. 14. P. 1813–1825. https://doi.org/10.1111/pbi.12539
Lizard G., Latruffe N., Vervandier-Fasseur D. // Molecules. 2020. V. 25. P. 605–618. https://doi.org/10.3390/molecules25030605
Pagliai F., Pirali T., Del Grosso E., Di Brisco R., Tron G.C., Sorba G., Genazzani A.A. // J. Med. Chem. 2006. V. 49. P. 467–470. https://doi.org/10.1021/jm051118z
Nagaradja E., Bentabed-Ababsa G., Scalabrini M., Chevallier F., Phillipot S., Fontanay S., Duval R.E., Halauko Y.S., Ivashkevich O.A., Matulis V.E., Roisnel T., Mongin F. // Bioorg. Med. Chem. 2015. V. 23. P. 6355–6363. https://doi.org/10.1016/j.bmc.2015.08.031
Bellina F., Guazzelli N., Lessi M., Manzini C. // Tetrahedron. 2015. V. 71. P. 2298–2305. https://doi.org/10.1016/j.tet.2015.02.024
Vergara D., De Domenico S., Tinelli A., Stanca E., del Mercato L.L., Giudetti A.M., Simeone P., Guazzelli N., Lessi M., Manzini C., Santino A., Bellina F., Maffia M. // Mol. BioSyst. 2017. V. 13. P. 1131–1141. https://doi.org/10.1039/C7MB00128B
Mayhoub A.S., Marler L., Kondratyuk T.P., Park E.-J., Pezzuto J.M., Cushman M. // Bioorg. Med. Chem. 2012. V. 20. P. 510–520. https://doi.org/10.1016/j.bmc.2011.09.031
Mayhoub A.S., Marler L., Kondratyuk T.P., Park E.-J., Pezzuto J.M., Cushman M. // Bioorg. Med. Chem. 2012. V. 20. P. 2427–2434. https://doi.org/10.1016/j.bmc.2012.01.047
Mayhoub A.S., Marler L., Kondratyuk T.P., Park E.-J., Pezzuto J.M., Cushman M. // Bioorg. Med. Chem. 2012. V. 20. P. 7030–7039. https://doi.org/10.1016/j.bmc.2012.10.006
Ogas T., Kondratyuk T.P., Pezzuto J.M. // Ann. N.Y. Acad. Sci. 2013. V. 1290. P. 21–29. https://doi.org/10.1111/nyas.12196#
Gobec M., Tomašič T., Markovič T., Mlinarič-Raščan I., Dolenc M.S., Jakopin Ž. // Chemico-Biological Interactions. 2015. V. 240. P. 200–207. https://doi.org/10.1016/j.cbi.2015.08.018
Bertini S., Calderone V., Carboni I., Maffei R., Martelli A., Martinelli A., Minutolo F., Rajabi M., Testai L., Tuccinardi T., Ghidoni R., Macchia M. // Bioorg. Med. Chem. 2010. V. 18. P. 6715–6724. https://doi.org/10.1016/j.bmc.2010.07.059
Chen P.-C., Tsai W.-J., Ueng Y.-F., Tzeng T.-T., Chen H.-L., Zhu P.-R., Huang C.-H., Shiao Y.-J., Li W.-T. // J. Med. Chem. 2017. V. 60. P. 4062−4073. https://doi.org/10.1021/acs.jmedchem.7b00376
Tanini D., Panzella L., Amorati R., Capperucci A., Pizzo E., Napolitano A., Menichettia S., d’Ischia M. // Org. Biomol. Chem. 2015. V. 13. P. 5757–5764. https://doi.org/10.1039/C5OB00193E
Farinha D.F. // Selenium-containing polyphenols: antioxidant properties / Dissertação para obtenção do Grau de Mestre em Química Bioorgânica. Outubro. 2016. 53 p. http://hdl.handle.net/10362/21502
Roberti M., Pizzirani D., Simoni D., Rondanin R., Baruchello R., Bonora C., Buscemi F., Grimaudo S., Tolomeo M. // J. Med. Chem. 2003. V. 46. P. 3546–3554. https://doi.org/10.1021/jm030785u
Simoni D., Grisolia G., Giannini G., Roberti M., Rondanin R., Piccagli L., Baruchello R., Rossi M., Romagnoli R., Invidiata F.P., Grimaudo S., Jung M.K., Hamel E., Gebbia N., Crosta L., Abbadessa V., Di Cristina A., Dusonchet L., Meli M., Tolomeo M. // J. Med. Chem. 2005. V. 48. P. 723–736. https://doi.org/10.1021/jm049622b
Romagnoli R., Baraldi P.G., Cruz-Lopez O., Cara C.L., Carrion M.D., Brancale A., Hamel E., Chen L., Bortolozzi R., Basso G., Viola G. // J. Med. Chem. 2010. V. 53. P. 4248–4258. https://doi.org/10.1021/jm100245q
Schobert R., Biersack B., Dietrich A., Effenberger K., Knauer S., Mueller T. // J. Med. Chem. 2010. V. 53. 6595–6602. https://doi.org/10.1021/jm100345r
Sala M., Chimento A., Saturnino C., Gomez-Monterrey I.M., Musella S., Bertamino A., Milite C., Sinicropi M.S., Caruso A., Sirianni R., Tortorella P., Novellino E., Campiglia P., Pezzi V. // Bioorg. Med. Chem. Lett. 2013. V. 23. P. 4990–4995. https://doi.org/10.1016/j.bmcl.2013.06.051
Chimento A., Sala M., Gomez-Monterrey I.M., Musella S., Bertamino A., Caruso A., Sinicropi M.S., Sirianni R., Puoci F., Parisi O.I., Campana C., Martire E., Novellino E., Saturnino C., Campiglia P., Pezzi V. // Bioorg. Med. Chem. Lett. 2013. V. 23. P. 6401–6405. https://doi.org/10.1016/j.bmcl.2013.09.054
Clouser C.L., Chauhan J., Bess M.A., van Oploo J.L., Zhou D., Dimick-Gray S., Mansky L.M., Patterson S.E. // Bioorg. Med. Chem. Lett. 2012. V. 22. P. 6642–6646. https://doi.org/10.1016/j.bmcl.2012.08.108
Roberti M., Pizzirani D., Simoni D., Rondanin R., Baruchello R., Bonora C., Buscemi F., Grimaudo S., Tolomeo M. // J. Med. Chem. 2003. V. 46. P. 3546–3554. https://doi.org/10.1021/jm030785u
Roberti M., Pizzirani D., Recanatini M., Simoni D., Grimaudo S., Di Cristina A., Abbadessa V., Gebbia N., Tolomeo M. // J. Med. Chem. 2006. V. 49. P. 3012–3018. https://doi.org/10.1021/jm060253o
Yang J., Liu G.-Y., Dai F., Cao X.-Y., Kang Y.-F., Hu L.-M., Tang J.-J., Li X.-Z., Li Y., Jin X.-L., Zhou B. // Bioorg. Med. Chem. Lett. 2011. V. 21 P. 6420–6425. https://doi.org/10.1016/j.bmcl.2011.08.090
Yan J., Guo Y., Wang Y., Mao F., Huang L., Li X. // Eur. J. Med. Chem. 2015. V. 95. P. 220–229. https://doi.org/10.1016/j.ejmech.2015.03.030
Estrela J.M., Mena S., Obrador E., Benlloch M., Castellano G., Salvador R., Dellinger R.W. // J. Med. Chem. 2017. V. 60. P. 9413−9436. https://doi.org/10.1021/acs.jmedchem.6b01026
Csuk R., Albert S., Siewert B., Schwarz S. // Eur. J. Med. Chem. 2012. V. 54. P. 669–678. https://doi.org/10.1016/j.ejmech.2012.06.015
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия