Биоорганическая химия, 2022, T. 48, № 3, стр. 340-351
Ацильномодифицированные водорастворимые производные хитозана – носители для адсорбционной иммобилизации папаина
А. В. Сорокин 1, 2, С. С. Ольшанникова 1, Н. В. Малыхина 1, Ф. А. Сакибаев 1, М. Г. Холявка 1, 3, *, М. С. Лавлинская 1, 2, В. Г. Артюхов 1
1 Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
2 Воронежский государственный университет инженерных технологий
394036 Воронеж, просп. Революции, 19, Россия
3 Севастопольский государственный университет
299053 Севастополь, ул. Университетская, 33, Россия
* E-mail: holyavka@rambler.ru
Поступила в редакцию 29.05.2021
После доработки 10.06.2021
Принята к публикации 18.06.2021
- EDN: SZJDMT
- DOI: 10.31857/S013234232202021X
Аннотация
Кислотным гидролизом в 0.1 М водном растворе соляной кислоты получены образцы хитозана с различными величинами молекулярных масс – 350 и 200 кДа, определенными вискозиметрическим методом. Из полученных образцов синтезированы целевые производные N-сукциноилхитозана и N-малеоилхитозана, структура которых подтверждена методом ИК-спектроскопии, а степени замещения рассчитаны на основе титриметрических данных. Осуществлена адсорбционная иммобилизация папаина на хитозане и его производных. Оптимальное соотношение содержания белка (мг/г носителя), общей активности (ед./мл раствора) и удельной активности (ед./мг белка) выявлено при иммобилизации папаина на матрице хитозана и N-сукциноилхитозана с молекулярной массой 200 кДа.
ВВЕДЕНИЕ
Хитозан – один из самых распространенных полисахаридов, представляющий собой линейный сополимер D-глюкозамина и N-ацетил-D-глюкозамина, соединенных между собой 1,4-β-гликозидными связями. За счет наличия свободной первичной аминогруппы он проявляет свойства поликатиона [1] и способен к взаимодействию с различными органическими и неорганическими соединениями. Благодаря этому хитозан находит широкое применение в различных областях деятельности человека: в создании гибридных гидрогелей и суперабсорбентов для сельского хозяйства и гигиенической промышленности [1–4], в биомедицинских целях для разработки систем доставки биологически активных веществ и новых форм лекарственных препаратов, в тканевой инженерии [5–8] и т.д.
Для расширения возможностей применения хитозана целесообразно проводить его химическую модификацию. Хорошо известно, что макромолекулы поли-β-гликозидов связаны большим количеством внутри- и межмолекулярных водородных связей, образующихся между гидроксильными и аминогруппами пиранозных колец [9]. Это сказывается на их способности растворяться в воде: хитозаны с Mr > 10 000 растворимы только в кислых средах с рН < 6.5 [10]. Введение же функциональных групп, блокирующих центры образования водородных связей, позволяет повысить рН-диапазон растворимости этого полимера. Кроме того, введение новых групп может увеличить конъюгирующую способность или биологическую активность. Например, введение в макромолекулы остатков янтарной кислоты усиливает антибактериальные свойства хитозана [11].
Перспективно использование хитозана и его производных в качестве матриц для адсорбционной иммобилизации ферментов. Создание иммобилизованных форм энзимов позволяет расширить оптимумы каталитической активности последних, а также защитить их от негативного воздействия окружающей среды [12–15]. Однако из-за ограниченной способности хитозана к растворению в водных средах процесс иммобилизации белков может протекать недостаточно полно ввиду стерической недоступности функциональных групп полисахаридных макромолекул, а также несовпадения значений рН растворов, требуемых для растворения полисахарида, с рН-оптимумами ферментов. Поэтому использование водорастворимых производных хитозана, сочетающих в себе нетоксичность и биосовместимость природного полимера с увеличенной способностью к растворению в воде, позволит создать более эффективные формы иммобилизованных ферментных препаратов.
Папаин – растительный фермент, получаемый из плодов папайи Carica papaya. Это глобулярный белок, состоящий из 212 а.о., с молекулярной массой 23 кДа. Папаин – цистеиновая протеаза, он стабилен в широком диапазоне условий, даже при высоких температурах, обладает терапевтическими свойствами, такими как антибактериальное, антиоксидантное и противоопухолевое действие. Кроме того, папаин может защищать клетки от повреждений, вызванных H2O2 [16].
Применение ферментов (в том числе, папаина) в свободной форме затруднено по ряду причин, к которым можно отнести трудоемкость их отделения от исходных реагентов и продуктов реакции после завершения процесса, неустойчивость (лабильность) энзимов к окружающим факторам, а также при различных внешних воздействиях, трудоемкость их очистки.
Иммобилизация ферментов на твердых носителях поможет преодолеть эти недостатки за счет повышения стабильности по сравнению со свободной формой энзима. Температура, pH и используемый растворитель – важные факторы, которые напрямую влияют на структуру фермента. Эти факторы следует оптимизировать в процессе иммобилизации. Иммобилизованный фермент имеет более жесткую молекулярную структуру, менее подвержен конформационным изменениям и иногда характеризуется более высокой доступностью активного центра для биокатализа. Кроме того, активность фермента может увеличиваться после иммобилизации за счет изменения конформации фермента [17].
Цель настоящей работы – синтез водорастворимых производных хитозана – N-малеоилхитозана и N-сукциноилхитозана – c различными молекулярными массами для дальнейшего использования в качестве матриц для адсорбционной иммобилизации папаина.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
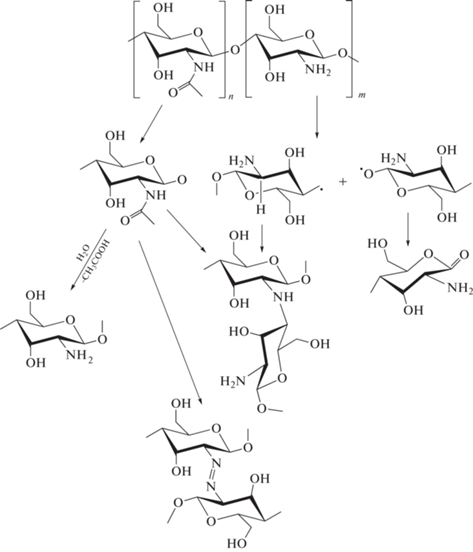
Молекулярная масса полимера – одна из ключевых характеристик, определяющих его физико-химические и биологические свойства, такие как способность к растворению, токсичность, конъюгирующая способность и др. Например, в работе Kuznetsov et al. [18] показано, что снижение молекулярной массы полимеров, используемых в качестве экстрагентов аминокислот, приводит к повышению количественных характеристик экстракции ввиду увеличения стерической доступности функциональных групп, участвующих в процессе связывания целевых компонентов. В связи с этим первым этапом настоящего исследования было получение хитозанов с различными молекулярными массами. Наиболее доступный в лабораторных условиях способ влияния на величину молекулярной массы полисахаридов – кислотный гидролиз. В литературе имеются данные об использовании уксусной, азотной, серной и соляной кислот для гидролиза полисахаридных молекул [18–20]. Однако азотная кислота, как мощный окислитель, может вызвать ряд побочных процессов; серная кислота – двухосновная, поэтому ее использование может привести к сшивке макромолекул хитозана; процесс деструкции полисахаридов в слабой уксусной кислоте протекает с невысокой скоростью; в связи с чем для деструкции хитозана мы использовали соляную кислоту. Механизм возможных при деструкции полисахарида процессов представлен на рис. 1 [21, 22].
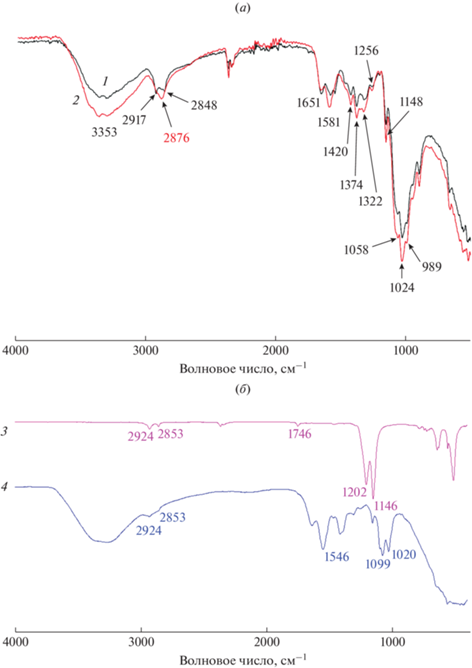
Для того чтобы подтвердить структуру образовавшегося в процессе деструкции вещества, нами был использован метод ИК-спектроскопии с Фурье-преобразованием. ИК-спектр коммерческого хитозана (рис. 2a, кривая 1) содержит полосы поглощения в области 1024–1058 см–1, относящиеся к колебаниям группы С–О–С пиранозного цикла, ряд полос при 1256, 1374, 1420 и в области 1917–2848 см–1, соответствующих деформационным колебаниям метильных и метиленовых групп циклического фрагмента полисахарида, при 1651 см–1 – полоса амид I – валентные колебания группы С=О, при 1581 см–1 – полоса амид II – колебания первичной аминогруппы [21]. Также в спектре присутствует широкая полоса поглощения при 3353 см–1, относящаяся к колебаниям ОН-групп молекул воды, ассоциированных с макромолекулами полимера. В ИК-спектре хитозана, деструктированного кислотным гидролизом под действием раствора соляной кислоты, вышеперечисленные полосы также присутствуют (рис. 2a, кривая 2). Кроме того, в спектре деструктированного полимера появляется новая низкоинтенсивная полоса поглощения при 2876 см–1 [22], относящаяся к валентным колебаниям гидрохлоридов первичных аминов.
Рис. 2.
ИК-спектры хитозанов и его производных: 1 – коммерческий хитозан, 2 – деструктированный хитозан, 3 – N‑малеоилхитозан, 4 – N-сукциноилхитозан.
Молекулярные массы деструктированного хитозана, рассчитанные по уравнению Марка–Куна–Хаувинка–Сакурады, с учетом величин констант K и α, взятых из литературных данных, составили 350 и 200 кДа. Известно [22], что растворимость хитозана в воде зависит от величины его молекулярной массы. Полученные кислотной деструкцией образцы не растворяются в воде, в связи с чем следующим этапом работы был синтез водорастворимых производных хитозана из полученных полимеров.
Для получения водорастворимых производных хитозана была осуществлена модификация полисахарида ангидридами янтарной и малеиновой кислот. Выбор ацилирующих агентов обусловлен тем, что янтарная кислота и ее производные играют важную роль в метаболизме клетки, а также они нетоксичны для организма человека и животных. Малеиновая кислота – аналог янтарной, однако содержит кратную связь между атомами С-2 и С-3, что оказывает влияние на химические свойства соединения. В связи с этим представляет интерес сравнение свойств хитозанов, модифицированных остатками этих кислот, как матриц для иммобилизации папаина. Схема реакции модификации хитозана представлена рис. 3.
Структуры полученных производных подтверждали с помощью ИК-спектроскопии. В ИК-спектре N-малеоилхитозана (рис. 2б, кривая 3) присутствуют характерные для хитозана полосы поглощения, описанные выше, а также появляется новая полоса поглощении при 1746 см–1, соответствующая колебаниям группы карбонила карбоксильных групп, введенных в пиранозный цикл полисахарида. Наличие этой полосы в ИК-спектре, а также способность к растворению в воде подтверждают успешность синтеза производных хитозана.
В ИК-спектре N-сукциноилхитозана (рис. 2б, кривая 4) наблюдается значительное увеличение интенсивности и смещение полос поглощения, соответствующих колебаниям карбонильных (с 1651 до 1632 см–1) и первичных аминогрупп (с 1581 до 1546 см–1), а также появляется новая полоса поглощения при 2924 см–1, относящаяся к колебаниям метиленовых групп остатков янтарной кислоты [23]. Спектральные данные подтверждают образование желаемого продукта реакции, а также присоединение заместителя через аминогруппу хитозана.
Использованные для синтеза реакции относятся к полимераналогичным превращениям, поэтому молекулярные массы синтезированных продуктов не определяли, принимая их равными массам используемых в синтезе полисахаридов.
Степени замещения синтезированных производных хитозана рассчитывали из данных кислотно-основного титрования [24]. Результаты определения приведены в табл. 1. Как видно из представленных данных, с увеличением молекулярной массы модифицированного хитозана уменьшается эффективность замещения, что обусловлено влиянием стерического фактора на доступность функциональных групп макромолекул полисахарида.
Таблица 1.
Степени замещения синтезированных производных хитозана
| № | Полисахарид | Молекулярная масса, кДа | Степень замещения |
|---|---|---|---|
| 1 | N-сукциноилхитозан | 600 | 0.21 |
| 350 | 0.32 | ||
| 200 | 0.45 | ||
| 2 | N-малеоилхитозан | 600 | 0.28 |
| 350 | 0.39 | ||
| 200 | 0.51 |
Для проектирования гетерогенного биокатализатора необходимо понимать механизм взаимодействия носителя с молекулами фермента. Мы изучили типы взаимодействий, энергии связывания, аминокислотный состав поверхностей папаина, которые в процессе адсорбции взаимодействуют с носителем (рис. 4–6). Из рисунков видно, что связи и взаимодействия с хитозаном и его производными образуются с участием активного центра фермента (Cys25 и His159), что, естественно, должно отразиться на активности иммобилизованных образцов. Аффинность связывания папаина с хитозаном составила –6.9, с N‑малеоилхитозаном –8.3, а с N-сукциноилхитозаном –7.6 ккал/моль (табл. 2), что указывает на более высокую степень сродства фермента к N-малеоилхитозану при иммобилизации. Анализ содержания белка в гетерогенных препаратах также показал, что наибольшее количество папаина (мг/г носителя) сорбируется на N-малеоилхитозане с молекулярной массой 350 кДа (рис. 7). Однако при этом фермент, вероятно, находится в каталитически невыгодной конформации, что отрицательно сказывается на его протеолитической активности. Общая активность папаина (ед./мл раствора) оказалась выше при его иммобилизации на хитозане с молекулярными массами 200 и 600 кДа (рис. 8). Наибольшую удельную активность показали образцы, адсорбированные на матрице хитозана и N-сукциноилхитозана с молекулярной массой 200 кДа (рис. 9). В целом же прослеживается следующая закономерность: чем больше образуется связей и взаимодействий с матрицей полимера, тем ниже удельная активность получаемого биокатализатора.
Рис. 4.
Связи и взаимодействия между папаином и хитозаном (пунктирными линиями обозначены водородные связи, длина связей приведена в Å).

Рис. 5.
Связи и взаимодействия между папаином и N-малеоилхитозаном (пунктирными линиями обозначены водородные связи, длина связей приведена в Å).
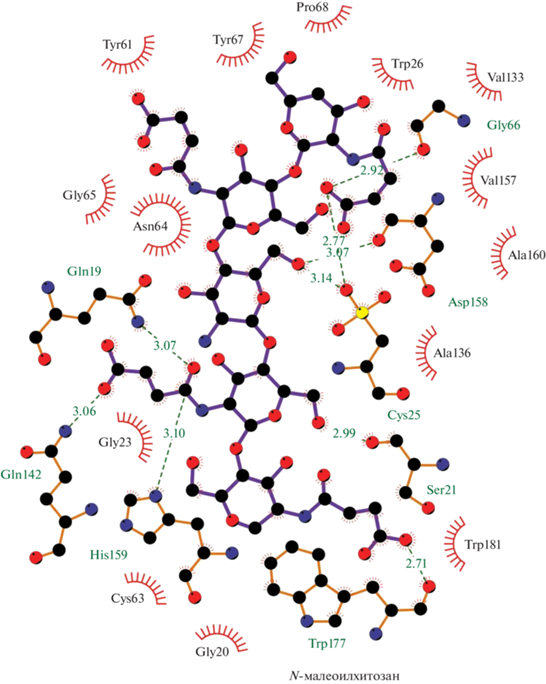
Рис. 6.
Связи и взаимодействия между папаином и N-сукциноилхитозаном (пунктирными линиями обозначены водородные связи, длина связей приведена в Å).
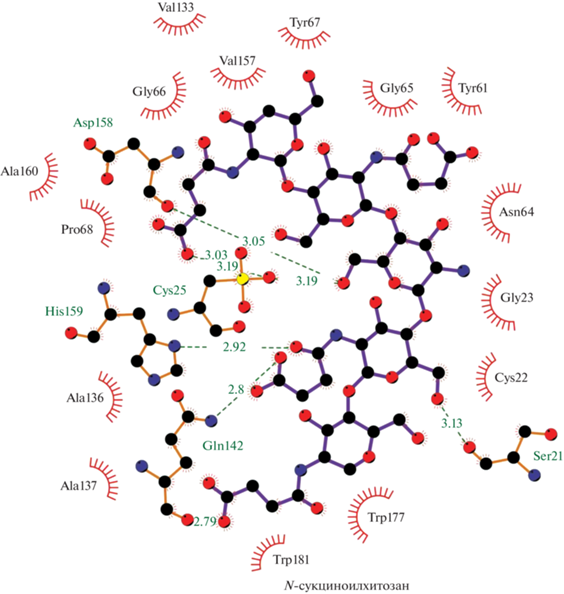
Таблица 2.
Аминокислотные остатки папаина, формирующие связи и взаимодействия с хитозаном и его производными
| Аффиность, ккал/моль | Аминокислотные остатки, формирующие | |
|---|---|---|
| водородные связи, и длина связи | иные типы взаимодействий | |
| 1) Аминокислоты папаина, которые образуют связи и взаимодействия с хитозаном | ||
| −6.9 | Cys25, 2.99 Å Asn64, 2.95 Å Val157, 3.18 Å |
Gln19, Ser21, Cys22, Gly23, Gly65, Gly66, Val157, Asp158, His159, Ala160, Trp177 |
| 2) Аминокислоты папаина, которые образуют связи и взаимодействия с N-малеоилхитозаном | ||
| −8.3 | Gln19, 3.07 Å Ser21, 2.99 Å Cys25, 2.77 Å Gly66, 2.92 Å Gln142, 3.06 Å Asp158, 3.07 Å His159, 3.1 Å Trp177, 2.71 Å |
Gly20, Gly23, Trp26, Tyr61, Cys63, Asn64, Gly65, Tyr67, Pro68, Val133, Ala136, Val157, Ala160 |
| 3) Аминокислоты папаина, которые образуют связи и взаимодействия с N-сукциноилхитозаном | ||
| −7.6 | Ser21, 3.13 Å Cys25, 3.19 Å Gln142, 2.79 Å Asp158, 3.05 Å His159, 2.92 Å |
Cys22, Gly23, Tyr61, Asn64, Gly65, Gly66, Tyr67, Pro68, Val133, Ala136, Ala137, Val157, Ala160, Trp177, Trp181 |
Рис. 7.
Содержание белка (мг/г носителя) в препаратах папаина, иммобилизованного адсорбционным методом на матрице хитозана и его производных.

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использован хитозан из креветочных панцирей со средней молекулярной массой 600 кДа и степенью деацетилирования 0.85 (ООО “Биопрогресс”, Россия). Для получения водорастворимых производных хитозана применяли янтарный и малеиновый ангидриды (оба >98%; Sigma, США). Все реактивы использовали без дополнительной очистки.
Для получения хитозанов с различными молекулярными массами проводили кислотный гидролиз исходного полисахарида. Навеску хитозана массой 1 г растворяли в 100 мл 2%-ного водного раствора уксусной кислоты, после чего переносили раствор в круглодонную колбу, снабженную обратным холодильником, добавляли 50 мл 0.1 М водного раствора НСl и кипятили в течение 10 или 20 мин. Далее смесь охлаждали до комнатной температуры, раствор нейтрализовали водным раствором аммиака до слабощелочного значения рН. Полимер из реакционной массы выделяли осаждением в изопропиловый спирт, после чего промывали дистиллированной водой и этиловым спиртом и сушили в вакуумном сушильном шкафу до постоянной массы.
Молекулярные массы деструктированных хитозанов определяли общепринятым вискозиметрическим методом с помощью вискозиметра Уббелоде (Cannon Instrument Company, США) в смеси водных растворов 0.3 М уксусной кислоты и 0.2 М ацетата натрия при 25°С. Из данных вискозиметрии с помощью уравнения Марка–Куна–Хаувинка–Сакурады вычисляли значения молекулярных масс:
где [η] – характеристическая вязкость (дл/г), рассчитанная из данных вискозиметрии; М – средневязкостная молекулярная масса полимера; K и α – константы, равные 82 × 10–5 дл/г и 0.76 соответственно [25].N-сукциноилхитозан получали по следующей методике. Навеску хитозана массой 2 г растворяли в 200 мл 2%-ного водного раствора уксусной кислоты. Затем растворяли 0.4 г янтарного ангидрида в 25 мл ацетона и вносили по каплям в течение 30 мин в раствор хитозана. Полученную смесь выдерживали 2 ч на водяной бане при 50°С, далее смесь охлаждали до комнатной температуры. Полимер из реакционной массы выделяли осаждением в 4-метил-2-пентанон, после чего промывали этиловым спиртом, отфильтровывали и сушили в вакуумном сушильном шкафу до постоянной массы.
Для синтеза N-малеолилхитозана навеску хитозана массой 1.6 г растворяли в 100 мл 2%-ного водного раствора уксусной кислоты и перемешивали до полного растворения хитозана. Затем растворяли 3 г малеинового ангидрида в 50 мл этилового спирта и вносили в раствор хитозана. Смесь выдерживали 4 ч при комнатной температуре. Полимер из реакционной массы выделяли осаждением в 4-метил-2-пентанон, после чего промывали этиловым спиртом и сушили в вакуумном сушильном шкафу до постоянной массы.
Модификацию хитозанов подтверждали с помощью метода ИК-спектроскопии. ИК-спектры регистрировали в диапазоне частот 4000–400 см–1 на спектрометре Bruker Vertex 70 с Фурье-преобразователем (Bruker Optics, Германия) методом нарушенного полного внутреннего отражения.
Степень замещения полученных полимеров определяли титриметрически согласно методике, представленной в работе Kasaai [26].
Иммобилизацию папаина на матрице хитозана и его производных осуществляли адсорбционным методом. К 1 г хитозана добавляли 20 мл раствора фермента (в концентрации 2 мг/мл в глициновом буфере, рН 9.0), инкубировали в течение 2 ч. После окончания инкубации образовавшийся осадок (в виде геля) промывали 50 мМ Tris-HCl-буфером (pH 7.5) до отсутствия в промывных водах белка (контроль осуществляли на спектрофотометре СФ-2000 (ОКБ “Спектр”, Россия) при λ = 280 нм).
Содержание белка в иммобилизованных препаратах папаина определяли методом Лоури [27]. Определение протеолитической активности фермента проводили на субстрате азоказеине (Sigma, США) [28]. К 50 мг образца добавляли 200 мкл Tris-HCl-буфера, pH 7.5, 800 мкл азоказеина (0.5% в 50 мМ Tris-HCl-буфере, pH 7.5) и инкубировали 2 ч при 37°C. Далее добавляли 800 мкл ТХУ (5%), инкубировали 10 мин при 4°C, затем центрифугировали в течение 3 мин при 13 000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3%-ного NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1-см кювете на спектрофотометре СФ-2000. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл Tris-HCl-буфера. За единицу каталитической активности принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин.
Удельную протеолитическую активность папаина (ед./мг) рассчитывали по формуле:
где А – протеолитическая активность, мкМ/мин на 1 мг белка; D – оптическая плотность при 410 нм; 1000 – пересчет в мкМ; 120 – время инкубации, мин; 200 – объем пробы, мкл; С – концентрация белка в пробе, мг/мл, измеренная по методу Лоури.Статистическую значимость различий величин контрольных и опытных показателей определяли по t-критерию Стьюдента (при p < 0.05), поскольку все показатели характеризовались нормальным распределением.
ЗАКЛЮЧЕНИЕ
Были синтезированы производные N-сукциноилхитозана и N-малеоилхитозана с молекулярными массами 200, 350 и 600 кДа. Структура полученных производных подтверждена методом ИК-спектроскопии. Осуществлена адсорбционная иммобилизация папаина на хитозане и его производных. In silico изучены типы взаимодействий, энергии связывания, аминокислотный состав поверхностей папаина, которые в процессе адсорбции взаимодействуют с носителем. Выявлена следующая закономерность: чем больше образуется связей и взаимодействий с матрицей полимера, тем ниже удельная активность получаемого биокатализатора. Установлено, что оптимальное соотношение содержания белка (мг/г носителя), общей активности (ед./мл раствора) и удельной активности (ед./мг белка) наблюдается при иммобилизации папаина на матрице хитозана и N-сукциноилхитозана с молекулярной массой 200 кДа.
Полученные результаты могут быть полезны при разработке промышленных катализаторов и медицинских препаратов на основе иммобилизованного папаина.
Список литературы
Ravishankar K., Dhamodharan R. // Reactive and Functional Polymers. 2020. V. 149. P. 104517. https://doi.org/10.1016/j.reactfunctpolym.2020.104517
Qureshi M.A., Nishat N., Jadoun S., Ansari M.Z. // Carbohydrate Polymer Technologies and Applications. 2020. V. 1. P. 100014. https://doi.org/10.1016/j.carpta.2020.100014
Sanchez-Salvador J.L., Balea A., Concepcion Monte M., Negro C., Blanco A. // Int. J. Biol. Macromol. 2021. V. 178. P. 325–343. https://doi.org/10.1016/j.ijbiomac.2021.02.200
Rizwan M., Gilani S.R., Durani A.I., Naseem S. // J. Adv. Res. 2021. V. 33. P. 15–40. https://doi.org/10.1016/j.jare.2021.03.007
Pellá M.C.G., Lima-Tenório M.K., Tenório-Neto E.T., Guilherme M.R., Muniz E.C., Rubira A.F. // Carbohydr. Polym. 2018. V. 196. P. 233–245. https://doi.org/10.1016/j.carbpol.2018.05.033
Peers S., Montembault A., Ladavière C. // J. Control. Release. 2020. V. 326. P. 150–163. https://doi.org/10.1016/j.jconrel.2020.06.012
Qu B., Luo Y. // Int. J. Biol. Macromol. 2020. V. 152. P. 437–448. https://doi.org/10.1016/j.ijbiomac.2020.02.240
Pita-López M.L., Fletes-Vargas G., Espinosa-Andrews H., Rodríguez-Rodríguez R. // Eur. Polym. J. 2021. V. 145. P. 110176. https://doi.org/10.1016/j.eurpolymj.2020.110176
Jiang T., James R., Kumbar S.G., Laurencin C.T. // Natural and Synthetic Biomedical Polymers / Eds. Kumbar S.G., Laurencin C.T., Deng M. Amsterdam: Elsevier Science, 2014. P. 91–113. https://doi.org/10.1016/b978-0-12-396983-5.00005-3
Akpan E.I., Gbenebor O.P., Adeosun S.O., Cletus O. // Handbook of Chitin and Chitosan / Eds. Gopi S., Thomas S., Pius A. Amsterdam: Elsevier Science, 2020. P. 131–164. https://doi.org/10.1016/b978-0-12-817970-3.00005-5
Niu X., Zhu L., Xi L., Guo L., Wang H. // Food Control. 2019. V. 108. P. 106829. https://doi.org/10.1016/j.foodcont.2019.106829
Holyavka M.G., Evstigneev M.P., Artyukhov V.G., Savin V.V. // J. Mol. Catalysis B: Enzymatic. 2016. V. 129. P. 1–5. https://doi.org/10.1016/j.molcatb.2016.03.006
Holyavka M.G., Kayumov A.R., Baydamshina D.R., Koroleva V.A., Trizna E.Y., Trushin M.V., Artyukhov V.G. // Int. J. Biol. Macromol. 2018. V. 115. P. 829–834. https://doi.org/10.1016/j.ijbiomac.2018.04.107
Holyavka M.G., Kondratyev M.S., Lukin A.N., Agapov B.L., Artyukhov V.G. // Int. J. Biol. Macromol. 2019. V. 138. P. 681–692. https://doi.org/10.1016/j.ijbiomac.2019.07.132
Holyavka M., Faizullin D., Koroleva V., Olshannikova S., Zakhartchenko N., Zuev Yu., Kondratyev M., Zakharova E., Artyukhov V. // Int. J. Biol. Macromol. 2021. V. 180. P. 161–176. https://doi.org/10.1016/j.ijbiomac.2021.03.016
Jain J. // Int. J. Engineering Appl. Sci. Technol. 2020. V. 5. P. 193–197.
Vasconcelos N.F., Cunha A.P., Ricardo N.M.P.S., Freire R.S., de Araújo Pinto Vieira L., Brígida A.I.S., de Fátima Borges M., de Freitas Rosa M., Vieira R.S., Andrade F.K. // Int. J. Biol. Macromol. 2020. V. 165. P. 3065–3077. https://doi.org/10.1016/j.ijbiomac.2020.10.200
Kuznetsov V.A., Lavlinskaya M.S., Ostankova I.V., Shatalov G.V., Shikhaliev K.S., Ryzhkova E.A. // Polymer Bulletin. 2018. V. 75. P. 1237–1251. https://doi.org/10.1007/s00289-017-2091-2
Novikov V.Y. // Russ. J. Appl. Chem. 2004. V. 77. P. 484–487. https://doi.org/10.1023/b:rjac.0000031297.24742.b9
Kasaai M.R., Arul J., Charlet G. // The Scientific World Journal. 2013. V. 2013. P. 508540. https://doi.org/10.1155/2013/508540
Santoso J., Adiputra K.C., Soerdirga L.C., Tarman K. // IOP Conf. Ser.: Earth Environ. Sci. 2020. V. 414. P. 012021. https://doi.org/10.1088/1755-1315/414/1/012021
Dimzon I.K.D., Knepper T.P. // Int. J. Biol. Macromol. 2015. V. 72. P. 939–945. https://doi.org/10.1016/j.ijbiomac.2014.09.050
Mucha M., Pawlak A. // Polimery. 2002. V. 47. P. 509–516. https://doi.org/10.14314/polimery.2002.509
Aiping Z., Tian C., Lanhua Y., Hao W., Ping L. // Carbohydrate Polymers. 2006. V. 66. P. 274–279. https://doi.org/10.1016/j.carbpol.2006.03.014
Sorokin A., Lavlinskaya M. // Polymer Bulletin. 2021. https://doi.org/10.1007/s00289-020-03521-9
Kasaai M.R. // Carbohydr. Polymers. 2007. V. 68. P. 477–488. https://doi.org/10.1016/j.carbpol.2006.11.006
Lowry O.H., Rosebrough N.J., Faar A.L., Randall R.J. // J. Biol. Chem. 1951. V. 193. P. 265–275.
Sabirova A.R., Rudakova N.L., Balaban N.P., Ilyinskaya O.N., Demidyuk I.V., Kostrov S.V., Rudenskaya G.N., Sharipova M.R. // FEBS Lett. 2010. V. 584. P. 4419–4425. https://doi.org/10.1016/j.febslet.2010.09.049
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия