Биоорганическая химия, 2022, T. 48, № 3, стр. 328-339
Фармакологические свойства галогенидов 2-аминобензимидазолия и производных имидазо[1,2-а]бензимидазола
А. А. Спасов 1, 2, О. Н. Жуковская 3, Н. А. Гурова 1, *, Л. В. Науменко 1, Н. В. Елисеева 1, А. Ф. Кучерявенко 1, В. А. Косолапов 1, Д. С. Яковлев 1, 2, В. Ю. Муравьева 1, В. А. Бабкова 1, Д. А. Бабков 1, Ю. В. Лифанова 1, А. С. Морковник 3
1 ФГБОУ ВО “Волгоградский государственный медицинский университет” Минздрава России
400131 Волгоград, площадь Павших Борцов, 1, Россия
2 ГБУ “Волгоградский медицинский научный центр”
400131 Волгоград, площадь Павших Борцов, 1, Россия
3 ФГАОУ ВО “Южный федеральный университет”, Научно-исследовательский институт физической
и органической химии
344090 Ростов-на-Дону, ул. Cтачки, 194/2, Россия
* E-mail: gurova.vlgmed@mail.ru
Поступила в редакцию 12.07.2021
После доработки 10.08.2021
Принята к публикации 14.08.2021
- EDN: VDJXFV
- DOI: 10.31857/S0132342322020233
Аннотация
Исследована биологическая активность галогенидов 2-аминобензимидазолия и производных 9-замещенных 2-(4-фторфенил)имидазо[1,2-a]бензимидазолов in vitro. Среди производных аминобензимидазолия обнаружено соединение с NHE-1-ингибирующей активностью. Среди производных имидазобензимидазола найдены соединения, которые влияют на продолжительность рефрактерного периода предсердий крыс, агрегацию тромбоцитов, гемореологическую активность, подавляют образование конечных продуктов гликирования. У всех изученных соединений не выявлены DPP-4-ингибирующее, антиоксидантное действие, каппа-опиоидная агонистическая, 5-НТ2А- и 5-НТ3-антагонистическая активность.
ВВЕДЕНИЕ
При создании мультитаргетных лекарственных препаратов большое внимание уделяют так называемым привилегированным структурам. Под ними понимают некоторую неизменную часть молекулы, которая обеспечивает сродство соединений к широкому спектру биологических мишений. При этом “непривилегированные” части молекул выполняют функции эффективных модуляторов взаимодействия мишень–лиганд [1–3]. Бензимидазол – привилегированная структура с широким потенциалом биологической активности, в том числе кардиопротекторными свойствами [4–10].
Современное понятие кардиопротекции предполагает непосредственное влияние биологически активного препарата на кардиомиоциты и включает в себя различные варианты его воздействия, препятствующие возникновению ионно-, электрофизиологически и метаболически индуцируемого ремоделирования миокарда.
Один из важных факторов ремоделирования – активация натрий-водородного обменника (NHE-1), следствием которой являются патогенетические процессы “кальциевой перегрузки” клеток сердца и мозга, стимулирование прогипертрофического действия за счет ряда факторов, что, в конечном счете, и формирует морфологическую, электрофизиологическую и функциональную ветви общего процесса ремоделирования миокарда. Селективное ингибирование NHE-1 сарколеммы (клеточной мембраны мышечной клетки или мышечного волокна) способно уменьшить ишемические/реперфузионные нарушения и улучшить восстановление функции органов после повреждения [11, 12]. Соответственно, важную роль в блокировании ремоделирования могли бы играть ингибиторы NHE-1. Структуры некоторых из них представлены на рис. 1 [13].
С другой стороны, интересным и перспективным типом кардиопротекторных агентов способны служить соединения, ограничивающие действие серотонина на сердце и сосуды [14]. Имеются также литературные данные о важной роли в повреждении миокарда предварительной активации каппа-опиоидных рецепторов, обусловленной связанным с этим формированием феноменом ишемического прекондиционирования миокарда и необратимых повреждений кардиомиоцитов в условиях коронароокклюзии in vivo [15]. Именно с этим связаны кардиопротекторные свойства каппа-агонистов, которые препятствуют повреждению миокарда за счет снижения (общего для опиоидов) образования cAMP в миокарде во время ишемии и реперфузии, а также за счет селективной активации протеинкиназы С, NO-синтазы и открытия КАТР-каналов [16].
Действие кардиопротекторов приводит к оптимизации процессов генерирования и расхода энергии, коррекции функции дыхательной цепи, восстановлению оксидантно-антиоксидантного баланса и, таким образом, способствует выживаемости кардиомиоцитов в условиях ишемии/реперфузии, снижает тромбогенный потенциал и улучшает гемореологический профиль крови.
Цель настоящего исследования – поиск соединений, активных в отношении мишеней, участвующих в процессах кардиопротекции, среди галогенидов 2-аминобензимидазолия и производных 9-замещенных 2-(4-фторфенил)имидазо[1,2-a]бензимидазолов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Галогениды 2-аминобензимидазолия обладают разнообразной биологической активностью [8]. Кроме того, эти соли интересны и в качестве исходных соединений для получения фармакологически активных производных трициклических систем на основе бензимидазола.
В настоящей работе исследованы фармакологические свойства шести синтезированных нами новых галогенидов 2-аминобензимидазолия (IIa–f) (схема 1 ), а также двух полученных ранее [17] 9‑замещенных производных 2-(4-фтор)фенилимидазо[1,2-а]бензимидазола (IIIa, b), продуктов циклизации солей (IId, e). Выходы солей (IIa–f) высокие: 92–95%. При использовании 4‑фторфенацилброма стадия циклизации проводится в очень мягких условиях (ацетон, комнатная температура), при использовании же в качестве реагента 4-фторфенацилхлорида требуются, судя по получению соли (IIf), существенно более жесткие условия (длительное, 8–10-часовое кипячение раствора реактантов в ацетонитриле).
Схема 1 . Схема синтеза производных 2-(4-фтор)фенилимидазо[1,2-a]бензимидазола.
Строение полученных солей (IIа–f) подтверждено данными ИК- и 1ЯМР-спектров, а также данными элементного анализа (приведены в дополнительных материалах). В ИК-спектрах этих солей присутствуют, в частности, характеристические полосы поглощения CO-группы в области 1693–1697 см–1 и две полосы валентных колебаний первичной NH2-группы в области 3265–3160 см–1. В спектрах 1Н-ЯМР указанных солей наблюдаются два двухпротонных синглета при 5.99 (6.09) и 8.91 (8.94) м.д., относящиеся к метиленовой группе ароилметильных заместителей и NH2-групп (2Н) соответственно.
Для обоих типов солей (IIa–f) было проведено тестирование на наличие активности в отношении некоторых мишеней, определяющих возможные кардиопротекторные свойства.
По характеру N9-заместителя соединения (IIa–f) и (IIIa, b) можно разделить на две группы: с алкильными (аллильными) N-заместителями и с N-заместителями диалкиламино(морфолино)этильного типа (табл. 1–3).
Таблица 1.
NHE-1-ингибирующая, 5-НТ2А-антагонистическая и каппа-опиоидная агонистическая активность галогенидов 2-аминобензимидазолия и производных имидазо[1,2-a]бензимидазола
| Соединение | R | X– | NHE-1-ингибирующая активность, Δ% (10 нМ) | 5-НТ2А-антаго-нистическая активность, Δ% (1 мкМ) | Каппа-опиоидная агонистическая активность, Δ% (100 мкМ) | |
|---|---|---|---|---|---|---|
 |
(IIa) | Et | Br– | 45.22 ± 24.89 | − | 5.2 ± 3.8 |
| (IIb) | All | Br– | 39.09 ± 6.56* | –11.2 ± 5.1 | 2.9 ± 0.5* | |
| (IIc) | Pr | Br– | 33.63 ± 4.84* | –19.1 ± 6.3* | 4.8 ± 0.3* | |
| (IId) |  |
Br– | 35.45 ± 14.33 | − | 1.4 ± 1.2 | |
| (IIe) |  |
Br– | − | 3.7 ± 5.6 | − | |
| (IIf) | 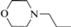 |
Cl– | 70.93 ± 7.99*, ** | –9.3 ± 2.3* | 12.6 ± 1.6* | |
 |
(IIIa) | 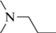 |
2HCl | 48.74 ± 10.90* | 0 | 4.2 ± 1.3 |
| (IIIb) |  |
2HCl | 41.69 ± 10.00* | 4.9 ± 4.9 | 2.4 ± 1.6 | |
Зонипорид 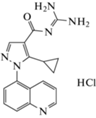 |
48.05 ± 7.09* | − | − | |||
Кетансерин  |
− | 81.4 ± 1.5* | − | |||
U-50488  |
− | − | 23.4 ± 2.4* | |||
Таблица 2.
Сердечно-сосудистые эффекты галогенида 2-аминобензимидазолия и производных имидазо[1,2-a]бензимидазола
| Соединение | 5-НТ3-антагонистичес-кая активность, Δ% (1 мкМ) | Влияние на рефрактерный период кардиомиоцитов, МЭК, 10 мкМ |
Влияние на АДФ-индуцированную агрегацию тромбоцитов, Δ% (100 мкМ) | Изменение индекса агрегации эритроцитов, ∆% (100 мкМ) |
|---|---|---|---|---|
| (IIe) | 3.7 ± 5.6 | − | − | –17.12 ± 5.2* |
| (IIIa) | 0 | 6.0 ± 1.0*, *** | 50.9 ± 13.2* | –30.49 ± 4.4*, ** |
| (IIIb) | 4.9 ± 4.9 | 6.5 ± 1.0*, *** | 18.12 ± 2.36* | –26.37 ± 1.04* |
Трописетрон
 |
–30.2 ± 4.0* | − | − | − |
Этмозин
 |
− | 5.1 ± 1.0*, *** | − | − |
Хинидин
 |
− | 34.0 ± 10.0* | − | − |
Ацетилсалициловая кислота
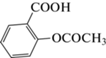 |
− | − | –52.1 ± 4.2* | − |
Пентоксифиллин
 |
− | − | − | –18.61 ± 3.83* |
Таблица 3.
Антигликирующая и DPP-4-ингибирующая активность галогенида 2-аминобензимидазолия и производных имидазо[1,2-a]бензимидазола
| Соединение | Антигликирующая активность (ингибирование флуоресценции БСА), 1 мМ, ∆% | DPP-4-ингибирующая активность (100 мкМ) |
|---|---|---|
| (IIe) | 11.4 ± 9.49** | − |
| (IIIа) | 97.1 ± 0.43* | 3.54 ± 5.23 |
| (IIIb) | 57.1 ± 23.69* | –1.02 ± 3.44 |
Аминогуанидин
 |
70.7 ± 5.71* | − |
Вилдаглиптин
 |
− | –98.89 ± 1.03* |
Проведенный нами ранее кластерный анализ массива из 59 производных конденсированных и неконденсированных бензимидазолов на их возможную NHE-1-ингибирующую активность in vitro в концентрации 10 нМ показал, что все исследованные таким образом соединения можно разделить на три группы: 1) высокоактивные – Δ(10 нМ) > 54%; 2) умеренно активные – 54% ≥ Δ(10 нМ) > 42%; 3) низкоактивные – Δ(10 нМ) < 42%. Было также установлено, что среди N1-замещенных 2-аминобензимидазолов наиболее перспективными в отношении NHE-1-ингибирующей активности должны быть структуры с морфолиноэтильным или пиперидиноэтильным N1-заместителем. Что касается имидазо[1,2-a]бензимидазолов, то сам по себе его трициклический скаффолд не предопределяет существенную NHE-1-ингибирующую активность, но возможно ее значительное усиление под влиянием заместителей. Позднее при проведении дополнительного ансамблевого дискриминантного анализа 25 соединений [18] было подтверждено, что N1-замещенные 2-аминобензимидазолы, не имеющие полностью циклического гуанидинового структурного фрагмента, должны обладать более высокой NHE-1-ингибирующей активностью, чем имеющие такой фрагмент N9-замещенные имидазо[1,2-a]бензимидазолы, при одном и том же N-заместителе.
При экспериментальном исследовании все изученные соединения продемонстрировали наличие NHE-1-ингибирующей активности, сопоставимой с препаратом сравнения зонипоридом. При этом различия по величине ∆% изменения светопропускания богатой тромбоцитами плазмы оказались статистически значимыми по отношению к контролю (р < 0.05) (табл. 1). Наибольшую активность проявила соль (IIf) с морфолиноэтильным N-заместителем.
Ранее метод кластерного анализа был применен нами и для изучения влияния структуры 301 испытанных оригинальных производных бензимидазола на их способность увеличивать продолжительность рефрактерного периода (рефрактерность) миокарда предсердий крыс. В результате все структуры и в этом случае были разбиты на три класса активности: 1) высокоактивные (МЭК < < 72.5 мкM); 2) умеренно активные (72.5 мкM ≤ ≤МЭК < 279 мкM); 3) низкоактивные (МЭК ≥ ≥ 279 мкM). При этом также был сделан вывод о перспективности N9-производных имидазо[1,2-a]бензимидазола для создания на их основе структурно новых антиаритмических соединений с высоким индексом значимости. N1-замещенные бензимидазолы, согласно этим данным, характеризовались, напротив, выраженным отрицательным значением этого индекса, что позволило сделать статистически значимый отрицательный прогноз для них по данному виду активности. Дополнительным важным результатом при этом было выявление таких заместителей-фармакофоров в положении 2 имидазобензимидазола, присутствие которых может служить достоверным признаком высокой антиаритмической активности. Ими являются трет-бутильный, тиенильный и арильный заместители, особенно при наличии в молекуле N9-(2-диэтиламино)этильного заместителя.
Все эти предварительные выводы нашли свое полное подтверждение в данном исследовании. Действительно, наиболее активными в отношении увеличения продолжительности рефрактерного периода предсердий крыс оказались представители 2‑фторфенилимидазо[1,2-a]бензимидазолов, имеющих в положении N9 диэтиламиноэтильный (IIIa) и диметиламиноэтильный (IIIb) заместители. По своей активности они оказались примерно равны препарату сравнения этмозину и статистически значимо превосходили хинидин (табл. 2).
Аналогичный подход с кластерным анализом был применен и для градации бензимидазолов по их гемореологической активности в зависимости от структуры. При этом ранее был использован массив из 277 соединений десяти различных структурных классов. При аналогичном распределении структур по активности соединения были разнесены по трем группам: 1) высокоактивные (ЕС50 < 326 мкМ); 2) умеренно активные (325 мкМ ≤ ЕС50 < 100 мкМ); 3) низкоактивные (ЕС50 ≥ 100 мкM). С достоверным уровнем значимости было показано, что N9-замещенные имидазо[1,2-a]бензимидазолы и в этом случае могут быть отнесены к перспективному классу структур с высокой гемореологической активностью, особенно при наличии в положении 2 таких арильных заместителей, как 4-фторфенильная и 3,4-дихлорфенильная группы, а в положении 9 – пиррролидиноэтильной или диметиламиноэтильной фармакофорных групп. В соответствии с этими результатами в ходе настоящего исследования было показано, что 2-(4-фтор)фенилимидазо[1,2-a]бензимидазолы (IIIa, b) с N9-диметил(диэтил)аминоэтильной группой достоверно снижали индекс агрегации эритроцитов, тем самым улучшая гемореологические свойства крови, превосходя по своей активности препарат сравнения пентоксифиллин (табл. 2). Существенной активностью, впрочем, характеризуется и четвертичная бензимидазолиевая соль (IIe), лишь незначительно уступающая по активности препарату сравнения.
На модели АДФ-индуцированной агрегации тромбоцитов соединение (IIIa) продемонстрировало антиагрегантную активность, сравнимую с таковой у препарата сравнения ацетилсалициловой кислоты, тогда как соединение (IIIb) в этом случае проявило лишь незначительный антиагрегантный эффект (табл. 2).
При изучении антигликирующей активности было показано, что соединение (IIIb) подавляет образование конечных продуктов гликирования, причем примерно столь же эффективно, как и препарат сравнения аминогуанидин с хорошо известной антигликирующей активностью (табл. 3).
Среди не наблюдающихся у изученных соединений видов активности следует указать на отсутствие 5-HT3- и 5-HT2А-антагонистического действия, каппа-опиоидной агонистической и DPP-4-ингибирующей активности (табл. 1–3), равно как и на отсутствие антиоксидантной активности при ее тестировании с использованием модели аскорбат-зависимого перекисного окисления липидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химический синтез. Исходные 1-замещенные 2-аминобензимидазолы (Ia–f) синтезировали из 2-аминобензимидазола и соответствующего алкилбромида или диалкиламиноалкилхлорида в двухфазной системе 42%-ный NaOH–ацетон [19]. 2-Аминобензимидазол получали из технического метил-N-бензимидазолил-2-карбамата (БМК), полупродукта синтеза фунгицида беномил [20]. Использовали также коммерчески доступные реагенты фторфенацилбромид и фторфенацилхлорид (Alfa Aesar, Великобритания).
Соединения (IIIа, b) синтезировали по методике Анисимовой с соавт. [17].
Контроль за ходом реакций и чистотой синтезируемых соединений осуществляли методом ТСХ на пластинах с Аl2О3 (элюент – хлороформ, хроматограммы проявляли парами иода во влажной камере). ИК-спектры регистрировали на приборе JACOFT/IR-6800 (Jasco, Япония) методом нарушенного полного внутреннего отражения в порошке, спектры 1Н-ЯМР (δ, м.д.) – на спектрометре Varian Unity 300 (Varian, США) в DMSO-d6 с использованием в качестве референсного сигнала остаточных протонов дейтерорастворителя. Температуру плавления определяли на приборе Fisher Johns Melting Point Apparatus (Fisher Scientific, США).
Общая методика синтеза четвертичных солей 2‑амино-бензимидазолия (IIа–е). В раствор 2 ммоль амина (Iа–е) в ацетоне (15 мл) вносили 2 ммоль 4-фторфенацилбромида. Бромиды (IIа–е) при этом начинали практически сразу же выпадать в осадок. После выдерживания реакционной смеси при комнатной температуре в течение 8–10 ч осадок соли отфильтровывали, тщательно промывали ацетоном и высушивали на воздухе. Выход соединений (IIа–е) был близок к количественному (92–95%). Для дальнейшей циклизации такие соли могут быть использованы без дополнительной очистки.
Сведения о выходе целевых продуктов, температура правления, данные спектров соединений, а также данные элементного анализа соединений (IIа–е) приведены в дополнительных материалах.
Биологическая активность полученных соединений. Эксперименты проводили на 132 белых неинбредных крысах обоего пола массой 250–450 г (ООО “НПК БиоТех”, вет. свидетельство № 2003680881), 36 морских свинках обоего пола массой 280–320 г (ООО “НПК БиоТех”, вет. свидетельство № 896613690) и 25 кроликах-самцах породы шиншилла (ФГУП ОПХ “Манихино”, вет. свидетельство № 2256618221) весом 3–4 кг, содержащихся в условиях вивария в соответствии c СП 2.2.1.3218-14 “Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)” (температура 18–22°С, естественный световой режим, стандартная диета в соответствии с ГОСТ Р 50258-92).
NHE-1-ингибирующую активность изучали in vitro по изменению формы тромбоцитов кролика методом измерения светопропускания [21, 22]. Забор крови осуществляли из краевой вены уха кролика в пробирки с цитратом натрия (3.8%) в соотношении 9 : 1. Кровь центрифугировали при 1000 об/мин в течение 12 мин (центрифуга Multi centrifuge CM 6M, Elmi, Латвия), забирали богатую тромбоцитами плазму. Активацию NHЕ-обменника проводили буферным раствором, содержащим пропионат натрия (600 мкл, в ммоль/л: пропионат натрия – 135, HEPES – 20, СaCl2 – 1, МgCl2 – 1, глюкоза – 10; pH 6.7, 37°С). Для контроля изменения светопропускания в условиях нормального рН использовали раствор Кребса (600 мкл, pH 7.4, 37°С). Изменение формы тромбоцитов регистрировали по светопропусканию с помощью лазерного анализатора агрегации тромбоцитов АЛАТ-2 (ООО НПФ “БИОЛА”, Россия; программное обеспечение AGGR версия 2.00, Россия). Все соединения в концентрации 10 нМ в объеме 10 мкл добавляли в кювету к 200 мкл богатой тромбоцитами плазмы за 5 мин до добавления раствора пропионата натрия, инкубировали при постоянном перемешивании (800 об/мин, 37°С). В качестве препарата сравнения использовали селективный ингибитор NHE-1 зонипорид (Sigma, США). Активность определяли по способности соединений изменять форму тромбоцитов (светопропускание) в сравнении с контролем (∆%).
Экспериментальный поиск соединений, влияющих на продолжительность рефрактерного периода миокарда изолированных предсердий, проводили ex vivo и оценивали по усвоению навязанного ритма изолированными предсердиями крыс [21, 22]. Изолированные предсердия помещали в питательный раствор Кребса (состав, мМ: NaCl – 118, КСl – 4.7, СаСl2 – 2.52, MgSO4 – 1.64, NaHCO3 – 24.88, КН2РО4 – 1.18, глюкоза – 5.55) при 24°C и постоянной оксигенации. Регистрацию фармакологического ответа проводили с помощью изотонического датчика 7006 при диастолической нагрузке 0.5 г и самописца Unirecord (установка для работы на изолированных органах, Ugo Basile, Италия). Об активности соединений судили по минимальной эффективной концентрации (МЭК), препятствующей навязыванию ритма (3 Гц; длительность импульса 0.5 мс; напряжение тока, в 2 раза превышающее пороговую величину; электростимулятор ЭСЛ-2, Россия) в течение 15 с. Все соединения вводили в ванночку, где находились предсердия, и исследовали в диапазоне концентраций 0.01–1 мМ. В качестве препаратов сравнения использовали этмозин (ГУ НИИ фармакологии им. В.В. Закусова, Россия) и хинидин (Sigma, США).
Влияние соединений на гемореологические свойства крови (вязкость крови) кролика изучали в условиях моделирования синдрома повышенной вязкости крови in vitro, заключающегося в инкубировании крови при 42.5°С в течение 60 мин. Забор крови проводили из краевой ушной вены кроликов методом свободного падения капли при стабилизации 3.8%-ным водным раствором цитрата натрия (pH 6.0) в соотношении 9 : 1. Производили стандартизацию образцов крови к единому гематокриту 45 у.е. Определение кажущейся вязкости крови проводили на анализаторе крови (АКР-2, Россия) при скоростях сдвига от 300 до 10 с–1. Действие соединений на степень агрегации эритроцитов оценивали по изменению индекса агрегации, рассчитываемому как отношение показателя вязкости крови при скорости сдвига 10 с–1 к вязкости крови при скорости сдвига 100 с–1. Соединения исследовали в концентрации 100 мкМ. В качестве препарата сравнения использовали пентоксифиллин (Aventis, Германия) в концентрации 100 мкМ.
Влияние тестируемых образцов на функциональную активность тромбоцитов кролика in vitro изучали согласно методу G. Born в модификации В.А. Габбасова (1989) на двухканальном лазерном анализаторе агрегации тромбоцитов АЛАТ-2 (ООО НПФ “БИОЛА”, Россия, программное обеспечение AGGR версия 2.00, Россия) [21, 22]. Исследуемые соединения тестировали в концентрации 100 мкМ. Исследования выполняли на богатой тромбоцитами плазме. Венозную кровь забирали из ушной краевой вены кролика, стабилизировали 3.8%-ным раствором цитрата натрия в соотношении 9 : 1 и центрифугировали в течение 10 мин при 1500 об/мин (центрифуга MultiCentrifuge CM 6M, Elmi, Латвия). Для получения контрольной пробы в стеклянную кювету агрегометра вносили 300 мкл богатой тромбоцитами плазмы с магнитной мешалкой и добавляли индуктор агрегации тромбоцитов АДФ в конечной концентрации 5 мкМ. Для изучения антиагрегантой активности исследуемых соединений в кювету с 300 мкл богатой тромбоцитами плазмы первоначально добавляли 10 мкл раствора тестируемого образца. Активность исследуемых соединений определяли по способности соединений снижать функциональную активность тромбоцитов в сравнении с контролем (%). В качестве препарата сравнения использовали ацетилсалициловую кислоту (Sigma, США).
При определении антигликирующей активности реакционная смесь содержала растворы бычьего сывороточного альбумина (1 мг/мл) и глюкозы (500 мМ) в фосфатном буфере (pH 7.4). Для предупреждения бактериального роста в буферный раствор вносили азид натрия в конечной концентрации 0.02%. Соединения изучали в концентрации 1 мМ. Образцы инкубировали в течение 24 ч при 60°С. Затем определяли специфическую флуоресценцию гликированного бычьего сывороточного альбумина (БСА) на спектрофлуориметре F-7000 (Hitachi, Япония) при длине волны возбуждения 370 нм и испускания 440 нм. Антигликирующую активность рассчитывали по отношению к показателю флуоресценции отрицательного контроля (гликированный БСА) [21]. В качестве положительного контроля использовали известный ингибитор неферментативного гликозилирования аминогуанидин (Sigma, США).
Фармакологическую активность соединений в отношении серотониновых рецепторов типов 2А и 3 исследовали in vitro с использованием установки для работы с изолированными органами (UgoBasile, Италия). Изучение 5-HT2А-активности соединений осуществляли с использованием препарата изолированного сегмента рога матки крысы [21, 22]. Для этого после наркотизации животного (хлоралгидрат, Panreac Quimica, Испания; внутрибрюшинно 400 мг/кг) и эвтаназии методом декапитации препарировали сегмент органа, который помещали в ванночку установки со следующими условиями инкубации: физиологический раствор Тироде (рН 7.4), термостатирование 24°С, постоянная оксигенация 95–97% (кислородный концентратор Армед 7А-3А, Россия). Препарат органа соединяли с изотоническим датчиком (модель 7006, UgoBasile, Италия) под нагрузкой 1 г. В ванночку вносили изучаемое соединение или препарат сравнения кетансерин (Sigma, США) в конечной концентрации 1 мкМ. Через 2 мин добавляли серотонина гидрохлорид (Sigma, США) в конечной концентрации 1 мкМ. Контрольное измерение проводили только с использованием серотонина. После каждого тестирования осуществляли смену физиологического раствора не менее 3 раз. Величину (∆%) антисеротонинового действия соединений рассчитывали по изменению спастического эффекта серотонина относительно контрольного измерения.
Исследование активности соединений в отношении 3-го типа 5-HT-рецепторов проводили аналогичным образом с использованием препарата изолированных предсердий морской свинки [21, 22]. Условия инкубации органа: раствор Кребса (pH 7.4), термостатирование 37°С, постоянная оксигенация 95–97%. Тестирование соединений проводили в концентрации 1 мкМ при инкубации в течение 2 мин. В качестве препарата сравнения использовали трописетрона гидрохлорид (Sigma, США) в аналогичной концентрации. Оценивали способность соединений изменять частоту спонтанных предсердных сокращений (∆%) при стимуляции серотонина гидрохлоридом (конечная концентрация 3 мкМ, Sigma, США).
Влияние соединений на каппа-опиоидные рецепторы исследовали in vitro на модели активации тромбоцитов методом малоуглового светорассеяния в солевой среде (буфер Tris-HCl, рН 7.4). Венозную кровь из краевой ушной вены кроликов стабилизировали 3.8%-ным раствором цитрата натрия в соотношении 9 : 1 и центрифугировали при 1000 об/мин в течение 10 мин. Эксперименты проводили в термостатируемой кюветной камере лазерного анализатора размеров частиц ЛАСКА-1К (ООО “Люмэкс”, Россия). На кювету фотометра, снабженную перемешивающим устройством и содержащую 7 мл среды и 0.1 мл богатой тромбоцитами плазмы под углом 90° направляли свет от лазерного источника. Регистрировали интенсивность светорассеяния в диапазоне углов 2°–14° (с шагом в 2°): начальную (после внесения тромбоцитов) и последующую (после внесения соединений). Все изучаемые соединения исследовали в концентрации 100 мкМ, время экспозиции составляло 2 мин. В качестве препарата сравнения использовали селективный каппа-агонист U‑50488 (Sigma, США). Динамику интенсивности светорассеяния (I) рассчитывали по формуле:
Для оценки ингибиторной активности соединений в отношении DPP-4 вносили 40 мкл плазмы крови здоровых добровольцев в 50 мкл 0.1 М буферного раствора Tris-HCl (pH 8.0). В полученную смесь добавляли 10 мкл раствора исследуемого соединения до конечной концентрации 100 мкМ в Tris-буферном растворе и преинкубировали при 37°С в течение 5 мин. Затем вносили в реакционную смесь 100 мкл 1 мМ раствора субстрата дипептидилпептидазы-4 Gly-Pro-п-нитроанилида (Sigma, США). Инкубировали при 37°С в течение 15 мин и регистрировали образование п‑нитроанилина по величине оптической плотности при длине волны 405 нм [24], используя микропланшетный ридер Infinite M200 PRO (Tecan, Австрия). В контрольную пробу вносили равный объем растворителя. В качестве препарата сравнения использовали вилдаглиптин (Sigma, США).
Антиоксидантные свойства изучали in vitro на модели аскорбат-зависимого перекисного окисления липидов [21, 22]. Соединения изучали в концентрации 1 мкМ. В качестве препарата сравнения использовали антиоксидант дибунол (Merck, Германия) в концентрации 1 мкМ. За кинетикой перекисного окисления липидов, индуцируемого раствором аскорбиновой кислоты, следили по накоплению малонового диальдегида в реакции с 2-тиобарбитуровой кислотой (ТБК) (Fluka, Швейцария). Пробы, содержащие 10%-ный экстракт гомогената печени крысы, полученный в стеклянном гомогенизаторе Поттера с электрическим приводом МШ-2 (Россия), на 0.1 М Tris-НСl-буфере (рН 7.4) инкубировали в течение 10 мин в водяном термостате (EL-20, Votice, Польша) при 37°С. После инициирования реакции добавлением 0.8 мМ аскорбиновой кислоты в пробе осаждался белок, реакцию останавливали добавлением 0.2 мл 50%-ной трихлоруксусной кислоты. После центрифугирования при 3000 об/мин в течение 10 мин на центрифуге СМ-6М 3 (Elmi, Латвия) к надосадочной жидкости добавляли 0.8%-ный раствор 2-тиобарбитуровой кислотой (ТБК, Fluka, Швейцария), пробы кипятили 10 мин на водяной бане. Пробы фотометрировали в кварцевой кювете с длиной оптического пути 1 см при длине волны 532 нм на цифровом спектрофотометре PD-303UV (Apel, Япония). Активность соединений оценивали в процентах ингибирования по отношению к пробе без соединения по результатам трех независимых экспериментов по формуле:
Все исследованные соединения и препараты растворяли в дистиллированной воде. Препарат сравнения ацетилсалициловую кислоту (Sigma, США) растворяли в 30 мкл диметилсульфоксида (ДМСО) с последующим добавлением дистиллированной воды до необходимого объема.
При выборе концентраций для исследования рецепторной активности новых химических соединений ориентировались на фармакологически эффективные в условиях экспериментальной модели концентрации эталонного препарата сравнения. При проведении исследований по описанным видам активности все соединения и препараты сравнения были изучены в шести повторах на точку.
Статистические расчеты проводили с помощью попарного сравнения выборок с использованием U-критерия Манна–Уитни в пакете программ Statistica 6.0 (Statsoft Inc.). Различия считали статистически значимыми при р < 0.05.
ЗАКЛЮЧЕНИЕ
Синтезированы шесть соединений галогенидов 2-аминобензимидазолия и два продукта их циклизации – производных 9-замещенных 2-(4-фторфенил)имидазо[1,2-a]бензимидазолов, исследована их биологическая активность in vitro в отношении мишеней, участвующих в процессах кардиопротекции. Нами предварительно был проведен анализ зависимости биологической активности от химической структуры ранее изученных химических молекул и составлены прогнозы, результаты которых нашли подтверждение в данном исследовании. Так, при изучении NHE-1-ингибирующей активности наиболее активное соединение (IIf) с морфолиноэтильным N-заместителем обнаружено среди производных аминобензимидазолия. Его активность статистически значимо превосходила активность препарата сравнения зонипорида. N9-замещенные имидазо[1,2-a]бензимидазолы были рассмотрены как перспективный класс структур с высокой способностью увеличивать рефрактерность миокарда, а также обладающих гемореологической активностью. При исследовании на изолированных предсердиях крыс их способности увеличивать продолжительность рефрактерного периода активными оказались представители 2-фторфенилимидазо[1,2-a]бензимидазолов, имеющих в положении N9 диэтиламиноэтильный (IIIa) и диметиламиноэтильный (IIIb) заместители. По величине МЭК их эффект был подобен препарату сравнения этмозину. Эти же соединения достоверно снижали индекс агрегации эритроцитов, превосходя по своей активности препарат сравнения пентоксифиллин. Прогнозы антиагрегантной активности в большей степени связаны с производными класса N9 2,3-дигидроимидазо[1,2-a]бензимидазола, у изученных производних имидазо[1,2-a]бензимидазола не выявлена выраженная активность. Для галогенидов 2-аминобензимидазолия наличие антиоксидантной, каппа-опиоидной агонистической, 5-НТ2А- и 5-НТ3-антагонистической активностей не выявлено ни в прогнозе, ни в эксперименте.
Таким образом, были обнаружены активные соединения, представляющие интерес для определения их безопасности и перспектив дальнейших исследований. Соединение (IIIb) оказалось активным в отношении трех мишеней: оно увеличивает рефрактерный период, снижает индекс агрегации тромбоцитов, подавляет образование конечных продуктов гликирования, подобно препарату сравнения аминогуанидину. Одновременное применение методов медицинской химии и фармакологии может перевести направленный поиск новых активных соединений на качественно новый уровень системного поиска.
Список литературы
Horton D.A., Bourne G.T., Smythe M.L. // Chem. Rev. 2003. V. 3. P. 893–930. https://doi.org/10.1021/cr020033s
Kim J., Kim H., Park S.B. // J. Am. Chem. Soc. 2014. V. 136. P. 14629–14638. https://doi.org/10.1021/ja508343a
Sączewski F., Balewski Ł. // Expert Opin. Ther. Pat. 2013. V. 8. P. 965–995. https://doi.org/10.1517/13543776.2013.788645
Spasov A.A., Kucheryavenko A.F., Gaidukova K.A., Kosolapov V.A., Zhukovskaya O.N. // Res. Results Pharmacol. 2020. V. 6. № 1. P. 1–9. https://doi.org/10.3897/rrpharmacology6.50373
Yigit M., Yigit B., Taslimi P., Ozdemir I., Karaman M., Gulçin L. // J. Mol. Struct. 2020. V. 1207. P. 127802. https://doi.org/10.1016/j.molstruc.2020.127802
Guruvelli P.V.S., Wagmare P., Harinath B.C., Jamullamudi R.N., Kurre P.N., Muthyala M.K.K. // Anti-Infect. Agents. 2019. V. 17. P. 20–27. https://doi.org/10.2174/2211352516666180810101327
Shelton K.L., DeBord M.A., Wagers P.O., Southerland M.R., Williams T.M., Robishaw N.K., Shriver L.P., Tessier C.A., Panzner M.J., Youngs W.J. // Bioorg. Med. Chem. 2017. V. 25. P. 421–439. https://doi.org/10.1016/j.bmc.2016.11.009
Спасов А.А., Жуковская О.Н., Бабков Д.А., Бригадирова А.А., Бабкова В.А., Морковник А.С., Литвинов Р.Л., Соколова Е.В. // Изв. РАН. Сер. химическая. 2020. № 4. С. 774–780.
Анисимова В.А., Жуковская О.Н., Петров В.И., Спасов А.А., Косолапов В.А., Кучерявенко А.Ф., Гайдукова К.А., Сороцкий Д.В. // Пат. Российской Федерации RU 2623439 C1. Опубл. 26.06.2017. Бюл. № 18.
Спасов А.А., Анисимова В.А., Гурова Н.А., Тимофеева А.С., Федорчук В.Ю., Минкин В.И. // Пат. Российской Федерации RU 2526902 С1. Опубл. 27.08.2014. Бюл. № 24.
Pedersen S.F., Counillon L. // Physiol. Rev. 2019. V. 99. P. 2015–2113. https://doi.org/10.1152/physrev.00028.2018
Yeves A.M., Ennis I.L. // Hipertension y Riesgo Vascular. 2020. V. 37. P. 22–32. https://doi.org/10.1016/j.hipert.2019.09.002
Zhang R., Lei L., Xu Y., Hua W., Gong G. // Bioorg. Med. Chem. Lett. 2007. V. 17. P. 2430–2433. https://doi.org/10.1016/j.bmcl.2007.02.035
Yakovlev D.S., Spasov A.A., Mal’tsev D.V., Anisimova V.A. // Bull. Exp. Biol. Med. 2014. V. 157. P. 350–355.
Zhang S., Zhou Y., Zhao L., Tian X., Jia M., Gu X., Feng N. // Eur. J. Pharmacol. 2018. V. 15. P. 100–108. https://doi.org/10.1016/j.ejphar.2018.05.043
Headrick J.P., See Hoe L.E., Du Toit E.F., Peart J.N. // Br. J. Pharmacol. 2015.V. 172. P. 2026–2050. https://doi.org/10.1111/bph.13042
Анисимова А.А., Спасов А.А., Толпыгин И.Е., Минкин В.И., Черников М.В., Яковлев Д.С., Стуковина А.Ю., Горягин И.И., Гречко О.Ю., Кириллова Н.В., Косолапов В.А., Тибирькова Е.В., Салазникова О.А., Науменко Л.В., Гурова Н.А. // Хим.-фарм. журн. 2010. Т. 44. № 7. С. 7–13.
Васильев П.М., Муравьева В.Ю., Гурова Н.А., Янолиева Л.Р., Ворфоломеева В.В., Анисимова В.А., Богославцева М.В. // Вестник Волг. ГМУ. 2016. № 2 (58). С. 87–90.
Симонов А.М., Ковалев Г.В., Анисимова В.А., Спасов А.А., Ермилова Э.С., Поротиков В.И., Каверина Н.В., Пятин Б.М., Меринова С.В., Авдюнина Н.И. // Пат. Российской Федерации RU 2068261 С1. Опубл. 27.10.1996. Бюлл. № 4.
Пожарский А.Ф., Анисимова В.А., Цупак Е.Б. // Практические работы по химии гетероциклов. Ростов-на-Дону: Изд-во Рост. ун-та, 1988. С. 130–131.
Жуковская О.Н., Спасов А.А., Гурова Н.А., Косолапов В.А., Кучерявенко А.Ф., Яковлев Д.С., Бабкова В.А., Бабков Д.А., Салазникова О.А., Муравьева В.Ю., Бригадирова А.А., Агацарская Я.В., Вишневская В.В., Морковник А.С. // Эксп. клин. фармакол. 2019. Т. 82. № 7. С. 3–9. https://doi.org/10.30906/0869-2092-2019-82-7-3-9
Жуковская О.Н., Анисимова В.А., Спасов А.А., Яковлев Д.С., Гурова Н.А., Кучерявенко А.Ф., Салазникова О.А., Кузнецова В.А., Мальцев Д.В., Бригадирова А.А., Морковина Я.В., Соловьева О.А., Гурова В.В., Резников Е.В. // Хим.-фарм. журн. 2017. Т. 51. № 3. С. 20–24.
Mindukshev I.V., Krivchenko A.I., Ermolaeva E.E., Goncharov N.V., Vivulanets E.V., Shabanova E.Yu., Petrishchev N.N., Jenkins R.O. // Spectroscopy. 2005. V. 19. P. 247–257. https://doi.org/10.1155/2005/919317
Matheeussen V., Lambeir A.M., Jungraithmayr W., Gomez N., Entee K.M., Veken P.V., Scharpé S., Meester I. // Clin. Chim. Acta. 2012. V. 413. P. 456–462. https://doi.org/10.1016/j.cca.2011.10.031
Дополнительные материалы
- скачать ESM.docx
- Приложение 1
Инструменты
Биоорганическая химия