Биоорганическая химия, 2022, T. 48, № 3, стр. 313-327
Экспрессия генов целлюлозосинтаз при гравистимуляции растений льна (Linum usitatissimum) и тополя (Populus alba × tremula)
Н. Е. Мокшина 1, 2, *, П. В. Микшина 1, Т. А. Горшкова 1
1 Казанский институт биохимии и биофизики – обособленное структурное подразделение ФИЦ Казанский научный центр РАН
420111 Казань, ул. Лобачевского, 2/31, Россия
2 Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: ne_mokshina@kibb.knc.ru
Поступила в редакцию 29.10.2021
После доработки 29.11.2021
Принята к публикации 13.12.2021
- EDN: FADQIT
- DOI: 10.31857/S0132342322030137
Аннотация
Биосинтез растительной целлюлозы осуществляется мембранным комплексом изоферментов с участием ряда коферментов. Принято считать, что целлюлозосинтазные комплексы, синтезирующие первичную и вторичную клеточную стенку, различаются по составу изоферментов. Некоторые растительные волокна, включая флоэмные волокна льна и ксилемные волокна древесины натяжения тополя, формируют третичную клеточную стенку, которая характеризуется повышенным содержанием целлюлозы и пониженным содержанием ксилана и лигнина. Состав и типы целлюлозосинтазных комплексов, вовлеченных в биосинтез третичной клеточной стенки, до сих пор не установлены. Опираясь на транскриптомные данные для растений льна (Linum usitatissimum) и тополя (Populus alba × tremula), мы оценили экспрессию генов, кодирующих целлюлозосинтазы, в ходе развития гравитропической реакции с участием флоэмных и/или ксилемных волокон, формирующих третичную клеточную стенку. Изменения в экспрессии генов целлюлозосинтаз, характерных как для первичных, так и для вторичных клеточных стенок, в различных модельных системах свидетельствуют о подвижности ансамбля различных изоформ целлюлозосинтаз при реализации гравиответа, который может затрагивать как отдельный тип клеток, так и совокупность тканей с различными типами клеточных стенок. На выделенных флоэмных волокнах льна продемонстрирована вовлеченность целлюлозосинтаз обоих типов в формирование третичной клеточной стенки на всех стадиях гравиответа.
ВВЕДЕНИЕ
Целлюлоза, будучи непременным компонентом клеточной стенки любой растительной клетки, выступает самым распространенным биополимером на нашей планете. Несмотря на то, что с химической точки зрения целлюлоза устроена достаточно просто и представляет собой β-1,4-D-глюкан, элементарное звено которого – β-целлобиоза (β-D-глюкопиранозил-(1,4)-β-D-глюкопираноза), биосинтез ее молекул в растениях осуществляется сложноорганизованной многокомпонентной системой ферментов. Центральное положение в этой системе занимают целлюлозосинтазы (CESA), принадлежащие к семейству 2 гликозилтрансфераз (GT2, EC 2.4.1.12, согласно CAZy). CESA собраны в мембранные комплексы, так называемые “розетки”, при этом каждый фермент такого комплекса синтезирует отдельную глюкановую цепь. На данный момент принято считать, что розетка состоит из шести “лепестков”, а “лепесток” розетки – из трех индивидуальных белков CESA; таким образом, один комплекс синтезирует микрофибриллу целлюлозы, которая состоит из 18 глюкановых цепей [1, 2]. В геноме резуховидки (Arabidopsis thaliana) идентифицировано 10 генов, кодирующих CESA [3]. Известно, что набор изоформ CESA отличается для первичных и вторичных клеточных стенок, формирующихся на разных стадиях развития клеток и имеющих различные свойства и функции. Так, целлюлозу первичных клеточных стенок синтезируют изоформы CESA1, 3, 6 (далее PCW CESA, PCW – primary cell wall), а вторичных – CESA4, 7, 8 (далее SCW CESA, SCW – secondary cell wall) [4, 5]. CESA10 – близкий гомолог CESA1; CESA2, 5, 9 – близкие гомологи CESA6 [6]. Интересно, что in vitro каждая изоформа CESA может взаимодействовать с любой другой изоформой [7]. Кроме того, есть единичные сообщения, согласно которым экспрессия генов PCW CESA сохраняется в клетках ксилемных сосудов, которые формируют вторичную клеточную стенку. Это может быть связано с тем, что клеткам необходимо перестроиться с биосинтеза первичной клеточной стенки на биосинтез вторичной, и какое-то время оба типа комплекса могут функционировать на плазмалемме одновременно [8]. Некоторые ученые выдвигают и более смелые предположения, согласно которым вторичную клеточную стенку синтезируют оба типа комплексов [9].
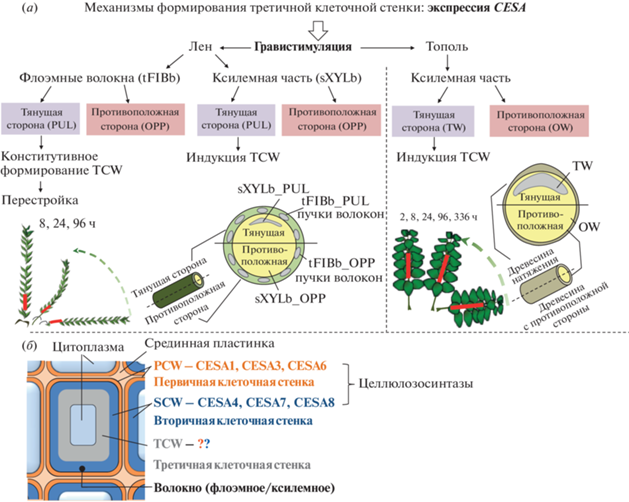
“Поведение” целлюлозосинтазных комплексов в ходе формирования третичной клеточной стенки, которая обнаруживается только в волокнах и для которой характерно очень высокое содержание целлюлозы – до 85–90% [10], пока исследовано крайне слабо. Широко используемыми моделями для изучения формирования третичной клеточной стенки служат волокна льна (Linum usitatissimum L.) и древесина натяжения тополя (Populus sp.) [11, 12]. Флоэмные волокна льна после прекращения роста растяжением (интрузивный рост) формируют утолщенную третичную клеточную стенку; следует отметить, что этому процессу предшествует отложение тонкого слоя вторичной клеточной стенки, который выявляется только при иммуномечении [13]. Формирование третичной клеточной стенки во флоэмных волокнах льна происходит конститутивно, в ходе нормального развития растений. Высокая механическая прочность и собранность в пучки позволяют быстро извлекать флоэмные волокна льна, развивающиеся in planta, что дает возможность анализировать определенный тип клеток на определенной стадии их развития, и избежать проблем в интерпретации результатов, которые возникают при анализе гетерогенных образцов, состоящих из разных типов клеток.
В геноме льна (L. usitatissimum) выявлено 16 генов целлюлозосинтаз (LusCESA), из которых, судя по гомологии с генами резуховидки (A. thaliana), 11 генов кодируют PCW CESA, а 5 – SCW CESA [14]. Первые сведения, касающиеся экспрессии генов целлюлозосинтаз в волокнах льна [14], были получены вскоре после расшифровки генома льна [15]. С использованием количественной ПЦР было показано, что на стадии формирования третичной клеточной стенки экспрессия генов SCW LusCESA выше, чем в тканях, формирующих первичную клеточную стенку. Транскриптомный анализ позволил оценить экспрессию генов всех изоформ LusCESA в волокнах на разных стадиях развития и установить, что в волокнах, формирующих первичную клеточную стенку, экспрессируются только гены PCW LusCESA, тогда как в волокнах, формирующих третичную клеточную стенку, экспрессируются как гены PCW LusCESA, так и SCW LusCESA [16].
В ксилемных волокнах древесины натяжения тополя (Populus sp.) также формируется третичная клеточная стенка (альтернативное название – G‑слой вторичной клеточной стенки [17]). По составу и структуре она схожа с третичной клеточной стенкой волокон льна [18], но ее формирование индуцируется гравистимуляцией (наклон стебля), в отличие от флоэмных волокон льна, в которых формирование третичной клеточной стенки происходит конститутивно. В ходе ответа на гравистимуляцию развитие стебля в участке, где формируется изгиб, происходит асимметрично: древесина натяжения и волокна с третичной клеточной стенкой, как ее характерный элемент, образуются только с одной, тянущей стороны стебля; с противоположной стороны такие изменения отсутствуют. В геноме тополя (Populus trichocarpa) идентифицировано 17 генов, кодирующих PtiCESA [19], их филогения сходна с филогенией целлюлозосинтаз льна [14]. Третичная клеточная стенка может индуцироваться в ксилемных волокнах и у растений льна, подвергнутых гравистимуляции [20, 21]. По механизмам формирования она должна быть близка к третичной клеточной стенке в ксилемных волокнах древесины натяжения тополя. При этом в ходе гравитропического ответа происходят существенные изменения и в конститутивно формируемой третичной клеточной стенке флоэмных волокон [20, 22]. Через 8 ч после гравистимуляции активируется экспрессия генов некоторых изоформ LusCESA во флоэмных волокнах, расположенных на верхней (тянущей) стороне стебля: LusCESA1-A, LusCESA3-B,3-C, LusCESA4, LusCESA7-B, LusCESA8-B [16].
Накопление и систематизация транскриптомных данных для льна и тополя привели к созданию онлайн-платформы FIBexDB (https://ssl.cres-t.org/fibex/, [23]), которая позволяет анализировать и сопоставлять экспрессию генов целлюлозосинтаз в различных тканях стебля льна и тополя в ходе развития гравиответа. Цель данной работы – выявить особенности экспрессии генов целлюлозосинтаз в волокнах различного происхождения, формирующих утолщенную третичную клеточную стенку, обогащенную целлюлозой. В работе рассмотрены три различные системы: 1) флоэмные волокна льна в условиях гравистимуляции, которые в норме формируют третичную клеточную стенку (конститутивно); 2) ксилемная часть растений льна (L. usitatissimum), в ксилемных волокнах которой индуцируется формирование третичной клеточной стенки в ходе гравистимуляции; 3) древесина натяжения тополя (Populus alba × × tremula), в ксилемных волокнах которой формируется третичная клеточная стенка (рис. 1). Сопоставление уровня экспрессии генов различных целлюлозосинтаз в этих системах позволяет приблизиться к пониманию механизмов биосинтеза целлюлозы в третичной клеточной стенке, которые до сих пор не расшифрованы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспрессия генов целлюлозосинтаз в тканях стебля льна (L. usitatissimum) при гравистимуляции. Сопоставление экспрессии генов целлюлозосинтаз в ходе гравитропического ответа растений льна проводили на основе ранее проведенных экспериментов, первичные результаты которых депонированы в базе данных NCBI (PRJNA631357) и внесены в базу данных FIBexDB. Описание методики транскриптомного анализа приведено в соответствующих публикациях [16, 21, 24]. Гравистимуляция в этих работах достигалась путем наклона растений льна; при последующем развитии гравиответа были отобраны образцы изолированных флоэмных волокон (tFIB) и ксилемной части стебля (sXYL) с тянущей (PUL, от англ. pulling) и противоположной стороны стебля (OPP, от англ. opposite) через 8, 24 и 96 ч после наклона (рис. 1). Через 96 ч стебель растения выше изгиба (сформирован в области 3–5 см выше семядольных листьев) принимал вертикальное положение. Ранее было показано, что гравистимуляция приводит к появлению видимых морфологических изменений во флоэмных волокнах (расширение люмена волокон, формирование “перетяжек” [20]), а также к изменениям в экспрессии ряда генов, продукты которых вовлечены в формирование клеточной стенки [24], и модификациям в межмолекулярных взаимодействиях между полисахаридами клеточной стенки [22]. Также гравистимуляция индуцировала формирование третичной клеточной стенки в ксилемных волокнах [21].
Мы рассмотрели экспрессию генов LusCESA в ходе развития гравиответа в анализируемых тканях льна. И во флоэмных волокнах, и в ксилемной части стебля экспрессировались гены LusCESA, продукты которых синтезируют целлюлозу как первичной, так и вторичной клеточной стенки (рис. 2а). При этом в ксилемной части стебля гены SCW LusCESA были активированы в большей степени по сравнению с флоэмными волокнами, тогда как гены PCW LusCESA экспрессировались примерно на одинаковом уровне во всех анализируемых образцах. Ксилемная часть стебля представляет собой смесь тканей, в которой присутствуют клетки с первичной клеточной стенкой, при этом большая часть представлена сосудами и волокнами, которые формируют вторичную клеточную стенку. В таком случае, если опираться на классические представления о формировании клеточных стенок, в ксилемной части стебля экспрессию генов PCW LusCESA мы можем ассоциировать с формированием клеточных стенок паренхимы, молодых сосудов и волокон, а повышенную экспрессию генов SCW LusCESA – с формированием вторичной клеточной стенки в зрелых сосудах и волокнах, которые преобладают в этой части стебля. Более того, известно, что при переходе от синтеза первичной клеточной стенки к отложению вторичной какое-то время возможно сосуществование двух типов комплексов [8].
Рис. 2.
(а) – Экспрессия генов LusCESA во флоэмных волокнах (tFIB) и ксилемной части (sXYL) на разных сторонах стебля льна (тянущей, PUL, и противоположной, OPP) в ходе развития гравиответа (8, 24, 96 ч после наклона); (б) – отношение экспрессии генов LusCESA в тканях растений льна (tFIB_PUL, tFIB_OPP, sXYL_PUL, sXYL_OPP) в ходе развития гравиответа (8, 24, 96 ч после наклона) к экспрессии генов в соответствующих тканях контрольных растений, которые не подвергались гравистимуляции (tFIBb, sXYLb); (в) – отношение экспрессии генов LusCESA в тканях растений льна (tFIB, sXYL), отобранных с тянущей стороны стебля (PUL), к экспрессии генов в тканях из соответствующих участков стебля, отобранных с противоположной стороны тех же растений (OPP), в ходе развития гравиответа (8, 24, 96 ч после наклона). Оранжевые столбики – LusCESA, продукты которых вовлечены в формирование первичной клеточной стенки (PCW); синие столбики – LusCESA, продукты которых вовлечены в формирование вторичной клеточной стенки (SCW).

Во флоэмных волокнах, формирующих третичную клеточную стенку, экспрессия генов PCW LusCESA была примерно на том же уровне, что и в ксилемной ткани, и даже более выражена для некоторых изоформ на ранних стадиях гравиответа (8 и 24 ч) в волокнах с тянущей части стебля. При этом образцы изолированных волокон обогащены именно волокнами с третичной клеточной стенкой, а не выступают смесью тканей, как ксилемная часть. Это означает, что по крайней мере в одном типе клеток – волокнах, формирующих третичную клеточную стенку, – одновременно экспрессируются и PCW LusCESA, и SCW LusCESA, причем это наблюдается и в контрольных растениях, и на разных стадиях развития гравиответа.
Если сравнить экспрессию LusCESA во флоэмных волокнах и ксилемной части гравистимулированных и контрольных растений (рис. 2б), то существенные изменения в экспрессии LusCESA отчетливо детектировались в изолированных флоэмных волокнах. При этом изменения наблюдались как с тянущей, так и с противоположной стороны стебля, хотя и в разных временных точках: повышение экспрессии большинства генов PCW и SCW LusCESA отмечалось в волокнах с тянущей стороны уже после 8 ч после наклона, тогда как с противоположной стороны стебля максимальные отличия с контрольными растениями наблюдались позднее (24 ч после наклона) (рис. 2б).
Если сравнить экспрессию генов LusCESA в изолированных волокнах одних и тех же растений, но отобранных с тянущей и противоположных сторон стебля (PUL/OPP), то очевидно, что более высокая их активация наблюдалась во флоэмных волокнах с тянущей стороны на ранней стадии гравиответа (8 ч) (рис. 2в). Именно в волокнах, локализованных на тянущей стороне стебля, наблюдаются существенные морфологические изменения в ходе гравиответа [20]. В ксилемной части стебля изменения в экспрессии были незначительными, хотя экспрессия некоторых генов PCW LusCESA повышалась в участках стебля с тянущей стороны, а на более поздних этапах (96 ч после наклона) отмечалось небольшое повышение экспрессии генов SCW LusCESA (рис. 2в). Поскольку в ксилемных волокнах с тянущей стороны стебля индуцируется формирование третичной клеточной стенки [20, 22], отсутствие выраженных вариаций в экспрессии различных генов LusCESA может быть связано с гетерогенностью образцов ксилемы, в которых количество клеток, формирующих третичную стенку, существенно ниже, чем клеток, откладывающих вторичную стенку. В последних, судя по полученным данным, экспрессия LusCESA не изменяется существенно в ответ на гравистимуляцию. Возможно также, что высокий уровень экспрессии SCW LusCESA, характерный для клеток ксилемы, формирующих вторичную клеточную стенку (рис. 2а), достаточен для запуска отложения третичной клеточной стенки в ходе гравиответа.
Кластеризация генов LusCESA по характеру изменения их экспрессии, проведенная для флоэмных волокон и образцов ксилемы льна, выявила в обоих случаях несколько групп генов (рис. 3). В некоторых из этих кластеров гены PCW LusCESA и SCW LusCESA были перемешаны друг с другом. Так, у флоэмных волокон во втором кластере LusCESA8-A соседствовал с двумя вариантами LusCESA3 и с LusCESA6-В, а в третьем кластере присутствовали несколько вариантов LusCESA6 и LusCESA4 (рис. 3а). Аналогично, во второй кластер из образцов ксилемы попали несколько SCW LusCESA и LusCESA3-С (рис. 3б). Это может свидетельствовать о сходном характере регуляции некоторых PCW и SCW LusCESA при формировании третичной клеточной стенки, что не характерно для других типов клеточных стенок. Последствия такой комбинации для свойств формируемых микрофибрилл целлюлозы еще предстоит выяснить.
Рис. 3.
Кластеризация генов LusCESA во флоэмных волокнах (а) и ксилемной части стебля льна (б) в ходе гравистимуляции (через 8, 24, 96 ч после наклона). tFIB_PUL и sXYL_PUL – изолированные флоэмные волокна и ксилемная часть соответственно с тянущей стороны стебля льна; tFIB_OPP и sXYL_OPP – изолированные флоэмные волокна и ксилемная часть соответственно с противоположной стороны стебля льна. Цвета тепловой карты отражают уровень экспрессии в горизонтальном ряду (образцы) от максимального (красный) до минимального (синий).

Кластеризация четко выявляет различия в экспрессии LusCESA в образцах, отобранных с различных сторон стебля гравистимулированных растений льна (PUL и OPP). Особенно четко эти различия выявляются на изолированных флоэмных волокнах. Изучение особенностей строения целлюлозы гравистимулированных растений льна с помощью твердотельного ЯМР хоть и не выявило существенных различий в размерах макрофибрилл целлюлозы для PUL и контрольных образцов, но продемонстрировало существенные различия в их организации, а также в параметрах микрофибрилл, формирующих эти макрофибриллы. При гравистимуляции наблюдалось увеличение степени кристалличности целлюлозы (за счет увеличения размера кристаллического кора микрофибрилл), снижение отношения Iα/Iβ (прежде всего, за счет возрастания доли β-алломорфа), уменьшение доли паракристаллической целлюлозы и снижение доли цепей недоступной поверхности микрофибрилл, погруженной внутрь макрофибриллы. Усиление упорядоченности сопровождалось снижением подвижности целлюлозы, что было продемонстрировано в SP/MAS 13C-ЯМР-экспериментах [22].
Экспрессия генов целлюлозосинтаз в древесине тополя (P. alba × tremula) при гравистимуляции. Наиболее известный пример индуцированного формирования третичной клеточной стенки – древесина натяжения тополя (Populus sp.), в которой третичная клеточная стенка формируется в ксилемных волокнах на верхней части ствола (стебля) при его наклоне. Отложение третичной клеточной стенки происходит в ксилемных волокнах, которые уже содержат выраженные слои вторичной (один или несколько) клеточной стенки [10]. Ранее уже отмечалось, что формирование желатинозного слоя (третичной клеточной стенки) в древесине натяжения осины (Populus tremula) сопровождается увеличением экспрессии гена PtaCESA8-B, а для остальных генов SCW PtaCESA отмечали снижение экспрессии по сравнению с нормальной древесиной [26]. При этом анализа экспрессии генов, кодирующих все изоформы CESA, в ходе развития гравиответа в древесине натяжения (tension wood, TW) и сравнения их с нормальной древесиной (normal wood, NW) и с древесиной на противоположной стороне (opposite wood, OW) не проводилось. В своей работе для анализа экспрессии генов Pa×tCESA мы использовали данные для гибрида тополя белого и осины (P. alba × tremula INRA 717-1B4), размещенные в FIBexDB [25]. Для RNA-seq-анализа Zinkgraf et al. отбирали образцы древесины натяжения (TW) и образцы древесины с противоположной стороны (OW) через 2, 8, 24, 48, 96 и 336 ч после наклона растений. В качестве референсного генома при RNA-seq-анализе данных транскриптомов гибридного тополя P. alba × tremula использовали геном тополя P. trichocarpa [25]; различия в нуклеотидных последовательностях генов этих видов минимальны, об эффективности и допустимости такого анализа также говорится в работе Liu et al. [27].
При анализе экспрессии генов Pa×tCESA в древесине гибридного тополя ожидаемо выявлен более высокий уровень экспрессии генов SCW Pa×tCESA по сравнению с PCW Pa×tCESA во всех тканях (рис. 4а). Экспрессия генов SCW Pa×tCESA (при усреднении экспрессии генов всех изоформ PCW и SCW) была выше в ~12.7 раз по сравнению с генами PCW Pa×tCESA: 28 000 и 2200 прочтений, картируемых на каждый ген (total gene reads, TGR) соответственно. При этом наблюдалась разница в экспрессии генов различных изоформ (PCW и SCW) в разных образцах древесины, а также изменение в экспрессии генов различных изоформ в ходе развития гравитропической реакции. Так, во всех образцах древесины высокий уровень экспрессии был присущ гену Pa×tCESA4, а ген Pa×tCESA8-A имел минимальный уровень экспрессии среди генов SCW Pa×tCESA во всех образцах древесины.
Рис. 4.
(a) – Экспрессия генов Pa×tCESA в нормальной древесине (NW), в древесине натяжения (TW) и противоположной древесине (OW) гибридного тополя (P. alba × tremula) в ходе развития гравиответа (2, 8, 24, 48, 96, 336 ч после наклона); (б) – отношение уровня экспрессии генов Pa×tCESA в тканях древесины (OW, TW) в ходе развития гравиответа (2, 8, 24, 48, 96, 336 ч после наклона) к уровню экспрессии генов в древесине контрольных растений (NW); (в) – отношение уровня экспрессии генов Pa×tCESA в тканях древесины натяжения (TW) к уровню экспрессии генов в тканях древесины, противолежащей древесине натяжения (OW), в ходе развития гравиответа (2, 8, 24, 48, 96, 336 ч после наклона). Оранжевые столбики – Pa×tCESA, продукты которых вовлечены в формирование первичной клеточной стенки, синие столбики – Pa×tCESA, продукты которых вовлечены в формирование вторичной клеточной стенки.
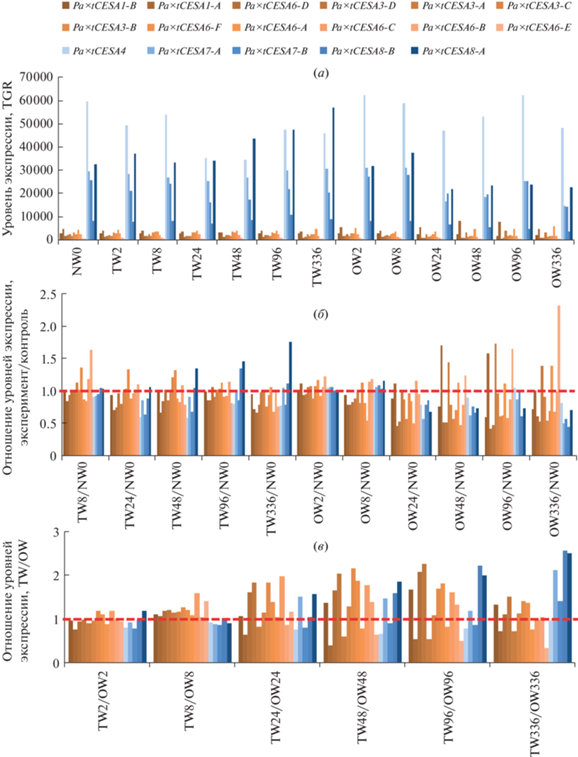
При сравнении экспрессии Pa×tCESA в образуемой в ответ на гравистимуляцию древесине натяжения с нормальной древесиной (рис. 4б) показано, что экспрессия некоторых генов PCW Pa×tCESA и всех SCW Pa×tCESA подавлена в древесине с противоположной стороны (OW), тогда как некоторые гены PCW Pa×tCESA, наоборот, существенно активировались в этих образцах по сравнению с контролем. В древесине натяжения разница с контрольными образцами была не столь существенной (рис. 4б), при этом, начиная с 48 ч, наблюдалась активация экспрессии генов SCW Pa×tCESA. Поскольку образцы древесины представляют собой смесь тканей, в которых формируется и первичная, и вторичная клеточные стенки, то соотнести активацию определенных изоформ с формированием определенного типа клеточной стенки, опираясь на представленные данные, невозможно. При этом древесина натяжения отличается от нормальной древесины и древесины с противоположной стороны стебля, главным образом, наличием третичной клеточной стенки в ксилемных волокнах.
При сравнении транскрипционных профилей генов Pa×tCESA в образцах, которые отобраны с одних и тех же растений (древесина натяжения и древесина противоположной стороны стебля), в древесине натяжения была выявлена активация экспрессии некоторых генов PCW Pa×tCESA (Pa×tCESA1-A, 3-A, 3-B, 6-A, 6-B, 6-D, 6-E) и подавление экспрессии остальных генов PCW Pa×tCESA (рис. 4в). Максимальные различия в экспрессии генов PCW Pa×tCESA наблюдали через 48 и 96 ч после гравистимуляции, через 336 ч различия постепенно сглаживались, тогда как экспрессия некоторых генов SCW Pa×tCESA (Pa×tСESA7-A, 8-A, 8-B) активировалась в древесине натяжения по сравнению с древесиной, расположенной с противоположной стороны стебля, и достигала максимума через 336 ч (рис. 4в). Кластеризация генов выявила группы, в каждой из которых представлены исключительно гены PCW Pa×tCESA либо SCW Pa×tCESA (рис. 5).
Рис. 5.
Кластеризация генов Pa×tCESA в древесине натяжения (TW) и в древесине противоположной стороны стебля (OW) в ходе гравистимуляции тополя (через 2, 8, 24, 96, 336 ч после наклона). Цвета тепловой карты отражают уровень экспрессии в горизонтальном ряду (образцы) от максимального (красный) до минимального (синий).

Сравнение экспрессии генов различных изоформ CESA в тканях стебля льна и тополя в ходе гравистимуляции. Во всех анализируемых нами системах представлены образцы тянущей части (PUL, TW) и противоположной части стебля (OPP, OW) гравистимулированного растения, что позволяет провести сопоставление динамики экспрессии CESA в ходе гравиответа. Такое сопоставление опирается на результаты проведенного ранее филогенетического анализа аминокислотных последовательностей целлюлозосинтаз резуховидки (A. thaliana), льна (L. usitatissimum) и тополя (P. trichocarpa) [14], позволившего соотнести различные изоформы CESA и провести их обозначение с учетом степени родства. В геномах льна и тополя произошло увеличение числа всех изоформ CESA по сравнению с резуховидкой, при этом большинство ортологов в геноме льна имеют соответствующие ортологи в геноме у тополя, за исключением изоформы PtiCESA3-D, которая не выявлена у льна. Экспрессия для паралогов одного гена может иметь как сходную динамику, что может свидетельствовать об их схожих функциях, так и отличаться, что может свидетельствовать об их различных функциях. Чаще для CESA мы наблюдаем реализацию первого сценария, особенно при явной дупликации генов (например, LusCESA1-A/B, LusCESA7-A/B), а отличия в экспрессии выявляются для генов изоформ из клад с большим количеством представителей (например, LusCESA3, LusCESA6).
Сопоставление транскриптомных данных для разных модельных систем позволило обнаружить ряд закономерностей в динамике экспрессии генов CESA в ходе гравиответа. В ксилемных образцах реакция развивалась позднее, чем во флоэмных волокнах, что, по всей видимости, связано с тем, что во флоэмных волокнах формирование третичной стенки уже отлажено, а в ксилемных образцах инициируется с нуля (рис. 6а, 6б). С этим же, вероятно, отчасти связана и на порядок более низкая экспрессия SCW LusCESA во флоэмных волокнах льна (даже на тянущей стороне стебля) по сравнению с ксилемными образцами из обоих проанализированных видов растений (рис. 7а, 7б). При этом основной причиной такого эффекта служит активное формирование вторичной клеточной стенки во многих тканях гетерогенных ксилемных образцов, тогда как в тканево-однородных флоэмных волокнах этот процесс полностью отсутствует. Очевидно, что при формировании третичной клеточной стенки гены PCW и SCW CESA экспрессируются примерно на одинаковом уровне, в то время как при отложении вторичной клеточной стенки этот баланс резко сдвинут в сторону SCW CESA.
Рис. 6.
Экспрессия генов PCW CESA в изолированных волокнах льна (а), в ксилемной части стебля льна (б) и в древесине тополя (OW, TW) (в) в ходе гравиответа. В качестве первой точки приведены данные для контрольных растений, которые не подвергались гравистимуляции; (г) – филогенетическое древо CESA резуховидки, тополя (P. trichocarpa) и льна. Построено для аминокислотных последовательностей CESA (Mokshina et al., 2014) с помощью программы MEGA7 (Maximum Likelihood метод, модель JTT+G). Клады, несущие изоформы PCW CESA (оранжевый), объединены; клады для изоформ SCW CESA (синий) объединены для разных растений.

Рис. 7.
Экспрессия генов SCW CESA в изолированных волокнах льна (а), в ксилемной части стебля льна (б) и в древесине тополя (OW, TW) (в) в ходе гравиответа. В качестве первой точки приведены данные для контрольных растений, которые не подвергались гравистимуляции; (г) – филогенетическое древо CESA резуховидки, тополя (P. trichocarpa) и льна. Построено для аминокислотных последовательностей CESA (Mokshina et al., 2014) с помощью программы MEGA7 (Maximum Likelihood метод, модель JTT+G). Клады, несущие изоформы SCW CESA (синий), объединены; клады для изоформ PCW CESA (оранжевый) объединены для разных растений.

Изменения экспрессии генов Pa×tCESA в древесине натяжения тополя более многоплановы, чем в образцах льна. Так, в ходе гравиответа наблюдалась активация экспрессии некоторых Pa×tCESA в ксилемных тканях, расположенных со стороны ОW, по сравнению с TW (Pa×tCESA1 и Pa×tCESA4; рис. 6в, 7в). В аналогичных образцах льна экспрессия ни одной из изоформ LusCESA в образце OPP не превышала таковую в образце PUL. Было высказано предположение, что механизмы биосинтеза клеточной стенки флоэмных волокон тополя могут отличаться от биосинтеза клеточной стенки ксилемных волокон с третичной клеточной стенкой, поскольку нокаут генов SCW PtiCESA по-разному сказывался на морфологии этих клеток [28]. При этом у льна все базовые характеристики третичной клеточной стенки, конститутивно формируемой во флоэмных волокнах, аналогичны таковым в индуцируемой в ксилемных волокнах в ходе гравиответа [21].
Разные гены, кодирующие различные изоформы одного и того же варианта целлюлозосинтазы (например, CESA3), имели различные паттерны экспрессии, причем некоторые закономерности выявлялись во всех проанализированных модельных системах. Так, ген CESA6-F имел существенно более низкий уровень экспрессии во всех образцах (лен и тополь) по сравнению с другими генами первичных изоформ (на порядок/порядки), что позволяет предположить функциональные отличия кодируемого им продукта от продуктов других CESA6. Наглядно продемонстрирована диверсификация экспрессии различных изоформ гена LusCESA3: наблюдалось увеличение экспрессии LusCESA3-B и LusCESA3-С в волокнах с тянущей стороны и низкий уровень экспрессии гена LusCESA3-A во всех проанализированных тканях (рис. 6а, 6б). Вероятно, продукт гена LusCESA3-A, как и LusCESA6-F, функционально отличается от других членов рассматриваемой клады и не ассоциирован с реализацией гравиответа.
В ходе развития гравиответа динамика экспрессии некоторых генов CESA сходным образом отличалась в образцах тянущей и противоположной стороны стебля во всех модельных системах. Так, во всех образцах с тянущей стороны стебля происходила активация экспрессии CESA8-В (рис. 7). Подобный эффект отмечался также в древесине натяжения осины (P. tremula); было даже высказано предположение, что третичная клеточная стенка в древесине натяжения синтезируется особым комплексом, который состоит исключительно из CESA8-B [26]. Это предположение было опровергнуто недавно опубликованной работой, согласно которой нокаут любого из генов SCW CESA (PtiCESA4, или PtiCESA7A/B, или PtiCESA8A/B) приводит к тому, что в ксилемных и флоэмных волокнах гравистимулированных растений тополя не формируется третичная клеточная стенка [28].
В экспериментальных работах, посвященных функционированию целлюлозосинтазных комплексов, периодически возникает вопрос о стехиометрии входящих в них изоформ. Принято считать, что SCW CESA в комплексах находятся в эквимолярных соотношениях, т.е. 1 : 1 : 1 для CESA4, 7, 8, как показано при отложении вторичных стенок в ксилеме резуховидки (A. thaliana) [29] и древесине ели обыкновенной (Picea abies) [26]. Стехиометрия изоформ CESA1, 3, 6 при формировании первичной клеточной стенки резуховидки также определена как эквимолярная, т.е. 1 : 1 : 1 [30]. Однако в древесине осины (P. tremula), как установлено при масс-спектрометрическом анализе представленности пептидных фрагментов, специфичных для конкретных изоформ, соотношение SCW CESA составляет 3 : 2 : 1 (PtaCESA8a/b : PtaCESA4 : PtaCESA7a/b), причем в древесине натяжения оно меняется на 8 : 3 : 1 [26]. Судя по нашим данным, полученным при анализе динамики уровня мРНК соответствующих генов, стехиометрия как PCW, так и SCW CESA подвижна и может различаться, т.к. не все изоформы активируются в равной степени. Например, LusCESA3-B и LusCESA3-С активируются в большей степени во флоэмных волокнах с тянущей стороны. Также остается открытым вопрос о том, различается ли стехиометрия CESA в волокнах различного происхождения (флоэмные и ксилемные).
Вопрос о стехиометрии изоформ связан с вопросом их функциональных различий, в частности с характером расположения изоформ в комплексе, их взаимодействия между собой и другими вспомогательными белками. Анализ функциональных особенностей SCW CESA показал отличия в сайт-специфичности при белковых взаимодействиях, что может обусловливаться их положением в комплексе. Так, показано, что CESA7 имеет наибольшую сайт-специфичность, и положение этого белка наиболее критично для функционирования всего комплекса, тогда как CESA8, напротив, в наименьшей степени обладает специфичностью при взаимодействии с другими белками [31]. Интересно, что именно целлюлозосинтаза AtCESA7 способна частично восстанавливать биосинтез целлюлозы первичной клеточной стенки при трансформации кодирующего ее гена в мутанты резуховидки cesa3, а целлюлозосинтаза AtCESA1 может частично восстановить биосинтез вторичной клеточной стенки у мутанта cesa8ko [7]. Кроме того, согласно филогенетическому анализу, клада генов, кодирующих CESA7, отличается от клад других SCW CESA (рис. 7г).
Таким образом, гравистимуляция приводит к активации экспрессии генов некоторых изоформ LusCESA, при этом во флоэмных волокнах льна подобная активация может быть с большой вероятностью ассоциирована с перестройками в третичной клеточной стенке волокна, а в ксилемных тканях и древесине натяжения активация CESA может быть связана с перестройками и биосинтетическими процессами в разных типах клеток. В целом полученные данные свидетельствуют об особенностях набора различных изоформ целлюлозосинтаз при формировании третичной клеточной стенки. На каких именно параметрах биосинтеза целлюлозы эти особенности сказываются, предстоит выяснить в дальнейших исследованиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для оценки экспрессии генов CESA использовали нормализованные транскриптомные данные, размещенные в базе данных FIBexDB, подбаза транскриптомов льна (https://ssl.cres-t.org/fibex/flax/, [23]). Для растений льна транскриптомные данные (в двух повторностях) были получены нами ранее для изолированных волокон и ксилемной части стебля прямостоячих растений (tFIBb, sXYL), а также с тянущей (tFIBb_PUL, sXYLb_PUL) и противоположной стороны (tFIBb_OPP, sXYLb_OPP) стебля в ходе развития гравитропической реакции (через 8, 24, 96 ч после наклона) (номер проекта в NCBI PRJNA631357) (табл. 1). Транскриптомные данные были верифицированы с помощью количественной ПЦР путем попарного сравнения экспрессии некоторых изоформ LusCESA, а также генов других белков, в волокнах на разных сторонах стебля и с волокнами контрольных растений [24]. Аннотация генов целлюлозосинтаз была проведена согласно работе Mokshina et al. [14].
Таблица 1.
Описание образцов, транскриптомные данные которых были использованы в работе
| № | Название образца | Растение | Описание | Ссылка |
|---|---|---|---|---|
| 1 | tFIBb | L. usitatissimum | Изолированные волокна с третичной клеточной стенкой (tFIBb). Нижняя часть стебля, 5 см, без наклона | [32] |
| 2 | tFIBb_PUL8/24/96 | L. usitatissimum | Изолированные волокна с третичной клеточной стенкой с тянущей стороны (PUL) стебля через 8, 24 и 96 ч после наклона | [21, 24] |
| 3 | tFIBb_OPP8/24/96 | L. usitatissimum | Изолированные волокна с третичной клеточной стенкой (tFIB) с противоположной стороны (OPP) стебля через 8, 24 и 96 ч после наклона | [21, 24] |
| 4 | sXYLb | L. usitatissimum | Ксилемная часть стебля с вторичной клеточной стенкой (sXYL). Нижняя часть стебля, 5 см, без наклона | [32] |
| 5 | sXYLb_PUL8/24/96 | L. usitatissimum | Ксилемная часть стебля с вторичной клеточной стенкой (sXYL) с тянущей стороны (PUL) стебля через 8, 24 и 96 ч после наклона | [21, 24] |
| 6 | sXYLb_OPP8/24/96 | L. usitatissimum | Ксилемная часть стебля с вторичной клеточной стенкой (sXYL) с противоположной стороны (OPP) стебля через 8, 24 и 96 ч после наклона | [21, 24] |
| 7 | NW_0 | P. alba × tremula | Нормальная древесина, без наклона | [25] |
| 8 | TW_2/8/24/48/96/336 | P. alba × tremula | Древесина натяжения после 2, 8, 24, 48, 96 и 336 ч гравистимуляции | [25] |
| 9 | OW_2/8/24/48/96/336 | P. alba × tremula | Древесина с противоположной стороны после 2, 8, 24, 48, 96 и 336 ч гравистимуляции | [25] |
Для древесины тополя использовали транскриптомные данные эксперимента [25] (номер проекта в NCBI PRJNA398515), размещенные в FIBexDB, подбаза транскриптомов тополя (https://ssl.cres-t.org/fibex/poplar/, [23]). Zinkgraf et al. [25] наклоняли 6-месячные растения тополя (P. alba × tremula INRA 717-1B4) до горизонтального положения и отбирали образцы из участка стебля 20–40 междоузлия после удаления коры через 2, 8, 24, 48, 96 и 336 ч гравистимуляции, собирая ксилемную часть лезвием с соответствующих сторон (TW, OW) (табл. 1); далее проводили RNA-seq-анализ [25]. Аннотация генов CESA тополя проведена нами на основе работы Kumar et al. [19] и с помощью сервиса Popgenie (https://popgenie.org/) (табл. 2). Согласно номенклатуре, предложенной в работе Kumar et al. [19], в префиксе генов CESA P. trichocarpa сокращается до Pti, P. tremula – до Pta, P. canescens (alba× tremula) – до Pa×t. Для генов льна и тополя указан ID согласно базе данных Phytozome (https://phytozome-next.jgi.doe.gov/), в которой в качестве префиксов для обозначения генов льна и тополя используются Lus и Potri соответственно.
Таблица 2.
Номера генов CESA и их сокращения
| Ген льна (Phytozome) | Название гена | Ген тополя (Phytozome) |
Название гена* |
|---|---|---|---|
| PCW CESA | |||
| Lus10018902 Lus10028597 | LusCESA1-A LusCESA1-B | Potri.018G029400 Potri.006G251900 | PtiCESA1-A/Pa×tCESA1-A PtiCESA1-B/Pa×tCESA1-B |
| Lus10039607 Lus10007538 Lus10012198 | LusCESA3-A LusCESA3-B LusCESA3-C | Potri.006G052600 Potri.016G054900 Potri.009G060800 Potri.001G266400 | PtiCESA3-A/Pa×tCESA3-A PtiCESA3-B/Pa×tCESA3-B PtiCESA3-C/Pa×tCESA3-C PtiCESA3-D/Pa×tCESA3-D |
| Lus10006161 Lus10041063 Lus10003526 Lus10002939 Lus10002940 Lus10022449 | LusCESA6-A LusCESA6-B LusCESA6-C LusCESA6-D LusCESA6-E LusCESA6-F | Potri.005G087500 Potri.007G076500 Potri.005G194200 Potri.002G066600 Potri.013G019800 Potri.005G027600 | PtiCESA6-A/Pa×tCESA6-A PtiCESA6-B/Pa×tCESA6-B PtiCESA6-C/Pa×tCESA6-C PtiCESA6-D/Pa×tCESA6-D PtiCESA6-E/Pa×tCESA6-E PtiCESA6-F/Pa×tCESA6-F |
| SCW CESA | |||
| Lus10008226 | LusCESA4 | Potri.002G257900 | PtiCESA4/Pa×tCESA4 |
| Lus10043485 Lus10043486 | LusCESA7-A LusCESA7-B | Potri.006G181900 Potri.018G103900 | PtiCESA7-A/Pa×tCESA7-A PtiCESA7-B/Pa×tCESA7-B |
| Lus10007296 Lus10029245 | LusCESA8-A LusCESA8-B | Potri.011G069600 Potri.004G059600 | PtiCESA8-A/Pa×tCESA8-A PtiCESA8-B/Pa×tCESA8-B |
* Поскольку при анализе транскриптомов P. alba × tremula использовали геном P. trichocarpa в качестве референсного [25], названия генов PtiCESA и Pa×tCESA совпадают.
Кластеризацию проводили с помощью опций базы данных FIBexDB: список номеров генов помещали в окно “search by multiple queries”. После вывода на экран данных экспрессии для выбранных генов и образцов выбирали алгоритм для кластеризации k-means (Cluster3) (число кластеров – 4), Pearson correlation.
Построение филогенетического древа на основе аминокислотных последовательностей CESA льна (L. usitatissimum), тополя (P. trichocarpa) и резуховидки (A. thaliana) [14] проводили с помощью программы MEGA7 (Maximum Likelihood метод, модель JTT+G).
ЗАКЛЮЧЕНИЕ
Показано, что гравистимуляция вызывает перестройки в клеточной стенке флоэмных волокон льна (L. usitatissimum), которые сопровождаются кратковременной активацией биосинтетических процессов на ранних стадиях гравиответа с участием различных изоформ целлюлозосинтаз. В ксилемной части стебля льна гравистимуляция приводит к индукции образования третичной клеточной стенки в ксилемных волокнах, что сопровождается постепенным увеличением экспрессии генов целлюлозосинтаз, вовлеченных в формирование вторичной клеточной стенки (SCW LusCESA). Гравистимуляция древесины тополя (Populus sp.) также сопровождается активацией некоторых генов PCW и SCW Pa×tCESA в древесине натяжения. Активация экспрессии некоторых генов PCW Pa×tCESA и подавление экспрессии других генов PCW Pa×tCESA отмечались в древесине, расположенной на противоположной от древесины натяжения стороне стебля. Особую роль в гравиответе у различных систем (флоэмные волокна, древесина натяжения) может играть CESA8-B, поскольку увеличение экспрессии гена этой изоформы было продемонстрировано как для древесины натяжения, так и для флоэмных волокон с тянущей стороны стебля льна. Стехиометрия SCW CESA в волокнах льна и древесины натяжения тополя может быть сходной, а стехиометрия PCW CESA предположительно не эквимолярная.
Список литературы
Nixon B.T., Mansouri K., Singh A., Du J., Davis J.K., Lee J.-G., Slabaugh E., Vandavasi V.G., O’Neill H., Roberts E.M., Roberts A.W., Yingling Y.G., Haigler C.H. // Sci. Rep. 2016. V. 6. P. 28696. https://doi.org/10.1038/srep28696
Purushotham P., Ho R., Zimmer J. // Sci. 2020. V. 369. P. 1089–1094. https://doi.org/10.1126/science.abb2978
Richmond T.A., Somerville C.R. // Plant Physiol. 2000. V. 124. P. 495–498. https://doi.org/10.1104/pp.124.2.495
Doblin M.S., Kureck I., Jacob-Wilk D., Delmer D.P. // Plant Cell Physiol. 2002. V. 43. P. 1407–1420. https://doi.org/10.1093/pcp/pcf164
Kumar M., Turner S. // Phytochem. 2015. V. 112. P. 91–99. https://doi.org/10.1016/j.phytochem.2014.07.009
Hématy K., Höfte H. // In: Plant Cell Monographs / Ed. Verbelen J.-P., Vissenberg K. Springer Verlag, 2006. V. 6. P. 33–56. https://ur.booksc.me/book/11611855/c97d70
Carroll A., Mansoori N., Li S.D., Lei L., Vernhettes S., Visser R.G.F., Somerville C., Gu Y., Trindade L.M. // Plant Physiol. 2012. V. 160. P. 726–737. https://doi.org/10.1104/pp.112.199208
Watanabe Y., Schneider R., Barkwill S., Gonzales-Vigil E., Hill J.L., Jr., Samuels A.L., Persson S., Mansfield S.D. // PNAS. 2018. V. 115. P. E6366–E6374.
Song D., Shen J., Li L. // New Phytol. 2010. V. 187. P. 777–790. https://doi.org/10.1111/j.1469-8137.2010.03315.x
Gorshkova T., Chernova T., Mokshina N., Ageeva M., Mikshina P. // New Phytol. 2018. V. 218. P. 66–72. https://doi.org/10.1111/nph.14997
Gorshkova T., Brutch N., Chabbert B., Deyholos M., Hayashi T., Lev-Yadun S., Mellerowicz E.J., Morvan C., Neutelings G., Pilate G. // Critic. Rev. Plant Sci. 2012. V. 31. P. 201–228. https://doi.org/10.1080/07352689.2011.616096
Guedes F.T.P., Laurans F., Quemener B., Assor C., Lainé-Prade V., Boizot N., Vigouroux J., Lesage-Descauses M.-C., Leplé J.-C., Déjardin A., Pilate G. // Planta. 2017. V. 246. P. 857–878. https://doi.org/10.1007/s00425-017-2737-1
Горшкова Т.А., Гурьянов О.П., Микшина П.В., Ибрагимова Н.Н., Мокшина Н.Е., Сальников В.В., Агеева М.В., Аменицкий С.И., Чернова Т.Е., Чемикосова С.Б. // Физиология растений. 2010. Т. 57. № 3. С. 328–341.
Mokshina N., Gorshkova T., Deyholos M.K. // PLoS One. 2014. V. 9. P. e97949. https://doi.org/10.1371/journal.pone.0097949
Wang Z., Hobson N., Galindo L., Zhu S., Shi D., McDill J., Yang L., Hawkins S., Neutelings G., Datla R., Lambert G., Galbraith D.W., Grassa C.J., Geraldes A., Cronk Q.C., Cullis C., Dash P.K., Kumar P.A., Cloutier S., Sharpe A.G., Wong G.K., Wang J., Deyholos M.K. // Plant J. 2012. V. 72. P. 461–473. https://doi.org/10.1111/j.1365-313X.2012.05093.x
Mokshina N., Gorshkov O., Ibragimova N., Chernova T., Gorshkova T. // Function. Plant Biol. 2017. V. 44. P. 820–831. https://doi.org/10.1071/FP17105
Clair B., Dejardin A., Pilate G., Alméras T. // Front. Plant Sci. 2018. V. 9. P. 623. https://doi.org/10.3389/fpls.2018.00623
Gorshkova T., Mokshina N., Chernova T., Ibragimova N., Salnikov V., Mikshina P., Tryfona T., Banasiak A., Immerzeel P., Dupree P., Mellerowicz E.J. // Plant Physiol. 2015. V. 169. P. 2048–2063. https://doi.org/10.1104/pp.15.00690
Kumar M., Thammannagowda S., Bulone V., Chiang V., Han K.H., Joshi C.P., Mansfield S.D., Mellerowicz E., Sundberg B., Teeri T., Ellis B.E. // Trends Plant Sci. 2009. V. 14. P. 248–254. https://doi.org/10.1016/j.tplants.2009.02.004
Ibragimova N.N., Ageeva M.V., Gorshkova T.A. // Protoplasma. 2017. V. 254. P. 749–762. https://doi.org/10.1007/s00709-016-0985-8
Petrova A., Kozlova L., Gorshkov O., Nazipova A., Ageeva M., Gorshkova T. // Front. Plant Sci. 2021. V. 12. P. 660375. https://doi.org/10.3389/fpls.2021.660375
Ibragimova N., Mokshina N., Ageeva M., Gurjanov O., Mikshina P. // Int. J. Mol. Sci. 2020. V. 21. P. 5322. https://doi.org/10.3390/ijms21155322
Mokshina N., Gorshkov O., Takasaki H., Onodera H., Sakamoto S., Gorshkova T., Mitsuda N. // New Phytol. 2021. V. 231. P. 512–515. https://doi.org/10.1111/nph.17405
Gorshkov O., Mokshina N., Ibragimova N., Ageeva M., Gogoleva N., Gorshkova T. // Funct. Plant Biol. 2017. V. 45. P. 203–214. https://doi.org/10.1071/FP16348
Zinkgraf M., Gerttula S., Zhao S., Filkov V., Groover A. // J. Integr. Plant Biol. 2018. V. 60. P. 578–590. https://doi.org/10.1111/jipb.12645
Zhang X., Dominguez P.G., Kumar M., Bygdell J., Miroshnichenko S., Sundberg B., Wingsle G., Niittylä T. // Plant Physiol. 2018. V. 177. P. 1096–1107. https://doi.org/10.1104/pp.18.00394
Liu L., Missirian V., Zinkgraf M., Groover A., Filkov V. // BMC Genomics. 2014. V. 15. https://doi.org/10.1186/1471-2164-15-S5-S3
Xu W., Cheng H., Zhu S., Cheng J., Ji H., Zhang B., Cao S., Wang C., Tong G., Zhen C., Mu L., Zhou Y., Cheng Y. // New Phytol. 2021. V. 231. P. 1478–1495. https://doi.org/10.1111/nph.17338
Hill J.L., Jr., Hammudi M.B., Tien M. // Plant Cell. 2014. V. 26. P. 4834–4842. https://doi.org/10.1105/tpc.114.131193
Gonneau M., Desprez T., Guillot A., Vernhettes S., Höfte H. // Plant Physiol. 2014. V. 166. P. 1709–1712. https://doi.org/10.1104/pp.114.250159
Kumar M., Atanassov I., Turner S. // Plant Physiol. 2017. V. 173. P. 970–983. https://doi.org/10.1104/pp.16.01642
Mokshina N., Gorshkov O., Galinousky D., Gorshkova T. // Ind. Crop. Prod. 2020. V. 152. P. 112549. https://doi.org/10.1016/j.indcrop.2020.112549
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия