Биоорганическая химия, 2022, T. 48, № 4, стр. 470-478
Окислительная модификация и протеолиз белков печени садковой радужной форели при воздействии средовых факторов
Н. П. Канцерова 1, *, Е. Д. Тушина 1, И. В. Суховская 1, Л. А. Лысенко 1
1 Институт биологии – обособленное подразделение ФГБУН ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: nkantserova@yandex.ru
Поступила в редакцию 05.08.2021
После доработки 07.09.2021
Принята к публикации 18.09.2021
- EDN: CTKDRF
- DOI: 10.31857/S0132342322030083
Аннотация
В эксперименте показана динамика взаимосвязанных показателей – уровня окислительной модификации (карбонилирования) тканевых белков и активности протеиназ, осуществляющих контроль качества и утилизацию поврежденных, в том числе окисленных, белков (протеасом) – в печени культивируемой радужной форели (Oncorhynchus mykiss Walb.), как в периоды, благоприятствующие росту рыб, так и при воздействии естественных неблагоприятных факторов. Оба показателя демонстрировали корреляцию с темпом роста рыб, отражающим уровень общего метаболизма и окислительных процессов: содержание белковых карбонилов – положительную (r = 0.42, p < 0.01), а активность протеасом – отрицательную (r = –0.46, p < 0.01). При действии повреждающих факторов физиологическая динамика образования и утилизации белковых карбонилов нарушалась. Так, кратковременная гипоксия, вызванная падением уровня растворенного в воде кислорода, и метаболическая депрессия по окончании подледного периода приводили к уменьшению окислительного повреждения белков печени рыб, а инфекционные патогены, напротив, – к накоплению окисленных белков, менее выраженному при введении в рацион растительной добавки с антиоксидантной активностью. Активность протеасом, играющих ведущую роль в поддержании протеостаза клетки в условиях окислительного стресса, в рассматриваемых нами ситуациях повышалась лишь при воздействии множественных стрессоров – гипоксии с последовавшим инфицированием рыб. Экспериментальный рацион, содержащий натуральные биоактивные вещества, не изменял физиологическую динамику окисления белков и скорости их утилизации у рыб, растущих в оптимальных условиях, но способствовал сохранению баланса в этой системе и, в целом, повышению устойчивости рыб к действию повреждающих факторов.
ВВЕДЕНИЕ
Окислительные процессы лежат в основе энергообмена клетки и служат источником свободных радикалов – активных форм кислорода (АФК), азота и др., которые участвуют в физиологических процессах, но, образуясь в избытке, способны повреждать клеточные компоненты – органеллы, мембраны и макромолекулы. Свободно-радикальные процессы усиливаются при старении, действии прооксидантов и неблагоприятных средовых факторов [1–3] и, в случае их преобладания над эффективностью антиоксидантной системы (АОС), приводят к оксидативному стрессу и накоплению поврежденных макромолекул, в том числе продуктов окислительной модификации белков (ОМБ) [4]. По современным представлениям, АОС включает не только классические ферменты (каталазу, SOD, GPx, GST и др.) и молекулярные антиоксиданты (глутатион, ретинол, токоферолы), но и ряд транскрипционных факторов (например, Nrf2) и протеиназы контроля качества белков [5]. Контроль качества клеточных белков (в том числе элиминация окисленных (карбонилированных), аминокислотные остатки в которых необратимо модифицированы альдегидными или кетоновыми группами, и в силу этого утративших нативную структуру и биологическую функцию [6]) осуществляется путем их протеолитической деградации в аутофаголизосомах [7] и протеасомах [5]. В печени рыб преобладает протеасомный путь гидролиза окисленных белков, включающий энергозависимые этапы их распознавания протеиназами и, в ряде случаев, селективного мечения убиквитином [8]. Убиквитин-протеасомная система (УПС) включает 20S и 26S протеасомные комплексы, в полости которых расщепляются мономерные неубиквитинированные или меченные убиквитином полипептиды [9]; недостаточность протеасомной активности приводит к накоплению дефектных белков.
Помимо физиологической зависимости окислительных процессов в организме рыб от темпа их роста и эффективности АОС, снижающихся с возрастом, уровень белкового окисления у искусственно выращиваемой рыбы зависит от действия множественных стрессоров. Так, в условиях садкового рыбоводства радужная форель Oncorhynchus mykiss Walb. подвержена воздействию слабой проточности воды, высокой плотности посадки, летнего подъема температуры воды и ассоциированного с ними кислородного голодания [10, 11]. Стрессоры приводят к снижению темпов роста рыбы, распространению бактериальных инфекций, повышению летальности [12–14]. В современной аквакультуре отдается приоритет стимуляции естественной резистентности выращиваемых видов к повреждающим факторам и сопутствующему окислительному стрессу путем использования натуральных антиоксидантов. Показано, что экстракты гвоздики Eugenia caryophyllus и корицы Cinnamomum zeylanicum, богатые фенольными соединениями с антиоксидантной активностью, снижают степень перекисного окисления липидов (ПОЛ) в скелетных мышцах нильской тиляпии Oreochromis niloticus [15]. При введении в состав корма солодки Glycyrrhiza glabra и астрагала Astragalus membranaceus усиливается ответная реакция АОС печени желтого окуня Perca flavescens на кратковременные гипер-, гипотермию и гипоксию [16]. Стимулирующий потенциал веществ из лиственничного сырья – дигидрокверцетина (ДГК), флавоноида с доказанной антиоксидантной, противовоспалительной и противовирусной активностью [17, 18], и арабиногалактана (АГ), полисахарида с пребиотическим и иммуномодулирующим действием, – успешно применяется в медицине и ветеринарии [18, 19], но недостаточно изучен в аквакультуре [20–22]. Преимущество использования подобных соединений заключается прежде всего в их безопасности для живых организмов и окружающей среды.
Цель настоящей работы – изучение уровня карбонилированных белков и протеолитической активности протеасом в печени садковой радужной форели, выращенной на стандартном или обогащенном ДГК и АГ корме, при воздействии сезонных изменений средовых факторов, включая повреждающие (летнюю гипертермию, кислородное голодание и бактериальные патогены).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведено сравнение биохимических и физиологических показателей у двух групп радужной форели, получавших в течение двух выростных сезонов стандартный коммерческий корм (BioMar, Дания) без добавок (контрольные садки) или с добавкой, включавшей 25 мг ДГК и 50 мг АГ на 1 кг корма (опытные садки). В этот период на выращиваемую в садках форель действовали следующие неблагоприятные факторы: бактериальная инфекция, сезонное повышение температуры воды, гипоксия.
Рост и выживаемость форели. Статистически достоверные различия по темпу роста форели, выращиваемой в течение двух выростных сезонов на стандартном (контроль) и обогащенном смесью ДГК и АГ (опыт) корме, обнаружены не были (табл. 1). Тем не менее можно говорить о тенденции к более высокой скорости роста рыб, выращенных на экспериментальном рационе, поскольку к концу эксперимента средняя масса рыб контрольной группы составила 1947.3 ± 314.7 г, опытной – 2289.3 ± 120.3 г. Несмотря на ранее описанное активирующее влияние смеси ДГК и АГ на механизмы роста мышечной ткани радужной форели (снижение отрицательной регуляции миогенеза миостатином, повышение уровня экспрессии гена тяжелой цепи миозина) при кратковременном действии неблагоприятных факторов [21], добавка, по-видимому, не обладает способностью к стимуляции роста рыб в долговременной перспективе.
Таблица 1.
Относительный темп роста радужной форели, выращиваемой на стандартной диете (контроль) и с добавлением смеси ДГК + АГ (опыт)
| Год | Дата | Относительный темп роста, % массы/сутки | |
|---|---|---|---|
| контроль | опыт | ||
| 2017 | 14.07 | 2.2 ± 1.2 | 1.7 ± 0.8 |
| 26.07 | 2.7 ± 0.4 | 2.7 ± 0.9 | |
| 12.08 | 2.8 ± 1.4 | 3.7 ± 0.9 | |
| 28.08 | 3.5 ± 1.6 | 4.3 ± 1.0 | |
| 12.09 | 4.3 ± 1.4 | 5.3 ± 0.6 | |
| 16.11 | 4.4 ± 0.9 | 4.2 ± 0.7 | |
| 2018 | 12.05 | 2.2 ± 0.9 | 2.2 ± 0.6 |
| 27.06 | 2.7 ± 1.2 | 3.4 ± 0.9 | |
| 17.07 | 3.5 ± 1.5 | 3.7 ± 1.3 | |
| 24.08 | 3.9 ± 1.3 | 4.8 ± 1.6 | |
| 18.09 | 4.1 ± 1.5 | 4.9 ± 0.7 | |
Летальность среди рыб контрольной и опытной групп была сходной в начале периода наблюдений (июнь 2017 г.) – 0.96 против 0.95% и достоверно различалась (р < 0.05, значения в контроле и опыте соответственно) на пике инфекционного заболевания (середина июля – начало августа 2017 г.) – 2.18 против 0.67%, в период низких температур (подледный период декабрь 2017 г. – апрель 2018 г.) – 3.15 против 0.19%, в период высоких температур (конец июля – начало августа 2018 г.) – 1.15% против 0.82%. Полученные результаты согласуются с отмеченной ранее способностью растительных добавок повышать выживаемость культивируемых видов рыб, например, нильской тиляпии – на 11% при введении в состав корма экстракта прополиса и алое [23], морского окуня Dicentrarchus labrax, инфицированного Photobacterium damselae, при скармливании 5% экстракта морских водорослей Gracilaria sp. [24].
Окислительная модификация белков печени форели. Окислительная модификация белков печени садковой форели, оцениваемая по концентрации карбонилированных групп в их составе, варьировала в ходе наблюдения вслед за изменением внешних факторов и различалась в ряде случаев у рыб контрольной и опытной групп. Относительно низкое содержание белковых карбонилов в печени форели, выловленной по окончании подледного периода (май 2018 г.; рис. 1), по всей видимости, связано со сниженным уровнем общего метаболизма, включая окислительные процессы, у рыб в ходе зимовки. Описанная реакция была в равной степени выражена у рыб, выращенных на контрольном или обогащенном ДГК и АГ рационе (1.4 ± 0.3 против 1.3 ± 0.3 нмоль/мг белка). Содержание белковых карбонилов, аналогично скорости весового прироста, повышалось в соответствии с сезонным ростом температуры воды (в пределах температурного оптимума O. mykiss 14–19°С) у рыб, обитающих в благоприятных для роста условиях и в отсутствие повреждающих факторов (рис. 1). Сезонное накопление окисленных белков в печени форели, коррелирующее с весовым приростом рыб (r = 0.42, р < 0.01) и достигающее максимума к концу выростного сезона, особенно ярко проявилось в 2018 г. Положительная сезонная динамика ОМБ нарушалась при действии некоторых средовых факторов. Так, при кратковременной гипоксии, вызванной резким падением растворенного в воде кислорода до 5.0 мг/л (при оптимуме >7.0 мг/л для форели) 11–19 июля 2017 г., в печени исследуемых рыб наблюдалось двухкратное снижение уровня белковых карбонилов – с 4.2 ± 0.5 до 1.9 ± 0.3 нмоль/мг белка (р < 0.05; рис. 1). Это согласуется с имеющимися данными о том, что гипоксия и аноксия приводят к снижению продукции АФК [25], карбонилированных белков и продуктов ПОЛ в органах и клетках (включая иммунные) рыб, а возвращение к нормоксии – к постепенному восстановлению их уровня [26, 27]. Гипоксия нередко (как и в нашем эксперименте) провоцирует бактериальное заражение рыб; предполагают [27], что повышению восприимчивости рыб к инфекциям способствует вызванная гипоксией дисфункция иммунных клеток крови, цитотоксическое действие которых зависит от АФК. Последовавшее за кислородным голоданием спонтанное инфицирование форели бактериальными патогенами (вторая половина июля 2017 г.) и, возможно, антибиотикотерапия энрофлоксацином (начало августа) вызвали двухкратное повышение уровня белковых карбонилов, сохранившееся в контрольной группе рыб до конца выростного сезона 2017 г., в опытной – с частичной отменой эффекта (рис. 1). Бактериальные инфекции, по данным многих исследователей [24, 28], приводят к развитию окислительного стресса и, как следствие, к увеличению содержания белковых карбонилов и продуктов ПОЛ у рыб, а натуральные антиоксиданты способны замедлить окисление белков и липидов в этих условиях [24, 29].
Рис. 1.
Содержание карбонилированных белков в печени садковой форели, выращиваемой на стандартной диете (контроль) и с добавлением смеси ДГК + АГ (опыт). * Различия достоверны между контролем и опытом. # Различия достоверны между значениями в текущую и предыдущую дату взятия материала (p < 0.05).
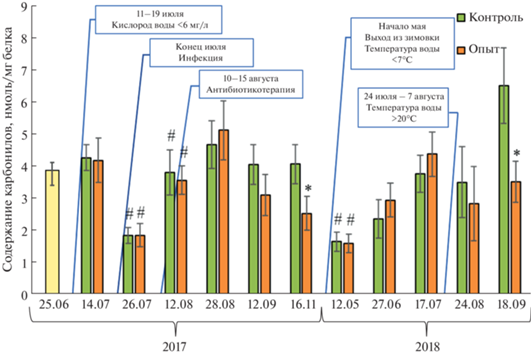
Положительная сезонная динамика ОМБ также нарушалась в период повышения температуры воды сверх оптимальных для форели значений (август 2018 г.; рис. 1), критичного для жизнестойкости особей в целом. Сочетанное действие гипертермии и вызванного ею снижения уровня растворенного кислорода (показатели связаны обратной зависимостью) до нижней границы оптимума O. mykiss привело к умеренному снижению ОМБ и, вероятно, других кислород-зависимых процессов (энергопродукции, иммунных реакций цитотоксичности) в тканях рыб. При этом ведущим действующим на рыб фактором, по всей видимости, стала именно умеренная гипоксия, поскольку изолированное влияние гипертермии, по данным литературы, оказывает противоположный биологический эффект – разобщение дыхательной цепи митохондрий, утечку протонов, неполное восстановление кислорода и увеличение продукции АФК [30, 31].
Достоверная разница по содержанию карбонильных производных белков в печени форели контрольной и опытной групп наблюдалась в конце каждого выростного сезона; их содержание было ниже у рыб, получавших с кормом ДГК и АГ, чем у рыб контрольной группы (р < 0.05): в 2017 г. – 2.5 ± 0.5 против 4.1 ± 0.6, в 2018 – 3.5 ± ± 0.6 против 6.5 ± 1.2 нмоль/мг белка (рис. 1). Полученные результаты, свидетельствующие о способности добавки снижать степень окисления клеточных белков в период нормального роста и при действии повреждающих факторов, согласуются с ранее описанными эффектами других антиоксидантов близкой ДГК структуры. Например, природный флавоноид ресвератрол снижал in vitro уровень МДА и белковых карбонилов в эритроцитах человека, обработанных трет-бутилгидропероксидом [32], а также возраст-зависимое накопление окисленных белков в скелетных мышцах камбалы [33] и мыши [34].
Интенсивность протеасомного протеолиза в печени радужной форели. Полученные данные указывают на физиологически обусловленную зависимость изученных параметров – активности протеасом и белкового окисления – от общего уровня белкового обмена, повышенного в периоды, благоприятные для роста рыб и, напротив, сниженного при действии субоптимальных факторов, включая температурный (гипо- и гипертермию). В нашем эксперименте подтверждено, что более высокий темп роста и метаболизма и сопутствующий им базальный уровень окислительных процессов у молоди рыб компенсируется развитой антиоксидантной системой [34, 35]. Аналогично скорости роста рыб, эффективность АОС, оцениваемая по активности протеасом в печени, была максимальной у рыб первого года жизни, а на втором демонстрировала возрастной регресс (рис. 2). Возрастное снижение интенсивности внутриклеточного белкового обмена и протеолитических процессов обнаружено у многих организмов, включая рыб [35, 36].
Рис. 2.
Химотрипсиноподобная активность протеасом в печени садковой форели, выращиваемой на стандартной диете (контроль) и с добавлением смеси ДГК + АГ (опыт). * Различия достоверны между контролем и опытом. # Различия достоверны между значениями в текущую и предыдущую дату взятия материала (p < 0.05).
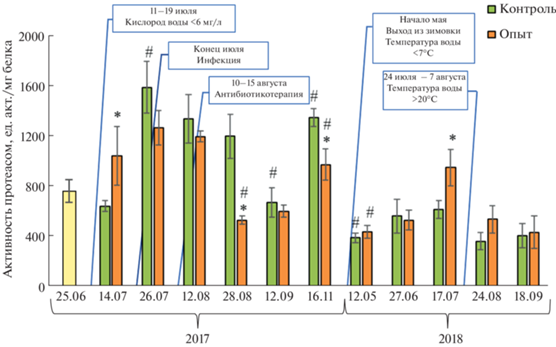
В благоприятный для роста рыб сезон 2018 г. уровень активности протеасом в их печени положительно коррелировал (r = 0.325, р < 0.05) с содержанием карбонилированных белков, сходным образом для садковой форели контрольной и опытной групп; однако взаимосвязь нарушалась при действии множественных повреждающих факторов в 2017 г. (r = –0.11). Наблюдаемая зависимость отличалась от ранее описанной для клеточных культур, испытывающих внешние воздействия или возрастные изменения, включая астроциты крысы [37], кератиноциты человека при старении [38], фибробласты кожи человека при воздействии УФ-излучения [39], в которых при снижении протеасомной активности возрастало содержание окисленных белков. Как следует из наших и ранее опубликованных наблюдений, подобная взаимосвязь прослеживается не всегда, что предполагает неоднозначную зависимость двух показателей друг от друга и многофакторность их регуляции. Так, в нашей работе повышенная активность протеасом не повлияла на содержание окисленных белков в печени форели при понижении температуры среды (ноябрь 2017 г., по сравнению с сентябрем 2017 г.; рис. 1, 2), аналогично ранее описанному эффекту акклимации молоди рыб семейства Anarhichadidae к гипотермии, сопровождавшемуся активацией 20S протеасом в скелетных мышцах при отсутствии влияния на ОМБ [40]. По другим свидетельствам [41], высокая нагрузка на антиоксидантную систему радужной форели, вызванная действием сточных вод, приводила к повышению содержания окисленных белков в печени, но не к изменению активности 20S протеасомы. К настоящему моменту данные об особенностях регуляции протеасом у рыб практически отсутствуют, вместе с тем известно, что активность их каталитических субъединиц регулируется на трансляционном и посттрансляционном уровнях [42]. Установлено, что 20S протеасома более устойчива к воздействию окислительного стресса, чем 26S протеасома; кроме того, последняя в условиях окислительного стресса диссоциирует на коровую частицу 20S и регуляторные комплексы 19S [5], что увеличивает тотальную неселективную (убиквитин-независимую) активность 20S протеасом в клетках. Известно, что 4-гидроксиноненал, продукт ПОЛ, способен связываться с 20S протеасомой и инактивировать ее [43]. Кроме того, показано [5, 42, 44], что накопление сильно окисленных белков может приводить к образованию устойчивых к протеолизу агрегатов, которые подвергаются убиквитинированию и связываются с протеасомами, ингибируя их активность. Таким образом, на активность протеасом могут влиять различные факторы – как эндогенные (продукты окисления белков и липидов, возраст организма), так и экзогенные (средовые факторы, токсиканты).
В нашем эксперименте особенно выраженное стимулирующее действие на протеасомный механизм утилизации окисленных белков оказал фактор инфицирования рыб. Известно, что провоспалительные сигнальные пути, активирующиеся при инфекции, приводят к усилению катаболических процессов в клетках и подавляют транскрипцию факторов иммунной защиты [45, 46]. У рыб, содержавшихся на контрольном рационе, в ответ на действие инициирующего фактора – гипоксии и, возможно, латентной стадии инфекции (14 июля, рис. 2) – наблюдалась инактивация протеасом (644.7 ± 45.2, р ≤ 0.05), сопоставимая с ранее описанным эффектом подавлением протеасомной активности у рыб в гипоксических условиях [47], вместе с тем у особей, получавших обогащенный ДГК и АГ корм, в этих условиях развивалась обратная реакция – срочная активация протеасом (1045.8 ± 233.1, р ≤ 0.05). Вероятно, активация защитного клеточного механизма – протеасомного пути, развивающаяся в более короткий срок в присутствии биодобавки, отражает один из механизмов ее гепатопротекторного действия, подтвержденного, в частности, для ДГК-содержащего лекарственного средства Legalon® [17, 18]. Гипоксия, как мы предполагаем, сыграла триггерную роль в развитии у рыб бактериальной инфекции, в связи с чем гипоксическое состояние сменилось окислительным стрессом, который предсказуемо привел к активации протеасомного пути. Более выраженный протеасомозависимый ответ у рыб контрольной группы (26 июля, рис. 2) позволяет предположить у них окислительный стресс большей силы. Как показано ранее, именно 20S протеасомы путем убиквитин-независимого протеолиза поддерживают протеостаз клетки в условиях окислительного стресса [48, 49].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Схема эксперимента и отбор проб. Исследования проводили на форелевом хозяйстве Республики Карелия с июня 2017 г. по сентябрь 2018 г. В июне 2017 г. самок форели (1+) сходной массы 100 ± 2.3 г поместили в садки (5 тыс. особей на садок) и выращивали по сентябрь 2018 г. на дифференцированном рационе в соответствии со схемой эксперимента. В течение двух выростных сезонов (с мая по сентябрь) форель контрольной группы получала стандартный коммерческий корм (BioMar, Дания) без добавок, форель экспериментальной группы – стандартный корм с добавлением смеси ДГК и АГ (25 и 50 мг на кг корма соответственно); дозировка рекомендована производителем (ОАО “Аметис”, Россия; сертификат № 396-08.17); скармливание добавки проводили двухнедельными курсами с двухнедельными перерывами. По окончании выростного сезона 2017 г. обе выборки форели были оставлены на подледный период в тех же садках. В мае 2018 г. рыба (возраст 2+) была выведена из голодания, отсортирована по размеру, и особи среднего размера (733 ± 62.1 и 770 ± 87.1 г для контрольного и опытного садков соответственно) включены в продолжение эксперимента в 2018 г.
Ежедневно фиксировали температуру воды в садках и содержание растворенного кислорода оксиметром Seven2Go Pro S9 (Mettler Toledo, Швейцария). В период наблюдений 2017 г. максимальная температура воды в водоеме составляла 17°С, при этом содержание растворенного кислорода было высоким (7.0–10.9 мг/л), за исключением периода его резкого падения (11–19 июля) до 6.0 мг/л, в отдельные дни – до 5 мг/л (при оптимуме для форели >7.0 мг/л). В 2018 г., с 17 июля по 22 августа, отмечался температурный максимум 19–22°С (при оптимуме для форели 14–19°С), сопровождавшийся снижением уровня растворенного кислорода до 7.2–8.0 мг/л, минимального за выростной сезон 2018 г.
Помимо естественных вариаций средовых факторов, форель подверглась действию спорадического фактора – бактериальных патогенов. Во второй половине июля 2017 г. у форели обеих групп манифестировала бактериальная геморрагическая септицемия, вызванная ассоциацией Pseudomonas putida и Cytophaga psychrophila (заключение микробиологической экспертизы № 939/22 от 23.08.2017, ФГБНУ “ФНЦ – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко” РАН), в связи с чем рыба обеих групп была подвергнута антибактериальной терапии энрофлоксацином (25 мг/кг рыбы; 10–15 августа 2017 г.). Рыба получала антибиотик с кормом.
В ходе эксперимента, с 25 июня 2017 г. (до введения добавки, нулевая точка) и далее каждые две недели выростного сезона 2017 г. и ежемесячно – в 2018 г., проводили измерения массы и длины форели. Относительный темп роста (% массы/сутки) рассчитывали по формуле: (W2 – W1)/W1/(t2 – t1) × 100, где W1 – начальный вес, W2 – конечный вес рыб, (t2 – t1) – количество суток между измерениями (табл. 1). В те же сроки на льду отбирали образцы (100–200 мг) печени рыб (от 8 особей из каждого садка). Образцы хранили в жидком азоте до начала анализа.
Реагенты и оборудование. В работе использовали химические реагенты, ингибиторы и субстраты протеиназ (Sigma-Aldrich, США), гомогенизатор TissueLyser LT (Qiagen, Германия), центрифугу Allegra 64R (Beckman Coulter, США), мультимодальный планшетный ридер CLARIOstar (BMG LABTECH, Германия).
Получение препаратов протеиназ. Паренхиму печени гомогенизировали в 20 мМ Tris-HCl-буфере (рН 7.5) с добавлением 150 мМ NaСl, 5 мМ ЭДТА-Na, 20 мМ ДТТ, 0.1%-ного Triton X-100, 1 мМ АТР, 5 мМ MgCl2, ингибиторов протеиназ (1 мМ PMSF, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина) в соотношении 1 : 10 (w/v) и центрифугировали (20 000 g, 20 мин).
Анализ протеолитической активности протеасом. Химотрипсиноподобную (ХТП) активность протеасом определяли по гидролизу флуорогенного олигопептида Suc-LLVY-AMC. Реакционная смесь содержала 20 мМ Tris-HCl (pH 7.5), 1 мМ ДТТ, 5 мМ MgCl2, 1 мМ ATР и 30 мкМ субстрат. Флуоресценцию образцов измеряли при длине волны 380 (ex) и 440 нм (em). Истинную ХТП-активность протеасом рассчитывали за вычетом активности примесных протеиназ, определенной в присутствии 5 мкM MG132, ингибитора ХТП-активности протеасом. Активность (ед. акт.) выражали в условных единицах показаний флуориметра и нормализовали по содержанию в пробах белка.
Cодержание белковых карбонильных групп оценивали по методу Levine et al. [50]. К 100 мкл исследуемого образца, полученного при гомогенизации ткани в 20 мМ Tris-HCl-буфере, рН 7.5 (соотношение 1 : 10, w/v) и дальнейшем центрифугировании (20 000 g, 20 мин), добавляли 500 мкл 0.2%-ного 2,4-ДНФГ, растворенного в 2 М HCl (опыт), или 500 мкл 2 М HCl (контроль). Реакционную смесь инкубировали 1 ч в темноте при комнатной температуре, затем добавляли 500 мкл 20%-ной ТХУ, выдерживали 10 мин при 4°С и центрифугировали (10 000 g, 10 мин). Осадок промывали дважды смесью этанол : этилацетат (1 : 1), высушивали и растворяли в 1 мл 6 М гуанидингидрохлорида при нагревании до 90°С. Продукты реакции кетоновых и альдегидных функциональных групп с 2,4-ДНФГ – 2,4-динитрофенилгидразоны – регистрировали спектрофотометрически при 370 нм. Количественное содержание динитрофенилгидразонов рассчитывали с использованием коэффициента их молярной экстинкции, равного 21 мМ–1 см–1, и выражали в нм/мг белка.
Анализ содержания белка. Концентрацию белка определяли по методу Брэдфорд [51] с использованием BSA в качестве стандарта.
Статистическая обработка данных. Статистический анализ результатов проводили при помощи критерия Краскела–Уоллиса с последующим сравнением выборок с использованием критерия Манна–Уитни. Коэффициенты корреляции между сравниваемыми показателями определяли по Пирсону.
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе работы изучен уровень карбонилированных белков и протеолитической активности протеасом в печени садковой радужной форели, выращенной на стандартном или обогащенном ДГК и АГ корме, при воздействии средовых факторов (летней гипертермии, кислородного голодания и бактериальной инфекции). Изученная в работе динамика содержания окисленных клеточных макромолекул и активности протеасомного пути их утилизации оказалась тесно связана с процессами роста рыб и, по всей видимости, интенсивностью обменных процессов, включая белковый метаболизм и окислительные пути энергопродукции, приводящие к генерации АФК. Нами установлена зависимость уровня белкового окисления в печени форели от сезонной вариабельности природных факторов, включая повреждающие – гипо- и гипертермию, гипоксию, бактериальную инфекцию. В условиях окислительного стресса, вызванного инфекционным заболеванием, избыточное образование белковых карбонилов приводит к активации протеасом – компонентов АОС, отвечающих за деградацию необратимо поврежденных окислением белковых молекул. Наблюдаемое накопление окисленных тканевых белков, вызванное действием на организм повреждающих средовых факторов, может быть следствием как их избыточного образования, так и подавления путей их элиминации; по нашим данным, обогащение рациона кормовой растительной добавкой с антиоксидантным действием способствует поддержанию баланса этих процессов.
Основным показанием к практическому применению изученной добавки может служить профилактика заболеваемости и повышение естественной резистентности рыб в условиях искусственного выращивания, связанного с действием неблагоприятных факторов различной природы (погодных, инфекционных, антропогенных). Учитывая природное происхождение ДГК и АГ, получаемых водно-спиртовой экстракцией из отходов заготовки лиственницы, и, как следствие, их безопасность, нетоксичность, биоразлагаемость, становится очевидным преимущество изученной добавки в сравнении с применяемыми в рыбоводной практике антибиотиками, гормонами, вакцинами, как для здоровья выращиваемой рыбы, так и для экосистем водоемов, используемых для садкового рыбоводства.
Список литературы
Parvez S., Raisuddin S. // Environ. Toxicol. Pharmacol. 2005. V. 20. P. 112–117. https://doi.org/10.1016/j.etap.2004.11.002
Lu Y., Wu Z., Song Z., Xiao P., Liu Y., Zhang P., You F. // Fish Shellfish Immunol. 2016. V. 58. P. 125–135. https://doi.org/10.1016/j.fsi.2016.09.008
Johnstone J., Nash S., Hernandez E., Rahman M.S. // Mar. Environ. Res. 2019. V. 149. P. 40–49. https://doi.org/10.1016/j.marenvres.2019.05.017
Шлапакова Т.И., Костин Р.К., Тягунова Е.Е. // Биоорг. химия. 2020. Т. 46. С. 466–485. [Shlapakova T.I., Kostin R.K., Tyagunova E.E. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 657–674.] https://doi.org/10.1134/S1068162020050222
Vasilopoulou M.A., Ioannou E., Roussis V., Chondrogianni N. // Redox Biol. 2021. V. 41. P. 101897. https://doi.org/10.1016/j.redox.2021.101897
Nyström T. // EMBO J. 2005. V. 24. P. 311–317. https://doi.org/10.1038/sj.emboj.7600599
Siemieniuk E., Kolodziejczyk L., Skrzydlewska E. // Toxicol. Mech. Methods. 2008. V. 18. P. 519–524. https://doi.org/10.1080/15376510701624001
Старкова Н.Н., Королева Е.П., Ротанова Т.В. // Биоорг. химия. 2000. Т. 26. С. 83–96. [Starkova N.N., Koroleva E.P., Rotanova T.V. // Russ. J. Bioorg. Chem. 2000. V. 26. P. 71–84.] https://doi.org/10.1007/BF02759152
Ardley H.C., Robinson P.A. // Essays Biochem. 2005. V. 41. P. 15–30. https://doi.org/10.1042/EB0410015
Канцерова Н.П., Чурова М.В., Лысенко Л.А., Тушина Е.Д., Родин М.А., Крупнова М.Ю., Суховская И.В. // Биоорг. химия. 2020. Т. 46. С. 729–735. [Kantserova N.P., Churova M.V., Lysenko L.A., Tushina E.D., Rodin M.A., Krupnova M.Yu., Sukhovskaya I.V. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 1181–1186.] https://doi.org/10.1134/S1068162020060114
Skov P.V., Larsen B.K., Frisk M., Jokumsen A. // Aquaculture. 2011. V. 319. P. 446–452. https://doi.org/10.1016/j.aquaculture.2011.07.008
Ackerman P.A., Forsyth R.B., Mazur C.F., Iwama G.K. // Fish Physiol. Biochem. 2000. V. 23. P. 327–336. https://doi.org/10.1023/A:1011107610971
Palmisano A.N., Winton J.R., Dickhoff W.W. // Mar. Biotechnol. 2000. V. 2. P. 329–338. https://doi.org/10.1007/s101260000005
Tort L. // Dev. Comp. Immunol. 2011. V. 35. P. 1366–1375. https://doi.org/10.1016/j.dci.2011.07.002
Sary C., Carbonera F., Todesco H., Nunes do Prado I., Visentainer J.V., Oliveira M., da Silva M.C., Ribeiro R.P., Lewandowski V. // Aquac. Res. V. 50. P. 673–679. https://doi.org/10.1111/are.13944
Elabd H., Wang H.-P., Shaheen A., Yao H., Abbass A. // Aquac. Rep. 2017. V. 8. P. 21–30. https://doi.org/10.1016/j.aqrep.2017.09.002
Teselkin Y.O., Babenkova I.V., Kolhir V.K., Baginskaya A.L., Tjukavkina N.A., Kolesnik Y.A., Selivanova I.A., Eichholz A.A. // Phytother. Res. 2020. V. 14. P. 160–162. https://doi.org/10.1002/(sici)1099-1573(200005)14: 3<160::aid-ptr555>3.0.co;2-y
Weidmann A.E. // Eur. J. Pharmacol. 2012. V. 684. P. 19–26. https://doi.org/10.1016/j.ejphar.2012.03.035
Ma C., Zu Y., Li J., Li W., Liu S. // Ind. Crop. Prod. 2017. V. 95. P. 324–331. https://doi.org/10.1016/j.indcrop.2016.10.040
Awad E., Awaad A.S., Esteban M.A. // Fish Shellfish Immunol. 2015. V. 43. P. 43–50. https://doi.org/10.1016/j.fsi.2014.12.009
Kantserova N.P., Lysenko L.A., Churova M.V., Tushina E.D., Sukhovskaya I.V., Nemova N.N. // Int. Aquat. Res. 2020. V. 12. P. 63–73. https://doi.org/10.22034/IAR(20).2020.671431
Fokina N.N., Lysenko L.A., Ruokolainen T.R. Sukhovskaya I.V., Kantserova N.P., Nemova N.N. // Appl. Biochem. Microbiol. 2020. V. 56. P. 356–362. https://doi.org/10.1134/S0003683820030035
Dotta G., de Andrade J.I.A., Garcia P., Alves Jesus G.F., Mouriño J.L.P., Mattos J.J., Dias Bainy A.C., Martins M.L. // Fish Shellfish Immunol. 2018. V. 79. P. 175–180. https://doi.org/10.1016/j.fsi.2018.05.024
Peixoto M.J., Ferraz R., Magnoni L.J., Pereira R., Gonçalves J.F., Calduch-Giner J., Pérez-Sánchez J., Ozório R.O.A. // Sci. Rep. 2019. V. 9. P. 16134. https://doi.org/10.1038/s41598-019-52693-6
Lushchak V.I., Bagnyukova T.V. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 2006. V. 144. P. 283–289. https://doi.org/10.1016/j.cbpb.2006.02.014
Lushchak V.I., Bagnyukova T.V., Lushchak O.V., Storey J.M., Storey K.B. // Int. J. Biochem. Cell Biol. 2005. V. 37. P. 1319–1330. https://doi.org/10.1016/j.biocel.2005.01.006
Maita M. // J. Aquac. Res. Develop. 2015. V. 6. P. 6. https://doi.org/10.4172/2155-9546.S1.002
Adeyemi J.A. // Fish Physiol. Biochem. 2014. V. 40. P. 347–354. https://doi.org/10.1007/s10695-013-9847-x
Griffiths H.R. // Nutr. Res Rev. 2002. V. 15. P. 3–17. https://doi.org/10.1079/NRR200134
Becker D., Brinkmann B.F., Zeis B., Paul R.J. // Biol. Cell. 2011. V. 103. P. 351–363. https://doi.org/10.1042/BC20100145
Paital B., Chainy G.B. // J. Therm. Biol. 2014. V. 41. P. 104–111. https://doi.org/10.1016/j.jtherbio.2014.02.013
Pandey K.B., Rizvi S.I. // Appl. Physiol. Nutr. Metab. 2009. V. 34. P. 1093–1097. https://doi.org/10.1139/H09-115
Wilson W.N., Baumgarner B.L., Watanabe W.O., Alam M.S., Kinsey S.T. // Comp. Biochem. Physiol. A Mol. Integr. Physiol. 2015. V. 183. P. 27–35. https://doi.org/10.1016/j.cbpa.2014.12.014
Olesen J., Ringholm S., Nielsen M.M., Brandt C.T., Pedersen J.T., Halling J.F., Goodyear L.J., Pilegaard H. // Exp. Gerontol. 2013. V. 48. P. 1274–1284. https://doi.org/10.1016/j.exger.2013.07.015
Almroth B.C., Johansson A., Förlin L., Sturve J. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 2010. V. 155. P. 442–448. https://doi.org/10.1016/j.cbpb.2010.01.012
Nemova N.N., Lysenko L.A. Kantserova N.P. // Russ. J. Dev. Biol. 2016. V. 47. P. 161–172. https://doi.org/10.1134/S1062360416040068
Zheng J., Bizzozero O.A. // J. Neurochem. 2010. V. 115. P. 1556–1567. https://doi.org/10.1111/j.1471-4159.2010.07062.x
Petropoulos I., Conconi M., Wang X., Hoenel B., Brégégère F., Milner Y., Friguet B. // J. Gerontol. A Biol. Sci. Med. Sci. 2000. V. 55. P. 220–227. https://doi.org/10.1093/gerona/55.5.b220
Catalgol B., Ziaja I., Breusing N., Jung T., Höhn A., Alpertunga B., Schroeder P., Chondrogianni N., Gonos E.S., Petropoulos I., Friguet B., Klotz L.O., Krutmann J., Grune T. // J. Biol. Chem. 2009. V. 284. P. 30076–30086. https://doi.org/10.1074/jbc.M109.044503
Lamarre S.G., Le François N.R., Driedzic W.R., Blier P.U. // J. Exp. Biol. 2009. V. 212. P. 1294–12301. https://doi.org/10.1242/jeb.028290
Almroth B.C., Albertsson E., Sturve J., Förlin L. // Ecotoxicol. Environ. Saf. 2008. V. 70. P. 370–380. https://doi.org/10.1016/j.ecoenv.2008.01.023
Grune T., Jung T., Merker K., Davies K.J. // Int. J. Biochem. Cell Biol. 2004. V. 36. P. 2519–2530. https://doi.org/10.1016/j.biocel.2004.04.020
Esterbauer H., Schaur R.J., Zollner H. // Free Radic. Biol. Med. 1991. V. 11. P. 81–128. https://doi.org/10.1016/0891-5849(91)90192-6
Jung T., Höhn A., Grune T. // Redox Biol. 2014. V. 2. P. 99–104. https://doi.org/10.1016/j.redox.2013.12.008
Pooley N.J., Tacchi L., Secombes C.J., Martin S.A.M. // BMC Genomics. 2013. V. 14. P. 747. https://doi.org/10.1186/1471-2164-14-747
Sassin W. // Beacon J. Stud. Ideol. Ment. Dimens. 2020. V. 3. P. 020440211. https://doi.org/10.5281/zenodo.4459199
Abu-El-Rub E., Sequiera G.L., Sareen N., Yan W., Moudgil M., Golam Sabbir M., Dhingra S. // Cell Death Dis. 2019. V. 10. P. 90. https://doi.org/10.1038/s41419-019-1359-x
Pickering A.M., Davies K.J. // Prog. Mol. Biol. Transl. Sci. 2012. V. 109. P. 227–248. https://doi.org/10.1016/B978-0-12-397863-9.00006-7
Raynes R., Pomatto L.C., Davies K.J. // Mol. Aspects Med. 2016. V. 50. P. 41–55. https://doi.org/10.1016/j.mam.2016.05.001
Levine R.L., Williams J.A., Stadtman E.R., Shacter E. // Methods Enzymol. 1994. V. 233. P. 346–357. https://doi.org/10.1016/s0076-6879(94)33040-9
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248–254. https://doi.org/10.1006/abio.1976.9999
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


