Биоорганическая химия, 2022, T. 48, № 4, стр. 461-469
Биологически активный фрагмент рецептора конечных продуктов гликирования (RAGE) способен ингибировать олигомеризацию бета-амилоида
Т. Д. Волкова 1, *, А. В. Аветисян 2, Д. О. Короев 1, А. В. Камынина 1, 3, С. М. Баласанянц 4, Р. А. Симонян 2, О. М. Вольпина 1
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского, Московский государственный университет имени М.В. Ломоносова
119992 Москва, Ленинские горы, 1, стр. 40, Россия
3 Центр исследований молекулярных механизмов старения и возрастных заболеваний, Московский физико- технический институт (Национальный исследовательский университет)
141701 Долгопрудный, Институтский пер., 9, Россия
4 Department of Biological Sciences, University of Illinois at Chicago
60607 Chicago, Illinois, 900 South Ashland Avenue, MBRB 4168, USA
* E-mail: tdvol@mx.ibch.ru
Поступила в редакцию 18.10.2021
После доработки 09.12.2021
Принята к публикации 11.12.2021
- EDN: IOUGAW
- DOI: 10.31857/S0132342322040194
Аннотация
Ранее обнаружено, что синтетический фрагмент (60–76) внеклеточного домена рецептора конечных продуктов гликирования (RAGE) оказывает защитное действие на животных и клеточных моделях болезни Альцгеймера. Было высказано предположение, что этот эффект обусловлен взаимодействием пептида с бета-амилоидом (Aβ), одним из лигандов RAGE, путем ингибирования образования токсичных олигомеров Aβ. Цель настоящего исследования – изучить с помощью методов физической химии способность пептида (60–76) предотвращать олигомеризацию Aβ40 в растворе в сравнении с укороченным пептидом (65–76), не способствующим сохранению памяти мышей. Динамику образования фибрилл Aβ40 в присутствии пептидов оценивали с помощью тиофлавина T, относительные размеры олигомеров определяли методом динамического светорассеяния, связывание пептидов с Aβ40 исследовали флуоресцентным титрованием. С помощью двух методов было показано, что пептид (60–76) RAGE способен значительно (более чем на 90%) подавлять образование олигомеров и фибрилл Aβ40, в отличие от пептида (65–76). Кроме того, показано, что протективная активность и способность пептидов ингибировать олигомеризацию Aβ40 не коррелируют с их связыванием с мономерным/тетрамерным Aβ40. Нами получено in vitro подтверждение гипотезы о том, что протективная активность синтетического фрагмента (60–76) RAGE связана с его способностью ингибировать олигомеризацию Aβ.
ВВЕДЕНИЕ
Известно, что процесс олигомеризации и образования фибрилл бета-амилоида (Aβ), происходящий в мозге человека при болезни Альцгеймера (БА), играет решающую роль в развитии нейродегенерации. Фибриллы образуют отложения вместе с тау-белком [1–5], в то время как растворимые олигомеры, которые не достигли размера фибрилл, связаны с нейротоксичностью Aβ [6–8], что было показано in vitro [9–16] и in vivo [15]. Отметим, что олигомеризация и образование фибрилл – результаты патологического накопления Aβ в головном мозге. Один из путей транспорта Aβ из кровотока в мозг опосредуется рецептором конечных продуктов гликирования (RAGE) [17]. RAGE локализуется на мембранах эндотелия, а также на мембранах нейронов, астроцитов и микроглии [18–21]. При развитии БА наблюдается сверхэкспрессия этого рецептора, что приводит к чрезмерному накоплению Aβ в головном мозге [18, 20, 22, 23]. Aβ – один из лигандов RAGE, активирующих патогенные сигнальные каскады в микроглии [24, 25], которые стимулируют общие негативные эффекты, такие как неконтролируемое воспаление, дисфункция митохондрий, окислительный стресс и повреждение нейронов [18, 26, 27]. Таким образом, RAGE способен опосредовать нейротоксический эффект Aβ, проявляющийся в ускорении развития когнитивных нарушений и патологических изменений в нейронах [28]. RAGE связывает все формы Aβ: мономерные, олигомерные и фибриллярные; кроме того, с помощью набора антител к RAGE было показано, что различные формы Aβ, в зависимости от уровня его олигомеризации, связываются с разными участками рецептора. В частности, фибриллы Aβ связываются с доменом C2, а растворимые олигомеры – с доменом V [29].
Ранее нами было показано, что синтетический фрагмент (60–76) V-домена RAGE при интраназальном введении проявляет терапевтический эффект на животных моделях БА, предотвращая нарушение пространственной памяти у бульбэктомированных (БЭ) и трансгенных мышей 5xFAD – моделях БА, в которых мыши проявляют поведенческие, биохимические и морфологические признаки заболевания [30, 31]. Введение пептида также предотвращает как накопление Aβ в головном мозге, так и патологические изменения в нейронах [32]. Способность пептида (60–76) предотвращать токсические эффекты Aβ в смешанной первичной культуре нейронов и астроцитов также была продемонстрирована ранее [33]. Показана специфическая активация RAGE пептидом (60–76), которая приводит к высвобождению глутамата преимущественно из астроцитов [34]. Косвенные данные, указывающие на возможность взаимодействия пептида с Aβ, были получены после интраназального введения флуоресцентно меченного аналога мышам 5xFAD. В результате наблюдалась совместная локализация пептида с амилоидными бляшками в срезах мозга [32]. Обнаружена также способность пептида связывать Aβ в растворе [33, 35]. Принимая во внимание все полученные данные, мы предположили, что механизм защитной активности пептида может осуществляться через его взаимодействие с Aβ путем ингибирования образования токсичных олигомеров.
Цель данной работы состояла в изучении двумя физико-химическими методами – динамического светорассеяния (ДСР) и анализа связывания с флуоресцентным красителем тиофлавином Т – способности синтетического пептида (60–76) RAGE, обладающего защитной активностью, предотвращать олигомеризацию Aβ в растворе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 приведена последовательность пептида (60–76) (P1) и выбранного для сравнения его укороченного фрагмента (65–76) (P2), который не проявлял активности на животной модели БА [32, 36]. В исследованиях мы использовали Aβ40 – одну из двух основных аллоформ Aβ, присутствующих в амилоидных бляшках [37, 38]. Растворимость Aβ40 намного выше, а скорость олигомеризации – ниже, чем у изоформы Aβ42, что позволяет работать с водными растворами точной концентрации и дает время для манипуляций на лабораторных приборах [39]. Размер частиц в растворе Aβ40 после его агрегации и влияние пептидов P1 и P2 на эту агрегацию изучали с помощью динамического светорассеяния (ДРС). Одновременно с этим способность пептидов ингибировать образование протофибрилл и фибрилл Aβ40 в растворе анализировали по изменению флуоресценции тиофлавина T. Кроме того, способность пептидов P1 и P2 напрямую связываться с Aβ40 изучали с помощью флуоресцентного титрования.
Таблица 1.
Результаты ингибирования олигомеризации Aβ40 фрагментами RAGE и их способность предотвращать нарушение пространственной памяти бульбэктомированных мышей в модели болезни Альцгеймера
| Обозначение | Фрагмент | Аминокислотная последовательность | Ингибирование олигомеризации Аβ40 | Связывание с Аβ40 (флуоресцент-ное титрование) | Защита памяти БЭ-мышей [13] | |
|---|---|---|---|---|---|---|
| ДРС | ThT | |||||
| P1 | 60–76 | AWKVLSPQGGGPWDSVA | + | + | + | + |
| P2 | 65–76 | SPQGGGPWDSVA | – | ± | + | – |
Определение размеров олигомеров Aβ40 в растворах методом динамического светорассеяния. Для изучения влияния фрагментов RAGE на олигомеризацию Аβ40 использовали метод динамического светорассеяния. Вначале определяли размеры молекул Aβ40 в исходных растворах, приготовленных по различным методикам. На рис. 1а показано распределение частиц по размерам в растворе дезагрегированного Aβ40, на рис. 1б – для Aβ40, растворенного в воде без предварительной дезагрегации.
Рис. 1.
Распределение размеров олигомеров исходного раствора Аβ40, измеренное методом ДРС: (а) – дезагрегированный Аβ40; (б) – недезагрегированный Аβ40.
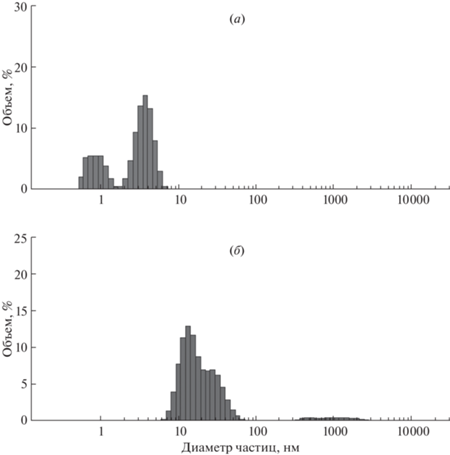
В растворе дезагрегированного Aβ40 можно видеть два пула частиц (рис. 1а). Первый включает мелкие частицы со средним гидродинамическим диаметром 0.9 нм, что соответствует диаметру мономеров. Второй пул содержит частицы со средним диаметром 3.8 нм, которые представляют собой димеры, тримеры и тетрамеры Aβ40 [40]. В растворе Aβ40, не подвергавшегося дезагрегации, не обнаружено мелких частиц, что означает отсутствие мономеров, димеров, тримеров и тетрамеров. Вместо этого обнаружен пул с широким спектром частиц размером 8–80 нм (рис. 1б), а кроме того, есть немного крупных частиц диаметром 200–2000 нм, которые представляют собой высокоолигомеризованные молекулы. Для всех дальнейших исследований был использован дезагрегированный Aβ40 (рис. 1а).
Далее раствор дезагрегированного Aβ40 с пептидами или без них подвергали агрегации, т.е. инкубировали в условиях, способствующих агрегации, а затем методом динамического светорассеяния определяли размер всех молекул Aβ40 в смеси (рис. 2).
Рис. 2.
Распределение размеров олигомеров Аβ40 после 40-часовой инкубации, измеренное методом ДРС: (а) – только Аβ40; (б) – Аβ40 с P1; (в) – Аβ40 с P2.
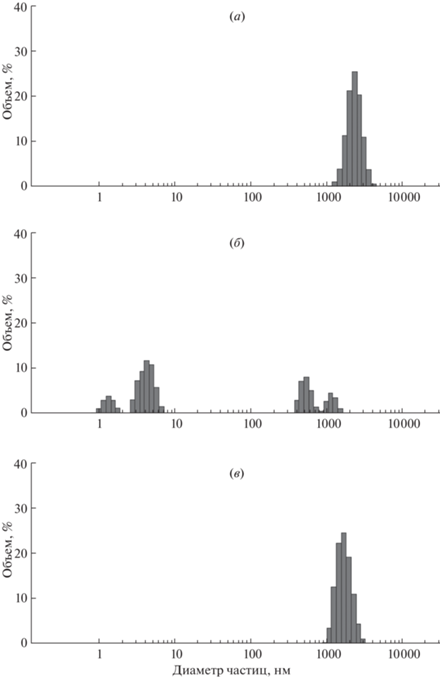
Анализ распределения частиц по размерам подтвердил, что олигомеризация Aβ40 прошла. В растворе Aβ40 без пептидов имелся только один пул агрегатов со средним значением гидродинамического диаметра 2500 нм (рис. 2а). После инкубации Aβ40 в присутствии пептида P1 распределение частиц по размерам в растворе резко изменилось. На рис. 2б можно увидеть два пула мелких частиц, подобных тем, которые представлены на рис. 1а. Это означает, что в смеси осталось большое количество мелких частиц диаметром 1–6 нм. Кроме того, есть два небольших пула более крупных агрегатов со средним диаметром 500 и 1100 нм, которые, тем не менее, намного меньше, чем в случае “чистого” Aβ40. После инкубации Aβ40 в присутствии пептида P2 распределение частиц в растворе было аналогично тому, которое наблюдалось для Aβ40 без пептида. На графике представлен только один пул очень крупных агрегатов со средним диаметром 1500 нм, что немного ниже, чем в случае чистого Aβ40, но значительно выше, чем в смеси Aβ40 с P1 (рис. 2в). Мелких частиц в растворе не осталось. Таким образом, методом динамического светорассеяния доказано, что P1 значительно ингибирует олигомеризацию Aβ40 и предотвращает образование крупных агрегатов, в то время как P2 практически не может влиять на процесс олигомеризации Aβ40.
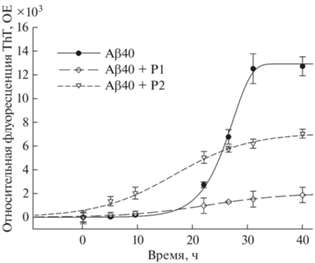
Изучение фибриллогенеза Аβ40 в присутствии фрагментов RAGE по изменению флуоресценции тиофлавина Т. Следующей задачей исследования было выяснение способности пептидов RAGE влиять на образование фибрилл Aβ40 – крупных олигомеров вытянутой структуры, входящих в состав амилоидных бляшек в мозге больных БА. Для этого динамику олигомеризации Aβ40 в присутствии двух пептидов изучали методом флуоресцентной спектрофотометрии с использованием красителя тиофлавина Т (ThT), который позволяет детектировать образование β-структуры, специфичной для протофибрилл и фибрилл Aβ. Перед добавлением буфера Aβ40 дезагрегировали так же, как и в других исследованиях, так что содержание олигомеров в начале эксперимента было на самом низком уровне. Ранее мы показали, что синтетический Aβ40, используемый в этом эксперименте, способен образовывать характерные β-складчатые фибриллы бета-амилоида в водных растворах [41].
Данные флуоресценции, полученные для Aβ40 в присутствии P1 или P2, сравнивали с данными для Aβ40 в отсутствие пептидов (рис. 3). Экспериментальные данные демонстрируют типичную кривую агрегации амилоида с 10-часовой лаг-фазой, в которой не происходит изменения флуоресценции (фаза нуклеации). За ней следует 6-часовая фаза элонгации, в которой образование амилоидных протофибрилл и фибрилл проявляется увеличением флуоресценции ThT. Явное существование лаг-фазы означает отсутствие амилоидных фибрилл в наших начальных препаратах. Во время фазы элонгации флуоресценция ThT увеличивалась в 15 раз в растворе чистого Aβ40. В присутствии P1 флуоресценция ThT увеличивалась менее чем в 2 раза, следовательно, данный пептид ингибировал процесс образования фибрилл Aβ40 более чем на 90%. В присутствии P2 флуоресценция ThT также была ниже, чем в отсутствие пептидов, но заметно выше, чем в присутствии P1. Пептид P2 подавлял образование протофибрилл и фибрилл Aβ40 только на 50%.
Влияние пептидов на олигомеризацию Aβ40, изученное методом ДРС, показало, что P1, который обладает защитной активностью на животных и клеточных моделях БА, значительно ингибирует процесс олигомеризации Aβ40 в растворе, в то время как неактивный укороченный фрагмент (65–76) (P2) практически не оказывает такого действия. Одновременно в исследовании с помощью ThT было показано, что P1 ингибирует образование фибрилл Aβ40 более чем на 90%. Эффект P2 был намного меньше. Следует отметить, что с помощью флуоресценции ThT можно выявить только β-структуры фибрилл, в отличие от анализа методом ДРС, который позволяет идентифицировать весь спектр олигомеров. Следовательно, только метод ДРС отражает объективное различие в способности P1 и P2 ингибировать процесс олигомеризации Aβ.
Флуоресцентное титрование фрагментов RAGE с помощью Aβ40. Для того чтобы найти объяснение различного влияния пептидов P1 и P2 на олигомеризацию Aβ40, мы решили исследовать напрямую способность их связывания с Aβ. Для этого проводили флуоресцентное титрование обоих пептидов при помощи Aβ40. Входящий в состав пептидов триптофан изменяет свою флуоресценцию в момент связывания пептида с лигандом, поэтому его удобно использовать как источник флуоресценции при титровании [42]. Это позволило избежать введения флуоресцентной метки и таким образом сохранить нативные свойства пептидов. Концентрация P1, который содержит два остатка Trp, составляла 0.5 мкМ, а концентрация P2, имеющего только один остаток Trp, – 2 мкМ для усиления сигнала. Раствор Aβ40, как и в предыдущих экспериментах, предварительно готовили в условиях, минимизирующих содержание олигомеров в растворе. Начальная концентрация Aβ40 составляла 200 нМ. Данные экспериментов по флуоресценции были представлены в виде графика отношения 1/ΔF по сравнению с 1/[S], где [S] – концентрация Aβ40 в кювете, ΔF – разница между измерениями интенсивности в отсутствие Aβ40 и в присутствии Aβ40 с определенной концентрацией (рис. 4).
Рис. 4.
Флуоресцентное титрование пептидов с помощью Aβ40: (а) – P1 в концентрации 0.5 мкМ; (б) P2 в концентрации 2 мкМ. Кривые изменения интенсивности флуоресценции триптофана 1/[ΔF] в зависимости от концентрации 1/[S] Aβ40 при измерении на длине волны 520 нм. Показаны результаты одного из пяти независимых экспериментов.
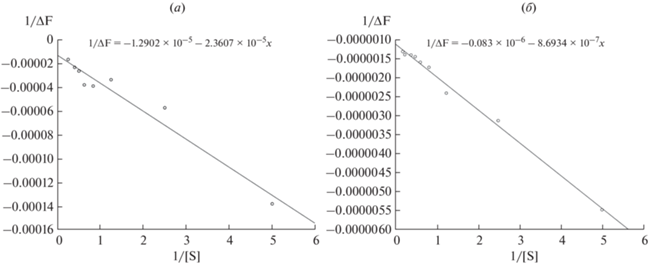
Были вычислены константы диссоциации: для P1 Kd = 1.41 ± 0.29 мкМ (рис. 4а), для P2 Kd = 0.51 ± ± 0.08 мкМ (рис. 4б). Результаты флуоресцентного титрования в настоящем исследовании показали, что оба пептида образуют комплексы с Aβ40, причем, как следует из рассчитанных Kd, P2 образует с Aβ40 даже более стабильный комплекс, чем P1. Очевидно, что метод флуоресцентного титрования не может объяснить различную способность пептидов ингибировать олигомеризацию Aβ. Интересно, что в работе Kamynina et al. [33] по результатам флуоресцентного титрования P2 не связывался с Aβ40, тогда как Kd для P1 была практически идентична значению, полученному в настоящем исследовании. Вероятно, это связано с тем, что Aβ40 не подвергался дезагрегации в работе Kamynina et al. [33]. Возможно, P2 образует комплексы только с мономерами-тетрамерами Aβ40, но не может связываться с олигомерами. В то же время P1 способен связываться с любой формой Aβ40. Эти результаты демонстрируют, что связывания пептида с мономерами-тетрамерами Aβ40 недостаточно для ингибирования образования крупных олигомеров и фибрилл. Вероятно, для подавления олигомеризации требуется также связывание пептида с малыми и средними олигомерами.
Все результаты, полученные в данной работе, объединены в табл. 1.
В последнем столбце табл. 1 представлены ранее полученные данные тестирования пространственной памяти у мышей, подвергнутых обонятельной бульбэктомии (БЭ) после интраназального введения P1 или P2 [32]. Из табл. 1 видно, что защитную активность проявляет только P1, который способен ингибировать процесс олигомеризации Aβ, что показано двумя методами – по изменению флуоресценции ThT и с помощью ДРС. В то же время способность пептидов P1 и P2 ингибировать олигомеризацию Aβ не коррелирует с их связыванием с мономерным/тетрамерным Aβ40.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез пептидов. Фрагменты RAGE человека (Q15109, UniProtKB/SwissProt) и Aβ40 человека (P05067.3, UniProtKB/Swiss-Prot) были синтезированы твердофазным методом на полимере Ванга с использованием Fmoc/But-схемы и очищены с помощью ВЭЖХ, как описано ранее [32, 41]. Гомогенность пептидов составляла >95%.
Дезагрегация бета-амилоида (1–40). Лиофилизированный синтетический Aβ40 растворяли в 1,1,1,3,3,3-гексафторпропан-2-оле (HFIP) (99%; Sigma-Aldrich, США) в концентрации 1 мг/мл и разделяли на аликвоты. HFIP выпаривали в потоке газообразного аргона, пептидную пленку растворяли в DMSO (Sigma-Aldrich, США) до конечной концентрации 20 мг/мл. Этот раствор энергично встряхивали и выдерживали при –20°C в течение 12 ч перед добавлением буфера.
Формирование олигомеров и фибрилл Аβ40. К 250 мкг Аβ40 в 12.5 мкл DMSO добавляли 1850 мкл буфера (20 мМ Тris-HCl, 100 мМ NaCl, pH 7.4) и сразу же встряхивали в течение 30 с. Для приготовления смеси Аβ40 и одного из фрагментов RAGE 200 мкг Р1 либо 140 мкг Р2 растворяли в 1850 мкл буфера и добавляли к 250 мкг Аβ40 в DMSO, после чего встряхивали в течение 30 с. Образцы перемешивали при 37°C в течение 40 ч.
Динамическое светорассеяние. Измерения динамического рассеяния света (ДРС) проводили на анализаторе Zetasizer Nano ZS (Malvern Instruments Ltd, Великобритания) с использованием лазерного источника с λ = 633 нм и детекции при угле рассеяния 173°. Образцы получали из дезагрегированного Aβ40 или дезагрегированного Aβ40, инкубированного в условиях образования олигомеров и фибрилл с пептидами или без них. В кювету ДРС переносили 100 мкл полученного раствора на 20 мин. Данные рассеяния света были проанализированы для оценки распределения частиц по размерам и их усредненного по z гидродинамического диаметра (dh) с применением уравнения Стокса–Эйнштейна, предполагающего сферическую форму частиц.
Анализ фибриллогенеза Аβ40 с использованием тиофлавина Т. Образование фибрилл Аβ40 отслеживали по связыванию тиофлавина Т [43] с помощью флуоресцентного планшетного ридера Clariostar Plus (BMG LABTECH, Германия). Раствор Аβ40 или Аβ40 в смеси с одним из пептидов объемом 75 мкл отбирали в указанное время и смешивали с 25 мкл 50 мкМ раствора ThT в лунках планшета из черного полистирола (SPL) для обнаружения флуоресценции тиофлавина Т. Конечная концентрация Аβ40 составляла 25 мкМ, пептидов – 50 мкМ, ThT – 12.5 мкМ. Флуоресценцию образцов измеряли при λвозб = 450 нм, λисп = 486 нм. В каждый момент времени из каждого раствора отбирали по четыре аликвоты, затем их добавляли в лунки планшета и измеряли флуоресценцию ThT в каждой лунке не менее четырех раз на разной высоте. Вычитали фоновую флуоресценцию буфера. В каждой точке рассчитывали среднее значение и стандартную ошибку среднего (SEM).
Флуоресцентное титрование. Флуоресцентное титрование синтетических пептидов проводили, как описано ранее [33]. Концентрация пептида Р1 составляла 0.5 мкМ, пептида Р2 – 2 мкМ. К ним добавляли дезагрегированный Aβ40, предварительно растворенный в DMSO, в увеличивающихся концентрациях: 200, 400, 800, 1200, 1600, 2000, 2500, 3000, 4000 и 5000 нМ. Максимум интенсивности флуоресценции обнаружен при 355 нм. В программе Statistica 10 (StatSoft, США) набор интенсивностей был представлен на графике с координатами 1/[S] относительно 1/ΔF [42]. Для каждого пептида проводили три независимых измерения константы диссоциации (Kd). Значения Kd представляли, как среднее ± стандартная ошибка среднего.
ЗАКЛЮЧЕНИЕ
В проведенных исследованиях выявлено, что биологически активный синтетический фрагмент (60–76) RAGE оказывает влияние на процесс олигомеризации Aβ. Методами динамического светорассеяния и анализа флуоресценции тиофлавина Т показано, что пептид (60–76), оказывающий протективное действие на пространственную память мышей в экспериментальных моделях болезни Альцгеймера, значительно подавляет образование олигомеров и фибрилл Aβ40. Неактивный укороченный фрагмент (65–76) этого пептида такой способностью не обладает. В то же время ингибирование олигомеризации Aβ пептидами (60–76) и (65–76) и их защитная активность не коррелируют со связыванием пептидов с мономерным/тетрамерным Aβ40.
Таким образом, нами получено подтверждение гипотезы о том, что протективная активность синтетического пептида (60–76) RAGE связана с его способностью ингибировать образование токсичных олигомеров Aβ. Выявлен один из возможных механизмов реализации протективного действия пептида (60–76), перспективного для разработки терапии болезни Альцгеймера.
Список литературы
Glenner G.G., Wong C.W. // Biochem. Biophys. Res. Commun. 1984. V. 120. P. 885–890. https://doi.org/10.1016/s0006-291x(84)80190-4
Hardy J. // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 2095–2097. https://doi.org/10.1073/pnas.94.6.2095
Hardy J.A., Higgins G.A. // Science. 1992. V. 256. P. 184–185. https://doi.org/10.1126/science.1566067
Masters C.L., Simms G., Weinman N.A., Multhaup G., Mcdonald B.L., Beyreuther K. // Proc. Natl. Acad. Sci. USA. 1985. V. 82. P. 4245–4249. https://doi.org/10.1073/pnas.82.12.4245
Selkoe D.J. // J. Neuropathol. Exp. Neurol. 1994. V. 53. P. 438–447. https://doi.org/10.1097/00005072-199409000-00003
Gandy S., Simon A.J., Steele J.W., Lublin A.L., Lah J.J., Walker L.C., Levey A.I., Krafft G.A., Levy E., Checler F., Glabe C., Bilker W.B., Abel T., Schmeidler J., Ehrlich M.E. // Ann. Neurol. 2010. V. 68. P. 220–230. https://doi.org/10.1002/ana.22052
Kayed R., Lasagna-Reeves C.A. // Alzheimer’s Disease: Advances for a New Century. 2013. V. 3. P. 67–78. https://doi.org/10.3233/978-1-61499-154-0-67
Klein W.L., Krafft G.A., Finch C.E. // Trends Neurosci. 2001. V. 24. P. 219–224. https://doi.org/10.1016/S0166-2236(00)01749-5
Harper J.D., Wong S.S., Lieber C.M., Lansbury P.T. // Chem. Biol. 1997. V. 4. P. 119–125. https://doi.org/10.1016/S1074-5521(97)90255-6
Hartley D.M., Walsh D.M., Ye C.P.P., Diehl T., Vasquez S., Vassilev P.M., Teplow D.B., Selkoe D.J. // J. Neurosci. 1999. V. 19. P. 8876–8884. https://doi.org/10.1523/Jneurosci.19-20-08876.1999
Lambert M.P., Barlow A.K., Chromy B.A., Edwards C., Freed R., Liosatos M., Morgan T.E., Rozovsky I., Trommer B., Viola K.L., Wals P., Zhang C., Finch C.E., Krafft G.A., Klein W.L. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 6448–6453. https://doi.org/10.1073/pnas.95.11.6448
Nilsberth C., Westlind-Danielsson A., Eckman C.B., Condron M.M., Axelman K., Forsell C., Stenh C., Luthman J., Teplow D.B., Younkin S.G., Naslund J., Lannfelt L. // Nat. Neurosci. 2001. V. 4. P. 887–893. https://doi.org/10.1038/Nn0901-887
Oda T., Wals P., Osterburg H.H., Johnson S.A., Pasinetti G.M., Morgan T.E., Rozovsky I., Stine W.B., Snyder S.W., Holzman T.F., Krafft G.A., Finch C.E. // Exp. Neurol. 1995. V. 136. P. 22–31. https://doi.org/10.1006/exnr.1995.1080
Walsh D.M., Hartley D.M., Kusumoto Y., Fezoui Y., Condron M.M., Lomakin A., Benedek G.B., Selkoe D.J., Teplow D.B. // J. Biol. Chem. 1999. V. 274. P. 25945–25952. https://doi.org/10.1074/jbc.274.36.25945
Walsh D.M., Klyubin I., Fadeeva J.V., Cullen W.K., Anwyl R., Wolfe M.S., Rowan M.J., Selkoe D.J. // Nature. 2002. V. 416. P. 535–539. https://doi.org/10.1038/416535a
Walsh D.M., Lomakin A., Benedek G.B., Condron M.M., Teplow D.B. // J. Biol. Chem. 1997. V. 272. P. 22364–22372. https://doi.org/10.1074/jbc.272.35.22364
Banks W.A. // Immunotherapy. 2010. V. 2. P. 1–3. https://doi.org/10.2217/Imt.09.72
Lue L.F., Walker D.G., Brachova L., Beach T.G., Rogers J., Schmidt A.M., Stern D.M., Du Yan S. // Exp. Neurol. 2001. V. 171. P. 29–45. https://doi.org/10.1006/exnr.2001.7732
Miller M.C., Tavares R., Johanson C.E., Hovanesian V., Donahue J.E., Gonzalez L., Silverberg G.D., Stopa E.G. // Brain Res. 2008. V. 1230. P. 273–280. https://doi.org/10.1016/j.brainres.2008.06.124
Yan S.D., Chen X., Fu J., Chen M., Zhu H.J., Roher A., Slattery T., Zhao L., Nagashima M., Morser J., Migheli A., Nawroth P., Stern D., Schmidt A.M. // Nature. 1996. V. 382. P. 685–691. https://doi.org/10.1038/382685a0
Yan S.D., Zhu H.J., Fu J., Yan S.F., Roher A., Tourtellotte W.W., Rajavashisth T., Chen X., Godman G.C., Stern D., Schmidt A.M. // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 5296–5301. https://doi.org/10.1073/pnas.94.10.5296
Leclerc E., Fritz G., Vetter S.W., Heizmann C.W. // Biochim. Biophys. Acta. 2009. V. 1793. P. 993–1007. https://doi.org/10.1016/j.bbamcr.2008.11.016
Walker D., Lue L.F., Paul G., Patel A., Sabbagh M.N. // Expert Opin. Investig. Drugs. 2015. V. 24. P. 393–399. https://doi.org/10.1517/13543784.2015.1001490
Cai Z.Y., Liu N.N., Wang C.L., Qin B.Y., Zhou Y.J., Xiao M., Chang L.Y., Yan L.J., Zhao B. // Cell. Mol. Neurobiol. 2016. V. 36. P. 483–495. https://doi.org/10.1007/s10571-015-0233-3
Pugazhenthi S., Qin L.M., Reddy P.H. // Biochim. Biophys. Acta. 2017. V. 1863. P. 1037–1045. https://doi.org/10.1016/j.bbadis.2016.04.017
Fang F., Lue L.F., Yan S.Q., Xu H.W., Luddy J.S., Chen D., Walker D.G., Stern D.M., Yan S.F., Schmidt A.M., Chen J.X., Yan S.S. // FASEB J. 2010. V. 24. P. 1043–1055. https://doi.org/10.1096/fj.09-139634
Mao Y.X., Cai W.J., Sun X.Y., Dai P.P., Li X.M., Wang Q., Huang X.L., He B., Wang P.P., Wu G., Ma J.F., Huang S.B. // Cell Death Dis. 2018. V. 9. P. 674. https://doi.org/10.1038/S41419-018-0718-3
Deane R., Singh I., Sagare A.P., Bell R.D., Ross N.T., LaRue B., Love R., Perry S., Paquette N., Deane R.J., Thiyagarajan M., Zarcone T., Fritz G., Friedman A.E., Miller B.L., Zlokovic B.V. // J. Clin. Invest. 2012. V. 122. P. 1377–1392. https://doi.org/10.1172/JCI58642
Sturchler E., Galichet A., Weibel M., Leclerc E., Heizmann C.W. // J. Neurosci. 2008. V. 28. P. 5149–5158. https://doi.org/10.1523/Jneurosci.4878-07.2008
Koroev D.O., Volpina O.M., Volkova T.D., Kamynina A.V., Samokhin A.N., Filatova M.P., Bobkova N.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 361–365. https://doi.org/10.1134/S1068162019050054
Volpina O.M., Koroev D.O., Volkova T.D., Kamynina A.V., Filatova M.P., Zaporozhskaya Y.V., Samokhin A.N., Aleksandrova I.Y., Bobkova N.V. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 638–644. https://doi.org/10.1134/s1068162015060187
Volpina O.M., Samokhin A.N., Koroev D.O., Nesterova I.V., Volkova T.D., Medvinskaya N.I., Nekrasov P.V., Tatarnikova O.G., Kamynina A.V., Balasanyants S.M., Voronina T.A., Kulikov A.M., Bobkova N.V. // J. Alzheimers Dis. 2018. V. 61. P. 1061–1076. https://doi.org/10.3233/jad-170483
Kamynina A.V., Esteras N., Koroev D.O., Bobkova N.V., Balasanyants S.M., Simonyan R.A., Avetisyan A.V., Abramov A.Y., Volpina O.M. // Front. Neurosci. 2018. V. 12. P. 681. https://doi.org/10.3389/fnins.2018.00681
Kamynina A., Esteras N., Koroev D.O., Angelova P.R., Volpina O.M., Abramov A.Y. // J. Cell. Physiol. 2021. V. 236. P. 6496–6506. https://doi.org/10.1002/jcp.30324
Avetisyan A., Balasanyants S., Simonyan R., Koroev D., Kamynina A., Zinovkin R., Bobkova N., Volpina O. // Neurochem. Int. 2020. V. 140. P. 104799. https://doi.org/10.1016/j.neuint.2020.104799
Koroev D.O., Volpina O.M., Volkova T.D., Kamynina A.V., Filatova M.P., Balasanyants S.M., Samokhin A.N., Bobkova N.V. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 150–154. https://doi.org/10.1134/s1068162017020066
Gravina S.A., Ho L.B., Eckman C.B., Long K.E., Otvos L., Younkin L.H., Suzuki N., Younkin S.G. // J. Biol. Chem. 1995. V. 270. P. 7013–7016. https://doi.org/10.1074/jbc.270.13.7013
Iwatsubo T., Odaka A., Suzuki N., Mizusawa H., Nukina N., Ihara Y. // Neuron. 1994. V. 13. P. 45–53. https://doi.org/10.1016/0896-6273(94)90458-8
Olivero G., Grilli M., Chen J.Y., Preda S., Mura E., Govoni S., Marchi M. // Front. Aging Neurosci. 2014. V. 6. P. 166. https://doi.org/10.3389/Fnagi.2014.00166
Bitan G., Kirkitadze M.D., Lomakin A., Vollers S.S., Benedek G.B., Teplow D.B. // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 330–335. https://doi.org/10.1073/pnas.222681699
Volkova T.D., Koroev D.O., Kamynina A.V., Filatova M.P., Avetisyan A.V., Volpina O.M. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 217–222. https://doi.org/10.1134/s1068162020020181
Huang Y.K., Chou R.H., Yu C. // J. Biol. Chem. 2016. V. 291. P. 14300–14310. https://doi.org/10.1074/jbc.M116.722215
Levine H. // Protein Sci. 1993. V. 2. P. 404–410. https://doi.org/10.1002/pro.5560020312
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия