Биоорганическая химия, 2022, T. 48, № 4, стр. 442-452
Влияние состава липидной матрицы на микроокружение левофлоксацина в липосомальных формах
И. М. Ле-Дейген 1, *, А. С. Сафронова 1, И. М. Колмогоров 1, А. А. Скуредина 1, Е. В. Кудряшова 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет,
119991 Москва, Ленинские горы, 1/3, Россия
* E-mail: i.m.deygen@gmail.com
Поступила в редакцию 15.11.2021
После доработки 17.12.2021
Принята к публикации 21.12.2021
- EDN: WUDUJV
- DOI: 10.31857/S0132342322040145
Аннотация
Изучено взаимодействие антибактериального препарата левофлоксацина с липидным бислоем различного состава: 100%-ный дипальмитоилфосфатидилхолин и с добавлением 20% кардиолипина. Для монокомпонентных липосом обнаружено заглубление левофлоксацина в приполярную область на границе раздела фаз липид–вода. Установлена роль анионного липида в механизме взаимодействия активной молекулы с бислоем: левофлоксацин входит в микроокружение фосфатной группы, вытесняя воду, и не продвигается вглубь гидрофобной части бислоя. Впервые проведено изучение микроокружения левофлоксацина в липосоме методами ИК- и КД-спектроскопии. Подобный подход на основе сочетания нескольких спектральных методов открывает перспективы дизайна новых лекарственных свойств и возможности предсказания характера взаимодействия активных молекул с биомембранами для прогнозирования их эффективности и потенциальных побочных эффектов.
ВВЕДЕНИЕ
Как в России, так и в мире актуальна задача терапии тяжелых инфекционных заболеваний, среди которых туберкулез и воспаление легких, в том числе вторичные бактериальные пневмонии, присоединяющиеся к внебольничным COVID-ассоциированным случаям. Антибактериальные препараты фторхинолонового ряда обладают высокой активностью и широким спектром действия, это делает их привлекательными для терапии инфекций легких, что подтверждается, например, включением фторхинолона левофлоксацина в протоколы лечения туберкулеза и вторичных бактериальных пневмоний. В частности, терапия левофлоксацином включена в алгоритм назначения антибактериальной терапии при SARS-CoV-2-ассоциированном повреждении легких у пациентов с COVID-19.
Для повышения эффективности терапии и снижения риска возникновения побочных эффектов перспективно ингаляционное введение левофлоксацина [1]. Проведены клинические испытания аэрозольного препарата на основе раствора левофлоксацина Aeroquin (MP-376, идентификатор испытания NCT01180634) для борьбы с инфекциями, в том числе вызываемыми Pseudomonas aeruginosa, при фиброзе легких [2], однако до конечного пациента препарат не дошел (проходит III фазу клинических испытаний). Необходимо создание систем доставки левофлоксацина для ингаляционного введения, в частности стоит задача повышения сродство систем доставки к тканям легкого [1]. Перспективным вариантом представляются липосомы, строение которых позволяет включать в них гидрофобные, гидрофильные и амфифильные соединения. Для дизайна систем доставки на основе липосомальных форм левофлоксацина необходимо глубокое понимание механизма взаимодействия липидного бислоя с активной молекулой. Известно, что липидный состав мембраны может оказывать существенное влияние на данный процесс [3]: ранее такой эффект в нашей лаборатории был показан для фторхинолона IV поколения – моксифлоксацина [4].
Заряженные группы липидов, в первую очередь, фосфатные и карбонильные группы на поверхности мембраны, способны образовывать электростатические связи с фторхинолонами. Показано, что данный тип взаимодействий вносит существенный вклад в связывание активных молекул с бислоем [5]. Предположительно, электростатическое взаимодействие также может повысить степень загрузки и обеспечить большее удержание левофлоксацина (ЛФ) во внутренней сфере липосом.
Глубокое понимание механизма взаимодействия ЛФ с липосомами разного состава позволяет оптимизировать липосомальные системы доставки с заданными параметрами с целью контроля высвобождения и регулировки доз применения инкапсулированного антибактериального препарата. Цель настоящей работы – изучение механизма взаимодействия левофлоксацина с липосомальной мембраной в зависимости от ее состава.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для установления механизма взаимодействия ЛФ с липосомальным бислоем и определения факторов, влияющих на этот процесс, были поставлены следующие задачи: 1) определить, как в зависимости от липидного состава изменяется характер взаимодействия липосом с ЛФ, установить основные сайты связывания, определить эффективность загрузки; 2) изучить состояние и микроокружение функциональных групп ЛФ методом спектроскопии кругового дихроизма (КД-спектроскопии).
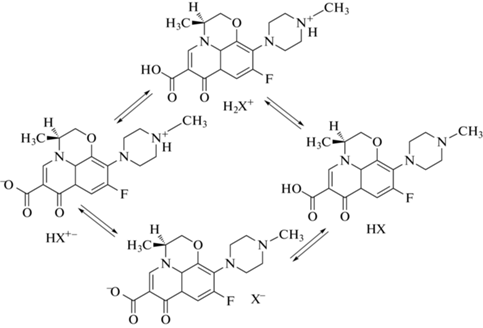
В зависимости от pH ЛФ может существовать в нескольких формах (рис. 1). Ранее мы установили [4], что моксифлоксацин (антибактериальный препарат того же класса, что и ЛФ) взаимодействует с липидной матрицей в основном за счет протонированного азота гетероцикла. Однако у ЛФ протонированный азот (формы HX+–, H2X+ [6, 7]) экранирован метильной группой, таким образом, характер взаимодействия с липидным бислоем у ЛФ может быть иным. Потенциальными сайтами связывания с липидным бислоем выступают ионогенные группы, в то время как заглубление в толщу бислоя малых органических молекул с большим числом полярных групп маловероятно, о чем свидетельствуют данные компьютерного моделирования, проведенного для мембраны на основе дипальмитоилфосфатидилхолина (ДПФХ) и доксорубицина [8].
Удобными и хорошо изученными модельными системами для выяснения роли электростатических взаимодействий при включении в липосомы малых органических молекул выступают липосомы ДПФХ 100%, в которых фосфатные группы липидов экранированы от взаимодействия положительно заряженными группами холина, и липосомы ДПФХ : кардиолипин (КЛ) 80 : 20% (m/m), обладающие выраженными анионными свойствами. Предположительно, дополнительный отрицательный заряд на везикулах, привносимый за счет добавления КЛ, способен внести изменения в характер взаимодействия липосом с ЛФ за счет формирования дополнительных электростатических взаимодействий с гетероциклом фторхинолона.
Получение липосомальных форм левофлоксацина и определение эффективности включения. Из литературы известно, что липидный состав оказывает существенное влияние на физико-химические свойства липосомальных форм малых лекарственных молекул [9], в том числе антибактериальных препаратов. Для левофлоксацина показано, что добавка холестерина к липосомам из фосфатидилхолина яичного желтка значительно уменьшает эффективность включения ЛФ при пассивной загрузке [10] – от 20 до 9%, что указывает на неблагоприятное действие повышенной жесткости мембраны на эффективность загрузки.
В работе рассмотрены липосомы ДПФХ 100% с характерной величиной ζ-потенциала –10 мВ и липосомы, содержащие 20% КЛ, с электрокинетическим потенциалом –20 мВ. Включение левофлоксацина практически не влияло на ζ-потенциал ДПФХ-липосом и незначительно (сравнимо с величиной погрешности) снижало ζ-потенциал анионных липосом (табл. 1 ). Включение ЛФ в липосомы не приводило к значимому изменению размера везикул, что наблюдалось ранее для липосомальной формы моксифлоксацина [4].
Степень включения левофлоксацина в липосомы определяли по материальному балансу путем регистрации УФ-спектров промывных вод после диализа. Для ЛФ характерна полоса поглощения с максимумом интенсивности при λ = = 285–287 нм (в зависимости от pH), соответствующая поглощению ароматического остова фторхинолона. Данный пик представляется удобным для анализа содержания препарата в растворе.
Были достигнуты высокие значения эффективности включения ЛФ: ~50%, что соответствовало ~4%-ному массовому соотношению ЛФ : липиды. Известно, что максимально возможное для малых лекарственных молекул соотношение 10% соответствует уже образованию нанокристаллов лекарства внутри водной полости бислоя [11]. Ранее для моксифлоксацина [4] было достигнуто массовое соотношение 5–6% в зависимости от состава липидной матрицы. В экспериментах с ЛФ добавление в бислой анионного липида не приводило к достоверному повышению эффективности загрузки, что указывает на незначительный вклад электростатических взаимодействий, однако для уточнения характера взаимодействия необходимо дополнительно изучить липосомальные формы ЛФ спектральными методами анализа.
Определение сайтов связывания липосом различного состава с левофлоксацином методом ИК-спектроскопии. Для изучения механизма взаимодействия ЛФ с липосомальной мембраной, определения основных сайтов связывания и для выявления различий в структуре загруженных липосом разного состава предложено использовать метод ИК-спектроскопии Фурье.
ИК-спектроскопия Фурье – это высокоинформативный спектральный метод, подходящий для изучения сложных коллоидных систем, в том числе липосом [12, 13]. Данный метод позволяет детально изучить взаимодействие ЛФ с различными функциональными группами липидов. ИК-спектры липосом содержат ряд основных полос поглощения, информативных при анализе взаимодействия липосом с различными молекулами. На рис. 2 приведен ИК-спектр липосом ДПФХ 100%. Симметричным и асимметричным валентным колебаниям СН2-группы соответствуют полосы в области 2850 ± 1 и 2919 ± 1 см–1. Эти полосы поглощения чувствительны к изменениям упаковки ацильных цепей липосом [14]. Полоса поглощения карбонильной группы расположена в области 1715–1750 см–1, она чувствительна к изменениям микроокружения на поверхности липид–вода. Для фосфатной группы фосфолипидов характерны две полосы валентных колебаний: ${{\nu PO}}_{2}^{ - }$ s 1088 см–1 и ${{\nu PO}}_{2}^{ - }$ as 1250–1230 см–1. Аналитически значимая полоса ${{\nu PO}}_{2}^{ - }$ as представляет наибольший интерес как чувствительная к взаимодействию катионных лигандов с полярной головной частью липосом. Изменение положения полос поглощения и их формы указывает на изменение микроокружения соответствующих функциональных групп. Таким образом, анализ ИК-спектров позволяет выявлять основные сайты связывания лигандов, в том числе малых органических молекул [15].
Рис. 2.
ИК-спектры липосом: (а) – ДПФХ 100% (сплошная линия) и ДПФХ 100%, нагруженные левофлоксацином (пунктир); (б) – ДПФХ : КЛ 80 : 20% (сплошная линия) и ДПФХ : КЛ, нагруженные левофлоксацином (пунктир). Условия: 0.02 М натрий-фосфатный буферный раствор (рН 7.4), 22°С; концентрация липидов 5 мг/мл.
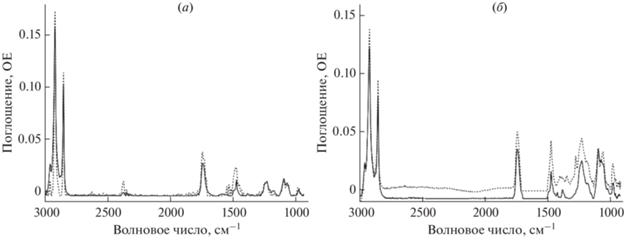
Рассмотрим различия в ИК-спектрах ДПФХ-липосом и липосомальной формы левофлоксацина (ЛЛФ) ДПФХ (рис. 2, табл. 2). Включение ЛФ в липосомы не приводило к существенным изменениям в областях поглощения валентных колебаний CH2-групп, что свидетельствует о том, что гидрофобная часть бислоя не включена во взаимодействие с ЛФ. Это ожидаемо, т.к. существенное влияние на плотность упаковки цепей могут оказывать, как правило, молекулы с крупным гидрофобным фрагментом, например, гидрофобизированный доксорубицин [16]. Для полосы фосфатной группы наблюдается незначительное изменение, связанное с увеличением интенсивности плеча пика 1240 см–1. Данные изменения в спектре связаны со снижением степени гидратации фосфатной группы и могут свидетельствовать о двух процессах. Возможно электростатическое связывание фосфатной группы с катионным лигандом, обычно при этом смещается и основной пик 1223 см–1 [17]; с другой стороны, плечо 1240 см–1 может также быть связано с вытеснением из микроокружения фосфатной группы воды. Поскольку и в ЛФ, и в ДПФХ заряд экранирован от взаимодействия, а плечо 1260 см–1 не наблюдается в спектре, мы предполагаем, что изменения в области поглощения фосфатной группы связаны с заглублением ЛФ в бислой вплоть до границы раздела фаз липид–вода. Об этом также свидетельствуют изменения в области поглощения карбонильной группы: данная полоса претерпевает характерное расщепление, описанное ранее [17]. Компонента 1740 см–1, соответствующая низкогидратированным карбонильным группам, характерна для электростатического взаимодействия на границе раздела фаз липид–вода. По-видимому, ЛФ частично вытесняет воду из микроокружения карбонильной и фосфатной групп. Аналогичный характер взаимодействия мы наблюдали для моксифлоксацина [4]: ДПФХ-мембрана не способна к существенному электростатическому взаимодействию с фторхинолонами.
Таблица 1.
Основные параметры липосомальных форм левофлоксацина (ЛЛФ) в сравнении с контрольными незагруженными липосомами
| Образец | Эффективность включения, % | ζ-Потенциал, мВ | Dh, нм (Z-Ave) |
|---|---|---|---|
| Липосомы ДПФХ 100% | – | –10.1 ± 0.5 | 103 ± 2 |
| ЛЛФ ДПФХ 100% | 55 ± 2 | –10.3 ± 0.2 | 100 ± 2 |
| Липосомы ДПФХ : КЛ 80 : 20 | – | –20.1 ± 1.0 | 100 ± 2 |
| ЛЛФ ДПФХ : КЛ 80 : 20 | 51 ± 7 | –21.5 ± 1.0 | 103 ± 3 |
Таблица 2.
Положение основных полос поглощения в ИК-спектрах липосомальной формы левофлоксацина ДПФХ 100% в сравнении с незагруженными липосомами
| Образец | νCH2 as, см–1 | νCH2 s, см–1 | νCO, см–1 | ${{\nu PO}}_{2}^{ - }$ as, см–1 |
|---|---|---|---|---|
| Липосомы ДПФХ 100% | 2918 | 2850 | 1737 | 1223 |
| Интерпретация | Гелеобразное состояние | |||
| ЛЛФ ДПФХ 100% | 2918 | 2850 | 1740, 1725 | 1221, 1240 |
| Интерпретация | Включение ЛФ не влияет на гидрофобную часть бислоя | Взаимодействие с ЛФ на границе раздела фаз липид : вода | Вытеснение воды из микроокружения фосфатной группы | |
Для анионных липосом состава ДПФХ : КЛ 80 : 20% наблюдается иная спектральная картина (табл. 3). Сравнивая положение основных полос поглощения в спектрах незагруженных липосом ДПФХ и ДПФХ : КЛ 80 : 20%, следует отметить существенные различия в областях, характерных для карбонильной и фосфатной групп. Эти различия ожидаемы и соответствуют включению в состав липосом анионного липида КЛ.
Таблица 3.
Положение основных полос поглощения в ИК-спектрах липосомальной формы левофлоксацина ДПФХ : КЛ 80 : 20% в сравнении с незагруженными липосомами
| Образец | νCH2 as, см–1 | νCH2 s, см–1 | νCO, см–1 | ${{\nu PO}}_{2}^{ - }$ as, см–1 |
|---|---|---|---|---|
| Липосомы ДПФХ : КЛ 80 : 20 | 2919 | 2851 | 1739, 1723 (плечо) | 1225 |
| Интерпретация | Гелеобразное состояние | |||
| ЛЛФ ДПФХ : КЛ 80 : 20 | 2918 | 2851 | 1740 | 1220, 1225, 1265 |
| Интерпретация | Включение ЛФ не влияет на гидрофобную часть бислоя | Взаимодействие с ЛФ на границе раздела фаз липид : вода | Вытеснение воды из микроокружения фосфатной группы | |
Полоса поглощения карбонильной группы в спектре липосом ДПФХ : КЛ 80 : 20% расщеплена на две компоненты, соответствующие высоко- (1723 см–1) и низкогидратированному (1739 см–1) состояниям, а в спектре ДПФХ-липосом представляет собой единый пик. Включение ЛФ в бислой приводит к изменению вида полос в обоих случаях. У ДПФХ-мембраны мы наблюдали расщепление полосы за счет появления плеча, связанного с низкогидратированными карбонильными группами. Для смешанных анионных липосом включение в бислой ЛФ приводит к единообразному смещению полосы на 1740 см–1. Компонента высокогидратированного состояния, по-видимому, соответствующая несвязанным карбонильным группам КЛ, исчезает. Вероятно, эти спектральные изменения связаны с взаимодействием данных функциональных групп с ЛФ и вытеснением молекул воды из их микроокружения. Таким образом, как для липосом ДПФХ 100%, так и для ДПФХ : КЛ 80 : 20% карбонильные группы липидов – важный сайт связывания ЛФ.
Примечательны изменения в области поглощения фосфатной группы. Здесь изменения в состоянии бислоя носят еще более выраженный характер по сравнению с липосомами ДПФХ 100%: существенно увеличиваются доли компонент, соответствующих низкогидратированным фосфатным группам, связанных с ЛФ. Очевидно, включение КЛ в состав бислоя обусловливает более интенсивное взаимодействие ЛФ с везикулами на поверхности.
Полученные данные свидетельствуют о различии механизмов связывания ЛФ с липосомами различного состава. ЛФ, по-видимому, не способен существенным образом влиять на подвижность гидрофобных цепей бислоя, и взаимодействие происходит на поверхности раздела фаз липид–вода. Присутствие анионного липида КЛ, вероятно, усиливает это взаимодействие за счет образования электростатических связей. Однако, если сравнивать эти результаты с полученными ранее для моксифлоксацина [4], следует отметить, что способность ЛФ к взаимодействию с бислоем несколько меньше, что может быть объяснено двумя факторами. С одной стороны, моксифлоксацин – наиболее липофильный фторхинолон, а с другой стороны, азот в его гетероцикле не метилирован и открыт ко взаимодействию с липидами. Для того чтобы более детально рассмотреть взаимодействие ЛФ с бислоем, рассмотрим, как меняется микроокружение самого фторхинолона при включении в бислой методами ИК-спектроскопии Фурье и КД-спектроскопии.
Изучение состояния левофлоксацина в липосомах методом ИК-спектроскопии Фурье. Сравнение спектров свободного ЛФ со спектрами ЛЛФ позволит соотносить полученные спектральные данные для липосомальных форм с ионогенным состоянием фторхинолона.
ИК-спектр ЛФ наиболее информативен в диапазоне 1800–950 см–1: здесь расположены полосы поглощения 1456 и 979 см–1, соответствующие колебаниям ароматического остова и пиперазольного фрагмента [18]. Эти полосы аналитически значимы и могут быть использованы для определения содержания ЛФ, а также его правовращающего стереоизомера офлоксацина в системе.
Рассмотрим влияние рН на спектры ЛФ, что позволит соотнести ИК-спектры ЛФ в матрицах систем доставки с ионногенным состоянием, которое будет преобладать в этой системе. В молекуле ЛФ присутствуют две ионогенные группы: карбоксильная группа, сопряженная с ароматической структурой хинолона, и пиперазольная группа.
Изменение pH существенно влияет на состояние молекулы, что сопровождается значительными изменениями в ИК-спектре молекулы при повышении pH с 2 до 4 и далее до рН 7 (рис. 3а). Существенные изменения наблюдаются в области 1640–1600 (область колебаний карбонильной и карбоксильной групп) и 1590–1400 см–1 (область колебаний ароматической структуры хинолона) (рис. 3б). Повышение pH приводит к появлению полосы 1580 см–1, соответствующей депротонированной карбоксильной группе, a также к существенным изменениям в структуре полос 1470–1450 см–1 – полосы с основным вкладом валентных колебаний С–С ароматического кольца и полос 1400–1339 см–1, относящихся к колебаниям связи C–N (ароматический третичный амин и амин пиперазольного кольца). Существенное изменение наблюдается также для области поглощения связи С=О карбоксильной группы (1270 см–1): повышение pH приводит к проявлению данной полосы поглощения (рис. 3а).
Рис. 3.
ИК-спектры левофлоксацина (1 мг/мл) при pH 7.0 (сплошная линия), рН 4.0 (прерывистая) и рН 2.0 (точки) в области 1800–950 см–1 (а) и 1650–1450 см–1 (б).
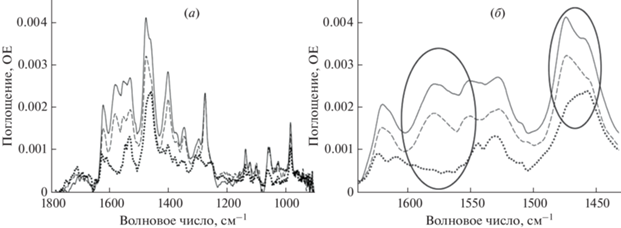
Анализ ИК-спектров, полученных при разных значениях рН (рис. 3), позволил провести соотнесение основных полос поглощения ЛФ с использованием литературных данных [18, 19]. Так, полосы 1730–1720 и 1622 см–1 соответствует валентным колебаниям связи С=О в карбоксильной и карбонильной группе соответственно, 1580 см–1 – полоса депротонированной карбоксильной группы, полосы поглощения 1606–1549 см–1 соответствуют колебаниям связей С=С в структуре хинолона, группа полос 1500–1400 см–1 относится к колебаниям связей С–С ароматического остова, которые могут перекрываться с колебаниями метильной группы связи СН3–N, полосы поглощения 1390–1350 и 1208 см–1, наиболее вероятно, относятся к колебаниям связи C–N (ароматический третичный амин), полоса поглощения 1339 см–1 чувствительна к протонированию пиперазольного кольца и соответствует связи C–N пиперазольной группы, полоса 1283–1270 см–1 отнесена к колебаниям связи С–О карбоксильной группы, полоса 1100 см–1 соответствует колебаниям связи С–О–С; колебаниям связи С–F соответствуют полосы в области 1053–1028 см–1; полоса 979 см–1 соответствует колебаниям пиперазольного остова колебания связей С–N и С–Н.
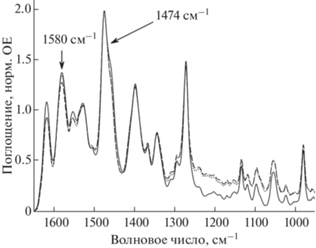
При включении ЛФ в липосомы в ИК-спектре фторхинолона наблюдаются небольшие изменения (рис. 4). Единообразно изменяется форма полосы поглощения 1474 см–1, соответствующей поглощению ароматического остова. Плечо 1458 см–1, характерное для полосы поглощения в спектре свободного ЛФ, исчезает при включении в липосомы, что указывает на изменение микроокружения фторхинолона за счет взаимодействия с бислоем. Обращает на себя внимание снижение интенсивности полосы поглощения 1580 см–1, соответствующей колебаниям депротонированной карбоксильной группы, причем наиболее выражен этот эффект для анионных липосом. Это хорошо согласуется с данными, представленными выше: очевидно, что взаимодействие ЛФ с липосомами ДПФХ : КЛ происходит в приповерхностном слое.
Рис. 4.
Нормированные ИК-спектры свободного левофлоксацина (сплошная линия), левофлоксацина в липосомах ДПФХ (пунктир) и ДПФХ : КЛ (точки). Условия: 0.02 М натрий-фосфатный буферный раствор (рН 7.4), 22°С.
Изучение состояния левофлоксацина в липосомах методом КД-спектроскопии. КД-спектроскопия – высокоинформативный метод анализа микроокружения и ионогенной формы оптически активных молекул, в частности фторхинолонов, в ахиральных матрицах, таких как липосомы. Изучение состояния хиральных молекул, таких как ЛФ, в липидных везикулах, – удобный способ определения механизма взаимодействия лекарств с бислоем.
В КД-спектре ЛФ наиболее информативна область в интервале 220–310 нм с характерными максимумами и минимумами эллиптичности [20]. Для того чтобы проанализировать изменения в спектрах КД при включении ЛФ в бислой, необходимо в независимых экспериментах проследить, как изменяется спектр ЛФ при изменении ионного состояния.
В зависимости от рН буферного раствора ЛФ находится в различных ионогенных формах (рис. 1), что отражается на КД-спектре (рис. 5а) [21]. В КД-спектре ЛФ наблюдаются два минимума: пик в области 287–300 нм соответствует сопряженной ароматической системе ЛФ (“первый минимум”), а пик при 222–231 нм в основном соответствует карбонильным и карбоксильным группам ЛФ (“второй минимум”). Помимо двух минимумов удается зафиксировать на спектре максимум в области 268–285 нм, однако его анализ затруднен: пик очень широкий.
Рис. 5.
Нормированные КД-спектры левофлоксацина: (а) – в различных буферных растворах: рН 4.0 (0.1 мМ раствор соляной кислоты), рН 7.4 (0.02 М натрий-фосфатный буферный раствор), рН 9.2 (0.02 М боратный буферный раствор); (б) – в различных средах: рН 7.4 (0.02 М натрий-фосфатный буферный раствор, 1,4-диоксан), 25°С.
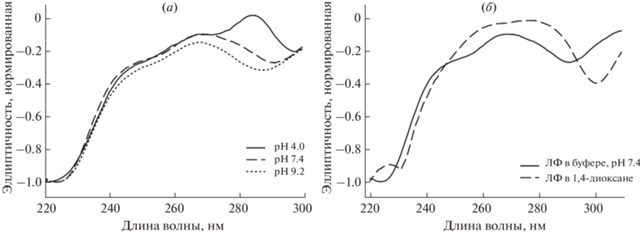
При рН 4.0 основная форма – H2X+ c характерным видом спектра (первый минимум 297 ± 0.5 нм, второй минимум 222 ± 0.5 нм). В растворе с физиологическим значением рН 7.4 устанавливается равновесие между несколькими формами, а именно HX, HX+–, X–, что приводит к существенным изменениям в спектре, в первую очередь к смещению положения максимума на 16 нм в синюю область (268 ± 0.5 нм) и к смещению второго минимума в красную область на 6 нм (226 ± 0.5 нм). В щелочной среде (рН 9.2) преобладает форма Х–, завершается смещение первого минимума в синюю область: итоговое смещение при переходе от рН 4.0 (полностью протонированная форма, 287 ± 0.5 нм) до рН 9.2 составляет 10 нм (297 ± 0.5 нм).
КД-спектры ЛФ очень чувствительны к изменению ионогенного состояния молекулы. С другой стороны, полярность микроокружения ЛФ также влияет на спектр. Например, при переходе в апротонный полярный растворитель 1,4-диоксан, который в первом приближении соответствует полярной части липидного бислоя, КД-спектр меняется существенно. По сравнению с водной средой, в 1,4-диоксане переход между разными ионогенными формами подавлен, и наблюдаемый спектр соответствует форме HX (рис. 5б). Относительно спектра раствора ЛФ в физиологическом рН спектр в 1,4-диоксане смещен единообразно в красную область, при этом наиболее ярко проявляется первый минимум (табл. 4). Это хорошо согласуется с литературными данными: так, при увеличении гидрофобности среды для тирозина и триптофана в КД-спектрах будет наблюдаться сдвиг в красную область [22].
Таблица 4.
Положение основных полос в КД-спектре левофлоксацина в различных средах
| Положение пика, нм | Функциональная группа | pH 4.0 | pH 7.4 | pH 9.2 | 1,4-Диоксан | ЛЛФ ДПФХ 100% | ЛЛФ ДПФХ : КЛ 80 : 20 |
|---|---|---|---|---|---|---|---|
| Первый минимум | Сопряженная ароматическая система | 297 ± 0.5 | 291 ± 0.5 | 287 ± 0.5 | 300 ± 0.5 | 296 ± 0.5 | 294 ± 0.5 |
| Второй минимум | Карбонильные и карбоксильные группы + ароматический остов | 222 ± 0.5 | 224 ± 0.5 | 223 ± 0.5 | 231 ± 0.5 | 229 ± 0.5 | 224 ± 0.5 |
| Формы ЛФ | H2X+ | HX, HX+–, X– | X– | HX | Взаимодействие с би-слоем на поверхности липид–вода | Взаимодействие преимущенственно на поверхности бислоя |
Первый минимум в ближней УФ-области изменяется аналогично подобному минимуму поглощения у триптофана, сдвигаясь в красную область при уменьшении полярности растворителя [22]. Второй минимум смещается при переходе в органический растворитель более заметно: на 9 нм в красную область, что ожидаемо для пика, соответствующего карбоксильным и карбонильным группам в ЛФ.
Первый минимум удобен для изучения состояния ЛФ в зависимости от рН среды: чем выше рН, тем дальше в синюю область сдвинут пик. Также первый минимум чувствителен к гидрофильности среды. Второй минимум удобен для оценки гидрофильно-гидрофобного баланса микроокружения ЛФ: при смене среды с водной на органическую пик смещается в красную область.
Влияние включения в липосомы на КД-спектр левофлоксацина. Рассмотрим изменения, наблюдаемые в КД-спектре ЛФ при включении его в липосомы (табл. 4, рис. 6).
Рис. 6.
Нормированные КД-спектры левофлоксацина в буферном растворе (0.02 М натрий-фосфатный буферный раствор, рН 7.4) и в липосомальных формах (ДПФХ : КЛ 80 : 20% и ДПФХ 100%), 25°С.
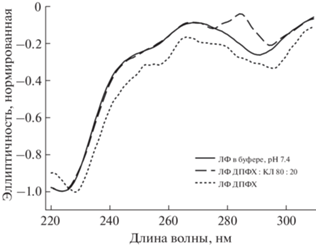
Для ДПФХ-липосом включение ЛФ приводит к смещению первого минимума в спектре на 5 нм в красную область (с 291 на 296 нм) и второго минимума на 5 нм (с 224 до 229 нм). Данные изменения указывают на возможное протонирование карбоксильных групп и изменение микроокружения ЛФ на более гидрофобное. Эти данные подкрепляют предположение, сделанное на основе ИК-спектроскопии Фурье: ЛФ способен заглубляться в ДПФХ-бислой, взаимодействуя с границей раздела фаз липид–вода.
При введении в состав липосом анионного липида КЛ изменения в КД-спектре носят менее выраженный характер. Первый минимум аналогично смещается на 3 нм – до 294 нм, а второй остается неизменным. Взаимодействие ЛФ с липосомами ДПФХ : КЛ 80 : 20 не приводит к изменению гидрофильности микроокружения лекарственной молекулы; взаимодействие, по-видимому, носит поверхностный характер за счет вытеснения воды в микроокружении фосфатных групп липидов.
Полученные данные позволяют предположить, что в нейтральных липосомах ЛФ встраивается в бислой глубже относительно анионных липосом. Возможно, бислой, содержащий КЛ, за счет взаимодействия фосфатных групп КЛ с протонированным гетероциклом удерживает ЛФ у поверхности, не позволяя ему заглубиться в мембрану.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. В работе использованы левофлоксацин, 1,4-диоксан (Sigma-Aldrich, США); HCl, лимонная кислота (тв.), динатрия гидрофосфат (двенадцативодный кристаллогидрат), бура Na2B4O7 ⋅ 10H2O (Реахим, Россия); таблетки для приготовления натрий-фосфатного буферного раствора с рН 7.4 (ПанЭко, Россия); кардиолипин (КЛ) динатриевая соль, раствор в хлороформе (25 мг/мл); дипальмитоилфосфатидилхолин, раствор в хлороформе (ДПФХ) – препараты фирмы Avanti Polar Lipids (США). В работе использовали буферные растворы: 0.1 мM солянокислый буферный раствор (pH 4.0); 0.02 М натрий-фосфатный буфер (pH 7.4); 0.01 М боратный буферный раствор (pH 9.2).
Получение липосом. Раствор липидов в хлороформе был взят в весовом соотношении ДПФХ : КЛ 80 : 20%, органический растворитель тщательно удаляли на вакуумном роторном испарителе (Ika, Германия) при температуре, не превышающей 55°С. Образующуюся тонкую пленку липидов диспергировали в 0.02 М натрий-фосфатном буфере (pH 7.4). Препарат в течение 5 мин подвергали воздействию ультразвуковой ванны (37 Гц). Далее препарат был обработан ультразвуком (22 кГц) в течение 600 с (2 × 300 с) в непрерывном режиме при постоянном охлаждении на диспергаторе 4710 (Cole-Parmer Instrument, США).
Получение липосомальных форм левофлоксацина. Для получения загруженных левофлоксацином липосом (ЛЛФ) методом пассивной загрузки была использована ранее описанная методика [4]. Липидную пленку диспергировали 0.01 М натрий-фосфатным буферным раствором (pH 7.4), содержащим левофлоксацин (4 мг/мл). Полученную суспензию в течение 5 мин подвергали воздействию ультразвуковой ванны (37 Гц), затем обрабатывали ультразвуком (22 кГц) в течение 600 с (2 × 300 с) в непрерывном режиме при постоянном охлаждении на диспергаторе 4710 (Cole-Parmer Instrument, США). Свободный левофлоксацин отделяли методом диализа против натрий-фосфатного буферного раствора (Serva MW cut-off 3500) в течение 2 ч с последующим определением степени включения ЛФ в везикулы.
УФ-спектроскопия. УФ-спектры левофлоксацина регистрировали на спектрометре УФ- и видимого диапазона UltraSpec 2100 pro (Amersharm Biosciences, США) в интервале 200–400 нм в кварцевой кювете на 1 мл (Hellma Analytics, Германия). Основной характеристический пик левофлоксацина наблюдался при 287 нм.
ИК-спектроскопия. Спектры регистрировали с помощью ИК-Фурье-спектрометра Tensor 27 (Bruker, Германия), оснащенного MCT-детектором, охлаждаемым жидким азотом, и термостатом (Huber, США). Измерения проводили в термостатируемой ячейке BioATR II (Bruker, Германия) с использованием элемента однократного отражения из ZnSe при 22°C и постоянной продувке системы сухим воздухом с помощью компрессора (JUN-AIR, Германия). На элемент внутреннего отражения наносили аликвоту (50 мкл) соответствующего раствора, спектр регистрировали трижды в интервале от 4000–950 см–1 с разрешением 1 cм–1; производили 70-кратное сканирование и усреднение. Спектр фонового раствора регистрировался аналогично и автоматически вычитался из спектра образца. Для анализа спектров использовали программу Opus 7.0 (Bruker, Германия). При регистрации ИК-спектров липосом, загруженных ЛФ, в качестве фонового раствора использовали раствор ЛФ в равной концентрации. При регистрации ИК-спектров ЛФ в липосомах в качестве фонового раствора использовали суспензии соответствующих незагруженных липосом.
КД-спектроскопия. КД-спектры регистрировали на спектрометре кругового дихроизма J-815 (Jasco, Япония) с термостатированным кюветным отделением в интервале длин волн 310–220 нм. В типичном эксперименте образец, содержащий 0.25–0.5 мг/мл препарата с фторхинолоном в соответствующем растворителе, помещали при заданной температуре в кварцевую кювету с длиной пути 1 мм (Hellma Analytics, Германия).
Динамическое рассеяние света. Измерение размеров частиц и их ζ-потенциалов проводили с помощью анализатора размера частиц Zetasizer Nano S (Malvern, Англия; 4 мВт He–Ne-лазер, 633 нм) в термостатируемой ячейке при 22°С с использованием программного обеспечения Malvern.
ЗАКЛЮЧЕНИЕ
Исследованы липосомальные формы левофлоксацина и их свойства. Определено, что состав липосом (анионный либо нейтральный) не влияет на загрузку фторхинолона, удалось получить формы с относительно высокой эффективностью включения – с массовым процентным соотношением лекарство : липид 4%. Методом ИК-спектроскопии Фурье установлено, что у ДПФХ-липосом ЛФ заглубляется в приполярную область на границе раздела фаз липид–вода. При взаимодействии со смешанными анионными липосомами установлена роль анионного липида в механизме взаимодействия активной молекулы с бислоем: ЛФ входит в микроокружение фосфатной группы, вытесняя воду, и не продвигается глубже.
Предложенный механизм подтвержден данными КД-спектроскопии. Обнаружено, что КД-спектр ЛФ в интервале длин волн 220–350 нм содержит три пика, отвечающих за микроокружение функциональных групп ЛФ: минимум в интервале 285–305 нм, соответствующий состоянию сопряженной азотсодержащей ароматической структуры, который сдвигается в коротковолновую область при повышении pH и в длинноволновую область при переходе в апротонный органический растворитель (при понижении гидрофильности среды); минимум в интервале 220–235 нм, соответствующий состоянию карбоксильной и карбонильной групп, а также двойных связей, который незначительно смещается при изменении pH и сдвигается длинноволновую область при понижении гидрофильности среды; минимум в интервале 265–285 нм, соответствующий состоянию ароматической структуры, который сдвигается в коротковолновую область при повышении pH и смещается в длинноволновую при понижении гидрофильности среды.
Полученные экспериментальные данные позволяют сделать вывод о механизме взаимодействия малых органических молекул, в первую очередь антибактериальных препаратов, с бислоем. Подобный подход на основе сочетания трех спектральных методов открывает перспективы создания новых лекарственных свойств и возможности предсказания характера взаимодействия активных молекул с биомембранами для прогнозирования их эффективности и потенциальных побочных эффектов.
Список литературы
Weers J. // Adv. Drug Deliv. Rev. 2015. V. 85. P. 24–43. https://doi.org/10.1016/j.addr.2014.08.013
Geller D.E., Flume P.A., Staab D., Fischer R., Loutit J.S., Conrad D.J. // Am. J. Respir. Crit. Care Med. 2011. V. 183. P. 1510–1516. https://doi.org/10.1164/rccm.201008-1293OC
Andrade S., Ramalho M.J., Loureiro J.A., Pereira M.C. // J. Mol. Liquids. 2021. V. 334. P. 116141. https://doi.org/10.1016/j.molliq.2021.116141
Le-Deygen I.M. // Chem. Phys. Lipids. 2020. V. 228. P. 104891. https://doi.org/10.1016/j.chemphyslip.2020.104891
Matos C., Moutinho C., Lobão P. // J. Membr. Biol. 2012. V. 245. P. 69–75. https://doi.org/10.1007/s00232-011-9414-2
Ska-Szmurło E.K., Grudzień M., Betlejewska-Kielak K., Pluciński F., Biernacka J., Mazurek A.P. // Acta Chim. Slov. 2014. V. 61. P. 827–834. https://journals.matheo.si/index.php/ACSi/article/ view/562
Ross D.L., Riley C.M. // Int. J. Pharm. 1992. V. 83. P. 267–272. https://doi.org/10.1016/0378-5173(82)90032-1
Yacoub T.J., Reddy A.S., Szleifer I. // Biophys. J. 2011. V. 101. P. 378–385. https://doi.org/10.1016/j.bpj.2011.06.015
Mohammed A.R., Weston N., Coombes A.G.A., Fitzgerald M., Perrie Y. // Int. J. Pharm. 2004. V. 285. P. 23–34. https://doi.org/10.1016/j.ijpharm.2004.07.010
Сорокоумова Г.М., Ясин Я.О.Х., Микулович Ю.Л., Смирнова Т.Г., Андреевская С.Н., Селищева А.А., Черноусова Л.Н., Швец В.И. // Вестник МИТХТ. 2013. Т. 5. С. 72–76. https://www.finechem-mirea.ru/jour/article/view/531
Barenholz Y. // J. Control. Release. 2012. V. 160. P. 117–134. https://doi.org/10.1016/j.jconrel.2012.03.020
Bensikaddour H., Fa N., Burton I., Deleu M., Lins L., Schanck A., Brasseur R., Dufrêne Y.F., Goormaghtigh E., Mingeot-Leclercq M.P. // Biophys. J. 2008. V. 94. P. 3035–3046. https://doi.org/10.1016/j.bbamem.2008.08.015
Deygen I.M., Kudryashova E.V. // Colloids and Surfaces B: Biointerfaces. 2016. V. 141. P. 36–43. https://doi.org/10.1016/j.colsurfb.2016.01.030
Manrique-Moreno M., Howe J., Suwalsky M., Garidel P., Brandenburg K. // Letters in Drug Design & Discovery. 2009. V. 7. P. 50–56. https://doi.org/10.2174/157018010789869280
Tretiakova D., Le-Deigen I., Onishchenko N., Kuntsche J., Kudryashova E., Vodovozova E. // Pharmaceutics. 2021. V. 13. P. 473. https://doi.org/10.3390/pharmaceutics13040473
Deygen I.M., Seidl C., Kolmel D.K., Bednarek C., Heissler S., Kudryashova E.V., Braese S. // Langmuir. 2016. V. 32. P. 10861–10869. https://doi.org/10.1021/acs.langmuir.6b01023
Deygen I.M., Kudryashova E.V. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 547–557. https://doi.org/10.1134/S1068162014050057
Nisar J., Iqbal M., Iqbal M., Shah A., Akhter M.S., Uddin S., Khan R., Uddin I., Shah L.A., Khan M.S. // Zeitschrift Fur Physikalische Chemie. 2020. V. 234. P. 117–128. https://doi.org/10.1515/zpch-2018-1273
Bhardwaj V., Bhardwaj T., Sharma K., Gupta A., Chauhan S., Cameotra S.S., Sharma S., Gupta R., Sharma P. // RSC Advances. 2014. V. 4. P. 24935–24943. https://doi.org/10.1039/c4ra02177k
Chamseddin, Jira T. // Curr. Pharmaceut. Analysis. 2013. V. 9. P. 121–129. https://doi.org/10.2174/157341213804806160
Ranjbar B., Gill P. // Chem. Biol. Drug Des. 2009. V. 74. P. 101–120. https://doi.org/10.1111/j.1747-0285.2009.00847.x
Li R., Nagai Y., Nagai M. // J. Inorg. Biochem. 2000. V. 82. P. 93–101. https://doi.org/10.1016/S0162-0134(00)00151-3
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия