Биоорганическая химия, 2022, T. 48, № 4, стр. 415-441
Флуоресцентные зонды для обнаружения хлорноватистой кислоты в живых клетках
В. Е. Реут 1, И. В. Горудко 1, Д. В. Григорьева 1, А. В. Соколов 2, 3, О. М. Панасенко 3, *
1 Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
2 ФГБНУ “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, 12, Россия
3 ФГБУ “Федеральный научно-клинический центр физико-химической медицины” ФМБА России
119435 Москва, ул. Малая Пироговская, 1а, Россия
* E-mail: o-panas@mail.ru
Поступила в редакцию 02.08.2021
После доработки 12.10.2021
Принята к публикации 22.11.2021
- EDN: SLWDKP
- DOI: 10.31857/S0132342322030162
Аннотация
Хлорноватистая кислота (HOCl) играет роль в иммунных (воспалительных) реакциях не только при защите организма от патогенов, но и в силу высокой реакционной способности провоцирует развитие и осложнение многих заболеваний. Актуальная задача – разработка высокочувствительных и избирательных по отношению к HOCl биосенсоров, включая флуоресцентные зонды. Тем не менее регистрация образования HOCl в биологических объектах сопряжена с рядом трудностей. Так, нестабильность используемых в настоящее время зондов или их цитотоксичность, а также возбуждение флуоресценции в ультрафиолетовой области спектра или в полосах поглощения основных клеточных белков делают поиск новых хемосенсоров актуальной задачей на протяжении многих лет. В данном обзоре рассмотрены вопросы классификации малых молекулярных зондов для регистрации HOCl в биологических системах, а также обобщены результаты разработки хемосенсоров. Особое внимание уделено достижениям в этой области за 2016–2021 гг. Сформулирован ряд проблем, касающихся конструирования и применения малых молекулярных зондов. Ввиду отсутствия “золотого стандарта” среди хемосенсоров HOCl, что связано в том числе с коммерческой недоступностью либо сложными методами синтеза новых сенсоров, даны рекомендации по области применения упомянутых хемосенсоров. Обозначены тенденции в разработке флуоресцентных хемосенсоров для визуализации продукции HOCl в живых клетках.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………................416
Типы молекулярных флуоресцентных зондов для регистрации HOCl……………….........417
Классификация зондов по сайтам реакции..........417
Классификация зондов по типу флуоресцентного ответа…………….....................418
Классификация зондов по типу флуорофора........419
Предпосылки к разработке современных флуоресцентных хемосенсоров……………...........420
Зонды “включения” и “выключения”...................420
Переход к концепции зондов “переключения” ........424
Последние достижения в разработке малых молекулярных флуоресцентных зондов для регистрации HOCl……………........................425
Зонды на основе кумарина…………………..............425
Зонды на основе флуоресцеина……………..............427
Зонды на основе феноксазина……………...............427
Зонды на основе родола……………………................430
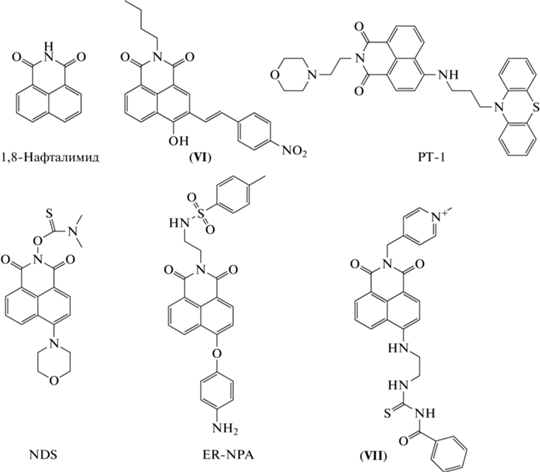
Зонды на основе 1,8-нафталимида…………….......430
Иные малые молекулярные зонды…………….........433
ЗАКЛЮЧЕНИЕ…………………………..................436
СПИСОК ЛИТЕРАТУРЫ…………………. ..........438
ВВЕДЕНИЕ
Активные формы кислорода (АФК), азота (АФА) и галогенов (АФГ), вырабатываемые живыми организмами, необходимы для обеспечения различных биологических функций: межклеточного взаимодействия, внутриклеточной передачи сигналов, модуляции артериального давления, контроля иммунной системы, фагоцитоза, регуляции активности ферментов и факторов транскрипции, синтеза биологических соединений, процессов метаболизма и др. [1, 2]. Однако в силу высокой реакционной способности данные соединения, модифицируя биологически важные молекулы (нуклеиновые кислоты, белки, липиды и др.), также вовлечены в патологические процессы, такие как старение, диабет, нейродегенеративные и сердечно-сосудистые заболевания, рак, катаракта, ревматоидный артрит, воспаление, ишемические и постишемические патологии [3]. Среди АФГ хлорноватистая кислота (HOCl), вырабатываемая миелопероксидазой (MPO, КФ 1.11.2.2) – ферментом, содержащимся в основном в азурофильных гранулах нейтрофилов, в меньшем количестве в моноцитах, – участвует в реакциях как окисления, так и хлорирования и играет особую роль в защите организма от внешних патогенов [4, 5]. Стоит отметить, что значение рКa HOCl составляет 7.5, т.е. при физиологическом рН практически равные концентрации HOCl и OCl– содержатся в водной среде, поэтому здесь и далее под HOCl подразумевается смесь этих форм (HOCl/OCl–) [6]. Повышение концентрации MPO в плазме крови, избыточное образование HOCl и хлорированных продуктов приводят к повреждению собственных клеток и тканей организма. Многие воспалительные заболевания (например, сердечно-сосудистые, нейродегенеративные, атеросклероз, васкулит, фиброз, ревматоидный артрит, некоторые виды рака и др.) сопровождаются повышением количества и/или активности MPO, ростом продукции HOCl и, как следствие, выявлением в биологических жидкостях пациентов с данными патологиями так называемых маркеров галогенирующего стресса (3-хлортирозина, 5-хлорурацила, α-хлоральдегидов, хлорированных белков и др.) [6, 7]. Ввиду исключительной роли HOCl как в защите организма от патогенов, так и в развитии патологий, исследование кинетики образования HOCl, ее локализации, механизмов регуляции активности MPO, выявление вклада MPO в развитие заболеваний – важные не только фундаментальные, но и прикладные задачи, направленные на профилактику, диагностику и контроль за лечением заболеваний, ассоциированных с воспалением.
Регистрация HOCl сопряжена с рядом трудностей. HOCl обладает высокой реакционной способностью и малым временем жизни в биологических средах. Так, константа скорости реакции HOCl с аминокислотами цистеином и метионином превышает 107 М−1 с−1, а с гистидином, таурином, α-аминогруппами – более 105 М−1 с−1 [8]. Также возможны реакции и с другими мишенями (NH2-группами “полярных головок” фосфатидилэтаноламина и фосфатидилсерина, ДНК, двойными связями в белках и липидах), однако они вряд ли будут играть решающую роль из-за более низких скоростей реакции. Более того, фагоциты генерируют также целый ряд других высокореакционных соединений: АФК ($^{\centerdot }{\text{O}}_{2}^{ - },$ H2O2, 1O2, •OH, ROO• и др.), АФА (•NO, ONOOˉ, ${\text{NO}}_{2}^{ - },$ •NO2 и др.), а также АФГ (помимо HOCl может образовываться HOBr, хлор-, бромамины и др.) [3, 9]. Учитывая все это, становится ясным, что для регистрации продукции HOCl в биологических системах необходимы надежные, чувствительные и селективные инструменты обнаружения, имеющие высокое пространственное и временное разрешение. Таким мощным инструментом, сочетающим простоту манипуляций и доступность, выступает флуоресцентный анализ на основе синтетических зондов (хемосенсоров) [10, 11]. Несмотря на то, что в последние годы разработано множество хемосенсоров, способных регистрировать HOCl и другие АФК, АФГ и АФА, такие недостатки, как низкая стабильность, отсутствие специфичности их реакций с окислителями или сильное влияние восстановителей, а также цитотоксичность делают поиск новых флуоресцентных зондов, способных регистрировать HOCl в биологических системах, по-прежнему актуальным направлением.
Большинство экспериментальных исследований и аналитических обзоров, посвященных данной тематике, сфокусированы на физико-химических аспектах взаимодействия зондов с HOCl в бесклеточной среде, а также перспективах разработки новых зондов [10–14]. Меньше внимания уделено применению этих зондов для регистрации HOCl в клеточных средах. Ввиду того, что конечная цель разработки сенсоров – изучение вклада HOCl в физиологические и патофизиологические процессы, скрининг лекарственных препаратов, а также прогнозирование и диагностика заболеваний, крайне важны исследования возможности использования этих веществ в системах клеток/тканей/организма. В данном обзоре собрана информация о наиболее перспективных малых молекулярных флуоресцентных зондах, предназначенных для регистрации HOCl в клеточных системах. Отметим также, что некоторые вопросы применения наночастиц и квантовых точек для регистрации HOCl приведены в работах [15–17] и не будут затронуты в данном обзоре.
ТИПЫ МОЛЕКУЛЯРНЫХ ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ ДЛЯ РЕГИСТРАЦИИ HOCl
Выбор флуоресцентного зонда зависит от целей исследования, а чувствительность и избирательность зонда по отношению к аналиту (веществу, содержание которого требуется оценить, в нашем случае – HOCl) – зачастую определяющие факторы выбора сенсора. В качестве количественной меры чувствительности зонда к HOCl чаще всего используют предел обнаружения (ПО) [18]. Математическое выражение для расчета ПО выглядит так:
ПО = 3σ/k,
где σ – стандартное отклонение интенсивности флуоресценции раствора зонда в отсутствие HOCl, k – тангенс угла наклона калибровочной кривой зависимости интенсивности флуоресценции от концентрации HOCl [19]. Под избирательностью понимают предпочтительное взаимодействие зонда с HOCl по сравнению с прочими соединениями. Чаще всего в экспериментальных статьях чувствительным зонд признают в случае, когда изменение интенсивности его флуоресценции при действии HOCl значительно больше, чем при действии других присутствующих высокореакционных соединений. Чувствительность и избирательность зонда могут ограничивать как используемый химический механизм преобразования сенсора, так и тип преобразования флуоресцентного ответа или использование конкретных флуорофоров.
Классификация зондов по сайтам реакции
Разработка флуоресцентных зондов для регистрации HOCl основана на окислительно-восстановительных реакциях или реакциях замещения между HOCl и хемосенсором. Примеры некоторых основных реакций HOCl с функциональными группами флуоресцентных зондов представлены на рис. 1:
Рис. 1.
Механизмы взаимодействия хемосенсоров с HOCl (R – флуорофор). Реакция HOCl: 1 – с X-содержащими соединениями (X = S, Se, Te; R' = H или алкил); 2 – с производными оксима; 3 – с гидразинами и амидами (R' = NH2); 4 – с Cu(I)-содержащими соединениями; 5 – с ненасыщенной углерод-углеродной связью; 6 – с производными п-метоксифенола (Х = О) и п-аминофенола (X = NR', R' = H или алкил). Адаптировано по данным работ [16, 22].
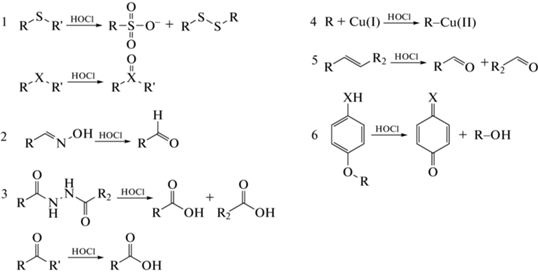
1) серосодержащие соединения окисляются под воздействием HOCl с образованием сульфонатов, дисульфидов или сульфоксидов, селен- и теллур-содержащие – до селен- и теллуроксидов соответственно (рис. 1, 1) [20];
2) производные оксима окисляются HOCl до альдегидов (рис. 1, 2) [21, 22];
3) гидразины и амиды хлорируются под действием HOCl с последующим гидролизом в водной среде и образованием карбонильных соединений (рис. 1, 3) [16, 22];
4) Cu(I) и другие металл-содержащие соединения окисляются под действием HOCl (рис. 1, 4), на основе реакций такого типа для косвенного обнаружения HOCl разработаны хемосенсоры, чувствительные, например, к Cu(II) [22];
5) ненасыщенные углерод-углеродные связи (–НС=СН–) подвергаются реакции электрофильного присоединения HOCl с образованием изомеров хлоргидринов [6] и дальнейшему окислению до более стабильных нехлорированных карбонильных соединений (рис. 1, 5) [22];
6) производные п-метоксифенола и п-аминофенола окисляются HOCl с высвобождением бензохинона и бензохинонимина соответственно (рис. 1, 6) [16, 22, 23].
Классификация зондов по типу флуоресцентного ответа
Для регистрации HOCl важны флуоресцентные свойства используемых зондов. Так, в результате взаимодействия сенсора с аналитом интенсивность его флуоресценции может изменяться следующим образом:
1) уменьшаться, такой тип зондов упоминается в литературе под названиями “turn-off” [10], “on-off” [16], “negative” [24] (т.е. “выключения”, “отрицательные”);
2) увеличиваться, такой тип зондов именуется “turn-on” [13], “off-on” [16, 25], “positive” [24] (т.е. “включения”, “положительные”);
3) убывать на одной и возрастать на другой длине волны испускания или возбуждения флуоресценции, наиболее часто встречаемое наименование таких зондов – “ratiometric” [16], реже “switch” (т.е. “ратиометрические” или “переключения”).
Исторически первым появившимся типом хемосенсоров были зонды “выключения”. Такие молекулярные зонды обладают собственной флуоресценцией и теряют свои флуоресцентные свойства при взаимодействии с HOCl (рис. 2а, 1). Если хемосенсор не флуоресцирует или интенсивность флуоресценции крайне мала, а образующийся в результате реакции с HOCl продукт обладает флуоресценцией, интенсивность которой в разы превышает фоновый уровень, то его относят к типу “включения” (рис. 2а, 2.1). “Включение” зонда может происходить при непосредственном окислении до флуоресцирующего продукта либо за счет высвобождения заблокированного флуорофора. Возможна ситуация, когда зонд первоначально нужно “активировать”, а уже затем при реакции с аналитом он переходит во флуоресцирующую форму – такая система получила название “двойного замка” (рис. 2а, 2.2) [26]. Если при взаимодействии с HOCl происходит сдвиг спектрального диапазона в спектрах возбуждения или испускания, то такие зонды относятся к типу “переключения” (рис. 2а, 3). Наиболее часто зонды “переключения” характеризуются изменениями в спектрах испускания.
Рис. 2.
Типы и механизмы флуоресцентного ответа датчиков. (а) – Общий вид типов флуоресцентного ответа: 1 – “выключения”, 2.1 – “включения”, 2.2 – “двойного замка”, 3 – “переключения”; (б) – механизмы изменения флуоресцентного ответа: 1.1 – FRET выкл, 1.2 – FRET вкл, 2.1 – a-PET, 2.2 – д-PET, 3 – ICT, 4 – ESIPT. “Ф” – флуорофор, “Д” – донор, “А” – акцептор. С изменениями и дополнениями из работы P. Gao et al. [27]. Пояснения см. в тексте.
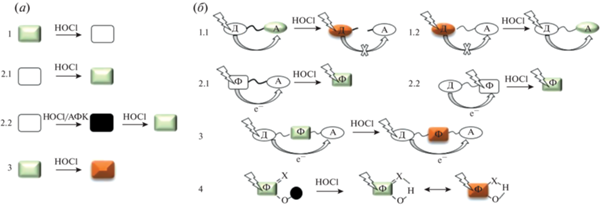
Вместе с указанием типа датчика говорят и о механизме (если он установлен) изменения его флуоресцентных свойств: флуоресцентный резонансный перенос энергии (FRET), фотоиндуцированный перенос электронов (PET), внутримолекулярный перенос заряда (ICT) или внутримолекулярный перенос протонов в возбужденном состоянии (ESIPT, рис. 2б) [27].
FRET – явление безылучательной передачи энергии от донора “Д” к акцептору “A” (рис. 2б) за счет дальнодействующих диполь-дипольных взаимодействий. Эффективность FRET сильно зависит от степени перекрытия спектров поглощения (возбуждения) “A” и испускания “Д”. Процесс FRET до взаимодействия хемосенсора с HOCl может быть как активным с последующей инактивацией (FRET выкл – рис. 2б, 1.1), так и заблокированным с последующей активацией (FRET вкл – рис. 2б, 1.2). Зонды, сконструированные по принципу FRET, могут относиться ко всем трем типам (“включения”, “выключения” и “переключения”), однако чаще всего используются в качестве зондов “переключения”, где и “Д”, и “А” выступают флуорофорами [27, 28]. В последние годы чаще стали появляться сведения о новом механизме передачи энергии между “Д” и “А”, аналогичном FRET, но лишенном некоторых его недостатков: не требуется эффективное перекрытие спектров испускания “Д” и поглощения “А”, эффективность переноса не зависит значительно от расстояния между “Д” и “А”, за счет чего возрастает скорость безызлучательной передачи энергии, и наблюдается большой псевдостоксов сдвиг. Предполагается, что процесс передачи энергии идет через электронно-сопряженный жесткий линкер π-системы (фенильные остатки, ацетилен, оксидазольный компонент) и называется передачей энергии через связь (through bond energy transfer, TBET), хотя сам механизм еще не вполне изучен. Подробнее с этим механизмом и зондами на его основе можно ознакомиться, например, в обзоре Cao et al. [29].
PET – явление фотоиндуцированного переноса электронов, часто используемое при проектировании зондов типа “включения”. Зонды, в основе которых используется механизм PET, можно разделить на а-PET и д-PET. a-PET представляет собой процесс переноса электронов от возбужденного флуорофора “Ф” к электронно-дефицитному “A” (рис. 2б, 2.1), что вызывает тушение флуоресценции “Ф” и называется окислительным PET. д‑PET представляет собой перенос электронов от “Д” к возбужденному “Ф” (рис. 2б, 2.2) и вызывает восстановление “Ф”, а также тушение флуоресценции и называется восстановительным PET. При реакции зонда с HOCl происходит смещение энергетических уровней “Д” и “А” относительно друг друга (для д-PET – “Д” и “Ф”, для a‑PET – “А” и “Ф”), что приводит к блокировке процесса PET и увеличению интенсивности флуоресценции [27, 28].
Зонды, работающие по принципу ICT, в составе одной молекулы содержат “Д” и “A” электронов на разных концах от “Ф” (рис. 2б, 3). Сам флуорофор также может быть использован в качестве “Д” или “А”. Возбужденное состояние зонда обладает большим дипольным моментом по сравнению с основным состоянием. Перестройка сольватной оболочки приводит к сближению уровней энергии основного и возбужденного состояний и флуоресценции с длиной волны значительно большей, чем у возбуждающего излучения. При реакции зонда с HOCl нарушается первоначальное распределение электронной плотности сенсора, что служит причиной изменения эффективности процесса ICT. Уменьшение эффективности ICT приводит к сдвигу в синюю область спектра испускания флуоресценции, и наоборот, возрастание эффективности ICT способствует сдвигу в красную область спектра флуоресценции. На основе ICT чаще всего проектируют зонды типа “включения” и “переключения” [27, 28].
ESIPT относится к явлению переноса атомов водорода (в основном от гидроксильных или аминогрупп) от “Ф” к соседним гетероатомам (в основном к N, O или S) при лазерном возбуждении (рис. 2б, 4). ESIPT обычно происходит в молекулах с пяти- или шестичленным кольцом, которые подвергаются процессу таутомеризации, сопровождающемуся эмиссионными изменениями из-за различий в структуре энергетических уровней таутомеров. Стратегия ESIPT может эффективно применяться для конструирования зондов типа “переключения” [27, 30].
Стоит отметить, что использование зондов типа “выключения” зачастую затрудняет регистрацию HOCl ввиду остаточного флуоресцентного сигнала. Зонды типа “включения” и “переключения” обеспечивают лучшее пространственное разрешение, и их применение более предпочтительно. Сенсоры типа “переключения” удобны для визуализации прореагировавшего и непрореагировавшего зонда, что помогает минимизировать ошибки, которые могут возникнуть из-за неоднородности образца или неоднородности распределения зонда [31]. Однако часто наблюдается малый сдвиг длин волн в спектрах испускания или образование двух продуктов реакции с двумя разными длинами волн возбуждения, что затрудняет применение зондов типа “переключения” на практике. Кроме того, они, как правило, имеют громоздкую структуру за счет использования нескольких флуорофоров, что ограничивает их применение [32, 33].
Классификация зондов по типу флуорофора
Выбор подходящих низкомолекулярных флуоресцентных зондов для обнаружения HOCl в биологических исследованиях может основываться на разновидности их “ядра”, т.е. флуорофора. Существует несколько основных типов “ядер”: кумарин, флуоресцеин, родамин, 4,4-дифтор-4-бор-3а,4а-диаза-s-индацен (бор-дипиррометен, BODIPY), 1,8-нафталимид, цианин, триазолин и др. [12, 13, 34]. Таким образом, выбор зонда может быть сделан исходя из хорошо изученных химических и фотофизических свойств флуорофора.
ПРЕДПОСЫЛКИ К РАЗРАБОТКЕ СОВРЕМЕННЫХ ФЛУОРЕСЦЕНТНЫХ ХЕМОСЕНСОРОВ
Первые флуоресцентные зонды для регистрации продукции АФК в клетках, сконструированные по типу “выключения”, были крайне неспецифичными. В дальнейшем целесообразным представлялось конструирование более специфичных хемосенсоров для регистрации HOCl. Параллельно этот процесс сопровождался переходом к синтезу сенсоров типа “включения” и “переключения”. В данном разделе представлен ряд наработок в этой области.
Зонды “включения” и “выключения”
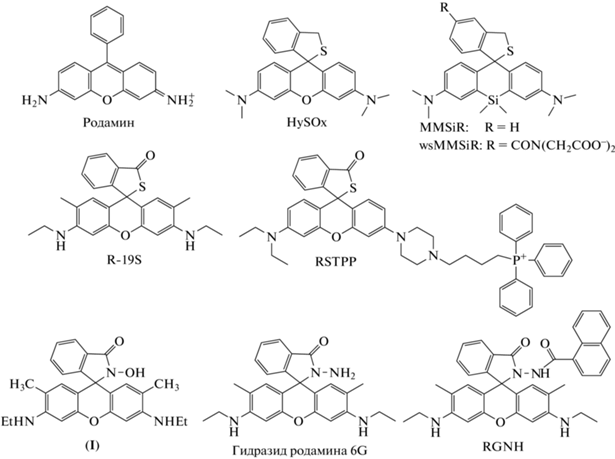
Хемосенсоры на основе родамина. В 2007 г. группа ученых во главе с S. Kenmoku представила HySOx – хемосенсор типа “включения” (λвозб = = 552 нм; λисп = 575 нм), реализованный на основе концепции “S-замка” (рис. 3) [35]. “Включение” флуоресценции наблюдается после окисления сенсора под действием HOCl с разрывом S-содержащего кольца и переходом зонда во флуоресцирующую форму. HySOx – чувствительный и избирательный флуоресцентный зонд для HOCl, кроме того, интенсивность флуоресценции его продукта практически не зависит от рН в диапазоне 6.5–9.0. К недостаткам стоит отнести малый квантовый выход и сильное перекрывание спектров поглощения и испускания [35]. В 2011 г. на основе HySOx синтезирован ряд Si-содержащих аналогов (MMSiR и его более гидрофобное производное wsMMSiR, рис. 3), интенсивность флуоресценции которых возрастает при реакции с HOCl в ближней инфракрасной области спектра (λвозб = = 652 нм; λисп = 770 нм) [36]. HySOx и его модификации были успешно апробированы при визуализации продукции HOCl в фагосомах нейтрофилов, активированных опсонизированным зимозаном [35, 36]. Также с их помощью была выявлена продукция HOCl in vivo в модели перитонита у мышей, который был вызван внутрибрюшинной инъекцией зимозана и форбол-12-миристат-13-ацетата (PMA) [36].
В 2011 г. группой X. Chen et al. был предложен еще один структурный аналог HySOx – R-19S (λвозб = 510 нм; λисп = 545 нм) (рис. 3) [37]. Этот зонд типа “включения” показал хорошую чувствительность и селективность обнаружения HOCl с оптимумом рН ~ 6.0. С помощью данного хемосенсора была выявлена продукция HOCl нейтрофилами человека и мышей методами конфокальной микроскопии и проточной цитометрии, а также продукция HOCl в кишечном эпителии Drosophila melanogaster, индуцируемая при пероральном введении насекомым микробного экстракта [37]. В 2015 г. был представлен зонд RSTPP – еще один структурный аналог HySOx типа “включения” (λвозб = 553 нм; λисп = 580 нм) (рис. 3) [38]. Главная особенность этого зонда – наличие катиона трифенилфосфония, который обеспечивает проникновение RSTPP в митохондрии клеток. Зонд показал высокую чувствительность и селективность, однако интенсивность флуоресценции продукта стабильна в узком диапазоне pH 6–7. Для апробации сенсора были использованы макрофаги линии RAW264.7 (макрофаги мышей, зараженных вирусом лейкемии Абельсона), в норме экспрессирующие MPO на низком уровне [39], однако способные увеличивать экспрессию фермента при действии ряда стимулов, например, интерферона гамма (IFN-γ) [40]. При помощи хемосенсора методом конфокальной микроскопии была показана продукция эндогенной HOCl в митохондриях макрофагов RAW264.7, индуцируемая последовательной инкубацией клеток с липополисахаридами (LPS) и PMA. Также показана продукция HOCl клетками RAW264.7 при их инкубации с Escherichia coli [38].
В 2009 г. группа ученых во главе с Y.K. Yang предложила зонд типа “включения” на основе родамина 6G – соединение (I) (рис. 3) [41]. В исходном состоянии соединение (I) находится в нефлуоресцирующей спироциклической форме. Остаток гидроксамовой кислоты – сайт для HOCl, после реакции с которым происходит хлорирование и элиминирование HCl с образованием открытой формы родамина 19 (R19). Для данного хемосенсора характерно малое время реакции (достижение плато интенсивности флуоресценции происходит за 20 с), большая чувствительность (увеличение интенсивности флуоресценции наблюдалось уже при внесении 25 нМ HOCl) и высокая селективность по отношению к HOCl в сравнении с другими основными АФК и АФА. Однако рабочий диапазон pH оказался несколько сдвинут в щелочную область (pH 7.5–10.0, максимум при pH 9.0). Зонд был использован для визуализации экзогенной HOCl при ее инкубации с клетками рака легкого линии A549 и с эмбрионами аквариумных рыб Danio rerio (семейство карповых) [41].
В 2011 г. Z. Zhang et al. синтезировали гидразид родамина 6G – хемосенсор типа “включения” (рис. 3) [42]. В отличие от соединения (I), в данном хемосенсоре в качестве специфического сайта реакции выступает гидразидный фрагмент, N-хлорирование которого при действии HOCl с последующей элиминацией HCl приводит к высвобождению R19 (λвозб = 500 нм; λисп = 550 нм). К достоинствам этого зонда можно отнести высокую чувствительность (ПО = 60 нМ), а также широкий диапазон линейного отклика (2–400 мкМ HOCl при рН 7.4). Главные недостатки сенсора – значительное увеличение интенсивности флуоресценции в присутствии ионов меди (Cu2+) и сильный сдвиг оптимума рН работы зонда в сторону низких значений pH 2–5, при которых значительно возрастает автофлуоресценция хемосенсора. Гидразид родамина 6G был использован для регистрации образования HOCl методом конфокальной микроскопии в макрофагах линии RAW264.7 при их инкубации с LPS и IFN-γ и последующей активации PMA (система LPS/IFN-γ/ PMA) [42].
В 2015 г. эта же группа ученых предложила нафтоилгидразид родамина 6G (RGNH), сконструированный на основе гидразида родамина 6G с нафтоильным фрагментом в аминоположении последнего (рис. 3) [43]. RGNH также относится к зондам типа “включения”. Взаимодействие RGNH с HOCl приводит к образованию флуоресцентного R19 по механизму, аналогичному для гидразида родамина 6G (λвозб = 500 нм; λисп = 550 нм). Введение нафтоильного фрагмента позволило повысить избирательность и добиться более высокой чувствительности (ПО = 9 нМ) по сравнению с гидразидом родамина 6G, однако рабочий диапазон рН зонда оказался сильно сдвинут в щелочную область (рН 9–12). RGNH был успешно применен для регистрации методами конфокальной микроскопии и проточной цитометрии продукции HOCl клетками линии RAW264.7 при их стимуляции LPS/IFN-γ/PMA [43].
Из упомянутых выше зондов коммерчески доступен только зонд HySOx, известный также как BioTracker 574 Red HOCl Dye (Sigma-Aldrich, США).
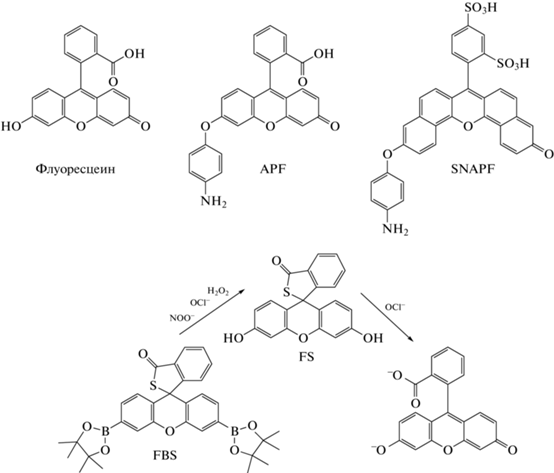
Хемосенсоры на основе флуоресцеина. Аминофенил флуоресцеина (APF) был разработан группой K. Setsukinai в 2003 г. [44]. Присоединение обогащенного электронами фрагмента 4-аминофениларилэфира к молекуле флуоресцеина (рис. 4) приводит к тушению его флуоресценции за счет процесса PET. Показано, что APF при действии •OH, HOCl/HOBr и ONOOˉ, а также в присутствии систем пероксидаза хрена/H2O2 и MPO/H2O2/Clˉ путем О-деарилирования превращается в флуоресцеин, что сопровождается увеличением интенсивности флуоресценции (λвозб = = 490 нм; λисп = 515 нм), т.е. выступает зондом типа “включения”. ПО для •OH, ONOOˉ и HOCl составил 50 нМ [45]. APF используют для регистрации продукции HOCl и HOBr нейтрофилами и эозинофилами методами конфокальной микроскопии [44] и проточной цитометрии [46], а большой квантовый выход и высокая чувствительность позволяют регистрировать продукцию HOCl/HOBr в суспензии лейкоцитов, полученной сразу же после гемолиза эритроцитов цельной крови [46, 47]. Однако для оценки избирательной роли HOCl относительно других АФК, АФГ и АФА в превращение APF в флуоресцеин необходимо использовать разностный подход с применением структурного аналога APF – гидроксифенилфлуоресцеина (HPF), который реагирует с теми же высокореакционными соединениями, что и APF, за исключением HOCl [44].
В 2007 г. J. Shepherd et al. предложили модификацию APF до сульфонафтоаминофенил флуоресцеина (SNAPF), который также представляет собой датчик типа “включения”. Отличительная особенность SNAPF – сдвиг спектров возбуждения и регистрации флуоресценции в ближнюю инфракрасную область (λвозб = 614 нм; λисп = 676 нм) [48]. Данный зонд показал высокую селективность и был использован для регистрации методом флуоресцентной микроскопии продукции HOCl нейтрофилами человека и макрофагами мышей, трансгенных по гену, кодирующему MPO человека, при стимуляции клеток PMA. Кроме того, с применением SNAPF было выявлено присутствие HOCl в образцах артерий человека с атеросклеротическими бляшками, а также in vivo у мышей с перитонитом, индуцированным тиогликолятом [48].
Концепция “двойного замка” была реализована группой Q. Xu в 2013 г. при конструировании зонда типа “включения” FBS [49]. При реакции FBS с H2O2, ONOO− или HOCl образуется слабо флуоресцирующий продукт – FS, который, в свою очередь, избирательно реагирует с HOCl с высвобождением флуоресцеина (λвозб = 498 нм; λисп = 523 нм) (рис. 4). Зонд чувствителен и селективен по отношению к HOCl в диапазоне рН 7–9. FBS не окисляется до флуорофора под действием $^{\centerdot }{\text{O}}_{2}^{ - },$ •NO, •OH, гидропероксидов и пероксильных радикалов. FBS был применен для визуализации продукции НOCl в кишечнике дрозофилы при оральном введении насекомым бактериального экстракта [49].
Из упомянутых зондов на основе флуоресцеина коммерчески доступны только APF и его структурный аналог HPF (Sigma-Aldrich, США).
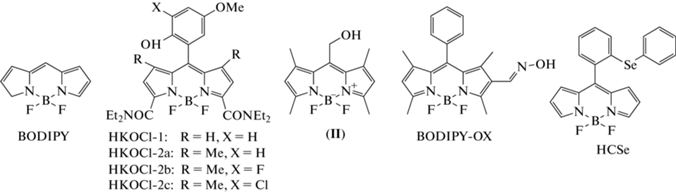
Хемосенсоры на основе BODIPY. В 2008 г. Z.N. Sun et al. сконструировали зонд типа “включения” HKOCl-1 (рис. 5) [50]. Увеличение интенсивности флуоресценции сенсора происходит вследствие окисления 4-метоксифенола до бензохинона в присутствии HOCl, что приводит к потере способности остатка 4-метоксифенола тушить флуоресценцию “ядра” BODIPY по механизму PET (λвозб = 520 нм; λисп = 541 нм). Зонд обладает высокой чувствительностью и избирательностью, широким рабочим диапазоном pH 5–8. HKOCl-1 использовали для регистрации образования HOCl в системе MPO/H2O2/Clˉ, а также в макрофагах линии RAW264.7 при их стимуляции LPS/IFN-γ/PMA [50, 51]. Однако в дальнейшем зонд не получил практического применения ввиду повторного окисления флуоресцирующего продукта с образованием нефлуо-ресцирующего соединения [52].
В 2014 г. J.J. Hu et al. разработали ряд аналогов HKOCl-1 (HKOCl-2a–c) с дополнительной защитой 4-метоксифенола двумя метильными группами (рис. 5) [52]. Среди них HKOCl-2b (λвозб = 523 нм; λисп = 545 нм) показал наиболее высокую селективность и чувствительность (ПО = 18 нМ) в отношении HOCl. Для зондов HKOCl-2a и HKOCl-2b характерно длительное время выхода на плато интенсивности флуоресценции при их реакции с HOCl (до 15 мин), в то время как для HKOCl-2c этот показатель значительно ниже (3 мин). Тем не менее величина флуоресцентного отклика для HKOCl-2c в 3 раза меньше таковой по сравнению с HKOCl-2а и HKOCl-2b. По совокупности параметров HKOCl-2b был выбран как самый перспективный и применен для регистрации методом конфокальной микроскопии продукции HOCl в клетках линии RAW264.7 при их стимуляции PMA или зимозаном. Также с использованием данного зонда впервые была показана продукция HOCl в дифференцированных клетках линии THP-1 (моноциты человека с острым моноцитарным лейкозом, экспрессирующие MPO на низком уровне [53]) при их стимуляции PMA или зимозаном [52].
Зонд типа “выключения” на основе BODIPY с гидроксиметильной группой в мезо-позиции был представлен группой L. Gai в 2013 г. (соединение (II), рис. 5) [54]. “Выключение” флуоресценции зонда (λвозб = 480 нм; λисп = 525 нм) происходит за счет превращения гидроксиметильной группы в формильную в результате реакции окисления в присутствии HOCl. Сенсор продемонстрировал хорошую избирательность в отношении HOCl по сравнению с •OH, $^{\centerdot }{\text{O}}_{2}^{ - },$ H2O2, •NO. Данный зонд был протестирован на клеточной линии аденокарциномы протоков молочной железы человека MCF-7 при экзогенном введении HOCl в культуральную среду [54].
В 2013 г. M. Emrullahoglu et al. предложили зонд типа “включения” на основе “ядра” BODIPY с внедренной группой альдоксима (BODIPY-OX) (рис. 5) [55]. При действии HOCl образуется флуоресцирующий нитрилоксид BODIPY-CNO (λвозб = 470 нм; λисп = 529 нм). Зонд показал высокую чувствительность (ПО = 500 нМ) и селективность, но интенсивность флуоресценции BODIPY-CNO сильно зависит от рН (оптимум при рН 8.0). В дальнейшем было показано, что BODIPY-CNO нестабилен и разлагается на компоненты, которые не удалось идентифицировать, что сделало невозможным применение зонда для регистрации образования HOCl в клеточной среде [55].
В этом же году S. Liu совместно с S. Wu представили селен-содержащий зонд типа “включения” HCSe (рис. 5). Изначально флуоресценция HCSe блокируется за счет процесса PET. После окисления HCSe при действии HOCl образуется оксид селена (HCSeО), в котором PET заблокирован, что приводит к увеличению интенсивности флуоресценции (λвозб = 510 нм; λисп = 526 нм). Зонд характеризуется высокой чувствительностью и селективностью, быстрым ответом, оптимум работы сенсора лежит в диапазоне pH 6–8. HCSe был использован для регистрации образования HOCl в клетках линии RAW264.7, стимулированных PMA [56].
Из вышеперечисленных зондов в настоящий момент производится и доступен к приобретению только HKOCl-1 (Molbase (Shanghai) Biotechnology Co. Ltd, Китай).
Переход к концепции зондов “переключения”
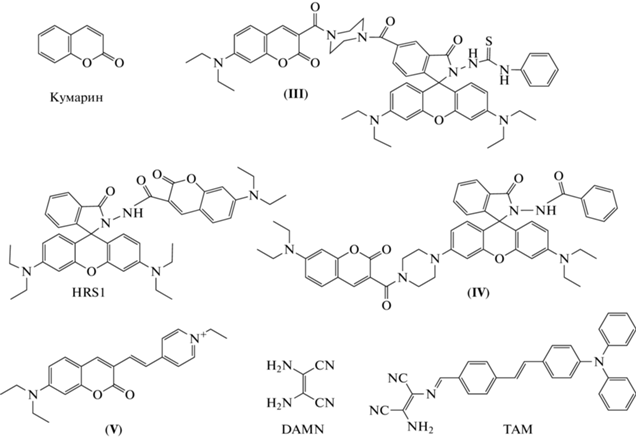
В 2009 г. группой W. Lin впервые для регистрации HOCl был предложен зонд типа “переключения”. В основе функционирования данного сенсора лежит превращение оксима в альдегид под действием HOCl. Однако оптимум работы зонда находится в щелочной области (pH > 9), из-за чего зонд непригоден для регистрации продукции HOCl в клеточных системах [21]. В 2012 г. эта же группа ученых в качестве основы для зондов “переключения” предложила стратегию циклизации родамин-тиосемикарбазидов до родамин-оксадиазолов при действии HOCl [31]. Так был создан родамин-кумариновый сенсор (соединение (III), рис. 6), в котором “переключение” интенсивности флуоресценции с кумаринового (λвозб = 414 нм; λисп = 473 нм) на родаминовый (λвозб = 414 нм; λисп = 594 нм) каналы осуществляется за счет FRET (λвозб = 414 нм; λисп = 594/473 нм). Зонд показал высокую избирательность и чувствительность к HOCl (ПО = 52 нМ), быстрый выход интенсивности флуоресценции на плато (в течение 3 мин). При этом изменение флуоресценции зонда сильно зависит от pH (оптимум работы при рН 6.0). Этот родамин-кумариновый сенсор был успешно применен для регистрации продукции HOCl клетками линии RAW264.7 при их стимуляции LPS/PMA [31].
В 2013 г. группой L. Long был предложен зонд HRS1 [57]. Он содержит флуорофоры на основе кумарина и родамина, связанные между собой диацилгидразином, выступающим сайтом реакции с HOCl. HRS1 характеризуется флуоресценцией в области спектра, характерной для кумарина (λвозб = 410 нм; λисп = 501 нм). После реакции HRS1 с HOCl происходит высвобождение как кумаринового, так и родаминового фрагментов. Таким образом, сенсор можно рассматривать как зонд типа “переключения” по кумарину (λвозб = = 410 нм; λисп = 464/501 нм), так и “включения” по родамину (λвозб = 554 нм; λисп = 578 нм). Зонд показал высокую селективность и чувствительность к HOCl (ПО = 24 нМ) в бесклеточной среде, быстрый выход на плато интенсивности флуоресценции (в течение 1 мин). Тем не менее HRS1 не получил дальнейшего применения из-за необходимости учитывать присутствие обоих флуорофоров с разными каналами возбуждения флуоресценции [57].
Y. Zhang et al. в 2014 г. предложили еще один родамин-кумариновый зонд типа “переключения” (соединение (IV), рис. 6). Как и у HRS1, диацилгидразин выступает в качестве сайта реакции с HOCl. Процесс “переключения” происходит по механизму FRET (λвозб = 410 нм; λисп = 580/470 нм). Сенсор характеризуется избирательностью в отношении HOCl, а также быстрым ответом, однако в качестве недостатков необходимо отметить высокий ПО HOCl (170 мкМ) и сильную зависимость интенсивности флуоресценции от pH (оптимум при pH 9.3). Помимо этого, продукт реакции зонда с HOCl (кумарин-родаминовая кислота) подвергается хлорированию с последующей циклизацией при действии HOCl, что приводит к блокировке FRET и увеличению флуоресценции в канале регистрации кумарина. Хемосенсор был применен для регистрации продукции HOCl клетками линии RAW264.7 при их стимуляции LPS [58].
Группа во главе с L. Wang в 2014 г. синтезировала зонд “переключения” на основе кумарина (соединение (V), рис. 6) [59]. В качестве сайта распознавания в этом сенсоре впервые был использован N-алкилпиридиний, который окисляется под действием HOCl до N-алкилпиридона. При этом происходит блокировка процесса ICT, что сопровождается сдвигом длин волн в спектре испускания (λвозб = 420 нм; λисп = 488/631 нм) в синюю область. Зонд характеризуется высокой селективностью, сравнительно высокой чувствительностью к HOCl (ПО = 93 нМ) и малым временем реакции, однако интенсивность флуоресценции сильно зависит от pH (оптимум при рН 7.5–11.0). Зонд был использован для определения концентрации HOCl в образцах воды рек, а также для регистрации продукции HOCl в клетках линии RAW264.7 при их активации PMA.
В 2015 г. S. Goswami et al. предложили зонд TAM на основе трифениламина в качестве сенсора типа “переключения” для обнаружения HOCl (рис. 6) [60]. Диаминомалеонитрил (DAMN, рис. 6) связан с основой зонда через иминогруппу, которая служит сайтом реакции с HOCl. После окисления TAM под действием HOCl происходит отщепление фрагмента DAMN, что сопровождается сдвигом в спектре испускания флуоресценции зонда (λвозб = 430 нм; λисп = 485/630 нм) в синюю область. Для зонда характерна высокая чувствительность (ПО = 70 нМ), селективность и малое время реакции с HOCl (выход на плато за 100 с), большой квантовый выход (0.86) и широкий рабочий диапазон рН (2.0–10.5). Однако данный сенсор характеризуется сильным сольватохромизмом (сдвигом спектров испускания флуоресценции в зависимости от полярности растворителя). TAM был использован для регистрации методом конфокальной микроскопии экзогенной HOCl в мононуклеарных клетках периферической крови человека [60].
Ни один из упомянутых зондов типа “переключения” не доступен для приобретения.
ПОСЛЕДНИЕ ДОСТИЖЕНИЯ В РАЗРАБОТКЕ МАЛЫХ МОЛЕКУЛЯРНЫХ ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ ДЛЯ РЕГИСТРАЦИИ HOCl
В последние годы идет активная работа по конструированию малых молекулярных зондов для регистрации HOCl на основе известных флуорофоров с различными модификациями для достижения заданных свойств. Так, особый интерес представляют зонды не только с высокой селективностью и чувствительностью, но и с быстрым ответом для возможности исследования образования HOCl кинетически. Также усилия ученых сосредоточены на возможности двухфотонного возбуждения зондов и/или регистрации их флуоресценции в ближнем инфракрасном диапазоне. Большой толчок в развитии получили сенсоры типа “переключения”.
Зонды на основе кумарина
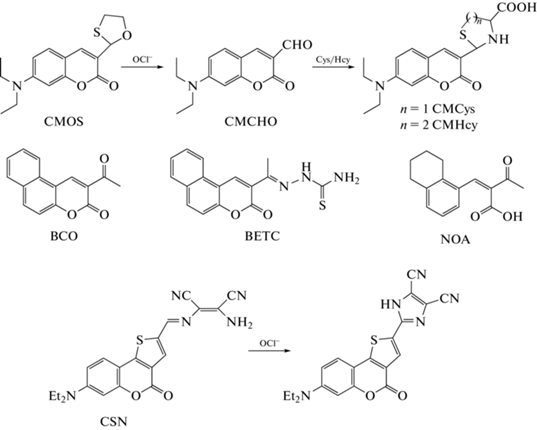
В начале 2018 г. группа ученых во главе с Z. Liu предложила зонд типа “выключения” CMOS на основе кумарина (рис. 7) [61]. 1,3-Оксотиолан служит в качестве сайта реакции с HOCl. “Выключение” интенсивности флуоресценции (λвозб = 405 нм; λисп = 480 нм) происходит вследствие образования нефлуоресцирующего продукта окисления CMOS под действием HOCl – CMCHO. Также показано, что в присутствии цистеина или гомоцистеина (Cys/Hcy) CMCHO подвергается тиоацеталированию с образованием CMCys или CMHcy (рис. 7), что сопровождается медленным увеличением интенсивности флуоресценции на длине волны, характерной для CMOS. Таким образом, данный зонд – пример перехода типа “включение”–“выключение”–“включение”. CMOS характеризуется быстрым откликом (5 с), высокой чувствительностью (ПО = 21 нM) и селективностью, оптимум работы зонда наблюдается в диапазоне pH 4.0–6.5. Зонд был использован для визуализации экзогенной HOCl в клетках рака яичников (SKVO-3). Методом конфокальной микроскопии было показано уменьшение интенсивности флуоресценции CMOS в клетках SKVO-3 при внесении HOCl, а также восстановление интенсивности флуоресценции в присутствии Cys/Hcy. Исходя из полученных данных, авторами был сделан вывод о возможности использования CMOS для изучения процессов окисления и восстановления тиолов в биологических системах [61].
В 2019 г. L. Jin et al. предложили сразу два хемосенсора типа “переключения” и “включения” с “ядром” кумарина – BCO и BETC соответственно (рис. 7) [62]. В основе механизма “переключения” BCO (λвозб = 372 нм; λисп = 430/460 нм) и “включения” BETC (λвозб = 350 нм; λисп = 440 нм) лежит окисление связей C=O (в случае BCO), C=O и C=N (в случае BETC) при действии HOCl с образованием общего конечного продукта (NOA, рис. 7). Оба зонда показали высокую чувствительность (ПО = 154 нМ для BCO и 32 нМ для BETC) и избирательность к HOCl. Однако BCO обладает малым сдвигом длин волн испускания флуоресценции, что затрудняет его применение. Хемосенсоры были использованы для визуализации экзогенной HOCl в клетках гепатоцеллюлярной карциномы человека (HepG2) методом конфокальной микроскопии [62].
В начале 2020 г. группа L. Shi представила зонд типа “переключения” на основе кумарина – CSN, в котором DAMN был выбран в качестве сайта реакции с HOCl [63]. “Переключение” зонда (λвозб = 413 нм; λисп = 470/640 нм) происходит благодаря реакциям окисления и циклизации DAMN в присутствии HOCl. Зонд характеризуется большим синим сдвигом, высокой чувствительностью (ПО = 94 нМ) и селективностью к HOCl, оптимум интенсивности флуоресценции зонда наблюдался в диапазоне pH 6.6–8.6. Недостаток CSN – слабая фотостабильность (значительное изменение флуоресцентных характеристик CSN наблюдалось спустя 30 мин после начала облучения зонда ксеноновой лампой). Несмотря на это, было показано постепенное усиление интенсивности флуоресценции зонда в синем канале регистрации по отношению к красному каналу в клетках HeLa (клетки раковой опухоли шейки матки) после инкубации с HOCl. Хемосенсор также был успешно применен для регистрации продукции HOCl клетками RAW264.7 при их стимуляции LPS методом конфокальной микроскопии [63].
Ни один из указанных в данном подразделе зондов на основе кумарина не доступен для приобретения.
Зонды на основе флуоресцеина
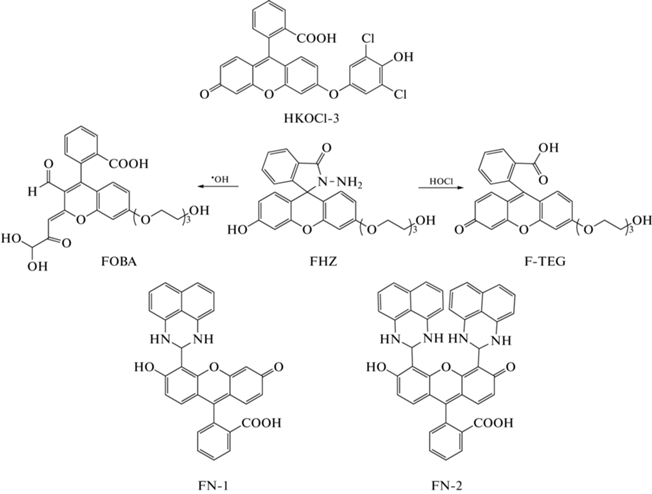
В 2016 г. J. Hu et al. предложили модификацию зонда HPF с внедрением в него двух атомов хлора в орто-положении (2,6-дихлорфенольный фрагмент) – HKOCl-3 (рис. 8) [64]. PET обеспечивает низкий фоновый уровень флуоресценции HKOCl-3. “Включение” датчика происходит за счет реакции окислительного O-деарилирования 2,6-дихлорфенола (λвозб = 490 нм; λисп = 527 нм). HKOCl-3 обладает крайне высокой чувствительностью (ПО = 0.33 нМ), селективностью и быстрым ответом на HOCl; его недостаток – сильная зависимость интенсивности флуоресценции продукта от pH среды (оптимум достигается в узком диапазоне pH 7.0–7.5). Хемосенсор был использован для регистрации методом конфокальной микроскопии продукции HOCl в клетках линий RAW264.7 и THP-1, нейтрофилах человека, а также в клетках микроглии мышей (BV-2, экспрессирующих MPO при воздействии ряда стимулов [65, 66]) при стимуляции PMA. Помимо этого, HKOCl-3 подходит для регистрации продукции эндогенной HOCl методом проточной цитометрии и при помощи спектрофлуориметра. Данный зонд эффективен также во флуоресцентной микроскопии при регистрации продукции эндогенной HOCl in vivo в живых интактных эмбрионах аквариумных рыб Danio rerio на разных стадиях их развития [64].
В 2016 г. группа R. Zhang представила хемосенсор типа “включения” FHZ на основе флуоресцеина (рис. 8) [67]. Зонд имеет два сайта реакции: для •OH и для HOCl. В присутствии только •OH происходит гидроксилирование одного из шестичленных ароматических колец с последующим его разрывом, а также разрыв пятичленного кольца FHZ с образованием конечного продукта FOBA (рис. 8). В присутствии только HOCl реакция идет без разрыва шестичленного ароматического кольца с образованием продукта F-TEG (рис. 8). Ввиду спектральных различий образующихся продуктов возможна одновременная регистрация увеличения интенсивности флуоресценции при действии •OH и HOCl в разных каналах: в синем (λвозб = 410 нм; λисп = 486 нм) для •OH и в зеленом (λвозб = 490 нм; λисп = 520 нм) для HOCl. FHZ в течение 2–3 мин реагирует с присутствующими одновременно •OH и HOCl с увеличением интенсивности флуоресценции в 19 раз в синем канале и в 35 раз – в зеленом канале. В случае с HOCl показано, что “включение” флуоресценции происходит за счет блокирования процесса PET [67, 68]. FHZ избирателен в отношении •OH и HOCl и был протестирован на клетках HeLa при экзогенном внесении окислителей и на клетках RAW264.7 при их активации PMA. Показано, что FHZ распределяется как в цитоплазме, так и в митохондриях клеток. Продемонстрирована высокая биосовместимость зонда. Так, на живых эмбрионах аквариумных рыб Danio rerio было показано избирательное накопление спонтанно образующихся •OH и HOCl в органах (кишечник, печень, пронефрос) с течением времени [67].
В 2019 г. группа J. Lv представила два зонда типа “включения” на основе флуоресцеина – FN-1 и FN-2 (рис. 8) [69]. Оба зонда были получены путем конденсации аминогрупп 1,8-диаминонафталина с альдегидными группами моно- (в случае FN-1) или бис- (в случае FN-2) альдегида флуоресцеина. Азот полученной при этом иминогруппы (–NH–) выступает мишенью для HOCl. При реакции зондов с HOCl образуются моно- и бисальдегид флуоресцеина (для FN-1 и FN-2 соответственно). Реакция сопровождается “включением” флуоресценции флуоресцеина (λвозб = 490 нм; λисп = 529 нм) за счет блокировки PET. Квантовый выход флуоресценции продуктов реакции зондов с HOCl в 3–4 раза ниже, чем у флуоресцеина. FN-1 по сравнению с FN-2 обладает большим фоновым уровнем флуоресценции и меньшей скоростью реакции с HOCl. Оптимальный диапазон работы достигается при pH 7–10 для FN-1 и рН 6–10 для FN-2. Оба сенсора более специфичны, но менее чувствительны по отношению к HOCl по сравнению с APF (ПО = 210 и 230 нМ для FN-1 и FN-2 соответственно). FN-1 и FN-2 были использованы для регистрации продукции HOCl при экзогенном внесении H2O2 к клеткам HeLa, предварительно проинкубированными с NaCl и MPO [69].
Из указанных в данном подразделе зондов на основе флуоресцеина доступны к приобретению зонды HKOCl-3 (MedChemExpress, США) и FHZ (Sigma-Aldrich, США).
Зонды на основе феноксазина
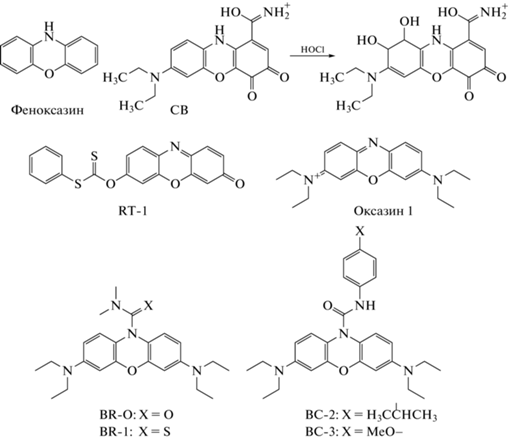
В 2016 г. краситель феноксазинового ряда – целестиновый синий В (CB) – был предложен в качестве зонда типа “включения” для регистрации продукции HOCl (рис. 9) [70]. Фоновая флуоресценция CB в видимой области спектра практически не наблюдается, реакция с HOCl приводит к образованию гликоля CB (рис. 9) [71]. Реакция CB с HOCl сопровождается увеличением интенсивность флуоресценции в оранжевой области спектра (λвозб = 460 нм; λисп = 590 нм). Зонд характеризуется избирательностью в отношении HOCl, HOBr, а также галогенированных производных таурина и белков. Хемосенсор обладает высокой чувствительностью к HOCl (ПО = 32 нМ), фотостабильностью, высокой скоростью реакции (плато интенсивности флуоресценции достигается в течение 30 с) и большим стоксовым сдвигом. Существенное увеличение интенсивности флуоресценции (в ~100 раз) наблюдается в диапазоне рН 7.0–7.5, а фоновый уровень флуоресценции низок и практически не изменяется в диапазоне рН 2.2–8.0. С использованием CB методами проточной цитометрии и конфокальной микроскопии показана продукция HOCl нейтрофилами человека при их стимуляции PMA [70]. Помимо этого, CB может использоваться для кинетического анализа продукции HOCl в суспензиях нейтрофилов, активированных PMA, хемотаксическим пептидом N-формилметионил-лейцил-фенилаланином и растительными лектинами с различной углеводной специфичностью (в присутствии цитохалазина B). Хемосенсор был успешно опробован при исследовании влияния лекарственных препаратов на продукцию HOCl нейтрофилами человека [70–72].
В 2019 г. M.G. Choi et al. представили зонд типа “включения” RT-1 на основе карбонодитиоатного производного резоруфина (рис. 9) [73]. Гидролиз карбонодитиоатного фрагмента при действии HOCl приводит к высвобождению флуоресцирующего резоруфина (λвозб = 550 нм; λисп = 587 нм). Зонд показал высокую чувствительность (ПО = = 2.18 нМ), избирательность к HOCl, однако относительно невысокую скорость реакции с HOCl (интенсивность флуоресценции достигала плато в течение 3 мин). К недостаткам зонда следует отнести падение интенсивности флуоресценции резоруфина в присутствии ионов брома и иода, а также сильную зависимость отношения интенсивности флуоресценции резоруфина к интенсивности флуоресценции RT-1 от значения pH среды (оптимум при pH 8.0). RT-1 был использован для визуализация экзогенной HOCl в клетках линий RAW264.7 и HeLa [73].
В 2020 г. группа J. Yang представила два зонда типа “включения” BR-O [74] и BR-1 [75], имеющих N,N-диметилкарбонильный и N,N-диметилтиокарбонильный остатки в качестве сайтов реакции с HOCl соответственно (рис. 9). Оба хемосенсора окисляются HOCl с высвобождением нестабильной восстановленной формы бис-диметиламинофеноксазина, который быстро гидролизуется и окисляется до конечного флуорофора – оксазина 1 (λвозб = 610 нм; λисп = 670 нм). Оба зонда показали избирательность в отношении HOCl по сравнению с АФК и АФА, достаточно быстрый ответ (плато интенсивности флуоресценции достигается за 7 и 2.5 мин для BR-O и BR-1 соответственно), стабильность флуоресцентного сигнала в диапазоне pH 5–8, а также высокую чувствительность (ПО = 19 и 11 нМ для BR-O и BR-1 соответственно). Недостаток этих сенсоров – сильное перекрывание спектров поглощения и испускания (стоксов сдвиг составил 20 нм для обоих зондов). BR-O и BR-1 показали увеличение интенсивности флуоресценции при внесении экзогенной HOCl в культуру клеток RAW264.7. Кроме того, с помощью данных зондов выявлено спонтанное образование HOCl в клетках острой промиелоцитарной лейкемии человека (линия HL-60, экспрессирующая MPO на высоком уровне [53]) и подавление этого процесса в присутствии ингибитора MPO – гидразида 4-аминобензойной кислоты [74, 75]. BR-1 был использован для регистрации образования HOCl в модели артрита коленного сустава мышей [75], индуцированного инъекцией мукополисахарида λ-каррагинана – известного индуктора артрита у крыс [76].
В этом же году группа ученых во главе с W. Zheng представила две модификации зонда BR-O: BC-2 и BC-3 (рис. 9) [77]. Мишень для HOCl в этих сенсорах – атом углерода амидной группы. Как и в случае BR-O и BR-1, взаимодействие BC-2 и BC-3 с HOCl приводит к разрыву амидной связи с высвобождением восстановленного бис-диметиламинофеноксазина, который затем быстро переходит в окисленную форму, что сопровождается увеличением интенсивности флуоресценции оксазина 1 (λвозб = 620 нм; λисп = = 669 нм). BC-2 и BC-3 чувствительны (ПО = 20 и 11 нМ соответственно) и селективны в отношении HOCl по сравнению с АФК и АФА. При этом увеличение интенсивности флуоресценции в 3 раза больше в случае взаимодействия HOCl с BC-3 в сравнении с BC-2. Существенное улучшение данных модификаций по сравнению с зондами BR-O и BR-1 – уменьшение времени достижения плато интенсивности флуоресценции после добавления HOCl (30–50 с). BC-3 был использован для регистрации спонтанной продукции HOCl в клетках линии HL-60, а также в модели артрита у мышей при инъекции λ-каррагинана [77].
Из указанных зондов на основе феноксазина коммерчески доступен только зонд CB (Sigma-Aldrich, США; Thermo Fisher Scientific, США).
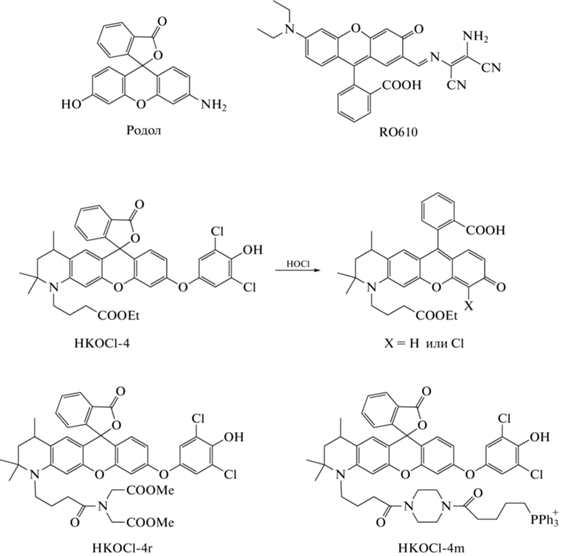
Зонды на основе родола
Родол – гибридный флуорофор на основе флуоресцеина и родамина (рис. 10) – и его производные (родафлуоры) также используются в качестве флуоресцентных зондов для регистрации HOCl. В 2018 г. группа Y. Zhang представила зонд типа “включения” RO610 на основе родола [78]. DAMN был выбран в качестве сайта реакции. При действии HOCl происходит отщепление остатка DAMN, что сопровождается “включением” флуоресценции родола (λвозб = 535 нм; λисп = = 577 нм). RO610 обладает высокой чувствительностью (ПО = 29 нМ), селективностью по отношению к HOCl в сравнении с АФК и АФА, быстрым выходом кинетической кривой изменения интенсивности флуоресценции на плато (в течение 30 с). Однако хемосенсор имеет небольшой рабочий диапазон pH (7.0–8.5). RO610 был апробирован для визуализации экзогенной HOCl на клетках линии A549, а также при внутрибрюшинной инъекции HOCl мышам. Помимо этого, была показана возможность регистрации образования эндогенной HOCl in vivo в модели перитонита у мышей как при введении им зимозана, так и в норме без дополнительной стимуляции [78].
В 2020 г. X. Bai et al. на основе родола представили зонд типа “включения” HKOCl-4 и его производные – HKOCl-4r и HKOCl-4m (рис. 10) [79]. Во всех трех зондах остаток 2,6-дихлорфенола был использован в качестве сайта для реакции с HOCl. Превращение сенсоров во флуоресцирующую форму происходит за счет реакции О-деарилирования (λвозб = 530 нм; λисп = 557 нм). HKOCl-4 крайне чувствителен (ПО = 9 нM) и селективен в отношении HOCl. Увеличение интенсивности флуоресценции происходит быстро (плато достигается в течение 30 с), однако наблюдается сильная зависимость интенсивности флуоресценции от pH (максимум при pH 8.0). HKOCl-4r и HKOCl-4m были разработаны с целью улучшения проникновения зонда в клетки и регистрации продукции HOCl в митохондриях. Так, в HKOCl-4r введена группа сложного диметилового эфира, которая может гидролизоваться эстеразами клеток, а в HKOCl-4m введен катионный митохондриально-нацеленный фрагмент на основе трифенилфосфония (рис. 10). Методом конфокальной микроскопии с использованием HKOCl-4r было показано образование HOCl в клетках линии RAW264.7 при их стимуляции PMA, а также LPS/IFN-γ, помимо этого показано присутствие HOCl в тканях мозга крыс с ишемическим повреждением. Методами конфокальной микроскопии и проточной цитометрии с помощью HKOCl-4m была визуализирована HOCl в митохондриях клеток линии RAW264.7 при их стимуляции PMA или LPS/IFN-γ [79].
Из указанных зондов на основе родола доступны к приобретению зонды HKOCl-4 и HKOCl-4m.
Зонды на основе 1,8-нафталимида
Несмотря на то, что 1,8-нафталимид и ранее использовался для конструирования зондов для HOCl, в последние годы его популярность возросла. В 2017 г. группа во главе с J. Li синтезировала зонд типа “включения” на основе 1,8-нафталимида – соединение (VI) (рис. 11) [80]. HOCl окисляет гидроксильную группу данного зонда до карбонильной, что сопровождается увеличением интенсивности флуоресценции (λвозб = 414 нм; λисп = 523 нм). Хемосенсор характеризуется относительно низкой чувствительность (ПО = 2.66 мкМ), большим диапазоном линейной зависимости интенсивности флуоресценции от концентрации HOCl (0.1–1.0 мМ), стабильностью в физиологическом диапазоне pH, хорошей селективностью и высокой скоростью реакции с HOCl (плато изменения интенсивности флуоресценции достигается в течение 3 с). Соединение (VI) было использовано для визуализации экзогенной HOCl в клетках линии A549 с помощью конфокальной микроскопии [80].
В этом же году C. Liu et al. представили лизосомо-нацеленный хемосенсор типа “включения” PT-1 (рис. 11) [81]. 1,8-Нафталимид выступает в качестве флуорофора, фенотиазиновый фрагмент – в качестве донора электронов, а морфолиновый фрагмент – в качестве лизосомо-нацеленной группы. В результате реакции HOCl с атомом серы в фенотиазиновом фрагменте происходит блокировка процесса PET, что способствует увеличению интенсивности флуоресценции зонда (λвозб = 460 нм; λисп = 535 нм). Зонд обладает высокими значениями таких параметров, как селективность, чувствительность (ПО = 0.88 нM) и квантовый выход (0.57), а также быстрым откликом (плато изменения интенсивности флуоресценции достигается в течение 10 с), рабочий диапазон pH соответствует кислой области, что необходимо для регистрации HOCl в лизосомах (pH 2–6). PT-1 был апробирован при регистрации экзогенной HOCl в клетках линии L929 (линия клеток подкожной соединительной ткани мышей), а также эндогенной HOCl в клетках линии RAW264.7 при стимуляции LPS/PMA [81].
В начале 2020 г. C. Jiao et al. представили хемосенсор типа “включения” NDS для регистрации HOCl (рис. 11) [82]. В NDS нафталимид выступает в качестве флуорофора, диметилтиокарбамат – в качестве сайта реакции с HOCl, а морфолиновый фрагмент обеспечивает проникновение зонда в лизосомы. Предполагается, что HOCl реагирует с атомом серы сенсора с последующим гидролизом целевой группы. “Включение” интенсивности флуоресценции зонда (λвозб = 420 нм; λисп = = 525 нм) происходит благодаря процессу ICT. NDS обладает высокой чувствительностью (ПО = = 105 нМ), селективностью и скоростью реакции с HOCl: плато изменения интенсивности флуоресценции достигается в течение 16 с при реакции NDS с HOCl в растворе и в течение 300 с при реакции с HOCl, образующейся в системе MPO/H2O2/Cl−. NDS был использован для регистрации образования HOCl в лизосомах клеток HeLa при их стимуляции LPS/PMA [82].
В этом же году другая группа ученых во главе с T. Yang разработала зонд типа “включения” ER-NPA для регистрации HOCl в эндоплазматическом ретикулуме (рис. 11) [83]. В качестве флуорофора был использован нафталимид, в качестве сайта реакции с HOCl – п-аминофениловый эфир, а в качестве целевой группы для эндоплазматического ретикулума – метилсульфонамид. Предполагается, что в ER-NPA PET обеспечивает гашение флуоресценции нафталимида, а в присутствии HOCl окисление и гидролиз эфирной связи в ER-NPA приводит к отщеплению остатка аминофенила и образованию гидроксильного аниона, что способствует процессу ICT и “включению” флуоресценции (λвозб = 450 нм; λисп = 550 нм). Зонд показал высокую чувствительность (ПО = 6.2 нМ) и селективность, а также стабильность и высокий уровень интенсивности флуоресценции при действии HOCl в диапазоне pH 2–10. При реакции с HOCl плато изменения интенсивности флуоресценции достигается в течение 60 с. ER-NPA был использован для регистрации экзо- и эндогенной HOCl (при стимуляции LPS/PMA, а также туникамицином) в клетках HeLa методом конфокальной микроскопии в режиме двухфотонного возбуждения (λвозб = 800 нм; λисп = 550 нм). Данный зонд показал эффективность также в случае регистрации экзо- и эндогенной HOCl (при стимуляции LPS/PMA) in vivo в эмбрионах аквариумных рыб Danio rerio [83].
В начале 2021 г. J. Xu et al. представили митохондриально-нацеленный зонд типа “включения” – соединение (VII) [84]. Остаток нафталимида использован в качестве флуорофора, (2‑аминоэтил)-тиомочевина – в качестве сайта реакции, а кватернизованный пиридиновый фрагмент – в качестве митохондриально-нацеленной группы. При взаимодействии с HOCl происходит внутримолекулярная циклизация тиомочевинной группы зонда, что сопровождается увеличением интенсивности флуоресценции (λвозб = 370 нм; λисп = 488 нм). Зонд характеризуется избирательностью к HOCl по сравнению с другими активными формами, относительно высокой чувствительностью (ПО = 230 нМ), большим рабочим диапазоном pH (pH 2–9), интенсивность флуоресценции достигает плато в течение 60 с. Хемосенсор был использован при визуализации экзогенной HOCl в митохондриях клеток линии PC-12 (клетки феохромоцитомы крысы), а также для регистрации образования эндогенной HOCl в клетках линии RAW264.7 при их стимуляции PMA [84].
Ни один из указанных в данном подразделе зондов не доступен для приобретения.
Иные малые молекулярные зонды
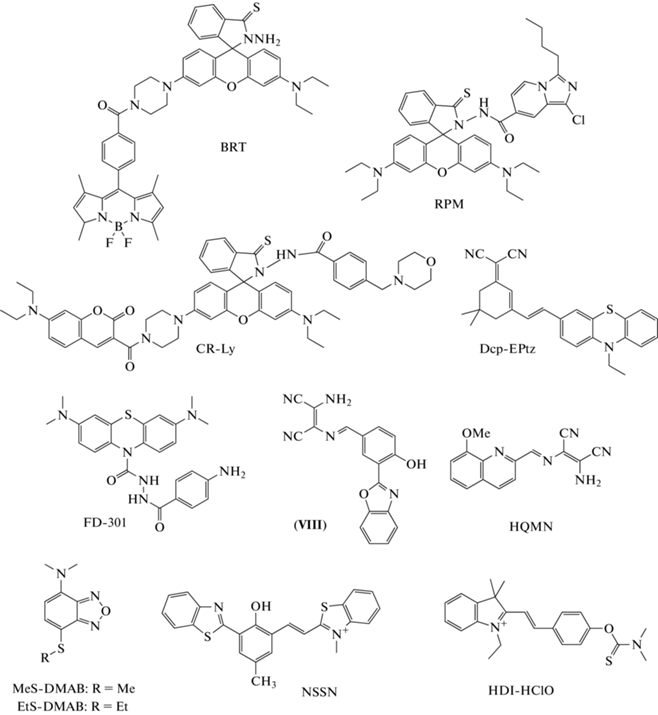
В 2016 г. группа ученых во главе с Y. Liu представила гибридный зонд “переключения” на основе “ядер” BODIPY и родамина – BRT (рис. 12) [85]. В отличие от предшественников, например, HRS1 и соединения (IV) (рис. 6), атом кислорода в родаминовом кольце заменен на атом серы. При действии HOCl тиогидразид родамина переходит в открытую форму, что сопровождается переносом энергии по механизму FRET от BODIPY к родамину (λвозб = 525 нм; λисп = 580/540 нм). Зонд показал высокую чувствительность (ПО = 38 нM), селективность, а также скорость реакции (выход кинетической кривой изменения интенсивности флуоресценции на плато достигался в течение 15 с) в отношении HOCl по сравнению с другими окислителями. Однако “переключение” интенсивности флуоресценции зонда сильно зависит от pH (оптимум при pH 4.0–5.5). BRT был использован для регистрации методом конфокальной микроскопии продукции HOCl клетками линии RAW264.7 при их активации LPS [85].
В 2018 г. группа во главе с G.J. Song синтезировала новый зонд типа “переключения” RPM (рис. 12) [86]. В структуре хемосенсора в качестве донора энергии использован имидазо[1,5-a]пиридин, акцептора – модифицированный остаток родамина. Зонд обладает собственной флуоресценцией, характерной для имидазо[1,5-a]пиридина (λвозб = 400 нм; λисп = 462 нм). При реакции с HOCl карбонильная группа в имидазо[1,5-a]пиридине преобразуется в оксадиазол, что ослабляет его способность принимать электроны. С другой стороны, происходит открытие кольца родаминового фрагмента, что в итоге приводит к увеличению интенсивности флуоресценции в оранжевой области спектра при сохранении флуоресценции в синей области (λвозб = 400 нм; λисп = = 587/462 нм). Авторы полагают, что подобный эффект обусловлен комбинацией ICT и TBET. RPM обладает высокой избирательностью по отношению к HOCl, быстрым ответом (плато изменения интенсивности флуоресценции достигается в течение 30 с), большим рабочим диапазоном pH (5.5–8.0), в пределах которого эффективность “переключения” максимальна и постоянна. Недостаток сенсора – сравнительно малая чувствительность (ПО = 2.08 мкМ). RPM был использован для визуализации методом конфокальной микроскопии образования HOCl клетками линии RAW264.7 при их стимуляции LPS [86].
Используя вышеописанный подход, H. Meng et al. в 2019 г. сконструировали ратиометрический зонд CR-Ly (рис. 12) [87]. “Ядра” кумарина и родамина были выбраны, соответственно, в качестве донора и акцептора энергии, а морфолиновый фрагмент – в качестве лизосомо-нацеленной группы. Механизм “переключения” CR-Ly и соединения (IV), описанного в подразделе о переходе к концепции зондов “переключения” (рис. 6), аналогичны. Диацилгидразин выступает в качестве сайта реакции с HOCl, после взаимодействия с которым родаминовый фрагмент претерпевает превращение из спироциклической формы в форму с раскрытым кольцом. При этом разблокировка процесса FRET приводит к “переключению” флуоресценции с кумарина на родамин (λвозб = 420 нм; λисп = 582/479 нм). CR-Ly характеризуется крайне высокой чувствительностью (ПО = 12 нM) и селективностью по отношению к HOCl, относительно малым временем реакции (плато изменения интенсивности флуоресценции достигается в течение 50 с). Соотношение изменения интенсивности флуоресценции максимально и слабо зависит от рН в слабокислой области (pH 4–6), что соответствует целям разработки зонда для применения в лизосомах. Возможность визуализации продукции HOCl в лизосомах была показана на клетках линии RAW264.7 при их стимуляции LPS/PMA [87].
В 2018 г. D. Zheng et al. представили зонд типа “включения” Dcp-EPtz на основе фенотиазин-дицианоизофорона (рис. 12) [88]. Окисление атома серы при действии HOCl приводит к образованию альдегида в качестве продукта реакции, который характеризуется интенсивностью флуоресценции в красной области (λвозб = 475 нм; λисп = 618 нм) и большим стоксовым сдвигом (>143 нм). Dcp-EPtz обладает высокой селективностью в отношении HOCl по сравнению с другими окислителями, широким рабочим диапазоном pH 5–8. Однако вследствие образования интермедиатов радикальной природы интенсивность флуоресценции продукта реакции нестабильна в течение первых 300 с после начала реакции. Dcp-EPtz был использован для регистрации методом конфокальной микроскопии экзогенной HOCl в клетках линии L929 и продукции эндогенной HOCl в клетках линии RAW264.7 при их активации LPS/PMA [88].
В середине 2020 г. L. Liu et al. разработали и реализовали новый подход к регистрации базальной активности MPO [89]. В основу хемосенсора типа “включения” FD-301 (рис. 12) положена структура известного ингибитора MPO – гидразида 4-аминобензойной кислоты, связанного с помощью дибензоилгидразинового линкера с флуорофором – метиленовым синим. FD-301 специфически связывается с MPO благодаря гидразидному фрагменту, однако стерические затруднения, вызванные наличием метиленового синего, не приводят к ингибированию каталитической активности фермента. Мишенью реакции выступает гидразидный остаток, окисление которого HOCl приводит к разрыву связи и высвобождению флуорофора (λвозб = 620 нм; λисп = 686 нм). FD-301 обладает высокой чувствительностью (ПО = 44 нМ) и скоростью реакции с HOCl (плато изменения интенсивности флуоресценции достигается за 10 с), широким рабочим диапазоном pH 3–8, селективностью в отношении HOCl по сравнению с другими окислителями. Хемосенсор был успешно апробирован при визуализации экзогенной HOCl в клетках линии RAW264.7, а также спонтанной продукции эндогенной HOCl в клетках линии HL-60. FD-301 был применен для регистрации образования HOCl in vivo в модели артрита, индуцированного инъекцией λ-каррагинана в голеностопный сустав мыши, и ex vivo в модели язвенного колита мышей, индуцированного оральным приемом 5%-ного декстрана [89].
В 2018 г. L. Chen et al. предложили зонд типа “включения” (соединение (VIII)) для обнаружения HOCl на основе флуоресцентного “ядра” 2‑(2'-гидроксифенил)бензоксазола (рис. 12) [90]. DAMN был выбран в качестве сайта реакции с HOCl. При реакции HOCl с зондом происходит превращение иминогруппы в альдегидную. Реакция сопровождается увеличением интенсивности флуоресценции (λвозб = 360 нм; λисп = 435 нм) за счет ингибирования PET. Зонд характеризуется высокой чувствительностью, селективностью и скоростью реакции (плато интенсивности флуоресценции достигается в течение 30 с) в отношении HOCl. Хемосенсор был использован в режиме двухфотонного возбуждения (λвозб = 740 нм) для регистрации образования HOCl в клетках линии RAW264.7 при их стимуляции LPS/IFN-γ/PMA, а также в срезах гиппокампа мыши при стимуляции PMA [90].
В 2018 г. группа ученых во главе с S. Das предложила зонд “переключения” на основе хинолина – HQMN (рис. 12) [91]. Как и у соединения (VIII), DAMN служит в качестве сайта реакции с HOCl. Полученный в ходе реакции зонда с HOCl альдегид характеризуется значительным сдвигом в синюю область максимума интенсивности флуоресценции (λвозб = 370 нм; λисп = 468/572 нм). Зонд показал высокую селективность в отношении HOCl по сравнению с другими окислителями, а также большой сдвиг максимума испускания при действии HOCl (104 нм). Однако теоретический предел обнаружения HOCl (ПО = 787 нМ) в ~10 раз больше, чем у многих сенсоров, разработанных в последние годы, а плато интенсивности флуоресценции достигается в течение 100 с, что в ~3 раза больше, чем у зондов феноксазинового ряда, зондов на основе родола и др. С помощью HQMN показано увеличение спонтанной продукции HOCl в моноцитах больных сахарным диабетом по сравнению с моноцитами здоровых доноров [91].
В 2018 г. J. Sun et al. предложили два флуоресцентных зонда типа “включения” с бензофуразаном в качестве флуорофора – MeS-DMAB и EtS-DMAB (рис. 12) [92]. Тиоэфирная группа окисляется при действии HOCl до сульфоксида и сульфоновой группы для MeS-DMAB и EtS-DMAB соответственно, что приводит к увеличению интенсивности флуоресцентного сигнала за счет активации процесса ICT (λвозб = 440 нм; λисп = = 610 нм). Оба хемосенсора характеризуются большим стоксовым сдвигом (170 нм), высокой избирательностью в отношении HOCl, однако время достижения плато интенсивности флуоресценции после добавления HOCl составляет 30–40 мин. Поскольку чувствительность EtS-DMAB (ПО = 340 нМ) по отношению к HOCl выше в сравнении с MeS-DMAB, он был использован для регистрации методом конфокальной микроскопии экзогенной HOCl в клетках линии HeLa и образования эндогенной HOCl в клетках линии RAW264.7 при их активации LPS/IFN-γ/PMA [92].
В 2020 г. Y. Huang et al. предложил зонд двойного действия NSSN для регистрации HOCl в митохондриях (рис. 12) [93]. Зонд содержит два бензотиазольных фрагмента и один остаток п-метилфенола между ними. Реакция с HOCl протекает по связи C=C, расположенной между орто-положением п-метилфенола и бензотиазола с последующим отщеплением бензотиазольного фрагмента. При этом наблюдается “переключение” интенсивности флуоресценции зонда с красной на желтую область спектра (λвозб = 450 нм; λисп = = 540/670 нм) предположительно за счет процесса ESIPT. При концентрации HOCl 30–70 мкМ спектр испускания флуоресценции смещается в красную область, и NSSN может быть использован в качестве зонда “включения” (λвозб = 450 нм; λисп = 552 нм). Хемосенсор селективен в отношении HOCl, имеет низкий предел обнаружения (ПО = 130 нМ), рабочий диапазон лежит в области pH 7–10, однако время выхода на плато интенсивности флуоресценции составляет 5 мин. NSSN был использован для визуализации экзогенной HOCl в митохондриях клеток HeLa, а также при подкожной инъекции HOCl мышам [93].
В 2021 г. P. Luo совместно с X. Zhao представили зонд типа “включения” HDI-HClO (рис. 12) [94]. Зонд содержит фрагменты индоленина, фенола и, как и в некоторых других работах, N,N-диметилтиокарбамат в качестве сайта реакции с HOCl. При реакции хемосенсора с HOCl происходит активация ранее блокированного процесса ICT, что приводит к “включению” зонда (λвозб = = 440 нм; λисп = 520 нм). HDI-HClO продемонстрировал высокую селективность и чувствительность (ПО = 8.3 нM), быстрый выход на плато кинетической кривой изменения интенсивности флуоресценции (8 с), широкий рабочий диапазон pH 7–10. При этом следует отметить незначительное влияние биологических тиолов на интенсивность флуоресценции зонда в режиме кинетических исследований. HDI-HClO был апробирован при визуализации экзогенной HOCl в клетках линии HeLa, а также эндогенной HOCl в макрофагах RAW264.7 при их стимуляции LPS/PMA [94].
Ни один из указанных в данном подразделе зондов не доступен для приобретения.
Краткая характеристика новых малых молекулярных флуоресцентных зондов для регистрации HOCl приведена в табл. S1 (см. дополнительные материалы).
ЗАКЛЮЧЕНИЕ
Разработка чувствительных, селективных и биологически совместимых флуоресцентных зондов с целью регистрации реакционных соединений, в том числе HOCl, в биологических объектах вызывает интерес многих ученых, особенно это стало заметно в последние 10 лет. За это время было разработано множество зондов на основе различных флуоресцентных “ядер”, групп распознавания, типов и механизмов изменения интенсивности флуоресценции. Сами зонды стали более специализированными и чаще применяемыми для мониторинга образования HOCl с целью изучения ее участия в физиологических и патофизиологических процессах, а также выяснения роли этой молекулы в клеточной сигнализации.
В настоящем обзоре мы представили классификацию, стратегии обнаружения, а также достижения в разработке флуоресцентных зондов для обнаружения HOCl в биологических объектах. Однако, несмотря на значительные успехи в этой области, существует ряд ограничений использования флуоресцентных зондов вне зависимости от их типа: 1) малый стоксов сдвиг, который приводит к потере чувствительности зонда вследствие поглощения испускаемого света; 2) меньшая скорость реакции сенсора с HOCl по сравнению со скоростью реакции HOCl с функциональными группами биомолекул, что затрудняет кинетические исследования функционального ответа клеток на внешние стимулы; 3) сложная процедура синтеза и, как следствие, коммерческая недоступность, высокая стоимость или низкая чистота продукта; 4) малый рабочий диапазон рН и/или его сдвиг в кислотные или щелочные области (за исключением случаев разработки зондов, нацеленных на определенную органеллу клетки-мишени); 5) низкая стабильность самого зонда (малое время хранения препарата) и/или фотообесцвечивание флуоресцентного продукта во время наблюдений; 6) влияние HOCl и других АФК, АФГ и АФА на продукт реакции зонда с HOCl; 7) малая селективность (высокая степень влияния других АФК, АФГ и АФА, а также ионов); 8) низкая чувствительность (большое значение ПО) и т.д. [16].
В настоящее время получен ряд зондов, лишенных большинства вышеперечисленных недостатков при их использовании в бесклеточных средах. Однако данный факт не гарантирует достаточную чувствительность этого же зонда в клеточных культурах. Принимая во внимание специфику клеточных систем, к зондам для регистрации HOCl предъявляются некоторые дополнительные требования.
1) В идеале сенсор должен позволять производить избирательную оценку образования HOCl во внутри- или внеклеточных областях. Поэтому при конструировании зонда должен быть соблюден подходящий для конкретной задачи баланс между гидрофобностью и гидрофильностью зонда в контексте проницаемости для мембран, удержания в клетках и растворимости в физиологических средах [14].
2) В качестве растворителя для сенсора идеально использование воды или буферного раствора с физиологическим значением рН. В ряде случаев допускаются малые добавки органического сорастворителя. Большое содержание органических растворителей может нарушать физико-химические свойства биомолекул и влиять на жизнеспособность клеток. Однако большинство флуоресцентных зондов плохо растворимы в водных средах. В качестве растворителей или сорастворителей используют такие органические вещества, как N,N-диметилформамид, диметилсульфоксид, ацетонитрил, этанол, глицерин [95]. Следует помнить, что часто используемый диметилсульфоксид сам окисляется HOCl [96]. Чаще других в качестве буферных растворов используют фосфатно-солевой буфер, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту (HEPES), 2‑амино-2-гидроксиметил-пропан-1,3-диол (Tris) и др. [95]. Однако применение двух последних соединений нежелательно ввиду их реакции с HOCl [97].
3) Необходимо избегать сильного поглощения зонда в ультрафиолетовой области, а также совпадения спектров поглощения и/или возбуждения сенсора с полосами Соре основных белков плазмы крови. Первую из этих проблем можно обойти, если использовать режим двухфотонного возбуждения хемосенсора, что, однако, не всегда реализуемо.
4) Зонд должен быть нетоксичным для клеток в используемых концентрациях на протяжении всего периода измерений (в зависимости от используемых методов промежуток времени варьируется от 30 мин до нескольких суток). При этом желательно наличие у зонда высокого молярного коэффициента поглощения, что дает возможность уменьшить его концентрацию, необходимую для экспериментов, и, следовательно, снизить вмешательство в изучаемые механизмы [14].
При разработке зонда, лишенного сразу нескольких недостатков, исследователи часто берут за основу некоторое удачное решение с целью его дальнейшей доработки. Так, среди тенденций в разработке и применении малых молекулярных зондов для регистрации HOCl можно отметить частое использование DAMN в качестве мишени для HOCl в составе сенсоров, например, в CSN [63], RO610 [78], соединении (VIII) [90], HQMN [91]. Новой ветвью стало использование зондов на основе феноксазина (CB [70], RT-1 [73], BR-O [74], BR-1 [75], BC-2 и BC-3 [77]), а также гибридного флуорофора родола (RO610 [78], HKOCl-4 и его производные [79]). Вызывает интерес стратегия одновременной регистрации нескольких типов окислителей, реализованная, например, в работе R. Zhang et al. [67] на примере зонда FHZ.
Наблюдается усложнение структуры зондов за счет введения дополнительных мишеней для увеличения селективности и/или чувствительности датчиков, а также более частое использование пар донор–акцептор для создания зондов типа “переключения”. Общая тенденция – разработка зондов с большим стоксовым сдвигом и регистрацией в ближнем инфракрасном диапазоне (альтернативно – зондов с возможностью двухфотонного возбуждения), совместимых с часто используемыми длинами волн лазерного излучения (например, 488, 640, 750 нм и др.) [32, 33].
Из представленных в данном обзоре новых малых молекулярных зондов (табл. S1 в дополнительных материалах), в зависимости от целей исследования и исходя из данных, указанных авторами статей, для регистрации HOCl подходят следующие зонды:
1) по используемому методу регистрации HOCl:
а) для конфокальной микроскопии – все указанные зонды;
б) для проточной цитометрии – HKOCl-3 [64], CB [70–72], HKOCl-4r [79];
в) для исследования в суспензиях клеток с использованием спектрофлуориметра – HKOCl-3 [64], CB [70–72];
г) для кинетических исследований образования HOCl (время реакции <1 мин) – все зонды, кроме BCO и BETC (время реакции не определено) [62], FN-1 и FN-2 [69], RT-1 [73], BR-O [74], BR-1 [75], Dcp-EPtz [88], EtS-DMAB [92], NSSN [93];
2) для регистрации продукции HOCl в клеточных органеллах:
а) в митохондриях – FHZ (в цитоплазме и митохондриях) [67], HKOCl-4m [79], соединение (VII) [84], NSSN [93];
б) в лизосомах – NDS [82], CR-Ly [87];
в) в эндоплазматическом ретикулуме – ER-NPA [83];
3) для регистрации образования HOCl:
а) in vivo – FHZ [67], BR-1 [75], BC-3 [77], RO610 [78], ER-NPA [83], FD-301 [89], NSSN [93];
б) в срезах тканей – HKOCl-4r [79], соединение (VIII) [90];
4) использование ближнего инфракрасного диапазона или режима двухфотонного возбуждения:
а) CSN – “переключение” из красной области спектра в синюю (λисп = 470/640 нм) [63], NSSN – “переключение” из красной области спектра в желтую (λисп = 540/670 нм) [93];
б) возбуждение и испускание в красной области спектра – BR-O [74], BR-1 [75] и BC-3 [77] (λвозб = 610 нм; λисп = 670 нм), FD-301 (λвозб = 620 нм; λисп = 686 нм) [89];
в) BRT – “переключение” из синей области спектра в оранжевую с сохранением красной полосы (λисп = 587/462 нм) [85];
г) возможность использования двухфотонного возбуждения – соединение (VIII) (λвозб = 740 нм; λисп = 435 нм) [90], ER-NPA (λвозб = 800 нм; λисп = = 550 нм) [83].
К настоящему времени коммерчески доступны для приобретения следующие зонды: HKOCl-3 (CAS 2031170-80-4), FHZ (CAS 1883737-63-0), СВ (CAS 1562-90-9), HKOCl-4 (CAS 2031170-85-9) и HKOCl-4m (CAS 2031170-88-2).
В 2016–2021 гг. был достигнут несомненный прогресс в разработке малых молекулярных флуоресцентных зондов, а также их применении для визуализации HOCl как in vitro, так и in vivo. Однако многие проблемы, связанные с чувствительностью и селективностью зондов, скоростью их реакции с HOCl (для кинетических исследований), малым стоксовым сдвигом, использованием органических растворителей, а также малой фотостабильностью остаются актуальными и сейчас. В связи с этим при выборе хемосенсора для практического применения необходимо обратить внимание на ту совокупность характеристик зонда, которая наиболее оптимально позволит решить конкретно поставленную перед экспериментатором задачу. Кроме того, очень небольшое количество разработанных хемосенсоров доступно к непосредственному приобретению, что вызывает дополнительные затруднения у исследователей, но вместе с тем открывает возможность и необходимость дальнейшего конструирования и синтеза новых зондов для регистрации HOCl.
Список литературы
Alfadda A.A., Sallam R. M. // J. Biomed. Biotechnol. 2012. V. 2012. P. 936486–936499. https://doi.org/10.1155/2012/936486
Milkovic L., Cipak Gasparovic A., Cindric M., Mouthuy P.A., Zarkovic N. // Cells. 2019. V. 8. P. 793–806. https://doi.org/10.3390/cells8080793
Phaniendra A., Jestadi D.B., Periyasamy L. // Indian J. Clin. Biochem. 2015. V. 30. P. 11–26. https://doi.org/10.1007/s12291-014-0446-0
Winterbourn C.C. // Toxicology. 2002. V. 181. P. 223–227. https://doi.org/10.1016/S0300-483X(02)00286-X
Arnhold J. // Int. J. Mol. Sci. 2020. V. 21. P. 8057–8084. https://doi.org/10.3390/ijms21218057
Panasenko O.M., Gorudko I.V., Sokolov A.V. // Biochemistry (Mosc.). 2013. V. 78. P. 1466–1489. https://doi.org/10.1134/S0006297913130075
Ulfig A., Leichert L.I. // Cell. Mol. Life Sci. 2021. V. 78. P. 385–414. https://doi.org/10.1007/s00018-020-03591-y
Pattison D.I., Davies M.J. // Chem. Res. Toxicol. 2001. V. 14. P. 1453–1464. https://doi.org/10.1021/tx0155451
Zhang L., Wang X., Cueto R., Effi C., Zhang Y., Tan H., Qin X., Ji Y., Yang X., Wang H. // Redox Biol. 2019. V. 26. P. 101284–101299. https://doi.org/10.1016/j.redox.2019.101284
Chen X., Tian X., Shin I., Yoon J. // Chem. Soc. Rev. 2011. V. 40. P. 4783–4804. https://doi.org/10.1039/C1CS15037E
Burns J.M., Cooper W.J., Ferry J.L., King D.W., DiMento B.P., McNeill K., Miller C.J., Miller W.L., Peake B.M., Rusak S.A., Rose A.L., Waite T.D. // Aquat. Sci. 2012. V. 74. P. 683–734. https://doi.org/10.1007/s00027-012-0251-x
Hu J.J., Ye S., Yang D. // Isr. J. Chem. 2017. V. 57. P. 251–258. https://doi.org/10.1002/ijch.201600113
Yudhistira T., Mulay S.V., Kim Y., Halle M.B., Churchill D.G. // Chem. Asian J. 2019. V. 14. P. 3048–3084. https://doi.org/10.1002/asia.201900672
Chan J., Dodani S.C., Chang C.J. // Nat. Chem. 2012. V. 4. P. 973–984. https://doi.org/10.1038/nchem.1500
Dong S., Zhang L., Lin Y., Ding C., Lu C. // Analyst. 2020. V. 145. P. 5068–5089. https://doi.org/10.1039/D0AN00645A
Zhang R., Song B., Yuan J. // TrAC Trends Anal. Chem. 2018. V. 99. P. 1–33. https://doi.org/10.1016/j.trac.2017.11.015
Wan J., Zhang X., Zhang K., Su Z. // Rev. Anal. Chem. 2020. V. 39. P. 209–221. https://doi.org/10.1515/revac-2020-0119
Tholen D.W., Linnet K., Kondratovich M., Armbruster D.A., Garrett P.E., Jones R.L., Kroll M.H., Lequin R.M., Pankratz T.J., Scassellati G.A., Schimmel H., Tsai J. // Clinical and Laboratory Standards Institute (CLSI). Protocols for Determination of Limits of Detection and Limits of Quantitation; Approved Guideline. CLSI document EP17-A.CLSI, Wayne, PA, 2004. https://demo.nextlab.ir/Organization/Documents/ CLSI-Standards/CLSI-EP17-A.aspx
Long G.L., Winefordner J.D. // Anal. Chem. Am. Chem. Soc. 1983. V. 55. P. 712A–724A. https://doi.org/10.1021/ac00258a001
Ruff F., Szabó D., Rábai J., Jalsovszky I., Farkas Ö. // J. Phys. Org. Chem. 2019. V. 32. P. e4005. https://doi.org/10.1002/poc.4005
Lin W., Long L., Chen B., Tan W. // Chemistry. 2009. V. 15. P. 2305–2309. https://doi.org/10.1002/chem.200802054
Yue Y., Huo F., Yin C., Escobedo J.O., Strongin R.M. // Analyst. 2016. V. 141. P. 1859–1873. https://doi.org/10.1039/C6AN00158K
Bai X., Ng K.K.H., Hu J.J., Ye S., Yang D. // Annu. Rev. Biochem. 2019. V. 88. P. 605–633. https://doi.org/10.1146/annurev-biochem-013118-111754
Bartosz G. // Clin. Chim. Acta. 2006. V. 368. P. 53–76. https://doi.org/10.1016/j.cca.2005.12.039
Zhang Y. R., Liu Y., Feng X., Zhao B.X. // Sens. Actuators B Chem. 2017. V. 240. P. 18–36. https://doi.org/10.1016/j.snb.2016.08.066
Winterbourn C.C. // Biochim. Biophys. Acta. 2014. V. 1840. P. 730–738. https://doi.org/10.1016/j.bbagen.2013.05.004
Gao P., Pan W., Li N., Tang B. // Chem. Sci. 2019. V. 10. P. 6035–6071. https://doi.org/10.1039/C9SC01652J
Fu Y., Finney N.S. // RSC Adv. 2018. V. 8. P. 29051–29061. https://doi.org/10.1039/C8RA02297F
Cao D., Zhu L., Liu Z., Lin W. // J. Photochem. Photobiol. C Photochem. Rev. 2020. V. 44. P. 100371. https://doi.org/10.1016/j.jphotochemrev.2020.100371
Jiao Y., Zhu B., Chen J., Duan X. // Theranostics. 2015. V. 5. P. 173–187. https://doi.org/10.7150/thno.9860
Yuan L., Lin W., Xie Y., Chen B., Song J. // Chemistry. 2012. V. 18. P. 2700–2706. https://doi.org/10.1002/chem.201101918
Wang L., Du W., Hu Z., Uvdal K., Li L., Huang W. // Angew. Chem. I nt. Ed. Engl. 2019. V. 58. P. 14026–14043. https://doi.org/10.1002/anie.201901061
Andina D., Leroux J.C., Luciani P. // Chemistry. 2017. V. 23. P. 13549–13573. https://doi.org/10.1002/chem.201702458
Cao D., Liu Z., Verwilst P., Koo S., Jangili P., Kim J.S., Lin W. // Chem. Rev. 2019. V. 119. P. 10403–10519. https://doi.org/10.1021/acs.chemrev.9b00145
Kenmoku S., Urano Y., Kojima H., Nagano T. // J. Am. Chem. Soc. 2007. V. 129. P. 7313–7318. https://doi.org/10.1021/ja068740g
Koide Y., Urano Y., Hanaoka K., Terai T., Nagano T. // J. Am. Chem. Soc. 2011. V. 133. P. 5680–5682. https://doi.org/10.1021/ja111470n
Chen X., Lee K.A., Ha E.M., Lee K.M., Seo Y.Y., Choi H.K., Kim H.N., Kim M.J., Cho C.S., Lee S.Y., Lee W.J., Yoon J. // Chem. Commun. 2011. V. 47. P. 4373–4375. https://doi.org/10.1039/C1CC10589B
Zhou J., Li L., Shi W., Gao X., Li X., Ma H. // Chem. Sci. 2015. V. 6. P. 4884–4888. https://doi.org/10.1039/C5SC01562F
Bruno J.G., Herman T.S., Cano V.L., Stribling L., Kiel J.L. // In Vitro Cell. Dev. Biol. Anim. 1999. V. 35. P. 376–382. https://doi.org/10.1007/s11626-999-0111-8
Adachi Y., Kindzelskii A.L., Petty A.R., Huang J.B., Maeda N., Yotsumoto S., Aratani Y., Ohno N., Petty H.R. // J. Immunol. 2006. V. 176. P. 5033–5040. https://doi.org/10.4049/jimmunol.176.8.5033
Yang Y.K., Cho H.J., Lee J., Shin I., Tae J. // Org. Lett. 2009. V. 11. P. 859–861. https://doi.org/10.1021/ol802822t
Zhang Z., Zheng Y., Hang W., Yan X., Zhao Y. // Talanta. 2011. V. 85. P. 779–786. https://doi.org/10.1016/j.talanta.2011.04.078
Zhang Z., Deng C., Meng L., Zheng Y., Yan X. // Anal. Methods. 2015. V. 7. P. 107–114. https://doi.org/10.1039/C4AY02281E
Setsukinai K.I., Urano Y., Kakinuma K., Majima H.J., Nagano T. // J. Biol. Chem. 2003. V. 278. P. 3170–3175. https://doi.org/10.1074/jbc.M209264200
Cohn C.A., Pedigo C.E., Hylton S.N., Simon S.R., Schoonen M.A. // Geochem. Trans. 2009. V. 10. P. 1–9. https://doi.org/10.1186/1467-4866-10-8
Flemmig J., Zschaler J., Remmler J., Arnhold J. // J. Biol. Chem. 2012. V. 287. P. 27913–27923. https://doi.org/10.1074/jbc.M112.364299
Flemmig J., Schwarz P., Bäcker I., Leichsenring A., Lange F., Arnhold J. // J. Immunol. Methods. 2014. V. 415. P. 46–56. https://doi.org/10.1016/j.jim.2014.09.003
Shepherd J., Hilderbrand S.A., Waterman P., Heinecke J.W., Weissleder R., Libby P. // Chem. Biol. 2007. V. 14. P. 1221–1231. https://doi.org/10.1016/j.chembiol.2007.10.005
Xu Q., Lee K.A., Lee S., Lee K.M., Lee W.J., Yoon J. // J. Am. Chem. Soc. 2013. V. 135. P. 9944–9949. https://doi.org/10.1021/ja404649m
Sun Z.N., Liu F.Q., Chen Y., Tam P.K.H., Yang D. // Org. Lett. 2008. V. 10. P. 2171–2174. https://doi.org/10.1021/ol800507m
Yang D., Sun Z.N., Peng T., Wang H.L., Shen J.G., Chen Y., Tam P.K.H. // Live Cell Imaging / Ed. Papkovsky D. Humana Press, 2010. V. 591. P. 93–103. https://doi.org/10.1007/978-1-60761-404-3
Hu J.J., Wong N.K., Gu Q., Bai X., Ye S., Yang D. // Org. Lett. 2014. V. 16. P. 3544–3547. https://doi.org/10.1021/ol501496n
Murao S.L., Stevens F.J., Ito A., Huberman E. // Proc. Natl. Acad. Sci. USA. 1988. V. 85. P. 1232–1236. https://doi.org/10.1073/pnas.85.4.1232
Gai L., Mack J., Liu H., Xu Z., Lu H., Li Z. // Sens. Actuators B Chem. 2013. V. 182. P. 1–6. https://doi.org/10.1016/j.snb.2013.02.106
Emrullahoğlu M., Üçüncü M., Karakuş E. // Chem. Commun. 2013. V. 49. P. 7836–7838. https://doi.org/10.1039/C3CC44463E
Liu S.R., Wu S.P. // Org. Lett. 2013. V. 15. P. 878–881. https://doi.org/10.1021/ol400011u
Long L., Zhang D., Li X., Zhang J., Zhang C., Zhou L. // Anal. Chim. Acta. 2013. V. 775. P. 100–105. https://doi.org/10.1016/j.aca.2013.03.016
Zhang Y.R., Chen X.P., Zhang J.Y., Yuan Q., Miao J.Y., Zhao B.X. // Chem. Commun. 2014. V. 50. P. 14241–14244. https://doi.org/10.1039/C4CC05976J
Wang L., Long L., Zhou L., Wu Y., Zhang C., Han Z., Wang J., Da Z. // RSC Adv. 2014. V. 4. P. 59535–59540. https://doi.org/10.1039/C4RA10633D
Goswami S., Aich K., Das S., Pakhira B., Ghoshal K., Quah C.K., Bhattacharyya M., Fun H.K., Sarkar S. // Chem. Asian J. 2015. V. 10. P. 694–700. https://doi.org/10.1002/asia.201403234
Liu Z., Li G., Wang Y., Li J., Mi Y., Guo L., Xu W., Zou D., Li T., Wu Y. // RSC Adv. 2018. V. 8. P. 9519–9523. https://doi.org/10.1039/C7RA13419C
Jin L., Tan X., Zhao C., Wang Q. // Anal. Methods. 2019. V. 11. P. 1916–1922. https://doi.org/10.1039/C9AY00105K
Shi L., Yu H., Zeng X., Yang S., Gong S., Xiang H., Zhang K., Shao G. // New J. Chem. 2020. V. 44. P. 6232–6237. https://doi.org/10.1039/D0NJ00318B
Hu J.J., Wong N.K., Lu M.Y., Chen X., Ye S., Zhao A.Q., Gao P., Kao R.Y.-T., Shen J., Yang D. // Chem. Sci. 2016. V. 7. P. 2094–2099. https://doi.org/10.1039/C5SC03855C
Chang C.Y., Song M.J., Jeon S.B., Yoon H.J., Lee D.K., Kim I.H., Suk K., Choi D.K., Park E.J. // Am. J. Pathol. 2011. V. 179. P. 964–979. https://doi.org/10.1016/j.ajpath.2011.04.033
Agrawal I., Sharma N., Saxena S., Arvind S., Chakraborty D., Chakraborty D.B., Jha D., Ghatak S., Epari S., Gupta T., Jha S. // iScience. 2021. V. 24. P. 101968–101978. https://doi.org/10.1016/j.isci.2020.101968
Zhang R., Zhao J., Han G., Liu Z., Liu C., Zhang C., Liu B., Jiang C., Liu R., Zhao T., Han M.Y., Zhang Z. // J. Am. Chem. Soc. 2016. V. 138. P. 3769–3778. https://doi.org/10.1021/jacs.5b12848
Zhou Y., Wang Y.K., Wang X.F., Zhang Y.J., Wang C.K. // Chin. Phys. B. 2017. V. 26. P. 083102-1–083102-7. https://doi.org/10.1088/1674-1056/26/8/083102
Lv J., Wang F., Wei T., Chen X. // Ind. Eng. Chem. Res. 2017. V. 56. P. 3757–3764. https://doi.org/10.1021/acs.iecr.7b00381
Козлов С.О., Кудрявцев И.В., Грудинина Н.А., Костевич В.А., Панасенко О.М., Соколов А.В., Васильев В.Б. // Acta Biomedica Scientifica. 2016. Т. 1. С. 86–91. https://doi.org/10.12737/article_590823a4895537.04307905
Sokolov A.V., Kostevich V.A., Kozlov S.O., Donskyi I.S., Vlasova I.I., Rudenko A.O., Zakharova E.T., Vasilyev V.B., Panasenko O.M. // Free Radic. Res. 2015. V. 49. P. 777–789. https://doi.org/10.3109/10715762.2015.1017478
Lutsenko V.E., Grigorieva D.V., Gorudko I.V., Cherenkevich S.N., Gorbunov N.N., Kostevich V.A., Panasenko O.M., Sokolov A.V. // Med. Acad. J. 2019. V. 19. P. 63–71. https://doi.org/10.17816/MAJ19263-71
Choi M.G., Lee Y.J., Lee K.M., Park K.Y., Park T.J., Chang S.K. // Analyst. 2019. V. 144. P. 7263–7269. https://doi.org/10.1039/C9AN01884K
Yang J., Yao Y., Shen Y., Xu Y., Lv G., Li C. // ZAAC. 2020. V. 646. P. 431–436. https://doi.org/10.1002/zaac.202000127
Yang J., Zheng W., Shen Y., Xu Y., Lv G., Li C. // J. Lumin. 2020. V. 226. P. 117460–117466. https://doi.org/10.1016/j.jlumin.2020.117460
Hansra P., Moran E.L., Fornasier V.L., Bogoch E.R. // Inflammation. 2000. V. 24. P. 141–155. https://doi.org/10.1023/A:1007033610430
Zheng W., Yang J., Shen Y., Yao Y., Lv G., Hao S., Li C. // Dyes Pigments. 2020. V. 179. P. 108404–108410. https://doi.org/10.1016/j.dyepig.2020.108404
Zhang Y., Ma L., Tang C., Pan S., Shi D., Wang S., Li M., Guo Y. // J. Mater. Chem. B. 2018. V. 6. P. 725–731. https://doi.org/10.1039/C7TB02862H
Bai X., Yang B., Chen H., Shen J., Yang D. // Org. Chem. Front. 2020. V. 7. P. 993–996. https://doi.org/10.1039/D0QO00081G
Li J., Yin C., Liu T., Wen Y., Huo F. // Sens. Actuators B Chem. 2017. V. 252. P. 1112–1117. https://doi.org/10.1016/j.snb.2017.07.171
Liu C., Jiao X., He S., Zhao L., Zeng X. // Talanta. 2017. V. 174. P. 234–242. https://doi.org/10.1016/j.talanta.2017.06.012
Jiao C., Liu Y., Pang J., Lu W., Zhang P., Wang Y. // J. Photochem. Photobiol. Chem. 2020. V. 392. P. 112399–112405. https://doi.org/10.1016/j.jphotochem.2020.112399
Yang T., Sun J., Yao W., Gao F. // Dyes Pigments. 2020. V. 180. P. 108435–108442. https://doi.org/10.1016/j.dyepig.2020.108435
Xu J., Wang C., Ma Q., Zhang H., Tian M., Sun J., Wang B., Chen Y. // ACS Omega. 2021. V. 6. P. 14399–14409. https://doi.org/10.1021/acsomega.1c01271
Liu Y., Zhao Z.M., Miao J.Y., Zhao B.X. // Anal. Chim. Acta. 2016. V. 921. P. 77–83. https://doi.org/10.1016/j.aca.2016.03.045
Song G.J., Ma H.L., Luo J., Cao X.Q., Zhao B.X. // Dyes Pigments. 2018. V. 148. P. 206–211. https://doi.org/10.1016/j.dyepig.2017.09.022
Meng H., Huang X.Q., Lin Y., Yang D.Y., Lv Y.J., Cao X.Q., Zhang G.X., Dong J., Shen S.L. // Spectrochim. Acta. A. Mol. Biomol. Spectrosc. 2019. V. 223. P. 117355–117360. https://doi.org/10.1016/j.saa.2019.117355
Zheng D., Qiu X., Liu C., Jiao X., He S., Zhao L., Zeng X. // New J. Chem. 2018. V. 42. P. 5135–5141. https://doi.org/10.1039/C8NJ00279G
Liu L., Wei P., Yuan W., Liu Z., Xue F., Zhang X., Yi T. // Anal. Chem. 2020. V. 92. P. 10971–10978. https://doi.org/10.1021/acs.analchem.9b04601
Chen L., Park S.J., Wu D., Kim H.M., Yoon J. // Dyes Pigments. 2018. V. 158. P. 526–532. https://doi.org/10.1016/j.dyepig.2018.01.027
Das S., Aich K., Patra L., Ghoshal K., Gharami S., Bhattacharyya M., Mondal T.K. // Tetrahedron Lett. 2018. V. 59. P. 1130–1135. https://doi.org/10.1016/j.tetlet.2018.02.023
Sun J., Zhang L., Hu Y., Fang J. // Sens. Actuators B Chem. 2018. V. 266. P. 447–454. https://doi.org/10.1016/j.snb.2018.03.124
Huang Y., Zhang Y., Huo F., Liu Y., Yin C. // Dyes Pigments. 2020. V. 179. P. 108387–108393. https://doi.org/10.1016/j.dyepig.2020.108387
Luo P., Zhao X. // ACS Omega. 2021. V. 6. P. 12287–12292. https://doi.org/10.1021/acsomega.1c01102
Wu D., Chen L., Xu Q., Chen X., Yoon J. // Acc. Chem. Res. 2019. V. 52. P. 2158–2168. https://doi.org/10.1021/acs.accounts.9b00307
Imaizumi N., Kanayama T., Oikawa K. // Analyst. 1995. V. 120. P. 1983–1987. https://doi.org/10.1039/AN9952001983
Prütz W.A. // Arch. Biochem. Biophys. 1996. V. 332. P. 110–120. https://doi.org/10.1006/abbi.1996.0322
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Биоорганическая химия