Биоорганическая химия, 2022, T. 48, № 4, стр. 453-460
Влияние липидных компонентов на иммуногенность синтетического фрагмента антигена NS4A вируса гепатита С
А. Н. Белявцев 1, 2, *, Н. С. Шастина 1, В. В. Куприянов 2, Л. И. Николаева 2, М. В. Мельникова 3, Е. Ф. Колесанова 3, М. Ю. Шимчишина 1, 2, И. В. Капустин 4
1 ФГБОУ ВО “МИРЭА – Российский технологический университет” (Институт тонких химических технологий им. М.В. Ломоносова)
119571 Москва, просп. Вернадского, 86, Россия
2 ФГБУ “Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи” Минздрава России
123098 Москва, ул. Гамалеи, 18, Россия
3 ФГБНУ “Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича”
119121 Москва, ул. Погодинская, 10, стр. 8, Россия
4 ФБУН “Московский научно-исследовательский институт эпидемиологии и микробиологии
им. Г.Н. Габричевского” Роспотребнадзора
125212 Москва, ул. Адмирала Макарова, 10, Россия
* E-mail: belyavcev@mirea.ru
Поступила в редакцию 04.08.2021
После доработки 19.08.2021
Принята к публикации 12.10.2021
- EDN: AJDXBW
- DOI: 10.31857/S0132342322030046
Аннотация
Целью данного исследования было изучение влияния липидных компонентов на иммуногенность синтетического 24-членного пептида, содержащего B- и Th-эпитопы. Амидированный по C-концу синтетический пептид имел первичную структуру VIVGRIILSGRPAVIPDREVLYRK, которая соответствует фрагменту антигена NS4A вируса гепатита С. Для усиления иммуногенности было выполнено ацилирование пептида по N-концевой α-аминогруппе путем присоединения липида 1,3-(дипальмитоиламино)пропан-2-О-сукцината. Также получена липосомальная форма пептида с размером частиц 160 ± 20 нм и степенью включения пептида 80%. Препарат пептида в липосомах обладал стабильностью в течение трех месяцев. Изучена иммуногенность пептида, липопептида и пептида в липосомах по выработке антител В-клетками и цитокинов (IFN-γ и IL-2) специфическими CD4+-T-лимфоцитами у иммунизированных лабораторных мышей. Наибольшей иммуногенностью обладал 24-членный пептид, включенный в фосфатидилхолиновые липосомы, что свидетельствует о перспективности использования данного пептида в дальнейших исследованиях по созданию кандидатной вакцины от гепатита C.
ВВЕДЕНИЕ
Вирус гепатита С (ВГС) – этиологический агент гепатита С, который инфицирует гепатоциты и при развитии длительной хронической инфекции может приводить к циррозу или гепатоцеллюлярной карциноме. В последние годы появились средства эффективной терапии гепатита С. Однако пока элиминация данной инфекции – недостижимая задача, т.к. до сих пор не создана профилактическая вакцина. В последние годы ведутся исследования, нацеленные на получение различных вариантов вакцин от гепатита С (рекомбинантных, векторных, субъединичных, пептидных и др.) [1]. Вакцинные препараты на основе синтетических пептидов привлекают разработчиков тем, что имеют минимальное количество побочных эффектов [2, 3].
Для обеспечения эффективности синтетических пептидных вакцин большое значение имеет правильный выбор целевых антигенных детерминант и адъюванта [2]. Одно из перспективных современных направлений – использование в качестве адъювантов синтетических вакцин липофильных соединений. Показано, что некоторые из них способны взаимодействовать с Toll-подобными рецепторами (TLRs) и усиливать иммунный ответ на синтетические антигенные детерминанты [4].
Исторической основой идеи конъюгирования пептидного антигена с липофильным адъювантом было исследование T.P. Hopp в начале 1980-х гг. [5]. При разработке синтетической пептидной вакцины против гепатита B он обнаружил, что гуморальный иммунный ответ значительно усиливался после конъюгации пептида, воспроизводящего эпитопы HBs-антигена вируса гепатита B, с Nα,Nε-дипальмитоиллизином. В дальнейшем были обнаружены другие свойства природных липопептидов: митогенная активность трипальмитоилированного пентапептида из бактериальной мембраны Escherichia coli [6] и иммунная активность выделенного из мембраны Mycoplasma fermentans макрофаг-активирующего липопептида, содержащего липидный компонент S-[2,3-бис(пальмитоилокси)пропил]цистеин (Pam2Cys) [7]. Проявление иммунностимулирующей активности этими липофильными соединениями в составе диацильных и триацильных липопептидных лигандов сигнальных рецепторов связывают с наличием в их структуре патоген-ассоциированных молекулярных паттернов, которые распознаются этими рецепторами. Благодаря наличию подобных липидных фрагментов липопептиды, содержащие антигенные детерминанты, могут проявлять самоадъювантные свойства [8]. Еще одним способом повышения иммуногенности пептидов может служить их включение в липосомы [9, 10].
Ранее нами был синтезирован 24-членный пептид – фрагмент антигена NS4A вируса гепатита C, содержащий консервативный B-клеточный и Т-хелперный эпитопы антигена NS4A ВГС [11, 12], показана иммунореактивность этого пептида с антителами из сывороток больных гепатитом C [13]. Таким образом, данный пептид мог бы служить компонентом вакцины против гепатита С. Однако известно, что пептиды примерно такой длины, даже содержащие и B-, и Т-эпитопы, проявляют достаточно высокую иммуногенность только в присутствии адъювантов [1]. Поэтому целью данного исследования было изучение возможности повышения иммуногенности ранее синтезированного 24-членного пептида путем конъюгации с потенциальным липофильным адъювантом 1,3-(дипальмитоиламино)пропан-2-О-сукцинатом, а также после включения в наноразмерные фосфатидилхолиновые липосомы.
Считается, что защиту от ВГС-инфекции в значительной степени обеспечивает эффективная продукция интерферона-γ (IFN-γ) и интерлейкина-2 (IL-2) CD4+-Т-лимфоцитами (Th1-путь) [14]. Поэтому мы исследовали как продукцию антител, так и секрецию указанных цитокинов Т-лимфоцитами после иммунизации лабораторных мышей различными препаратами на основе 24-членного синтетического пептида.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение конъюгата 24-членного пептида с липофильным адъювантом и липосомальной формы пептида. В качестве липофильного компонента, конъюгируемого с синтетическим пептидом, нами был выбран устойчивый к ферментативному расщеплению амидный аналог диацилглицеролипида – N-[2,3-бис(пальмитоилокси)пропил]сукцината (Pam2Suc) [15, 16]. Ранее было показано, что Pam2Suc обладает иммуностимулирующей активностью в составе липопептидов, реализующейся путем активации дендритных клеток через Toll-подобные рецепторы 2-го типа (TLR-2) [16]. Поэтому были основания полагать, что более стабильный амидный аналог глицеролипида будет обладать по крайней мере не меньшей иммуностимулирующей активностью.
Для разработки потенциального самоадъювантного препарата, представляющего собой конъюгат амидированного по C-концу пептида VIVGRIILSGRPAVIPDREVLYRK (содержащего фрагмент последовательности антигена NS4A ВГС субтипа 1b [17]) с липофильным остатком, сначала был получен 1,3-(дипальмитоиламино)пропан-2-О-сукцинат (Pam2AP-Suc), имеющий структурное сходство с уже исследованным липофильным адъювантом Pam2Suc [16]. В структуре пропильного фрагмента Pam2Suc имеется одна аминогруппа (в 1-м положении), через которую он связан с сукцинильным остатком, а у пропильного фрагмента Pam2AP-Suc имеются две аминогруппы (в 1- и 3-м положениях), через которые он связан с остатками пальмитиновой кислоты. Pam2AP-Suc имеет структурное сходство с липофильными фрагментами лигандов TLR, иммуностимулирующее действие которых при взаимодействии с этими рецепторами уже установлено. Получение Pam2AP-Suc осуществляли ацилированием 1,3-(дипальмитоиламино)пропан-2-ола избытком янтарного ангидрида (4 экв.) в присутствии DMAP (2 экв.) в пиридине. Структура полученного соединения подтверждена методом 1Н-ЯМР-спектроскопии и элементным анализом.
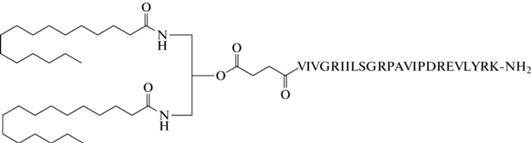
Введение Pam2AP-Suc в структуру липопептида (рис. 1) проводили на смоле Ринка по окончании сборки последовательности 24-членного пептида (2.5 экв. липида на 1 экв. пептида) в смеси растворителей дихлорметан/ДМФА (1 : 1, v/v) при активации карбоксильной группы сочетанием Oxyma Pure, HBTU и 2,4,6-коллидина с последующим деблокированием функциональных групп липопептида и отщеплением его от твердой фазы действием трифторуксусной кислоты со скэвенджерами.
Липопептид был нерастворим в воде и образовывал устойчивые агрегаты, что существенно затруднило его очистку. Выделение липопептида осуществляли методом офВЭЖХ с УФ-детектированием при длине волны 205 нм, используя в качестве подвижной фазы элюент ацетонитрил/вода (с добавлением 0.1% трифторуксусной кислоты) при линейном градиенте ацетонитрила 5–100% за 20 мин (дополнительные материалы, рис. S1–S3 ). Молекулярная масса липопептида подтверждена масс-спектрометрическим анализом. Очищенный липопептид (степень чистоты по данным аналитической офВЭЖХ >90%) был лиофильно высушен.
Липосомальная форма амидированного по C‑концу 24-членного пептида была получена методом пассивной загрузки [18], с экструзией – пропусканием дисперсии мультиламеллярных везикул фосфатидилхолина и пептида в стерильном PBS через поликарбонатный фильтр с размером пор 100 нм. Размер частиц определяли методом светодинамического рассеяния (дополнительные материалы, рис. S4 ), он составил 160 ± 20 нм при концентрации пептида 1 мг/мл и степени включения ~80%. Степень включения пептида в липосомы определяли методом гель-проникающей хроматографии на сефадексе G-25 с элюцией ФСБ по количеству элюировавшегося свободного пептида. Измерение размеров частиц липосом с включенным пептидом показало их стабильность в течение трех месяцев. В течение этого периода не обнаружено формирования осадка, образующегося при разрушении липосом.
Иммуногенность препаратов на основе 24-членного пептида. Сравнительный анализ иммуногенности полученных препаратов на основе 24-членного пептида проводили на модели лабораторных мышей (сток CD-1). Животных опытных групп (n = 24, по 6 на каждое вещество) иммунизировали индивидуальным препаратом в дозе 100 мкг на мышь: 1) синтетическим пептидом, 2) дипальмитоильным липопептидом, 3) пептидом с неполным адъювантом Фрейнда (НАФ), 4) липосомальной формой пептида (пептид в липосомах). Применяли трехкратную схему иммунизации с интервалом в две недели. Животным контрольной группы (n = 6) вводили по той же схеме физиологический раствор. Через 10 дней после последней иммунизации проводили эвтаназию мышей, забор селезенки и крови, определяли гуморальный иммунный ответ и продукцию цитокинов: IFN-γ и IL-2.
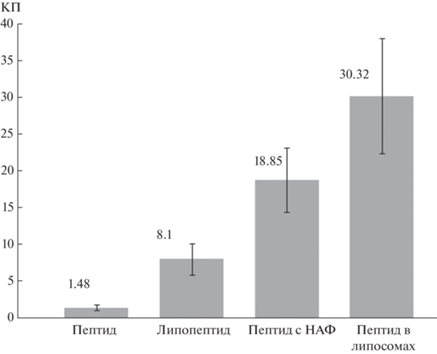
Все вводимые препараты вызывали формирование B-клеточного ответа у лабораторных мышей (рис. 2). В течение всего периода наблюдения после иммунизации снижения веса животных и изменения общего состояния не отмечено, что говорит об отсутствии явного токсического эффекта у исследуемых препаратов. B-клеточный ответ был минимальным на свободный 24-членный пептид, в 5.5 раз выше на липопептид, в 12.7 раз выше на пептид с НАФ и в 20 раз выше на пептид в липосомах. Таким образом, максимальный В-клеточный ответ был зафиксирован у мышей, иммунизированных пептидом в липосомах, однако внутри групп имелись индивидуальные колебания в интенсивности иммунного ответа.
Рис. 2.
Результат ИФА сывороток мышей, иммунизированных препаратами: пептид, липопептид, пептид с неполным адъювантом Фрейнда, пептид в липосомах. По оси ординат отмечена шкала единиц КП (коэффициент позитивности). КП – это отношение OD образца сыворотки крови к пороговому значению OD.
Результаты анализа продукции IFN-γ и IL-2 представлены на рис. 3. Максимальный уровень выработки IFN-γ среди исследуемых препаратов был зафиксирован у мышей, иммунизированных 24-членным пептидом в липосомах. Только при использовании этого препарата из группы исследуемых веществ показано достоверное превышение (в 4.6 раза) в выработке IFN-γ относительно контрольной группы животных (р < 0.01). Максимальный уровень выработки IL-2 среди исследуемых препаратов был зафиксирован у мышей, иммунизированных пептидом с НАФ (превышение в 2.9 раза относительно контрольной группы), однако отличия от контрольной группы в выработке IL-2 не были статистически достоверными (p > 0.05).
Рис. 3.
Результаты анализа продукции IL-2 и IFN-γ Т-клетками иммунизированных мышей и контрольных животных (физиологический раствор). На оси абсцисс отмечены вещества, вводимые животным. * Достоверное отличие от контрольной группы (p < 0.02).
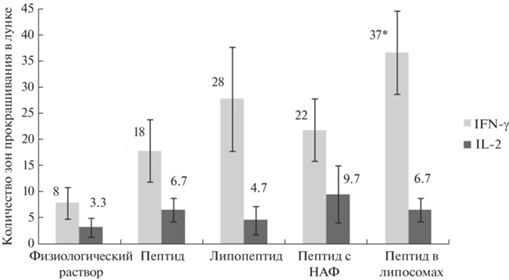
Уровень продукции цитокинов Т-лимфоцитами мышей, иммунизированных липопептидом, показывает, что конъюгация 24-членного пептида с 1,3-(дипальмитоиламино)пропан-2-О-сукцинатом в незначительной степени усиливает иммунный ответ относительно исходного пептида.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры 1Н-ЯМР регистрировали на импульсном ЯМР-спектрометре DPX-300 (Bruker, Германия) с рабочей частотой 300 МГц и записывали в дейтерированных растворителях с тетраметилсиланом в качестве внутреннего стандарта. Спектры в видимой и ультрафиолетовой областях регистрировали на спектрофотометре UV-1601 (Shimadzu, Япония). Размер частиц определяли методом динамического светорассеяния на приборах Delsa Nano C (Beckman Coulter Inc., США) и Zetasizer Nano ZS (Malvern, США). Для регистрации результатов ИФА использовали микропланшетный анализатор (фотометр) StatFax 3200 (Awareness Technology Inc., США). Результаты анализа ELISpot регистрировали с помощью прибора AID ELISpot Reader (Autoimmun Diagnostika GmbH, Германия). Для отдельных стадий ИФА и ELISpot использовали термостатируемый инкубатор-шейкер (Biosan, Латвия). Липосомы получали с помощью миниэкструдера LiposoFast basic Avestin (США).
Реактивы. В работе использовали диметилформамид (о.с.ч.) (Компонент-Реактив, Россия); хлороформ (х.ч.), метанол (х.ч.), диэтиловый эфир (ч.д.а.), хлористый метилен (х.ч.), пиридин (ч.д.а.) (Химмед, Россия). Хлороформ очищали перегонкой над хлористым кальцием, хлористый метилен перегоняли над пентоксидом фосфора, диэтиловый эфир – над гидроксидом калия. DMF очищали молекулярными ситами. В работе использовали следующие реагенты: этиловый эфир циангидроксииминоацетата (Oxyma Pure), 2,4,6-коллидин, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU) (Chempep, США); 4-диметиламинопиридин (DMAP), янтарный ангидрид, TFA (Sigma-Aldrich, США); соляную кислоту (Химмед, Россия); уксусную кислоту, триизопропилсилан (TIS), тиоанизол, соевый фосфатидилхолин (Lipoid GmbH, Германия). 1,3-(Дипальмитоиламино)пропан-2-ол был получен в лаборатории ранее по описанной методике [15]. Пептид VIVGRIILSGRPAVIPDREVLYRK-NH2 был синтезирован ранее на амидной смоле Ринка [13]; часть пептида не удаляли со смолы и не снимали защитные группы с боковых функциональных групп аминокислотных остатков.
Хроматография. Тонкослойную хроматографию проводили на пластинках Sorbfil (Сорбполимер, Россия). Обнаружение пятен на хроматограммах осуществляли в УФ-свете, обработкой 10%-ной H2SO4 в метаноле, комплексом [ФМК + + Ce2SO4], нингидрином с последующим нагреванием до 150°С во всех случаях.
Колоночную хроматографию проводили на Silica gel (0.040–0.063 мм) (Merck, Германия). Очистку липопептида производили методом полупрепаративной офВЭЖХ на хроматографе Agilent 1100 с использованием диодно-матричного детектора. Применяли колонку Reprosilpur Basic C18 (250 × 4.6 мм I.D., S – 5 мкм), элюент – вода/ацетонитрил с 0.1% TFA при градиенте концентрации ацетонитрила 5–100% за 20 мин, скорость потока 1 мл/мин, tR = 18.4 мин. Оптическое поглощение элюента при аналитической и препаративной ВЭЖХ измеряли в диапазоне длин волн 205–220 нм.
Синтез 1,3-(дипальмитоиламино)пропан-2-О-сукцината. Раствор 200 мг (0.36 ммоль) 1,3-(дипальмитоиламино)пропан-2-ола, 88 мг (0.72 ммоль) DMAP, 143 мг (1.42 ммоль) янтарного ангидрида в пиридине (15 мл) кипятили в течение 8 ч, разбавляли хлороформом (70 мл), затем полученный раствор промывали 0.1 М раствором НCl (1 × 75 мл) до слабокислой реакции, органическую фазу промывали водой (2 × 75 мл), сушили над сульфатом натрия, упаривали, целевое вещество выделяли методом колоночной адсорбционной хроматографии на силикагеле, элюируя системой растворителей хлороформ–метанол (2.5→5% метанола).
Выход 90 мг (37%), Rf 0.43 (хлороформ : метанол, 8.5 : 1.5), Тпл 122–124°С (кристаллизация из гексана).
1Н-ЯМР-спектр (DMSO-d6, δ, м.д.): 0.85 (т, 6Н, 2СН3, Pam), 1.21–1.28 (м, 48Н, 24CH2, Pam), 1.44–1.52 (м, 4Н, 2β-СН2, Pam), 2.02–2.18 (м, 4Н, 2α-СН2, Pam), 2.38–2.46 (м, 4Н, 2СН2, Suc), 4.07–4.34 (м, 4Н, 2СН2, проп), 4.71–4.93 (м, 1Н, СН, проп), 6.47–6.69 (м, 2Н, 2NH).
Синтез конъюгата 1,3-(дипальмитоиламино)пропан-2-О-сукцината с амидированным по С-концу 24-членным пептидом (липопептида). К связанному со смолой Ринка защищенному по боковым функциональным группам пептиду VIVGRIILSGRPAVIPDREVLYRK (0.08 ммоль) добавляли предварительно активированный по карбоксильной группе сочетанием Oxyma Pure, HBTU и 2,4,6-коллидина 1,3-(дипальмитоиламино)пропан-2-О-сукцинат (0.2 ммоль), перемешивали смесь в течение 16 ч, затем промывали ДМФА и хлористым метиленом. Липопептид отщепляли от смолы Ринка и деблокировали его боковые функциональные группы действием трифторуксусной кислоты с добавлением по 2.5% скэвенджеров – тиоанизола, триизопропилсилана и воды, далее смывали с фильтра из пористого стекла хлористым метиленом, концентрировали на роторном испарителе, осаждали из хлористого метилена диэтиловым эфиром, отделяя осадок центрифугированием, высушивали и выделяли с помощью офВЭЖХ.
Выход 0.054 г (20%); ESI-MS, m/z: найдено [M + 3H]3+ 1123.8; [M + 4H]4+ 843.1; [M + 5H]5+ 674.6; вычислено Mr (C163H288N40O35) 3368.34.
Получение липосомальной формы 24-членного пептида VIVGRIILSGRPAVIPDREVLYRK-NH2. Раствор 34 мг фосфатидилхолина в хлороформе упаривали на роторном испарителе для получения липидной пленки, добавляли 2 мг 24-членного пептида, растворенного в стерильном PBS (рН 7.4, 1 мг/мл), и встряхивали на вортексе для получения солюбилизированных с пептидом мультиламеллярных везикул [19]. Полученные мультиламеллярные везикулы пропускали через поликарбонатный фильтр (размер пор 100 нм) ручного экструдера 21 раз для получения однослойных липосом с включенным пептидом. Полученные липосомы пропускали через колонку с сефадексом G25 (эксклюзионную хромотографию проводили на колонке Illustra NAP-5 GE Healthcare Life Science (Великобритания) с сорбентом Sephadex G25 Medium), элюируя PBS, и определяли степень включения пептида в липосомы (по суммарной оптической плотности фракций, соответствующих свободному пептиду, рассчитывали количество и долю не включенного в липосомы пептида). На колонку наносили 0.5 мл раствора липосомальной формы пептида с концентрацией в нем пептида 1 мг/мл, после выхода фракций липосом с включенным пептидом собрали две фракции свободного пептида объемом по 2 мл (спектрофотометрически при 210 нм определена их оптическая плотность: 0.291 и 0.125). Затем по закону Бугера–Ламберта–Бера определяли концентрацию пептида в этих фракциях и рассчитывали эффективность включения (ЭВ) по формуле:
Размер липосом с включенным пептидом определяли методом динамического рассеяния света. Перед иммунизацией пептид в липосомах пропускали через стерилизующий фильтр 200 нм.
Иммунизация животных. Для иммунизации использовали лабораторных мышей-альбиносов (сток CD-1, питомник ФГБУН НИЦБМТ ФМБА России, филиал “Андреевка”, возраст 3 недели, вес 18–20 г, самки, n = 30). Животные были разделены на 5 групп по 6 особей. Каждая группа была иммунизирована индивидуальным препаратом: пептидом, липопептидом, пептидом с неполным адъювантом Фрейнда, пептидом в липосомах. Перед иммунизацией липопептид (1 мг) растворяли в 100 мкл 10%-ного DMSO/DPBS (раствор Дульбекко), после чего доводили до 1 мл DPBS. Доза антигенной нагрузки составляла 100 мкг на мышь для всех препаратов. Пятая группа была контрольной – животные получали инъекцию стерильного физиологического раствора (100 мкл). При иммунизации мышей был выполнен легкий наркоз медицинским эфиром. Введение образцов было выполнено подкожно в верхнюю часть спины. Применяли трехкратную схему иммунизации с интервалом в две недели. Для выявления наличия явных признаков токсического эффекта от вводимых соединений осуществляли ежедневный осмотр общего состояния мышей и взвешивание: после первой инъекции каждые 3 дня, после второй – каждые 7-е сутки. Через 10 дней после последней иммунизации была выполнена эвтаназия мышей, забор селезенки и крови (после цервикальной дислокации и декапитации).
Клетки селезенки мышей культивировали, используя стерильные планшеты (Nunc, Дания), среду RPMI-1640 с аланилглутамином (ПанЭко, Россия) и сыворотку крови эмбриональную телячью (HyClone, США). Для подсчета клеток использовали набор Cell Counting Kit-8 (Sigma-Aldrich, США), для стимуляции клеток – набор PepTivator HCV 1b NS4 (Meltenyi Biotec, Германия).
Иммуноферментный анализ. Пептид, растворенный в 0.05 М карбонатно-бикарбонатном буфере (pH 9.25) в концентрации 0.01 мг/мл, сорбировали в течение 16 ч при температуре 4°C в лунки полистирольного планшета (Nunc, Дания). После блокирования свободных зон лунок в течение 1 ч при 37°C бычьим сывороточным альбумином в PBS (1 мг/мл; Sigma, США) проводили иммуноферментный анализ по методике, описанной в работе [13]. По завершении реакции регистрировали оптическую плотность (OD) в лунках на планшетном спектрофотометре при длине волны 450 нм. Статистически достоверно отличающимися от контроля считали величины OD, превышающие сумму среднего арифметического OD лунок, в которых анализировали образцы от контрольной группы мышей, и тройного стандартного отклонения.
Выделение лимфоцитов из селезенки мышей. Селезенку подопытных мышей гомогенизировали в DPBS (Thermo Fisher Scientific/Gibco, Великобритания) в конической пробирке с пластиковым пестиком. К гомогенату добавляли коллагеназу (100 ед./мл) и 3 мМ CaCl2, инкубировали 3 ч при 37°С, периодически перемешивая. Клеточную суспензию фильтровали через стерильное сито с размером пор 30 мкм. Эритроциты удаляли с помощью лизирующего раствора следующего состава: 150 мМ хлорид аммония (11.85 г/л), 10 мМ бикарбонат калия, 0.1 мМ ЭДТА, pH 7.2–7.4. Отмывали клетки DPBS с 3-кратным осаждением центрифугированием в течение 5 мин при 300 g. Полученные образцы содержали спленоциты и Т-лимфоциты. После этого клетки подсчитывали в камере Горяева с окрашиванием трипановым синим, суспендировали в среде RPMI 1640 c аланилглутамином и 10% эмбриональной телячьей сыворотки, затем сеяли в 96-луночный планшет для ELISpot в концентрации 1 × 105–2.5 × × 105 клеток на лунку. Клетки стимулировали пептидом VIVGRIILSGRPAVIPDREVLYRK-NH2 (10 мкг/мл) и пептидами из набора PepTivator HCV 1b NS4 (10 мкг для стимуляции 1 × 108 клеток). Неспецифическую стимуляцию клеток проводили смесью форбол-12-миристат-13-ацетата (20 нг/мл; Invitrogen, США) и иономицина (1 мкг/мл; Invitrogen, США).
Методика выполнения ELISpot. Для оценки продукции IFN-γ и IL-2 использовали тест-системы Mouse IL-2 ELISPOT Kit и Mouse Interferon gamma ELISPOT Kit (Abcam, Великобритания). Непосредственно перед экспериментом в стерильных условиях в лунки планшета добавляли клетки и оставляли в CO2-инкубаторе на 15 ч. Затем неадсорбированные клетки удаляли из планшета и отмывали лунки 4 раза по 100 мкл PBS (pH 7.4) с 0.1% Tween 20 (с инкубацией 10 мин при 4°С после добавления PBS). Далее добавляли по 100 мкл антицитокиновых антител, конъюгированных с авидином, и инкубировали 1.5 ч при комнатной температуре. По завершении инкубации удаляли жидкость из планшета и добавляли по 100 мкл PBS (pH 7.4) с 0.1% Tween 20 (отмывка), повторяли 4 раза по 100 мкл (с интервалом 5 мин). Добавляли по 100 мкл конъюгата стрептавидина с щелочной фосфатазой и инкубировали 1 ч при комнатной температуре. Промывали 4 раза PBS (pH 7.4) с 0.1% Tween 20 по 100 мкл с интервалом 5 мин. Снимали с планшета верхнюю и нижнюю крышки и промывали в струе дистиллированной воды 3 раза. Удаляли избыток воды на фильтровальной бумаге и добавляли субстрат щелочной фосфатазы. Инкубировали 10–15 мин при комнатной температуре до появления пятен без фона. Затем промывали в струе дистиллированной воды 3 раза. Остатки воды удаляли на фильтровальную бумагу, планшет высушивали. Для более полного проявления пятен планшет оставляли в холодильнике при 4°С на ночь. Далее с использованием автоматического считывающего устройства AID ELISpot Reader регистрировали прокрашенные зоны цитокинов.
Расчет статистической достоверности различий выполняли с использованием t-критерия Стьюдента и χ2 Пирсона (статистически значимыми считали отличия при p < 0.02).
ЗАКЛЮЧЕНИЕ
При анализе влияния липидного компонента на иммуногенность синтетического 24-членного пептида VIVGRIILSGRPAVIPDREVLYRK-NH2, фрагмента антигена NS4A ВГС, содержащего B- и Th-эпитопы, обнаружено значительное усиление иммуногенности при включении пептида в наноразмерные фосфатидилхолиновые липосомы. Липопептид, состоящий из 24-членного пептида и 1,3-(дипальмитоиламино)пропан-2-О-сукцината, был менее иммуногенным, чем немодифицированный пептид с неполным адъювантом Фрейнда.
Формирование высокого уровня иммунной активности после иммунизации 24-членным пептидом в липосомах показывает, что подобный препарат как компонент кандидатной вакцины от гепатита С перспективен для дальнейших исследований.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Н.И. Журило за получение ЯМР-спектров, В.А. Щелконогову за содействие в получении липосомальной формы пептида и исследовании характеристик пептида в липосомах (работа выполнена при использовании оборудования Центра коллективного пользования РТУ МИРЭА (соглашение № 075-15-2021-689 от 01.09.2021, уникальный идентификационный номер 2296.61321Х0010)), И.А. Вострову, И.Е. Соколову, Р.Г. Вахреневу и Е.А. Ручко за анализ реакционной смеси и выделение липопептида методом офВЭЖХ, А.В. Панову и Е.Я. Табор за содействие в приобретении необходимых тест-систем.
Список литературы
Колесанова Е.Ф., Соболев Б.Н., Мойса А.А., Егорова Е.А., Арчаков А.И. // Биомед. химия. 2015. Т. 61. С. 254–264. https://doi.org/10.18097/PBMC20156102254
Мойса А.А., Колесанова Е.Ф. // Биомед. химия. 2011. Т. 57. С. 14–30.
Рыжиков А.Б., Рыжиков Е.А., Богрянцева М.П., Усова С.В., Даниленко Е.Д., Нечаева Е.А., Пьянков О.В., Пьянкова О.Г., Гудымо А.С., Боднев С.А., Онхонова Г.С., Слепцова Е.С., Кузубов В.И., Рыднюк Н.Н., Гинько З.И., Петров В.Н., Моисеева А.А., Торжкова П.Ю., Пьянков С.А., Трегубчак Т.В., Антонец Д.В., Гаврилова Е.В., Максютов Р.А. // Инфекция и иммунитет. 2021. Т. 11. № 2. С. 283–296. https://doi.org/10.15789/2220-7619-ASB-1699
Schromm A.B., Howe J., Ulmer A.J., Wiesmuller K.H., Seyberth T., Jung G., Rössle M., Koch M.H.J., Gutsmann T., Brandenburg K. // J. Biol. Chem. 2007. V. 282. P. 11030–11037. https://doi.org/10.1074/ jbc.M700287200
Hopp T.P. // Mol. Immunol. 1984. V. 21. P. 13–16. https://doi.org/10.1016/0161-5890(84)90084-1
Lex A., Wiesmüller K.H., Jung G., Bessler W.G. // J. Immunol. 1986. V. 137. P. 2676–2681.
Mühlradt P.F., Kieß M., Meyer H., Süßmuth R., Jung G. // J. Exp. Med. 1997. V. 185. P. 1951–1958. https://doi.org/10.1084/jem.185.11.1951
Moyle P.M., Toth I. // Curr. Med. Chem. 2008. V. 15. P. 506–516. https://doi.org/10.2174/092986708783503249
Schwendener R.A., Ludewig B., Cerny A., Engler O. // In: Liposomes. Methods in Molecular Biology (Methods and Protocols). V. 605 / Ed. Weissig V. New York: Humana Press, 2010. P. 163–175. https://doi.org/10.1007/978-1-60327-360-2_11
Huang W.-C., Deng B., Lin C., Carter K.A., Geng J., Razi A., He X., Chitgupi U., Federizon J., Sun B., Long C.A., Ortega J., Dutta S., King C.R., Miura K., Lee S.-M., Lovell J.F. // Nat. Nanotechnol. 2018. V. 13. P. 1174–1181. https://doi.org/10.1038/s41565-018-0271-3
Gerlach J.T., Ulsenheimer A., Grüner N.H., Jung M.-C., Schraut W., Schirren C.-A., Heeg M., Scholz S., Witter K., Zahn R., Vogler A., Zachoval R., Pape G.R., Diepolder H.M. // J. Virol. 2005. V. 19. P. 12425–12433. https://doi.org/10.1128/JVI.79.19.12425-12433.2005
Pereboeva L.A., Pereboev A.V., Morris G.E. // J. Med. Virol. 1998. V. 56. P. 105–111. https://doi.org/10.1002/(sici)1096-9071(199810)56: 2<105::aid-jmv1>3.0.co;2-c
Белявцев А.Н., Мельникова М.В., Шастина Н.С., Вахренев Р.Г., Шевченко Н.Г., Сапронов Г.В., Колесанова Е.Ф., Николаева Л.И. // Биоорг. химия. 2021. Т. 47. С. 341–347. [Belyavtsev A.N., Melnikova M.V., Shastina N.S., Vachrenev R.G., Shevchenko N.G., Sapronov G.V., Kolesanova E.F., Nikolaeva L.I. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 713–718.] https://doi.org/10.1134/S1068162021030031
Semmo N., Klenerman P. // World J. Gastroenterol. 2007. V. 13. P. 4831–4838. https://doi.org/10.3748/wjg.v13.i36.4831
Mergen F., Lambert D.M., Poupaert J.H., Bidaine A. // Chem. Phys. Lipids. 1991. V. 59. P. 267–272.
Zeng W., Eriksson E., Chua B.Y., Grollo L., Jackson D. // Amino Acids. 2010. V. 39. P. 471–480. https://doi.org/10.1007/s00726-009-0463-0
Sarwar M.T., Kausar H., Ijaz B., Ahmad W., Ansar M., Sumrin A., Ashfaq U.A., Asad S., Gull S., Shahid I., Hassan S. // Virol. J. 2011. V. 8. P. 317. https://doi.org/10.1186/1743-422X-8-317
Антонова Н.А., Сорокоумова Г.М., Федорова Т.Н., Стволинский С.Л., Абаимов Д.А., Попенко В.И., Швец В.И. // Тонкие химические технологии. 2016. Т. 11. С. 55–62. https://doi.org/10.32362/2410-6593-2018-13-2-55-62
Щелконогов В.А., Сорокоумова Г.М., Баранова О.А., Чеканов А.В., Клочкова А.В., Казаринов К.Д., Соловьева Э.Ю., Федин А.И., Швец В.И. // Биомед. химия. 2016. Т. 62. № 5. С. 577–583. https://doi.org/10.18097/PBMC20166205577
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. S1 - Рис. S4
Инструменты
Биоорганическая химия