Биоорганическая химия, 2022, T. 48, № 5, стр. 606-610
Влияние ингибиторов миозина на экспрессию механозависимых генов в раннем развитии шпорцевой лягушки
П. А. Филенко 1, А. А. Чеченина 1, А. Г. Зарайский 1, Ф. М. Ерошкин 1, *
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: xenopus.fe@gmail.com
Поступила в редакцию 13.12.2021
После доработки 16.12.2021
Принята к публикации 24.12.2021
- EDN: YMSDRK
- DOI: 10.31857/S0132342322040091
Аннотация
Механические силы, возникающие в развивающихся зародышах, способны распространяться в эмбрионах на значительные расстояния и влиять на экспрессию генов. Изучение механозависимой транскрипции – актуальная задача современной биологии развития. Один из подходов к решению этой задачи – применение низкомолекулярных ингибиторов миозина. В настоящей работе мы изучили методом ОТ-ПЦР влияние четырех ингибиторов миозина – блеббистатина, S-нитроблеббистатина, ML-9 и и 2,3-бутандион монооксима – на экспрессию восьми механозависимых генов в ранних зародышах шпорцевой лягушки Xenopus laevis. При воздействии ингибиторов миозина наблюдалось изменение уровня экспрессии четырех механозависимых генов: gsc, myh6, Xbra и xmc. Полученные результаты свидетельствуют в пользу того, что механические силы могут играть роль в передне-задней разметке зародыша X. laevis, регулируя экспрессию соответствующих генов.
ВВЕДЕНИЕ
Механические силы играют важную роль в эмбриогенезе, выступая связующим звеном между морфогенезом и клеточной дифференцировкой [1, 2]. В ходе эмбрионального развития они возникают при направленном перемещении клеток внутри зародыша [3–5]. Формируя градиенты, механические напряжения могут служить как своего рода морфогены, влияя на транскрипцию генов. Поиск и изучение механозависимых генов – важные задачи современной биологии развития.
Цель настоящего исследования – подтвердить механозависимый характер регуляции в целых ранних зародышах шпорцевой лягушки Xenopus laevis тех генов, которые ранее были идентифицированы как механозависимые на модели эмбриональных эксплантатов X. laevis.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами была разработана методика искусственного растяжения фрагментов эмбриональных тканей (эксплантатов) шпорцевой лягушки X. laevis и с помощью высокопроизводительного секвенирования проведено сравнение транскриптомов растянутых и контрольных эксплантатов (неопубликованные данные). Было обнаружено, что растяжение повышает экспрессию генов Xbra, cdx4, myh6 и xmc, которые в норме экспрессируются в задней части зародыша, испытывающей наибольшие механические напряжения, и понижает экспрессию генов CD82, cebpa, gsc и otx2a, которые в норме экспрессируются в головной части, где механические напряжения отсутствуют [6]. Известно, что данные гены – ключевые регуляторы развития соответствующих отделов эмбриона [7–9]. Это подтверждает нашу гипотезу о роли градиента механических сил как регулятора передне-задней разметки зародыша [2]. Однако эксперименты на модели эмбриональных эксплантатов позволяют судить о роли механических натяжений в нормальном развитии лишь косвенно. Помочь ответить на этот вопрос могли бы эксперименты типа “loss-of-function”, т.е. с ослаблением определенной функции, в нашем случае – механических напряжений.
Поскольку возникновение и распространение механических сил опосредуется перестройкой цитоскелета и актин-миозиновыми сокращениями [10], один из способов сброса механических напряжений в зародыше – применение низкомолекулярных ингибиторов миозина. При этом логично ожидать, что экспрессия механоактивируемых генов будет падать при уменьшении напряжений в зародыше, а механоингибируемых – возрастать. Данный метод успешно применялся в работах по изучению механозависимых генов на зародышах Danio rerio [11] и Nematostella vectensis [12]. Для обработки зародышей X. laevis нами были использованы четыре ингибитора миозина: (–)-блеббистатин, S-нитроблеббистатин, ML-9 и 2,3-бутандион монооксим (БДМ). Данные ингибиторы различаются по механизму действия: (–)-блеббистатин и S-нитроблеббистатин блокируют активируемую актином АТРазу немышечных миозинов [13]; ML-9 блокирует киназу легкой цепи миозина [14]; БДМ ингибирует АТРазную активность моторных доменов миозина II скелетных мышц [15]. Влияние ингибиторов миозина на экспрессию генов оценивали с помощью количественной ОТ-ПЦР.
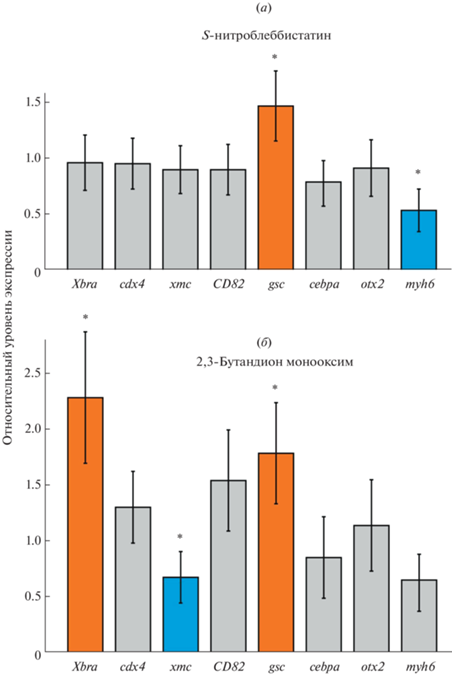
Проведенные эксперименты показали, что воздействие (–)-блеббистатином и ML-9 не влияет достоверно на экспрессию изучаемых генов (данные не приведены), что может объясняться особенностями выбранного модельного организма. Воздействие S-нитроблеббистатином увеличивает экспрессию gsc и уменьшает экспрессию myh6 (рис. 1а). Воздействие БДМ увеличивает экспрессию Xbra и gsc и уменьшает экспрессию xmc (рис. 1б). Из полученных результатов можно сделать несколько выводов. Во-первых, изменения экспрессии генов gsc, myh6 и xmc совпадают с ожидаемыми, что подтверждает их механозависимую природу. Во-вторых, несколько неожиданная активация экспрессии Xbra под действием БДМ, возможно, объясняется побочными эффектами БДМ [16]. В-третьих, различия в эффектах разных ингибиторов миозина указывают на различия в механизмах регуляции разных генов.
Рис. 1.
Влияние S-нитроблеббистатина (а) и 2,3-бутандион монооксима (б) на экспрессию изучаемых генов в ранних зародышах шпорцевой лягушки X. laevis. Уровень экспрессии в контрольных (необработанных) зародышах принят за единицу. Звездочкой обозначено достоверное изменение уровня экспрессии соответствующих генов (p > 0.95). Оранжевые столбцы обозначают активируемые гены, синие – ингибируемые. Планки погрешности отображают стандартное отклонение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления растворов блеббистатин (кат. № 203391; Sigma-Aldrich, США), S-нитроблеббистатин (кат. № 13891; Cayman Chemichal, США) и ML-9 (кат. № C1172; Sigma-Aldrich, США) разводили в DMSO до конечной концентрации 10 мМ. Эмбрионы X. laevis инкубировали до стадии ранней гаструлы в растворе 0.1× MMR (модифицированный раствор Рингера) по стандартной методике [9], затем в среду добавляли ингибиторы миозина в конечной концентрации 50 мкМ ((–)-блеббистатин, S-нитроблеббистатин и ML-9) и 25 мМ (БДМ (кат. № 31550; Sigma-Aldrich, США)). Чтобы избежать выпадения в осадок блеббистатина, раствор готовили по методике Swift et al. [17]: в темноте, с использованием предварительно нагретого до 42–43°C раствора 0.1× MMR. Раствор БДМ готовили непосредственно перед применением. После добавления ингибиторов эмбрионы инкубировали 6 ч при комнатной температуре в темноте. Затем из них выделяли тотальную РНК c использованием реагента ExtractRNA (кат. № BC032; Евроген, Россия). Изменения в экспрессии генов количественно оценивали при помощи ОТ-ПЦР в реальном времени в присутствии интеркалирующего красителя SybrGreen по ранее опубликованной методике [18], последовательности праймеров приведены в табл. 1. Каждый эксперимент проводили в 6–12 повторностях, статистическую достоверность результатов оценивали по t-критерию Стьюдента (p > 0.95).
Таблица 1.
Последовательности праймеров для ОТ-ПЦР в реальном времени
| Мишень | Праймер | Последовательность (5'–3') |
|---|---|---|
| ODC | ODC D ODC R |
GCCAGTTCTAACAAAGAAACCCA TCTACGATACGATCCAGCCCA |
| Xbra | Xbra D Xbra R |
TGCCTAAATAACCACAAACTTCTCC ATATAACATACTTTCTCTCCCCGT |
| cdx4 | Cdx4 D Cdx4 R |
CCCAGTTTGTGGCTGTGTTC TGGCTGGCTGGTATAAGGAG |
| myh6 | myh6 D myh6 R |
CAAACCCAGTTAGAGGCTGAGA GAGCGGTTGGCCTGACTT |
| xmc | Xmc D Xmc R |
GGATACCCTTTCCCCAACTGA TGGACAATTCTGCCTCCAGC |
| CD82 | CD82 D CD82 R |
ATCTGCCCTATGTTGGAGGTG CTGTTCTGCCCCTACTGGTC |
| cebpa | cebpa D cebpa R |
GATCCTTCCAGTTCGGACCA GGTCGGGCCTCTGTGTACTT |
| gsc | Gsc D Gsc R |
TGGCAAGGAGGGTTCATCT ATTCCACTTTTGGGCATTTTCT |
| otx2a | Otx2a D Otx2a R |
ATTTTACCCACACAGAACCCT CTCCATCTTTTATCCACCTGCT |
ЗАКЛЮЧЕНИЕ
Таким образом, методом ОТ-ПЦР нами изучено влияние влияние четырех ингибиторов миозина – блеббистатина, S-нитроблеббистатина, ML-9 и 2,3-бутандион монооксима – на экспрессию восьми механозависимых генов в ранних зародышах шпорцевой лягушки X. laevis. Эти гены ранее были идентифицированы нами как механозависимые на модели эмбриональных эксплантатов X. laevis. В настоящей работе показано, что при воздействии ингибиторов миозина изменялся уровень экспрессии четырех генов: gsc, myh6, Xbra и xmc. Важно отметить, что головные, механически ингибируемые гены (CD82 и gsc) активируются при фармакологической релаксации, в то время так туловищные, механически активируемые гены (myh6 и xmc), наоборот, подавляются, что логично согласуется с прочими данными и подтверждает механозависимый характер регуляции этих генов в целых ранних зародышах X. laevis. Полученные результаты подкрепляют наше предположение о роли механических натяжений в передне-задней разметке зародыша [2].
Список литературы
Agarwal P., Zaidel-Bar R. // Curr. Opin. Cell Biol. 2021. V. 68. P. 1–9. https://doi.org/10.1016/j.ceb.2020.08.007
Eroshkin F.M., Zaraisky A.G. // Genesis. 2017. V. 55. P. 4. https://doi.org/10.1002/dvg.23026
Moore S.W., Keller R.E., Koehl M.A. // Development. 1995. V. 121. P. 3131–3140. https://doi.org/10.1242/dev.121.10.3131
Sutlive J., Xiu H., Chen Y., Gou K., Xiong F., Guo M., Chen Z. // Small. 2021. P. e2103466. https://doi.org/10.1002/smll.202103466
Бредов Д.В., Володяев И.В., Лучинская Н.Н. // Онтогенез. 2021. Т. 52. С. 317–328. [Bredov D.V., Volodyaev I.V., Luchinskaya N.N. // Russ. J. Develop. Biol. 2021. V. 52. P. 277–286.] https://doi.org/10.31857/S0475145021050025
Ерошкин Ф.М., Кремнев С.В., Ермакова Г.В., Зарайский А.Г. // Онтогенез. 2018. Т. 49. С. 361–371. [Eroshkin F.M., Kremnev S.V., Ermakova G.V., Zaraisky A.G. // Russ. J. Develop. Biol. 2018. V. 49. P. 362–369.] https://doi.org/10.1134/S1062360418060024
Isaacs H.V., Andreazzoli M., Slack J.M. // Evol. Dev. 1999. V. 1. P. 143–152. https://doi.org/10.1046/j.1525-142x.1999.99020.x
Latinkic B.V., Smith J.C. // Development. 1999. V. 126. P. 1769–1779. https://doi.org/10.1242/dev.126.8.1769
Ерошкин Ф.М., Байрамов А.В., Ермакова Г.В., Зарайский А.Г., Мартынова Н.Ю. // Биоорг. химия. 2018. Т. 44. С. 303–315. [Eroshkin F.M., Bayramov A.V., Ermakova G.V., Zaraisky A.G., Martynova N.Y. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 310–321.] https://doi.org/10.1134/S1068162018030032
Discher D.E., Janmey P., Wang Y.L. // Science. 2005. V. 310(5751). P. 1139–1143. https://doi.org/10.1126/science.1116995
Brunet T., Bouclet A., Ahmadi P., Mitrossilis D., Driquez D., BrunetA., Henry L, Serman F., Béalle G., Ménager C., Dumas-Bouchiat F., Givord D., Yanicostas C., Le-Roy D., Dempsey N.M., Plessis A., Farge E. // Nat. Comm. 2013. V. 4. P. 2821. https://doi.org/10.1038/ncomms3821
Pukhlyakova E., Aman A.J., Elsayad K., Technau U. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. P. 6231–6236. https://doi.org/10.1073/pnas.1713682115
Straight A.F., Cheung A., Limouze J., Chen I., Westwood N.J., Sellers J.R., Mitchison T.J. // Science. 2003. V. 299(5613). P. 1743–1747. https://doi.org/10.1126/science.1081412
Saitoh M., Naka M., Hidaka H. // Biochem. Biophys. Res. Comm. 1986. V. 140. P. 280–287. https://doi.org/10.1016/0006-291x(86)91087-9
Higuchi H., Takemori S. // J. Biochem. 1989. V. 105. P. 638–643. https://doi.org/10.1093/oxfordjournals.jbchem.a122717
Ostap E.M. // J. Muscle. Res. Cell Motil. 2002. V. 23. P. 305–308. https://doi.org/10.1023/a:1022047102064
Swift L.M., Asfour H., Posnack N.G., Arutunyan A., Kay M.W., Sarvazyan N. // Pflugers Arch. 2012. V. 464. P. 503–512. https://doi.org/10.1007/s00424-012-1147-2
Мартынова Н.Ю., Паршина Е.А., Ерошкин Ф.М., Зарайский А.Г. // Биоорг. химия. 2020. Т. 46. С. 396–403. [Martynova N.Y., Parshina E.A., Eroshkin F.M., Zaraisky A.G. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 530–536.] https://doi.org/10.31857/S013234232004020X
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


