Биоорганическая химия, 2022, T. 48, № 5, стр. 537-550
Синтетические антимикробные пептиды. IV. Влияние катионных групп лизина, аргинина и гистидина на антимикробную активность пептидов с “круговым” типом амфипатичности
Н. В. Амирханов 1, *, А. В. Бардашева 1, Н. В. Тикунова 1, Д. В. Пышный 1
1 ФГБУН “Институт химической биологии и фундаментальной медицины” СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 8, Россия
* E-mail: nariman@niboch.nsc.ru
Поступила в редакцию 11.03.2022
После доработки 25.03.2022
Принята к публикации 28.03.2022
- EDN: EWCIHV
- DOI: 10.31857/S0132342322050049
Аннотация
В данной работе синтезированы три новых синтетических антимикробных пептида (САМП) XFXXFFXXFF (X5F5), обладающих “круговым” (спиральным или циклическим) типом амфипатичности (КТА), содержащих катионные аминокислотные остатки аргинина, лизина или гистидина (X = Arg, Lys или His), исследована антимикробная и гемолитическая активность синтезированных пептидных препаратов. Показано, что в целом такие пептиды в сравнении с САМП XXXXXXXXXFF (X9F2), обладающими “линейным” типом амфипатичности (ЛТА), проявляют более чем в 8 раз большую антибактериальную и в ~2 разa меньшую противогрибковую активность. Выявлено, что по отношению к бактериальным клеткам Staphylococcus aureus, Escherichia coli, Salmonella enterica и Pseudomonas aeruginosa наибольшей антибактериальной активностью обладают пептиды, содержащие в качестве катионных составляющих остатки аргинина, а наименьшей – пептиды с остатками гистидина. По отношению к грибковым культурам Candida albicans, напротив, наибольшей фунгицидной активностью обладают пептиды, содержащие в качестве катионных составляющих гистидиновые остатки. Показано, что исследованные пептиды X5F5, независимо от их катионного состава, обладают повышенной гемолитической активностью (20–60% гемолиза при 500 мкМ концентрации пептидов в среде) по сравнению с пептидами, обладающими “линейным” типом амфипатичности X9F2 (не более 4% гемолиза при той же концентрации пептидов). Несмотря на свою относительно высокую гемолитическую активность, средняя бактериальная селективность исследованных пептидов X5F5 остается достаточно высокой, среднегеометрический терапевтический индекс (СГ ТИ) для которых составляет ~10, за исключением пептида H5F5, содержащего остатки гистидина (СГ ТИ = 0.5). В то же время селективность гистидин-содержащего пептида H5F5 по отношению к клеткам грибов (ТИ = 2.7) в 5 раз выше его селективности по отношению к бактериальным клеткам, но в 200 раз ниже фунгицидной селективности гистидин-содержащего пептида H9F2 (ТИ = 571.4), обладающего “линейным” типом амфипатичности. Учитывая повышенную антибактериальную активность препаратов на основе САМП X5F5 с “круговым” типом амфипатичности, для создания антибактериальных препаратов наиболее перспективны пептиды, содержащие в качестве катионных групп аминокислотные остатки аргинина (R5F5) и лизина (K5F5), а для создания противогрибковых агентов – пептиды с “линейным” типом амфипатичности, содержащие в качестве катионных групп аминокислотные остатки гистидина (Н9F2).
ВВЕДЕНИЕ
В настоящее время все более актуальным становится поиск новых типов антибиотиков (антимикробных препаратов), к которым патогенные микроорганизмы не способны были бы вырабатывать устойчивость. Перспективными в этом плане могут оказаться выявленные в природе антимикробные пептиды (АМП), синтезирующиеся в ответ на контакт с чужеродными микроорганизмами или их внедрение [1–4]. АМП – это в основном амфифильные катионные пептиды, которые воздействуют на отрицательно заряженную мембрану микробных клеток. В результате такого воздействия развитие резистентности патогенов к АМП в значительной степени затруднено, поскольку требует внесения серьезных изменений в структуру и электрофизиологические свойства их клеточной мембраны [1, 4–7].
В последнее время для исследования зависимости биологических свойств АМП от их структуры и аминокислотного состава с целью моделирования и поиска оптимальных и максимально простых по составу структур АМП с новыми улучшенными свойствами все больше используются искусственно создаваемые синтетические антимикробные пептиды (САМП) [4, 8–10], которые отличаются от природных АМП [11–14] или от их синтетических аналогов [9, 15–18] тем, что они могут быть сконструированы de novo, т.е. независимо от структуры многочисленно известных природных АМП [4, 8–10, 18–21]. Конструирование таких САМП должно быть основано на двух общих принципах воздействия АМП на микробные клетки, в частности на принципах катионности цепи и амфифильности пептида, т.е. наличия в молекуле пептида одновременно гидрофобных и гидрофильных катионных положительно заряженных групп [8, 9, 18]. Катионность цепи способствует взаимодействию с отрицательно заряженными микробными поверхностями, а гидрофобность позволяет встраиваться в микробные мембраны.
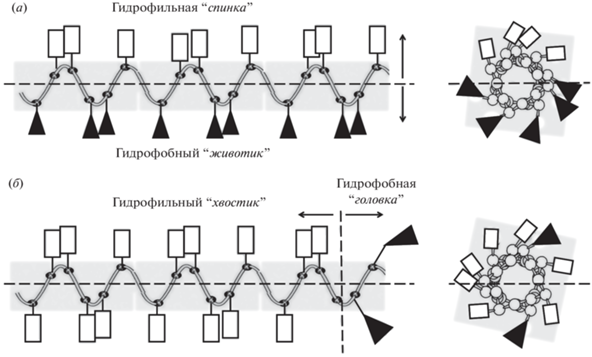
Однако для эффективного воздействия на мембраны микробных клеток наличия хаотично расположенных амфифильных групп в таких пептидах недостаточно. Существенное влияние на проявление биологических свойств может оказать последовательная линейная сгруппированность амфифильных групп вдоль цепи самой пептидной молекулы или образуемая определенным образом сосредоточенность таких групп в пространстве. Например, в зависимости от характера или типа сгруппированности и взаимного расположения полярных (гидрофильных и гидрофобных) амфифильных групп в АМП относительно друг друга в пространстве такие катионные амфифильные пептиды могут быть разделены на два подтипа или класса амфипатичности: пептиды с классическим широко известным и хорошо исследованным в литературе “круговым” (спиральным или кольцевым) типом амфипатичности (КТА) [2, 12, 13, 21, 22] (рис. 1а) и пептиды с малоизвестным “линейным” типом амфипатичности (ЛТА) (рис. 1б) [23–25]. Следует подчеркнуть, что пространственная сгруппированность амфифильных групп в САМП-КТА предполагает обязательное наличие α-спиральной структурированности самой молекулы пептида, благодаря которой на молекуле пептида образуются разделенные в пространстве своеобразные поверхности – гидрофильная “спинка” и гидрофобный “животик” (рис. 1а), тогда как в случае САМП-ЛТА достаточно лишь последовательного (линейного) расположения катионных групп друг за другом, образующих так называемую “хвостовую” катионную (гидрофильную) область пептидной молекулы и отдельную концевую часть в виде гидрофобной “головки” (рис. 1б). Оба типа таких пептидов (САМП-КТА и САМП-ЛТА) считаются амфифильными, поскольку имеют одновременно и гидрофильные, и гидрофобные группы, однако обладают различным типом амфипатичности, т.е. различным типом взаимного расположения амфифильных групп в пространстве.
Рис. 1.
Гипотетическое представление классического “кругового” (а) и “линейного” (б) типов амфипатичности α-спиральных пептидов. Прямоугольниками обозначены гидрофильные или катионные остатки аминокислот, треугольниками – гидрофобные остатки. В случае классического “кругового” типа амфипатичности (КТА) [2, 12, 13] гидрофобные и гидрофильные полярные поверхности α-спиральной молекулы пептида разделены продольной осевой линией (а). На рисунке верхняя поверхность гидрофильная, нижняя – гидрофобная (амфипатичность по типу “спинка–животик”). В случае линейного типа амфипатичности (ЛТА) гидрофобные и гидрофильные (катионные) остатки аминокислот разнесены на противоположных концах вдоль линейной оси пептида. Гидрофобная и гидрофильная полярные области в этом случае разделены поперечной линией, перпендикулярной продольной оси пептида (б), где один (левый) конец молекулы имеет гидрофильный “хвостик”, а противоположный (правый) – гидрофобную “головку”. Справа представлены двумерные проекции “спиральных колес” Шиффер и Эдмундсона [21, 22] этих же пептидов. Видно, что полярная однородность гидрофобных и гидрофильных групп в случае “линейного” типа амфипатичности (б) в проекции, представленной слева, гораздо выше, чем когда та же молекула представлена в классическом виде в виде двумерных проекций “спиральных колес” (справа).
Предполагается, что вследствие такой разной геометрической структурированности САМП-КТА и САМП-ЛТА механизмы и эффективность воздействия этих пептидов на микроорганизмы, так же как и их различная структура, могут быть разными [23, 24]. Говоря же о терапевтической значимости и токсичности таких пептидов, можно обратить внимание, например, на то, что САМП-КТА, исходя из своей структуры, должны быть более гидрофобными, а соответственно, и более токсичными по отношению к красным кровяным тельцам, т.е. обладать большей гемолитической активностью, чем САМП-ЛТА [23, 24].
Помимо разного типа амфипатичности пептидов на эффективность биологического воздействия также может оказывать влияние и их различный катионный состав [25]. Так, например, ранее было показано, что наличие различных катионных аминокислотных остатков, таких как аргинин, лизин или гистидин, в модельных САМП-ЛТА XXXXXXXXXFF (X9F2) (X = Arg, Lys или His), по-разному способно влиять на антимикробную активность самого пептида [25]. Было выявлено, что аргинин- и лизин-содержащие производные таких пептидов обладают повышенной антибактериальной активностью, а пептиды, содержащие остатки гистидина, – повышенной антигрибковой активностью [25].
Тем не менее на настоящий момент аналогичное влияние катионного аминокислотного состава на свойства САМП-КТА, обладающих классическим “круговым” типом амфипатичности, не было исследовано. В настоящей работе нам необходимо было выяснить, уникальны ли обнаруженные для САМП-ЛТА особенности их антимикробной активности в зависимости от катионного аминокислотного состава или такими же особенностями обладают и САМП-КТА. Также необходимо было сравнить биологические свойства таких типов САМП друг с другом.
Цель настоящей работы – синтез и сравнительное исследование антимикробных и гемолитических свойств, а также оценка терапевтического индекса САМП: RFRRFFRRFF, KFKKFFKKFF и HFHHFFHHFF (X5F5) (X = Arg, Lys или His), обладающих так называемым “круговым” (спиральным) типом амфипатичности, в зависимости от их катионного аминокислотного состава (аргинина, лизина или гистидина), а также сравнение полученных результатов с аналогичными данными для пептидов с “линейным” типом амфипатичности: RRRRRRRRRFF, KKKKKKKKKFF и HHHHHHHHHFF (X9F2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура, синтез и физико-химические свойства пептидов. В качестве модельных последовательностей для изучения свойств САМП-КТА и САМП-ЛТА нами были использованы соответствующие пептиды общей структуры XFXXFFXXFF (X5F5) и XXXXXXXXXFF (X9F2) (X = Arg, Lys или His), состоящие из катионных остатков аргинина, лизина или гистидина и гидрофобных остатков фенилаланина.
Последовательности пептидов X5F5 построены таким образом, что в проекциях спиральных колец [2, 21, 22] все катионные (гидрофильные) аминокислотные остатки расположены компактно на одной стороне круга, а гидрофобные остатки – на противоположной (рис. 2а), а на самой молекуле пептида эти остатки образуют разделенные друг от друга, соответственно, гидрофильные и гидрофобные поверхности (рис. 1а).
Рис. 2.
Структуры пептидов XFXXFFXXFF (X5F5) (а) и XXXXXXXXXFF (X9F2) (б) (X = Arg, Lys, His), образующих, соответственно, “круговой” и “линейный” тип амфипатичности, представленные в виде двумерных проекций “спиральных колес” Шиффер и Эдмундсона [2, 21, 22]. Видно, что последовательности аминокислот в пептиде X5F5 сконструированы таким образом, что все пять гидрофильных остатков расположены на одной стороне круговой проекции, а пять гидрофобных остатков – на противоположной стороне круга, образуя таким образом некую полярную однородность гидрофобных и гидрофильных групп, т.е. строго амфипатичную гидрофобно-гидрофильную круговую асимметрию. В проекциях пептида X9F2 амфифильные группы расположены хаотично по кругу, не образуя при этом какую-либо строгую асимметрию, характерную для “кругового” типа амфипатичности.

Напротив, в случае пептидов X9F2 с “линейным” типом амфипатичности катионные (X) и гидрофобные (F) группы в двумерных проекциях расположены хаотично по проекционному кругу (рис. 2б) и не образуют таким образом “круговой” тип амфипатичности. Полярно противоположные (гидрофобные и гидрофильные) амфифильные группы в таких пептидах компактно распределены по концам линейно вытянутой молекулы, образуя таким образом “линейный” тип амфипатичности, когда все катионные остатки сосредоточены на одном конце цепи в виде так называемого гидрофильного “хвоста”, а гидрофобные остатки – на другом конце цепи в виде так называемой гидрофобной “головки” (рис. 1б).
Синтез пептидов X5F5 и X9F2 проводили стандартным твердофазным методом с использованием Fmoc-стратегии [26] согласно ранее опубликованной схеме [25] на пептидном синтезаторе PS3. Структура синтезированных пептидов X5F5 и X9F2 (H2N-XFXXFFXXFF–C(O)NH2 и H2N-X9F2–C(O)NH2 (X = Arg, Lys, His)) включала в себя последовательность аминокислот, содержащую свободную N-концевую аминогруппу (придающую пептиду дополнительный положительный заряд), и амидную группу на C-конце цепи, нейтрализующую отрицательный заряд свободной концевой карбоксильной группы. Эффективность присоединения одного аминокислотного мономерного звена, определенная путем измерения количества удаляемых Fmoc-групп на каждой стадии конденсации, для синтезированных пептидов в среднем составляла 96.9–99.8%. Конечные выходы пептидов после деблокирования, удаления с полимерного носителя и очистки методом офВЭЖХ составили ~58–63% для САМП-KТА X5F5 и ~56–63% для САМП-ЛТА X9F2 (табл. 1). По данным офВЭЖХ и масс-спектрометрии, все выделенные пептиды соответствовали ожидаемой структуре и были гомогенными с содержанием основного вещества не менее 95%. Время удерживания на колонке при офВЭЖХ САМП-КТА X5F5 по сравнению с соответствующими САМП-ЛТА X9F2 [25] (табл. 1) было в целом закономерно выше, что связано с увеличенным содержанием в их составе гидрофобных остатков фенилаланина (пять и два остатка Phe соответственно). Согласно этим данным, в случае как САМП-КТА X5F5, так и САМП-ЛТА X9F2 наиболее гидрофобны пептиды, содержащие в качестве катионных групп остатки аргинина, затем – остатки гистидина, наименьшей гидрофобностью обладают пептиды, содержащие остатки лизина.
Таблица 1.
Физико-химические характеристики пептидов
| Пептид | Структура | Общий выход синтезаа, % | Время удерживанияб, мин | Молекулярная масса | ||
|---|---|---|---|---|---|---|
| 80% CH3CN | 50% CH3CN | расч. [M + H] | эксп. [M + H] | |||
| САМП-КТА X5F5 (X – Arg, Lys или His) | ||||||
| R5F5 | RFRRFFRRFF | 60.3 | 17.5 | 22.6 | 1533.8 | 1533.4 |
| K5F5 | KFKKFFKKFF | 57.8 | 16.9 | 21.9 | 1393.8 | 1393.2 |
| H5F5 | HFHHFFHHFF | 62.9 | 17.0 | 22.0 | 1438.6 | 1438.2 |
| САМП-ЛТА X9F2 (X – Arg, Lys или His) | ||||||
| R9F2 | RRRRRRRRRFF | 56.0 | 15.5 | 20.4 | 1717.0 | 1716.5 |
| K9F2 | KKKKKKKKKFF | 57.8 | 14.6 | 18.2 | 1465.0 | 1465.3 |
| H9F2 | HHHHHHHHHFF | 62.9 | 15.6 | 20.0 | 1545.7 | 1545.8 |
Таким образом, синтез всех пептидов X5F5 в указанном режиме проходит достаточно эффективно, как и в случае ранее полученных пептидов X9F2 [25] с относительно высокими выходами независимо от состава аминокислот в структуре пептида, а зависимость гидрофобности соответствующих пептидов от их катионного состава по данным офВЭЖХ для САМП-КТА и САМП-ЛТА может быть расположена в одном ряду следующим образом:
Антимикробная активность пептидов. Антимикробную активность пептидов X5F5 и X9F2 изучали с использованием культур микроорганизмов: грамположительных (Staphylococcus aureus) и грамотрицательных бактерий (Escherichia coli, Salmonella enterica, Pseudomonas aeruginosa), а также условно-патогенного дрожжеподобного гриба Candida albicans.
Тестируемые пептиды в конечных концентрациях 0.3–100 мкМ добавляли к культурам клеток микроорганизмов и наблюдали за ростом клеток. Влияние присутствия пептидов в культуральной среде на рост клеток контролировали измерением оптической плотности суспензии клеток при длине волны 595 нм в течение 24 ч [23–25].
Для оценки антимикробной активности исследованных пептидов были определены их минимальные подавляющие концентрации (МПК50), при воздействии которых доля микробных частиц составляла 50% от концентрации частиц в контрольной культуре [25]. Для сравнения усредненной антимикробной активности пептидных препаратов для всех протестированных культур микроорганизмов были определены их среднегеометрические (СГ) [27, 28] значения МПК50. Значения МПК50 и СГ МПК50, характеризующие антимикробную активность каждой из групп САМП-КТА X5F5 и САМП-ЛТА X9F2, представлены в табл. 2.
Таблица 2.
Антимикробная активность пептидов
| Пептид | МПК50, мкМ | СГ1, мкМ | ||||
|---|---|---|---|---|---|---|
| Candida albicans | Staphylococcus aureus | Escherichia coli | Salmonella enterica | Pseudomonas aeruginosa | ||
| САМП-КТА X5F5 (X – Arg, Lys или His) | ||||||
| R5F5 | 17.0 | 6.2 | 4.7 | 2.1 | 1.9 | 3.3 |
| K5F5 | 25.9 | 17.0 | 6.5 | 3.2 | 2.6 | 5.5 |
| H5F5 | 7.7 | 58.1 | 80.0 | 30.3 | 32.8 | 46.4 |
| СГ2, мкМ | 15.0 | 18.3 | 13.5 | 5.9 | 5.5 | 9.4а |
| САМП-ЛТА X9F2 (X – Arg, Lys или His) | ||||||
| R9F2 | 12.9 | 44.2 | 46.0 | 68.8 | 67.0 | 55.3 |
| K9F2 | 18.9 | >100.0 | 74.0 | >100.0 | 70.5 | >72.2 |
| H9F2 | 1.4 | >100.0 | >100.0 | >100.0 | >100.0 | >100.0 |
| СГ2, мкМ | 7.0 | $ \gg $76.2 | >69.8 | $ \gg $88.3 | $ \gg $77.9 | >77.8а |
| AgNO3б | 57.8 | 51.2 | 32.9 | 39.5 | 33.5 | 38.6 |
| ХГб | 33.4 | 4.1 | 6.5 | 12.0 | 10.5 | 7.6 |
СГ1 – среднегеометрические значения МПК50 по всем бактериям отдельно для каждого пептида (СГ по горизонтали, учитывая лишь бактериальные культуры).
СГ2 – среднегеометрические значения МПК50 по всем трем пептидам (X – Arg, Lys и His) для каждой культуры клеток отдельно (СГ по вертикали).
В качестве универсальных положительных контролей для сравнения относительной антимикробной активности исследуемых пептидов использовали известные антисептические препараты – водные растворы нитрата серебра (AgNO3) и хлоргексидина (ХГ). В некоторых случаях антимикробная активность исследуемых пептидов значительно превышала активность контрольных препаратов AgNO3 и ХГ, а в других – оказалась ниже. Например, в случае дрожжевой культуры C. albicans значения МПК50 для всех исследуемых пептидов – как САМП-КТА, так и САМП-ЛТА (МПК50 от 1.4 до 25.9 мкМ) – были ниже, чем МПК50 для контрольных препаратов AgNO3 и ХГ (МПК50 = 57.8 и 33.4 мкМ) (табл. 2), что указывает на большую противогрибковую активность исследуемых пептидов по сравнению с AgNO3 и ХГ. В случае же бактериальных культур, напротив, антибактериальная активность контрольных препаратов AgNO3 и ХГ была выше (СГ МПК50 = 38.6 и 7.6 мкМ), чем у исследуемых пептидов. Таким образом, AgNO3 и ХГ проявили себя в качестве удобных, универсальных и надежных положительных контролей для исследования как антимикробной, так и антигрибковой активности САМП-КТА и САМП-ЛТА.
При сравнении антибактериальной активности пептидов в зависимости от их катионного состава следует отметить, что в группе исследуемых САМП-КТА максимальным антибактериальным действием по отношению ко всем исследованным бактериальным культурам, т.е. наименьшим значением СГ МПК50, обладает аргинин-содержащий пептид R5F5 (3.3 мкМ), следующим по активности в этой группе пептидов оказался пептид K5F5 (5.5 мкМ), содержащий остатки лизина, тогда как пептид H5F5, содержащий остатки гистидина, проявил существенно меньшую активность (46.4 мкМ) (табл. 2). Аналогичная закономерность зависимости антибактериальной активности от катионного состава аминокислот наблюдается и в группе САМП-ЛТА X9F2. Таким образом, средняя антибактериальная активность для каждого из пептидов группы САМП-КТА и САМП-ЛТА в зависимости от их катионного состава понижается в ряду:
Средняя антигрибковая активность (по отношению к условно-патогенной дрожжевой культуре C. albicans) для этих же пептидов (табл. 2), напротив, в каждой группе максимальна для гистидин-содержащих пептидов H5F5 и H9F2 (МПК50 = = 7.7 и 1.4 мкМ соответственно):
Таким образом, катионный состав АМП играет существенную роль, как в случае САМП-КТА, так и САМП-ЛТА, и обусловливает различное воздействие на клетки бактерий и грибов.
В каждой группе пептидных препаратов в отдельности были определены также суммарные среднегеометрические значения МПК50 (СГ1, табл. 2) по всем четырем видам исследованных бактериальных культур и трем катионным производным (Arg, Lys или His) пептидов, которые для САМП-КТА и САМП-ЛТА составили 9.4 и >77.8 мкМ соответственно. Таким образом, антибактериальная активность (АБА) САМП-КТА в целом более чем в 8 раз превосходит активность САМП-ЛТА:
При сравнении антигрибковой активности двух рассматриваемых групп пептидов, напротив, САМП-ЛТА в целом проявили более высокую противогрибковую активность (СГ2 = 7.0), чем САМП-КТА (СГ2 = 15.0) (табл. 2). Другими словами, средняя антигрибковая или фунгицидная активность (ФА) для пептидов из группы САМП-ЛТА в целом более чем в 2 раза превышает ФА для пептидов из группы САМП-КТА:
Противогрибковая активность САМП-ЛТА существенно выше не только по отношению к противогрибковой активности САМП-КТА, но и выше также по отношению к антибактериальной активности этой же группы пептидов внутри самой группы САМП-ЛТА. Так, например, в случае САМП-ЛТА общая средняя фунгицидная активность пептидов R9F2, K9F2 и H9F2 (СГ2 = 7.0 мкМ) более чем в 10 раз превышает их общую среднюю антибактериальную активность (СГ1 > 77.8 мкМ) (табл. 2). Напротив, в случае САМП-КТА общая противогрибковая активность пептидов R5F5, K5F5 и H5F5 (СГ2 = 15.0 мкМ) была в ~2 раза ниже их общей антибактериальной активности (СГ1 = 9.4 мкМ). Другими словами, пептиды из группы САМП-КТА более предпочтительно воздействуют на клетки бактерий, чем на клетки грибов, а пептиды из группы САМП-ЛТА, напротив, более эффективно воздействуют на клетки грибов, чем на клетки бактерий:
Говоря о повышенной антибактериальной избирательной активности САМП-КТА по сравнению с САМП-ЛТА (АБАСАМП-КТА > АБАСАМП-ЛТА), можно предположить, что для проявления антибактериальной активности, вероятно, более характерен именно классический тип амфипатичности, образуемый α-спиральными пептидами. Катионные пептиды при контакте с микробными клетками проходят вначале через внешнюю мембрану и слой пептидогликана и далее взаимодействуют с отрицательно заряженными головками фосфолипидных групп цитоплазматической мембраны [17]. Согласно литературным данным, короткие α-спиральные AMP, как правило, не структурированы или слабо структурированы в растворе [8, 9, 17]. Отмечается, что при взаимодействии с отрицательно заряженной поверхностью мембран α-спиральная амфипатическая структурированность САМП-КТА способна усиливаться, и это способствует внедрению образовавшейся гидрофобной поверхности САМП-КТА во внутренний бислой фосфолипидной мембраны [17]. Вначале такие пептиды укладываются или плавают по поверхности мембраны в виде “бревен”, затем собираются в агрегаты типа “плотов” и образуют торроидальные поры в мембране, через которые может выливаться наружу внутреннее содержимое цитоплазмы [17]. В конечном счете такое действие пептидов может приводить к гибели клетки.
Пептиды с “линейным” типом амфипатичности структурированы таким образом, что образуют лишь гидрофильные и гидрофобные концы (рис. 1б), при этом исключается образование раздельных гидрофобных и гидрофильных α-спиральных поверхностей (рис. 1б и 2б). Вследствие этого в случае САМП-ЛТА, скорее всего, возможна реализация другого, более простого, “коврового”, способа воздействия на мембрану [17, 23]. Катионные пептиды при этом вначале устилают отрицательно заряженную поверхность в виде ковра с дальнейшим внедрением гидрофобных головок во внутренний бислой фосфолипидной мембраны и тем самым дестабилизируют цитоплазматическую мембрану в целом. Это приводит к разрушению мембраны и гибели клетки, но при больших концентрациях, чем в случае воздействия путем образования “торроидальных” пор с участием САМП-КТА.
Таким образом, “круговой” тип амфипатичности в случае воздействия на бактериальные клетки в исследованных нами случаях оказывается более эффективным по сравнению с “линейным” типом амфипатичности.
С другой стороны, в случае воздействия на клетки грибов “линейный” тип амфипатичности более эффективен и предпочтителен по сравнению с классическим типом амфипатичности. Вероятно, пептиды с “линейным” типом амфипатичности из-за своей меньшей структурированности в пространстве при взаимодействии с отрицательно заряженными компонентами клеточной стенки грибов и большей линейной однородности гораздо легче проникают (проскальзывают) через более жестко сформированные и структурированные клеточные стенки грибов, чем через стенки бактерий. Таким образом, пространственная α-спиральная структурированность пептидов, усиленная взаимодействием с отрицательно заряженными компонентами клеточной стенки грибов, в случае САМП-КТА создает некоторые стерические препятствия или барьеры при прохождении через клеточные стенки грибов, тем самым снижая эффективность их воздействия по сравнению с эффективностью воздействия САМП-ЛТА.
Следует также обратить внимание на избирательное отношение САМП к грибковым клеткам по сравнению с бактериальными клетками в зависимости не только от типа амфипатичности (КТА или ЛТА), но и от их катионного состава пептидов. Так, например, среди всех исследованных катионных пептидов как в группе САМП-КТА, так и САМП-ЛТА наблюдается повышенная противогрибковая активность гистидин-содержащих пептидов H5F5 и H9F2 (МПК50 = 7.7 и 1.4 мкМ соответственно), которая в ~2–3 и 9–13 раз превышает противогрибковую активность, проявляемую соответствующими аргинин- (R5F5 и R9F2) (МПК50 = 17.0 и 12.9 мкМ) и лизин-содержащими (K5F5 и K9F2) (МПК50 = 25.9 и 18.9 мкМ) катионными производными (табл. 2). Такое избирательное действие пептидов H5F5 и H9F2, содержащих остатки гистидина, по отношению к грибковым культурам по сравнению с аргинин- и лизин-содержащими катионными пептидами подтверждается литературными данными, в которых указывается на целый класс гистидин-содержащих природных АМП, так называемых гистатинов (Hst) – богатых гистидином (катионных) антимикробных белков [29]. Известно, что Hst содержатся в слюне [30] и проявляют избирательную активность как к условно-патогенным дрожжевым культурам, таким как C. albicans [30], так и к другим дрожжевым культурам [31].
Согласно литературным данным (см., например, обзор Puri et al. [29] и приведенные в нем ссылки), один из представителей гистатинов – Hst 5 – связывается с белками клеточной стенки C. albicans (Ssa1/2) и гликанами и поглощается клетками посредством переносчиков грибковых полиаминов. Попав внутрь грибковых клеток, Hst 5 может влиять на функции митохондрий и вызывать окислительный стресс, однако конечная причина гибели клеток – дисрегуляция объема и дисбаланс ионов, вызванный осмотическим стрессом. Но поскольку специфической активностью по отношению к C. albicans обладает не только Hst 5, но и остальные гистатины, содержащие в своем составе остатки гистидинов, вполне уместно предположить, что на поверхности дрожжевых клеток C. albicans имеются специфические рецепторы к гистидин-богатым пептидам. Другими словами, причина проникновения гистатинов, как можно предположить, – это не их катионные свойства (например, у гистидин-содержащих пептидов H9F2 и H5F5 один положительный заряд, образованный за счет открытой концевой аминогруппы, и слабый положительный заряд за счет остатков гистидина), а наличие рецепторов, специфических к гистидин-богатым пептидам. Проникновение в клетку в данном случае, скорее всего, должно идти не по электростатическому, а по рецептор-опосредованному механизму, хотя электростатическое взаимодействие также играет немаловажную роль в первоначальном связывании с отрицательно заряженной поверхностью клетки C. albicans.
В случае САМП-ЛТА H9F2 избирательное противогрибковое воздействие многократно усиливается как за счет содержания в составе пептида гистидина, так и одновременно за счет его типа амфипатичности. Так, например, при сравнении действия САМП-ЛТА и САМП-КТА на C. albicans и на клетки бактерий, пептид H9F2 из группы САМП-ЛТА проявил антигрибковую активность (МПК50 = 1.4 мкМ), превышающую его антибактериальную активность (МПК50 > 100.0 мкМ) более чем в 70 раз, тогда как аналогичный гистидин-содержащий пептид H5F5 из группы САМП-КТА проявил антигрибковую активность (МПК50 = 7.7 мкМ), превышающую его антибактериальную активность (МПК50 = 46.4 мкМ) всего лишь в 6 раз. Другими словами, гистидин-содержащие пептиды проявляют высокую избирательную противогрибковую активность по сравнению с действием на клетки бактерий не только за счет содержания остатков гистидинов, обладающих определенным повышенным сродством к поверхности грибковых клеток, но и за счет своего типа амфипатичности.
Таким образом, в группе пептидов САМП-КТА, как и в случае ранее исследованных САМП-ЛТА, наибольшей антибактериальной активностью обладают пептиды, содержащие в качестве катионных составляющих аргининовые остатки, и наименьшей – пептиды с остатками гистидина. По отношению же к грибковым культурам, напротив, наибольшей противогрибковой активностью обладают пептиды, содержащие в качестве катионных составляющих гистидиновые остатки. В целом САМП-КТА при сравнении их c САМП-ЛТА проявляют большую антибактериальную активность и меньшую фунгицидную активность, при этом особо высокой антигрибковой активностью обладает гистидин-содержащий пептид H9F2 из группы САМП-ЛТА, активность которого существенно выше аналогичной активности, проявляемой гистидин-содержащим пептидом H5F5 из группы САМП-КТА.
Гемолитическая активность пептидов. Эксперименты, проведенные с лизисом эритроцитов, показали, что САМП-КТА X5F5 обладают не только повышенной антибактериальной активностью, но также и существенно большей гемолитической активностью (рис. 3а), чем САМП-ЛТА (рис. 3б). Например, как ранее было показано [25], гемолитическая активность при действии САМП-ЛТА R9F2, K9F2 и H9F2 in vitro даже при достаточно высокой их концентрации в среде (1000 мкМ), содержащей эритроциты, составляла 3–4%, а при концентрации 500 мкМ лизису подвергалось всего лишь 2.4, 1.0 и 2.7% эритроцитов соответственно (рис. 3б), тогда как уровень гемолиза для пептидов R5F5, K5F5 и H5F5 из группы САМП-КТА при той же их концентрации в среде 500 мкМ составил уже 37.9, 22.9 и 62.6% соответственно (рис. 3а), т.е. САМП-КТА по уровню их действия на эритроциты оказались в 15–20 раз более токсичными, чем САМП-ЛТА.
Такая высокая гемолитическая активность САМП-КТА X5F5, скорее всего, связана с их повышенной гидрофобностью, обусловленной содержанием в составе этих пептидов пяти гидрофобных остатков фенилаланина, тогда как в САМП-ЛТА X9F2 содержится всего два таких гидрофобных остатка. Аналогичное влияние гидрофобности АМП на их гемолитическую активность было отмечено ранее во многих работах [8, 9, 32, 33]. Таким образом, в целом гемолитическая активность (ГА), проявляемая САМП-КТА, больше той же активности, проявляемой САМП-ЛТА:
Среди аргинин-, лизин- и гистидин-содержащих пептидов, как в группе САМП-КТА, так и в ранее исследованной группе САМП-ЛТА, наименьшей токсичностью по отношению к эритроцитам обладают лизин-содержащие пептиды K5F5 и K9F2, а наибольшей – гистидин-содержащие пептиды H5F5 и H9F2 (рис. 3).
Таким образом, в зависимости от катионного состава аминокислот (Arg, Lys или His) относительную токсичность как САМП-КТА X5F5, так и САМП-ЛТА X9F2 можно расположить в одном ряду по возрастанию их гемолитической активности:
Терапевтический индекс. Увеличение антимикробной активности АМП часто сопровождается увеличением их гемолитического действия, т.е. способности разрушать эритроциты [8, 9, 34, 35]. Другими словами, активный в отношении микроорганизмов препарат может оказаться в свою очередь также и довольно токсичным. В таком случае терапевтический потенциал антимикробных агентов оценивается на основе селективности их действия на исследуемые патогенные микроорганизмы по сравнению с аналогичным их действием на эритроциты, в виде терапевтического индекса (ТИ), т.е. как отношение величины минимальной гемолитической концентрации (МГК) к величине МПК, где МГК – концентрация пептида, вызывающая лизис определенной доли свежих красных кровяных телец [24, 27].
Для оценки селективности действия пептидов нами были определены величины МГК пептидов и вычислены их значения ТИ (табл. 3). Для сравнения селективности каждого пептида по отношению ко всем бактериальным культурам в целом были подсчитаны также среднегеометрические (СГ) значения ТИ для каждого из пептидов по отношению ко всем исследованным бактериальным культурам, а также среднегеометрические значения ТИ по всем трем пептидам (X – Arg, Lys и His) для каждой культуры клеток отдельно.
Таблица 3.
Минимальная гемолитическая концентрация (МГК), терапевтический индекс (ТИ) и среднегеометрические (СГ) значения МГК и ТИ исследуемых пептидов
| Пептиды | МГКа, мкМ | ТИб | СГ1 | ||||
|---|---|---|---|---|---|---|---|
| C. albicans | S. aureus | E. coli | S. enterica | P. aeruginosa | |||
| САМП-КТА X5F5 (X – Arg, Lys или His) | |||||||
| R5F5 | 33 | 1.9 | 5.3 | 7.0 | 15.7 | 17.4 | 10.0 |
| K5F5 | 60 | 2.3 | 3.5 | 9.2 | 18.8 | 23.1 | 10.9 |
| H5F5 | 21 | 2.7 | 0.4 | 0.3 | 0.7 | 0.6 | 0.5 |
| СГ2 | 35 | 2.3 | 1.9 | 2.6 | 5.9 | 6.4 | 3.7в |
| САМП-ЛТА X9F2 (X – Arg, Lys или His) | |||||||
| R9F2 | 920 | 71.3 | 20.8 | 20.0 | 13.4 | 13.7 | 16.6 |
| K9F2 | 1000 | 52.9 | <10.0 | 13.5 | <10.0 | 14.2 | <11.8 |
| H9F2 | 800 | 571.4 | <8.0 | <8.0 | <8.0 | <8.0 | <8.0 |
| СГ2 | 903 | 129.2 | <11.9 | <12.9 | <10.2 | <11.6 | <11.6в |
а МГК – минимальная гемолитическая концентрация – такая концентрация пептида (мкМ), которая вызывает лизис 4% свежих красных кровяных клеток. Средняя ошибка приведенных значений МГК, ТИ и СГ не превышает величины 15–20%.
б ТИ – терапевтический индекс для каждой культуры микроорганизмов по отдельности, выраженный в виде отношения значения МГК к МПК50. Большие значения ТИ указывают на большую селективность пептида.
в Суммарное среднегеометрическое значение ТИ по всем бактериям и пептидам для соответствующей группы САМП-ЛТА и САМП-КТА.
СГ1 – среднегеометрические значения ТИ по всем бактериям отдельно для каждого пептида (СГ по горизонтали, учитывая лишь бактериальные культуры).
СГ2 – среднегеометрические значения МГК (мкМ) и ТИ по всем трем пептидам (X – Arg, Lys и His) для каждой культуры клеток отдельно (СГ по вертикали).
В случае САМП-КТА X5F5 наблюдается их высокая антибактериальная (СГ МПК50 = 9.4 мкМ) (табл. 2) и одновременно высокая гемолитическая активность (СГ МГК = 35 мкМ) (табл. 3). Последний фактор существенно снижает среднюю селективность препаратов на основе САМП-КТА (СГ ТИ = 3.7) (табл. 3). Тем не менее, несмотря на свою повышенную токсичность, некоторые САМП-КТА благодаря своей повышенной антибактериальной активности проявили относительно высокую селективность по отношению к отдельным бактериальным культурам. Например, высокая бактериальная селективность проявляется у аргинин- и лизин-содержащих пептидов R5F5 и K5F5 по отношению к бактериальным культурам S. enterica (ТИ = 15.7 и 18.8) и P. aeruginosa (ТИ = 17.4 и 23.1) – значения ТИ у этих пептидов выше значений ТИ аналогичных менее токсичных САМП-ЛТА R9F2 и K9F2 по отношению к тем же культурам клеток (ТИ = 13.4 и <10.0 для S. enterica; ТИ = 13.7 и 14.2 для P. aeruginosa) (табл. 3).
В случае САМП-ЛТА X9F2, напротив, наблюдается меньшая антибактериальная активность пептидов при их меньшей гемолитической активности. Первый из этих факторов уменьшает, а последний – увеличивает селективность этих препаратов. Например, СГ ТИ для САМП-КТА R5F5 и K5F5 составляет 10.0 и 10.9 соответственно, за исключением пептида H5F5, содержащего остатки гистидина (СГ ТИ = 0.5), а значение СГ ТИ для САМП-ЛТА R9F2 составляет 16.6 – величину не только сравнимую, но и даже превышающую аналогичное значение СГ ТИ для САМП-КТА R5F5 (СГ ТИ = 10.0) (табл. 3). Другими словами, несмотря на свою сниженную антибактериальную активность, САМП-ЛТА R9F2 обладает большим терапевтическим индексом, чем аналогичный аргинин-содержащий пептид R5F5 из группы САМП-КТА, благодаря именно своей низкой гемолитической активности.
Таким образом, величины ТИ, представляемые в виде соотношения значений МГК к МПК в этих случаях, – это некий баланс, определяющий, в конечном счете, какой из этих двух факторов (антимикробная активность или токсичность) доминирует при оценке их реальной селективности или терапевтической значимости. Однако в целом сравнивать величины ТИ для САМП-ЛТА и САМП-КТА затруднительно из-за низкой, а порой и неопределенной в условиях эксперимента антибактериальной активности некоторых САМП-ЛТА, таких как K9F2 и H9F2, среднегеометрические значения МПК50 для которых составили >72.2 и >100 мкМ (табл. 2).
В случае фунгицидной активности особо следует отметить селективность гистидин-содержащего пептида H9F2 из группы САМП-ЛТА по отношению к условно-патогенному грибу C. albicans. В данном случае высокая фунгицидная активность этого пептида одновременно сопровождается низкой токсичностью, что приводит к его достаточно высокой селективности (ТИ = = 571.4), более чем в 200 раз превышающей аналогичную селективность гистидин-содержащего пептида H5F5 из группы САМП-КТА (ТИ = 2.7). По сравнению с пептидом H9F2, для пептида H5F5 сниженная фунгицидная активность одновременно сопровождается его высокой гемолитической активностью, что дополнительно вносит вклад в снижение значения его фунгицидной селективности.
Таким образом, САМП с “круговым” типом амфипатичности характеризуются одновременно повышенной антимикробной и гемолитической активностью. Увеличение гемолитической активности такого типа пептидов, вероятно, связано с увеличением их гидрофобности. Однако у САМП с “круговым” типом амфипатичности сохраняется высокая бактериальная селективность, связанная с их увеличенной антибактериальной активностью. У пептидов же с “линейным” типом амфипатичности также сохраняется высокая бактериальная селективность, связанная в данном случае с их низкой гемолитической активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использовали реактивы для пептидого синтеза (Sigma, Fisher Scientific, Bachem, Protein Technologies, США); полистирольный полимер 855013 Novabiochem® NovaSyn®TG Sieber resin, функционализированный 9-Fmoc-аминоксантен-3-илоксильным фрагментом, 200 ммоль/г (Merck Schuchardt OHG, Германия); защищенные аминокислотные мономеры (Protein Technologies, США); конденсирующий реагент HATU – 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат (кат. № 023926, Oakwood Products Inc., США).
Синтез пептидов. Пептиды были синтезированы твердофазным методом с использованием Fmoc-стратегии [26] аналогично опубликованной ранее схеме [25] на пептидном синтезаторе PS3 (Protein Technologies, США). Содержание основного вещества в синтезированных пептидах по данным офВЭЖХ составляло не менее 95%.
Штаммы микроорганизмов. Штаммы патогенных бактерий Pseudomonas aeruginosa ATCC 9027, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, Salmonella enterica ATCC 14028 и условно-патогенного гриба Candida albicans ЭМТК 34 поддерживали и нарабатывали в Коллекции экстремофильных микроорганизмов и типовых культур Института химической биологии и фундаментальной медицины СО РАН.
Аналитическую офВЭЖХ проводили на хроматографе LC-20 AD (Shimadzu, Япония) с использованием детектора SPD-M20A (Shimadzu, Япония) на колонке Gemini 5 µm NX-C18, 110 Å, 4.6 × × 250 мм (Phenomenex Inc., США), уравновешенной 0.1%-ным раствором TFA, в линейном градиенте концентрации ацетонитрила 0–50% или 0–80% в течение 30 мин при скорости потока 1 мл/мин, УФ-детекция при длине волны 210, 220, 240 и 260 нм.
Молекулярные массы пептидов (табл. 1) определяли с помощью масс-спектрометрии MALDI-TOF (REFLEX III, Bruker Daltonics, Германия) и ESI-MS (LC/MS XCT Ultra, Agilent Technologies, США) в Центре масс-спектрометрического анализа Института химической биологии и фундаментальной медицины СО РАН.
Антимикробная активность пептидов. Растворы пептидов определенной концентрации для оценки антимикробной активности готовили из сухих навесок. Для пептидов R9F2, K9F2 и H9F2, а также пептидов R5F5, K5F5 и H5F5, которые содержали по два или пять остатков фенилаланина соответственно, дополнительно проводили определение концентрации путем измерения поглощения в ближней УФ-области спектра с использованием значений молярных коэффициентов поглощения при длине волны 260 нм, равных 330 и 820 л моль–1 см–1, молярные коэффициенты которых ранее были определены, исходя из соответствующих растворов пептидов, приготовленных из сухих навесок. Исходные растворы пептидов с концентрацией 1–2 мМ хранили при –15°С в темноте не более месяца. Непосредственно перед экспериментом растворы разбавляли до нужной концентрации средой Мюллера–Хинтона. Исходная концентрация пептидов для приготовления проб для дальнейшего испытания их гемолитической активности составляла 10 мМ в воде.
Для работы использовали взвесь ночных бульонных культур, выращенных на стандартных питательных средах. Количество микроорганизмов (титр) во взвеси определяли по оптической плотности при длине волны 595 нм.
Для оценки антибактериального действия пептидов проводили совместное инкубирование клеточных культур с исследуемыми пептидными препаратами в 96-луночных планшетах для культивирования. Ночные бульонные культуры ресуспендировали в среде Мюллера–Хинтона (для C. albicans – в среде Сабуро), доводя количество микроорганизмов до посевной дозы ~5 × 105 КОЕ/мл. В лунки последовательно вносили раствор исследуемых пептидных препаратов, а затем клеточную суспензию в соотношении 1 : 9 по объему (общий объем 200 мкл) в конечных концентрациях 0.3–100 мкМ. В качестве отрицательного контроля вместо тестируемого пептида вносили аналогичный объем среды Мюллера–Хинтона (для C. albicans – среды Сабуро). В качестве положительного контроля вместо тестируемого пептида вносили аналогичный объем водных растворов AgNO3 или хлоргексидина (ХГ) в соответствующих разведениях, так же как и для пептидов, в конечных концентрациях 0.3–100 мкМ. Инкубацию проводили в течение 24 ч при 37°С и 560 об/мин на шейкер-инкубаторе (Kuhner LT-X, АБТЕК, Россия). В нулевой точке и через 2, 4, 5, 6, 7, 8 и 24 ч после начала инкубации измеряли оптическую плотность суспензии на планшетном спектрофотометре iMark™ (Bio-Rad, США) при длине волны 595 нм. Результаты выражали в виде среднего значения оптической плотности клеточной суспензии в трех независимых экспериментах, выполненных в двух повторах. Среднестатистическая ошибка (или стандартное отклонение значений экспериментальных данных) при этом не превышала 15–30%. Стандартное отклонение (S) рассчитывали по формуле:
Расчет МПК50. Исходя из полученных средних значений оптической плотности суспензий клеточных культур, определяли величины относительной степени роста культуры микробных клеток (Np/N0) в виде отношения оптической плотности микробных частиц после добавления пептидного препарата (Np) к оптической плотности в контрольной культуре (N0). Концентрацию пептида, при которой величина относительной степени роста культуры микробных клеток составляла 50%, определяли по кривым зависимости величины относительной степени роста культуры микробных клеток (Np/N0) в процентах от концентрации пептидов [25].
Фотометрический метод оценки гемолитической активности антимикробных пептидов в отношении эритроцитов человека. Гемолитическую активность исследуемых пептидов тестировали в отношении свежих эритроцитов человека согласно ранее опубликованным методикам [25, 27, 36]. Образец крови для получения эритроцитов был предоставлен ООО “Лаборатория Гемотест” (Новосибирск, Россия).
Метод основан на измерении оптической плотности при длине волны 540 нм в надосадочной жидкости, полученной после центрифугирования суспензии эритроцитов, поскольку при разрушении эритроцитов вышедший из клеток гемоглобин придает среде характерную красную окраску, сохраняющуюся после осаждения эритроцитов. Свежие эритроциты человека трижды промывали фосфатно-солевым буфером (PBS: 10 мМ Na2HPO4, 1.76 мМ K2HPO4, pH 7.4), содержащим 173 мМ NaCl и 2.7 мМ KCl. К 50 мкл суспензии эритроцитов в PBS добавляли растворы пептидов в виде двукратных серийных разведений до конечного объема 100 мкл и концентрации суспензии эритроцитов 4% (по объему, за 100% принимали объем суспензии осажденных центрифугированием эритроцитов), инкубировали в течение 30 мин при 37°С. После центрифугирования и отделения осадка измеряли оптическую плотность надосадочной жидкости при длине волны 540 нм. За 100% гемолиза принимали оптическую плотность раствора, полученную при действии на эритроциты 10%-ного раствора тритона Х-100. За 0% принимали оптическую плотность, полученную при действии на эритроциты “холостого” буферного раствора, не содержащего пептидных проб. Гемолитический анализ проводили дважды с использованием одного образца крови человека. Данные представлены как среднее значение ± стандартные отклонения трех независимых экспериментов. Средняя ошибка эксперимента при этом не превышала 15–20%.
ЗАКЛЮЧЕНИЕ
В данной работе синтезированы три новых антимикробных пептида XFXXFFXXFF (X5F5) (X – Arg, Lys или His), обладающих “круговым” типом амфипатичности (САМП-КТА), изучены антимикробные и гемолитические свойства синтезированных пептидов в зависимости от их катионного аминокислотного состава (аргинина, лизина или гистидина) в сравнении с тремя антимикробными пептидами XXXXXXXXXFF (X9F2) с “линейным” типом амфипатичности (САМП-ЛТА).
Показано, что все исследуемые САМП-КТА обладают ярко выраженной антибактериальной активностью (в отношении S. aureus, E. coli, S. enterica, P. aeruginosa) и меньшей фунгицидной активностью (в отношении C. albicans). Напротив, антибактериальная активность САМП-ЛТА существенно ниже их фунгицидной активности. По отношению к бактериальным клеткам наибольшая антибактериальная активность выявлена у пептидов, содержащих в качестве катионных составляющих остатки аргинина (R5F5, R9F2), а наименьшая – у пептидов с остатками гистидина (H5F5, H9F2).
По отношению к грибковым культурам, напротив, наибольшей фунгицидной активностью обладают пептиды, содержащие в качестве катионных составляющих гистидиновые остатки (H5F5, H9F2).
В экспериментах с лизисом эритроцитов человека показано, что гемолитическая активность САМП-КТА превышает активность САМП-ЛТА. Наименьшей токсичностью к эритроцитам обладают лизин-содержащие пептиды (K5F5, K9F2), а наибольшей – гистидин-содержащие пептиды (H5F5, H9F2).
Несмотря на относительно высокую гемолитическую активность, средняя бактериальная селективность исследованных пептидов X5F5 остается достаточно высокой (СГ ТИ ≈ 10), за исключением пептида H5F5, содержащего остатки гистидина (СГ ТИ = 0.5). В то же время селективность гистидин-содержащего пептида H5F5 по отношению к клеткам грибов (ТИ = 2.7) в 5 раз выше его селективности по отношению к бактериальным клеткам, но в 200 раз ниже фунгицидной селективности гистидин-содержащего пептида H9F2 (ТИ = 571.4), обладающего “линейным” типом амфипатичности.
Таким образом, учитывая высокую антибактериальную активность САМП-КТА и несмотря на их повышенную гемолитическую активность, можно рекомендовать их аргининин и лизин-содержащие производные (R5F5, K5F5) в качестве перспективных антимикробных препаратов, поскольку в этом случае для получения одинакового терапевтически значимого эффекта требуется меньшая концентрация, а следовательно, и меньшее количество пептидного препарата по сравнению с аналогичными препаратами из группы САМП-ЛТА. Для создания противогрибковых препаратов наиболее перспективны пептиды из группы САМП-ЛТА, содержащие в качестве катионных групп аминокислотные остатки гистидина (H9F2).
Список литературы
Peschel A., Sahl H.G. // Nat. Rev. Microbiol. 2006. V. 4. P. 529–536. https://doi.org/10.1038/nrmicro1441
Bahar A.A., Ren D. // Pharmaceuticals (Basel). 2013. V. 6. P. 1543–1575. https://doi.org/10.3390/ph6121543
Chung P.Y., Khanum R.J. // Microbiol. Immunol. Infect. 2017. V. 50. P. 405–410. https://doi.org/10.1016/j.jmii.2016.12.005
Kim H., Jang J.H., Kim S.C., Cho J.H. // J. Antimicrob. Chemother. 2014. V. 69. P. 121–132. https://doi.org/10.1093/jac/dkt322
Баландин С.В., Овчинникова Т.В. // Биоорг. химия. 2016. Т. 42. С. 255–275. [Balandin S.V., Ovchinnikova T.V. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 229–248.] https://doi.org/10.1134/S1068162016030055
Mookherjee N., Hancock R.E. // Cell. Mol. Life Sci. 2007. V. 64. P. 922–933. https://doi.org/10.1007/s00018-007-6475-6
Navon-Venezia S., Feder R., Gaidukov L., Carmeli Y., Mor A. // Antimicrob. Agents Chemother. 2002. V. 46. P. 689–694. https://doi.org/10.1128/AAC.46.3.689-694.2002
Liu X., Cao R., Wang S., Jia J., Fei H. // J. Med. Chem. 2016. V. 59. P. 5238–5247. https://doi.org/10.1021/acs.jmedchem.5b02016
Hollmann A., Martínez M., Noguera M.E., Augusto M.T., Disalvo A., Santos N.C., Semorile L., Maffía P.C. // Colloids Surf. B: Biointerfaces. 2016. V. 141. P. 528–536. https://doi.org/10.1016/j.colsurfb.2016.02.003
Clark S., Jowitt T.A., Harris L.K., Knight C.G., Dobson C.B. // Commun. Biol. 2021. V. 4. P. 605. https://doi.org/10.1038/s42003-021-02137-7
Азимова В.Т., Потатуркина-Нестерова Н.И., Нестеров А.С. // Современные проблемы науки и образования. 2015. № 1. C. 1336. [Azimova V.T., Potaturkina-Nesterova N.I., Nesterov A.S. // Modern Problems of Science and Education. 2015. № 1. P. 1336.] https://science-education.ru/en/article/view?id=17746
Jiang Z., Vasil A.I., Hale J.D., Hancock R.E., Vasil M.L., Hodges R.S. // Biopolymers. 2008. V. 90. P. 369–383. https://doi.org/10.1002/bip.20911
Huang Y.B., Huang J.F., Chen Y.X. // Protein Cell. 2010. V. 1. P. 143–152. https://doi.org/10.1007/s13238-010-0004-3
Vlieghe P., Lisowski V., Martinez J., Khrestchatisky M. // Drug Discov. Today. 2010. V. 15. P. 40–56. https://doi.org/10.1016/j.drudis.2009.10.009
Смирнова М.П., Афонин В.Г., Шпень В.М., Тяготин Ю.В., Колодкин Н.И. // Биоорг. химия. 2004. Т. 30. С. 458–465. [Smirnova M.P., Afonin V.G., Shpen’ V.M., Tyagotin Yu.V., Kolodkin N.I. // Russ. J. Bioorg. Chem. 2004. V. 30. P. 409–416.] https://doi.org/10.1023/B:RUBI.0000043782.21640.c2
Giangaspero A., Sandri L., Tossi A. // Eur. J. Biochem. 2001. V. 268. P. 5589–5600. https://doi.org/10.1046/j.1432-1033.2001.02494.x
Tossi A., Sandri L., Giangaspero A. // Biopolymers. 2000. V. 55. P. 4–30. https://doi.org/10.1002/1097-0282(2000)55:1<4::AID- BIP30>3.0.CO;2-M
Dinh T.T.T., Kim D.-H., Lee B.-J., Kim Y.-W. // Bull. Korean Chem. Soc. 2014. V. 35. P. 3632–3636. https://doi.org/10.5012/BKCS.2014.35.12.3632
Tew G.N., Liu D., Chen B., Doerksen R.J., Kaplan J., Carroll P.J., Klein M.L., de Grado W.F. // Proc. Natl. Acad. Sci. USA. 2002. V. 99. P. 5110–5114. https://doi.org/10.1073/pnas.082046199
Javadpour M.M., Juban M.M., Lo W.C., Bishop S.M., Alberty J.B., Cowell S.M., Becker C.L., McLaughlin M.L. // J. Med. Chem. 1996. V. 39. P. 3107−3113. https://doi.org/10.1021/jm9509410
Chen Y., Mant C.T., Farmer S.W., Hancock R.E., Vasil M.L., Hodges R.S. // J. Biol. Chem. 2005. V. 280. P. 12316–12329. https://doi.org/10.1074/jbc.m413406200
Schiffer M., Edmundson A.B. // Biophys. J. 1967. V. 7. P. 121–135. https://doi.org/10.1016/S0006-3495(67)86579-2
Амирханов Н.В., Тикунова Н.В., Пышный Д.В. // Биоорг. химия. 2018. Т. 44. С. 492–505. [Amirkhanov N.V., Tikunova N.V., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 492–503.] https://doi.org/10.1134/S1068162018050035
Amirkhanov N.V., Tikunova N.V., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 833–841. https://doi.org/10.1134/S1068162019060037
Амирханов Н.В., Бардашева А.В., Тикунова Н.В., Пышный Д.В. // Биоорг. химия. 2021. Т. 47. С. 315–326. [Amirkhanov N.V., Bardasheva A.V., Tikunova N.V., Pyshnyi D.V. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 681–690.] https://doi.org/10.1134/S106816202103002X
Chan W.C., White P.D. // Fmoc Solid Phase Peptide Sythesis: a Practical Approach / Eds. Chan W.C., White P.D. Oxford: IRL Press, 2000. P. 64–66.
Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. // J. Pept. Sci. 2015. V. 21. P. 105–113. https://doi.org/10.1002/psc.2732
Jiang Z., Vasil A.I., Gera L., Vasil M.L., Hodges R.S. // Chem. Biol. Drug Des. 2011. V. 77. P. 225–240. https://doi.org/10.1111/j.1747-0285.2011.01086.x
Puri S., Edgerton M. // Eukaryot. Cell. 2014. V. 13. P. 958–964. https://doi.org/10.1128/ec.00095-14
Khurshid Z., Najeeb S., Mali M., Moin S.F., Raza S.Q., Zohaib S., Sefat F., Zafar M.S. // Saudi Pharm. J. 2017. V. 25. P. 25–31. https://doi.org/10.1016/j.jsps.2016.04.027
Tsai H., Bobek L.A. // Biochim. Biophys. Acta. 1997. V. 1336. P. 367–369. https://doi.org/10.1016/s0304-4165(97)00076-7
Wiradharma N., Sng M.Y., Khan M., Ong Z.Y., Yang Y.Y. // Macromol. Rapid Commun. 2013. V. 34. P. 74–80. https://doi.org/10.1002/marc.201200534
Wieprecht T., Dathe M., Epand R.M., Beyermann M., Krause E., Maloy W.L., MacDonald D.L., Bienert M. // Biochemistry. 1997. V. 36. P. 12869–12880. https://doi.org/10.1021/bi971398n
Dathe M., Wieprecht T., Nikolenko H., Handel L., Maloy W.L., MacDonald D.L., Beyermann M., Bienert M. // FEBS Lett. 1997. V. 403. P. 208–212. https://doi.org/10.1016/s0014-5793(97)00055-0
Окороченков С.А., Желтухина Г.А., Небольсин В.Е. // Биомед. химия. 2012. Т. 58. С. 131–143. [Okorochenkov S.A., Zheltukhina G.A., Nebol’sin V.E. // Biochem. Moscow Suppl. Ser. В. 2011. V. 5. P. 95–102.] https://doi.org/10.1134/S1990750811020120
Jacobsen F., Mohammadi-Tabrisi A., Hirsch T., Mittler D., Mygind P.H., Sonksen C.P., Raventos D., Kristensen H.H., Gatermann S., Lehnhardt M., Daigeler A., Steinau H.U., Steinstraesser L. // J. Antimicrob. Chemother. 2007. V. 59. P. 493–498. https://doi.org/10.1093/jac/dkl513
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



