Биоорганическая химия, 2022, T. 48, № 5, стр. 551-560
Методика радиолигандного анализа для одновременного определения содержания β1- и β2-адренорецепторов в клетках крови человека
А. Я. Шевелев 1, Н. М. Каширина 2, Л. Н. Липатова 2, Е. В. Янушевская 2, М. М. Пекло 2, И. Н. Рыбалкин 1, 2, П. Н. Руткевич 1, 2, О. К. Чусовитина 2, Н. А. Скоблова 3, Ю. С. Скоблов 3, *, Т. Н. Власик 1, 2, К. А. Зыков 2, 4
1 ЗАО “Фрамон”
121552 Москва, ул. 3-я Черепковская, 15а, Россия
2 Национальный медицинский исследовательский центр кардиологии Минздрава России
121552 Москва, ул. 3-я Черепковская, 15а, Россия
3 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
4 ФГБОУ ВО “Московский государственный медико-стоматологический университет
им. А.И. Евдокимова” Минздрава России
127473 Москва, ул. Делегатская, 20/1, Россия
* E-mail: sur@ibch.ru
Поступила в редакцию 11.12.2021
После доработки 22.12.2021
Принята к публикации 24.12.2021
- EDN: NVSZNC
- DOI: 10.31857/S0132342322050219
Аннотация
Разработана методика одновременного раздельного определения β1- и β2-адренорецепторов на основе радиолигандного анализа с использованием 125I-иодоцианопиндолола, включающая проведение трех измерений: 1) без лигандов-конкурентов; 2) в присутствии селективного лиганда ICI 118,551 (0.25 мкМ); 3) в присутствии двух селективных лигандов – ICI 118,551 и CGP 20712 (по 0.25 мкМ каждого). Методика протестирована на модельной системе из двух трансгенных линий клеток ADL-7A и A2R9 с экспрессией рекомбинантных β1- и β2-адренорецепторов. При соотношении количества β1-адренорецепторов к β2-адренорецепторам 1 : 10 погрешность измерения составляет ~15%. Анализ девяти клеточных линий, представляющих различные типы клеток крови, показал наличие β2-адренорецепторов в клетках Daudi, Raji, Dami, K-562, HL-60, U‑937 и THP-1 и их отсутствие в Т-лимфоцитарных клетках Jurkat и MOLT-4. β1-Адренорецепторы достоверно зарегистрированы лишь в клетках THP-1 моноцитарного происхождения. В остальных клетках, за исключением линии Dami, их количество оказалось ниже порога детекции, оцениваемого на уровне 200 молекул на клетку. Измерения, выполненные на мононуклеарных клетках периферической крови семи здоровых доноров, продемонстрировали присутствие β2-адренорецепторов в диапазоне 1000–2500 молекул на клетку, тогда как содержание β1-адренорецепторов во всех случаях находилось на грани или за гранью порога детекции.
ВВЕДЕНИЕ
В патогенезе сердечно-сосудистых и бронхообструктивных заболеваний – двух самых распространенных неинфекционных патологий – важную роль играют адренергические механизмы. Людям, страдающим этими заболеваниями, часто необходимо назначение препаратов, воздействующих на β1- и β2-адренорецепторы. Основные мишени β‑агонистов и β-блокаторов – ткани сердца и легких, труднодоступные для лабораторных анализов. Однако в ряде исследований продемонстрирована высокая степень корреляции (~0.9) между содержанием β-адренорецепторов в лимфоцитах крови и их содержанием в ткани предсердий [1, 2]. Таким образом, открывается возможность оценивать процессы, происходящие в этих тканях под воздействием применяемых в ходе лечения препаратов, наблюдая за динамикой поведения β‑адренорецепторов в клетках периферической крови.
На поверхности лейкоцитов крови в основном представлены β2-адренорецепторы [3, 4]. Систематических сравнительных измерений содержания β2‑адренорецепторов в клетках крови у пациентов с сердечно-сосудистыми и бронхообструктивными заболеваниями ранее не проводилось, поэтому экспериментальные данные о динамике поведения β2‑адренорецепторов при использовании препаратов, воздействующих на адренорецепторную систему, носят фрагментарный, случайный характер.
Анализ содержания β1-адренорецепторов весьма затруднен из-за крайне низкой их представленности в клетках крови. У большинства людей содержание β1-адренорецепторов в лейкоцитах в ~20 раз ниже содержания β2-адренорецепторов [5]. Есть косвенные свидетельства, указывающие на присутствие β1-адренорецепторов в моноцитах [6]. Не исключено также, что количество β1-адренорецепторов на Т-лимфоцитах может резко возрастать при некоторых сердечно-сосудистых патологиях или под влиянием каких-либо других факторов [5].
Содержание β1- и β2-адренорецепторов обычно измеряют при помощи 125I-меченного лиганда иодоцианопиндолола, способного одинаково эффективно связываться с обоими типами рецепторов. Присутствие преобладающих количеств β2-адренорецепторов на лейкоцитах крови – дополнительный фактор, препятствующий определению минорной фракции β1-адренорецепторов.
Настоящая статья – продолжение работ по модификации радиолигандного анализа для определения β-адренорецепторов в крови индивидуальных людей [5, 7].
Цель данного исследования – разработка методики радиолигандного анализа, позволяющей проводить одновременное раздельное определение содержания β1- и β2‑адренорецепторов на поверхности клеток крови человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кинетические параметры реакции связывания. Корректная постановка экспериментов по радиолигандному анализу подразумевает такой выбор условий и параметров, при котором реакция связывания лиганда с рецептором доходит до состояния, близкого к равновесному [8]. На рис. 1 представлена кинетика прямой реакции связывания 125I‑иодоцианопиндолола с трансгенными клетками ADL-7A и A2R9, экспрессирующими, соответственно, рекомбинантные β1- или β2‑адренорецепторы, при температуре 37°С и концентрации лиганда 114 пМ (400 000 имп. мин–1 мл–1). Как можно видеть, 30‑минутной инкубации вполне достаточно для того, чтобы обе кривые связывания вышли на плато.
Рис. 1.
Кинетика прямой реакции связывания 125I‑иодоцианопиндолола с клетками ADL-7A (а) и A2R9 (б) при 37°С и концентрации лиганда 114 пМ.

Кинетика обратной реакции, определенная при температурах 25 и 37°С (рис. 2), демонстрирует тот факт, что за время, необходимое для проведения отмывок (~30 мин), потеря связанной радиоактивности за счет диссоциации лиганда хотя и имеет место, но ее доля невелика – не более 15% за время манипуляций.
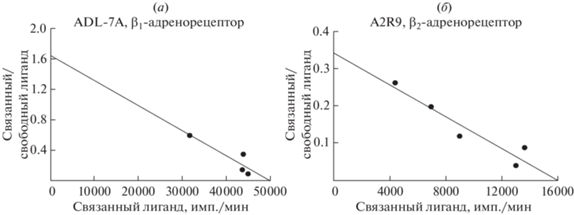
Константы связывания и число рецепторов на клетку. Константы связывания 125I-иодоцианопиндолола с β1- и β2-адренорецепторами (Kd) и число рецепторов, приходящееся на одну клетку ADL-7A или A2R9 (величину Bmax), определяли по графикам Скетчарда (рис. 3). Результаты представлены в табл. 1.
Таблица 1.
Константы диссоциации и содержание β1‑ и β2‑адренорецепторов в модельных трансгенных клетках
| Модельные клетки | Тип адрено-рецептора | Kd, пМ | Количество молекул рецепторов на клетку (Bmax) |
|---|---|---|---|
| ADL-7A | β1 | 40 | 4.3 × 106 |
| A2R9 | β2 | 16 | 3.7 × 106 |
Ингибирование селективными лигандами. Агаповой с соавт. [7] ранее была продемонстрирована возможность определения β2‑адренорецепторов в Т‑лимфоцитах по разнице сигналов связывания 125I‑иодоцианопиндолола в присутствии и в отсутствие высокоселективного лиганда-конкурента ICI 118,551. Однако попытки непосредственно применить аналогичный подход для определения β1‑адренорецепторов, используя лиганд-конкурент CGP 20712 вместо ICI 118,551, потерпели неудачу. Причина заключается в том, что селективность CGP 20712 не абсолютна: при концентрациях лиганда, в достаточной степени ингибирующих связывание 125I-иодоцианопиндолола с β1-адренорецепторами, имеет место хотя и небольшое, но заметное ингибирование связывания 125I-иодоцианопиндолола и с β2‑адренорецепторами. А поскольку содержание β2-адренорецепторов в клетках крови в норме на порядок превосходит содержание β1‑адренорецепторов, возникающая интерференция препятствует вычленению и идентификации той части разницы в сигналах, которая обусловлена присутствием именно β1-адренорецепторов.
С целью свести к минимуму помехи, обусловленные присутствием преобладающих количеств β2-адренорецепторов, мы предложили схему анализа, включающую три измерения связывания 125I-иодоцианопиндолола с клетками: 1) в отсутствие лигандов-конкурентов; 2) в присутствии лиганда ICI 118,551 в такой концентрации, которая подавляла бы связывание с β2-адренорецепторами почти до нуля; 3) в присутствии обоих лигандов ICI 118,551 и CGP 20712. В условиях, когда связывание с β2‑адренорецепторами практически блокировано, даже небольшая разница между вторым и третьим измерениями должна отражать содержание β1‑адренорецепторов в системе. Разумеется, при расчетах необходимо учесть, что высокие концентрации ICI 118,551 до определенной степени ингибируют связывание 125I-иодоцианопиндолола с β1‑адренорецепторами.
В рамках простой линейной модели связывание 125I‑иодоцианопиндолола с клетками, несущими оба типа адренорецепторов, можно представить в виде суммы трех независимых компонентов: В0 – фонового связывания, не подверженного влиянию селективных лигандов; В1 – специфического связывания с β1‑адренорецепторами; В2 – специфического связывания с β2‑адренорецепторами. Фоновое связывание включает в себя как полностью неспецифическое налипание меченого цианопиндолола на поверхность клетки, не вытесняемое высокими концентрациями немеченого лиганда, так и специфическое связывание с другими клеточными рецепторами, в частности с серотониновыми рецепторами [9]. В присутствии ICI 118,551 (второе измерение) связывание с β1‑адренорецепторами будет ослаблено до уровня k1B1, а с β2‑адренорецепторами – до уровня k2B2, где коэффициенты k1 и k2 характеризуют уровни остаточного связывания 125I-иодоцианопиндолола, соответственно, с β1‑ и β2‑адренорецепторами. В присутствии обоих селективных лигандов специфическое связывание меченого иодоцианопиндолола будет описываться аналогичными величинами k3B1 и k4B2. В соответствии с формулой Ченга–Прусоффа [10] коэффициенты k1–k4 зависят как от концентраций лигандов-конкурентов, так и от концентрации способного к связыванию 125I‑иодоцианопиндолола в пробе, поэтому при проведении измерений эти концентрации должны быть фиксированы.
Для результатов трех вышеуказанных измерений можно записать систему трех линейных уравнений и, зная коэффициенты k1–k4, разрешить ее относительно неизвестных В0, В1 и В2. При условии малости доли связавшегося 125I-иодоцианопиндолола по отношению к его полному количеству в системе количества адренорецепторов каждого типа далее рассчитываются по приближенным формулам:
Рабочие концентрации селективных лигандов ICI 118,551 и CGP 20712 – по 0.25 мкМ каждого – были выбраны на основании анализа кривых ингибирования (рис. 4). Соответствующие коэффициенты k1–k4 приведены в табл. 2.
Рис. 4.
Кривые ингибирования лигандами-конкурентами связывания 125I‑иодоцианопиндолола с β1‑ (а, б) и β2‑адренорецепторами (в).
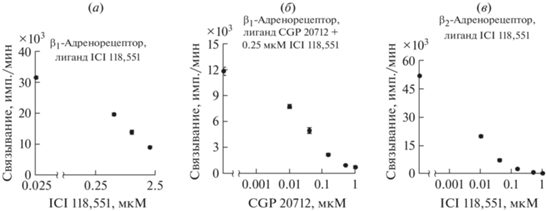
Таблица 2.
Коэффициенты остаточного связывания 125I‑иодоцианопиндолола в присутствии селективных лигандов-ингибиторов
| Лиганды-ингибиторы | β1‑Адренорецептор клетки ADL-7A |
β2‑Адренорецептор клетки A2R9 |
|---|---|---|
| 0.25 мкМ ICI 118,551 | k1 = 0.76 | k2 = 0.032 |
| 0.25 мкМ ICI 118,551 + 0.25 мкМ CGP 20712 | k3 = 0.11 | k4 = 0.032 |
Модельное смешивание клеток. Тестирование описанной выше схемы анализа проводили с использованием клеток ADL-7A и A2R9, которые смешивали друг с другом в различных пропорциях. При этом соотношение модельных клеток выбирали так, чтобы имитировать ситуацию, характерную для клеток крови: содержание β1‑адренорецепторов существенно ниже содержания β2‑адренорецепторов. Приготовленные смеси подвергали анализу по предложенной методике и на основании полученных данных вычисляли, сколько клеток ADL-7A и A2R9 было в каждой смеси. Работоспособность методики оценивали по тому, насколько близки оказывались полученные значения к истинным количествам клеток обоих типов, использованным при составлении смесей.
Результаты трех типичных экспериментов представлены на рис. 5. Эти и другие подобные эксперименты показали, что если соотношение β1‑ и β2‑адренорецепторов составляет ~1 : 10, погрешность анализа находится в пределах 15%. Если же доля β1‑адренорецепторов снижается до 1 : 40, то ошибка в их определении может достигать 40%, что превращает результат анализа в качественную оценку.
Рис. 5.
Модельное смешивание разных количеств клеток, экспрессирующих β1‑адренорецептор (ADL-7A) и β2‑адренорецептор (A2R9), в разных пропорциях. Три группы столбцов – это результаты трех независимых экспериментов.

Связывание лиганда на суспензионных клеточных культурах и мононуклеарных клетках крови здоровых доноров. Разработанная методика была применена для оценки содержания β1‑ и β2‑адренорецепторов в клетках ряда линий, ведущих свое начало от различных типов клеток крови человека. Результаты анализа представлены в табл. 3. Как можно видеть, β2‑адренорецепторы практически не представлены в клетках, происходящих от Т- и В-лимфоцитов (Jurkat, MOLT-4, Daudi и Raji), и относительно высоко представлены в клетках моноцитарного происхождения THP-1 и U-937. Что касается β1‑адренорецепторов, то их присутствие достоверно выявлено в клетках THP-1 и под сомнением – в клетках Dami. Для большинства остальных исследованных клеточных линий содержание β1‑адренорецепторов оказалось ниже порога детекции, который в среднем можно оценить на уровне 250 молекул на клетку.
Таблица 3.
Содержание β1- и β2-адренорецепторов в клеточных линиях
| Клетки | Происхождение | Количество молекул рецепторов на клетку | |
|---|---|---|---|
| β1-адренорецепторы | β2-адренорецепторы | ||
| Jurkat | Т-лимфоциты | <50 | <30 |
| MOLT-4 | Т-лимфобласты | <150 | <120 |
| Daudi | В-лимфоциты | <30 | 130 ± 20 |
| Raji | В-лимфоциты | <100 | 230 ± 60 |
| Dami | Мегакариоциты | 480 ± 230 | 250 ± 120 |
| K-562 | Гранулоциты | <300 | 480 ± 200 |
| HL-60 | Промиелоциты | <500 | 4000 ± 300 |
| U-937 | Макрофаги | <800 | 6900 ± 900 |
| THP-1 | Моноциты | 23 000 ± 3000 | 6200 ± 1800 |
Полученные нами данные на культурах суспензионных клеток имеет смысл сопоставить с результатами аналогичных исследований других групп авторов. Sager et al. [11] измерили содержание β2‑адренорецепторов в клетках HL‑60. Их данные (~2000 молекул на клетку) по порядку величины сравнимы с полученным в настоящей работе значением 4000. В работе Mäki et al. [12] проведен радиолигандный анализ содержания β‑адренорецепторов (без дифференциации по типам) в мембранных фракциях клеток ряда линий, в том числе HL‑60, U-937, K-562 и Raji. Как и следовало ожидать, β‑адренорецепторы обнаружены в клетках HL-60 и U-937, причем в сравнимых количествах. Однако в клетках K-562 и Raji присутствие β‑адренорецепторов авторами не зарегистрировано, что расходится с результатами нашего исследования. По-видимому, порог детекции в работе Mäki et al. проходил выше и не позволил выявить в 5–10 раз меньшие количества β2‑адренорецепторов, которые, по нашим данным, содержатся в этих клетках. Наибольшее число β1‑ и β2‑адренорецепторов выявлено нами в клетках моноцитарной линии THP-1. В работах Grisanti et al. [6] и Talmadge et al. [13] методами иммуноблоттинга и радиолигандного анализа также показано, что клетки THP-1 производят значительные количества β1‑ и β2‑адренорецепторов. Таким образом, тестирование разработанной нами методики на клеточных линиях дало результаты, близкие к результатам работ других авторов.
Выполненный аналогичным образом анализ содержания β1‑ и β2‑адренорецепторов в мононуклеарных клетках периферической крови (PBMC) семи здоровых доноров показал (табл. 4), что количество β2‑адренорецепторов в этих клетках варьирует в диапазоне 1000–2500 молекул на клетку. Присутствие β1‑адренорецепторов в клетках PBMC ни у одного из доноров достоверно зарегистрировать не удалось.
Таблица 4.
Содержание β1- и β2-адренорецепторов в мононуклеарных клетках периферической крови здоровых доноров
| Донор | Количество молекул рецепторов на клетку | |
|---|---|---|
| β1-адренорецепторы | β2-адренорецепторы | |
| 1 | <200 | 2370 ± 120 |
| 2 | (60 ± 60) | 1320 ± 60 |
| 3 | <70 | 1260 ± 60 |
| 4 | (140 ± 160) | 1890 ± 150 |
| 5 | <250 | 1890 ± 170 |
| 6 | (240 ± 440) | 1130 ± 240 |
| 7 | (220 ± 460) | 2030 ± 270 |
Обсуждение полученных результатов. В настоящее время известны три типа β-адренорецепторов: β1, β2 и β3. В лейкоцитах человека β3-адренорецептор не обнаружен, β2‑адренорецептор встречается практически во всех типах белых клеток крови. Изучению представленности β‑адренорецепторов в клетках крови больных и здоровых людей посвящены многочисленные исследования [4, 5, 8, 14–17]. Сопоставлять результаты этих исследований довольно сложно, т.к. анализы проводились по разным методикам и часто не верифицировались количественно другими методами. Несмотря на отсутствие строгой метрологической верификации, в некоторых случаях удавалось выявить очень интересные и клинически значимые изменения представленности β2‑адренорецепторов, связанные с респираторными патологиями [17]. В данной работе количество рецепторов определяли по количеству связавшейся с клетками радиоактивности в имп./мин на 1 млн клеток. Очевидно, прямой пересчет количества радиоактивного лиганда, связанного с клетками, в количество рецепторов, экспонированных на поверхности этих клеток, без учета Kd приводит к некоторому занижению результатов измерений. Поэтому данные работы Агаповой с соавт. [17] следует рассматривать скорее как оценочные.
Тем не менее, анализируя результаты различных исследований, можно заключить, что содержание β2-адренорецепторов в мононуклеарных клетках периферической крови варьирует в диапазоне 400–2500 молекул на клетку, что вполне согласуется и с нашими данными.
В большинстве органов и тканей человека β1- и β2-адренорецепторы присутствуют совместно, поэтому актуальна задача их раздельного определения. В работе Бундкирхена с соавт. [18] представлено одно из возможных решений этой задачи при помощи математического анализа кривых связывания 125I-иодоцианопиндолола в зависимости от концентраций лигандов-ингибиторов ICI 118,551 и CGP 20712. Построение таких кривых требует большого объема экспериментального материала, поскольку подразумевает проведение не менее 40 измерений. Предложенная нами более простая схема анализа из трех измерений имеет то преимущество, что для ее выполнения достаточно ~6 млн клеток, которые можно получить из 10–20 мл крови.
Как правило, одновременно с содержанием рецепторов проводят оценку соответствующих Kd иодоцианопиндолола. В ряде работ Kd измеряли на модельных клетках, экспрессирующих тот или иной тип адренорецепторов [19, 20]. Kd для обоих типов рецепторов, по-видимому, близки между собой и заключены в пределах между 17 и 53 пМ. Похожие значения, 40 пМ для β1-адренорецептора и 16 пМ для β2-адренорецептора, получены и в нашей работе.
Вопрос о том, сколько β1‑адренорецепторов в норме содержится в различных типах клеток крови, на сегодняшний день остается открытым. Cообщение Смоляковой с соавт. [5] о высоком уровне β1‑адренорецепторов в клетках крови некоторых пациентов с кардиологическими патологиями, возможно, связано с какими-то особыми обстоятельствами и нуждается в дополнительном экспериментальном подтверждении. Нам удалось лишь показать, что количество β1‑адренорецепторов в суммарной фракции мононуклеарных клеток у семи здоровых людей не превышает 250 молекул на клетку и не может быть достоверно измерено при помощи предложенной методики.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Линии клеток и условия культивирования. Линия клеток ADL-7A была получена нами ранее [21] путем трансфекции клеток эмбриональной почки человека НЕК293 (из коллекции Института экспериментальной кардиологии НМИЦ) плазмидой pMC4IPW‑ADRBopt, кодирующей оптимизированный ген β1-адренорецептора человека под контролем промотора ранних генов цитомегаловируса. Линию клеток A2R9 получали трансфекцией исходных клеток НЕК293 плазмидой pC4IPW‑hADRB2-EGFP, кодирующей ген β2-адренорецептора, соединенного на С-конце с зеленым флуоресцентным белком, который служил маркером для идентификации трансфицированных клонов. Клетки указанных линий культивировали в среде DMEM, содержащей 10%-ную фетальную бычью сыворотку (FBS), 2 мM L-глутамин, 100 ед./мл пенициллина и 0.1 мг/мл стрептомицина (все реактивы Invitrogen, США), в атмосфере 5% CO2 при 37°С.
Для проведения реакции связывания с 125I-иодоцианопиндололом клетки снимали с поверхности флаконов обработкой трипсином, реакцию протеолиза останавливали добавлением культуральной среды с 10% FBS, клетки осаждали центрифугированием 15 мин при 1100 об/мин (200 g), дважды промывали фосфатно-солевым буферным раствором (PBS) при комнатной температуре и суспендировали в PBS до конечной концентрации 101–106 кл./мл (НЕК293) или 106 кл./мл (ADL-7A, A2R9).
Суспензионные клетки человека линий Raji, Daudi, Jurkat, K-562, U‑937, MOLT-4, Dami, HL-60 и THP-1 из коллекции Института экспериментальной кардиологии НМИЦ культивировали в среде RPMI 1640, содержащей 10% FBS, 2 мM L‑глутамин, 100 ед./мл пенициллина и 0.1 мг/мл стрептомицина. Для проведения радиолигандного анализа клетки осаждали центрифугированием и дважды промывали PBS, как описано выше.
Мононуклеарные клетки периферической крови человека (PBMC). Забор крови у добровольцев проводили в лаборатории Института экспериментальной кардиологии НМИЦ. Венозную кровь семи здоровых добровольцев собирали в вакуумные пробирки BD Vacutainer CPT (Becton, Dickinson and Company, США) и обрабатывали согласно инструкции производителя. Мононуклеарные клетки переносили в другие пробирки и дважды промывали PBS.
Лиганды. В работе использовали следующие лиганды: цианопиндолол хемифумарат (Bio-Techne Corporation, США), ICI 118,551 (Sigma-Aldrich, США) и CGP 20712 (Bio-Techne Corporation, США).
125I-иодоцианопиндолол. Радиоактивный изотоп иода в составе молекулы Na125I (2000 Ки/ммоль) получали от АО “Радиевый институт им. В.Г. Хлопина” (Санкт-Петербург, Россия). Внедрение атома 125I в молекулу цианопиндолола при помощи хлорамина Т проводили методом Greenwood et al. [22] с некоторыми модификациями. В реакцию мечения брали 1 мкг цианопиндолола хемифумарата и 1 мКи Na125I в 50 мкл 0.2 М калий-фосфатного буфера, рН 7.0. Реакцию инициировали добавлением 10 мкл раствора хлорамина Т (5 мг/мл), инкубировали при комнатной температуре в течение 30 с, останавливали реакцию добавлением 10 мкл тиосульфата натрия (20 мг/мл). Смесь выдерживали 5 мин при комнатной температуре, после чего добавляли 1 мкл раствора “холодного” иодида натрия (6 мг/мл).
Целевой продукт очищали при помощи высокоэффективной жидкостной хроматографии на колонке Диасорб 130 (5 мкм, 4 × 150 мм; Елсико, Россия) в ион-парном режиме с элюцией в градиенте концентрации ацетонитрила 0–90% в 10%‑ной уксусной кислоте. Фракции, содержащие 125I‑иодоцианопиндолол, объединяли, упаривали досуха, растворяли в 70%-ном этиловом спирте и хранили при –20°С. Долю радиоактивности во фракции, способной к связыванию с адренорецепторами (фракция “bindable”), оценивали в предварительных экспериментах с избыточным количеством клеток ADL-7A или A2R9.
Реакция связывания с 125I-иодоцианопиндололом. Модельные клетки смешивали с таким расчетом, чтобы в 100 мкл суспензии находилось 2 × × 105 клеток НЕК293, выполняющих роль носителя, и дозированное число клеток ADL-7A и/или A2R9, как правило, 100–5000 клеток. В случае суспензионных клеточных линий использовали от 2 × 105 до 2 × 106 клеток в 100 мкл, клетки PBMC брали в количестве от 5 × 105 до 106 в 100 мкл суспензии. Для снижения неспецифического связывания в суспензию добавляли казеиновый концентрат CBC2 (Stereospecific Detection Technologies, Германия) в разведении 1 : 10.
В пробирки типа эппендорф последовательно вносили 100 мкл клеточной смеси, 20 мкл PBS, или 20 мкл 2.5 мкМ раствора селективного лиганда ICI 118,551, или 20 мкл смеси 2.5 мкМ ICI 118,551 и 2.5 мкМ СGP 20712, затем добавляли 80 мкл раствора 125I‑иодоцианопиндолола в PBS с 10% CBC2. В стандартных экспериментах количество радиоактивности во фракции “bindable” составляло 80 000 имп./мин на пробу. Пробирки с реакционной смесью инкубировали в течение 30 мин при 37°С с перемешиванием на шейкере.
По окончании инкубации пробирки с пробами центрифугировали 10 мин при 2000 g. Супернатант удаляли, осадок суспендировали в 200 мкл PBS, центрифугировали 10 мин при 2000 g, после чего осадок вторично суспендировали в 200 мкл PBS, центрифугировали 5 мин при 10 000 g и удаляли супернатант. Количество связавшейся с клетками радиоактивности определяли при помощи гамма-счетчика 2470 Wizard2 (PerkinElmer, США) с эффективностью счета 79%. Все измерения проводили в трех или четырех параллелях. Отклонение от средней величины не превышало 20%.
В кинетических экспериментах по истечении времени инкубации для полной остановки реакции связывания в пробы добавляли немеченый цианопиндолол до 10 мкМ.
ЗАКЛЮЧЕНИЕ
В данном исследовании разработана и верифицирована методика одновременного раздельного определения β1- и β2-адренорецепторов на основе радиолигандного анализа с использованием 125I-иодоцианопиндолола, определен порог детекции β1‑адренорецепторов, обсуждаются методологические вопросы сопоставления результатов анализа. Верификация методики проведена с помощью модельного смешивания трансгенных линий клеток ADL-7A и A2R9 друг с другом в различных пропорциях и последующего раздельного определения количества β1- и β2-адренорецепторов в получаемых смесях. При соотношении количества β1-адренорецепторов к β2-адренорецепторам 1 : 10 погрешность измерения не превышает 15%, однако с уменьшением доли β1-адренорецепторов до 1 : 40 ошибка измерения резко возрастает и может достигать 40%.
По разработанной методике проанализировано содержание β1- и β2-адренорецепторов в девяти клеточных линиях (различных типах клеток крови), а также в мононуклеарных клетках периферической крови семи здоровых доноров.
Измерение количества β1- и β2-адренорецепторов в мононуклеарных клетках крови здоровых доноров, описанное в настоящей статье, выступает скорее демонстрацией возможности применения разработанной нами методики и не может претендовать на серьезные медико-биологические заключения вследствие явно недостаточного количества исследованных образцов крови.
Важным достижением предложенного метода можно считать возможность использования этого анализа для индивидуального человека (пациента), что делает метод весьма привлекательным для прикладных медицинских целей. Однако, учитывая высокую динамику рецепторного аппарата человека под действием различных факторов (патологии, стресс, лекарственные препараты и проч.), к получаемым данным надо относиться осторожно. Видимо, более информативными и более корректными с медицинской точки зрения будут такие исследования по динамике изменений адренорецепторной активности, как ответ на действие лекарственных препаратов.
Список литературы
Michel M.C., Beckeringh J.J., Ikezono K., Kretsch R., Brodde O.E. // J. Hypertens Suppl. 1986. V. 4. P. S215–S218.
Brodde O.E., Kretsch R., Ikezono K., Zerkowski H.R., Reidemeister J.C. // Science. 1986. V. 231. P. 1584–1585. https://doi.org/10.1126/science.3006250
Zoukos Y., Leonard J.P., Thomaides T., Thompson A.J., Cuzner M.L. // Ann. Neurol. 1992. V. 31. P. 657–662. https://doi.org/10.1002/ana.410310614
Zoukos Y., Thomaides T.N., Kidd D., Cuzner M.L., Thompson A. // J. Neurol. Neurosurg. Psychiatry. 2003. V. 74. P. 197–202. https://doi.org/10.1136/jnnp.74.2.197
Смолякова Е.В., Скоблов Ю.С., Скоблова Н.А., Агапова О.Ю., Амбатьелло Л.Г., Климова А.А., Кузнецова Т.В., Масенко В.П., Нистор С.Ю., Рвачева А.В., Чазова И.Е., Зыков К.А. // Биоорг. химия. 2019. Т. 45. С. 295–301. [Smolyakova E.V., Skoblov Yu.S., Skoblova N.A., Agapova O.Y., Ambatiello L.G., Klimova A.A., Kuznetsova T.V., Masenko V.P., Nistor S.Y., Rvacheva A.V., Chazova I.E., Zykov K.A. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 129–134.] https://doi.org/10.1134/S1068162019020134
Grisanti L.A., Evanson J., Marchus E., Jorissen H., Woster A.P., DeKrey W., Sauter E.R., Combs C.K., Porter J.E. // Mol. Immunol. 2010. V. 47. P. 1244–1254. https://doi.org/10.1016/j.molimm.2009.12.013
Агапова О.Ю., Скоблов Ю.С., Зыков К.А., Рвачева А.В., Бейлина В.Б., Масенко В.П., Чазова И.Е. // Биоорг. химия. 2015. Т. 41. С. 592–598. [Agapova O.Y., Skoblov Yu.S., Zykov K.A., Rvacheva A.V., Beilina V.B., Masenko V.P., Chazova I.E. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 529–535.] https://doi.org/10.1134/s1068162015050027
Hulme E.C., Trevethick M.A. // Br. J. Pharmacol. 2010. V. 161. P. 1219–1237. https://doi.org/10.1111/j.1476-5381.2009.00604.x
Adham N., Tamm J.A., Salon J.A., Vaysse P.J., Weinshank R.L., Branchek T.A. // Neuropharmacology. 1994. V. 33. P. 387–391. https://doi.org/10.1016/0028-3908(94)90068-x
Cheng Y., Prusoff W.H. // Biochem. Pharmacol. 1973. V. 22. P. 3099–3108. https://doi.org/10.1016/0006-2952(73)90196-2
Sager G., Bang B.E., Pedersen M., Aarbakke J. // J. Leukoc. Biol. 1988. V. 44. P. 41–45. https://doi.org/10.1002/jlb.44.1.41
Mäki T., Andersson L.C., Kontula K.K. // Eur. J. Haematol. 1992. V. 49. P. 263–268. https://doi.org/10.1111/j.1600-0609.1992.tb00059.x
Talmadge J., Scott R., Castelli P., Newman-Tarr T., Lee J. // Int. J. Immunopharmacol. 1993. V. 15. P. 219–228. https://doi.org/10.1016/0192-0561(93)90098-j
Brodde O.E., Engel G., Hoyer D., Bock K.D., Weber F. // Life Sci. 1981. V. 29. P. 2189–2198. https://doi.org/10.1016/0024-3205(81)90490-2
Fujii N., Homma S., Yamazaki F., Sone R., Shibata T., Ikegami H., Murakami K., Miyazaki H. // Am. J. Physiol. 1998. V. 274. P. E1106–E1112. https://doi.org/10.1152/ajpendo.1998.274.6.E1106
Красникова Т.Л., Коричнева И.Л., Радюхин В.А. // Биохимия. 1989. Т. 54. С. 235–243.
Агапова О.Ю., Скоблов Ю.С., Ткачев Г.А., Миронова Н.А., Голицын С.П., Масенко В.П., Чазова И.Е., Зыков К.А. // Мол. биология. 2016. Т. 50. С. 999–1006. https://doi.org/10.7868/S0026898416050025
Bundkirchen A., Brixius K., Bölck B., Nguyen Q., Schwinger R.H. // Eur. J. Pharmacol. 2003. V. 460. P. 19–26. https://doi.org/10.1016/s0014-2999(02)02875-3
Tate K.M., Briend-Sutren M.M., Emorine L.J., Delavier-Klutchko C., Marullo S., Strosberg A.D. // Eur. J. Biochem. 1991. V. 196. P. 357–361. https://doi.org/10.1111/j.1432-1033.1991.tb15824.x
Hoffmann C., Leitz M.R., Oberdorf-Maass S., Lohse M.J., Klotz K.N. // Naunyn-Schmiedebergs Arch. Pharmacol. 2004. V. 369. P. 151–159. https://doi.org/10.1007/s00210-003-0860-y
Шевелев А.Я., Каширина Н.М., Кузнецова И.Б., Шарф Т.В., Мамочкина Е.Н., Агапова О.Ю., Гурская Т.Х., Липатова Л.Н., Пекло М.М., Руткевич П.Н., Янушевская Е.В., Рыбалкин И.Н., Скоблов Ю.С., Ефремов Е.Е., Власик Т.Н., Зыков К.А. // Вестник биотехнол. и физ.-хим. биологии им. Ю.А. Овчинникова. 2015. Т. 11. С. 5–14.
Greenwood F.C., Hunter W.M., Glover J.S. // Biochem. J. 1963. V. 89. P. 114–123. https://doi.org/10.1042/bj0890114
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия