Биоорганическая химия, 2022, T. 48, № 5, стр. 531-536
Влияние структуры липидного фрагмента на встраивание и выход гликолипидов из клеток: изучение с помощью синтетических аналогов
Е. В. Сливка 1, А. Б. Тузиков 1, С. В. Хайдуков 1, В. А. Комарова 1, С. Генри 2, Н. В. Бовин 1, Е. М. Рапопорт 1, *
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Centre for Kode Technology Innovation, School of Engineering, Auckland University of Technology
1142 Auckland, Private Bag 92006, New Zealand
* E-mail: eugenia_rapoport@mail.ru
Поступила в редакцию 15.02.2022
После доработки 28.03.2022
Принята к публикации 30.03.2022
- EDN: SCMDRO
- DOI: 10.31857/S0132342322050232
Аннотация
Многие важные аспекты межклеточного транспорта гликосфинголипидов (ГСЛ) остаются неизвестными, в частности, как ГСЛ преодолевают гликокаликс клетки-донора и клетки-акцептора. Изучение этого процесса значительно облегчается, если использовать не природные ГСЛ, а их синтетические аналоги. Однако для получения адекватных результатов мы должны знать, как упрощения структуры молекулы-пробы влияют на принципиально важные ее свойства, в частности, как замена церамидного остатка в ГСЛ на синтетический аналог влияет на кинетику выхода и встраивания. Целью данного исследования было сравнение свойств синтетических аналогов ГСЛ, в составе одного из которых находится природный церамид, а других – более удобные с точки зрения синтеза липидные остатки. Для этого использовали конструкты FSL (Function-Spacer-Lipid), содержащие липидный остаток в трех вариантах: DOPE (1,2-O-диолеоил-sn-глицеро-3-фосфоэтаноламин), холестерин (Chol) и С18-церамид (Cer). Во всех трех молекулах липидный остаток связан с биотином посредством гидрофилизирующего спейсера CMG2. С помощью конфокальной микроскопии показано сходство паттернов локализации этих трех липидов между собой и с изученными ранее (где в качестве F были гликаны разного размера), FSL обнаруживались в виде ограниченных зон (патчей) среднего размера 0.3 мкм и не выявлялись в клеточных рафтах. В то же время наблюдались следующие различия в свойствах трех FSL: 1) процесс встраивания церамидного конструкта выходит на плато в течение 3 ч, в то время как двух других – в течение 1 ч; 2) количество встроенного церамидного конструкта меньше, чем двух других; 3) выход холестеринового конструкта из клеток, куда он предварительно встроен, происходит медленнее, чем двух других. Таким образом, несмотря на некоторые количественные различия, качественно все три конструкта ведут себя похожим образом, что делает их привлекательными при изучении встраивания и выхода ГСЛ из клетки.
ВВЕДЕНИЕ
Гликосфинголипиды (ГСЛ) входят в состав плазматической мембраны всех эукариотических клеток. Они вовлечены в межклеточную адгезию, регулируют пролиферацию и апоптоз клеток, участвуют в передаче клеточных сигналов [1–3]. Многочисленные данные свидетельствуют о том, что ГСЛ способны не только связываться с сигнальными белками и рецепторами на поверхности клетки, но и переходить с клетки на клетку, в результате оказываясь там, где отсутствует машинерия для их синтеза. Например, на эритроцитах выявляются Lea- и Leb-содержащие ГСЛ (определяющие антигенность системы групп крови Льюиса), которые сами эти клетки не синтезируют [4]; эти ГСЛ переносятся из плазмы крови, куда они, в свою очередь, попадают из эндотелия [4–6]. До сих пор нет объяснений, по какому механизму ГСЛ захватываются клетками из крови. Чтобы встроиться в плазматическую мембрану, ГСЛ должен дважды преодолеть гликокаликс – клетки-донора и клетки-акцептора; данных о том, как это происходит, практически нет. Отсутствие данных связано с общими проблемами исследования ГСЛ: как коммерческие реагенты они малодоступны, выделение затруднено вследствие их низкого содержания и гетерогенности по углеводному и липидному фрагментам [7].
Удобный подход в решении сформулированной выше и других задач исследования трафика ГСЛ – применение их синтетических аналогов [8], которые получили название FSL (Function-Spacer-Lipid) [9–11]. Эти конструкты доступны в достаточных для исследования количествах [11], легко встраиваются в мембрану живой клетки, что не влияет на жизнеспособность [12] и выполнение клеткой основных ее функций.
Цель данной работы – изучить, каким образом замена церамидного остатка на синтетический аналог – DOPE или остаток холестерина – повлияет на встраивание в клеточную мембрану и выход встроенного конструкта FSL из клетки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе использовали FSL, в которых гидрофобные остатки представлены тремя вариантами: С18-церамидом (Cer), 1,2-O-диолеоил-sn-глицеро-3-фосфоэтаноламином (DOPE) и холестерином (Chol). Для удобства детекции в качестве функционального остатка F все три конструкта содержали биотин, присоединенный к гидрофобному остатку с помощью гидрофилизирующего карбоксиметилглицильного спейсера CMG2. Структуры FSL приведены на рис. 1.
Рис. 1.
Структура конструктов, использованных в данной работе. Обозначения: biot – биотин; CMG2 – спейсер, содержащий повторяющиеся карбоксиметилглицильные блоки; DOPE – 1,2-O-диолеоил-sn-глицеро-3-фосфоэтаноламин; Chol – O-замещенный холестерин; Cer – C18-церамид. Гидрофобный остаток в составе конструктов выделен рамкой.
Встраивание FSL в клетки. Конструкт (рис. 1) встраивали в монослой клеток EA.hy 926 в среде, содержащей фетальную сыворотку теленка (FCS), которую использовали в пониженной концентрации (0.3%), чтобы избежать предполагаемого влияния сывороточного альбумина на трафик липидов [13]. Встраивание FSL подтверждали и визуализировали с помощью флуоресцентно-меченого стрептавидина (Str-FITC), измеряя среднегеометрическое значение флуоресценции.
DOPE- и Chol-конструкты выявлялись в клетках уже через 20 мин, а на плато (если быть точным, то на участок медленного роста) процесс встраивания выходил к первому часу инкубации (рис. 2). Накапливание церамидного конструкта было в разы медленнее, особенно в начальный период, выходя на плато к третьему часу. На промежутке 3–24 ч степень встраивания менялась незначительно (рис. 2); морфологических изменений клеток не наблюдалось.
Рис. 2.
Кинетика встраивания FSL в клетки EA.hy 926. Клетки инкубировали с конструктами при 37°С. Результаты цитофлуориметрического анализа представлены как среднее двух независимых экспериментов.
Сравнивая интенсивность флуоресценции клеток и калибровочных частиц, содержащих известное количество флуоресцеина, и зная, что одна молекула стрептавидина в среднем связывается с шестью молекулами FITC, а Str-FITC, в свою очередь, связывается с одной или двумя молекулами биотина, мы рассчитали, что количество конструкта, встроившегося за 40 мин, составляет 0.6–1.1 × 105 молекул на клетку церамидного производного, 0.9–1.9 × 105 DOPE и 1.1–2.2 × 105 холестеринового производных, что составляет ~0.01% от количества липидов плазматической мембраны клетки [14].
Расположение FSL в клетке. Локализация FSL была исследована с помощью конфокальной микроскопии. На всех полученных изображениях наблюдалось неравномерное окрашивание, т.е. FSL выявлялись в виде патчей (рис. 3). Анализ распределения флуоресценции в выделенных областях дает размер патчей в интервале 0.2–2.0 мкм, преимущественно 0.3 мкм.
Рис. 3.
Расположение FSL-конструктов по отношению к рафтам клеток EA.hy 926, данные конфокальной микроскопии. Клетки инкубировали с FSL в течение 2 ч при 37°С. Окрашивание рафтов (зеленый цвет) проводили с помощью конъюгата СTB-Alexa Fluor 488, биотин в составе FSL выявляли с помощью конъюгата Str-Alexa Fluor 594 (красный цвет). На гистограммах (нижняя панель) приведено распределение флуоресценции FSL в областях, выделенных белыми прямоугольниками (верхняя панель). По оси абсцисс – координата соответствующей точки на горизонтальной стороне белого прямоугольника; масштабный отрезок 5 мкм.

Клеточные рафты выявляли с помощью холеротоксина В (CТВ), про который известно, что он связывается с ганглиозидом GM1 – обязательным компонентом рафтовых доменов [15]. FSL локализовались преимущественно за пределами рафтов. Незначительная солокализация с GM1 наблюдалась только в случае церамидного конструкта (рис. 3). По-видимому, отсутствие конструкта в рафтах связано с высокой структурной организацией рафтов, из-за чего встраивание в них дополнительного липидного производного (путем “разбавления” липидов рафта или их замещения) невыгодно. Отметим, что внутри клетки конструкты также не выявлялись, т.е. в выбранных условиях не наблюдалось эндоцитоза FSL.
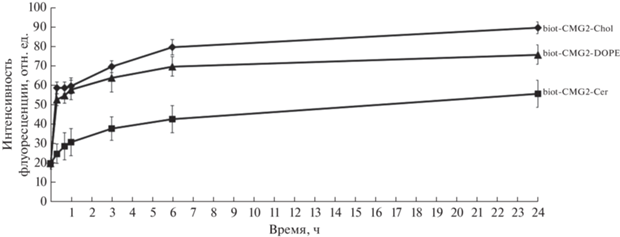
Выход FSL из клеток. Далее мы исследовали, как долго остаются конструкты, нагруженные на клетку, как это описано выше. Для этого после встраивания FSL клетки помещали при 37°С в буферный раствор на сутки в СО2-инкубаторе без перемешивания. В течение первых шести часов наблюдалось значительное снижение интенсивности флуоресценции по сравнению с исходным значением для DOPE- и Сer-конструктов (рис. 4), через 6 ч их оставалось ~50 и 40% соответственно. За это же время выход холестеринового конструкта составил не более 15%, а через 24 ч его терялось всего лишь ~20%. Полученные результаты показали, что большая часть Сer- и DOPE-конструктов выходит из клетки в течение первых суток, тогда как Chol-конструкт удерживается в мембране.
Рис. 4.
Выход FSL из клеток EA.hy 926, данные цитофлуориметрии. Значение “0” соответствует флуоресценции после встраивания FSL и немедленной отмывки. По оси ординат приведена убыль флуоресценции, которую рассчитывали по формуле: [(Fi/F0) × 100] – 100, где Fi и F0 – значения интенсивности флуоресценции клеток в заданное время и при 0 мин соответственно.

При коммуникации клетки обмениваются белками, нуклеиновыми кислотами и липидами, в том числе гликосфинголипидами. В силу гетерогенности по церамидному остатку и многообразия по гликановому, их перенос изучать затруднительно, и поэтому доступная информация о транспорте ГСЛ крайне ограничена; в то же время применение синтетических конструктов привлекательно, т.к. позволяет синтезировать конструкты с разнообразными гликанами и варьировать липидный остаток L в FSL. В предшествующем исследовании [8] мы показали, что размер гликана не оказывает принципиального влияния ни на встраивание FSL в клетку, ни на его выход из клетки. В настоящей работе мы изучили влияние структуры липидного остатка на встраивание и выход FSL из клетки, чтобы понять, насколько оправдано использование DOPE- или Chol-конструктов для изучения процессов с участием ГСЛ, т.е. церамид-содержащих молекул. Во всех случаях конструкты выявлялись в патчах, размер которых мало зависит от природы липидного компонента; DOPE- и Chol-конструкты накапливаются в составе клетки быстрее, чем церамидный, хотя эта разница невелика; количество молекул DOPE- и Chol-конструктов, встроенных в клетку, выше, чем церамидного; Chol-конструкт медленнее выходит из клетки, чем DOPE- и Cer-конструкты. Различия в выходе, скорее всего, объясняются удерживанием конструктов в гликокаликсе клетки. Таким образом, в использованных экспериментальных системах изученные конструкты оказались сходными, хотя в некоторых процессах к церамидному конструкту ближе по свойствам оказался холестериновый, а в других – DOPE-конструкт. Несмотря на то, что универсального “миметика” для церамидного остатка мы не нашли, полученные данные позволяют гибко использовать конструкт того или иного типа в зависимости от конкретной решаемой задачи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использовали культуральную среду DMEM-F12, фетальную сыворотку теленка (FCS) и глутамин (Gibco, США); конъюгаты холеротоксина В (СТB) с Alexa Fluor 488 и стрептавидина с Alexa Fluor 594 (Invitrogen, США); бычий сывороточный альбумин (BSA) и мовиол® 4-88 (Sigma, США); частицы Immuno-Brite (10 мкм), содержащие 31 000, 115 000 или 450 000 остатков флуоресцеина (Beckman Coulter Life Sciences, США); реактивы фирмы Реахим (Россия).
FSL. FSL-конструкты синтезированы, как описано ранее [16], их чистота, подтвержденная ЯМР-спектрометрией, составляет >95%.
Встраивание FSL в клетки EA.hy 926. Клетки EA.hy 926 предоставлены Edgell С.-J. (Chapel Hill, США). Клетки получены путем слияния эндотелиальных клеток из пупочной вены человека с клетками линии А-549 (карциномы легкого). По морфологии и фенотипу они воспроизводят клетки макрососудов [17]. Культивирование клеток проводили в среде DMEM-F12, содержавшей 10%-ную фетальную сыворотку теленка и 2 мМ глутамин, при 37°С в атмосфере 5% СО2 (инкубатор Sanyo, Япония). В лунках 24-луночного планшета (Nunc, Дания) к монослою клеток после отмывки средой DMEM-F12, содержавшей 0.3%-ную фетальную сыворотку теленка (DMEM-0.3% FCS), добавляли FSL (конечная концентрация 5 мкМ). Встраивание проводили, инкубируя клетки с FSL в течение разных промежутков времени при 37°С, 5% СО2. Далее клетки снимали с пластика раствором Версена (PBS, содержавший 0.02% ЭДТА), отмывали 3 раза PBA (PBS, содержавший 0.2% BSA) центрифугированием при 90 g, 4°С в течение 3 мин. Для измерения флуоресценции клеточной суспензии добавляли конъюгат стрептавидина с флуоресцеинизотиоцианатом (Str-FITC) в разведении 1 : 50 в РВА, инкубировали при 4°С в течение 30 мин на шейкере. Затем клетки отмывали 3 раза РВА, переносили в пробирки для цитофлуориметрии, тщательно перемешивали с 2 мл PBS. Флуоресценцию клеток измеряли на проточном лазерном цитофлуориметре FACScan (Becton-Dickinson, CШA) или FC500 (Beckman Coulter, США) при 488 нм и комнатной температуре. Обработку данных проводили с помощью программы FlowJo10.8.0 (Beckton-Dickinson, CША) или Kaluza 1.3 (Beckman-Coulter, США). В каждой пробе анализировали не менее 5000 клеток. Параллельно измеряли флуоресценцию стандартных частиц, полученные значения использовали для построения калибровочного графика и определения количества молекул конструктов, встроенных в одну клетку.
Выход FSL из клеток. FSL инкубировали с клетками EA.hy 926 в лунках 24-луночного планшета в течение 2 ч при 37°С, как указано выше. Клетки отмывали в среде, содержавшей 0.3% FCS, и оставляли в этой же среде без перемешивания при 37°С в атмосфере CO2 (5%) на определенные промежутки времени, после чего снимали с пластика раствором Версена, отмывали трижды PBA в течение 3 мин при 4°C, как описано выше. Флуоресценцию клеток анализировали методом цитофлуориметрии при 488 нм и комнатной температуре.
Конфокальная микроскопия. Детекцию встроенного FSL проводили, инкубируя клетки EA.hy 926 с конъюгатом стрептавидина с Alexa Fluor 594 (разведение 1 : 200 в PBA) при 4°С в течение 20 мин.
Для окрашивания рафтов клетки отмывали PBS и инкубировали с конъюгатом СТВ-Alexa Fluor 488 (разведение 1 : 100 в PBS) на льду в течение 20 мин.
На предметные стекла наносили 15 мкл смеси, содержавшей 2.4 г мовиола, 6 г глицерина, 6 мл воды и 12 мл 0.2 М Tris-HCl (рН 8.5), далее добавляли 10 мкл суспензии клеток. Изображения получали с помощью конфокального микроскопа Eclipse TE-2000-E (Nicon, Япония), в каждом опыте было проанализировано не менее десяти случайно выбранных клеток. Обработку данных проводили с помощью программы ImageJ (https://imagej.nih.gov/ij/download.html).
ЗАКЛЮЧЕНИЕ
В данной работе проведено сравнение трех FSL, имеющих одинаковый полярный участок FS и разные липидные остатки L: остаток С18-церамида, DOPE или холестерина, показана их схожесть в отношении встраивания в клеточную мембрану и выхода этих FSL из нее. Это означает, что при исследовании межклеточного переноса гликосфинголипидов, липидная часть которых представлена церамидом, оправдано использование синтетических аналогов, в которых церамидный фрагмент заменен на другой липидный остаток, в частности на легко синтезируемые производные DOPE. По той же причине DOPE-аналоги природных гликосфинголипидов, встроенные во внеклеточные микровезикулы, обещают стать перспективными молекулами-векторами для увеличения селективности доставки микровезикул, нагруженных терапевтическими молекулами.
Список литературы
Tettamanti G., Bassi R., Viani P., Riboni L. // Biochimie. 2003. V. 85. P. 423–437. https://doi.org/10.1016/s0300-9084(03)00047-6
Hakomori S.-I. // Proc. Natl. Acad. Sci. USA. 2002. V. 99. P. 225–232. https://doi.org/10.1073/pnas.012540899
Hakomori S.-I., Handa K. // Glycoconj. J. 2015. V. 32. P. 1–8. https://doi.org/10.1007/s10719-014-9572-4
Marcus D.M. // Ann. N. Y. Acad. Sci. V. 169. P. 161–163. https://doi.org/10.1111/j.1749-6632.1970.tb55982.x
Hirsch H.F., Graham H.A. // Transfusion. 1980. V. 20. P. 474–475. https://doi.org/10.1046/j.1537-2995.1980.20480260286.x
Oriol R., Danilovs J., Lemieux R., Terasaki P., Bernoco D. // Hum. Immunol. 1980. V. 3. P. 195–205. https://doi.org/10.1016/0198-8859(80)90014-2
Riboni L., Paola Giussani P., Paola Viani P. // In Sphingolipids as Signaling and Regulatory Molecules / Eds. Chalfant C., Poeta M.D. Adv. Exp. Med. Biol. V. 688. New York: Springer, 2010. P. 25–45. https://doi.org/10.1007/978-1-4419-6741-1_2
Rapoport E.M., Khasbiullina N.R., Komarova V.A., Ryzhov I.M., Gorbatch M.M., Tuzikov A.B., Khaidukov S.V., Popova I.S., Korchagina E.Y., Henry S.M., Bovin N.V. // Biochim. Biophys. Acta Biomembr. 2021. V. 1863. P. 183645. https://doi.org/10.1016/j.bbamem.2021.183645
Henry S. // Curr. Opin. Hematol. 2009. V. 16. P. 467–472. https://doi.org/10.1097/moh.0b013e328331257e
Oliver C., Blake D., Henry S. // Transfusion. 2011. V. 51. P. 1723–1730. https://doi.org/10.1111/j.1537-2995.2010.03034.x
Korchagina E., Tuzikov A., Formanovsky A., Popova I., Henry S., Bovin N. // Carbohydr. Res. 2012. V. 356. P. 238–246. https://doi.org/10.1016/j.carres.2012.03.044
Blake D., Bovin N., Bess D., Henry S. // J. Vis. Exp. 2011. V. 54. P. e3289. https://doi.org/10.3791/3289
Schwarzmann G., Hoffmann-Bleihauer P., Schubert J., Sandhoff K., Marsh D. // Biochemistry. 1983. V. 22. P. 5041–5048. https://doi.org/10.1021/bi00290a025
Alberts B., Johnson A., Lewis Ju., Raff M., Roberts K., Walter P. // In Molecular Biology of the Cells, 4th ed. New York, Garland Science, 2002. https://www.ncbi.nlm.nih.gov/books/NBK26871
Nichols B.J. // Curr. Biol. 2003. V. 13. P. 686–690. https://doi.org/10.1016/s0960-9822(03)00209-4
Henry S., Williams E., Barr K., Korchagina E., Tuzikov A., Ilyushina N., Abayzeed S.A., Webb K.F., Bovin N. // Sci. Rep. 2018. V. 8. P. 2845. https://doi.org/10.1038/s41598-018-21186-3
Baranska P., Jerczynska H., Pawlowska Z., Koziolkiewicz V., Cherniewski C. // Cancer Genomics Proteomics. 2005. V. 2. P. 265–270.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


