Биоорганическая химия, 2022, T. 48, № 5, стр. 616-620
Галогенсодержащие 4-гидроксибензилиден-роданины как флуорогены для белка FAST
А. И. Соколов 1, 2, Н. С. Балеева 1, 2, *, М. С. Баранов 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 21.03.2022
После доработки 26.03.2022
Принята к публикации 02.04.2022
- EDN: RROZRA
- DOI: 10.31857/S0132342322050244
Аннотация
Синтезирован ряд (Z)-5-(4-гидроксибензилиден)-2-тиоксотиазолидин-4-онов, содержащих атомы галогенов в разных положениях бензилиденового фрагмента. Все новые соединения проявляют флуорогенные свойства и образуют флуоресцентные комплексы с белком FAST. Показано, что производные, содержащие атомы галогенов в третьем положении 4-гидроксибензилидена, могут быть использованы в качестве лигандов флуороген-активирующего белка FAST во флуоресцентной микроскопии.
ВВЕДЕНИЕ
Среди генетически кодируемых флуоресцентных меток большую популярность приобретают флуороген-активирующие белки [1, 2]. Такие белки применяют в паре с флуорогенами – небольшими органическими соединениями. Взаимодействие эти двух компонентов приводит к образованию комплекса с яркой флуоресценцией, в то время как по отдельности белок и его лиганд не флуоресцируют. Благодаря такому принципу работы эти белки имеют ряд преимуществ в сравнении с прочими флуоресцентными метками. Применение самомодифицирующихся белков обязательно включает отмывку ярко флуоресцирующего несвязанного флуорофора [3, 4], в то время как при использовании флуороген-активирующих белков стадию отмывки можно исключить, поскольку в свободном виде флуороген не дает фонового сигнала. Другому типу генетически-кодируемых меток – флуоресцентным белкам – для созревания хромофора необходимы дополнительное время и присутствие кислорода [5], тогда как у флуороген-активирующих белков хромофор может быть добавлен в любой момент. Еще одно преимущество флуороген-активирующих белков – их малый размер. В то время как молекулярная масса флуоресцентных белков составляет 26–30 кДа [6], наиболее известный флуороген-активирующий белок FAST имеет массу всего 14 кДа [7], а недавно нами был предложен белок nanoFAST массой всего 10.8 кДа – на данный момент это самая маленькая генетически кодируемая метка [8].
В качестве флуорогенов белка FAST используются различные арилиден-имидазолоны или арилиден-роданины [9–11]. При рассмотрении структур роданиновых лигандов можно увидеть, что введение различных групп в бензилиденовом фрагменте молекулы зачастую не приводит к потере флуорогенных свойств (рис. 1) [9]. Однако такие модификации влияют на флуоресцентные свойства комплекса, в частности происходит батохромное смещение максимумов поглощения и испускания при введении более электронно-донорных заместителей. Поскольку важным свойством флуоресцентных меток, применяемых во флуоресцентной микроскопии, выступает цветовое разнообразие, мы решили ввести другие заместители, изостерические относительно уже существующих флуорогенов, однако обладающие иными электронно-донорными или акцепторными эффектами, и исследовать влияние этих замен на флуорогенные свойства.
Рис. 1.
Строение известных 4-гидроксибензилиден-роданиновых флуорогенов белка FAST и оптические свойства флуоресцентных комплексов FAST–флуороген.

Целью настоящей работы стало создание ряда 4-гидроксибензилиден-роданинов, содержащих разные галогеновые заместители в разных положениях бензилиденового фрагмента, и изучение флуорогенных свойств новых соединений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
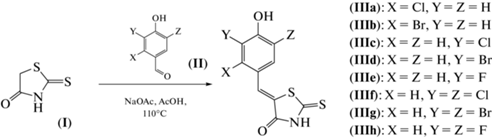
4-Гидроксибензилиден-роданины (III) были синтезированы путем конденсации насыщенного роданина (I) с разными галогенсодержащими альдегидами (II). Реакцию проводили в уксусной кислоте в присутствии ацетата натрия при нагревании (схема 1 ). Изучение оптических свойств полученных производных показало, что все они характеризуются абсорбцией с максимумами в области 380–390 нм. Также было установлено, что эти соединения слабо флуоресцируют (квантовый выход не выше 0.5%) с максимумом ~440–450 нм.
Схема 1 . Схема синтеза соединений (III).
Дальнейшие исследования показали, что все полученные соединения проявляют флуорогенные свойства – при смешивании с белком FAST происходит резкое усиление флуоресценции. Наиболее яркое разгорание (в 30–70 раз) было зафиксировано для соединений, имеющих галогеновый заместитель в третьем положении ароматического фрагмента (соединения (IIIс–e)), и для дизамещенных аналогов (соединения (IIIf–h)). Также мы установили, что новые производные (III) хорошо связываются с белком FAST. Значение Kd варьировало от 0.03 до 0.30 мкМ (для известных роданиновых лигандов белка FAST значение Kd составляет 0.01–0.97 мкМ [7, 9]).
Для более подробного изучения мы отобрали наиболее перспективных кандидатов на роль новых флуорогенов белка FAST – соединения, которые имеют Kd < 0.20 мкМ и при этом разгораются в присутствии белка более чем в 60 раз. В результате была выбрана пара производных, содержащих атомы хлора и брома в третьем положении ароматического кольца (соединения (IIIc) и (IIId) соответственно). Установлено, что при взаимодействии с белком FAST эти соединения образуют флуоресцентные комплексы с максимумом абсорбции ~470 нм и максимумом эмиссии ~530 нм (рис. 2). Оба комплекса характеризуются схожей яркостью: квантовым выходом 11% и коэффициентом экстинкции ~45 000 М–1 см–1 (табл. 1).
Рис. 2.
Нормализованные спектры абсорбции (зеленые кривые) и эмиссии (красные кривые) комплексов FAST–(IIIc) (а) и FAST–(IIId) (б) в фосфатном буфере.
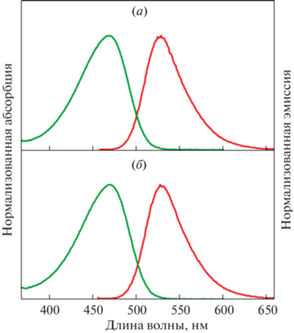
Таблица 1.
Оптические свойства комплексов белка FAST в фосфатном буфере
| Комплекс | Максимум поглощения, нм | Максимум эмиссии, нм | Kd, мкM | Коэффициент экстинкции, М–1 см–1 | Квантовый выход флуоресценции, % |
|---|---|---|---|---|---|
| FAST–HBR | 467 | 527 | 0.62 | 44 000 | 9 |
| FAST–(IIIc) | 469 | 527 | 0.14 | 46 500 | 11 |
| FAST–(IIId) | 470 | 530 | 0.13 | 45 500 | 11 |
Примечание: данные для комплекса FAST–HBR взяты из статьи Plamont et al. [7].
Мы сравнили полученные результаты с данными, известными для других роданиновых флуорогенов, и установили, что комплекс FAST–HBR (4‑гидроксибензилиден-роданин без заместителей в фенольном кольце) проявляет наиболее схожие свойства [7]. Он поглощает и испускает свет с максимумами 467 и 527 нм соответственно, но с заметно меньшей интенсивностью, чем комплексы FAST–(IIIc) и FAST–(IIId) (табл. 1). Прочие же известные роданиновые комплексы белка FAST характеризуются более длинноволновыми максимумами абсорбции и эмиссии (минимальная разница составляет 15 нм) [9]. Таким образом, модификация роданиновых флуорогенов белка FAST введением атомов брома и хлора в третье положение фенольной группы позволила увеличить цветовую палитру генетически кодируемых флуоресцентных меток на основе белка FAST.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры ЯМР (δ, м.д.; J, Гц) регистрировали на спектрометре Avance III NMR (700 МГц; Bruker, США) при 303 K в DMSO-d6 (внутренний стандарт – Me4Si), спектры поглощения – на спектрофотометре Cary 100 Bio (Varian, США), спектры флуоресценции – на спектрофлуориметре Cary Eclipse (Varian, США). Температуры плавления определяли на приборе SMP 30 (Stuart Scientific, Великобритания) и не исправляли. Масс-спектры высокого разрешения регистрировали на приборе micrOTOF II (Bruker, Германия), ионизация электрораспылением.
Белок FAST. Препарат белка FAST получен согласно методике, описанной ранее [9].
Синтез (Z)-5-(4-гидроксибензилиден)-2-тиоксотиазолидин-4-онов (III). В пробирку с завинчивающейся крышкой помещали соответствующий ароматический альдегид (2 ммоль), 2-тиоксотиазолидин-4-он (320 мг, 2.4 ммоль), безводный ацетат натрия (492 мг, 6 ммоль) и 5 мл ледяной уксусной кислоты. Полученную смесь перемешивали при 110°С в течение 2–5 ч. За прохождением реакции следили по ТСХ (элюент – хлороформ и этанол, 50 : 1). После окончания реакции реакционную смесь охлаждали до комнатной температуры и выливали в 100 мл дистиллированной воды. Полученный раствор подкисляли соляной кислотой (водный раствор, 5%) до pH 2.0. Выпавший осадок отфильтровывали и промывали дистиллированной водой (2 × 30 мл). Полученный продукт перекристаллизовывали из смеси CH2Cl2/MeOH (v/v, 10 : 1) с добавлением н-гексана.
(Z)-5-(2-Хлор-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIa). Оранжевый порошок (433 мг, 80%); т. пл. 267–269°C. 1H-ЯМР: 6.95 (дд, J2 8.6, 2.3, 1H), 7.02 (д, J2 2.3, 1H), 7.40 (д, J2 8.6, 1H), 7.73 (с, 1H), 10.83 (с, 1H), 13.82 (уш. с., 1H). 13C-ЯМР: 115.8, 117.2, 121.3, 124.4, 126.6, 130.9, 136.6, 160.7, 169.3, 195.4. HRMS (ESI), m/z: найдено М, 269.9455; рассчитано для C10H5ClNO2${\text{S}}_{2}^{ - }$, [M – H]– 269.9456.
(Z)-5-(2-Бром-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIb). Оранжевый порошок (120 мг, 19%); т. пл. 234–236°C. 1H-ЯМР: 6.98 (дд, J2 8.7, 2.5, 1H), 7.19 (д, J2 2.6, 1H), 7.38 (д, J2 8.6, 1H), 7.71 (с, 1H), 10.80 (с, 1H), 13.80 (уш. с., 1H). 13C-ЯМР: 116.2, 120.4, 122.9, 124.6, 127.5, 129.4, 130.9, 160.6, 169.3, 195.4. HRMS (ESI), m/z: найдено М, 313.8957; рассчитано для C10H5BrNO2${\text{S}}_{2}^{ - }$, [M – H]– 313.8951.
(Z)-5-(3-Хлор-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIc). Оранжевый порошок (158 мг, 29%); т. пл. 265–266°C. 1H-ЯМР: 7.12 (д, J2 8.6, 1H), 7.39 (дд, J2 8.6, 2.3, 1H), 7.55 (с, 1H), 7.65 (д, J2 2.3, 1H), 11.16 (с, 1H), 13.74 (уш. с., 1H). 13C-ЯМР: 117.4, 120.8, 122.8, 125.2, 130.3, 130.8, 132.9, 155.6, 169.3, 195.2. HRMS (ESI), m/z: найдено М, 269.9455; рассчитано для C10H5ClNO2${\text{S}}_{2}^{ - }$, [M – H]– 269.9456.
(Z)-5-(3-Бром-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIId). Желтый порошок (417 мг, 66%); т. пл. 263–265°C. 1H-ЯМР: 7.10 (д, J2 8.4, 1H), 7.42 (дд, J2 8.5, 2.3, 1H), 7.54 (c, 1H), 7.78 (д, J2 2.2, 1H), 11.22 (с, 1H), 13.73 (уш. с., 1H). 13C-ЯМР: 110.3, 117.1, 122.7, 125.6, 130.7, 130.9, 136.0, 156.6, 169.3, 195.2. HRMS (ESI), m/z: найдено М, 313.8957; рассчитано для C10H5BrNO2${\text{S}}_{2}^{ - }$, [M – H]– 313.8951.
(Z)-5-(3-Фтор-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIe). Оранжевый порошок (65 мг, 13%); т. пл. 261–263°C. 1H-ЯМР: 7.11 (т, J2 8.7, 1H), 7.27 (дд, J2 8.4, 2.2, 1H), 7.45 (дд, J2 12.2, 2.3, 1H), 7.56 (с, 1H), 10.85 (с, 1H), 13.74 (уш. с., 1H). 13C-ЯМР: 118.6, 122.8, 124.6 (д, J2 6.6), 127.6, 131.1, 132.9 (д, J2 3.7), 147.9 (д, J2 11.7), 151.0 (д, J2 243.2), 169.4, 195.3. HRMS (ESI), m/z: найдено М, 253.9753; рассчитано для C10H5FNO2${\text{S}}_{2}^{ - }$, [M – H]– 253.9751.
(Z)-5-(3,5-Дихлор-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIf). Желтый порошок (202 мг, 33%); т. пл. 268–269°C. 1H-ЯМР: 7.53 (c, 1H), 7.57 (c, 2H), 11.21 (уш. с., 1H), 13.69 (уш. с., 1H). 13C-ЯМР: 122.8, 124.7, 125.8, 129.1, 130.3, 151.0, 169.0, 194.7. HRMS (ESI), m/z: найдено М, 303.9072; рассчитано для C10H4Cl2NO2${\text{S}}_{2}^{ - }$, [M – H]– 303.9066.
(Z)-5-(3,5-Дибром-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIg). Оранжевый порошок (120 мг, 19%); т. пл. 310–321°C с разложением. 1H-ЯМР: 7.54 (с, 1H), 7.75 (с, 2H), 10.95 (уш. с., 1H), 13.77 (уш. с., 1H). 13C-ЯМР: 112.4, 124.8, 127.4, 129.0, 134.1, 152.9, 169.1, 194.8. HRMS (ESI), m/z: найдено М, 393.8041; рассчитано для C10H5Br2NO2${\text{S}}_{2}^{ - }$, [M – H]– 393.8035.
(Z)-5-(3,5-Дифтор-4-гидроксибензилиден)-2-тиоксотиазолидин-4-он (IIIh). Желтый порошок (390 мг, 71%); т. пл. 272–273°C. 1H-ЯМР: 7.27 (д, J2 8.5, 2H), 7.51 (с, 1H), 11.23 (уш. с., 1H), 13.78 (уш. с., 1H). 13C-ЯМР: 114.1 (дд, J2 17.3, 5.3), 123.3 (т, J2 9.2), 124.6, 129.9, 136.5 (т, J2 16.4), 152.2 (дд, J2 243.7, 7.8), 169.2, 195.0. HRMS (ESI), m/z: найдено М, 271.9654; рассчитано для C10H4F2NO2${\text{S}}_{2}^{ - }$, [M – H]– 271.9657.
ЗАКЛЮЧЕНИЕ
Синтезирован ряд галогенсодержащих (Z)-5-(4-гидроксибензилиден)-2-тиоксотиазолидин-4-онов. Установлено, что все новые соединения обладают флуорогенными свойствами и способны образовывать флуоресцентные комплексы с белком FAST. Показано, что 3-хлор- и 3-бром-4-гидроксибензилиден-роданины не уступают по эффективности известным роданиновым флуорогенам, расширяют цветовую палитру флуорогенов белка FAST и могут применяться во флуоресцентной микроскопии.
Список литературы
Gallo E. // Bioconjug. Chem. 2020. V. 31. P. 16–27. https://doi.org/10.1021/acs.bioconjchem.9b00710
Dou J., Vorobieva A.A., Sheffler W., Doyle L.A., Park H., Bick M.J., Mao B., Foight G.W., Lee M.Y., Gagnon L.A., Carter L., Sankaran B., Ovchinnikov S., Marcos E., Huang P.-S., Vaughan J.C., Stoddard B.L. // Nature. 2018. V. 561. P. 485. https://doi.org/10.1038/s41586-018-0509-0
Los G.V., Encell L.P., McDougall M.G., Hartzell D.D., Karassina N., Zimprich C., Wood M.G., Learish R., Friedman Ohana R., Urh M., Simpson D., Mendez J., Zimmerman K., Otto P., Vidugiris G., Zhu J., Darzins A., Klaubert D.H., Bulleit R.F., Wood K.V. // ACS Chem. Biol. 2008. V. 3. P. 373–382. https://doi.org/10.1021/cb800025k
Gronemeyer T., Chidley C., Juillerat A., Heinis C., Johnsson K. // Protein Eng. Des. Sel. 2006. V. 7. P. 309–316. https://doi.org/10.1093/protein/gzl014
Balleza E., Kim J.M., Cluzel P. // Nat. Methods. 2018. V. 15. P. 47–51. https://doi.org/10.1038/nmeth.4509
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiol. Rev. 2010. V. 90. P. 1103–1163. https://doi.org/10.1152/physrev.00038.2009
Plamont M.A., Billon-Denis R., Maurin S., Gauron C., Pimenta F.M., Specht C.G., Shi J., Quérard J., Pan B., Rossignol J., Moncoq K., Morellet N., Volovitch M., Lescop E., Chen Y., Triller A., Vriz S., Saux T., Jullien L., Gautier A. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 497–502. https://doi.org/10.1073/pnas.1513094113
Mineev K.S., Goncharuk S.A., Goncharuk M.V., Povarova N.V., Sokolov A.I., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Ruchkin D.A., Bukhdruker S., Remeeva A., Mishin A., Borshchevskiy V., Gordeliy V., Arseniev A.S., Gorbachev D.A., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. Sci. 2021. V. 12. P. 6719–6725. https://doi.org/10.1039/d1sc01454d
Li C., Plamont M.A., Sladitschek H.L., Rodrigues V., Aujard I., Neveu P., Saux T., Jullien L., Gautier A. // Chem. Sci. 2017. V. 8. P. 5598–5605. https://doi.org/10.1039/C7SC01364G
Povarova N.V., Zaitseva S.O., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Zagudaylova M.B., Bozhanova N.G., Gorbachev D.A., Malyshevskaya K.K., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. A Eur. J. 2019. V. 25. P. 9592–9596. https://doi.org/10.1002/chem.201901151
Myasnyanko I.N., Gavrikov A.S., Zaitseva S.O., Smirnov A.Y., Zaitseva E.R., Sokolov A.I., Malyshevskaya K.K., Baleeva N.S., Mishin A.S., Baranov M.S. // Chem. A Eur. J. 2021. V. 27. P. 3986–3990. https://doi.org/10.1002/chem.202004760
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия