Биоорганическая химия, 2022, T. 48, № 6, стр. 751-756
Кетопроизводные арилиден-имидазолонов как флуорогенные красители
А. И. Соколов 1, 2, А. А. Горшкова 1, Н. С. Балеева 1, 2, *, М. С. Баранов 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 12.04.2022
После доработки 22.04.2022
Принята к публикации 24.04.2022
- EDN: FVJRNV
- DOI: 10.31857/S0132342322060240
Аннотация
Синтезированы четыре (Z)-2-ацетил-4-бензилиден-1-метил-1Н-имидазол-5(4Н)-она, характеризующиеся значительным варьированием интенсивности флуоресценции в различных средах. Установлено, что введение 2-ацетильной группы позволяет значительно сместить положение спектральных максимумов в длинноволновую область. Показано, что полученные кетопроизводные арилиден-имидазолонов могут использоваться для окрашивания эндоплазматического ретикулума во флуоресцентной микроскопии.
ВВЕДЕНИЕ
Флуоресцентные белки – самый распространенный тип генетически кодируемых флуоресцентных меток. Такие белки способны автокаталитически из собственных аминокислотных остатков формировать внутренние ароматические структуры – хромофоры, которые представляют собой различные арилиден-имидазолоны. На сегодняшний день во флуоресцентной микроскопии применяется множество разноцветных флуоресцентных белков, имеющих хромофоры разного строения [1]. Среди них отдельное место занимают белки, содержащие в своем составе хромофоры с ацильной группой во втором положении имидазолонового цикла, например, белок AsFP [2]. Наличие такой группы обусловливает значительное батохромное смещение максимумов поглощения и эмиссии этих белков.
Известно, что арилиден-имидазолоны в свободном от белка виде флуоресцируют крайне слабо [3]. Это объясняется возможностью безызлучательного сброса энергии возбуждения из-за подвижности арилиденового фрагмента [4]. Однако благодаря таким свойствам арилиден-имидазолоны можно использовать в качестве флуорогенных красителей, например, для окрашивания белков и нуклеиновых кислот, а также отдельных клеточных органелл [5–9].
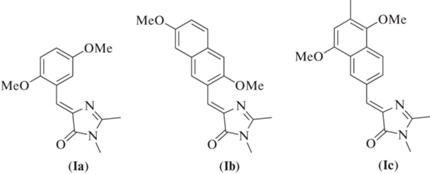
Ранее было показано, что некоторым арилиден-имидазолонам свойственно заметное варьирование интенсивности флуоресценции в разных средах [10–13]. Такое свойство позволило применять эти соединения в роли своего рода флуоресцентных “сенсоров полярности” и использовать для окрашивания эндоплазматического ретикулума и других органелл. Было установлено, что к подобной группе относятся арилиден-имидазолоны, имеющие одновременно два электронно-донорных заместителя в мета- и орто-положениях арилиденового фрагмента (схема 1 , соединения (I)) [11, 14, 15]. Позднее мы показали, что введение во второе положение имидазолонового цикла этих соединений стирольных заместителей позволяет сохранить такое варьирование [14, 15]. Введение стирольных групп – важная модификация в химии красителей, которая позволяет увеличить размер π-системы и, как следствие, приводит к батохромному сдвигу спектральных максимумов. Подобные красители особо востребованы во флуоресцентной микроскопии, т.к. длинноволновое излучение наименее токсично для живых тканей.
Схема 1 . Строение соединений (I).
В настоящей работе изучено влияние другой модификации, которая может привести к смещению максимумов поглощения и испускания в длинноволновую область. Проведенные нами ранее исследования показали, что введение кетогруппы во второе положение имидазолонового кольца разных арилиден-имидазолонов часто приводит к батохромному сдвигу спектральных максимумов на 50–100 нм [16, 17]. Поэтому целью данной работы стали синтез кетопроизводных арилиден-имидазолонов (I) и изучение влияния кетогруппы в структуре на оптические свойства этих красителей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
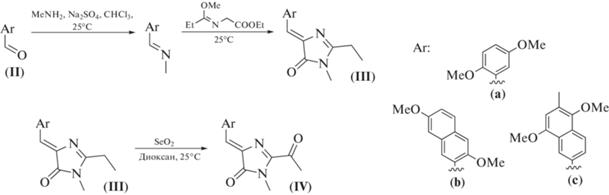
На первой стадии синтеза из различных ароматических альдегидов (II) были получены соответствующие арилимины, из которых без дополнительной очистки с помощью [3+2]циклоприсоединения были синтезированы арилиден-имидазолоны (III) (схема 2 ). Затем арилиден-имидазолоны (III) под действием диоксида селена были окислены до соответствующих кетопроизводных (IV) (схема 2 ).
Схема 2 . Синтез соединений (III) и (IV).
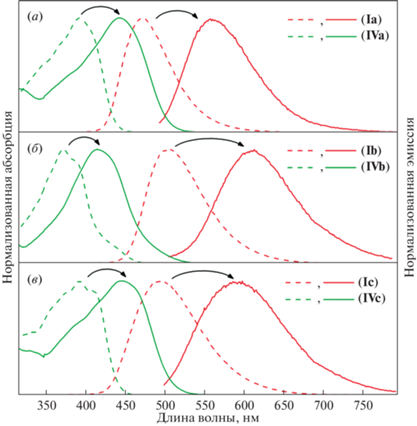
На следующем этапе работы были изучены оптические свойства полученных кетонов (IV). Установлено, что максимумы абсорбции находятся в области 410–450 нм, а максимумы эмиссии – в области 560–630 нм (табл. 1). Сравнение этих результатов с данными, известными для соединений (I), показывает, что введение кетогруппы приводит к батохромному сдвигу максимумов на 50–100 нм (отмечено на рис. 1 стрелками) и заметному увеличению стоксового сдвига (разница между максимумами эмиссии и абсорбции) (рис. 1). Выбранная нами модификация также привела к небольшому снижению интенсивности флуоресценции. Так, квантовый выход флуоресценции кетонов (IV) в диоксане составляет 1.2–4.2%, в то время как соединения (I) флуоресцируют в этом растворителе с квантовым выходом 6–40% [14, 15]. Однако новые производные (IV), так же как и соединения (I), характеризовались выраженным варьированием величины квантового выхода (табл. 1), что говорит о перспективности их использования в роли “сенсоров полярности” для живых систем.
Таблица 1.
Оптические свойства соединений (IV) в разных растворителях
| Соединение | MeOH | CH3CN | EtOAc | Диоксан | |
|---|---|---|---|---|---|
| (IVa) | Максимум поглощения, нм | 447 | 444 | 444 | 444 |
| Коэффициент экстинкции, М–1 см–1 | 18 000 | 20 500 | 20 500 | 20 500 | |
| Максимум эмиссии, нм | 599 | 603 | 570 | 561 | |
| Квантовый выход флуоресценции, % | <0.5 | 1.9 | 2.9 | 3.2 | |
| (IVb) | Максимум поглощения, нм | 412 | 413 | 415 | 416 |
| Коэффициент экстинкции, М–1 см–1 | 25 500 | 27 500 | 27 500 | 27 000 | |
| Максимум эмиссии, нм | ~600 | ~570 | 623 | 612 | |
| Квантовый выход флуоресценции, % | <0.5 | <0.5 | 0.7 | 1.2 | |
| (IVc) | Максимум поглощения, нм | 449 | 448 | 449 | 446 |
| Коэффициент экстинкции, М–1 см–1 | – | 14 500 | 15 500 | 15 000 | |
| Максимум эмиссии, нм | ~620 | ~630 | 620 | 590 | |
| Квантовый выход флуоресценции, % | <0.5 | <0.5 | 1.2 | 4.2 |
Рис. 1.
Спектры поглощения (зеленый) и эмиссии (красный) соединений (I) (пунктир) и кетопроизводных (IV) (сплошная) в диоксане; (a) – соединения (Ia) и (IVa), (б) – соединения (Ib) и (IVb), (в) – соединения (Ic) и (IVc).
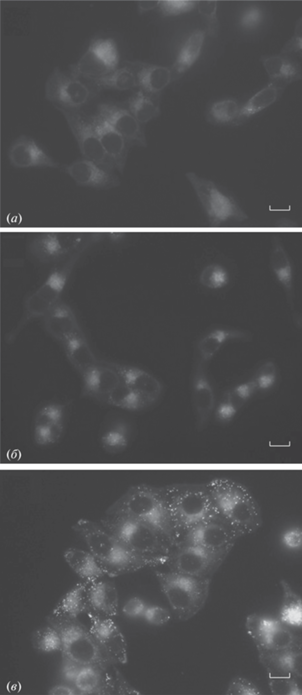
В связи с тем, что квантовый выход соединений (IV) варьируется, на заключительном этапе данной работы мы решили исследовать возможность их использования для окрашивания клеточных культур. Было установлено, что при добавлении растворов кетонов (IV) к клеткам линии HeLa Kyoto в конечной концентрации 10 мкМ появляется выраженная флуоресценция, ассоциированная со структурами эндоплазматического ретикулума (рис. 2). Наиболее яркая флуоресценция наблюдалась для производного (IVc), однако окрашивание в этом случае было наименее селективным, т.к. помимо флуоресценции структур эндоплазматического ретикулума наблюдалось формирование ярких флуоресцентных капель, вызванное вероятной агрегацией красителя. Аналогичным поведением характеризовалось производное (IVb), хотя формирование агрегатов в этом случае было менее выражено. Вероятно, наличие нафталинового фрагмента в структуре этих двух соединений снижает их растворимость в воде и облегчает формирование агрегатов. Наилучший же результат был достигнут для производного (IVa), имеющего наименьший размер.
Рис. 2.
Окрашивание эндоплазматического ретикулума кетопроизводными (IV) в живых клетках линии H-eLa Kyoto; (a) – соединение (IVa), (б) – соединение (IVb), (в) – соединение (IVc). Конечная концентрация соединений – 10 мкМ. Масштабный отрезок – 10 мкм.
Таким образом, мы установили, что кетоны (IV), как и арилиден-имидазолоны (I), способны окрашивать эндоплазматический ретикулум и могут найти свое применение во флуоресцентной микроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры ЯМР (δ, м.д.; J, Гц) регистрировали на приборах Bruker Fourier 300 (300 МГц; Bruker, США), Bruker Avance III NMR (700 МГц; Bruker, США) и Bruker Avance III NMR (800 МГц; Bruker, США), оснащенном 5-мм криодатчиком TXI, в DMSO-d6 и CDCl3 (внутренний стандарт – Me4Si). Спектры поглощения в УФ- и видимом диапазоне регистрировали на спектрофотометре Varian Cary 100 Bio (Varian, США), спектры флуоресценции – на спектрофлуориметре Varian Cary Eclipse (Varian, США). Температуры плавления определяли на приборе SMP30 (Stuart Scientific, Великобритания) и не исправляли. Масс-спектры высокого разрешения регистрировали на приборе TripleTOF 5600+ (AB Sciex, США) с ионизацией методом электроспрея (ESI). Напряжение на капилляре 5.5 кВ в режиме регистрации положительных ионов, 4.5 кВ в режиме регистрации отрицательных ионов. Поток газа-носителя – 15 Arb, газа-распылителя – 25 Arb. Пробы вводили с помощью шприцевого насоса со скоростью потока 20 мкл/мин.
Синтез 2-этил-1-метил-1Н-имидазол-5(4Н)-онов (II). К раствору ароматического альдегида (5 ммоль, 1 экв.) в хлороформе (50 мл) добавляли 40%-ный водный раствор метиламина (2.2 мл, 25 ммоль, 5 экв.), после чего в колбу вносили безводный сульфат натрия до исчезновения водного слоя в реакционной смеси. Колбу закрывали пробкой и выдерживали при комнатной температуре в течение 96 ч. Далее суспензию отфильтровывали и сушили над безводным сульфатом натрия. Осушитель отфильтровывали, а раствор упаривали при пониженном давлении. К остатку после упаривания добавляли карбоксиимидат (1.13 г, 6.5 ммоль, 1.3 экв.). Полученную смесь перемешивали при комнатной температуре в течение 96 ч. Целевой продукт выделяли и очищали методом флеш-хроматографии (элюент – хлороформ и этанол, 100 : 3).
Синтез 2-этил-1-метил-1Н-имидазол-5(4Н)-онов (III). К раствору 2-этил-1-метил-1Н-имидазол-5(4Н)-она (0.4 ммоль, 1 экв.) в диоксане (8 мл) добавляли диоксид селена(IV) (88 мг, 0.8 ммоль, 2 экв.). Полученную смесь выдерживали в масляной бане при 100°C в течение 30 мин. Затем смесь охлаждали до комнатной температуры, разбавляли этилацетатом (80 мл) и переносили в делительную воронку, где смесь последовательно промывали насыщенным раствором карбоната калия (100 мл) и насыщенным раствором хлорида калия (3 × 100 мл). Органическую фазу отделяли, сушили над безводным сульфатом натрия. Осушитель отфильтровывали, а раствор упаривали при пониженном давлении. Целевые соединения выделяли из остатка после упаривания с помощью флеш-хроматографии (элюент – этилацетат и гексан, 1 : 2).
Выходы реакций, температуры плавления и спектральные характеристики синтезированных соединений (II) и (III) приведены в дополнительных материалах.
Флуоресцентная микроскопия. Скрининг соединений проводили с использованием живых клеточных культур HeLa Kyoto (ATCC). Соединения добавляли к клеткам HeLa Kyoto в концентрациях 1–10 мкM (соединения разводили из 1 мM стокового раствора в DMSO). Изображения получали на инвертированном широкопольном флуоресцентном микроскопе BZ-9000 (Keyence, Япония) с объективом Nikon Plan Apo 60× 1.40 Oil (Nikon, США) и набором светофильтров Keyence GFP-B EX 470/40 DM 495 BA 535/50.
ЗАКЛЮЧЕНИЕ
Синтезированы четыре кетопроизводных арилиден-имидазолонов. Установлено, что введение кетогруппы не приводит к существенным изменениям оптических свойств, и для всех новых соединений, как и для оригинальных арилиден-имидазолонов, характерно варьирование величины квантового выхода флуоресценции при замене растворителя. Продемонстрировано, что синтезированные кетоны перспективны в качестве красителей во флуоресцентной микроскопии, т.к. они способны окрашивать эндоплазматический ретикулум.
Список литературы
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiol. Rev. 2010. V. 90. P. 1103–1163. https://doi.org/10.1152/physrev.00038.2009
Yampolsky I.V., Remington S.J., Martynov V.I., Potapov V.K., Lukyanov S., Lukyanov K.A. // Biochemistry. 2005. V. 44. P. 5788–5793. https://doi.org/10.1021/bi0476432
Deng H., Zhu X. // Mater. Chem. Front. 2017. V. 1. P. 619–629. https://doi.org/10.1039/C6QM00148C
Baranov M.S., Lukyanov K.A., Borissova A.O., Shamir J., Kosenkov D., Slipchenko L.V., Tolbert L.M., Yampolsky I.V., Solntsev K.M. // J. Am. Chem. Soc. 2012. V. 134. P. 6025–6032. https://doi.org/10.1021/ja3010144
Plamont M.A., Billon-Denis E., Maurin S., Gauron C., Pimenta F.M., Specht C.G., Shi J., Quérard J., Pan B., Rossignol J., Moncoq K., Morellet N., Volovitch M., Lescop E., Chen Y., Triller A., Vriz S., Le Saux T., Jullien L., Gautier A. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 497–502. https://doi.org/10.1073/pnas.1513094113
Bozhanova N.G., Baranov M.S., Klementieva N.V., Sarkisyan K.S., Gavrikov A.S., Yampolsky I.V., Zagaynova E.V., Lukyanov S.A., Lukyanov K.A., Mishin A.S. // Chem. Sci. 2017. V. 8. P. 7138–7142. https://doi.org/10.1039/C7SC01628J
Paige J.S., Wu K.Y., Jaffrey S.R. // Science. 2011. V. 333. P. 642–646. https://doi.org/10.1126/science.1207339
Filonov G.S., Moon J.D., Svensen N., Jaffrey S.R. // J. Am. Chem. Soc. 2014. V. 136. P. 16299–308. https://doi.org/10.1021/ja508478x
Collot M., Kreder R., Tatarets A.L., Patsenker L.D., Melya Y., Klymchenko A.S. // Chem. Commun. 2015. V. 51. P. 17136–17139. https://doi.org/10.1039/C5CC06094J
Chuang W.-T., Hsieh C.-C., Lai C.-H., Lai C.-H., Shih C.-W., Chen K.-Y., Hung W.-Y., Hsu Y.-H., Chou P.-T. // J. Org. Chem. 2011. V. 76. P. 8189–8202. https://doi.org/10.1021/jo2012384
Deng H., Yu C., Gong L., Zhu X. // J. Phys. Chem. Lett. 2016. V. 7. P. 2935–2944. https://doi.org/10.1021/acs.jpclett.6b01251
Ermakova Y.G., Sen T., Bogdanova Y.A., Smirnov A.Y., Baleeva N.S., Krylov A.I., Baranov M.S. // J. Phys. Chem. Lett. 2018. V. 9. P. 1958–1963. https://doi.org/10.1021/acs.jpclett.8b00512
Ermakova Y.G., Bogdanova Y.A., Baleeva N.S., Zaitseva S.O., Guglya E.B., Smirnov A.Y., Zagudaylova M.B., Baranov M.S. // Dye Pigment. 2019. V. 170. P. 107 550. https://doi.org/10.1016/j.dyepig.2019.107550
Smirnov A.Y., Perfilov M.M., Zaitseva E.R., Zagudaylova M.B., Zaitseva S.O., Mishin A.S., Baranov M.S. // Dye Pigment. 2020. V. 177. P. 108258. https://doi.org/10.1016/j.dyepig.2020.108258
Perfilov M.M., Zaitseva E.R., Smirnov A.Y., Mikhaylov A.A., Baleeva N.S., Myasnyanko I.N., Mishin A.S., Baranov M.S. // Dye Pigment. 2022. V. 198. P. 110 033. https://doi.org/10.1016/j.dyepig.2021.110033
Sokolov A.I., Myasnyanko I.N., Baleeva N.S., Baranov M.S. // ChemistrySelect. 2020. V. 5. 7000–7003. https://doi.org/10.1002/slct.202001782
Zaitseva E.R., Smirnov A.Y., Myasnyanko I.N., Sokolov A.I., Baranov M.S. // Chem. Heterocycl. Compd. 2020. V. 56. P. 116–119. https://doi.org/10.1007/s10593-020-02634-3
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Биоорганическая химия