Биоорганическая химия, 2022, T. 48, № 6, стр. 745-750
Циклооктатетраен как фотостабилизатор флуорогена белка FAST
А. И. Соколов 1, 2, А. А. Горшкова 1, Н. С. Балеева 1, 2, *, М. С. Баранов 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 11.05.2022
После доработки 22.05.2022
Принята к публикации 17.06.2022
- EDN: AICGDI
- DOI: 10.31857/S0132342322060239
Аннотация
Синтезированы два новых аналога флуорогена N871b, содержащих циклооктатетраен. Изучена фотостабильность флуоресцентных комплексов белка FAST с новыми соединениями при окрашивании живых клеток HeLa Kyoto в условиях конфокальной микроскопии. Показано, что один аналог демонстрирует заметно большую фотостабильность в сравнении с оригинальным флуорогеном N871b. Полученные результаты говорят о высокой перспективности применения циклооктатетраена для модификации красителей на основе арилиден-имидазолонов.
ВВЕДЕНИЕ
Флуоресцентные красители, используемые в современной флуоресцентной микроскопии, характеризуются длинноволновыми поглощением и испусканием, имеют небольшой размер и низкую токсичность. Также к важным свойствам флуоресцентной метки относятся яркость и фотостабильность красителя. Последнее имеет особенное значение для применения в микроскопии сверхвысокого разрешения, т.к. в данном случае изучаемый объект подвергается интенсивному облучению.
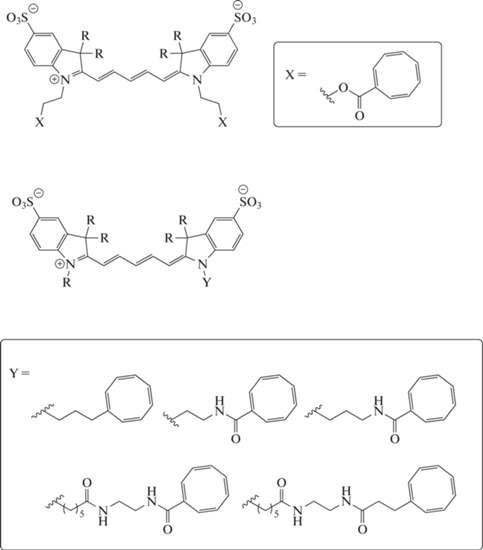
В связи с этим новым перспективным объектом для исследований стали недавно предложенные так называемые “самовосстанавливающиеся” красители (self-healing dyes) [1–4]. Такие красители состоят из двух фрагментов: флуоресцентного красителя и фотостабилизатора. Последний препятствует формированию возбужденного триплетного состояния флуорофора, которое и приводит к фотообесцвечиванию. Пример фотостабилизатора – циклооктатетраен (COT, от англ. CycloOctaTetraen) (рис. 1). В настоящий момент в большинстве случаев модификация COT-группой применяется для цианиновых красителей [5–8]. Циклооктатетраен, как правило, связан с молекулой красителя либо с помощью простого алкильного линкера, либо амидной или сложноэфирной группой, увеличивающей π-систему сопряжения COT (рис. 1). Причем в зависимости от строения цианинового красителя (например, количества двойных связей) тот или иной тип связи с COT оказывает разный фотостабилизирующий эффект [5, 6].
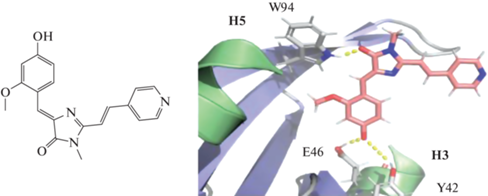
В данной работе исследовано влияние циклооктатетраена на фотостабильность арилиден-имидазолоновых флуоресцентных красителей. В качестве модельного соединения был выбран синтезированный нами ранее флуороген N871b, который успешно используется в паре с флуороген-активирующим белком FAST для генетически кодируемого флуоресцентного мечения (рис. 2) [9].
Рис. 2.
Строение флуорогена N871b и его связывание с флуороген-активирующим белком FAST. Отмечены водородные связи флуорогена N871b с остатками триптофана (W94), глутаминовой кислоты (E46) и тирозина (Y42).
Цель настоящей работы – синтез аналогов флуорогена N871b, содержащих COT-группу, и изучение фотостабильности этих соединений при окрашивании живых клеток HeLa Kyoto с использованием метода конфокальной микроскопии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Важное условие химической модификации флуорогена – сохранение его способности формировать флуоресцентный комплекс с белком, поэтому для введения COT-группы необходимо выбрать тот фрагмент молекулы, который в наименьшей степени участвует в процессе формирования комплекса с флуороген-активирующим белком. Для модификации флуорогена N871b мы выбрали группу на атоме азота имидазолона, т.к. согласно полученным нами ранее данным о структуре флуоресцентного комплекса флуорогена N871b с белком FAST, этот фрагмент находится вне кармана белка, и его модификация, вероятно, не повлияет на процесс формирования комплекса (рис. 2) [10].
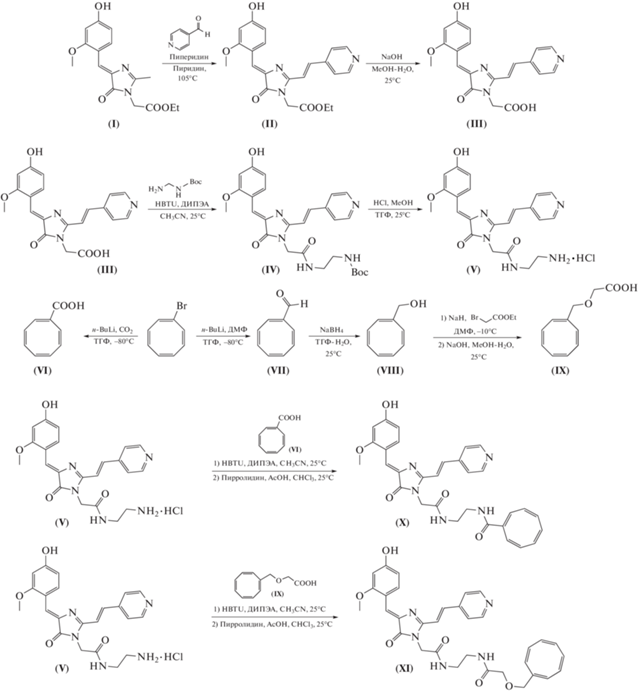
На первом этапе работы был синтезирован аналог флуорогена N871b, содержащий эфирную группу в первом положении имидазолона (II) (схема 1 ). Гидролиз последнего позволил получить производное N871b с кислотной группой (III). Затем при взаимодействии кислоты (III) и защищенного диамина с последующим снятием защитной группы был получен амин (V) (схема 1 ). Одновременно с этим нами были синтезированы необходимые производные циклооктатетраена (VI) и (IX), содержащие кислотные группы. На финальном этапе с помощью реакции амина (V) с кислотами (VI) и (IX) были получены целевые соединения (X) и (XI) (схема 1 ).
Схема 1 . Синтез соединений (III–XI).
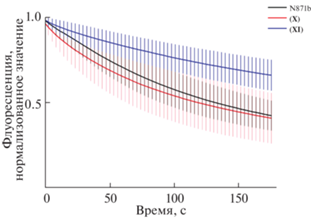
Затем мы изучили эффективность окрашивания живых клеток соединениями (X) и (XI) в сравнении с оригинальным флуорогеном N871b в условиях конфокальной микроскопии. К клеткам HeLa Kyoto, трансфицированным плазмидой, содержащей ген, кодирующий белок FAST, слитый с белком цитоскелета, были добавлены флуороген N871b и соединения (X) и (XI). При добавлении новых синтезированных соединений (X) и (XI), так же как и при добавлении флуорогена N871b, наблюдалось значимое усиление флуоресценции. Это позволяет заключить, что введение COT-группы в молекулу N871b не привело к потере флуорогенных свойств, и новые соединения способны формировать флуоресцентный комплекс с белком FAST. Также было установлено, что при длительном облучении (лазером с длинной волны 543 нм) комплекс соединения (X) обесцвечивается с той же скоростью, что и комплекс белка FAST с оригинальным флуорогеном N871b (рис. 3), в то время как комплекс соединения (XI) в аналогичных условиях продемонстрировал заметно большую фотостабильность (рис. 3).
Рис. 3.
Кривые фотообесцвечивания флуоресцентного сигнала флуорогена N871b и соединений (X) и (XI) в комплексе с белком FAST в клетках линии HeLa Kyoto, полученные при помощи лазерной сканирующей микроскопии (SD отображается окрашенной областью, n = 9–10). Соединения разводили из 1 мM раствора в DMSO до конечной концентрации 5–10 мкМ.
Таким образом, мы показали, что фотостабильность флуоресцентного комплекса белка FAST с флуорогеном N871b можно увеличить с помощью введения циклооктатетраена в молекулу флуорогена. Вероятно, предложенная нами модификация может быть также использована для синтеза и иных флуоресцентных арилиден-имидазолоновых красителей, отличающихся высокой фотостабильностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры ЯМР (δ, м.д.; J, Гц) регистрировали на спектрометре Avance III NMR (700 МГц; Bruker, США) при 303 K в DMSO-d6 (внутренний стандарт – Me4Si). Температуры плавления определяли на приборе SMP30 (Stuart Scientific, Великобритания) и не исправляли. Масс-спектры высокого разрешения регистрировали на приборе micrOTOF II (Bruker, Германия), ионизация электрораспылением.
Общая методика синтеза соединений (X) и (XI). Соединение (V) (137 мг, 0.3 ммоль), соответствующую кислоту (VI) или (IX) (0.66 ммоль), HBTU (318 мг, 0.84 ммоль) и ДИПЭА (0.21 мл, 1.23 ммоль) суспензировали в ацетонитриле (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 12 ч в инертной атмосфере. Затем реакционную смесь упаривали, продукт очищали с помощью флеш-хроматографии (элюент – хлороформ/метанол 100 : 7). Полученный продукт растворяли в хлороформе (10 мл), к раствору добавляли пирролидин (37 мл, 0.45 ммоль), полученную смесь перемешивали при комнатной температуре в течение 30 мин. Затем к смеси добавляли 50 мкл уксусной кислоты, полученный раствор перемешивали при комнатной температуре в течение 20 мин. Далее реакционную смесь разбавляли хлороформом (20 мл), промывали водным раствором NaH2PO4 (30 мл, рН 6.0). Органические вытяжки высушивали над безводным сульфатом натрия и упаривали. Полученный продукт дополнительно очищали с помощью колоночной хроматографии (градиент – хлороформ/метанол от 100 : 3 до 100 : 7).
Методика синтеза исходных соединений, выходы реакций, температуры плавления и спектральные характеристики синтезированных соединений (I–XI) приведены в дополнительных материалах.
Фотообесцвечивание в условиях флуоресцентной микроскопии. Эксперименты проводили на иммортализованной (рак шейки матки человека) клеточной линии HeLa Kyoto (ATCC). Клетки высевали на чашки диаметром 35 мм со стеклянным дном (SPL Life Sciences, Корея), культивирование проводили в среде DМЕМ (ПанЭко, Россия) с добавлением 100 ед./мл пенициллина, 100 ед./мл стрептомицина (ПанЭко, Россия) и 10% эмбриональной телячьей сыворотки (ПанЭко, Россия). Перед трансфекцией проводили визуальную оценку конфлюентности, трансфекцию проводили при ее достижении 80% от максимальной. Для трансфекции клеточную среду заменяли на 500 мкл Opti-MEM (Gibco, США), через 2 ч к среде добавляли 500 мкл Opti-MEM, содержащей смесь из 3.75 мкл агента Трансфектин (Bio-Rad, США) и 1.5 мкг плазмиды, кодирующей ген белка FAST, слитого с белком цитоскелета виментином (https://pubmed.ncbi.nlm.nih.gov/33336838/). Через 4–6 ч среду заменяли на DМЕМ с добавлением пенициллина-стрептомицина и эмбриональной телячьей сыворотки в вышеуказанных концентрациях. На следующий день после трансфекции среду заменяли на раствор Хэнкса с добавлением 20 мM HEPES. Соединения (X) и (XI) добавляли к клеткам HeLa Kyoto в концентрации 10 мкM, соединение N871b – в концентрации 5 мкM (соединения разводили из 1 мM стокового раствора в ДМСО (ПанЭко, Россия), после чего проводили съемку на конфокальном микроскопе DM IRE2 (Leica, Германия), оборудованном иммерсионным масляным объективом HCX PL APO Lbd.BL 63 × 1.40 и гелий-неоновым (HeNe) лазером (543 нм). В клетках, экспрессирующих конструкцию виментин-FAST, выбирали области интереса размером 7.5 × 7.5 мкм, которые непрерывно сканировали HeNe-лазером (100%) в течение 175 с (2 мин 55 с) (n = 9–10 клеток). Полученные изображения обрабатывали и анализировали в программе Fiji ImageJ. Графики, демонстрирующие кривые фотообесцвечивания флуоресцентного сигнала, были получены в OriginPro8.1.
ЗАКЛЮЧЕНИЕ
Синтезированы два новых производных флуорогена N871b, содержащих циклооктатетраен. Установлено, что новые соединения формируют флуоресцентные комплексы с флуороген-активирующим белком FAST при окрашивании живых клеток в условиях конфокальной микроскопии. Показано, что при длительном облучении соединение (XI) демонстрирует большую фотостабильность в сравнении с оригинальным флуорогеном N871b. В связи с чем актуальным направлением для дальнейших исследований представляется изучение влияния циклооктатетраена на фотостабильность других арилиден-имидазолоновых флуоресцентных красителей.
Список литературы
Isselstein M., Zhang L., Glembockyte V., Brix O., Cosa G., Tinnefeld P., Cordes T. // J. Phys. Chem. Lett. 2020. V. 11. P. 4462–4480. https://doi.org/10.1021/acs.jpclett.9b03833
Van der Velde J.H.M., Uusitalo J.J., Ugen L.-J., Warszawik E., Herrmann A., Marrink S.J., Cordes T. // Faraday Discuss. 2015. V. 184. P. 221–235. https://doi.org/10.1039/c5fd00114e
Altman R., Zheng Q., Zhou Z., Terry D.S., Warren J.D., Blanchard S.C. // Nat. Methods. 2012. V. 9. P. 428–429. https://doi.org/10.1038/nmeth.1988
Zheng Q., Jockusch S., Zhou Z., Altman R.B., Warren J.D., Turro N.J., Blanchard S.C. // J. Phys. Chem. Lett. 2012. V. 3. P. 2200–2203. https://doi.org/10.1021/jz300670p
Pati A.K., El Bakouri O., Jockusch S., Zhou Z., Altman R.B., Fitzgerald G.A., Asher W.B., Terry D.S., Borgia A., Holsey M.D., Batchelder J.E., Abeywickrama C., Huddle B., Rufa D., Javitch J.A., Ottosson H., Blanchard S.C. // Proc. Natl. Acad. Sci. USA. 2020. V. 117. P. 24305–24315. https://doi.org/10.1073/pnas.2006517117
Zheng Q., Jockusch S., Zhou Z., Altman R.B., Zhao H., Asher W., Holsey M., Mathiasen S., Geggier P., Javitch J.A., Blanchard S.C. // Chem. Sci. 2017. V. 8. P. 755–762. https://doi.org/10.1039/C6SC02976K
Yang Z., Li L., Ling J., Liu T., Huang X., Ying Y., Zhao Y., Zhao Y., Lei K., Chen L., Chen Z. // Chem. Sci. 2020. V. 11. P. 8506–8516. https://doi.org/10.1039/d0sc02837a
Altman R., Terry D., Zhou Z., Zheng Q., Geggier P., Kolster R.A., Zhao Y., Javitch J.A., Warren J.D., Blanchard S.C. // Nat. Methods. 2012. V. 9. P. 68–71. https://doi.org/10.1038/nmeth.1774
Povarova N.V., Zaitseva S.O., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Zagudaylova M.B., Bozhanova N.G., Gorbachev D.A., Malyshevskaya K.K., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. A Eur. J. 2019. V. 25. P. 9592–9596. https://doi.org/10.1002/chem.201901151
Mineev K.S., Goncharuk S.A., Goncharuk M.V., Povarova N.V., Sokolov A.I., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Ruchkin D.A., Bukhdruker S., Remeeva A., Mishin A., Borshchevskiy V., Gordeliy V., Arseniev A.S., Gorbachev D.A., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. Sci. 2021. V. 12. P. 6719–6725. https://doi.org/10.1039/d1sc01454d
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Биоорганическая химия