Биоорганическая химия, 2023, T. 49, № 1, стр. 65-78
Полимеры 2,5-дигидроксибензойной кислоты индуцируют образование сфероидов клеток млекопитающих
Г. К. Рысцов 1, *, А. В. Лисов 1, М. Ю. Земскова 1, **
1 ФИЦ “Пущинский научный центр биологических исследований” РАН,
Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, просп. Науки, 5, Россия
* E-mail: gleb.8.ristsoff@gmail.com
** E-mail: mzemskova@ibpm.pushchino.ru
Поступила в редакцию 20.04.2022
После доработки 20.05.2022
Принята к публикации 31.05.2022
- EDN: GEUPDF
- DOI: 10.31857/S0132342322060197
Аннотация
Прикрепленные к подложке клетки, выращенные в двухмерной (2D) или суспензионной культуре, не могут точно воспроизвести существующие в тканях и органах межклеточные взаимодействия. Сфероиды, являясь трехмерными (3D) образованиями, более точно воспроизводят структуру органов или новообразований и демонстрируют повышенную по сравнению с 2D-культурами выживаемость, соответствующую морфологию и гипоксическое ядро, которое наблюдается в нативных опухолях in vivo. Сфероиды опухолевых клеток также являются моделями процесса метастазирования, поэтому в настоящее время сфероиды широко используют для тестирования новых противоопухолевых препаратов. Однако получение и применение 3D-культур может быть сопряжено с рядом трудностей, таких как потребность в дорогостоящих реагентах и оборудовании, низкая скорость формирования сфероидов необходимого размера и возникновение долгосрочных изменений в клеточном метаболизме, которые зависят от методик, используемых для получения сфероидов. Нами было обнаружено, что инкубирование опухолевых и нормальных клеток в присутствии нетоксичных для клеток полимеров 2,5-дигидроксибензойной кислоты (поли-2,5-ДГБК) способно индуцировать формирование 3D-структур. На основании обнаруженного эффекта был разработан новый способ быстрого получения 3D-культур, не требующий использования дополнительного оборудования, дорогостоящих реактивов и не оказывающий долговременного влияния на клеточный гомеостаз. Сфероиды, полученные по разработанной методике, представляют собой модели 3D-структур и могут быть использованы для биологических исследований межклеточных взаимодействий и скрининга фармацевтических препаратов.
ВВЕДЕНИЕ
Культуры клеток млекопитающих используют для скрининга лекарственных средств, исследований новообразований, тканевой инженерии, моделирования процессов метастазирования, анализа функций генов и анализа межклеточных взаимодействий [1–4]. За время использования клеточных культур в лабораторной практике было обнаружено, что клетки, выращенные как трехмерные структуры (3D, сфероиды), обеспечивают более достоверные данные для изучения клеточного гомеостаза и клинических испытаний, чем клетки, культивируемые в монослое. Рост клеток в 3D-культуре обеспечивает возможность клеток взаимодействовать как между собой, так и с внеклеточным матриксом. Эти взаимодействия более точно имитируют среду in vivo и позволяют получить более точные данные, приближенные к условиям организма, что особо значимо для проведения тестов для скрининга новых лекарств [5]. Сфероиды используют как модель новообразований для изучения механизмов резистентности к лекарственным средствам, которая может быть обусловлена межклеточными взаимодействиями, устойчивостью к индуцированной клеточной гибели (апоптозу), увеличению доли покоящихся клеток, модуляцией экспрессии белков (включая топоизомеразы и репаративные ферменты), снижением проницаемости для препаратов и наличиями гипоксического и некротического центров [6]. Таким образом клеточные ответы на воздействие фармакологических препаратов значительно различаются для одного и того же типа клеток, выращенных в 2D- или 3D-культурах. Очевидно, что использование сфероидов в моделировании роста опухолей для изучения сигнальных путей и межклеточных взаимодействий позволяет оптимизировать лечение и обеспечивает понимание механизмов развития устойчивости к лекарственным препаратам [7–10]. В настоящее время сфероиды интенсивно используют в платформах для скрининга новых медикаментов [11–13]. Сфероиды – альтернатива моделям лабораторных животных в исследованиях рака [14], а также возможный материал для использования в тканевой инженерии для реконструкции органов и тканей [15, 16].
Существует несколько подходов к выращиванию сфероидов, таких как метод предотвращения прикрепления [17–19], метод “висячей капли” [20–23], процедуры, основанные на перемешивании суспензии клеток [24–26], использовании матрикса [27–32] или искусственно сконструированных каркасов [33, 34]. Однако в настоящее время многие методики создания 3D-культур клеток либо дорогие и трудоемкие [19, 23], либо способны влиять на жизнедеятельность используемых клеток из-за применения биологически активных агентов [31–34].
Исследуя энзиматическое окисление фенольных мономеров гентизиновой кислоты (2,5-ДГБК) и биологических свойств полученных в результате этой реакции полимеров (поли-2,5-ДГБК), мы определяли цитотоксичность различных концентраций полимеров (0–100 мкг/мл) для различных типов клеток. Было обнаружено, что исследуемые вещества не обладают токсическими свойствами. На основании этого было решено провести серию опытов с использованием повышенной концентрации поли-2,5-ДГБК – 200 мкг/мл. Было обнаружено, что обработка культивируемых клеток человека поли-2,5-ДГБК в концентрации 200 мкг/мл приводит к переходу клеточной культуры в 3D-форму. Следует отметить, что полученные нами полимеры – это продукты поликонденсации 2,5-ДГБК (рис. 1а), которые структурно схожи с веществами из группы лигнинов, однако, в отличие от природных лигнинов, имеют постоянный состав, определяемый условиями синтеза [35].
Рис. 1.
(a) – Схема синтеза полимеров 2,5-ДГБК под воздействием лакказы, выделенной из гриба Trametes versicolor. Слева представлена структурная формула мономера – 2,5-ДГБК, справа – фрагмент полимерной макромолекулы, получаемой в результате окисления мономеров; (б) – результат гель-фильтрации поли-2,5-ДГБК на колонке с носителем Superdex 200. V0 – “пустой” объем колонки, Vt – полный объем колонки. Маркеры молекулярной массы: 1 – каталаза (230 кДа), 2 – амилаза (200 кДа), 3 – алкогольдегидрогеназа (150 кДа), 4 – гексокиназа (100 кДа), 5 – бычий сывороточный альбумин (67 кДа), 6 – рибонуклеаза (14 кДа).

На основании обнаруженных свойств полимеров и учитывая вышеперечисленные трудности применения различных технологий формирования 3D-культур, была поставлена цель разработать методику быстрого получения сфероидов из опухолевых и/или нормальных клеток млекопитающих, которые могут сохранять свойства роста в 3D-культурах в течение длительного времени.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез поли-2,5-ДГБК. Как нами было обнаружено ранее, окисление 2,5-ДГБК под воздействием лакказы приводит к образованию водонерастворимого осадка, однако при этом можно было синтезировать полимеры, растворимые в воде, посредством окислительной сополимеризации 2,5-ДГБК с желатином [35]. При окислении 20 мМ 2,5-ДГБК под воздействием лакказы в концентрации 3–7 ед./мл происходило образование водонерастворимого осадка серо-зеленоватого цвета. Однако при использовании лакказы в количестве от 10 ед./мл реакционная смесь приобретала темно-коричневый окрас, и образовывалось небольшое количество черного осадка. После удаления осадка центрифугированием и низкомолекулярных компонентов реакционной смеси с помощью диализа было проведено исследование молекулярно-массового распределения образца методом гель-фильтрации на колонке с носителем Superdex 200. Элюция препарата с колонки происходила одним пиком, что указывает на молекулярную гомогенность препарата (рис. 1б). Молекулярная масса образца составляла 15–20 кДа. Затем диализованный препарат высушивали под вакуумом и использовали в дальнейшей работе. Возможно, что образование водорастоворимых поли-2,5-ДГБК связано с активностью лакказы, т.е. под воздействием большего количества фермента образующиеся полимеры 2,5-ДГБК подвергаются вторичному окислению и разлагаются до более низкомолекулярных фрагментов.
Полимеры 2,5-ДГБК индуцируют формирование сфероидов клеток человека. В результате данного исследования были получены сфероиды из нескольких типов клеток, включающих как опухолевые, так и клетки первичных культур человека. Также мы изучили возможность формирования смешанных сфероидов, включающих в себя эпителиальные клетки и фибробласты стромы предстательной железы.
Было показано, что все клеточные линии, используемые в данном исследовании, как иммортализованные опухолевые культуры, так и первичные клетки мезенхимы (ММСК) и фибробласты стромы предстательной железы, способны формировать 3D-структуры в присутствии поли-2,5-ДГБК (рис. 2). При этом размер, форма или скорость роста сфероидов различаются для каждого типа клеток. Например, клетки линий PC3 (рис. 2в) и MDA-MB-453 (рис. 2з) формируют слабокомпактизированные сфероиды, называемые “виноградная гроздь” [36]. Для остальных клеточных линий показано, что клетки под воздействием поли-2,5-ДГБК первоначально организованы в рыхлые агрегаты (рис. 3а), которые при дальнейшем культивировании в присутствии полимера трансформируются в образования из плотно соединенных клеток (рис. 2а, 2б, 2г–ж, 2и, 2к, рис. 3б), как это характерно для сфероидов [37, 38]. Следует отметить, что морфология сфероидов с различной степенью компактизации, наблюдаемая для разных клеточных линий, не связана со свойствами поли-2,5-ДГБК. Ранее при применении других подходов формирования 3D-структур также отмечалась различная морфология сфероидов, т.е. организация клеток в составе сфероида по типу “виноградной грозди” для линий PC3 [39] и MDA-MB-453 [40] и образование компактных сфероидов клетками линий LNCaP [41], DU145 [41], T24 [42], MDA-MB-231 [43], MCF7 [44] и BT474 [45].
Рис. 2.
Сфероиды, сформированные в присутствии 200 мкг/мл поли-2,5-ДГБК, из различных клеточных линий, полученные с использованием варианта 1 методики (см. “Эксперим. часть”). (а) – LNCaP (клетки рака простаты); (б) – DU145 (клетки рака простаты); (в) – PC3 (клетки рака простаты); (г) – T24 (клетки рака мочевого пузыря); (д) – MDA-MB-231 (клетки рака груди); (е) – MCF7 (клетки рака груди); (ж) – BT474 (клетки рака груди); (з) – MDA-MB-453 (клетки рака груди); (и) – клетки первичной культуры фибробластов человека, полученных из стромы предстательной железы; (к) – ММСК (стволовые клетки человека). Микрофотографии сделаны с использованием 20× увеличения.
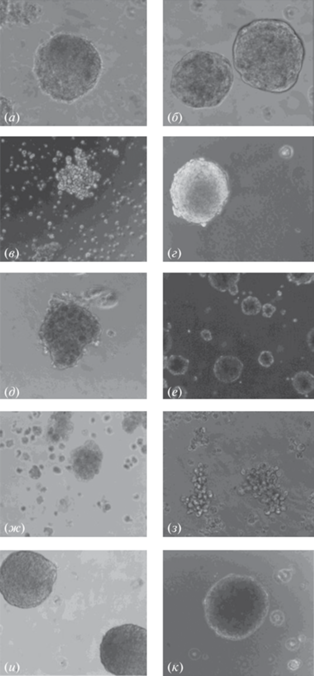
Рис. 3.
Сфероиды, сформированные из первичной культуры фибробластов человека, полученных из стромы предстательной железы, на разных этапах роста. Для формирования сфероидов использовали вариант 1 методики (см. “Эксперим. часть”). (а) – Клетки фибробластов человека через 24 ч после добавления поли-2,5-ДГБК (200 мкг/мл). Стрелкой отмечены рыхлые 3D-структуры, еще не прошедшие стадию компактизации; (б) – сфероиды фибробластов человека, растущие в присутствии 200 мкг/мл поли-2,5-ДГБК, через 72 ч после добавления полимеров в суспензию клеток; (в) – сфероиды фибробластов человека, инкубированные в течение 340 ч в неадгезивных флаконах, после удаления поли-2,5-ДГБК; (г) – сфероид фибробластов человека через 24 ч после удаления поли-2,5-ДГБК и переноса в культуральный флакон с адгезивным покрытием. Сфероид при культивировании на адгезивном покрытии прикрепляется к подложке, и клетки начинают мигрировать из 3D-структуры. Стрелкой отмечены мигрирующие клетки. Микрофотографии сделаны с использованием 20× увеличения.

Показано, что полученные с помощью поли-2,5-ДГБК сфероиды сохраняют характерную 3D-структуру и продолжают увеличиваться в размерах как в присутствии поли-2,5-ДГБК при культивировании в стандартной культуральной посуде (рис. 3б), так и после удаления полимеров и переноса сфероидов во флаконы с неадгезивным покрытием (рис. 3в). Таким образом, можно сделать вывод, что наличие в ростовой среде поли-2,5-ДГБК не только инициирует межклеточные взаимодействия, необходимые для роста клеток в 3D-культуре, но также предотвращает прикрепление сформированных сфероидов к поверхности культуральной посуды. Поскольку добавление новых клеток в процессе культивирования сфероидов не производили, можно сделать вывод о том, что увеличение размеров обусловлено делением клеток в составе сфероида. Сформированные сфероиды можно удерживать в неприкрепленном состоянии как минимум до 340 ч посредством их культивирования либо в присутствии поли-2,5-ДГБК, либо в отсутствии полимеров, но при этом необходимо использовать культуральную посуду с неадгезивной поверхностью.
Помимо наблюдений за увеличением размера сфероидов, что косвенно указывает на пролиферацию клеток в присутствии поли-2,5-ДГБК, была исследована способность сфероид-образующих клеток к миграции. Для этого сфероиды после удаления полимеров были помещены в стандартные культуральные флаконы с адгезивной поверхностью. Через 24 ч наблюдали прикрепление сфероидов к культуральной подложке и миграция клеток из состава сфероида (рис. 3г). В ходе визуального наблюдения за распластыванием сфероида было отмечено, что все мигрирующие из сфероида клетки прикреплены к подложке (рис. 3г). Этот факт косвенно свидетельствует об отсутствии клеточной гибели, поскольку, как характерно для всех использованных в данной работе клеточных культур, в случае их гибели происходит открепление клеток от культурального пластика и накопление в культуре “плавающих” мертвых клеток.
Несмотря на то, что описываемые нами процедуры после удаления поли-2,5-ДГБК включают использование культуральных емкостей с неадгезивной поверхностью, стоит отметить, что применение разработанной нами методики позволяет получить клеточные 3D-структуры и в случаях, когда клетки способны произвести прикрепление к неадгезивной поверхности. Например, на рис. 4а можно наблюдать, что только часть клеток линии LNCaP, посеянных во флаконы с неадгезивным покрытием, приступила к формированию сфероидов, в то время как большая часть популяции смогла произвести прикрепление ко дну флакона и начать рост в виде 2D-культуры. Также следует отметить, что в этих условиях сфероиды клеток LNCaP не образуют плотных 3D-структур. Однако за то же время обработка суспензии клеток поли-2,5-ДГБК индуцирует образование компактизированных сфероидов (рис. 4б), что указывает на преимущество разработанного нами метода перед ранее описанным с использованием неадгезивных покрытий.
Рис. 4.
Клетки LNCaP (клетки рака простаты), инкубированные в течение 96 ч в условиях, предотвращающих адгезию клеток. (а) – Клетки LNCaP, инкубированные в течение 96 ч в неадгезивных флаконах без добавления поли-2,5-ДГБК. Стрелкой отмечены некомпактизированные 3D-структуры. Микрофотография сделана с использованием 10× увеличения; (б) – сфероиды через 96 ч, сформированные с добавлением поли-2,5-ДГБК (200 мкг/мл) к суспензии клеток. Микрофотография сделана с использованием 20× увеличения.

В разработанной нами методике минимальная концентрация поли-2,5-ДГБК, необходимая для формирования сфероидов, составляет 200 мкг/мл. Однако клетки линии DU145 способны формировать сфероиды (по методике, описанной в варианте 1, см. “Эксперим. часть”) при концентрации поли-2,5-ДГБК 140 мкг/мл. Следует отметить, что данное исследование посвящено принципиальной возможности использования поли-2,5-ДГБК для индукции образования и дальнейшего роста сфероидов, однако концентрации соединения могут варьироваться в зависимости от типа клеток.
Использование полимеров 2,5-ДГБК для формирования 3D-структур из различных типов клеток. Для моделирования клеточных взаимодействий в составе опухолей или тканей используют так называемые “гетерологичные сфероиды”, сформированные различными типами клеток [46]. Для определения эффективности поли-2,5-ДГБК в формировании гетерологичных сфероидов первичные фибробласты стромы предстательной железы были окрашены прижизненным флуоресцентным красителем Vibrant Cell Tracer (Thermo Fisher Scientific, США) и смешаны с культурой эпителиальных опухолевых клеток простаты LNCaP (рис. 5а, 5б). Добавление к смешанным культурам поли-2,5-ДГБК привело к формированию сфероидов (рис. 5в). При этом сформированные сфероиды содержали оба типа клеток: неокрашенные эпителиальные клетки LNCaP и испускающие зеленый свет фибробласты (рис. 5в, 5г, фибробласты отмечены стрелками). Различные типы клеток в составе сфероидов расположены не хаотично, а сгруппированы в четко различимые области. Разделение клеток в сфероиде можно наблюдать как на фазовом контрасте (рис. 5в), где области скопления фибробластов более темные по сравнению с клетками LNCaP, так и при наблюдении флуоресценции – более темные области сфероидов, наблюдаемые в фазовом контрасте, обладают зеленой флуоресценцией (рис. 5г). Показано, что первоначально равномерное распределение клеток стромы (более крупные и окрашенные зеленым флуоресцентным красителем) и неокрашенных клеток LNCaP в смешанной культуре, через 48 ч культивирования в присутствии поли-2,5-ДГБК сменяется разделением клеток на флуоресцентную сердцевину и неокрашенную оболочку (рис. 5г), что может свидетельствовать о произошедшей перегруппировке клеток по их типу в составе сфероида. Учитывая, что флуоресценция обеспечивается фибробластами, можно предположить, что наблюдаемые окрашенные участки сформированы благодаря миграции и компартментализации клеток при формировании сфероида, а не в результате образования клеточного массива путем деления клеток, т.к. в противном случае наблюдалось бы значительное ослабление интенсивности зеленого свечения. Также следует отметить, что 48 ч, прошедшие с момента начала формирования сфероида под воздействием поли-2,5-ДГБК, – это недостаточный временной промежуток для создания группы клеток наблюдаемого размера вследствие деления исходных фибробластов. Таким образом, показано, что поли-2,5-ДГБК можно использовать для получения сфероидов, состоящих из различных типов клеток, в частности для изучения клеточных взаимодействий между фибробластами стромы и эпителиальными клетками в моделировании опухолей предстательной железы.
Рис. 5.
Сфероиды, сформированные из смеси первичной культуры фибробластов человека, полученных из стромы предстательной железы, и клеток LNCaP, на разных этапах роста. Для формирования сфероидов использовали вариант 1 методики (см. “Эксперим. часть”). (а) – Смешанная суспензия клеток первичной культуры фибробластов человека, полученных из стромы предстательной железы, и клеток LNCaP с добавлением поли-2,5-ДГБК (200 мкг/мл). Клетки фибробластов (отмечены стрелкой) более крупные; (б) – флуоресценция клеток фибробластов (отмечены стрелкой) в смешанной клеточной суспензии, представленной на микрофотографии (а); (в) – сфероид, сформированный из фибробластов стромы и клеток LNCaP, после 340 ч культивирования во флаконах с неадгезивным покрытием в отсутствии поли-2,5-ДГБК; (г) – флуоресценция клеток фибробластов (отмечены стрелкой) в составе гетерологичного сфероида. Центр сфероида испускает зеленое свечение, т.к. состоит из окрашенных клеток первичной культуры фибробластов. Микрофотографии сделаны с использованием 20× увеличения.

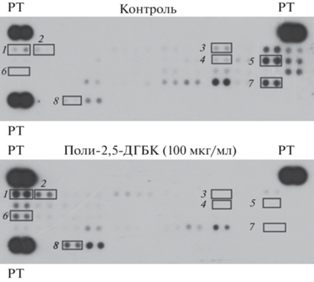
В основе инициируемого поли-2,5-ДГБК формирования сфероидов лежит реорганизация активности тирозинкиназных рецепторов. С целью определения молекулярных мишеней, воздействие на которые поли-2,5-ДГБК может приводить к формированию 3D-структур, мы исследовали изменение активности тирозинкиназных рецепторов в прикрепленной культуре клеток LNCaP, инкубированных при концентрации поли-2,5-ДГБК, которая еще не приводит к формированию сфероидов, но может индуцировать изменения в сигнальных путях клетки. В качестве объекта исследования была выбрана 2D-культура по той причине, что существование клеток в 3D-культуре само по себе приводит к изменению гомеостаза [47]. Клетки культивировали в присутствии 100 мкг/мл поли-2,5-ДГБК в течение 24 ч, поскольку было установлено, что эти условия еще не вызывают переход прикрепленной культуры в 3D-форму. Результаты фосфопротеомного анализа, представленные на рис. 6, указывают на повышение уровня фосфорилирования следующих рецепторов: EGFR, Tie-2, ErbB2 и EphB3, что косвенно указывает на их активацию. Также можно наблюдать снижение уровня фосфорилирования и, следовательно, ингибирование функциональной активности рецепторов Alk, DDR1, Insulin R, c-Ret, EphA1, DDR2, Ax1, ROR2, EphA10, Dtk, Tie-1 и EphA4.
Рис. 6.
Поли-2,5-ДГБК модулирует уровни фосфорилирования рецепторных тирозинкиназ в клетках LNCaP. Репрезентативное изображение мембран для фосфопротеомного анализа с антителами, иммобилизованными на мембране и специфичными к определенным клеточным рецепторам, представлены в двух экземплярах. Интенсивность каждого сигнала соответствует уровню фосфорилирования различных рецепторов в клетках LNCaP, инкубированных в присутствии 100 мкг/мл (нижняя панель) или в отсутствие (верхняя панель) поли-2,5-ДГБК. РТ – референсные точки; 1 – EGFR (EGFR) (здесь и далее в скобках указано семейство рецепторов, к которому относится белок); 2 – ErbB2 (EGFR); 3 – InsulinR (InsulinR); 4 – c-Ret (Ret); 5 – ROR2 (ROR); 6 – Tie-2 (Tie); 7 – EphA10 (EphR); 8 – EphB3 (EphR).
Одни из наиболее примечательных рецепторов, активность которых может регулировать рост клеток в 3D-культуре, – это EGFR и инсулиновый рецептор (Insulin R). Было показано, что активность EGFR необходима для образования непрерывных кольцевых апикальных соединений, содержащих эпителиальный кадгерин (E-кадгерин [48]) что приводит к уплотнению межклеточных контактов. Так, сверхэкспрессия EGFR в клетках MCF7 трансформирует адгезивную клеточную 2D-культуру в 3D-культуру [49]. Активация Tie-2 увеличивает плотность межклеточных взаимодействий при наличии контактов клетки с другими клетками [50, 51]. Высокая активность ErbB2 (HER2) сопряжена со снижением экспрессии фокальных адгезионных белков, таких как паксилин, фокальная адгезионная киназа и интегрин. Следовательно, стимуляция ErbB2 под воздействием поли-2,5-ДГБК может приводить к ингибированию данных белков и общему снижению способности клетки к прикреплению [52]. Рецептор EphB3 в активной форме ингибирует опосредованную интегрином адгезию клеток и индуцирует реорганизацию актинового цитоскелета и перераспределение Е-кадгерина [53], что также приводит к уменьшению способности клеток прикрепляться к подложке.
Эти процессы активации рецепторов под воздействием поли-2,5-ДГБК также коррелируют со снижением фосфорилирования и, следовательно, с ингибированием ряда тирозинкиназных рецепторов (рис. 6), таких как инсулиновый рецептор (Insulin R), рецепторы Ret и EphA10. Показано, что активность инсулинового рецептора необходима для экспрессии белков фокальной адгезии и паксиллина, которые регулируют способность клеток прикрепляться к культуральной подложке [54]. Ингибирование рецептора Ret снижает адгезию клеток, опосредованную функцией интегринов формировать комплексы, необходимые для узнавания лигандов межклеточного матрикса [55]. Инактивация рецепторов ROR2 и EphA10 сильно ингибирует клеточную адгезию [56, 57]. Поскольку сфероид-образующий эффект может быть обусловлен ослаблением прикрепления клеток к поверхности культуральной посуды (для предотвращения перехода суспензии в форму стандартной 2D-культуры) и усилением межклеточных взаимодействий, мы полагаем, что изменение активности этих клеточных рецепторов под воздействием поли-2,5-ДГБК приводит к изменению как способности роста в 2D-культуре (т.е. прикреплению к подложке), так и к усилению межклеточных контактов.
Известно, что рецепторные тирозинкиназы (RTK) реагируют на биохимические сигналы из окружающей среды, контролирующие поведение клеток в тканях. Координация их активности важна для морфогенеза и гомеостаза в зрелых тканях [58]. Поэтому дисрегуляция активности различных RTK, вызываемая поли-2,5 ДГБК, может приводить к изменениям в работе соответствующих сигнальных каскадов, находящихся под управлением данных рецепторов. Хотя определение конкретного механизма инициации и контроля перестройки клеток в 3D-структуру под воздействием поли-2,5-ДГБК затруднительно, мы предполагаем, что формирование сфероидов происходит в результате комплексного изменения активности вышеописанных рецепторов.
В ходе формирования сфероида происходит временное ингибирование киназы Akt1. Как упоминалось ранее, тирозинкиназные рецепторы имеют многочисленные нисходящие эффекторные цепочки. Поэтому возникла необходимость проверить, способна ли обработка поли-2,5-ДГБК, воздействуя на нисходящие эффекторы, приводить к долговременным изменениям клеточного гомеостаза. Известно, что рецепторы данной группы при нахождении в активном состоянии воздействуют на киназу Akt1 за счет нисходящих сигнальных каскадов. Наибольший интерес в данном случае представляют инсулиновый рецептор (Insulin R) и рецептор эфрина типа В3 (EPHB3). Инсулиновой рецептор – вышестоящий активатор Akt1, сигнальный путь которого включает IRS (insulin receptor substrate, субстрат рецептора инсулина), PI3-K (class IA phosphatidylinositol 3-kinase, фосфатидилинозитол-3-киназа класса IA), PIP2 (phosphatidylinositol (4,5)-bisphosphate, фосфатидилинозитол (4,5)-бисфосфат), PIP3 (phosphatidylinositol 3,4,5-trisphosphate, фосфатидилинозитол 3,4,5-трифосфат) и PDK1 (phosphoinositide-dependent protein kinase-1, фосфоинозитид-зависимая протеинкиназа-1) [59, 60]. EPHB3 – ингибитор Akt1, образующий комплекс с RACK1 (receptor of activated protein C kinase 1, рецептор активированной киназы протеина С 1) и PP2A (protein phosphatase 2, протеинфосфатаза 2), активность которых приводит к дефосфорилированию Akt1 и, следовательно, к подавлению активности киназы [61]. Таким образом, мы предположили, что в сфероидах, полученных посредством обработки клеток LNCaP поли-2,5-ДГБК, ингибирование инсулинового рецептора (вследствие уменьшения его фосфорилирования) и активации EPHB3 (вследствие увеличения его фосфорилирования) может приводить к уменьшению фосфорилирования и активации киназы Akt1. Результаты вестерн-блот-анализа сфероидов клеток LNСaP показали 17-кратное снижение уровней как фосфорилированного Akt1 (Ser473), так и общего количества киназы по сравнению с необработанными клетками (рис. 7). Как было отмечено ранее, рост клеток в 3D-культуре продолжается и после удаления поли-2,5-ДГБК при переносе культур во флаконы с неадгезивным покрытием. Для того чтобы определить, является ли ингибирование Akt1 необходимым условием для существования клеток в форме 3D-культуры или подавление ее экспрессии значимо для инициации формирования сфероидов и носит временный эффект, мы исследовали экспрессию Akt1 в сфероидах после удаления поли-2,5-ДГБК. Данные, представленные на рис. 7, свидетельствуют о том, что после удаления индуктора происходит постепенное восстановление как фосфорилирования Akt1 (Ser473), так и количества общего белка до уровней, наблюдаемых в необработанных полимерами клетках. Следует отметить, что при этом сформированные сфероиды сохраняют свою форму и растут в виде 3D-культур. Следовательно, можно предположить, что ингибирование Akt1 – это результат воздействия поли-2,5-ДГБК на функциональную активность рецепторов инсулина и Eph3B, а не последствие роста клеток в 3D-культуре. Таким образом, показано, что поли-2,5-ДГБК снижает количество Аkt1, однако экспрессия киназы восстанавливается до нормального уровня в течение 48 ч после удаления полимеров. Этот факт позволяет предположить, что изменения в фосфорилировании и, следовательно, в активности ряда клеточных рецепторов, наблюдаемые в результате воздействия поли-2,5-ДГБК, являются временными, и функция рецепторов нормализуется после удаления индуктора роста клеток в 3D-культурах.
Рис. 7.
Результаты вестерн-блот-анализа лизатов клеток LNCaP, растущих в монослое и не подвергнутых обработке поли-2,5-ДГБК (контроль), и сфероидов, сформированных в присутствии 200 мкг/мл поли-2,5-ДГБК. После формирования сфероидов полимеры удаляли, клетки инкубировали в ростовой среде во флаконах с неадгезивным покрытием в течение 0, 24 и 48 ч. (а) – Изменения в уровнях фосфорилирования киназы Аkt1 (p-Akt1) и общего белка Akt1 в контрольных клетках 2D-культуры и сфероидах. Интенсивность каждого сигнала соответствует уровню фосфорилирования (для p-Akt1) или уровню общего белка в контроле и сфероидах. Актин (β-актин) использовали для нормализации концентрации белков в каждой пробе; (б) – денситометрический анализ сигналов, полученных вестерн-блот-анализом лизатов контроля и сфероидов, представлен в виде средней плотности пикселей, отражающей изменения уровня р-Аkt1, нормализованного к уровню β-актина. Столбики ошибок представляют ± стандартное отклонение от среднего.

Наиболее близкой из существующих технологий к созданной нами методике является способ получения сфероидов с использованием производных RGD-пептида (аминокислотная последовательность Arg-Gly-Asp, узнаваемая интегринами). В данной методике производные RGD-пептида (например, циклический пептид Arg-GlyAsp-D-Phe-Lys (цикло-RGDfK) или циклоRGDfK, модифицированный 4-карбоксибутил-трифенилфосфонийбромидом (цикло-RGDfK (TPP)) добавляют в суспензию клеток, культивируемых в обычной культуральной посуде, затем в течение нескольких дней образуются сфероиды в результате самоагрегации клеток [62]. К недостаткам метода относится факт наличия у растворимых низкомолекулярных RGD-содержащих пептидов выраженной способности индуцировать апоптоз [63], что может вносить искажения в результаты тестирования противоопухолевых препаратов с целью определения их цитотоксичности. Кроме того, известно, что лиганды интегринов, такие как RGD-пептид, используются как эффективные противоопухолевые препараты [64–66]. Следовательно, биологическая активность RGD-пептида может существенно искажать результаты тестирования фармакологических препаратов при использовании сфероидов, полученных по данному методу.
В настоящей работе мы показали, что сфероиды, полученные в результате воздействия поли-2,5-ДГБК, восстанавливают экспрессию Akt1 через 48 ч после удаления соединения, и вероятно, что снижение уровня Akt1 в присутствии индуктора связано с ингибированием функции вышестоящих тирозинкиназных рецепторов. Мы можем предположить, что изменения в активности рецепторов, приводящие к формированию сфероидов, происходят только в присутствии полимера и после удаления поли-2,5-ДГБК гомеостаз клеток восстанавливается до нормального уровня. Следовательно, полученные с использованием нашей методики сфероиды можно применять для скрининга биологической активности различных соединений или фармакологических препаратов через 48 ч после удаления поли-2,5-ДГБК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез поли-2,5-ДГБК. Синтез полимеров проводили окислением 2,5-ДГБК (Sigma-Aldrich, США) под действием лакказы, выделенной из гриба Trametes versicolor, как это описано в работе Lisov et al. [35]. Реакцию проводили в 20 мМ натрий-ацетатном буфере, pH 5.0. Концентрация 2,5-ДГБК составляла 20 мМ, а лакказы – 10 ед./мл. Реакцию проводили при 30°C и перемешивании (200 об/мин) в течение 15 ч. Через 15 ч реакцию останавливали путем нагревания реакционной смеси на кипящей водяной бане в течение 5 мин. Далее осадок удаляли из реакционной смеси центрифугированием, супернатант диализовали против дистиллированной воды (пропускная способность мембраны – 10 кДа). После диализа препарат высушивали в роторном вакуумном испарителе при 40°С, взвешивали для определения количества вещества и растворяли в фосфатно-солевом буфере (PBS) до концентрации 1 мг/мл. Для работы с культурами клеток раствор поли-2,5-ДГБК стерилизовали посредством фильтрования через мембрану с диаметром пор 0.22 мкм и использовали для добавления с ростовую среду в указанных концентрациях. Гель-фильтрацию проводили на колонке HiLoad 26/60 Superdex 200 (Sigma-Aldrich, США), подвижная фаза – 20 мМ ацетатный буфер (рН 5.0), содержащий 15 M NaCl, скорость элюции 1 мл/мин.
Антитела. В качестве первичных антител для иммуноблоттинга использовали моноклональные антитела мыши (анти-АКТ1 (Santa Cruz Biotechnology, CША) и анти-β-актин, конъюгированные с пероксидазой (Sigma, Германия)) и антитела кролика (анти-фосфо-АКТ1 (S473) (D9E) (Cell Signaling Technology, CША)). В качестве вторичных антител для визуализации белка в вестерн-блот-анализе использовали конъюгированные с пероксидазой антитела против иммуноглобулинов мыши (H&L, goat) и кролика (H&L, goat) (Rockland, США).
Культуры клеток. Клетки первичной культуры фибробластов человека (выделенной из хирургического материала тканей предстательной железы) и ММСК культивировали в среде DMEM/F12. Клетки линий рака предстательной железы (LNCaP, DU145, PC3) и рака мочевого пузыря (T24) культивировали в среде RPMI 1640. Клетки линий рака молочной железы (MCF7, MDA-MB-231, BT474 и MDA-MB-231) культивировали в среде DMEM. Для культивирования использовались ростовые среды с добавлением 10% фетальной бычьей сыворотки (FBS), стрептомицина, пенициллина (50 мкг/мл) и L-глутамина (ПанЭко, Россия) Культивирование проводили при 37°С в атмосфере 5% СО2.
Формирование сфероидов. Способ 1: после достижения клетками 90% монослоя (3 × 106 клеток) ростовую среду удаляли, клетки открепляли от подложки обработкой раствором 0.05%-ного трипсина с ЭДТА (ПанЭко, Россия). Клетки ресуспендировали в соответствующей для каждой клеточной линии ростовой среде, центрифугировали 5 мин при 1200 об/мин. После удаления супернатанта клетки ресуспендировали в 4 мл ростовой среды, переносили в 6-см чашку Петри (Corning, США) и добавляли раствор поли-2,5-ДГБК до конечной концентрации 200 мкг/мл. После этого клетки инкубировали в течение 72 ч в СО2-инкубаторе MCO-19AIC(UV) (Sanyo, Япония). Среду со сформированными сфероидами переносили в 15-мл пробирку типа Falcon (Corning, США) и отстаивали 15 мин для осаждения сфероидов. Супернатант удаляли, добавляли 10 мл ростовой среды и перемешивали сфероиды плавным покачиванием вручную. Процедуру смены среды повторяли суммарно 3 раза для полного удаления поли-2,5-ДГБК. Затем сфероиды в 6.5 мл ростовой среды переносили во флаконы Т25 с неадгезивным покрытием (SPL LIFESCIENCES, Республика Корея) и использовали в дальнейших исследованиях.
Способ 2: по достижению клетками 100% монослоя ростовую среду удаляли, клетки промывали PBS. После удаления PBS на клетки наносили 2 мл раствора поли-2,5-ДГБК с концентрацией 1 мг/мл, после чего инкубировали 5 мин в CO2-инкубаторе при 37°C. Далее клетки механически отделяли от поверхности чашки Петри при помощи скребка и несколько раз ресуспендировали посредством 1-мл пипетки-дозатора, не допуская полного разделения клеточных агрегатов на отдельные клетки. К раствору поли-2,5-ДГБК добавляли 8 мл ростовой среды (конечная концентрация поли-2,5-ДГБК после разведения – 250 мкг/мл) и инкубировали 48 ч в CO2-инкубаторе (5% CO2) при 37°C. Среду со сформированными сфероидами переносили в пробирку и отстаивали 15 мин для осаждения сфероидов. Процедуру полного удаления поли-2,5-ДГБК проводили, как описано выше. Затем сфероиды ресуспендировали в 6.5 мл ростовой среды и переносили во флаконы Т25 с неадгезивным покрытием (SPL LIFESCIENCES, Республика Корея), культивировали до 340 ч.
Способ 3: заранее подготавливали 96-луночные культуральные планшеты для придания им низкоадгезивных свойств (Greiner Bio-One GmbH, Германия): в стерильных условиях в каждую лунку добавляли 200 мкл стерильного минерального масла (MP Biomedicals, Франция) и оставляли на 1 ч. После этого минеральное масло удаляли с максимально возможной полнотой. Далее планшет повторно стерилизовали облучением УФ-светом в течение 1 ч в ламинарном шкафу. Клетки линии LNCaP (рак предстательной железы) открепляли от подложки, как это описано выше в способе 1. После подсчета клеток суспензию клеток разбавляли ростовой средой до достижения концентрации 1 клетка в 100 мкл среды и помещали в подготовленные культуральные планшеты (100 мкл на лунку), т.е. большинство лунок 96-луночного планшета содержали 1 клетку. Далее клетки инкубировали в течение 120 ч в СО2-инкубаторе для прикрепления клеток к подложке и формирования колонии-клона. После инкубации ростовую среду удаляли и в каждую лунку добавляли 100 мкл ростовой среды, содержащей поли-2,5-ДГБК (200 мкг/мл). После замены среды планшет несильно ударяли сбоку несколько раз, в результате чего колония клеток отделялась от подложки без разделения на отдельные клетки. Далее клетки инкубировали в течение 48 ч в СО2-инкубаторе. Затем сфероиды отмывали от поли-2,5-ДГБК, как описано выше, эту процедуру можно проводить как в лунках 96-луночного планшета, содержащих индивидуальные клоны клеток, так и перенести полученные клоны в культуральные планшеты любого формата (24- или 12-луночные) с неадгезивным покрытием для дальнейшего роста сфероидов в условиях эксперимента.
Формирование гетерологичных сфероидов. Фибробласты стромы предстательной железы и клетки LNCaP культивировали и трипсинизировали, как это описано в способе 1 получения сфероидов. Суспензию клеток центрифугировали 5 мин при 1200 об/мин, супернатант удаляли, клетки ресуспендировали в 7.5 мл PBS и далее центрифугировали 5 мин при 1200 об/мин. Процедуру центрифугирования повторяли 2 раза для удаления остатков ростовой среды. Затем фибробласты стромы предстательной железы ресуспендировали в 1 мл PBS, содержащего краситель для прижизненного окрашивания Vibrant Cell Tracer Kit (25 мM; Thermo Fisher Scientific, США) и инкубировали 15 мин в CO2-инкубаторе, после чего центрифугировали 5 мин при 1200 об/мин. Процедуру центрифугирования повторяли 2 раза для удаления остатков красителя с последующим ресуспендированием в ростовой среде и подсчетом клеток. Суспензию окрашенных клеток стромы предстательной железы смешивали с суспензией клеток LNCaP в соотношении 1 : 1 по количеству клеток (5 × 106 кл./мл), полученную суспензию переносили в лунку 24-луночного планшета в среде объемом 500 мкл. В суспензию клеток добавляли поли-2,5-ДГБК до концентрации 200 мкг/мл и инкубировали в CO2-инкубаторе в течение 72 ч. Среду со сформированными сфероидами переносили в пробирку и оставляли на 15 мин для осаждения сфероидов. Супернатант удаляли, добавляли ростовую среду и перемешивали сфероиды плавным покачиванием. Процедуру смены среды повторяли 3 раза для полного удаления поли-2,5-ДГБК. Затем сфероиды в ростовой среде переносили во флаконы Т25 с неадгезивным покрытием (SPL LIFESCIENCES, Республика Корея) для дальнейшего наблюдения. Флуоресценцию окрашенных клеток стромы наблюдали при помощи инвертированного микроскопа Микромед И (ЛОМО, Россия).
Проверка стабильности и жизнеспособности сфероидов. Сфероиды, сформированные по вышеописанным методикам, после удаления поли-2,5-ДГБК инкубировали в течение двух недель в CO2-инкубаторе во флаконах Т25 с неадгезивным покрытием с заменой среды каждые три дня на свежую. По истечении данного срока сфероиды сохраняли характерную 3D-структуру, активно росли, увеличиваясь в размерах. После 340 ч инкубации во флаконах Т25 с неадгезивной поверхностью ростовую среду со сфероидами переносили в 6-см чашку Петри для наблюдения за прикреплением сфероидов к подложке и миграцией клеток из сфероида на поверхность чашки.
Анализ фосфорилирования рецепторных тирозинкиназ. Чтобы определить, приводит ли обработка поли-2,5-ДГБК к значительным изменениям клеточного гомеостаза, мы использовали Proteome Profiler Human Phospho-RTK Array Kit (R&D Systems, США) в соответствии с инструкциями производителя. Вкратце, клетки LNCaP, посеянные в количестве 2 × 105 клеток на 6-см чашку Петри, через 24 ч обрабатывали поли-2,5-ДГБК (100 мкг/мл) или контролем-носителем (среда с добавлением PBS) в течение 24 ч. После обработки клетки промывали 3 раза охлажденным PBS, лизировали с использованием поставляемого буфера для лизиса и определяли концентрацию белков в каждом клеточном лизате (Pierce BCA Protein Assay Kit, Thermo Fisher Scientific, США). Клеточные лизаты (300 мкг белка в 1 мл) наносили на мембраны, содержащие иммобилизованные антитела, специфичные к определенным клеточным рецепторам, и инкубировали в течение ночи при 4°С. Затем мембраны инкубировали с антителами против фосфорилированного тирозина, конъюгированными со стрептавидином-HRP для получения хемилюминесцентного сигнала после добавления реагента-субстрата. Уровень активности рецепторных киназ, связавшихся со специфическими антителами, определяли по интенсивности сигнала, отражающего количество фосфорилированного тирозина для каждой киназы, представленной в наборе. Для количественной оценки уровня фосфорилирования была проведена денситометрия интенсивности полученных сигналов с использованием программного обеспечения Studio Image Lite версии 5.2 (LI-COR Biosciences, США).
Вестерн-блот-анализ. Полученные, как описано в примере 2, сфероиды переносили во флаконы с неадгезивным покрытием (с заменой культуральной среды на свежую без добавления поли-2,5-ДГБК) и культивировали в течение 48 ч с отбором проб через 0, 24 и 48 ч. В качестве контроля использовали клетки LNCaP, выращенные до стадии монослоя в 2D-культуре в отсутствие поли-2,5-ДГБК. Клетки промывали холодным PBS и лизировали в 200 мкл буфера для лизиса (20 мМ Tris-HCl, pH 7.5, 1% NP-40, 100 мМ NaCl, 5 мМ EDTA), содержащего ингибиторы (Protease Inhibitor Cocktail Set V; Calbiochem, США) и ингибиторы фосфатаз (10 мМ β-глицерофосфат, 10 мМ ортованадат натрия, 10 мМ пирофосфат натрия и 5 мМ флуорит натрия). Концентрацию белка измеряли с использованием набора для анализа белка Pierce BCA Protein Assay Kit (Thermo Fisher Scientific, США). Клеточные лизаты (30 мкг тотального белка) разделяли с помощью электрофореза в 10%-ном ПААГ, затем белки переносили на нитроцеллюлозные мембраны (Bio-Rad Laboratories, США) и инкубировали с первичными антителами (разведение 1 : 1000 в буфере TBST, содержащем 5% BSA). После промывки мембраны инкубировали со вторичными антителами, конъюгированными с пероксидазой (разведение 1 : 5000 в буфере TBST, содержащем 5% обезжиренного молока). Визуализацию белка обеспечивали добавлением пикохемилюминесцентного субстрата (Thermo Fisher Scientific, США) с последующей детекцией хемилюминесцентных сигналов с помощью станции визуализации Fusion Fx (Vilber Lourmat, Франция). Относительные уровни экспрессии белка определяли денситометрией сигналов с использованием программного обеспечения Studio Image Lite (версия 5.2).
ЗАКЛЮЧЕНИЕ
Разработан новый метод быстрого получения 3D-культур клеток. Методы формирования сфероидов с применением поли-2,5-ДГБК, предложенные в настоящем исследовании (патент RU 2 742 689 C1, 2021) [67], имеют много преимуществ в лабораторном использовании и представляют собой простую и недорогую процедуру, которая вызывает минимальное вмешательство в жизнедеятельность клеток для их организации в 3D-структуру. Таким образом, новый метод 3D‑культивирования может быть применен для исследований солидных опухолей человека или других экспериментальных целей.
Список литературы
Egeblad M., Nakazone E.S., Werb Z. // Dev. Cell. 2010. V. 18. P. 884–901. https://doi.org/10.1016/j.devcel.2010.05.012
Mulholland T., McAllister M., Patek S., Flint D., Underwood M., Sim A., Edwards J., Zagnoni M. // Sci. Rep. 2018. V. 8. P. 14672. https://doi.org/10.1038/s41598-018-33055-0
Lin R.Z., Chang H.Y. // Biotechnol. J. 2008. V. 3. P. 1172–1184. https://doi.org/10.1002/biot.200700228
Harrison R.G., Greenman M.J., Mall P., Jackson C.M. // Anat. Rec. 1907. V. 1. P. 116–128. https://doi.org/10.1002/ar.1092340113
Breslin S., O’Driscoll L. // Drug Dis. Today. 2013. V. 18. P. 240–249. https://doi.org/10.1016/j.drudis.2012.10.003
Desoize B., Jardillier J. // Crit. Rev. Oncol. Hematol. 2000. V. 36. P. 193–207.
Dardousis K., Voolstra C., Roengvoraphoj M., Sekandarzad A., Mesghenna S., Winkler J., Ko Y., Hescheler J., Sachinidis A. // Mol. Ther. 2007. V. 15. P. 94–102. https://doi.org/10.1038/sj.mt.6300003
Ghosh S., Joshi M.B., Ivanov D., Feder-Mengus C., Spagnoli G.C., Martin I., Erne P., Resink T.J. // FEBS Lett. 2007. V. 581. P. 4523–4528. https://doi.org/10.1016/j.febslet.2007.08.038
Feder-Mengus C., Ghosh S., Weber W.P., Wyler S., Zajac P., Terracciano L., Oertli D., Heberer M., Martin I., Spagnoli G., Reschner A. // Br. J. Cancer. 2007. V. 96. P. 1072–1082. https://doi.org/10.1038/sj.bjc.6603664
Durand R.E. // Cancer Chemother. Pharmacol. 1990. V. 26. P. 198–204. https://doi.org/10.1007/bf02897199
Bartholoma P., Reininger-Mack I.A., Zhang Z., Thielecke H., Robitzki A. // J. Biomol. Screen. 2005. V. 10. P. 705–714. https://doi.org/10.1177/1087057105277841
Friedrich J., Seidel C., Ebner R., Kunz-Schughart L.A. // Nature Protoc. 2009. V. 4. P. 309–324. https://doi.org/10.1038/nprot.2008.226
Kunz-Schughart L.A., Freyer J.P., Hofstaedter F., Ebner R. // J. Biomol. Screen. 2004. V. 9. P. 273–285. https://doi.org/10.1177/1087057104265040
Dubessy C., Merlin J.M., Marchal C., Guillemin F. // Crit. Rev. Oncol. Hematol. 2000. V. 36. P. 179–192. https://doi.org/10.1016/s1040-8428(00)00085-8
Lin R.Z., Chu W.C., Chiang C.C., Lai C.H., Chang H.Y. // Tissue Eng. Part. C Methods. 2008. V. 14. P. 197–205. https://doi.org/10.1089/ten.tec.2008.0061
Steer D.L., Nigam S.K. // Am. J. Physiol. Renal. Physiol. 2004. V. 1. P. 1–7.
Ivascu A., Kubbies M. // J. Biomol. Screen. 2006. V. 11. P. 922–932. https://doi.org/10.1177/1087057106292763
Friedrich J., Seidel C., Ebner R., Kunz-Schughart L.A. // Nat. Protoc. 2009. V. 4. P. 309–324. https://doi.org/10.1038/nprot.2008.226
Klinder A., Markhoff J., Jonitz-Heincke A., Sterna P., Salamon A., Bader R. // Exp. Ther. Med. 2019. V. 17. P. 2004–2012. https://doi.org/10.3892/etm.2019.7204
Keller G.M. // Curr. Opin. Cell Biol. 1995. V. 7. P. 862–869. https://doi.org/10.1016/0955-0674(95)80071-9
Kelm J.M., Timmins N.E., Brown C.J., Fussenegger M., Nielsen L.K. // Biotechnol. Bioeng. 2003. V. 83. P. 173–180. https://doi.org/10.1002/bit.10655
Kurosawa H. // J. Biosci. Bioeng. 2007. V. 3. P. 389–398. https://doi.org/10.1263/jbb.103.389
Timmins N.E., Nielsen L.K. // Methods Mol. Med. 2007. V. 140. P. 141–151. https://doi.org/10.1007/978-1-59745-443-8_8
Kim J.B. // Semin. Cancer Biol. 2005. V. 5. P. 365–377. https://doi.org/10.1016/j.semcancer.2005.05.002
Barrila J., Radtke A.L., Crabbé A., Sarker S.F., Herbst-Kralovetz M.M., Ott C.M., Nickerson C.A. // Nat. Rev. Microbiol. 2010. V. 8. P. 791–801. https://doi.org/10.1038/nrmicro2423
Lin R.Z., Chang H.Y. // Biotechnol. J. 2008. V. 3. P. 1172–1184. https://doi.org/10.1002/biot.200700228
Lü W.D., Zhang L., Wu C.L., Liu Z.G., Lei G.Y., Liu J., Gao W., Hu Y.R. // PLoS One. 2014. V. 9. P. e103672. https://doi.org/10.1371/journal.pone.0103672
Hughes C.S., Postovit L.M., Lajoie G.A. // Proteomics. 2010. V. 10. P. 1886–1890. https://doi.org/10.1002/pmic.200900758
Porzionato A., Stocco E., Barbon S., Grandi F., Macchi V., De Caro R. // Int. J. Mol. Sci. 2018. V. 19. P. 4117. https://doi.org/10.3390/ijms19124117
Nath S., Devi G.R. // Pharmacol. Ther. 2016. V. 163. P. 94–108. https://doi.org/10.1016/j.pharmthera.2016.03.013
Sodunke T.R., Turner K.K., Caldwell S.A., McBride K.W., Reginato M.J., Noh H.M. // Biomaterials. 2007. V. 28. P. 4006–4016.
Zaki M.Y.W., Shetty S., Wilkinson A.L., Patten D.A., Oakley F., Reeves H. // J. Vis. Exp. 2021. V. 175. P. e62868. https://doi.org/10.3791/62868
Sourla A., Doillon C., Koutsilieris M. // Anticancer Res. 1996. V. 16. P. 2773–2780.
Jiang T., Munguia-Lopez J.G., Flores-Torres S., Grant J., Vijayakumar S., De Leon-Rodriguez A., Kinsella M.J. // Sci. Rep. 2017. V. 7. P. 4575. https://doi.org/10.1038/s41598-017-04691-9
Lisov A., Vrublevskaya V., Lisova Z., Leontievsky A., Morenkov O. // Viruses. 2015. V. 7. P. 5343–5360. https://doi.org/10.3390/v7102878
Edmondson R., Broglie J.J., Adcock A.F., Yang L. // Assay Drug Dev. Technol. 2014. V. 12. P. 207–218. https://doi.org/10.1089/adt.2014.573
Lin R.Z., Chang H.Y. // Biotechnol. J. 2008. V. 3. P. 1172–1184. https://doi.org/10.1002/biot.200700228
Benien P., Swami A. // Future Oncol. 2014. V. 10. P. 1311–1327. https://doi.org/10.2217/fon.13.274
Archibald M., Pritchard T., Nehoff H., Rosengren R.J., Greish K., Taurin S. // Int. J. Nanomed. 2016. V. 11. P. 179–200. https://doi.org/10.2147/IJN.S97286
Roberts G.C., Morris P.G., Moss M.A., Maltby S.L., Palmer C.A., Nash C.E., Smart E., Holliday D.L., Speirs V. // PLoS One. 2016. V. 11. e0157004. https://doi.org/10.1371/journal.pone.0157004
Takir G.G., Debelec-Butuner B., Korkmaz K.S. // Proceedings. 2018. V. 2. P. 1555. https://doi.org/10.3390/proceedings2251555
Kim C.J., Terado T., Tambe Y., Mukaisho K., Sugihara H., Kawauchi A., Inoue H. // Int. J. Oncol. 2018. V. 52. P. 231–240. https://doi.org/10.3892/ijo.2017.4194
Zhao L., Xiu J., Liu Y., Zhang T., Pan W., Zheng X., Zhang X. // Sci. Rep. 2019. V. 9. P. 19717. https://doi.org/10.1038/s41598-019-56241-0
Froehlich K., Haeger J.D., Heger J., Pastuschek J., Photini S.M., Yan Y., Lupp A., Pfarrer C., Mrowka R., Schleußner E., Markert U.R., Schmidt A. // J. Mammary Gland Biol. Neoplasia. 2016. V. 21. P. 89–98. https://doi.org/10.1007/s10911-016-9359-2
Rodríguez C.E., Reidel S.I., Bal de Kier Joffé E.D., Jasnis M.A., Fiszman G.L. // PLoS One. 2015. V. 10. P. e0137920. https://doi.org/10.1371/journal.pone.0137920
Djordjevic B., Lange C.S. // Acta Oncol. 2006. V. 45. P. 412–420. https://doi.org/10.1080/02841860500520743
Kim H., Phung Y., Ho M. // PLoS One. 2012. V. 7. e39556. https://doi.org/10.1371/journal.pone.0039556
Betson M., Lozano E., Zhang J., Braga V.M. // J. Biol. Chem. 2002. V. 277. P. 36962–36969. https://doi.org/10.1074/jbc.m207358200
Troitskaya O., Novak D., Nushtaeva A., Savinkova M., Varlamov M., Ermakov M., Richter V., Koval O. // Int. J. Mol. Sci. 2021. V. 22. P. 12937. https://doi.org/10.3390/ijms222312937
Kitajima D., Kasamatsu A., Nakashima D., Miyamoto I., Kimura Y., Endo-Sakamoto Y., Shiiba M., Tanzawa H., Uzawa K. // Oncology Lett. 2018. V. 15. P. 7237–7242. https://doi.org/10.3892/ol.2018.8212
Fukuhara S., Sako K., Noda K., Nagao K., Miura K., Mochizuki N. // Exp. Mol. Med. 2009. V. 41. P. 133–139. https://doi.org/10.3858/emm.2009.41.3.016
Weinberg F., Han M.K.L, Dahmke I.N., Del Campo A., de Jonge N. // PLoS One. 2020. V. 15. P. e0234430. https://doi.org/10.1371/journal.pone.0234430
Singh A., Winterbottom E., Daar I.O. // Front. Biosci. (Landmark Ed). 2012. V. 17. P. 473–497. https://doi.org/10.2741/3939
Godoy-Parejo C., Deng C., Liu W., Chen G. // Stem. Cells. 2019. V. 37. P. 1030–1041. https://doi.org/10.1002/stem.3026
Cockburn J.G., Richardson D.S., Gujral T.S., Mulligan L.M. // J. Clin. Endocrinol. Metab. 2010. V. 95. P. 342–346. https://doi.org/10.1210/jc.2010-0771
Henry C., Hacker N., Ford C. // Oncotarget. 2017. V. 8. P. 112727–112738. https://doi.org/10.18632/oncotarget.22559
Shin W.S., Park M.K., Lee Y.H., Kim K.W., Lee H., Lee S.T. // Cancer Sci. 2020. V. 111. P. 3292–3302. https://doi.org/10.1111/cas.14568
Chiasson-MacKenzie C., McClatchey A.I. // Cold Spring. Harb. Perspect. Biol. 2018. V. 10. P. a029215. https://doi.org/10.1101/cshperspect.a029215
Kim Y.B., Nikoulina S.E., Ciaraldi T.P., Henry R.R., Kahn B.B. // J. Clin. Invest. 1999. V. 104. P. 733–741. https://doi.org/10.1172/JCI6928
Mackenzie R., Elliott B. // Diabetes Metab. Syndr. Obes. 2014. V. 7. P. 55–64. https://doi.org/10.2147/DMSO.S48260
Li G., Ji X.D., Gao H., Zhao J.S., Xu J.F., Sun Z.J., Deng Y.Z., Shi S., Feng Y.X., Zhu Y.Q., Wang T., Li J.J., Xie D. // Nat. Commun. 2012. V. 3. P. 667. https://doi.org/10.1038/ncomms1675
Akasov R., Gileva A., Zaytseva-Zotova D., Burov S., Chevalot I., Guedon E., Markvicheva E. // Biotechnol. Lett. 2017. V. 39. P. 45–53.
Buckley C.D., Pilling D., Henriquez N.V., Parsonage G., Threlfall K., Scheel-Toellner D., Simmons D.L., Akbar A.N., Lord J.M., Salmon M. // Nature. 1999. V. 397. P. 534–539. https://doi.org/10.1038/17409
Kang I.C., Kim D.S., Jang Y., Chung K.H. // Biochem. Bioph. Res. Comm. 2000. V. 275. P. 169–173. https://doi.org/10.1006/bbrc.2000.3130
Ritchie C.K., Giordano A., Khalili K. // J. Cell Physiol. 2000. V. 184. P. 214–221. https://doi.org/10.1002/1097-4652(200008)184:2%3C214: :aid-jcp9%3E3.0.co;2-z
Anuradh, C., Kanno S., Hirano S. // Cell Biol. Toxicol. 2000. V. 16. P. 275–283. https://doi.org/10.1023/a:1026758429238
Рысцов Г.К., Лисов А.В., Земскова М.Ю. // Патент RU 2742689 C1, 2021.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


