Биоорганическая химия, 2023, T. 49, № 1, стр. 79-92
Экспериментальная оценка 3-мета-пиридин-1,2,4-оксадиазольного производного дезоксихолевой кислоты как прототипа ингибиторов 5-α-редуктазы в моделях in silico и in vivo
Ю. В. Мешкова 1, Д. С. Баев 1, И. В. Сорокина 1, *, И. И. Попадюк 1, О. В. Саломатина 1, Н. А. Жукова 1, Т. Г. Толстикова 1, Н. Ф. Салахутдинов 1
1 Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 9, Россия
* E-mail: sorokina.irina55@gmail.com
Поступила в редакцию 17.06.2022
После доработки 11.07.2022
Принята к публикации 12.08.2022
- EDN: GGKQXV
- DOI: 10.31857/S0132342323010189
Аннотация
Ингибиторы 5-α-редуктазы (5-АР) считаются наиболее эффективными препаратами в лечении пролиферативных процессов при аденоме предстательной железы. К ним относятся два синтетических азастероида – финастерид и дутастерид, которые в условиях длительной курсовой терапии вызывают побочные эффекты в виде расстройств половой функции у мужчин. В качестве стартового соединения для получения малотоксичных ингибиторов 5-АР нами предложена дезоксихолевая кислота, на основе которой синтезировано целевое соединение, содержащее 3-мета-пиридин-1,2,4-оксадиазольный фрагмент. Методом молекулярного докинга показано, что новый агент, подобно финастериду, способен проникать в сайт связывания 5-АР через образование ковалентных аддуктов с NADP-H. При этом оба лиганда имеют сопоставимые величины энергии связывания с мишенью (–20 и –15 ккал/моль соответственно у финастерида и целевого соединения). В экспериментах на тестостероновой и сульпиридной моделях доброкачественной гиперплазии предстательной железы установлено, что внутрижелудочное введение полученного производного дезоксихолевой кислоты крысам Wistar в дозе 20 мг/кг и финастерида в дозе 10 мг/кг оказывает сходное простатопротекторное действие путем уменьшения пролиферативных процессов в железистом эпителии и строме простаты крыс. Новый агент менее токсичен, чем финастерид: величина LD50 у мышей CD-1 составляет >1500 мг/кг против 1060 мг/кг у финастерида. На основании полученных результатов 3-мета-пиридин-1,2,4-оксадиазольное производное дезоксихолевой кислоты может рассматриваться как перспективный кандидат для доклинических испытаний.
ВВЕДЕНИЕ
Доброкачественная гиперплазия предстательной железы (ДГПЖ), возникающая на фоне общего старения организма, – наиболее распространенное урологическое заболевание, существенно снижающее работоспособность и качество жизни мужчин после 50–60 лет [1, 2]. Ведущая патогенетическая черта ДГПЖ – стимуляция пролиферативных процессов в железистом эпителии и строме периуретрального отдела простаты, ассоциированная с повышением активности простатической 5-α-редуктазы (5-АР).
5-АР – мембранный белок, один из ключевых ферментов метаболизма стероидов в организме. В предстательной железе экспрессируется одна из изоформ фермента – 5-АР II типа (КФ 1.3.99.5), которая катализирует превращение тестостерона в дигидротестостерон (DHT) [3, 4]. Оба андрогена являются лигандами андрогеновых рецепторов, однако аффинность DHT к 5-АР в 3–5 раз выше, чем у его предшественника [5]. Активация андрогеновых рецепторов, вызванная повышением продукции DHT, приводит к увеличению экспрессии ростовых факторов, индуцирующих митотическую активность клеток простаты и развитию ее аденомы [3].
Препаратами выбора для патогенетической терапии ДГПЖ считаются ингибиторы 5-α-редуктазы (5-АРИ). В настоящее время в этой группе имеется два конвенциональных препарата – финастерид и дутастерид – структурные аналоги азастероидного типа. Оба задерживают рост простаты (до 30%) и обладают относительно удовлетворительной переносимостью [6]. Однако в условиях длительных курсов терапии у пациентов возникают признаки половой дисфункции в виде снижения либидо, нарушения эякуляции, а также гинекомастии [7, 8]. Поэтому в мире ведется активный поиск 5-АРИ среди соединений других структурных классов.
Ранее в Новосибирском институте органической химии им. Н.Н. Ворожцова СО РАН в качестве прототипов 5-АРИ были исследованы дезоксихолевая кислота (DCA) и ее 1,2,4-оксадиазольные производные [9]. Методом молекулярного докинга показано, что эти соединения не уступают финастериду по величине энергии связывания в активном центре 5-АР. В модели ДГПЖ, индуцированной тестостероном, эти же агенты проявляют аналогичный финастериду антипролиферативный эффект в предстательной железе крыс.
Цель данной работы – синтез нового 1,2,4-оксадиазольного производного DCA, содержащего в 3-м положении гетероцикла мета-пиридиновый фрагмент, молекулярный докинг данного агента в активный центр 5-АР, исследование его простатопротекторных свойств на двух моделях с гормональной индукцией ДГПЖ у крыс (андроген- и пролактин-зависимая ДГПЖ) и определение токсичности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
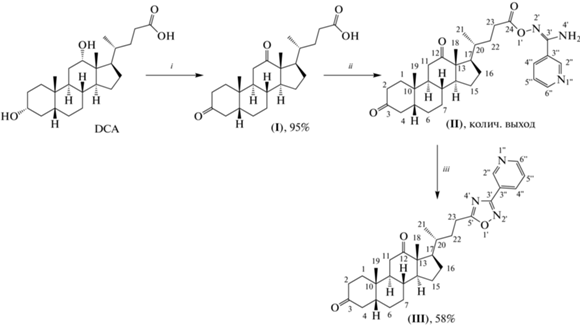
Синтез 3-(пиридин-3'-ил)-5-(24''-нор-3'',12''-диоксо-5''β-холан-23''ил)-1,2,4-оксадиазола (III). Целевое соединение (III), полученное трансформацией нативной карбоксильной группы в 1,2,4-оксадиазольное кольцо, было синтезировано в соответствии со схемой 1 . Стартовое соединение для синтеза – коммерчески доступная DCA. Первоначально провели окисление гидроксильных групп стероидного остова до карбонильных реагентом Джонса в ацетоне с образованием 3,12-диoксо-5β-холан-24-овой кислоты (I) по литературной методике с выходом 95% [10, 11].
Схема 1 . Синтез соединения (III): i – реагент Джонса, ацетон, 0°С → т. комн.; ii – 1) CDI, CH2Cl2; 2) N'-гидроксиникотинимидамид, CH2Cl2; iii – КОН, DMSO, 60°С.
Формирование 1,2,4-оксадиазольного цикла на базе карбоксильной группы проводили в два этапа: 1) взаимодействием активированной карбоксильной группы с N'-гидроксиникотинимидамидом с образованием соединений (II), активацию карбоксильной группы проводили N,N'-карбонилдиимидазолом (CDI); 2) замыкание 1,2,4-оксадиазольного цикла под действием гидроксида калия в DMSO привело к получению целевого соединения (III). Суммарный выход соединения (III) в расчете на исходное соединение составил 55%.
Молекулярный докинг. 5-АР катализирует необратимое восстановление 4,5-двойной связи в ∆4,5-3-кетостероидах до одинарной [12, 13]. Для протекания реакции необходим донор гидрид-иона в виде кофактора NADP-Н (рис. 1а). Рентген-кристаллографические модели взаимодействия 5-АР и финастерида демонстрируют высокую вероятность образования ковалентного аддукта финастерида с NADP-H по положению С-2 в цикле А молекулы финастерида, который необратимо блокирует активный сайт 5-АР, не позволяя протекать катализируемой реакции [14] (рис. 1б).
Рис. 1.
Механизмы превращения тестостерона в дигидротестостерон (а) и образования ковалентного аддукта NADP-Н и финастерида (б) из статьи авторов модели [16].

Возникновение аддуктов с NADP-H теоретически возможно и с другими стероидными молекулами, например, с производным DCA (рис. 2).
Рис. 2.
Возможные аддукты производного (III) с NADP+ и NADP-H. Сайты присоединения NADP-Н указаны стрелками с номерами, соответствующими шифрам аддуктов. Молекула NADP-H в структуре аддуктов приведена в сокращенном виде.
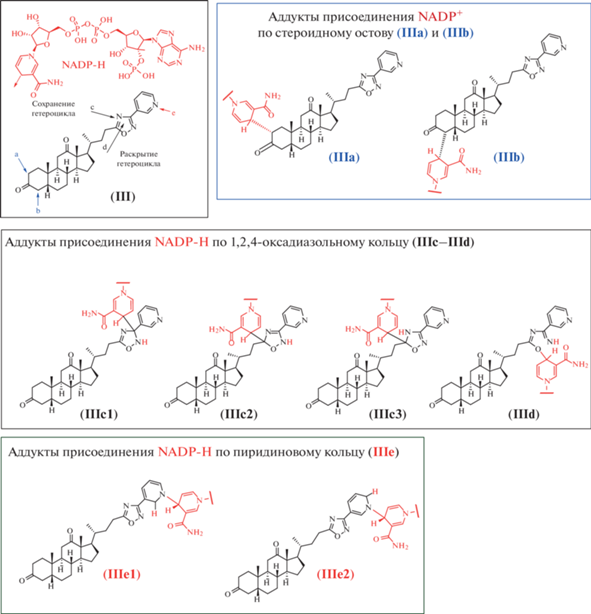
Рассматривая соединение (III) с точки зрения возможного взаимодействия с NADP+ и NADP-Н, можно выделить три фрагмента: стероидное ядро, 1,2,4-оксадиазольный цикл и пиридиновый фрагмент. Аддукты по стероидному фрагменту могут образовываться в результате взаимодействия енольной формы карбонильной группы с NADP+ (аддукты (IIIa) и (IIIb)). 1,2,4-Оксадиазольный фрагмент в результате взаимодействия с NADP-Н может образовывать аддукты как с сохранением гетероцикла (аддукты (IIIc1–IIIc3)), так и с разрушением гетероцикла (аддукт IIId). Причем хотелось бы отметить, что разрушение гетероциклического фрагмента по типу формирования аддукта (IIId) наблюдалось при изучении метаболизма 1,2,4-оксадиазолсодержащих производных [15, 16]. Аддукты по пиридиновому кольцу (IIIe1) и (IIIe2) могут быть образованы в результате первоначальной атаки как гидрид-иона (поскольку пиридиновое кольцо электронодефицитное и способно вступать в реакции ароматического нуклеофильного присоединения), так и в результате первичного присоединения NADP+ к атому азота пиридинового кольца.
В результате выполнения расчетной функции докинга были получены значения оценочной минимальной энергии связывания (табл. 1). Среди возможных аддуктов производного (III) в сайт связывания 5-АР могут проникать соединения с различными сайтами присоединения молекулы NADP-H: аддукты (IIIe1) и (IIIe2) (присоединение молекулы NADP-H происходит по пиридиновому кольцу); аддукт (IIIc1) (присоединение по 1,2,4-оксадиазольному циклу), аддукт (IIId) (может образовываться в результате метаболического раскрытия гетероцикла), а также аддукт (IIIa) (продукт присоединения NADP+ по 2-му положению стероидного остова). Самое низкое значение оценочной энергии связывания было получено для аддукта (IIId). По-видимому, присоединение молекулы NADP-H по связи N–O 1,2,4-оксадиазольного цикла с последующим раскрытием последнего дает конформационные преимущества в сайте связывания 5-АР по сравнению с различными вариантами присоединения с сохранением цикла. Аддукты по пиридиновому кольцу, вероятно, также способны принимать в сайте связывания 5-АР энергетически выгодные конформации. Интересно, что аддукты производного (III) с более разветвленной структурой, когда молекула NADP может быть присоединена к атомам азота 1,2,4-оксадиазольного цикла, не способны проникать в сайт связывания. Конформационные затруднения в сайте связывания также возникают и в случае аддуктов в 4-е (IIIb) и 12-е положения стероидного остова.
Таблица 1.
Результаты молекулярного докинга аддуктов производного (III) в сайт связывания 5-АР в сравнении с аддуктом финастерид-(NADP-H)
| Лиганд | Финастерид-(NADP-Н) | (IIId) | (IIIe1) | (IIIe2) | (IIIа) | (IIIc1) |
|---|---|---|---|---|---|---|
| Энергия связывания*, ккал/моль | –20.50 | –17.93 | –15.71 | –15.20 | –14.67 | –13.36 |
Особенности пространственного расположения и нековалентных взаимодействий в сайте связывания 5-АР были рассмотрены для аддуктов с самой высокой теоретической аффинностью. Сайт связывания NADP-Н и стероидов представляет собой туннелеобразную полость, состоящую из глубокого гидрофильного кармана, связывающего молекулу NADP-Н, и гидрофобного входного отдела, где располагается стероидная молекула (рис. 3а). Карман связывания NADP-Н преимущественно образован положительно заряженными аминокислотными остатками, формирующими большое количество водородных связей и электростатических взаимодействий с полярными группами NADP-Н. Стероидные молекулы стабилизированы в сайте связывания за счет гидрофобных взаимодействий стероидного ядра. Полярные группы молекулы финастерида (рис. 3б) обладают возможностями дополнительных взаимодействий с аминокислотными остатками Glu57 и Arg114, повышая устойчивость ингибирующей конформации аддукта в сайте связывания. Отмечается важность гидрофобного взаимодействия финастерида и аминокислотного остатка Phe118; показано, что точечная замена этой аминокислоты приводит к невозможности связывания тестостерона и резкому снижению каталитической активности фермента [17].
Рис. 3.
Особенности расположения и нековалентных взаимодействий аддуктов NADP+, NADP-H и соединения (III) в сайте связывания 5-АР в сравнении с аддуктом финастерид-(NADP-Н): (а) – суперпозиция структур аддуктов в сайте связывания (структуры выделены цветом: серым – дигидрофинастерид, желтым – (IIIе1), зеленым – (IIIe2), оранжевым – (IIIa), голубым – (IIId); (б) – финастерид-(NADP-Н); (в) – аддукт (IIId); (г) – аддукт (IIIе1); (д) – аддукт (IIIe2); (е) – аддукт (IIIa). Нековалентные взаимодействия соединений в активном сайте показаны пунктирными линиями: зелеными – водородные связи, фиолетовыми – стэкинг-взаимодействия, розовыми – гидрофобные взаимодействия.

Суперпозиция структур аддуктов в сайте связывания 5-АР (рис. 3а) показывает, что характерная особенность аддуктов (IIIe1) и (IIIe2) – наличие линкера между стероидным остовом и NADP, состоящего из алифатического участка и гетероциклических структур заместителя (рис. 3г, 3д). Этот линкер занимает пространство стероидного кармана сайта связывания. При этом стероидный остов новых производных располагается за пределами сайта связывания между петлевыми структурами L1 и L4 трансмембранного домена. Наличие линкера не препятствует структуре молекулы NADP занимать предназначенный ей гидрофильный карман. Аддукт (IIIa) обладает высокой структурной схожестью с аддуктом финастерида в силу присоединения молекулы NADP по 2-му положению цикла А стероидного каркаса. При этом каркас DCA располагается в стероидном кармане сайта связывания, а гетероциклический заместитель выходит за пределы сайта связывания, не участвуя в образовании водородных связей (рис. 3е). В результате присоединения молекулы NADP-Н через гетероциклический линкер аддукты (IIIe1), (IIIe2) и (IIId) обладают развернутым на 180° стероидным каркасом относительно аддуктов (IIIa) и финастерид-(NADP-Н). Карбонильные группы стероидного остова DCA аддуктов производного (III) не участвуют в образовании водородных связей с аминокислотными остатками сайта связывания 5-АР. Наиболее теоретически аффинный аддукт (IIId) интересен гибкостью линкерного участка молекулы, возникающей в результате метаболического раскрытия 1,2,4-оксадиазольного цикла (рис. 3в). Возникающая конформационная подвижность этой части молекулы приводит к занятию пиридиновым циклом аддукта глубокого кармана сайта связывания, где могут формироваться взаимодействия с аминокислотными остатками Cys119 и Phe216. Такое пространственное расположение молекулы (IIId) приводит к расположению каркаса DCA в стероидном кармане сайта связывания 5-АР, что существенно отличает эту молекулу от аддуктов, в которых молекула NADP тоже присоединена к атомам гетероциклического заместителя.
Простатопротекторная активность. Исследование простатопротекторной активности соединения (III) проводили в сравнении с финастеридом на двух гормон-зависимых моделях ДГПЖ у крыс линии Wistar, у которых пролиферативный процесс в простате индуцировали ежедневным введением тестостерона пропионата (андроген-опосредованная модель) [18] либо нейролептика сульпирида (пролактин-опосредованная модель) [19].
Предстательная железа интактных животных имеет типичное строение (рис. 4а): секреторная часть представлена концевыми отделами и выводными протоками многочисленных желез, выстланных преимущественно однослойным кубическим или призматическим эпителием без повышенной митотической активности; воспалительные и дегенеративные изменения в ткани отсутствуют.
Рис. 4.
Тестостероновая модель ДГПЖ. Дорсолатеральный отдел предстательной железы крыс линии Wistar. Окрашивание гематоксилин-эозином, увеличение 200×. (а) – Интактные животные; (б) – контрольная группа (4-недельное введение тестостерона). Выраженная пролиферация железистого эпителия. Утолщение соединительнотканных прослоек; (в) – референсная группа (4-недельное введение тестостерона и финастерида). Кистозно-расширенные выводные протоки желез и утолщение соединительнотканных прослоек; (г) – опытная группа (4-недельное введение тестостерона и соединения (III)). Железистый эпителий без дистрофических изменений.
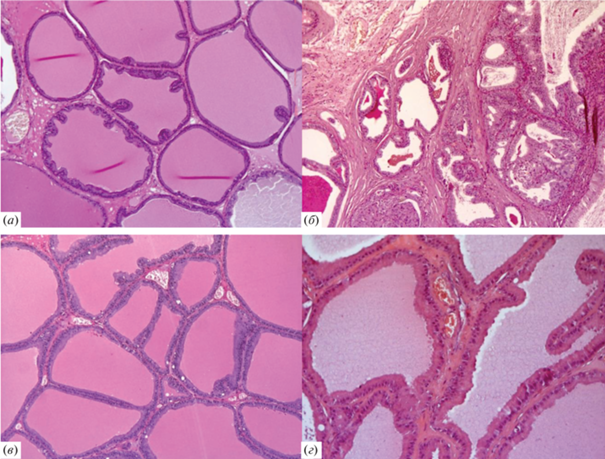
В ряде работ на тестостероновой модели ДГПЖ было показано, что высокий уровень циркулирующего тестостерона вызывает увеличение в простате концентрации DHT, что указывает на активацию 5-АР [20–22]. В этих условиях развитие активного гиперпластического процесса идет преимущественно в железистом эпителии, где имеется широкое представительство андрогеновых рецепторов, являющихся мишенью андрогенов. В нашем эксперименте 4-недельное введение тестостерона пропионата приводило к активному формированию новых очагов пролиферации в железистом отделе предстательной железы крыс контрольной группы с образованием разветвленных папиллярных структур в просвете ацинусов (рис. 4б). В отличие от интактных животных, существенно изменялось состояние эпителия ацинусов: он определялся как активно пролиферирующий, высокий призматический с гиперхромными ядрами, местами многорядный с большим количеством митозов. В нем также визуализировалась вакуольная дистрофия. Во всех отделах предстательной железы наблюдалось выраженное венозное полнокровие и отек стромы. Прогрессирование пролиферативной активности ацинарных структур сопровождалось нарушением оттока секрета из ацинусов, их кистозным расширением с атрофией эпителия. Просвет желез был заполнен секретом в виде эозинофильной субстанции и слущенными эпителиальными клетками. Таким образом, патологические изменения, выявленные в простате крыс контрольной группы, по тяжести соответствовали III–IV стадии гиперпластического процесса (рис. 4б).
Введение животным финастерида на фоне тестостерона приводило к заметной регрессии гиперпластического процесса, который у всех животных референсной группы соответствовал папиллярной очаговой гиперплазии I–II стадии (рис. 4в). Железистый эпителий в ацинусах определялся как призматический, без выраженных признаков пролиферации и атипии. Визуально уменьшилось количество митозов в эпителиоцитах. Тем не менее на фоне введения финастерида сохранялась вакуольная дистрофия железистого эпителия, а также выраженные гемодинамические нарушения в виде венозного полнокровия, отека и лимфоцитарно-макрофагальной инфильтрации стромы. Наблюдались признаки частичного нарушения оттока секрета из ацинусов с очаговым кистозным расширением и атрофией эпителия. Просвет желез был заполнен секретом в виде эозинофильной субстанции и слущенными клетками (рис. 4в).
Введение соединения (III) приводило к таким же положительным сдвигам в состоянии предстательной железы, какие отмечены выше у крыс референсной группы. Выявленные сдвиги были связаны с регрессией гиперпластических процессов, особенно в железистой части простаты. Железистый эпителий в ацинусах отмечен как призматический без повышенной митотической активности. При этом в железистом эпителии наблюдалось значительное снижение дистрофических изменений, а также некоторое улучшение гемодинамических процессов в виде слабо выраженного отека стромы и венозного полнокровия. Выводные протоки желез были частично кистозно расширены, с атрофичным эпителием. Просвет желез был заполнен секретом в виде эозинофильной субстанции. Морфологическая картина простаты опытных крыс соответствовала папиллярной очаговой гиперплазии I–II стадии (рис. 4г).
Таким образом, в тестостероновой модели ДГПЖ выявлена простатопротекторная активность соединения (III), которая проявлялась в снижении роста железистого эпителия и нормализации просвета желез. Эти наблюдения подтверждаются данными морфометрического анализа железы у этих же животных. Показано, что 4-недельное введение тестостерона достоверно увеличивало объемную плотность железистого эпителия в 1.5 раз и уменьшало просвет желез в 1.5 раза у контрольных животных относительно интактных (рис. 5). Введение соединения (III) на фоне андрогена приводило к существенному снижению объемной плотности эпителия в 1.4 раза относительно контрольной группы, в то время как для финастерида этот эффект был статистически не значимым (рис. 5). Кроме того, под влиянием изучаемого агента (III) просвет желез восстанавливался до показателей интактной нормы, тогда как при введении референсного препарата данный показатель не имел достоверных различий с контрольной группой (рис. 5). Показатели объемной плотности стромы во всех группах статистически не отличались от интактных животных, что характерно для тестостероновой модели [23].
Рис. 5.
Влияние соединения (III) на показатели объемной плотности компонентов предстательной железы крыс линии Wistar в модели ДГПЖ, индуцированной тестостероном. Данные представлены в виде среднего значения ± ошибка среднего; #р < 0.05 – достоверные различия относительно интактной группы; * p < 0.05 – достоверные различия относительно контрольной группы.

В модели ДГПЖ, индуцированной сульпиридом, патологические изменения опосредуются гиперпролактинемией – характерным побочным эффектом данного нейролептика [24]. Активизация гипофизарной секреции пролактина вносит свой вклад в патогенез ДГПЖ, который обычно развивается на фоне дисбаланса между андрогенами и пролактином [25]. В предстательной железе, особенно в ее строме, имеется много рецепторов пролактина, которые участвуют в рецепторных отношениях с железистым эпителием, а также в процессах ремоделирования ткани простаты.
В эксперименте на сульпиридной модели ДГПЖ нами показано, что 8-недельное введение нейролептика вызывало патологические изменения как в железистом, так и в стромальном компартментах простаты. У животных контрольной группы отмечалось развитие очаговой железистой гиперплазии, сходной с описанной выше в тестостероновой модели. К характерным признакам относятся появление новых очагов пролиферации в просвете ацинусов, изменение состояния железистого эпителия, указывающее на его митотическую активность, кистозное расширение простатических желез, заполненных секретом в виде эозинофильной и ШИК-позитивной субстанции (мукополисахариды, выявляемые в реакции с Шифф-йодной кислотой). Во всех отделах предстательной железы выявлялись выраженное венозное полнокровие, отек и коллагенизация стромы. Таким образом, выявленные патологические изменения в простате крыс контрольной группы соответствуют II–III стадии гиперпластического процесса (рис. 6а).
Рис. 6.
Сульпиридная модель ДГПЖ. Дорсолатеральный отдел предстательной железы крыс линии Wistar. Окрашивание ШИК–гематоксилин–оранжевый G, увеличение 200×. (а) – Контрольная группа (8-недельное введение сульпирида). Коллагенизация и отек стромы; (б) – референсная группа (8-недельное введение сульпирида и финастерида). Умеренная гиперплазия железистого эпителия, гемодинамические нарушения в виде полнокровия сосудов и плазматический отек межуточной ткани; (в) – опытная группа (8-недельное введение сульпирида и соединения (III)). Отек и коллагенизация стромы.

В группе животных, получавших сульпирид и препарат сравнения финастерид, отмечалась тенденция к небольшой регрессии гиперпластического процесса по сравнению с контролем, что выражалось в снижении активности пролиферативных процессов как в эпителии, так и в строме простаты. Вместе с тем у всех животных референсной группы зафиксирована умеренная очаговая гиперплазия железистого эпителия, признаки коллагенизации стромы, а также умеренные гемодинамические нарушения в виде полнокровия сосудов и плазматического отека интерстициальной ткани (рис. 6б).
В группе животных, получавших соединение (III) и сульпирид, визуально отмечалось уменьшение патологических изменений в простате, аналогично эффекту финастерида. Это проявлялось в виде менее выраженного пролиферативного процесса в секреторной части простаты по сравнению с крысами контрольной группы. В строме периуретральной зоны сохранялись умеренные гемодинамические нарушения в виде венозного полнокровия и отека, что способствовало затруднению оттока секрета из желез и сопровождалось их кистозным расширением. Стенки кровеносных сосудов утолщены, просветы их сужены (рис. 6в).
По данным морфометрического анализа, в результате 8-недельного введения сульпирида объемная плотность стромы простаты у крыс контрольной группы достоверно увеличивалась в 1.4 раза, а просвет желез уменьшался в 1.2 раза относительно интактных животных (рис. 7). Плотность железистого эпителия увеличивалась незначимо (в 1.1 раза).
Рис. 7.
Влияние соединения (III) на показатели объемной плотности компонентов предстательной железы крыс линии Wistar в модели ДГПЖ, индуцированной сульпиридом. Данные представлены в виде среднего значения ± ошибка среднего; #р < 0.05 – достоверные различия относительно интактной группы; * p < 0.05 – достоверные различия относительно контрольной группы.
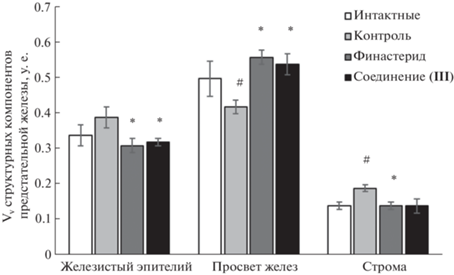
Введение финастерида на фоне сульпирида вызывало у животных достоверное снижение объемной плотности эпителия и стромы простаты относительно контрольной группы (в 1.3 и 1.4 раза соответственно) (рис. 7). Соединение (III) проявляло аналогичный антипролиферативный эффект в эпителии желез, а именно снижение объемной плотности в 1.2 раза относительно контроля, однако снижение объемной плотности стромы в 1.4 раза против контроля было статистически недостоверным. Показатель просвета желез существенно увеличивался как под влиянием соединения (III), так и финастерида (в 1.3 раза), демонстрируя достоверные различия с контрольной группой (рис. 7).
Таким образом, в сульпиридной модели ДГПЖ введение соединения (III) снижало пролиферативную активность эпителия простаты подобно финастериду. При этом оба агента поддерживали нормальные размеры стромы, характерные для интактных животных.
Острая токсичность. Острую токсичность соединения (III) определяли на мышах CD-1 в сравнении с финастеридом и DCA с регистрацией количества летальных исходов в течение 14 сут.
Установлено, что введение агентов в дозе 750 мг/кг не приводило к гибели животных во всех экспериментальных группах. Повышение дозы до 1500 мг/кг вызывало гибель 100% мышей в группе с введением финастерида и 66% мышей в группе с введением DCA. Введение соединения (III) в дозе 1500 мг/кг не вызывало гибель животных. Расчетные величины LD50 у финастерида, DCA и соединения (III) составили 1060, 1260 и >1500 мг/кг соответственно.
Таким образом, в результате химической модификации DCA токсичность производного (III) существенно снизилась по сравнению с исходным соединением и финастеридом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 3-(пиридин-3'-ил)-5-(24''-нор-3'',12''-диоксо-5''-β-холан-23''-ил)-1,2,4-оксадиазола (III). Спектры 1Н- и 13С-ЯМР и регистрировали на спектрометрах AV-300 (Bruker, Германия; рабочая частота на ядрах 1Н – 300.13 МГц, на ядрах 13С – 75.47 МГц) и DRX-500 (Bruker, Германия; рабочая частота на ядрах 1Н – 500.13 МГц, на ядрах 13С – 125.76 МГц) с использованием сигнала хлороформа (δH 7.24, δС 76.90 м.д.) в качестве внутреннего стандарта. Химические сдвиги сигналов (δ) приведены в миллионных долях (м.д.), а значения констант взаимодействия (J) – в герцах (Гц). Строение полученных соединений устанавливали на основе анализа спектров 1Н- и 13С-ЯМР с привлечением спектров двойного резонанса 1Н-1Н, двумерных спектров гомоядерной корреляции 1Н-1Н (1Н-1Н COSY) и двумерных спектров гетероядерной корреляции 13С-1Н на прямых (С–Н COSY, 1JС,Н 160) и дальних константах спин-спинового взаимодействия (COLOC, 2,3JC,H 10). В спектрах 1H-ЯМР указаны химические сдвиги только характеристических сигналов, поскольку остов молекулы в ходе реакции сохраняется. Температуры плавления определяли на приборе FP900 (Mettler Toledo, Швейцария). Точные значения масс молекулярных ионов определяли на масс-спектрометре высокого разрешения с двойной фокусировкой DFS (Double Focusing Sector Mass Spectrometer, DFS High Resolution GC/MS; Thermo Scientific, США). Оптическое вращение измеряли с помощью поляриметра PolAAr 3005 (Optical Activity, Великобритания). ВЭЖХ-анализ проводили на приборе Milichrom A-02 (Эконова, Россия), используя в качестве сорбента ProntoSIL 120-5-C18 AQ (размер частиц 5 мкм, колонка 2.0 × × 75 мм). Подвижная фаза: очищенная вода Millipore с 0.1% трифторуксусной кислоты, скорость потока 150 мкл/мин при 35°C с УФ-детектированием на пяти длинах волн (210, 220, 240, 260, 280 нм). Стандартное время процесса 25 мин, линейный градиент метанола 0–100%. Чистота целевого соединения для биологических испытаний составляла ≥99.5% (подтверждена ВЭЖХ-анализом). Ход реакций и чистоту полученных продуктов контролировали методом ТСХ на пластинах Silica gel 60 F254 (Merck, Германия) с использованием хлороформа и систем хлороформ–метанол в различных соотношениях. Очистку продуктов реакции проводили колоночной хроматографией на силикагеле (Merck, 60–200 mesh, Мasherey-Nagel GmbH & Co. KG, Германия). Все растворители, используемые в реакциях и хроматографическом разделении, предварительно перегоняли и сушили в соответствии со справочными данными. В работе использовали дезоксихолевую кислоту (DCA, 99%) (abcr GmbH & Co. KG, Германия); N,N'-карбонилдиимидазол (97%) и 3-цианопиридин (98%) (Acros Organics, Бельгия).
3,12-Диoксо-5β-холан-24-овую кислоту (I) получали окислением DCA реагентом Джонса с выходом 95% по известным методикам [10, 11], сигналы спектров 1H- и 13С-ЯМР хорошо согласуются с литературными данными [26].
N'-Гидроксиникотинимидамид получали из 3‑цианопиридина в соответствии с литературной методикой [27] и использовали в синтезе без дополнительной очистки.
N'-(3,12-Диoксо-5β-холан-24-илокси)-никотинимидамид (II). К 3,12-диoксо-5β-холан-24-овой кислоте (I) (4.0 г, 10.3 ммоль) в сухом CH2Cl2 (30 мл) при перемешивании добавляли порциями в течение 15 мин N,N'-карбонилдиимидазол (1.8 г, 11.3 ммоль). Через 2 ч добавляли N'-гидроксиникотинимидамид (1.6 г, 11.3 ммоль) и оставляли перемешиваться при комнатной температуре в течение 12 ч. Ход реакции контролировали ТСХ. Реакционную смесь промывали водой, затем насыщенным раствором NaCl, сушили MgSO4. Растворитель удаляли, масса сырого продукта (II) составила 5.2 г (количественный выход). Имидамид (II) использовали в последующей реакции без дополнительной очистки. Аналитически чистый образец соединения (II) очищали колоночной хроматографией (SiO2, элюент CHCl3 с градиентом MeOH 0–4.0%) в виде бесцветной аморфной массы. Т. пл. 129.8–130.5°С, [$\alpha _{D}^{{23}}$] +63 (c 0.20, CHCl3). 1H-ЯМР (CDCl3, 500 MГц): δ 8.84 (м, 1H, 4J 1.7, H-2′′), 8.61 (м, 1H, 3J 4.8, 4J 1.5, H-6′′), 8.05 (м, 1H, 3J 8.0, 4J 1.8, H-4′′), 7.32 (м, 1H, 3J 8.0, 3J 4.8, H-5′′), 5.42 (ш.с, 2H, NH2), 1.06 (с, 3H, CH3-19), 1.02 (с, 3H, CH3-18), 0.85 (д, 3H, 3J21,20 6.3, CH3-21). Сигналы остальных протонов лежат в области 1.00–2.68 м.д. 13C-ЯМР (CDCl3, 75 MГц): δ 214.5 (c, C-12), 212.4 (c, C-3), 171.5 (c, C-24), 153.9 (c, C-3′), 151.4 (д, C-6′′), 147.3 (д, C-2′′), 134.8 (д, C-4′′), 127.4 (с, C-3′′), 123.4 (д, C-5′′), 58.5, 57.5, 46.2, 44.2, 43.5, 41.9, 38.2, 36.7, 36.6, 35.4, 35.3, 35.2, 30.3, 29.8, 27.3, 26.4, 25.3, 24.1, 21.9 (к, C-19), 18.4 (к, C-21), 11.6 (к, C-18).
3-(Пиридин-3'-ил)-5-(24''-нор-3'',12''-диоксо-5''β-холан-23''ил)-1,2,4-оксадиазол (III). К перемешиваемому раствору имидамида (II) (2.03 г, 4.0 ммоль) в DMSO (20 мл) при 60°С добавляли КОН (0.67 г, 12.0 ммоль). Ход реакции контролировали ТСХ. Реакционную смесь охлаждали до комнатной температуры, добавляли H2O (100 мл) и экстрагировали AcOEt (3 × 70 мл). Объединенные органические вытяжки промывали H2O, насыщенным раствором NaCl, сушили MgSO4. Растворитель удаляли, масса реакционной смеси составляла 1.9 г. Очистку продукта (III) проводили колоночной хроматографией (SiO2, элюент CHCl3 с градиентом MeOH 0–3.0%). Масса 1,2,4-окадиазольного производного (III) составляла 1.14 г (выход 58%, в виде бесцветной прозрачной аморфной массы). Т. пл. 171.2–172.6°С, [$\alpha _{D}^{{20}}$] +73 (c 0.20; CHCl3). HRMS: m/z вычисл. C30H39O3N$_{3}^{ + }$ 489.2986; найдено 489.2985. 1H-ЯМР (CDCl3, 500 MГц): δ 9.26 (м, 1H, 4J 1.7, 5J 0.7, H-2′′), 8.69 (м, 1H, 3J 4.9, 4J 1.6, H-6′′), 8.30 (м, 1H, 3J 8.0, 4J 1.8, H-4′′′), 7.38 (м, 1H, 3J 8.0, 3J 4.8, H-5′′), 3.0 (ддд, 1H, 2J 15.8, J23,22 9.8, J23,22′ 5.3, H-23), 2.89 (ддд, 1H, 2J 15.8, J23′,22′ 9.2, J23′,22 6.8, H-23′), 2.58 (дд, 1H, 2J = = J11a,9a = 12.5, H-11a), 2.54 (дд, 1H, 2J 15.0, J4a,5a 13.3, H-4a), 2.30 (ддд, 1H, 2J = J2a,1a = 14.7, J2a,1e 5.2, H-2a), 1.08 (с, 3H, CH3-19), 1.03 (с, 3H, CH3-18), 0.84 (д, 3H, 3J21,20 6.3, CH3-21). Сигналы остальных протонов лежат в области 1.00–2.68 м.д. 13C-ЯМР (CDCl3, 125 MГц): δ 213.7 (c, C-12), 211.7 (c, C-3), 180.7 (c, C-5′), 166.2 (c, C-3′), 151.8 (д, C-6′′), 148.5 (д, C-2′′), 134.5 (д, C-4′′), 123.4 (д, C-5′′), 123.2 (с, C-3), 58.4, 57.4, 46.3, 44.2, 43.5, 42.0, 38.2, 36.7, 36.6, 35.5, 35.5, 35.3, 32.1, 27.4, 26.5, 25.3, 24.1, 23.8, 22.0 (к, C-19), 18.4 (к, C-21), 11.6 (к, C-18).
Молекулярный докинг. Молекулярное моделирование осуществляли в среде визуализации Schrodinger Maestro с использованием приложений из пакета Schrodinger Small Molecule Drug Discovery Suite 2017-1 [12]. Трехмерные структуры производных получали эмпирически в приложении LigPrep с использованием силового поля OPLS3 [13]. Принимали во внимание все возможные таутомерные формы соединений, а также все ионизированные формы соединений в диапазоне pH 7.0 ± 2.0. Для расчетов применяли модель 5-α-редуктазы (PDB ID 7BW1 [14], разрешение 2.8 Å). Для моделирования возможного механизма связывания с выбранной мишенью выполняли молекулярный докинг соединений в сайт связывания аддукта финастерида и NADP-Н в приложении Glide [28]. Область поиска для расчетной функции докинга выбирали автоматически, исходя из размеров и физико-химических свойств аддукта. Применяли алгоритм повышенной точности докинга XP (extra precision). Докинг проводили в сравнении с аддуктом финастерида и NADP-Н. Его трехмерную структуру получали в базе данных PubChem и подготавливали в приложении LigPrep. Нековалентные взаимодействия соединений в сайте связывания визуализировали с помощью Biovia Discovery Studio Visualizer [29].
Простатопротекторные свойства. Простатопротекторные свойства соединения (III) изучали в двух гормон-зависимых моделях ДГПЖ. В эксперименте использовали самцов крыс линии Wistаr массой 250–350 г (возраст 3.5 мес.), полученных из вивария ФИЦ Института цитологии и генетики СО РАН. Животных содержали в стандартных условиях со свободным доступом к воде и стандартному гранулированному корму, с влажностью и температурным контролем, 12-часовым циклом света и темноты.
Тестостероновая модель ДГПЖ. Животных разделили на четыре группы, по пять крыс в каждой. Крысам контрольной, референсной и опытных групп ежедневно вводили подкожно тестостерона пропионат (Дальхимфарм, Россия) в дозе 20 мг/кг [18]. Через час после инъекции тестостерона крысам опытных групп вводили внутрижелудочно водно-твиновую суспензию соединения (III) в дозе 20 мг/кг, референсной группе – финастерид (Пенестер, Zentiva, Чехия) в дозе 10 мг/кг, контрольной группе – водно-твиновую суспензию. Для приготовления суспензий в воду добавляли 1% твина-80. Доза финастерида выбрана на основе анализа литературных данных [30], а доза исследуемого соединения – исходя из предварительных экспериментов. Интактных животных не подвергали воздействиям. Длительность эксперимента составила 28 сут. Всех животных выводили из эксперимента декапитацией, далее проводили вскрытие животных и забор биологического материала. Ткань простаты подвергали стандартной гистологической обработке и исследовали светооптическим методом. Изменения объемных показателей структурных компонентов ткани предстательной железы количественно оценивали методом морфометрического анализа.
Сульпиридная модель ДГПЖ. Животных разделили на четыре группы, по пять крыс в каждой. Крысам контрольной, референсной и опытной групп ежедневно вводили внутрибрюшинно сульпирид (Санофи, Франция) в дозе 40 мг/кг [19]. Через час после введения сульпирида крысам опытных групп вводили внутрижелудочно водно-твиновую суспензию соединения (III) в дозе 20 мг/кг, референсной группе – финастерид (Пенестер, Zentiva, Чехия) в дозе 10 мг/кг, контрольной группе – водно-твиновую суспензию. Группа интактных животных не подвергалась воздействиям. Длительность эксперимента составила 60 сут. Всех животных выводили из эксперимента, забирали биологический материал и проводили исследования, аналогичные предыдущей модели.
Морфометрический анализ срезов. Анализ проводили при 400× увеличении микроскопа с использованием окулярной сетки на 289 точек. Подсчет объемной плотности (Vv) эпителия, интерстициальной ткани и просвета желез проводили в 25 полях зрения каждого препарата (пять снимков от одного животного). Объемную плотность каждого структурного компонента определяли по его доле по формуле: Vv = x/n, где x – количество точек, приходящихся на определенный структурный компонент; n – общее количество подсчитанных точек [31].
Острая токсичность. Острую токсичность оценивали на мышах-самцах CD-1 массой 20–25 г (возраст 2 мес.), полученных из вивария ФИЦ Института цитологии и генетики СО РАН. Соединения вводили внутрижелудочно через зонд в виде водно-твиновой суспензии в дозах 750 и 1500 мг/кг. В каждой группе было по шесть животных. Наблюдения за животными проводили через 1, 4 и 24 ч в первые сутки, а затем 1 раз в сутки в течение 14 сут с регистрацией количества летальных исходов. Величину среднесмертельной дозы определяли методом пробит-анализа по Литчвилду–Уилкоксону по логарифмической шкале “доза–эффект” [32].
Статистическая обработка данных. Использовали пакет программ Statistica 8.0 (Stat Soft. Inc., США). Для представления количественных показателей в таблицах вычисляли среднее значение и стандартную ошибку среднего. Межгрупповое сравнение данных проводили с помощью U-критерия Манна–Уитни. Различия считали достоверными при р ≤ 0.05.
ЗАКЛЮЧЕНИЕ
В работе представлен синтез нового 1,2,4-оксадиазольного производного дезоксихолевой кислоты, содержащего в 3-м положении гетероцикла мета-пиридиновый фрагмент (III). В эксперименте in silico показан механизм образования связи соединения (III) в сайте связывания с 5-АР по аналогии с аддуктом финастерида и NADP. Установлено, что соединение (III) и финастерид имеют сопоставимые величины показателей энергии связывания (–15.20 и –20.50 ккал/моль соответственно). В экспериментах in vivo на двух моделях ДГПЖ, индуцированных тестостероном и сульпиридом у крыс Wistar, соединение (III) при внутрижелудочном введении в дозе 20 мг/кг проявляло значимый антипролиферативный эффект в железистом эпителии и строме простаты, который по выраженности не уступал эффекту финастерида в эффективной дозе (10 мг/кг). На мышах CD-1 показано, что производное (III) менее токсично (LD50 > 1500 мг/кг), чем финастерид (LD50 = 1060 мг/кг).
Таким образом, новое 1,2,4-оксадиазольное производное дезоксихолевой кислоты можно рассматривать как перспективный агент, простатопротекторный эффект которого при ДГПЖ с высокой вероятностью связан с ингибированием 5-АР.
Список литературы
Launer B.M., McVary K.T., Ricke W.A., Lloyd G.L. // BJU Int. 2021. V. 127. P. 722–728. https://doi.org/10.1111/bju.15286
Lim K.B. // Asian J. Urol. 2017. V. 4. P. 148–151. https://doi.org/10.1016/j.ajur.2017.06.004
Carson C., Rittmaster R. // Urology. 2003. V. 61. P. 2–7. https://doi.org/10.1016/S0090-4295(03)00045-1
Vickman R.E., Franco O.E., Moline D.C., Vander Griend D.J., Thumbikat P., Hayward S.W. // Asian J. Urol. 2020. V. 7. P. 191–202. https://doi.org/10.1016/j.ajur.2019.10.003
La Vignera S., Condorelli R.A., Russo G.I., Morgia G., Calogero A.E. // Andrology. 2016. V. 4. P. 404–411. https://doi.org/10.1111/andr.12186
Thiruchelvam N. // Renal and Urological Surgery III. 2014. V. 32. P. 314–322. https://doi.org/10.1016/j.mpsur.2014.04.006
Gravas S., Cornu J.N., Drake M.J., Gacci M., Gratzke C., Herrmann T.R.W., Madersbacher S., Mamoulakis C., Tikkinen K.A.O. // Eur. Assoc. Urol. 2018. https:// uroweb.org/wp-content/uploads/EAU-Guidelines-on-the-Management-of-Non-neurogenic-Male-LUTS-2018-large-text.pdf
Kim E.H., Brockman J.A., Andriole G.L. // Asian J. Urol. 2018. V. 5. P. 28–32. https://doi.org/10.1016/j.ajur.2017.11.005
Сорокина И.В., Попадюк И.И., Жукова Н.А., Низомов С.А., Мешкова Ю.В., Баев Д.С., Саломатина О.В., Толстикова Т.Г., Салахутдинов Н.Ф. // Патент RU 2 750 488 C1, 2021.
Huang Y., Cui J., Jia L., Gan C., Song H., Zeng C., Zhou A. // Molecules. 2013. V. 18. P. 7436–7447. https://doi.org/10.3390/molecules18077436
Verzele D., Madder A. // J. Org. Chem. 2007. P. 1793–1797. https://doi.org/10.1002/ejoc.200600972
Schrodinger Small Molecule Drug Discovery Suite. 2017. https://www.schrodinger.com
Harder E., Damm W., Maple J., Wu C., Reboul M., Xiang J.Y., Wang L., Lupyan D., Dahlgren M.K., Knight J.L., Kaus J., Cerutti D., Krilov G., Jorgensen W., Abel R., Friecner R. // J. Chem. Theory Comput. 2016. V. 12. P. 281–296. https://doi.org/10.1021/acs.jctc.5b00864
Xiao Q., Wang L., Supekar S., Shen T., Liu H., Ye F., Huang J., Fan H., Wei Z., Zhang C. // Nat. Commun. 2020. V. 11. P. 1–10. https://doi.org/10.1038/S41467-020-19249-Z
Makino C., Watanabe A., Deguchi T., Shiozawa H., Schreck I., Rozehnal V., Ishizuka T., Watanabe N., Ando O., Murayama N., Yamazaki H. // Xenobiotica. 2019. V. 49. P. 961–969. https://doi.org/10.1080/00498254.2018.1514545
Tsalta C.D., Madatian A., Schubert E.M., Xia F., Hardesty W., Deng Y., Seymour J.L., Gorychi P.D. // Drug Metab. Dispos. 2011. V. 39. P. 1620–1632. https://doi.org/10.1124/dmd.110.036467
Makridakis N., Akalu A., Reichardt J.K.V. // Oncogene. 2004. V. 23. P. 7399–7405. https://doi.org/10.1038/sj.onc.1207922
Li J., Tian Y., Guo S., Gu H., Yuan Q., Xie X. // PLoS One. 2018. V. 13. P. 1–13. https://doi.org/10.1371/journal.pone.0191469
Миронов А.Н., Бунятян Н.Д. // Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К., 2012. 944 с.
Altavilla D., Minutoli L., Polito F., Irrera N., Arena S., Magno C., Rinaldi M., Burnett B.P., Squadrito F., Bitto A. // Br. J. Pharmacol. 2012. V. 167. P. 95–108. https://doi.org/10.1111/j.1476-5381.2012.01969.x
Hsu C.Y., Lin Y.S., Weng W.C., Panny L., Chen H.L., Tung M.C., Ou Y.C., Lin C.C., Yang C.H. // Life. 2021. V. 11. P. 743. https://doi.org/10.3390/life11080743
Veeresh Babu S.V., Veeresh B., Patil A.A., Warke Y.B. // Eur. J. Pharmacol. 2010. V. 626. P. 262–265. https://doi.org/10.1016/j.ejphar.2009.09.037
Сорокина И.В., Жукова Н.А., Мешкова Ю.В., Баев Д.С., Толстикова Т.Г., Бакарев М.А., Лушникова Е.Л. // Бюллетень экспериментальной биологии и медицины. 2022. Т. 173. С. 656–663. https://doi.org/10.47056/0365-9615-2022-173-5-656-663
Van Coppenolle F., Slomianny C., Carpentier F., Le Bourhis X., Achidouch A., Croix D., Legrand G., Dewailly E., Fournier S., Cousse H., Authie D., Raynaud J.-P., Beauvillain J.-C., Dupouy J.-P., Prevarskaya N. // Am. J. Physiol. Endocrinol. Metab. 2001. V. 280. P. 120–129. https://doi.org/10.1152/ajpendo.2001.280.1.e120
Тюзиков И.А., Мартов А.Г. // Андрология. 2012. № 3. С. 39–47.
Han Y.T., Yun H. // Org. Prep. Proc. Int. 2017. V. 49. P. 163–168. https://doi.org/10.1080/00304948.2017.1291005
Shruthi N., Poojary B., Kumar V., Hussain M.M., Rai V.M., Pai V.R., Bhat M., Revannasiddappa B.C. // RSC Adv. 2016. V. 6. P. 8303–8316. https://doi.org/10.1039/C5RA23282A
Friesner R.A., Murphy R.B., Repasky M.P., Frye L.L., Greenwood J.R., Halgren T.A., Sanschagrin P.C., Mainz D.T. // J. Med. Chem. 2006. V. 49. P. 6177–6196. https://doi.org/10.1021/jm051256o
Biovia Dicovery Studio Visualizer. 2016. https://discover.3ds.com/discovery-studio-visualizer-download
Jeon W.-Y., Kim O.S., Seo C.-S., Jin S.E., Kim J.-A., Shin H.-K., Kim Y., Lee Y. // BMC Complement. Altern. Med. 2017. V. 17. P. 384. https://doi.org/10.1186/s12906-017-1877-y
Автандилов Г.Г. // Медицинская морфометрия. М.: Медицина, 1990. 384 с.
Саноцкий И.В. // Методы определения токсичности и опасности химических веществ (токсикометрия). Москва: Медицина, 1970. 99 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия