Биоорганическая химия, 2023, T. 49, № 2, стр. 188-206
Дизайн, синтез и изучение анксиолитической активности новых пирроло[1,2-a]пиразин-содержащих лигандов TSPO
Г. В. Мокров 1, *, А. С. Пантилеев 1, М. А. Яркова 1, И. В. Рыбина 1, Т. А. Гудашева 1, Ю. В. Вахитова 1, С. Б. Середенин 1
1 ФГБНУ “НИИ фармакологии имени В.В. Закусова”
125315 Москва, ул. Балтийская, 8, Россия
* E-mail: g.mokrov@gmail.com
Поступила в редакцию 05.10.2022
После доработки 10.10.2022
Принята к публикации 12.10.2022
- EDN: PGKDNM
- DOI: 10.31857/S0132342323020173
Аннотация
Получена новая группа 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов, в которых заместителями при амидном атоме азота выступают алкильные, бензильные или алкоксифенилалкильные группы, остатки аминокислот или их производные. Синтезированные соединения имеют высокие теоретические значения аффинности по отношению к транслокаторному белку 18 кДа (TSPO) и благоприятный профиль ADMET-характеристик, что обусловливает их перспективность для разработки в качестве лекарственных средств. У восьми соединений в дозах 0.1–5.0 мг/кг при внутрибрюшинном введении в условиях эмоционально-стрессового воздействия в тесте “открытое поле” у мышей линии Balb/c и в тесте “приподнятый крестообразный лабиринт” у мышей ICR выявлена анксиолитическая активность. Для дальнейшей разработки в качестве потенциального анксиолитического средства было отобрано соединение-лидер N‑бензгидрил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид, показавший наличие противотревожной активности в широком интервале доз в обоих используемых тестах.
ВВЕДЕНИЕ
Современная стратегия фармакологической регуляции транслокаторного белка 18 кДа (TSPO) рассматривается как научная основа для создания анксиолитиков, обладающих существенным превосходством над бензодиазепинами, действие которых сопровождается седативным влиянием, миорелаксацией и побочными эффектами в виде атаксии, нарушений памяти, синдрома отмены и зависимости [1, 2].
TSPO – белок-переносчик массой 18 кДа с пятью трансмембранными доменами, локализующийся на внешней митохондриальной мембране стероид-продуцирующих клеток нервной системы. Основная функция TSPO – транспорт холестерина на внутреннюю мембрану митохондрий, что обеспечивает биосинтез нейростероидов [3]. Известно, что нейростероиды имеют специфический сайт связывания на ГАМКA-рецепторе [4], взаимодействие с которым увеличивает частоту открытия хлорного канала, что усиливает торможение передачи нервного возбуждения [5]. Установлено, что анксиолитический эффект нейростероидов свободен от нежелательных эффектов бензодиазепинов [6]. Механизм фармакологической регуляции TSPO включает аллостерическую модуляцию белка, приводящую к активации переноса холестерина и усилению биосинтеза нейростероидов [7]. Следовательно, лигандная активация TSPO включает эндогенные физиологические механизмы контроля анксиогенеза.
Недавние обзоры демонстрируют неослабевающий интерес к поиску новых лигандов TSPO в качестве потенциальных нейропсихотропных агентов [1, 8]. В ФГБНУ “НИИ фармакологии им. В.В. Закусова” с 2014 г. проводился синтез новых лигандов TSPO с целью создания препаратов с нейропсихотропной активностью в группах гетероциклических [9, 10] и пептидных соединений [11, 12]. На основе ядра пирроло[1,2-а]пиразина сконструирована группа новых гетероциклических TSPO-лигандов, среди которых получены высокоаффинные и TSPO-селективные соединения. В патенте RU 2572076 С2 описан класс лигандов TSPO, который относится к группе 1‑арилпирроло[1,2-a]пиразин-3-карбоксамидов [13]. Соединения ГМЛ‑1 (N-бензил-N-метил-1-фенилпирроло[1,2-a]-пиразин-3-карбоксамид) и ГМЛ-3 (N‑бутил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид) из этой группы проявили выраженную анксиолитическую активность в стандартных тестах, при этом было доказано, что их эффекты обусловлены взаимодействием с сайтом связывания белка TSPO. Методом радиолигандных исследований установлено, что ГМЛ-1 и ГМЛ-3 обладают высоким сродством к TSPO (Ki = 52 и 530 нM соответственно) [9]. В продолжении фармакологических исследований выявлено, что соединения ГМЛ-1 и ГМЛ-3 обладают антидепрессивной и ноотропной активностью [14], что позволяет рассматривать их как новую группу веществ с оригинальным фармакологическим спектром.
В патенте RU 2734240 С2 представлена группа N,1-дифенилпирроло[1,2-a]пиразин-3-карбоксамидов, в которой также были выявлены соединения, обладающие анксиолитическими свойствами [15]. Наиболее активные соединения ГМЛ-11 (N-бензил-N,1-дифенилпирроло[1,2-a]-пиразин-3-карбоксамид) и ГМЛ-21 (N-метил-N,1-дифенилпирроло[1,2-a]пиразин-3-карбоксамид) обладали анксиолитическим действием в очень низких дозах (0.001–0.1 и 0.05–1.0 мг/кг соответственно).
Цель настоящего исследования – дальнейший поиск соединений с анксиолитической активностью в ряду новых лигандов TSPO с пирроло[1,2-a]пиразиновым ядром, обладающих высоким теоретическим сродством к белку TSPO, высокой эффективностью и безопасностью и имеющих благоприятный профиль расчетных ADMET-параметров.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дизайн новых лигандов TSPO c пирроло[1,2-a]пиразиновым ядром. Для дизайна новых потенциальных лигандов TSPO было осуществлено несколько этапов молекулярного моделирования. На первом этапе была собрана библиотека наиболее перспективных известных лигандов TSPO, обладающих как наилучшими характеристиками связывания с рецептором, так и наиболее привлекательным спектром биологической активности (рис. 1). Среди них производные имидазопиридина YL-IPA08 и СВ-34, бензоксазин Этифоксин, пиридоиндол ONO-2952, производное индола FGIN-1-27, арилоксианилид DAA-1106, производные пирролопиразина GML-1 и GML-3, бензодиазепин Ro5-4864, изохинолин PK-11195 и производные пурина XBD-173 и ZBD-2.
Рис. 1.
Классические синтетические лиганды TSPO с экспериментальными константами ингибирования. Ароматические ядра обведены зелеными окружностями, арильные заместители – синими окружностями, гидрофобные группы – черными пунктирными окружностями, электроноакцепторные группы показаны красными стрелками.

С использованием библиотеки и программного обеспечения Phase (Schrödinger) была сгенерирована уточненная фармакофорная модель лигандов TSPO (рис. 2). Алгоритм программы создает суперпозицию набора пространственных и электронных признаков молекул, включая гидрофобные области и ароматические ядра, доноры и акцепторы водородной связи, анионные и катионные центры и их векторное расположение. Согласно визуализации расчетов, полученная модель имеет следующие компоненты: 1) две ароматические группы, одна из которых, как правило, гетероциклическая (R7 и R8); 2) алифатическую или ароматическую гидрофобную группу (H5); 3) группу акцептора электронов (А1), в большинстве молекул находится между группами H5 и R7/R8.
Рис. 2.
Фармакофорная модель лигандов TSPO, сгенерированная с использованием программы Phase (https://www.schrodinger.com/products/phase). Оранжевые кольца R7 и R8 соответствуют ароматическим/гетероароматическим группам, розовая сфера A1 представляет электроноакцепторную группу, зеленая сфера H5 – алифатическую или ароматическую гидрофобную группу. В качестве примера представлено соответствие фармакофорной модели молекулы этифоксина.

Для скрининга in silico использовали различные производные 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов, содержащие при амидном атоме азота линейные и циклические алкильные, арильные, гетарильные, бензильные или арилалкильные группы с различными заместителями в ароматических кольцах, остатки аминокислот или их производные по карбоксильной группе.
Молекулярный докинг проводили с использованием структуры TSPO мыши в комплексе с селективным лигандом PK-11195 (PDB ID: 2MGY) в программе Glide v8.1 [16]. Параметры ADMET рассчитывали в программе QikProp v6.8 (Schrödinger) [17]. Среди ключевых оценивали следующие характеристики: молекулярный вес, дипольный момент, молекулярный объем, количество доноров и акцепторов водородных связей, ионизационный потенциал, параметры липофильности в различных системах, степень связываемости с белками плазмы крови, параметр проникновения через гематоэнцефалический барьер, аффинность к hERG-инному каналу, уровень проникновения через мембраны, соответствие “правилу 5” Липинского и “правилу 3” Йоргенсена, оральную биодоступность и ряд других. Токсикологические параметры оценивали с использованием программы ADMETlab 2.0 [18]. Рассчитывали токсикологический риск соединений в тесте Эймса, острую токсичность у крыс, канцерогенный потенциал, воспалительные свойства по отношению к различным тканям и ряд других параметров.
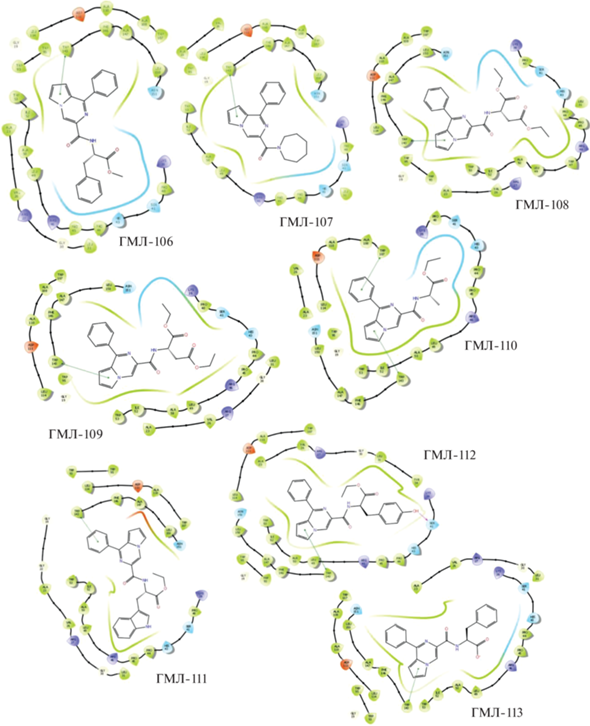
Отобранные по результатам молекулярного моделирования и результатам оценки расчетных параметров наиболее перспективные соединения представлены в табл. 1 и 2. Все эти молекулы продемонстрировали высокую теоретическую аффинность по отношению к активному центру TSPO. Скоринг-функция DS (Docking score), определяющая энергию взаимодействия “лиганд–рецептор”, для всех веществ была ниже значения –8 (табл. 1). Среди ключевых наблюдали следующие взаимодействия “лиганд–рецептор” (табл. 1, рис. 3 и 4): подавляющее большинство соединений имели π–π-стэкинговое взаимодействие пиррольного или фенильного кольца с Trp143 (исключение – ГМЛ-101) и гидрофобное взаимодействие с последовательностью Leu49–Trp53 (исключение – ГМЛ-12). Около половины отобранных соединений имели гидрофобные взаимодействия с последовательностями Trp107–Leu114 и Ser41–Arg46. У ГМЛ-12 и ГМЛ-110 наблюдали π–π-стэкинговое взаимодействие с Trp107. У ГМЛ-101 фиксировали π-катионное взаимодействие фенильной группы с His43, а у ГМЛ-103 – дополнительное π–π-стэкинговое взаимодействие с Phe146. У диметоксипроизводного ГМЛ-104 наблюдалось π-катионное взаимодействие арильного цикла с His43, π–π-стэкинг фенильной группы с Trp95 и водородная связь атома кислорода метоксигруппы с Lys39. Среди дополнительных взаимодействий соединений ГМЛ-106 и ГМЛ-110 фиксировалось полярное взаимодействие с последовательностью Lys39–Arg46. Наконец, у тирозин-содержащего соединения ГМЛ-112 была выявлена водородная связь гидроксигруппы с Ser41.
Таблица 1.
Результаты расчетов теоретических значений аффинности новых потенциальных лигандов TSPO ряда пирроло[1,2-a]пиразинов
| Соединение | Амидный заместитель | Эфир | Docking score | π–π-стэкинг с Trp107 | π–π-стэкинг с Trp143 | Гидрофобные взаимодействия | Дополнительные взаимодействия | ||
|---|---|---|---|---|---|---|---|---|---|
| Leu49–Trp53 | Trp107–Leu114 | Ser41–Arg46 | |||||||
| ГМЛ-12 | Pr, Pr | – | –8.999 | + | + | – | + | + | |
| ГМЛ-101 | Et, Bz | – | –10.144 | – | – | + | + | + | “π-катион” с His43 |
| ГМЛ-102 | CHPh2 | – | –9.551 | – | + | + | + | + | |
| ГМЛ-103 | Bz, Bz | – | –9.278 | – | + | + | + | – | “π–π” с Phe146 |
| ГМЛ-104 | (CH2)2Ph(OMe)2-3,4 | – | –9.404 | – | + | + | – | + | “π-катион” с His43; “π–π” с Trp95; Н-связь с Lys39 |
| ГМЛ-105 | CH2Ph(OMe)3-3,4,5 | – | –9.391 | – | + | + | – | + | |
| ГМЛ-106 | L-Phe | Me | –10.208 | – | + | + | – | – | Полярное взаимодействие с Lys39–Arg46 |
| ГМЛ-107 | –(СН2)7– | – | –9.193 | – | + | + | – | – | |
| ГМЛ-108 | L-Glu | Et | –9.125 | – | + | + | – | – | |
| ГМЛ-109 | L-Asp | Et | –9.603 | – | + | + | – | – | |
| ГМЛ-110 | L-Ala | Me | –8.726 | + | + | + | – | – | Полярное взаимодействие с Lys39–Arg46 |
| ГМЛ-111 | L-Trp | Et | –8.083 | – | + | + | + | – | |
| ГМЛ-112 | D-Tyr | Et | –10.119 | – | + | + | – | – | Н-связь с Ser41 |
| ГМЛ-113 | L-Phe | – | –10.095 | – | + | + | + | – | |
Таблица 2.
Результаты расчетов параметров ADMET новых потенциальных лигандов TSPO ряда пирроло[1,2-a]пиразинов
| Соедине-ние | Амидный заместитель | Эфир | Молеку- лярный вес | Дипольный момент | LogP | LogBB | “Правило 5” Липинского | “Правило 3” Йоргенсена | Оральная доступность, % | Тест Эймса | Острая токсичность у крыс |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ГМЛ-12 | Pr, Pr | – | 321.421 | 5.218 | 4.826 | –0.223 | 0 | 0 | 100 | – – – | – – – |
| ГМЛ-101 | Et, Bz | – | 355.438 | 4.266 | 5.433 | –0.045 | 1 | 1 | 100 | – – – | – – – |
| ГМЛ-102 | CHPh2 | – | 403.482 | 5.183 | 6.506 | –0.209 | 1 | 1 | 100 | – – – | – – – |
| ГМЛ-103 | Bz, Bz | – | 417.509 | 4.066 | 5.993 | –0.112 | 1 | 0 | 100 | – – – | – – – |
| ГМЛ-104 | (CH2)2Ph(OMe)2-3,4 | – | 401.464 | 6.692 | 5.032 | –0.222 | 1 | 0 | 100 | + | – – – |
| ГМЛ-105 | CH2Ph(OMe)3-3,4,5 | – | 417.463 | 6.112 | 4.786 | –0.335 | 0 | 0 | 100 | – – | – – – |
| ГМЛ-106 | L-Phe | Me | 399.448 | 6.215 | 5.163 | –0.676 | 1 | 1 | 100 | – – | – – – |
| ГМЛ-107 | –(СН2)7– | – | 319.405 | 4.690 | 4.398 | 0.096 | 0 | 0 | 100 | – – – | – – – |
| ГМЛ-108 | L-Glu | Et | 423.468 | 5.230 | 4.310 | –1.027 | 0 | 0 | 100 | – – – | – – – |
| ГМЛ-109 | L-Asp | Et | 409.441 | 7.367 | 4.001 | –1.325 | 0 | 0 | 100 | – – – | – – – |
| ГМЛ-110 | L-Ala | Me | 323.351 | 4.478 | 3.689 | –0.751 | 0 | 0 | 100 | – – – | – – – |
| ГМЛ-111 | L-Trp | Et | 452.512 | 8.433 | 5.743 | –0.954 | 1 | 1 | 100 | – – | – – – |
| ГМЛ-112 | D-Tyr | Et | 429.474 | 4.216 | 4.874 | –1.240 | 0 | 1 | 100 | – – – | – – – |
| ГМЛ-113 | L-Phe | – | 385.421 | 6.838 | 5.126 | –1.043 | 1 | 1 | 84 | – – – | – – – |
Примечание: LogP – показатель липофильности на разделе фаз октанол/вода; LogBB – уровень проникновения веществ через гематоэнцефалический барьер. По данным теста Эймса и острой токсичности у крыс указан эффект исследуемых соединений: наличие эффекта (+), отсутствие эффекта (– –), однозначное отсутствие эффекта (– – –).
Рис. 3.
Результаты молекулярного докинга новых производных 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов (ГМЛ-12, ГМЛ-101–ГМЛ-105) в активный сайт рецептора TSPO (PDB ID: 2MGY) в 2D-проекции.

Рис. 4.
Результаты молекулярного докинга новых производных 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов (ГМЛ-106–ГМЛ-112) в активный сайт рецептора TSPO (PDB ID: 2MGY) в 2D-проекции.
Результаты оценки основных ADMET-параметров отобранных соединений представлены в табл. 2. Значения молекулярного веса находились для всех соединений в пределах 319–452 г/моль, что попадает в интервал 130–725 г/моль, соответствующий 95% известных лекарственных препаратов. Дипольные моменты соединений составляли 4.1–8.4, что вписывается в рекомендуемые параметры для потенциальных лекарственных средств (1.0–12.5). Липофильность соединений оценивали путем расчета прежде всего параметра Log P (липофильность на разделе фаз октанол/вода). Известно, что лиганды TSPO, как правило, обладают достаточно высокими значениями липофильности (Log P не менее 3.5). Расчетные значения гидрофобности (Log P) новых соединений находились в диапазоне 3.7–6.5. Следует отметить, что высокий коэффициент липофильности необходим для образования устойчивой π–π-связи с остатками триптофана белка. Уровень проникновения соединений через гематоэнцефалический барьер (Log BB) также находился в рекомендуемых пределах от –3.0 до –1.2. Все новые соединения соответствовали правилам Липинского и Йоргенсена, определяющим необходимые требования к строению перорально активных лекарственных средств (расчетные значения для соединений не должны превышать 4 и 3 баллов соответственно). Оральная биодоступность новых соединений была максимально высокой (100% для всех соединений), за исключением соединения ГМЛ-113 (84%). Расчетные параметры токсичности отобранных молекул свидетельствуют об их перспективности для разработки в качестве потенциальных лекарственных соединений. Все они по данным теста Эймса (за исключением соединения ГМЛ-104) и по расчетам острой токсичности у крыс при пероральном введении показали полное отсутствие этих видов токсичности (значения “– – –“ и “– –”).
Синтез 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов. Сконструированные соединения общей формулы (I) были получены в соответствии со схемой 1 .
Схема 1 . Синтез 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов.
Исходную 1-фенилпирроло[1,2-a]пиразин-3-карбоновую кислоту (II) получали в соответствии со схемой, представленной в патенте RU 2572076 С2 [13]. Эту кислоту (II) вводили во взаимодействие с аминами (III) в хлористом метилене в присутствии конденсирующих агентов – 1‑гидроксибензотриазола и 1,3-дициклогексилкарбодиимида, в результате чего были получены целевые 1-фенилпирроло[1,2-a]пиразин-3-карбоксамиды (I). Структуры синтезированных соединений общей формулы (I) представлены на рис. 3 и 4, а заместители при амидной группе указаны в табл. 1 и 2.
Строение соединений общей формулы (I) подтверждено данными спектров 1Н-ЯМР, а их чистота – данными элементного анализа.
Влияние новых соединений на поведение мышей линии Balb/c в условиях эмоционально-стрессового воздействия в тесте “открытое поле”. В работе применена методика освещенного “открытого поля” (ОП), при котором перенос животного из темноты на ярко подсвеченную арену, помимо реакции на новую обстановку, включает дополнительный стрессирующий фактор, основанный на естественном стремлении грызунов избегать ярко освещенных мест [19]. В качестве тест-системы были использованы мыши инбредной линии Balb/c, характеризующейся реакцией замирания в тесте ОП использованной модификации [20]. О наличии анксиолитического действия судили по выявлению активирующего влияния на двигательную активность у животных с реакцией замирания.
В тесте ОП анализировали активность следующих соединений: ГМЛ‑12, ГМЛ‑101–ГМЛ-106 (табл. 3).
Таблица 3.
Влияние соединений ГМЛ‑12 и ГМЛ‑101–ГМЛ-106 на поведение мышей линии Balb/c в тесте “открытое поле”
| Соединение | Доза, мг/кг | ПА | ЦА | Ц | ВА | ОДА | Д |
|---|---|---|---|---|---|---|---|
| Контроль для ГМЛ-12 | – | 11.27 (6.86) | 2.00 (2.65) | 0.00 (0.00) | 0.00 (0.00) | 13.27 (9.16) | 1.64 (1.50) |
| ГМЛ-12 | 0.1 | 22.88 (14.78)* | 2.25 (1.58) | 0.00 (0.00) | 0.00 (0.00) | 25.13 (13.76)* | 2.00 (0.76) |
| 0.5 | 20.38 (5.55)* | 2.00 (1.69) | 0.00 (0.00) | 0.00 (0.00) | 22.38 (6.19)* | 2.38 (2.67) | |
| 1.0 | 34.38 (12.09)* | 10.38 (7.48)* | 0.00 (0.00) | 0.00 (0.00) | 44.75 (15.82)* | 1.63 (1.51) | |
| 5.0 | 20.00 (10.85) | 1.88 (2.42) | 0.00 (0.00) | 0.00 (0.00) | 21.88 (10.16) | 1.75 (1.39) | |
| p (ANOVA) | 0.029 | 0.021 | 1 | 1 | 0.002 | 0.854 | |
| Контроль для ГМЛ‑101–ГМЛ-106 | – | 22.00 (9.40) | 2.13 (2.36) | 0.00 (0.00) | 0.00 (0.00) | 24.13 (10.97) | 0.63 (0.74) |
| ГМЛ-101 | 0.1 | 34.38 (19.99) | 3.88 (2.42) | 0.00 (0.00) | 0.88 (1.36) | 39.13 (21.05) | 1.00 (1.31) |
| 0.5 | 31.88 (20.79) | 3.25 (4.59) | 0.13 (0.35) | 0.13 (0.35) | 35.38 (21.86) | 0.50 (0.76) | |
| 1.0 | 58.88 (14.63)* | 0.13 (0.35) | 0.00 (0.00) | 0.00 (0.00) | 59.00 (14.62)* | 0.63 (0.74) | |
| 5.0 | 34.75 (27.76) | 3.25 (9.19) | 0.50 (1.41) | 0.00 (0.00) | 38.50 (25.07) | 0.25 (0.46) | |
| p (ANOVA) | 0.0212 | 0.0123 | 0.5445 | 0.0091 | 0.0232 | 0.7131 | |
| ГМЛ-102 | 0.1 | 41.63 (10.34)* | 4.38 (3.66) | 0.00 (0.00) | 0.00 (0.00) | 46.00 (13.69)* | 1.25 (1.04) |
| 0.5 | 48.88 (10.83)* | 10.25 (10.53)* | 1.00 (2.07) | 0.38 (0.52) | 60.50 (15.01)* | 1.00 (1.07) | |
| 1.0 | 49.00 (12.33)* | 7.38 (6.72) | 0.13 (0.35) | 1.25 (2.38) | 57.75 (16.27)* | 1.00 (1.07) | |
| 5.0 | 27.00 (9.02) | 1.13 (2.10) | 0.00 (0.00) | 0.13 (0.35) | 28.25 (9.92) | 1.25 (1.04) | |
| p (ANOVA) | 0.0001 | 0.0062 | 0.0535 | 0.0366 | 0 | 0.6953 | |
| ГМЛ-103 | 0.1 | 21.25 (12.52) | 0.13 (0.35) | 0.00 (0.00) | 0.00 (0.00) | 21.38 (12.77) | 0.88 (1.13) |
| 0.5 | 21.00 (8.64) | 0.13 (0.35) | 0.00 (0.00) | 0.00 (0.00) | 21.13 (8.68) | 0.50 (0.76) | |
| 1.0 | 20.63 (7.95) | 0.13 (0.35) | 0.00 (0.00) | 0.00 (0.00) | 20.75 (7.92) | 0.88 (0.99) | |
| 5.0 | 19.50 (7.58) | 0.25 (0.46) | 0.25 (0.46) | 0.00 (0.00) | 20.00 (8.04) | 0.50 (0.76) | |
| p (ANOVA) | 0.9945 | 0.0383 | 0.0842 | 1 | 0.9658 | 0.8721 | |
| ГМЛ-104 | 0.1 | 27.13 (9.51) | 4.75 (3.15) | 0.00 (0.00) | 0.00 (0.00) | 31.88 (8.17) | 1.50 (1.07) |
| 0.5 | 29.75 (11.89) | 3.13 (4.19) | 0.38 (1.06) | 0.50 (1.07) | 33.75 (16.39) | 1.13 (1.13) | |
| 1.0 | 25.25 (10.02) | 6.25 (9.32) | 0.63 (1.19) | 0.00 (0.00) | 32.13 (18.51) | 0.75 (0.89) | |
| 5.0 | 29.88 (21.80) | 3.63 (8.67) | 0.00 (0.00) | 1.13 (3.18) | 34.63 (33.36) | 1.00 (1.20) | |
| p (ANOVA) | 0.7003 | 0.3697 | 0.2372 | 0.2446 | 0.5328 | 0.502 | |
| ГМЛ-105 | 0.1 | 32.88 (13.28) | 3.13 (3.87) | 0.00 (0.00) | 0.00 (0.00) | 36.00 (15.24) | 1.38 (1.41) |
| 0.5 | 38.88 (21.92) | 0.38 (0.74) | 0.00 (0.00) | 0.25 (0.46) | 39.50 (22.54) | 2.50 (1.20)* | |
| 1.0 | 32.63 (14.93) | 2.25 (3.81) | 0.25 (0.71) | 0.00 (0.00) | 35.13 (13.05) | 1.88 (1.96) | |
| 5.0 | 23.25 (7.63) | 0.50 (0.53) | 0.00 (0.00) | 0.00 (0.00) | 23.75 (7.54) | 1.88 (1.96) | |
| p (ANOVA) | 0.1779 | 0.1343 | 0.406 | 0.0842 | 0.1608 | 0.082 | |
| ГМЛ-106 | 0.1 | 21.13 (11.01) | 0.25 (0.46) | 0.00 (0.00) | 0.00 (0.00) | 21.38 (10.76) | 1.00 (1.07) |
| 0.5 | 27.50 (7.63) | 7.63 (9.46) | 0.63 (1.06) | 0.00 (0.00) | 35.75 (14.75) | 0.88 (0.83) | |
| 1.0 | 36.00 (10.61)* | 4.13 (3.44) | 0.25 (0.46) | 0.00 (0.71) | 40.63 (13.76)* | 2.13 (1.81) | |
| 5.0 | 39.00 (6.91)* | 9.13 (11.80) | 0.75 (1.49) | 0.00 (0.00) | 48.88 (13.21)* | 1.63 (1.41) | |
| p (ANOVA) | 0.0041 | 0.0472 | 0.2 | 0.406 | 0.0024 | 0.2645 |
Примечание: данные представлены в виде M (SD), где М – среднее арифметическое, SD – стандартное отклонение. p (ANOVA) – p-значение по результатам теста Краскела–Уоллеса. Сокращения: ПА – число пересеченных квадратов на периферии, ЦА – число пересеченных квадратов в центральных областях, Ц – число заходов в центр, ВА – число вертикальных стоек, ОДА – общая двигательная активность, Д – количество дефекаций. * Статистически значимые различия (p < 0.05) по сравнению с контрольной группой согласно критерию Манна–Уитни.
В условиях эмоционально-стрессового воздействия в тесте ОП при внутрибрюшинном введении соединений ГМЛ-12 (0.1, 0.5 и 1.0 мг/кг), ГМЛ-101 (1.0 мг/кг), ГМЛ-102 (0.1, 0.5 и 1.0 мг/кг) и ГМЛ-106 (1.0 и 5.0 мг/кг) обнаружено статистически значимое повышение общей двигательной активности мышей линии Balb/c по сравнению с контролем, обусловленное, прежде всего, повышением периферической активности и, в некоторых случаях, центральной активности. У соединения ГМЛ-103 в дозах 0.1–5.0 мг/кг статистически значимых изменений двигательной активности не выявлено. В то же время у соединений ГМЛ-101 в дозах 0.1–0.5 и 5.0 мг/кг, ГМЛ-102 в дозе 5.0 мг/кг, ГМЛ‑104 (0.1–5.0 мг/кг) и ГМЛ-105 (0.1–1.0 мг/кг) наблюдалась тенденция к увеличению активности.
Таким образом, в ряду изученных потенциальных TSPO-лигандов соединения ГМЛ-12 и ГМЛ-102 в широком диапазоне доз (0.1–1.0 мг/кг) при внутрибрюшинном введении обладают выраженным активирующим действием у мышей Balb/с за счет увеличения периферической и центральной двигательной активности, что характерно для соединений, обладающих анксиолитическим действием. Соединение ГМЛ-101 также проявляло значимую активность в дозе 1.0 мг/кг, а соединение ГМЛ-106 – в дозах 1.0–5.0 мг/кг.
На основании полученных данных в качестве соединения-лидера было отобрано соединение ГМЛ-102, которое дополнительно было исследовано в тесте “приподнятый крестообразный лабиринт” (ПКЛ).
Влияние новых соединений на поведение мышей ICR в тесте “приподнятый крестообразный лабиринт”. В тесте ПКЛ были исследованы следующие соединения: ГМЛ-107–ГМЛ-113 и ГМЛ-102 (табл. 4). Оценку поведения мышей в тесте ПКЛ проводили согласно методике Pellow et al. [21]. Установлено, что в тесте ПКЛ соединение ГМЛ-107 в дозе 0.1 мг/кг при внутрибрюшинном введении статистически значимо увеличивала время пребывания мышей ICR в открытых рукавах лабиринта, время (%) пребывания в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах (Тоткр/Тобщ) и число (%) заходов в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта (Nоткр/Nобщ) по сравнению с контрольной группой, что рассматривается как основной критерий анксиолитической активности. Тенденция к увеличению параметров Тоткр/Тобщ и Nоткр/Nобщ наблюдалась для соединения ГМЛ-107 в дозах 0.5–5.0 мг/кг. Соединение ГМЛ-113 также обладало эффектом в дозах 0.5–5.0 мг/кг, достоверно увеличивая значения обоих параметров Тоткр/Тобщ и Nоткр/Nобщ. Бензгидрильное производное ГМЛ-102, наиболее активное в тесте ОП, было эффективным и в тесте ПКЛ по параметрам Тоткр/Тобщ и Nоткр/Nобщ во всех исследуемых дозах (0.1–5.0 мг/кг).
Таблица 4.
Влияние соединений ГМЛ-102 и ГМЛ-107–ГМЛ-113 на поведение аутбредных мышей ICR в тесте “приподнятый крестообразный лабиринт”
| Соединение | Доза, мг/кг | Время в открытых рукавах, с | Время в закрытых рукавах, с | Число заходов в открытые рукава | Число заходов в закрытые рукава | Tоткр/ (Tоткр + Tзакр), % | Nоткр/ (Nоткр + Nзакр), % |
|---|---|---|---|---|---|---|---|
| Контроль для ГМЛ-107–ГМЛ-112 | – | 23 (4; 33) | 72 (68; 83) | 4 (1; 5) | 10 (8; 12) | 22 (4; 33) | 28 (5; 35) |
| ГМЛ-107 | 0.1 | 46 (29; 55)* | 81 (58; 86) | 4 (3; 8) | 7 (7; 10) | 37 (28; 44)* | 36 (32; 43)* |
| 0.5 | 19 (0; 31) | 48 (19; 85) | 4 (0; 7) | 7 (4; 10)* | 17 (2; 38) | 33 (6; 41) | |
| 1.0 | 46 (2; 53) | 47 (33; 90) | 7 (0; 11) | 9 (8; 10) | 41 (8; 51) | 42 (10; 57) | |
| 5.0 | 13 (7; 21) | 60 (25; 66)* | 3 (2; 5) | 9 (4; 11) | 23 (11; 41) | 34 (16; 42) | |
| p (ANOVA) | 0.0482 | 0.1797 | 0.5636 | 0.2152 | 0.1019 | 0.1974 | |
| ГМЛ-108 | 0.1 | 4 (0; 9) | 99 (52; 135) | 1 (0; 2) | 12 (8; 14) | 4 (0; 14) | 10 (0; 14) |
| 0.5 | 10 (1; 28) | 86 (72; 111) | 2 (0; 5) | 12 (8; 14) | 10 (1; 24) | 22 (3; 29) | |
| 1.0 | 10 (1; 29) | 84 (62; 108) | 2 (0; 5) | 10 (8; 11) | 10 (1; 23) | 18 (2; 34) | |
| 5.0 | 17 (4; 31) | 98 (82; 137)* | 2 (0; 4) | 10 (8; 12) | 19 (3; 24) | 18 (2; 27) | |
| p (ANOVA) | 0.6052 | 0.3363 | 0.7266 | 0.779 | 0.4242 | 0.3671 | |
| ГМЛ-109 | 0.1 | 6 (1; 31) | 56 (45; 68)* | 2 (0; 4) | 8 (6; 10) | 10 (2; 22) | 19 (3; 37) |
| 0.5 | 0 (0; 9) | 73 (32; 105) | 0 (0; 3) | 11 (6; 14) | 0 (0; 18) | 0 (0; 27) | |
| 1.0 | 0 (0; 5)* | 97 (71; 125) | 0 (0; 1)* | 11 (8; 13) | 0 (0; 5)* | 0 (0; 13)* | |
| 5.0 | 39 (2; 75) | 70 (47; 91) | 4 (1; 9) | 9 (5; 11) | 35 (2; 44) | 33 (4; 52) | |
| p (ANOVA) | 0.0363 | 0.0896 | 0.0646 | 0.3588 | 0.0341 | 0.0648 | |
| ГМЛ-110 | 0.1 | 6 (0; 31) | 74 (46; 111) | 2 (0; 5) | 9 (6; 10) | 8 (0; 21) | 15 (0; 35) |
| 0.5 | 5 (0; 35) | 95 (44; 109) | 1 (0; 5) | 13 (3; 15) | 11 (0; 33) | 14 (0; 33) | |
| 1.0 | 3 (0; 11) | 47 (2; 91) | 1 (0; 3) | 5 (1; 11) | 4 (0; 24) | 9 (0; 39) | |
| 5.0 | 5 (0; 27) | 90 (78; 100) | 2 (0; 3) | 9 (8; 12) | 6 (0; 23) | 12 (3; 30) | |
| p (ANOVA) | 0.7439 | 0.2865 | 0.8068 | 0.236 | 0.7638 | 0.8965 | |
| ГМЛ-111 | 0.1 | 0 (0; 3) | 45 (25; 61)** | 0 (0; 1)* | 6 (4; 8)** | 0 (0; 5) | 0 (0; 11) |
| 0.5 | 0 (0; 8)* | 85 (50; 98) | 0 (0; 1)* | 10 (6; 11) | 0 (0; 7)* | 0 (0; 10)* | |
| 1.0 | 9 (0; 44) | 85 (67; 98) | 3 (0; 6) | 12 (8; 15) | 10 (0; 32) | 24 (0; 29) | |
| 5.0 | 10 (0; 50) | 86 (59; 113) | 2 (0; 7) | 11 (7; 14) | 8 (0; 44) | 14 (2; 44) | |
| p (ANOVA) | 0.0969 | 0.0291 | 0.0803 | 0.0241 | 0.1029 | 0.0864 | |
| ГМЛ-112 | 0.1 | 3 (0; 13) | 71 (39; 101) | 1 (0; 2) | 8 (7; 9) | 2 (0; 14) | 5 (0; 17) |
| 0.5 | 13 (7; 37) | 80 (63; 91) | 3 (1; 6) | 10 (8; 12) | 16 (8; 31) | 19 (6; 37) | |
| 1.0 | 0 (0; 2)* | 53 (33; 80) | 0 (0; 1)* | 7 (3; 8)** | 0 (0; 3)* | 0 (0; 13)* | |
| 5.0 | 0 (0; 5) | 55 (25; 98) | 0 (0; 2) | 6 (3; 13) | 0 (0; 7) | 0 (0; 15) | |
| p (ANOVA) | 0.0225 | 0.3859 | 0.0582 | 0.0126 | 0.0261 | 0.0961 | |
| Контроль для ГМЛ-102 и ГМЛ-113 | – | 1 (0; 6) | 166 (145; 172) | 0.5 (0; 1) | 11 (9.5; 15) | 0.7 (0; 3.7) | 4.6 (0; 10) |
| ГМЛ-102 | 0.1 | 48 (31; 57)* | 164 (159; 176) | 4 (2; 6)* | 10 (8; 12) | 22 (16; 26)* | 23 (18; 42)* |
| 0.5 | 21 (18; 34)* | 163 (155; 173) | 3 (2; 4)* | 10 (9; 11) | 11 (10; 17)* | 21 (16; 28)* | |
| 1.0 | 50 (37; 60)* | 165 (156; 171) | 4 (3; 6)* | 10 (9; 11) | 24 (18; 26)* | 30 (20; 35)* | |
| 5.0 | 18 (14; 30)* | 166 (152; 173) | 3 (2; 4)* | 9 (8; 11)* | 10 (8; 15)* | 23 (19; 32)* | |
| p (ANOVA) | 0 | 0.9561 | 0.0009 | 0.3831 | 0.0001 | 0.002 | |
| ГМЛ-113 | 0.1 | 0 (0; 2) | 186 (171; 197)* | 0 (0; 0.5) | 12 (11; 14) | 0 (0; 0.8) | 0 (0; 4) |
| 0.5 | 10 (5; 20)* | 162 (138; 183) | 2 (1; 4)* | 12 (10; 12) | 5 (3; 10)* | 15 (9; 24)* | |
| 1.0 | 43 (27; 89)* | 134 (108; 141)* | 4 (3; 5)* | 12 (10; 13) | 24 (15; 48)* | 24 (18; 36)* | |
| 5.0 | 49 (33; 63)* | 146 (123; 163) | 4 (3; 6)* | 12 (9; 14) | 24 (17; 32)* | 28 (15; 37)* | |
| p (ANOVA) | 0 | 0.0021 | 0.0001 | 0.8405 | 0 | 0.0002 |
Примечания: данные представлены в виде Me (q25; q75), где Me – медиана, q25 – нижний квартиль, q75 – верхний квартиль. p (ANOVA) – p-значение согласно критерию Краскела–Уоллиса; Tоткр и Tзакр – время пребывания в открытых и закрытых рукавах; Nоткр и Nзакр – число заходов в открытые и закрытые рукава лабиринта. * p < 0.05 (достоверные различия с контролем согласно критерию Манна–Уитни). ** р < 0.01 (достоверные различия с контролем согласно критерию Манна–Уитни).
Соединения ГМЛ-108 и ГМЛ-110 ни в одной из изученных доз не влияли на поведение аутбредных мышей ICR в тесте ПКЛ, за исключением того, что в дозе 5.0 мг/кг ГМЛ-108 увеличивало время пребывания мышей в закрытых рукавах лабиринта.
Соединения ГМЛ-109 и ГМЛ-112 в дозе 1.0 мг/кг и соединение ГМЛ-111 в дозе 0.5 мг/кг статистически значимо по сравнению с контрольной группой уменьшали время пребывания мышей ICR в открытых рукавах лабиринта, число заходов в открытые рукава, время (%) пребывания в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах (Тоткр/Тобщ) и число (%) заходов в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта (Nоткр/Nобщ). Снижение двигательной и исследовательской активности мышей в тесте ПКЛ на фоне применения указанных соединений может свидетельствовать о наличии в спектре их фармакологической активности седативного или анксиогенного компонента, что необходимо исследовать с использованием соответствующих методов анализа поведения. Результаты настоящей работы определяют перспективу дальнейшего развернутого фармакологического изучения полученных новых оригинальных соединений.
Анализ связи “структура–активность”. В табл. 5 приведено соотнесение результатов оценки анксиолитической активности новых соединений in vivo с основными расчетными параметрами: Docking score (характеристика энергии связывания “лиганд–рецептор” в молекулярном докинге), липофильностью (Log P), общей оценкой ADMET-профиля и показателем проникновения через гематоэнцефалический барьер (Log BB).
Таблица 5.
Соотнесение расчетных характеристик с результатами оценки анксиолитической активности исследованных соединений in vivo
| Соединение | Амидный заместитель | Эфир | Docking score | LogP | Профиль ADMET | LogBB | Активные дозы в тестах ОП и ПКЛ, мг/кг | Выраженность эффекта |
|---|---|---|---|---|---|---|---|---|
| ГМЛ-12 | Pr, Pr | – | –8.999 | 4.826 | + | –0.223 | 0.1–1.0 (ОП) | ++ |
| ГМЛ-101 | Et, Bz | – | –10.144 | 5.433 | + | –0.045 | 1.0 (ОП); т.: 0.1–0.5 и 5.0 (ОП) | + |
| ГМЛ-102 | CHPh2 | – | –9.551 | 6.506 | + | –0.209 | 0.1–1.0 (ОП); 0.1–5.0 (ПКЛ) | ++++ |
| ГМЛ-103 | Bz, Bz | – | –9.278 | 5.993 | + | –0.112 | – (ОП) | 0 |
| ГМЛ-104 | (CH2)2Ph(OMe)2-3,4 | – | –9.404 | 5.032 | + | –0.222 | т.: 0.1–5.0 (ОП) | т.+ |
| ГМЛ-105 | CH2Ph(OMe)3-3,4,5 | – | –9.391 | 4.786 | + | –0.335 | т.: 0.1–1.0 (ОП) | т.+ |
| ГМЛ-106 | L-Phe | Me | –10.208 | 5.163 | + | –0.676 | 1.0–5.0 (ОП) | ++ |
| ГМЛ-107 | –(СН2)7– | – | –9.193 | 4.398 | + | 0.096 | 0.1 (ПКЛ); т.: 0.5–5.0 (ПКЛ) | + |
| ГМЛ-108 | L-Glu | Et | –9.125 | 4.310 | + | –1.027 | – (ПКЛ) | 0 |
| ГМЛ-109 | L-Asp | Et | –9.603 | 4.001 | + | –1.325 | [1.0] (ПКЛ) | – |
| ГМЛ-110 | L-Ala | Me | –8.726 | 3.689 | + | –0.751 | – (ПКЛ) | 0 |
| ГМЛ-111 | L-Trp | Et | –8.083 | 5.743 | + | –0.954 | [0.5] (ПКЛ) | – |
| ГМЛ-112 | D-Tyr | Et | –10.119 | 4.874 | + | –1.240 | [1.0] (ПКЛ) | – |
| ГМЛ-113 | L-Phe | – | –10.095 | 5.126 | + | –1.043 | 0.5–5.0 (ПКЛ) | ++ |
Примечания: Docking score – характеристика энергии связывания “лиганд–рецептор” в молекулярном докинге; LogP – показатель липофильности на разделе фаз октанол/вода; LogBB – величина, характеризующая способность вещества проникать через ГЭБ; ОП – тест “открытое поле”; ПКЛ – тест “приподнятый крестообразный лабиринт”. В квадратных скобках приведена доза, проявлявшая обратную активность. Указана выраженность эффекта соединений: тенденция (т.), активность в одной дозе (+), активность в нескольких дозах (++), активность в нескольких дозах в двух тестах (++++), обратная активность (–), отсутствие эффекта (0).
Хотя полной корреляции между перечисленными параметрами по результатам исследования не наблюдалось, отмечаются определенные закономерности по взаимосвязи биологической активности in vivo с расчетными показателями. Так, в частности, соединения, показавшие наличие анксиолитической активности, обладали в целом более высокими значениями Docking score (DS). Cреднее значение DS составляет –9.62 для активных соединений (ГМЛ-12, ГМЛ-101, ГМЛ-102, ГМЛ-104–ГМЛ-107, ГМЛ-113) и –9.15 для неактивных соединений (ГМЛ-103 и ГМЛ-108–ГМЛ-112). Сходная зависимость наблюдается для показателя липофильности (LogP). Среднее значение LogP в ряду активных соединений составляло 5.16, в то время как для соединений, не показавших положительного эффекта, LogP составляло 4.77. Среди ADMET-показателей особую значимость в отношении наличия положительного эффекта in vivo показал параметр Log BB, характеризующий способность соединения проникать через гематоэнцефалический барьер. Установлено, что у соединений, проявивших анксиолитическое действие, среднее значение Log BB составило –0.33. У неактивных молекул среднее LogBB составляет ‒0.90, т.е. их способность проникать через гематоэнцефалический барьер существенно ниже. При исключении из расчетов соединений ГМЛ-103 и ГМЛ-113, выбивающихся из общей закономерности, различие в средних значениях LogBB для активных и неактивных соединений еще более выраженное (–0.23 против –1.06). Эти результаты хорошо согласуются с тем фактом, что для достижения положительного анксиолитического действия соединение должно иметь способность в достаточной степени проникать через гематоэнцефалический барьер.
Лучшие результаты по биологической активности продемонстрировало бензгидрильное производное ГМЛ-102, показавшее наличие анксиолитического действия в широком интервале доз в обоих используемых тестах (ОП и ПКЛ). Это соединение имеет одни из лучших расчетных параметров: значение DS = –9.551; высокую липофильность (LogP = 6.506); подходящее значение LogBB = –0.209. Активным также были диалкильное и циклоалкильное производные ГМЛ-12 и ГМЛ-107 с высокими значениями LogBB (–0.223 и 0.096 соответственно). Для алкоксиарилалкильных соединений ГМЛ-104 и ГМЛ-105 отмечается лишь тенденция к наличию активности. Большинство аминокислотых производных показали отсутствие активности или даже анксиогенное действие. В ряду этих соединений были наименьшие значения LogBB (от –1.325 до –0.676). Исключением стали производные фенилаланина ГМЛ-106 и ГМЛ-113. Оба этих соединения обладали анксиолитическим эффектом в нескольких дозах. Возможно, это обусловлено включением какой-либо дополнительной биологической мишени в механизм их действия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Для определения физико-химических характеристик полученных соединений использовали следующее оборудование: температуру плавления определяли на приборе Optimelt MPA100 (Stanford Research Systems, США) в открытых капиллярах без корректировки; строение целевых и промежуточных соединений устанавливали методами одномерной 1Н- ,13С- и двумерной (COSY – гомоядерная корреляция, HSQC – гетероядерная одноквантовая корреляция) ЯМР-спектроскопии. Спектры 1Н- и 13С-ЯМР регистрировали в шкале δ, м.д. на спектрометре FOURIER 300 HD (Bruker Corporation, Германия; 300 и 75 МГц для ядер 1Н- и 13С соответственно) в растворах DMSO-d6 и CDCl3, внутренний стандарт тетраметилсилан (0 м.д.). Константа спин-спинового взаимодействия J, Гц. Для обозначения резонансных сигналов использовали следующие сокращения: с – синглет, д – дублет, т – триплет, м – мультиплет. Тонкослойную хроматографию (ТСХ) выполняли на стеклянных силикагелевых пластинах DC Kieselgel 60 G/F254 (Merck, Германия) с обнаружением в УФ-свете.
Молекулярный докинг. Молекулярный докинг проводили с использованием структуры TSPO в комплексе с селективным лигандом PK-11195 (PDB ID: 2MGY) в программе Glide v8.1 (https://www.schrodinger.com/products/glide).
Пространственную структуру рецептора TSPO подготавливали с помощью Schrodinger Protein Preparation Wizard (https://www.schrodinger.com/science-articles/protein-preparation-wizard) c использованием стандартного протокола [17]. Конформации лигандов рассчитывали в программе LigPrep (https://www.schrodinger.com/products/ligprep). Координаты сетки (x 5.65; y 4.66; z 5.91; 20 Å) отцентровывали по лиганду. Стыковку выполняли в программе Glide v8.1 с использованием стандартного протокола [16]. Позы визуализировали в Maestro 11.8 (https://www.schrodinger.com/products/maestro), LogP рассчитывали в MarvinSketch 20.1 (ChemAxon Ltd., Венгрия). Для проверки протокола докинга рассчитывали среднеквадратичное отклонение положений атомов (RSMD) между исходным лигандом PK-11195 в белке TSPO и повторно состыкованным подготовленным PK-11195 в сетке. Значение RSMD составило 1.97 Å, что позволило использовать этот протокол для прогнозирования связывания новых лигандов TSPO.
Общая методика получения 1-фенил-пирроло[1,2-a]пиразин-3-карбоксамидов (I). Раствор 2.2 ммоль (0.2 г) аминосодержащего соединения, 2.0 ммоль (0.48 г) 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и 2.2 ммоль (0.30 г) 1-гидроксибензотриазола в 20 мл хлористого метилена охлаждали до 0°С. К нему добавляли раствор 2.4 ммоль (0.50 г) 1,3-дициклогексилкарбодиимида в 10 мл хлористого метилена, смесь перемешивали при 0°С в течение 30 мин. Выпавший осадок отфильтровывали, фильтрат промывали 2 раза по 20 мл воды, сушили сульфатом натрия и упаривали досуха. Остаток хроматографировали на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1 : 1). Нужные фракции собирали и упаривали досуха, остаток перекристализовывали из этанола.
1-Фенил-N,N-дипропилпирроло[1,2-a]пиразин-3-карбоксамида (ГМЛ-12). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и дипропиламина. Выход 70%, светло-желтые кристаллы. Т. пл. 104–106°С. Найдено (%): C, 74.88; H, 7.22; N, 12.90. С20H23N3O. Вычислено (%): C, 74.74; H, 7.21; N, 13.07. Спектр 1Н-ЯМР (СDCl3): 0.82, 1.00 (два т, по 3Н, 2СН3, J 6.9); 1.76 (м, 4Н, 2СН2СН3); 3.49, 3.68 (два т, по 2Н, СН2NСН2, J 7.3); 6.97 (м, 1Н, Н(8)); 7.00 (м, 1Н, Н(7)); 7.49–7.59 (м, 4Н, 3PhH, Н(6)); 7.96–8.03 (м, 2Н, 2PhH); 8.45 (с, 1Н, Н(4)).
N-Бензил-N-этил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-101). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и N-бензил-N-этиламина. Выход 80%, бледно-серый порошок. Т. пл. 116–118°С. Найдено (%): C, 76.83; H, 6.12; N, 11.98. С23H21N3O. Вычислено (%): C, 77.72; H, 5.96; N, 11.82. Спектр 1Н‑ЯМР (СDCl3): 1.27 (два т, по 3Н, 2СН3, 3J 7.1); 3.73 (м, 2Н, СН2–СH3); 4.95 (два с, 2Н, СН2–Ph); 6.98 (м, 1Н, Н(8)); 7.01 (м, 1Н, Н(7)); 7.27–8.01 (м, 11Н, 2Ph, Н(6)); 8.54 (с, 1Н, Н(4)).
N-Бензгидрил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-102). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и бензгидриламина. Выход 85%, желто-серые игольчатые кристаллы. Т. пл. 150–152°С. Найдено (%): C, 80.67; H, 5.63; N, 10.26. С27H21N3O. Вычислено (%): C, 80.37; H, 5.25; N, 10.41. Спектр 1Н‑ЯМР (СDCl3): 6.53 (м, 1Н, СН); 7.00 (м, 1Н, Н(8)); 7.04 (м, 1Н, Н(7)); 7.27–7.55 (м, 16Н, 3Ph, Н(6)); 7.97 (м, 1H, NH); 8.78 (м, 1Н, Н(4)).
N,N-Дибензил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-103). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и дибензиламина. Выход 70%, желтый порошок. Т. пл. 115–116°С. Найдено (%): C, 80.52; H, 5.23; N, 10.12. С28H23N3O. Вычислено (%): C, 80.55; H, 5.55; N, 10.06. Спектр 1Н-ЯМР (СDCl3): 4.74 (м, 2Н, СН2); 5.17 (м, 2Н, СН2); 6.99 (м, 1Н, Н(8)); 7.02 (м, 1Н, Н(7)); 7.36–7.93 (м, 16Н, 3Ph, Н(6)); 8.64 (с, 1Н, Н(4)).
1-Фенил-N-(3,4-диметоксифенилэтил)пирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-104). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и 3,4-диметоксифенилэтиламина. Выход 90%, светло-желтый порошок. Т. пл. 160–163°С. Найдено (%): C, 71.85; H, 5.68; N, 10.52. С24H23N3O3. Вычислено (%): C, 71.80; H, 5.77; N, 10.47. Спектр 1Н-ЯМР (СDCl3): 2.91 (м, 2Н, СН2); 3.74 (м, 2Н, СН2) 3.88 (м, 6Н, 2СН3); 6.83 (м, 3Н, Ph,); 6.99 (м, 1Н, Н(8)); 7.04 (м, 1Н, Н(7)); 7.27–8.15 (м, 11Н, 2Ph, Н(6)); 8.74 (с, 1Н, Н(4)).
1-Фенил-N-(3,4,5-триметоксибензил)пирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-105). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и 3,4,5-триметоксибензиламина. Выход 80%, светло-желтый порошок. Т. пл. 180–183°С. Найдено (%): C, 69.27; H, 5.72; N, 10.19. С24H23N3O4. Вычислено (%): C, 69.05; H, 5.55; N, 10.07. Спектр 1Н-ЯМР (СDCl3): 3.87 (м, 9Н, 3СН3); 4.65 (м, 2Н, СН2); 6.62 (м, 2Н, Ar); 7.02 (м, 1Н, Н(8)); 7.04 (м, 1Н, Н(7)); 7.27–8.03 (м, 6Н, Ph, Н(6)); 8.81 (с, 1Н, Н(4)).
Метиловый эфир L-3-фенил-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамид)пропановой кислоты (ГМЛ-106). Получали из 1‑фенилппирроло[1,2-a]пиразин-3-карбоновой кислоты и L-фенилаланина. Выход 85%, карамельные кристаллы. Т. пл. 120–121°С. Найдено (%): C, 72.12; H, 5.42; N, 10.56. С24H21N3O3. Вычислено (%): C, 72.17; H, 5.30; N, 10.52. Спектр 1Н-ЯМР (СDCl3): 3.27 (м, 2Н, СН2); 3.75 (три с, 3Н, СН3); 5.10 (м, 1Н, СН); 6.99 (м, 1Н, Н(8)); 7.06 (м, 1Н, Н(7)); 7.55–7.95 (м, 11Н, 2Ph, Н(6)); 8.44 (м, 1Н, NH); 8.71 (с, 1Н, Н(4)).
Азепан-1-ил(1-фенилпирроло[1,2-a]пиразин-3-ил)метанон (ГМЛ‑107). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и азепана. Выход 85%, карамельные кристаллы. Т. пл. 92–93°С. Найдено (%): C, 75.35; H, 6.72; N, 13.12. С20H21N3O. Вычислено (%): C, 75.21; H, 6.63; N, 13.16. Спектр 1Н-ЯМР (СDCl3): 1.65 (с, 2Н, СН2СН2); 1.86 (м, 2Н, СН2–СH2); 3.71 (м, 2Н, СН2–N); 3.86 (м, 2Н, СН2–N); 6.97 (м, 1Н, Н(8)); 6.99 (м, 1Н, Н(7)); 7.52–7.97 (м, 6Н, Ph, Н(6)); 8.4 (с, 1Н, Н(4)).
Диэтиловый эфир L-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамидо)пентандионовой кислоты (ГМЛ‑108). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и диэтилового эфира L-глутаминовой кислоты. Выход 65%, карамельные кристаллы. Т. пл. 59–60°С. Найдено (%): C, 65.30; H, 5.98; N, 9.83. С23H25N3O5. Вычислено (%): C, 65.24; H, 5.95; N, 9.92. Спектр 1Н-ЯМР (СDCl3): 1.20–1.30 (м, 6Н, 2СН3); 2.00–2.40 (м, 4Н, 2СН2-СH3); 4.09–4.11 (м, 2Н, СН2–С(О)); 4.25–4.27 (м, 2Н, СН2–СН2); 7.00–7.06 (д, 2Н, Н(8), Н(7), J 3.46); 7.55–8.00 (м, 6Н, Ph, Н(6)); 8.74 (с, 1Н, Н(4)).
Диэтиловый эфир L-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамидо)бутандионовой кислоты (ГМЛ‑109). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и диэтилового эфира L-аспарагиновой кислоты. Выход 78%, желтые кристаллы. Т. пл. 42–43°С. Найдено (%): C, 64.30; H, 5.74; N, 10.13. С22H23N3O5. Вычислено (%): C, 64.54; H, 5.66; N, 10.26. Спектр 1Н-ЯМР (СDCl3): 1.24–1.30 (м, 6Н, 3СН3); 3.01–3.11 (дд, 4Н, СН2–С(O), J1 6.25, J2 7.20); 5.09–5.12 (м, 1Н, СН–NH), 7.99–7.06 (д, 2Н, Н(8), Н(7), J 3.46); 7.53–8.04 (м, 6Н, Ph, Н(6)); 8.74–8.75 (с, 1Н, Н(4)).
Метиловый эфир L-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамидо)пропановой кислоты (ГМЛ-110). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и метилового эфира L-аланина. Выход 90%, желтые кристаллы. Т. пл. 128–130°С. Найдено (%): C, 66.79; H, 5.74; N, 13.14. С18H17N3O3. Вычислено (%): C, 66.86; H, 5.30; N, 13.00. Спектр 1Н-ЯМР (СDCl3): 1.57 (д, 3Н, СН3, J 6.00); 3.80 (с, 3Н, OСН3); 4.82–4.91 (м, 1Н, СН–NH), 7.04–7.00 (м, 2Н, Н(8), Н(7)); 7.55–8.43 (м, 6Н, Ph, Н(6)); 8.75 (с, 1Н, Н(4)).
Этиловый эфир L-3-(1H-индол-3-ил)-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамидо)пропановой кислоты (ГМЛ-111). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и этилового эфира L-триптофана. Выход 80%, желтые кристаллы. Т. пл. 71–72°С. Найдено (%): C, 71.65; H, 5.74; N, 12.40. С27H24N4O3. Вычислено (%): C, 71.67; H, 5.35; N, 12.38. Спектр 1Н-ЯМР (СDCl3): 1.24 (м, 3Н, СН3); 3.45 (м, 2Н, СН2–СH); 3.69 (м, 2Н, СН2–CH3), 5.16 (м, 2Н, СН–N); 7.01–7.84 (м, 13Н, Н(8), Н(7), Indole, Ph.); 8.54 (м, Н(6)); 8.71 (с, 1Н, Н(4)).
Этиловый эфир D-3-(4-гидроксифенил)-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамидо)-пропановой кислоты (ГМЛ-112). Получали из 1‑фенилпирроло[1,2-a]пиразин-3-карбоновой кислоты и этилового эфира D-тирозина. Выход 45%, желтые кристаллы. Т. пл. 174–176°С. Найдено (%): C, 69.95; H, 5.36; N, 9.75. С25H23N3O4. Вычислено (%): C, 69.92; H, 5.40; N, 9.78. Спектр 1Н‑ЯМР (СDCl3): 1.26 (м, 3Н, СН3); 3.15–3.17 (м, 2Н, СН2Ph); 3.72–3.75 (м, 1Н, СН–N), 4.19–4.22 (м, 2Н, СН2–CH3), 6.70–7.90 (м, 12Н, Н(8), Н(7), 2Ph); 8.52–8.55 (м, Н(6)); 8.67–8.68 (с, 1 Н, Н(4)).
L-3-Фенил-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамид)пропановая кислота (ГМЛ-113). Растворяли 8.03 ммоль (3.21 г) метилового эфира L-3-фенил-2-(1-фенилпирроло[1,2-a]пиразин-3-карбоксамид)пропановой кислоты (ГМЛ-106) в смеси этилового и изопропилового спирта, добавляли гидроксид калия в 20 мл воды и кипятили с обратным холодильником 2 ч. Нейтрализовали реакционную смесь лимонной кислотой и экстрагировали хлористым метиленом, затем упаривали досуха на роторном испарителе и перекристаллизовывали из этанола. Выход 1.71 г, 53.3%. Желтые кристаллы. Найдено (%): C, 71.45; H, 5.16; N, 10.99. С23H19N3O3. Вычислено (%): C, 71.68; H, 4.97; N, 10.90. Спектр 1Н-ЯМР (DMSO-d6): 3.21 (м, 2Н, СН2); 4.52 (м, 1Н, СН); 7.06 (м, 2Н, Н(7), Н(8)); 7.20–8.05 (м, 11Н, 2Ph, Н(6)); 8.53 (м, 1Н, NH); 8.97 (с, 1Н, Н(4)).
Животные. Животные (240 мышей-самцов линии Balb/c массой 19–25 г; 272 аутбредных мышей-самцов ICR массой 23–30 г) получены из питомника лабораторных животных “Пущино” при филиале Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова.
Животных содержали в условиях лабораторного вивария в контролируемых условиях окружающей среды (20–24°C и относительная влажность 45–65%, 12-часовой цикл освещения, 10-кратная смена объема воздуха комнаты в час) в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму и питьевой воде. Животных распределяли по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более 10%. Перед опытом животных выдерживали в экспериментальной комнате в “домашних” клетках в течение 24 ч.
Тест “открытое поле”. В исследовании использовали мышей-самцов линии Balb/c. Для введения исследуемых соединений готовили их суспензию с Тween-80 и дистиллированной водой (1% Тween-80) в концентрациях от 10 до 500 мкг/мл в зависимости от используемой дозы. Объем введения составлял 0.1 мл на 10 г веса для мышей и рассчитывался в соответствии с массой тела, регистрируемой перед введением препарата. Полученную смесь вводили мышам однократной внутрибрюшинной инъекцией. В каждой исследовательской группе было по 8 животных. Животным контрольных групп вводили 1%-ную суспензию Тween-80 в дистиллированной воде.
Через 30 мин после внутрибрюшинного введения соединения животное сначала помещали на 1 мин в темную камеру, а затем – на один из периферических квадратов “открытого поля” (Open Science, Россия), которое представляет из себя белую круглую арену диаметром 1 м с белыми бортами высотой 50 см. Освещение осуществляли бестеневыми лампами, расположенными на уровне 1 м над поверхностью поля. Уровень освещенности составлял 3000 люкс. Все пространство арены равномерно разделено четырьмя концентрическими окружностями, которые в свою очередь разбиты радиусами на сектора так, что периферическая окружность состоит из 16 одинаковых криволинейных квадратов. Наблюдение за животным проводили в течение 3 мин, раздельно фиксировали число пересеченных квадратов на периферии (ПА), в центральных областях (ЦА), число заходов в центр (Ц), а также число вертикальных стоек (ВА) и количество дефекаций (Д). Суммарное число пересеченных квадратов вместе с числом вертикальных стоек обозначали как общую активность (ОДА).
Тест “приподнятый крестообразный лабиринт”. Установка “приподнятый крестообразный лабиринт” (ПКЛ) (Open Science, Россия) для мышей выполнена из поливинилхлорида серого цвета и представляет собой две взаимопересекающиеся под прямым углом горизонтальные дорожки 65 × × 5 см. Два противоположных отсека имеют непрозрачные вертикальные стенки высотой 15 см. Лабиринт приподнят от пола на 40 см. В месте перекрестья плоскостей находится открытая центральная платформа 5 × 5 см.
Эксперимент проводили в условиях дневного освещения. В начале тестирования животное помещали в центр лабиринта, что давало возможность переместиться в темные либо светлые рукава лабиринта – в зависимости от преобладания тревоги (боязнь высоты, открытого пространства) или исследовательской активности (что побуждало животное выходить из “защищенных” рукавов).
Исследуемые соединения вводили внутрибрюшинно аутбредным мышам-самцам ICR в виде суспензии с Tween-80 и дистиллированной водой (1% Тween-80) в концентрациях от 10 до 500 мкг/мл в зависимости от используемой дозы. Объем введения составлял 0.1 мл на 10 г веса для мышей и рассчитывался в соответствии с массой тела, регистрируемой перед введением препарата. Животным контрольных групп вводили 1%-ную суспензию Тween-80 в дистиллированной воде. В каждой исследовательской группе было по 8 животных.
Оценку поведения мышей в тесте ПКЛ проводили согласно методике Pellow et al. [21] через 30 мин после введения соединений. Фиксировали следующие показатели поведения животных в ПКЛ в течение 300 с: время нахождения в открытых рукавах, время нахождения в закрытых рукавах, число заходов в открытые рукава, число заходов в закрытые рукава, пребывание (в %) животных в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах лабиринта и число заходов (в %) в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта.
Статистическая обработка данных. Статистическую обработку полученных в ОП и ПКЛ результатов проводили с использованием однофакторного дисперсионного анализа (критерий Краскела–Уоллиса) и непараметрического анализа для независимых переменных (U-критерий Манна–Уитни, различия считали значимыми при р < 0.05).
ЗАКЛЮЧЕНИЕ
Синтезирована новая группа 1-фенилпирроло[1,2-a]пиразин-3-карбоксамидов, в которых заместителями при амидном атоме азота выступают алкильные, бензильные или алкоксифенилалкильные группы, остатки аминокислот или их производные (всего 14 соединений). Показано, что синтезированные соединения имеют высокие теоретические значения аффинности по отношению к белку TSPO и благоприятный профиль ADMET-характеристик, что обусловливает их перспективность для разработки в качестве лекарственных средств.
У некоторых соединений в дозах 0.1–5.0 мг/кг при внутрибрюшинном введении в условиях эмоционально-стрессового воздействия в тесте “открытое поле” у мышей линии Balb/c и в тесте “приподнятый крестообразный лабиринт” у мышей ICR выявлена анксиолитическая активность. Определены некоторые закономерности по взаимосвязи биологической активности in vivo с рядом расчетных показателей: более активными были соединения, обладающие большими значениями Docking score, LogP и LogBB, что хорошо согласуется с базовыми принципами медицинской химии в отношении нейропсихотропных средств.
Для дальнейшей разработки в качестве потенциального анксиолитического средства было отобрано соединение-лидер N‑бензгидрил-1-фенилпирроло[1,2-a]пиразин-3-карбоксамид (ГМЛ-102), показавший наличие противотревожной активности у мышей в широком интервале доз в обоих используемых поведенческих тестах.
Список литературы
Mokrov G.V., Deeva O.A., Gudasheva T.A. // Curr. Pharm. Des. 2020. V. 27. P. 217–237. https://doi.org/10.2174/1381612826666200903122025
Sanabria E., Cuenca R.E., Esteso M.Á., Maldonado M. // Toxics. 2021. V. 9. P. 25. https://doi.org/10.3390/toxics9020025
Rupprecht R., Papadopoulos V., Rammes G., Baghai T.C., Fan J., Akula N., Groyer G., Adams D., Schumacher M. // Nat. Rev. Drug Discov. 2010. V. 9. P. 971–988. https://doi.org/10.1038/nrd3295
Sugasawa Y., Cheng W.W.L., Bracamontes J.R., Chen Z.W., Wang L., Germann A.L., Pierce S.R., Senneff T.C., Krishnan K., Reichert D.E., Covey D.F., Akk G., Evers A.S. // Elife. 2020. V. 9. P. 1–32. https://doi.org/10.7554/ELIFE.55331
Guennoun R., Labombarda F., Gonzalez Deniselle M.C., Liere P., De Nicola A.F., Schumacher M. // J. Steroid Biochem. Mol. Biol. 2015. V. 146. P. 48–61. https://doi.org/10.1016/j.jsbmb.2014.09.001
Rupprecht R., Ranimes G., Eser D., Baghai T.C., Schule C., Nothdurfter C., Troxler T., Gentsch C., Kalkman H.O., Chaperon F., Uzunov V., McAllister K.H., Bertaina-Anglade V., La Rochelle C.D., Tuerck D., Floesser A., Kiese B., Schumacher M., Landgraf R., Holsboer F., Kucher K. // Science. 2009. V. 325. P. 490–493. https://doi.org/10.1126/science.1175055
Da Pozzo E., Costa B., Martini C. // Curr. Mol. Med. 2012. V. 12. P. 426–442. https://doi.org/10.2174/156652412800163451
Barresi E., Robello M., Costa B., Da Pozzo E., Baglini E., Salerno S., Da Settimo F., Martini C., Taliani S. // Eur. J. Med. Chem. 2021. V. 209. P. 112924. https://doi.org/10.1016/j.ejmech.2020.112924
Mokrov G.V., Deeva O.A., Gudasheva T.A., Yarkov S.A., Yarkova M.A., Seredenin S.B. // Bioorg. Med. Chem. 2015. V. 23. P. 3368–3378. https://doi.org/10.1016/j.bmc.2015.04.049
Mokrov G.V., Pantileev A.S., Yarkova M.A., Gudasheva T.A., Seredenin S.B. // Med. Chem. 2022. V. 18. P. 497–508. https://doi.org/10.2174/1573406417666210806095051
Gudasheva T.A., Deeva O.A., Mokrov G.V., Dyabina A.S., Yarkova M.A., Seredenin S.B. // Med. Chem. 2018. V. 15. P. 383–399. https://doi.org/10.2174/1573406415666181119164846
Gudasheva T.A., Deeva O.A., Pantileev A.S., Mokrov G.V., Rybina I.V., Yarkova M.A., Seredenin S.B. // Molecules. 2020. V. 25. P. 5132. https://doi.org/10.3390/molecules25215132
Середенин С.Б., Мокров Г.В., Гудашева Т.А., Деева О.А., Ярков С.А., Яркова М.А., Жердев В.П., Алексеев К.В., Дурнев А.Д., Незнамов Г.Г. // Патент RU 2572076 C2, 2015.
Середенин С.Б., Яркова М.А., Поварнина П.Ю., Мокров Г.В., Гудашева Т.А. // Патент RU 2699568 C2, 2019.
Середенин С.Б., Мокров Г.В., Яркова М.А., Пантилеев А.С., Гудашева Т.А., Дурнев А.Д. // Патент RU 2734240 C2, 2020.
Schrödinger Release 2015-4: Maestro, Version 10.4, Schrödinger, LLC, New York, NY, 2015. https://www.schrodinger.com/products/maestro
Schrödinger Release 2015-2: LigPrep, Schrödinger, LLC, New York, NY, 2015. https://www.schrodinger.com/products/ligprep
ADMETlab 2.0: an Integrated Online Platform for Accurate and Comprehensive Predictions of ADMET Properties, 2021. https://admetmesh.scbdd.com/
Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. Миронова А.Н. Москва: Гриф и К, 2012. 944 с.
Середенин С.Б., Ведерников А.А. // Бюлл. эксп. биол. и мед. 1979. Т. 88. № 7. С. 38–40.
Pellow S., Chopin P., File S.E., Briley M. // Neurosci. Meth. J. 1985. V. 14. P. 149–167.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



