Биоорганическая химия, 2023, T. 49, № 2, стр. 178-187
Гибридные органоминеральные носители для терапевтических белков
П. В. Зеленихин 1, *, А. Г. Галеева 1, 2, Р. Р. Исламова 1, О. Н. Лопатин 1, Р. С. Яруллин 3, О. Н. Ильинская 1
1 Казанский (Приволжский) федеральный университет
420008 Казань, Кремлевская, 18, Россия
2 ФГБНУ “Федеральный центр токсикологической, радиационной и биологической безопасности” (“ФЦТРБ-ВНИВИ”)
420075 Казань, Научный городок-2, Россия
3 ОАО “Татнефтехиминвест-холдинг”
420061 Казань, ул. Николая Ершова, 29А, Россия
* E-mail: pasha_mic@mail.ru
Поступила в редакцию 12.08.2022
После доработки 26.08.2022
Принята к публикации 27.08.2022
- EDN: GHXBZI
- DOI: 10.31857/S0132342323020239
Аннотация
Системы доставки лекарственных средств разрабатываются для обеспечения необходимой концентрации и пролонгированного эффекта действующего вещества в организме. Перорально применяемые белковые препараты требуют защиты от протеолиза в желудочно-кишечном тракте. Биосовместимые гидрофильные полисахариды в составе матрицы особенно перспективны, поскольку не раздражают кишечник и постепенно расщепляются специфическими гликозидазами, высвобождая терапевтический агент. Введение в состав носителя нерастворимой пористой минеральной матрицы дает возможность повысить концентрацию терапевтического средства в матрице без значительного увеличения объема таблетированной формы препарата. В данной работе создан новый оригинальный органоминеральный носитель на основе термообработанного измельченного цеолита клиноптилолита в сочетании с природными полисахаридами красных морских водорослей – агар-агара, агарозы и каррагинана. Гранулярный и мелкодисперсный клиноптилолиты в составе матрикса загружены перспективным терапевтическим агентом – рибонуклеазой Bacillus pumilus (биназой), проявляющей селективную цитотоксичность к опухолевым клеткам. Установлено, что как гранулярный, так и мелкодисперсный цеолиты в комплексе с полисахаридами лучше удерживают белок по сравнению с чистыми цеолитами и обеспечивают постепенный полный выход фермента за 18 ч, при этом биназа сохраняет каталитическую активность и вызывает апоптоз до 23.8% популяции клеток аденокарциномы двенадцатиперстной кишки человека HuTu80. Полученные данные обосновывают перспективность конструирования лекарственных форм на основе исследованных органоминеральных носителей.
ВВЕДЕНИЕ
В роли носителей терапевтических агентов и пробиотиков активно используются сорбенты на основе полимеров синтетического и природного происхождения, угля и минералов, после очистки и переработки которых получают так называемые медицинские глины [1]. Перспективное минеральное сырье – цеолиты, сочетающие в себе свойства адсорбента и “молекулярного сита” за счет пористой структуры. Кроме того, цеолиты выступают источником макро- и микроэлементов, что обусловливает их использование в качестве биологически активных пищевых добавок [2].
Разрабатываются также носители терапевтических средств на основе биодеградируемых полисахаридных гидрогелей [3, 4], которые могут быть введены в организм оральным [5] и инъекционным путями [6]. Биосовместимость гидрогелей с межклеточным матриксом человека, обусловленная сходством их структуры и физико-химических свойств, определяет перспективность использования подобных агентов в медицине. Наиболее технологичные гидрогели организованы в трехмерную сеть за счет механического переплетения молекул полимера и межмолекулярных взаимодействий, включая ионные, водородные и гидрофобные связи. Создание гибридных органоминеральных носителей особенно актуально, поскольку может значительно повысить их эффективность как безопасных сорбентов с регулируемым выходом терапевтических средств в месте доставки [7].
Известно ~80 видов цеолитов, различающихся по размеру так называемых окон (система каналов и полостей) и морфологии (фибриллярной, ламеллярной либо сферической) [8]. Некоторые цеолиты небезопасны. К таковым относятся прежде всего фибриллярные и тонкоигольчатые: например, эрионит способен индуцировать развитие мезотелиомы легких человека [9], натролит проявляет токсичность к клеткам эукариот [10]. Клиноптилолит сферической морфологии наименее токсичен и поэтому широко используется как сорбент при очистке воды, почвы, в разнообразных процессах детоксикации. На российском рынке представлен порошковый цеолит клиноптилолит (ZeoDetox, Россия), капсулы Метабаланс® (КРАФТ, Россия), содержащие цеолит и метаболиты Bacillus subtilis. Все больше внимания уделяется использованию клиноптилолита в ветеринарии и медицине [11, 12]. Измельчение и термическая обработка клиноптилолита повышает его адсорбционную емкость, при этом устранение свободной и связанной воды из кристаллической решетки облегчает впоследствии активное насыщение цеолита раствором адсорбатов за счет регидратации. Ранее нами установлено, что природный клиноптилолит способен к сорбции белков с различной молекулярной массой, причем как анионных (сывороточный альбумин) [13, 14], так и катионных (бациллярная РНКаза) [10], и обеспечивает пролонгированный выход белков с целевой активностью в среду культивирования раковых клеток.
Секретируемая гуанил-предпочитающая РНКаза Bacillus pumilus (биназа) – одна из ряда цитотоксичных РНКаз, избирательно поражающих злокачественные клетки. В отличие от РНКаз млекопитающих, ингибируемых цитоплазматическим ингибитором в клетках эукариот, биназа нечувствительна к ингибитору, устойчива к протеолизу и способна проникать в цитоплазму и ядро опухолевых клеток, где проявляет каталитическую активность по отношению к доступным молекулам РНК, индуцируя апоптоз как in vitro, так и in vivo [15–17]. Недавно нами было установлено, что биназа, загруженная в гидрогелевые микросферы на основе альгината и желатина, укрепленные ионами кальция, постепенно выходит из них, вызывая апоптоз клеток аденокарциномы двенадцатиперстной кишки человека HuTu80 [18].
Исходя из наших предыдущих результатов, подтверждающих терапевтический потенциал биназы как альтернативного химиотерапевтического агента и ее возможности доставки на минеральных носителях [10, 19] и в составе гидрогелей [18], мы подошли к постановке задачи создания гибридных органоминеральных носителей для этого фермента.
В связи с этим целью настоящей работы явилось получение гранулярной и мелкодисперсной фракций термически обработанного клиноптилолита, их модификация различными полисахаридными гелями и выявление адсорбционной емкости гибридных образцов в отношении терапевтического белка биназы с последующим анализом цитотоксического потенциала данного белка к опухолевым клеткам рака кишечника человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИE
Адсорбция биназы цеолитами. Татарско-Шатрашанское месторождение в центральной европейской части России содержит миллионы тонн клиноптилолита, минерала цеолитной группы гейландита. Структура клиноптилолита представлена трехмерной отрицательно заряженной открытой каркасно-полостной решеткой, состоящей из кремнекислых тетраэдров (SiO4)4–, соединенных атомами кислорода, причем часть атомов кремния замещена атомами алюминия (AlO4)5–. Окна клиноптилолита размером 2–15 Å и общим объемом 24–32% позволяют сорбировать разнообразные вещества.
Экспериментальный гидродинамический радиус биназы, определенный нами ранее методом ЯМР, составляет 2.1 нм [20], что не позволяет белку находиться внутри этих окон, хотя биназа относится к малым глобулярным белкам: для сравнения, гидродинамический радиус геликазы человека RecQI, имеющей молекулярную массу 158 кДа, составляет 5.4 ± 0.6 нм [21], а фибриногена с молекулярной массой 340 кДа – уже 10.95 нм [22]. Таким образом, белки не могут проникнуть внутрь цеолитов и реагируют только с внешней поверхностью кристаллов, где расположена часть активных центров, к которым ведут большие транспортные поры. Однако не только крупные органические молекулы, но и бактерии плотно сорбируются на цеолитах, что находит применение при биологической очистке сточных вод [23].
Мы сравнили сорбционную способность двух образцов термообработанного измельченного цеолита, различающихся по размерам частиц: образец № 1 с частицами ~200–800 мкм (гранулярный) и образец № 2 (мелкодисперсный), в котором размер частиц был <40 мкм (рис. 1). Проведенный анализ количественных показателей загрузки биназы в цеолиты выявил, что за 2 ч биназа ими практически полностью адсорбируется, при этом мелкодисперсный образец № 2 обладал несколько меньшей сорбционной способностью (адсорбционная емкость 0.175 ± 0.001 ед.) по сравнению с гранулярным образцом № 1 (адсорбционная емкость 0.168 ± 0.001 ед.), т.е. в условиях эксперимента из 1 мг/мл раствора биназы гранулярный цеолит № 1 сорбировал 0.87 мг, а мелкодисперсный № 2 – 0.84 мг белка (табл. 1).
Рис. 1.
Микрофотографии образцов термообработанных цеолитов различной гранулярности, использованных в работе.

Таблица 1.
Количество белка и каталитическая активность биназы в спиртовом растворе до и после загрузки фермента в образцы цеолитов
| Содержание белка, мг/мл (%) | РНКазная активность, ед./мл (%) | ||||
|---|---|---|---|---|---|
| биназа, 1 мг/мл |
цеолит | биназа, 1 мг/мл |
цеолит | ||
| № 1 | № 2 | № 1 | № 2 | ||
| 1.00 ± 0.04 (100) | 0.13 ± 0.02 (12.60 ± 0.15) |
0.16 ± 0.01 (16.00 ± 0.14) |
1 102 500 ± 11 726 (100) |
47 222 ± 4055 (4.28 ± 0.36) | 124 222 ± 7934 (11.26 ± 0.72) |
| Загруженная биназа, % от содержания в исходном растворе | |||||
| 87.4 ± 1.5 | 84.0 ± 1.4 | 95.7 ± 0.4 | 88.7 ± 0.7 | ||
Выход биназы из мелкодисперсного образца (№ 2) за 6 ч был практически полным, гранулярный цеолит (№ 1) лучше удерживал фермент и обеспечил за это время выход лишь около половины белка (табл. 2).
Таблица 2.
Динамика выхода биназы из цеолитов после 6 ч инкубации в mQ-воде при комнатной температуре
| Цеолит | Время, ч | РНКазная активность, % | Количество белка, % |
|---|---|---|---|
| № 1 | 2 | 7.30 ± 0.09 | 15.00 ± 0.06 |
| 4 | 18.10 ± 0.14 | 23.10 ± 0.02 | |
| 6 | 60.85 ± 0.61 | 52.85 ± 0.16 | |
| № 2 | 2 | 28.72 ± 0.23 | 27.70 ± 0.12 |
| 4 | 81.01 ± 0.22 | 52.40 ± 0.32 | |
| 6 | 98.42 ± 0.25 | 80.20 ± 0.28 |
Параметры входа и выхода биназы, определенные по каталитической активности, подтвердили тенденцию, зафиксированную при определении содержания белка, хотя абсолютные цифры вследствие более точного метода определения каталитической активности по сравнению с определением содержания белка были несколько выше.
Выход биназы из гибридного матрикса. Гибридные органоминеральные носители, кроме цеолитов включавшие агар-агар, агарозу либо каррагинан, обеспечили более медленный выход биназы по сравнению с выходом из собственно цеолитов. Так, за 6 ч из образца цеолита № 1 высвобождалось 6.7 × 105 ед. активности биназы, а из цеолита № 2 – 10.9 × 105 ед. активности, что составляет 60.85 и 98.42% от загруженного количества фермента соответственно (табл. 2). Каждый диск гибридного носителя, расположенного в лунке пластикового планшета, содержал 115 и 111 мкг биназы соответственно для образцов № 1 и 2, что составляло ~2.2 × 105 ед. активности фермента и было принято за 100%. За те же 6 ч из импрегнированных цеолитом № 1 гелей вышло ~0.79 × 105 ед. активности фермента, а из импрегнированных цеолитом № 2 гелей – 0.83 × 105 ед. активности биназы, т.е. 36.01 и 37.88% от загруженной величины. Полный выход биназы был зафиксирован только спустя 18 ч (рис. 2). Достоверных различий скорости высвобождения фермента из органоминеральных носителей с разными полисахаридными матрицами не зафиксировано.
Рис. 2.
Динамика выхода биназы из полисахаридных гелей, импрегнированных гранулярным цеолитом № 1 (а) и мелкодисперсным цеолитом № 2 (б).
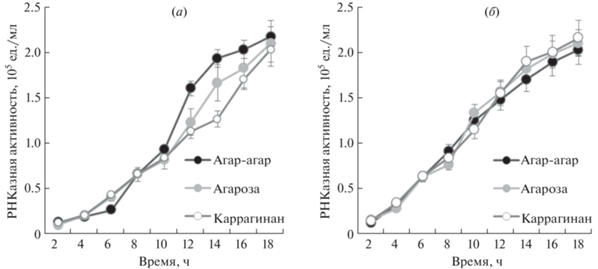
Отметим, что агар-агар, агароза и каррагинан содержат в своем составе D- и L-галактозы и 3,6-ангидрогалактозы и производятся из красных морских водорослей. В агар-агаре присутствуют еще и пентозы, D-глюкуроновая и пировиноградная кислоты, а в каррагинане – сульфатированные остатки галактоз. Однако эти различия в структуре используемых нами полисахаридов не влияли на динамические и количественные показатели выхода биназы из импрегнированных цеолитами гелей.
Полученные данные подтверждают, что как гранулярный, так и мелкодисперсный цеолиты в комплексе с полисахаридами лучше удерживают белок по сравнению с чистыми цеолитами. За 6–8 ч из сконструированных нами гибридных органоминеральных носителей высвобождается 36–38% загруженного фермента, полностью биназа выходит за 18 ч. Известно, что время транзита пищи через желудок составляет 0.5–2 ч, в тонкой кишке пища находится 1–4 ч, в толстой кишке она может оставаться более суток. Это означает, что импрегнированные цеолитами гели после предполагаемого однократного перорального приема обеспечат выход биназы на протяжении всего желудочно-кишечного тракта, где в случае наличия опухолей фермент может оказывать свое терапевтическое действие.
Индукция апоптоза биназой в составе органоминеральных носителей. Прежде всего, мы проверили, насколько сам органоминеральный матрикс, не содержащий биназу, обладает цитотоксичностью. Растворимые компоненты гибридных носителей потенциально способны индуцировать апоптоз. Однако установлено, что клетки аденокарциномы двенадцатиперстной кишки человека HuTu80 под действием незагруженных носителей переходят в апоптоз в незначительном количестве: не более 3% за 24 ч и не более 7% за 48 ч. Эта часть клеток состоит из примерно вдвое меньшей доли раннеапоптотических клеток по сравнению с позднеапоптотическими (рис. 3).
Рис. 3.
Индукция апоптоза клеток аденокарциномы двенадцатиперстной кишки человека HuTu80 контрольными полисахаридными гелями, импрегнированными цеолитами без биназы: (а) – через 24 ч, (б) – через 48 ч инкубации. В качестве положительного контроля индукции апоптоза использовали неиммобилизованную биназу. За 100% принято общее число клеток в популяции.

Определение доли апоптотических клеток, индуцированных органоминеральными носителями с биназой, показало, что она возрастает максимум до 7.2% (цеолит № 2 + агароза) и 23.8% (цеолит № 1 + каррагинан) за 24 и 48 ч соответственно. При этом доля позднеапоптотических клеток в популяции при обработке не иммобилизованной на носителях биназой достигает 17.9% за 24 ч; за 48 ч этот показатель возрастает незначительно (до 21.1%) в связи с динамической фрагментацией клеток, переходящих в дебрис. Апоптоз-индуцирующее действие биназы, выходящей из носителей, проявляется более медленно, на что указывает появление в популяции прежде всего раннеапоптотических клеток. Отметим, что наиболее эффективными носителями биназы можно считать каррагинановый и агарозный гели, импрегнированные гранулярным цеолитом (цеолит № 1), выходя из которых, биназа индуцирует переход к апоптозу за 48 ч 23.8 и 21.8% клеток соответственно (рис. 4).
Рис. 4.
Индукция апоптоза клеток аденокарциномы двенадцатиперстной кишки человека HuTu80 гибридными органоминеральными носителями, загруженными биназой: (а) – через 24 ч, (б) – через 48 ч инкубации. В качестве положительного контроля индукции апоптоза использовали неиммобилизованную биназу. За 100% принято общее число клеток в популяции.

Таким образом, нами установлена возможность конструирования носителей белков с потенциальной терапевтической активностью на основе комплексов цеолита клиноптилолита и природных полисахаридов. Полученные системы пролонгировали высвобождение и биологическую активность модельного терапевтического агента – бациллярной рибонуклеазы с противоопухолевой активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Белок биназа. В работе использовали гуанилспецифичную РНКазу биназу (EC 3.1.27.3; молекулярная масса 12.2 кДа, 109 а.о., pI 9.5), выделенную как гомогенный белок из культуральной жидкости штамма Bаcillus pumilus 7P дикого типа (ВКПМ В-3073) по методу, описанному ранее [24]. Каталитическую активность биназы в отношении субстрата – дрожжевой РНК – определяли модифицированным методом Анфинсена [25].
Клиноптилолит. Использовали цеолит с первой пачки Татарско-Шатрашанского месторождения (глубина 7–25 м). Цеолит подвергали высокотемпературной обработке в течение 6 мин при 1250°С (муфельная печь ЭКПС 50 модель 5007, Россия). Образцы раздробленного до гранул и мелкодисперсного порошка цеолита промывали 96%-ным этанолом, затем обрабатывали ультразвуком для дезинтеграции агрегатов (10 мин, 35 кГц, 130 В; Sapphire, Россия) и высушивали при комнатной температуре. Каплю разбавленных образцов цеолита помещали на решетку с углеродным покрытием и оставляли испаряться. Образцы анализировали с помощью трансмиссионного электронного микроскопа HT7700 Exalens (Hitachi High-Tech Science Corporation, Япония) при разрешении 1.4 Å. Светлопольные изображения получали при ускоряющем напряжении 100 кВ с помощью камеры AMT XR-81.
Загрузка/выгрузка белка из цеолита. Навески цеолитов (по 5 мг) предварительно отмывали трижды mQ-водой и высушивали при 160°С в течение 30 мин. Для загрузки каждую навеску цеолитов ресуспендировали в 1 мл спиртового (96%) раствора биназы (концентрация – 1 мг/мл, исходная РНКазная активность – 1.102 ± 0.010 × 106 ед./мг), гомогенизировали на вортексе и подвергали ультразвуковой обработке на льду (5 мин, 35 кГц, 120 В), после чего перемешивали на шейкере в течение 2 ч и осаждали при 4300 g в течение 5 мин. Для определения загрузочной способности цеолитов в полученных супернатантах измеряли остаточное количество белка по поглощению при 280 нм и РНКазную активность. За 100% принимали значения данных показателей для исходного спиртового раствора биназы.
Осадки после отделения первичных супернатантов высушивали при 50°С в течение 30–40 мин, после чего ресуспендировали в 1 мл mQ-воды и инкубировали при комнатной температуре в течение 6 ч, отбирая по 25 мкл супернатанта каждые 2 ч для определения количества выгружаемого белка и РНКазной активности.
Адсорбционную емкость цеолитов в условных единицах рассчитывали по формуле [26]:
где Сн – начальное содержание белка в растворе, мкг/мл; Ск – конечное содержание белка в растворе, мкг/мл; m – навеска сорбента, мкг; V – объем раствора белка, мл.Гибридные гели. Навески агар-агара (Merck, США), агарозы (AppliChem, Германия) и каррагинана (Sigma-Aldrich, США) по 45 мг суспендировали в 1455 мкл дистиллированной воды (для формирования 3%-ных гелей), гомогенизировали на вортексе, подогревали на водяной бане до расплавления – до 60°С (каррагинан и агарозу) и до 100°С (агар-агар), дожидались частичного остывания в течение 5–7 с и вносили в гелевые стоки гомогенизированные навески загруженных биназой цеолитов. Для определения динамики выхода биназы пластины гибридных гелей (высота 3 мм, объем 263 мкл) помещали в лунки 48-луночного планшета до окончательного застывания, сверху вносили по 1 мл дистиллированной воды и инкубировали при комнатной температуре в течение 14 ч, отбирая по 25 мкл супернатанта каждые 2 ч для измерения содержания белка и РНКазной активности.
Для определения выхода биназы в среду культивирования клеток гомогенизированные гибридные гели стерильно заливали во вставки, размещенные в пустом планшете-держателе. После застывания гелей вставки при помощи пинцета вносили в лунки с клетками, куда предварительно было внесено по 0.7 мл свежей среды, и наносили сверху на пластины по 0.2 мл среды. Планшеты инкубировали в течение 24 и 48 ч; в эти временные точки проводили цитометрический анализ.
Клетки. Линию клеток аденокарциномы двенадцатиперстной кишки человека HuTu80 (ATCC, США) культивировали при 37°С в атмосфере 5% СО2 в среде DMEM с добавлением пенициллина/стрептомицина (по 100 ед./мл) и 10% FBS до состояния монослоя, после чего клетки трипсинизировали и высевали в 24-луночные планшеты из расчета не менее 2 × 105 клеток на лунку. Непосредственно в планшете клетки выращивали до 80%-ной конфлюэнтности монослоя, после чего вводили в лунки матрицы-вставки для мультилуночных планшетов с диаметром пор 0.4 мкм (Thermo Scientific, США), содержащие исследуемые носители, загруженные и не загруженные биназой. Количество РНКазы на лунку в составе органоминеральной матрицы или в растворенном виде составляло 100 мкг, объем среды в каждой лунке – 1 мл. Планшеты инкубировали в атмосфере 5% СО2 при 37°С в течение 48 ч.
Цитометрия. Для цитофлуориметрической детекции параметров апоптоза использовали двойное окрашивание иодидом пропидия (PI) (Sigma, США) и потенциал-зависимым красителем иодидом 3,3'-дигексилоксакарбоцианин (DiOC6) (Molecular Probes, США) на проточном цитофлуориметре BD FACSCanto II (Becton Dickinson, США). По окончании срока инкубации клеток среду культивирования отбирали и вносили в центрифужные пробирки для предотвращения потерь клеток, сохранивших целостность, но уже потерявших способность к адгезии. Снятие клеток с культуральных планшетов осуществляли трипсинизацией (0.25%-ный трипсин-ЭДТА; ПанЭко, Россия). Объединенные образцы центрифугировали 5 мин (300 g при комнатной температуре), осадок ресуспендировали в 1 мл 0.01 М фосфатно-солевого буфера (рН 7.2). Затем вносили в суспензию клеток DiOC6 в конечной концентрации 50 нМ и выдерживали 20 мин в темноте при 37°С. За 2 мин до начала измерений добавляли PI до конечной концентрации 5 мкг/мл. При анализе цитометрических данных обсчитывали характеристики флуоресцентного сигнала не менее чем для 2 × 104 клеток для каждого образца в пяти повторах в каждом из трех независимых экспериментов.
Статистическая обработка. Статистическую обработку данных осуществляли в программном пакете Statistica 7.0 (StatSoft, США). Все эксперименты проводили не менее чем в трех повторах. В качестве критерия достоверности различий использовали критерий Манна–Уитни (p ≤ 0.05). При визуализации полученных результатов данные представляли в виде средних значений ± ± стандартное отклонение.
ЗАКЛЮЧЕНИЕ
На основе термообработанного измельченного цеолита клиноптилолита в сочетании с природными полисахаридами красных морских водорослей – агар-агара, агарозы и каррагинана – создан новый оригинальный органоминеральный носитель для доставки перспективного терапевтического агента – рибонуклеазы Bacillus pumilus (биназы) – к опухолям, локализованным в желудочно-кишечном тракте. Матрикс носителя состоял из гранулярного либо мелкодисперсного клиноптилолита, укрепленного биосовместимыми полисахаридами. Гранулярный и мелкодисперсный клиноптилолиты обладали сходной сорбционной емкостью, обеспечивая загрузку более 80% биназы за 2 ч. Выход биназы из мелкодисперсного образца за 6 ч был практически полным; гранулярный цеолит лучше удерживал фермент, высвобождая за это время выход лишь около половины белка; в то же время выход фермента из комплексного органоминерального носителя составил, соответственно, 36 и 38% от загруженного. Полный постепенный выход целевого белка из органоминерального матрикса пролонгирован до 18 ч, при этом фермент сохранял каталитическую активность и вызывал апоптоз до 23.8% популяции клеток аденокарциномы двенадцатиперстной кишки человека HuTu80. Различия в структуре используемых полисахаридов не оказывали значительного влияния на динамические и количественные показатели выхода биназы из импрегнированных цеолитами гелей.
Полученные результаты обосновывают возможность создания потенциальных лекарственных форм на основе подобных систем, где терапевтически активный белок будет удерживаться и стабилизироваться в структуре гибридной органоминеральной матрицы и пролонгированно высвобождаться из нее.
Список литературы
Бондарев А.В., Жилякова Е.Т. // Фармация и фармакология. 2019. Т. 7. С. 4–12. https://doi.org/10.19163/2307-9266-2019-7-1-4-12
Бондарев А.В., Жилякова Е.Т., Демина Н.Б., Размахнин К.К. // Разработка и регистрация лекарственных средств. 2021. Т. 10. С. 65–71. https://doi.org/10.33380/2305-2066-2021-10-4-65-71
Chirani N., Yahia L’H., Gritsch L., Motta F.L., Chirani S., Fare S. // J. Biomed. Sci. 2015. V. 4. P. 1–23. https://doi.org/10.4172/2254-609X.100013
Kouser R., Vashist A., Zafaryab M., Rizvi M.A., Ahmad S. // ACS Appl. Bio Mater. 2018. V. 1. P. 1810–1822. https://doi.org/10.1021/acsabm.8b00260
Liu X., Steiger C., Lin S., Parada G.A., Liu J., Chan H.F., Yuk H., Phan N.V., Collins J., Tamang S., Traverso G., Zhao X. // Nat. Commun. 2019. V. 1. P. 493. https://doi.org/10.1038/s41467-019-08355-2
Norouzi M., Nazari B., Miller D.W. // Drug Discov. Today. 2016. V. 21. P. 1835–1849. https://doi.org/10.1016/j.drudis.2016.07.006
Gao W., Zhang Y., Zhang Q., Zhang L. // Ann. Biomed. Eng. 2016. V. 44. P. 2049–2061. https://doi.org/10.1007/s10439-016-1583-9
Ivanova I.I., Knyazeva E.E. // Chem. Soc. Rev. 2013. V. 42. P. 3671–3688. https://doi.org/10.1039/c2cs35341e
Attanoos R.L., Churg A., Galateau-Salle F., Gibbs A.R., Roggli V.L. // Arch. Path. Lab. 2018. V. 142. P. 753–760. https://doi.org/10.5858/arpa.2017-0365-RA
Khojaewa V., Lopatin O., Zelenikhin P., Ilinskaya O. // Front. Pharmacol. 2019. V. 10. P. 442. https://doi.org/10.3389/fphar.2019.00442
Mastinu A., Kumar A., Maccarinelli G., Bonini S.A., Premoli M., Aria F., Gianoncelli A., Memo M. // Molecules. 2019. V. 24. P. 1517. https://doi.org/10.3390/molecules24081517
Kraljević Pavelić S., Simović Medica J., Gumbarević D., Filošević A., Pržulj N., Pavelić K. // Front. Pharmacol. 2018. V. 9. P. 1350. https://doi.org/10.3389/fphar.2018.01350
Исламова Р.Р., Яковлева Г.Ю., Ильинская О.Н., Лопатин О.Н. // Матер. международ. науч. конфер. “Проблемы геологии и расширение минерально-сырьевой базы стран Евразии”, Алматы. 2019. С. 317–322. ISBN 978-601-332-416-6.
Исламова Р.Р., Яковлева Г.И., Тюрин А.Н., Ильинская О.Н., Лопатин О.Н. // Записки российского минералогического общества. 2022. Т. 151. С. 105–113.
Makarov A.A., Kolchinsky A., Ilinskaya O.N. // BioEssays. 2008. V. 30. P. 781–790. https://doi.org/10.1002/bies.20789
Garipov A.R., Nesmelov A.A., Cabrera-Fuentes H.A., Ilinskaya O.N. // Toxicon. 2014. V. 92. P. 54–59. https://doi.org/10.1016/j.toxicon.2014.09.014
Mohamed I.S.E., Sen’kova A.V., Nadyrova A.I., Savin I.A., Markov A.V., Mitkevich V.A., Makarov A.A., Ilinskaya O.N., Mironova N.L., Zenkova M.A. // Biomolecules. 2020. V. 10. P. 1509. https://doi.org/10.3390/biom10111
Bogdanova L.R., Zelenikhin P.V., Makarova A.O., Zueva O.S., Salnikov V.V., Zuev Y.F., Ilinskaya O.N. // Polymers (Basel). 2022. V. 14. P. 2461. https://doi.org/10.3390/polym14122461
Khodzhaeva V., Makeeva A., Ulyanova V., Zelenikhin P., Evtugyn V., Hardt M., Rozhina E., Lvov Y., Fakhrullin R., Ilinskaya O. // Front. Pharmacol. 2017. V. 8. P. 631. https://doi.org/10.3389/fphar.2017.00631
Ilinskaya O., Ulyanova V., Lisevich I., Dudkina E., Zakharchenko N., Kusova A., Faizullin D., Zuev Y. // Biomed. Res. Int. 2018. P. 4837623. https://doi.org/10.1155/2018/4837623
Cui S., Arosio D., Doherty K.M., Brosh R.M., Jr., Falaschi A., Vindigni A. // Nucleic Acids Res. 2004. V. 32. P. 2158–2170. https://doi.org/10.1093/nar/gkh540
Wasilewska M., Adamczyk Z., Jachimska B. // Langmuir. 2009. V. 25. P. 3698–3704. https://doi.org/10.1021/la803662a
Dudkina E., Ulyanova V., Shah Mahmud R., Khodzhaeva V., Dao L., Vershinina V., Kolpakov A., Ilinskaya O. // FEBS Open Biol. 2016. V. 6. P. 24‒32. https://doi.org/10.1002/feb4.12023
Foglar L., Sipos L., Bolf N. // World J. Microbiol. Biotechnol. 2007. V. 23. P. 1595–1603. https://doi.org/10.1007/s11274-007-9405-8
Колпаков А.И., Ильинская О.Н. // Клиническая и лабораторная диагностика. 1999. № 5. С. 14‒16.
Пирузян А.В., Боковикова Т.Н., Найденов Ю.В. // Электронный научно-технический журнал “Физико-химический анализ свойств многокомпонентных систем”. 2008. № 6. https://fh.kubstu.ru/fams/issues/issue06/st0630.pdf
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


