Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 2, стр. 115-124
Донор NO SIN-1 как модулятор метаботропных глутаматных рецепторов в афферентном аминокислотном синапсе вестибулярного аппарата лягушки
И. В. Рыжова a, *, А. Д. Ноздрачев a, Т. В. Тобиас a, Е. А. Вершинина a
a Институт физиологии им. И.П. Павлова РАН
199034 Санкт Петербург, наб. Макарова, 6, Россия
* E-mail: ireneryzhova@mail.ru
Поступила в редакцию 30.03.2018
Принята к публикации 16.07.2018
Аннотация
Газообразный модулятор оксид азота (NO) синтезируется в вестибулярном эпителии в нормальных и патологических условиях. На изолированном вестибулярном аппарате лягушки при помощи метода внешней перфузии и регистрации импульсной активности нерва, контактирующего с задним полукружным каналом, изучали влияние донора NO морфолиносиндонимин гидрохлорида (SIN-1) на функцию метаботропных глутаматных рецепторов (МГР). SIN-1 (0.1–100 мкМ) увеличивал уровень фоновой импульсной активности афферентных волокон. SIN-1 (1 и 10 мкМ) уменьшал величину ответа агониста метаботропных глутаматных рецепторов (±)-1-аминоциклопентан-транс-1,3-дикарбоновой кислоты (ACPD). Ингибирующий эффект был обратим и не зависел от концентрации SIN-1. Показано, что NO может модулировать функцию метаботропных глутаматных рецепторов, модифицируя афферентный поток от вестибулярного аппарата в центральную нервную систему.
ВВЕДЕНИЕ
Сенсором внутреннего уха являются механочувствительные волосковые клетки, синаптически контактирующие с афферентными и эфферентными нервными волокнами. В нормальном состоянии волосковые клетки выделяют небольшое количество глутамата, который обеспечивает умеренную деполяризацию мембраны и готовность передачи информации от вестибулярных сенсоров в центральную нервную систему. Изменение положения головы сопровождается смещением стериоцилий на апикальной поверхности волосковых клеток, деполяризацией базальной мембраны и выделением нейропередатчика глутамата. Высокоэффективное и точное функционирование аминокислотного синапса вестибулярного эпителия требует многоуровнего механизма модуляции, которая осуществляется за счет влияния метаболитов эфферентной системы, а также посредством локальных модулирующих влияний на уровне синапса, координирующих работу пре- и постсинаптической мембран [1]. Изучение механизмов функционирования афферентного глутаматергического синапса и способов его модуляции связано с необходимостью исследования природы патологических состояний периферического отдела вестибулярного анализатора.
Один из локальных модуляторов синаптической передачи – газообразный внесинаптический мессенджер оксид азота (NO) – легко проникает через мембраны и распространяется по градиенту концентрации. NO синтезируется в тканях при активации синтазы оксида азота (NOS) в присутствии кальмодулина и ионов Са2+ [2–4]. Ключевые звенья пути NO/sGC-/GMP/PKG: фермент, активирующий синтез NO [5, 6] и внутриклеточный рецептор NO (растворимая гуанилатциклаза (sGC)), были выявлены в волосковых рецепторах внутреннего уха [7]. Нейрональная (nNOS) и эндотелиальная (eNOS) изоформы NOS функционируют в нормальных физиологических условиях, а индуцибельная изоформа – при воспалении, действии ототоксических веществ и патологических состояниях (при травме внутреннего уха). В вестибулярном эпителии изоформы nNOS и eNOS выявлены в афферентных и эфферентных нервных волокнах и волосковых клетках [5, 8–10]. Сравнение локализации nNOS и eNOS в волосковых клетках показало, что обе изоформы присутствуют в одной и той же клетке. nNOS локализована преимущественно в апикальной части в стереоцилиях, и обе изоформы обнаружены в цитоплазме волосковых клеток [11]. Важно отметить, что такие факторы, как стресс, гипоксия, повреждение тканей, стероидные гормоны, барбитураты, уровень активности нервной ткани могут существенно регулировать экспрессию nNOS [12].
Эндогенный синтез NO в тканях внутреннего уха доказан при помощи флуоресцентных и иммуноцитохимических методов. На вестибулярном аппарате морской свинки с использованием нового флуоресцентного индикатора зарегистрирован базовый синтез NO и изменение его динамики при аппликации глутамата, NMDA и AMPA, что предполагает участие NO в процессах нормальной синаптической передачи, при эксайтотоксичности и патологических состояниях внутреннего уха [13, 14]. На улитке морской свинки при помощи электрохимического метода и специфического сенсора к NO зарегистрирован синтез NO, который уменьшался в присутствии ингибитора NOS и увеличивался при звуковой нагрузке [15].
Данные сенсорной физиологии свидетельствуют о важной функциональной роли NO в синаптической передаче в структурах внутреннего уха. NO, который является полифункциональной молекулой, повышает уровень фоновой активности афферентных волокон [16, 17], увеличивает амплитуду ответов на механическую стимуляцию [18], модулирует функцию ионотропных глутаматных рецепторов (ИГР) [17], ингибирует активность Са2+- и К+-каналов [19–21], увеличивает концентрацию синаптических пузырьков в синапсе и высвобождение медиатора из пресинаптической мембраны [22, 23]. Согласно нашим предварительным данным донор NO S-нитрозо-N-ацетил-DL-пеницилламин (S-nitroso-N-acetyl-DL-penicillamine, SNAP), относящийся к классу S-нитрозотиолов, может влиять на модуляцию функции метаботропных глутаматных рецепторов (МГР) [24].
Молекулы доноров NO в водном растворе распадаются на два фрагмента, один из которых NO. Доноры различных классов характеризуются различной скоростью высвобождения NO. Для корректной интерпретации полученных результатов и доказательства влияния именно NO (но не второго фрагмента молекулы) на исследуемый феномен принято проводить сравнительное изучение влияния различных классов доноров. Таким образом, цель данной работы состояла в исследовании влияния донора SIN-1 на частоту фоновой активности афферентных волокон и величину ответов агониста МГР ACPD.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводили на лягушках-самцах Rana temporaria весом 20–25 г в осенне-зимний период. Вестибулярный аппарат лягушки является уникальной моделью, позволяющей исследовать механизмы синаптической передачи в бутонообразных окончаниях между волосковой клеткой типа II и афферентным нервным волокном. Опыты проводили на изолированном вестибулярном препарате при комнатной температуре в условиях постоянной перфузии нормальным раствором следующего состава (в мМ): NaCl – 117; KCl – 2.5; NaHCO3 – 1.2; NaH2PO3 · 2H2O – 0.17; CaCl2 – 1.8; глюкоза – 2.5. Хрящевую капсулу с лабиринтом иссекали и помещали для последующего препарирования в камеру, расположенную под объективом бинокулярного микроскопа. Множественную импульсную активность афферентных волокон, контактирующих с рецепторным эпителием заднего полукружного канала, регистрировали при помощи засасывающего стеклянного электрода, что позволяло регистрировать электрическую активность пула афферентных волокон в течение всего эксперимента on-line и контролировать ее на экране осциллографа. Параллельно электрическая активность афферентных волокон преобразовывалась в прямоугольные стандартные импульсы длительностью 2 мс, регистрируемые на компьютере в течение эксперимента при помощи оригинальной программы. Использовали только препараты со стабильным уровнем фоновой активности. Аппликацию растворов осуществляли методом внешней перфузии со скоростью 1 см3/мин. Исследуемые вещества растворяли в нормальном растворе в необходимых концентрациях (рН 7.4). В опытах использовали следующие вещества: ингибитор NOS гидрохлорид метилового эфира N-нитро-L-аргинина (N-nitro-L-arginine methyl ester hydrochloride, L-NAME); донор NO 3-морфолиносиднонимингидрохлорид (3-morpholino-sydnonimine hydrochloride, SIN-1); агонист МГР типа I и II (±)-1-аминоциклопентан-транс-1,3-дикарбоновую кислоту ((±)-1-aminocyclopentane-trans-1,3-dicarboxylic acid (ACPD), Sigma). Раствор донора NO SIN-1 готовили непосредственно перед экспериментом и в течение всего опыта максимально защищали от света. Дозозависимость эффектов L-NAME (1–100 мкМ) и SIN-1 (0.01–100 мкМ) исследовали на одних и тех же препаратах. Временной промежуток между аппликациями составлял не менее 15 мин.
Полученный цифровой материал анализировали off-line. Поскольку афферентные волокна характеризуются фоновой активностью, отражающей выделение глутамата волосковыми клетками, ответ агониста МГР ACPD оценивали как отношение максимальной частоты ответа на предъявление исследуемого вещества к частоте фоновой импульсной активности до его аппликации. Влияние донора NO SIN-1 и ингибитора NO-синтазы L-NAME на функцию МГР оценивали как изменение амплитуды ответа в отсутствие (контроль) и на фоне аппликации SIN-1 и L-NAME. Данные представлены средними значениями и стандартными ошибками M ± SEM. Проводили однофакторный дисперсионный анализ для зависимых переменных ANOVA (Repeated measures) с последующими множественными парными сравнениями (Post hoc test), фактор – стадия процесса (фон/воздействие/восстановление). При отсутствии достаточного материала в стадии восстановления, сравнивали только две стадии с применением t-теста. Все расчеты продублированы ранговым тестом Вилкоксона для зависимых переменных. Статистические решения принимались на 5% уровне значимости. Расчеты проводили с использованием программного комплекса SPSS Inc. Иллюстративный материал готовили с помощью пакета программ MS-Excel.
РЕЗУЛЬТАТЫ
Импульсную активность афферентных волокон, иннервирующих задний полукружный канал вестибулярного аппарата, регистрировали на 82 препаратах. Для активации МГР использовали агонист групп I и II ACPD, так как ранее нами было показано, что в афферентном синапсе вестибулярного аппарата присутствуют MГР групп I и II [25].
Влияние ингибитора NO-синтазы на ответы агониста МГР ACPD. Влияние ингибитора NO-синтазы L-NAME на амплитуду ответов агониста МГР ACPD изучали после 4-минутной перфузии синаптической области раствором L-NAME (1–100 мкМ) (рис. 1). L-NAME в концентрациях 1–10 мкМ был неэффективен, но в концентрации 100 мкМ статистически значимо увеличивал амплитуду ответа агониста МГР ACPD, причем потенциирующий эффект был обратим. (ANOVA F(2.16) = 4.58, p = 0.027), критерий Вилкоксона 0.021. р < 0.05; n = 10).
Рис. 1.
Влияние различных концентраций ингибитора NO-синтазы L-NAME на амплитуду ответа агониста МГР trans-ACPD (50 мкМ). а – Оригинальная запись эксперимента, L-NAME 100 мкМ. По оси абсцисс – время, с; по оси ординат – средняя частота импульсной активности, имп/с. б – Суммарная гистограмма, иллюстрирующая изменение амплитуды ответа агониста МГР ACPD после ингибирования NO-синтазы раствором L-NAME в различных концентрациях. По оси ординат – амплитуда ответа агониста МГР ACPD в нормальном растворе и после 3–4-минутного ингибирования NO-синтазы. По оси абсцисс – концентрация ингибитора NO-синтазы L-NAME: слева направо – ACPD-контроль, ACPD на фоне L-NAME. Здесь и далее * – статистически значимые отличия от контрольного уровня, p ≤ 0.05.
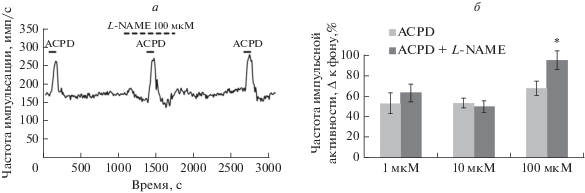
Вывод: ингибирование NO-синтазы приводило к увеличению амплитуды ответа агониста МГР ACPD, что увеличивало соотношение сигнал–шум.
Влияние донора NO SIN-1 на уровень фоновой активности aфферентных волокон и на ответы агониста МГР ACPD. Изучали влияние донора NO SIN-1 на уровень фоновой активности в диапазоне концентраций 0.01–100 мкМ. Применение однофакторного дисперсионного анализа выявило значимое влияние SIN на уровень фоновой активности (ANOVA F(4.28) = 3.377; p = 0.022, η2 = 0.325).
Перфузия синаптической области раствором SIN-1 вызывала увеличение уровня фоновой активности афферентных волокон. Динамика возбуждающего ответа широко варьировала от опыта к опыту. В ряде экспериментов после первоначального повышения уровня фоновой активности наблюдалось уменьшение частоты импульсных разрядов афферентных волокон на фоне продолжающейся аппликации SIN-1. Кривая доза–ответ для донора NO носила волнообразный характер (рис. 2). Пороговая концентрация составляла 0.01 мкМ. Повышение частоты фоновой активности было максимальным в присутствии 10 мкМ SIN-1. Значимые различия в средних величинах ответов наблюдались при концентрации 0.01 и 0.1 мкМ (Post hoc 0.004) и 0.01 и 10 мкМ (Post hoc 0.037). Тенденция к различию амплитуд ответов отмечена в концентрациях 1 и 10 мкМ (Post hoc 0.097) и 10 и 100 мкМ (Post hoc 0.097). После длительной перфузии синаптической области растворами донора NO в высокой концентрации не наблюдали восстановления первоначального уровня фоновой активности.
Рис. 2.
Влияние различных концентраций донора NO SIN-1 на уровень фоновой активности афферентных волокон, контактирующих с задним полукружным каналом вестибулярного аппарата лягушки. а – Оригинальная запись эксперимента. б – Кривая доза–ответ при перфузии синаптической области растворами донора NO SIN-1. По оси абсцисс – концентрация SIN-1. По оси ординат – увеличение частоты фоновой активности афферентных волокон в % по отношению к уровню фоновой активности, регистрируемой до начала аппликации вещества, фон 100%.
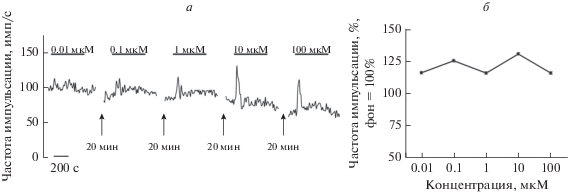
В наших опытах и SIN-1, и ACPD увеличивали импульсную активность афферентных волокон. Чтобы отделить стимулирующий эффект SIN-1 на фоновую активность от возбуждающего эффекта NO на ответы агониста МГР ACPD в суммарноме афферентном потоке применяли следующий экспериментальный протокол. Вначале регистрировали реакцию афферентных волокон на аппликацию агониста МГР ACPD (контроль). После возвращения импульсной активности к исходному уровню синаптическую область перфузировали раствором SIN-1, а аппликацию агониста МГР ACPD проводили после регистрации максимального ответа на аппликацию донора NO. Результаты этой серии опытов представлены на рис. 3.
Рис. 3.
Влияние донора NO SIN-1 на величину ответа агониста МГР ACPD. а – Oригинальная запись эксперимента. б – Суммарная гистограмма, отражающая ингибирование ответа агониста МГР ACPD на фоне развития ответа донора NO SIN-1. По оси абсцисс слева направо – ACPD контроль, ACPD после кратковременной аппликации SIN-1, ACPD – восстановление через 15 мин; по оси ординат величина ответа ACPD, среднее ± ошибка среднего.
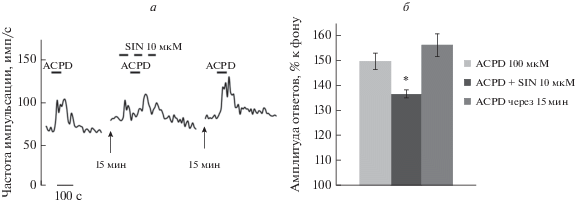
Донор NO SIN-1 статистически значимо уменьшал величину ответа агониста МГР ACPD. Отношение среднего значения максимальной амплитуды ответа к фоновой активности в норме составляло 141.89 ± 2.7, а на фоне аппликации 1 мкМ SIN-1 – 130.8 ± 4.3. Наблюдаемые различия были статистически значимыми (t-тест p = = 0.036; n = 15, р < 0.05; Вилкоксон р = 0.023). Величина ответа агониста МГР ACPD на фоне действия 10 мкМ SIN-1 статистически значимо изменялась от 149 ± 4.2 до 136.5 ± 2.1 (t-тест p = = 0.002; n = 14, р < 0.05; Вилкоксон р = 0.004). Повышение концентрации донора NO на порядок не повлияло на величину ингибирующего эффекта. Амплитуда ответа восстанавливалась в нормальном растворе.
ОБСУЖДЕНИЕ
Эффективность сигнала от вестибулярных органов в ЦНС определяется соотношением фоновой и вызванной активности. МГР локализованы на пре- и постсинаптической мембранах афферентного синапса [25, 26] и наряду с ИГР участвуют в формировании вызванной активности. Наши данные свидетельствуют о том, что и положительные, и отрицательные колебания концентрации NO влияют на функцию МГР. Как уже сказано, NO синтезируется в вестибулярном эпителии в широком диапазоне концентраций в нормальных и патологических условиях. На вестибулярном эпителии саккулюса лягушки при помощи специфического флуоресцентного зонда выявлен фоновый синтез NO, его значительное понижение в присутствии L-NAME, антагониста нейрональной и эндотелиальной NO-синтазы [27]. Поскольку иммунологическими методами NOS выявлена в волосковых рецепторах и в афферентных волокнах, можно предположить, что в наших опытах ингибитор NOS влиял на пре- и постсинаптические мембраны. На пресинаптическом уровне L-NAME уменьшал активность фермента, что могло приводить к подавлению синтеза NO, активирующего выделение медиатора глутамата. Нами показано депрессивное влияние ингибитора NOS на активность постсинаптичекой мембраны афферентного синапса вестибулярного эпителия в условиях блокады пресинаптической мембраны гипермагниевым–гипокальциевым раствором. В этих опытах восстановленный L-глутаматом уровень импульсной активности постсинаптической мембраны понижался в присутствии L-NAME [28].
В наших опытах подавление синтеза NO ингибитором нейрональной и эндотелиальной NO-синтазы L-NAME увеличивало амплитуду ответов агониста МГР ACPD. Потенцирующий эффект наблюдался только при высоких концентрациях ингибитора. Низкая чувствительность ответов МГР к ингибитору NOS предполагает, что негативные колебания уровня NO не оказывают существенного влияния на механизм формирования ответов перисинаптически локализованных МГР [29]. Важно отметить, что ингибитор NOS разнонаправленно действовал на фоновую активность афферентных волокон и на ответы МГР. Значительные различия в чувствительности ответов МГР и фоновой активности на аппликацию L-NAME могут объясняться до сих пор недостаточно изученными различиями в механизмах формирования фоновой и вызванной активности [1]. Согласно концепции Hendricson и Guth, фоновая активность формируется за счет активации ИГР без участия МГР [30]. Однако эта гипотеза не согласуется с данными, согласно которым ингибирование фоновой активности афферентных волокон наблюдается при воздействии антагониста МГР групп I и II MCPG [25] и ингибитора рецепторов IP3 2APB [31].
Нами не обнаружены данные о влиянии ингибиторов NOS на функцию МГР. Увеличение амплитуды ответов на аппликацию глутамата и агонистов ИГР мы наблюдали и ранее в условиях подавления активности NO-синтазы неспецифическим ингибитором L-NAME [17].
Молекулы доноров NO в водном растворе диссоциируют на два фрагмента, один из которых NO. Доноры NO достаточно хорошо изучены. S-сиднонимины (к которым относится SIN-1), относительно устойчивые в условиях затемнения, высвобождаются при физиологических значениях рН, менее токсичны, чем нитрозотиолы [32], и традиционно используются в качестве доноров NO в физиологических экспериментах [33, 34]. Показано, что SIN-1 может оказывать разнонаправленное действие на фоновую активность нейронов в различных экспериментальных моделях. На мотонейронах nucleus ambiguous гортани SIN-1 или увеличивал, или уменьшал, или не влиял на уровень фоновой активности [35]. В то же время SIN-1 подавлял фоновую активность нейронов среднего мозга [36]. В наших опытах SIN-1 оказывал позитивное волнообразное влияние на уровень фоновой активности, а его эффект мало зависел от концентрации. Аналогичная концентрационная кривая влияния SIN-1 на фоновую активность афферентных волокон и на амплитуду механически вызванных ответов получены на вестибулярном аппарате аксолотля [16], где позитивное модулирующее влияние донора на механически вызванные ответы было наибольшим при его концентрации 10 мкМ.
Сравнение характера влияния доноров NO SIN-1 и SNAP на фоновую активность афферентных волокон показывает, что оба донора в низких концентрациях увеличивали частоту фоновой активности, которая уменьшалась на фоне аппликации донора. В диапазоне низких концентраций доноров дозозависимый эффект отсутствовал [28]. Однако при аппликации высоких концентраций SNAP в ряде экспериментов за положительной фазой ответа следовало развитие второй негативной волны, амплитуда и длительность которой варьировала от опыта к опыту. Понижение частоты фоновой активности при аппликации SIN-1 было менее выражено и выявлено в небольшом числе опытов. Различия в развитии негативной фазы ответа могут быть связаны с различной химической реактивностью и кинетикой высвобождения NO у доноров разных классов [37]. Выраженного дозозависимого влияния доноров NO SIN-1 и SNAP на уровень фоновой активности афферентных волокон не выявлено также на вестибулярном аппарате аксолотля [16].
В наших экспериментах SIN-1 подавлял ответы агониста МГР ACPD. Ранее мы показали, что донор NO SNAP в одинаковой степени подавлял ответы агониста МГР групп I и II ACPD и агониста группы I МГР DHPG [24, 38], а ингибирующий эффект SNAP на ответы агониста МГР ACPD исчезал после 20-минутной предынкубации препарата в растворе ODQ – специфического ингибитора sGC [39]. В малых концентрациях SIN-1 и SNAP оказывали аналогичное влияние на уровень фоновой активности афферентных волокон и амплитуду ответа агониста МГР ACPD. Принимая во внимание отсутствие депрессивного влияния SNAP на функцию МГР в условиях ингибирования sGC и данных об отсутствии статистически значимых различий во влиянии доноров SIN-1 и SNAP, можно предположить, что ингибирование функции МГР обусловлено именно NO. Это предположение требует дополнительных исследований c использованием ингибитора sGC ODQ и скавенджера NO.
Наши эксперименты позволяют сделать вывод о том, что NO оказывает разнонаправленное действие на фоновую активность афферентных волокон и активность МГР, что существенно модифицирует сигнал, поступающий в центральную нервную систему от вестибулярных органов. Действительно, аппликация доноров NO в синаптическую область вызывает увеличение частоты фоновой активности афферентных волокон, которая, согласно гипотезе Guth и соавт. [1], обусловлена фоновым выделением медиатора глутамата волосковыми клетками. Изменение выхода различных медиаторов в присутствии NO в центральной и периферической нервной системе показано на различных экспериментальных моделях. NO модулировал выход ацетилхолина в нейромышечном синапсе [40, 41], увеличивал экзоцитоз GABA [42–45], глутамата [46, 47], но ингибировал выход глицина [44]. На культуре тканей кортикальных нейронов с помощью высокоэффективной жидкостной хроматографии показано увеличение выделения медиаторов аспартата, глутамата, глицина и GABA в присутствии донора NO SNAP. Повышение уровня выделения медиаторов подавлялось специфическим ингибитором sGC ODQ и скавенджером NO с-PTIO, что свидетельствует о специфичности реакции [23].
Учитывая, что в структурах внутреннего уха фоновая активность афферентных волокон отражает выделение медиатора глутамата волосковыми клетками [1], можно предположить, что NO стимулирует фоновый выход глутамата из волосковых рецепторов и поддерживает функциональную готовность постсинаптической мембраны. Выход глутамата из пресинаптической мембраны в присутствии ретроградного мессенджера NO рассматривается как один из механизмов синаптической пластичности [48].
МГР делятся на три группы в зависимости от структуры, фармакологических характеристик и связи с сигнальными каскадами вторичных посредников. Функция различных групп МГР в вестибулярном аппарате изучена недостаточно. В вестибулярном аппарате иммуноцитохимическими и электрофизиологическими методами выявлены только МГР групп I и II. Показано, что МГР группы I активируют фосфолипазу С, что приводит к выходу Са2+ из внутриклеточного депо с участием рецепторов рианодина и инозитолтрифосфата [25, 26, 30, 31, 49], локализованных в волосковых клетках [31, 50]. При механическом адекватном раздражении группа I МГР участвует в формировании положительной обратной связи, увеличивая контраст между фоновой и вызванной активностью [30]. МГР группы II выявлены иммуноцитологически [25], но их функция в вестибулярном эпителии остается совершенно неизученной, а МГР группы III не обнаружены [26]. Наши опыты показали, что функция МГР может модулироваться оксидом азота, поскольку амплитуда ответа на аппликацию ACPD и DHPG, агонистов МГР, значимо уменьшается на фоне аппликации доноров NO SNAР и SIN-1 [24, 38]. В этой связи модуляция функции рецепторов рианодина и инозитолтрифосфата волосковых клеток NO представляет особый интерес. Влияние NO на функцию МГР может осуществляться на пре- и постсинаптическом уровне, так как локализация NOS и МГР типа I и II выявлена в волосковых клетках и ганглиях Скарпа [25, 26, 30, 49].
Принято считать, что NO оказывает свое модулирующее действие при помощи двух основных механизмов: путем прямого взаимодействия NO с белками (реакция нитрозилирования) и посредством взаимодействия со специфическим цитозольным рецептором NO – растворимой гуанилатциклазой (путь NO/sGC/cGMP/PKG). Прямых данных о модулирующем влиянии NO на функцию МГР нам обнаружить не удалось.
Можно предположить, что одним из возможных механизмов влияния NO на функцию МГР является модуляция активности сигнального каскада, запускаемого МГР за счет изменения уровня IP3 или фосфорилирования рецепторов IP3 эндоплазматического ретикулума. На интактных клетках и микросомах гладкой мускулатуры кишечника показано, что активация PKG приводила к фосфорилированию рецепторов IP3, что уменьшало выход Са2+ из саркоплазматического ретикулума [51].
На культуре клеток СOS-7 при помощи флуоресцентного метода показано, что выход Са2+ из внутриклеточного депо, инициируемый брадикинином, существенно подавлялся в условиях предынкубации комплекса IRAG и киназы сGKIβ с аналогом cGMP 8-pCPT-cGMP [52, 53]. Эти данные указывают на то, что активация каскада NO/sGC/cGMP модулирует выход Са2+ из внутриклеточного депо, активируемый метаботропными рецепторами брадикинина.
На ооцитах китайского хомячка показано, что активация cGMP-зависимой киназы приводила к уменьшению синтеза IP3, стимулируемого тромбином, и, следовательно, к понижению выхода Са2+ [54]. Предполагается, что cGMP-зависимая киназа может понижать уровень внутриклеточного Са2+ не только путем подавления синтеза IP3, но и в результате влияния на протеинкиназу С, что может рассматриваться как механизм, направленный против эксайтотоксичности.
Функция МГР может модулироваться NO и за счет изменения активности рецепторов рианодина путем прямого присоединение NO. Показано, что функция рецепторов рианодина зависела от концентрации внутриклеточного Са2+ и модулировалась ATP, Mg2+, кальмодулином и NO [55]. Причем вектор влияния NO на рецепторы рианодина зависел от мембранного потенциала и концентрации донора NO. Частота открывания Са2+-канала стимулировалась низкими концентрациями донора NO и уменьшалась при его высоких концентрациях [56]. Процесс нитрозилирования рианодиновых кальциевых каналов показан на клетках Пуркинье [57–59].
Процесс синаптической передачи между нервными клетками формируется за счет быстрой и медленной волн возбуждения. Быстрая деполяризация синаптической мембраны активирует каналы плазматической мембраны и вызывает вход Са2+ в клетку за счет активации потенциал-зависимых Са2+-каналов. Пролонгирование волны возбуждения осуществляется при активации МГР и сопровождается выходом Са2+ из цистерн эндоплазматического ретикулума.
Наши данные позволяют сделать вывод о модулирующем влиянии NO на функцию МГР, что выражается в модификации второй волны возбуждения. Изменение соотношения уровня фоновой и вызванной активности при воздействии NO служит важным механизмом регуляции пластичности афферентного аминокислотного синапса и контроля уровня афферентного потока от вестибулярных органов в центральную нервную систему.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 годы (ГП-14, раздел 64), поддержана грантом РФФИ № 14-04-00409.
Список литературы
Guth P.S., Perin P., Norris C.H., Valli P. 1998. The vestibular hair cells: Post-transductional signal processing. Prog. Neurobiol. 54, 193–247.
Garthwaite J., Boulton C. 1995. Nitric oxide signaling in the central nervous system. Annu. Rev. Physiol. 57, 683–706.
Garthwaite J. 2010. New insight into the functioning of nitric oxide-receptive guanylyl cyclase: Physiological and pharmacological implications. Mol. Cell. Biochem. 334, 221–232.
Martines-Ruiz A., Cadenas S., Lamas S. 2011. Nitric oxide signaling: Classical, less classical, and nonclassical mechanisms. Free Radic. Biol. Med. 51, 17–29.
Hess A., Bloch W., Arnhold S., Andressen C., Stennert E., Addicks K., Michel O. 1998. Nitric oxide synthase in the vestibulocochlear system of mice. Brain Res. 813, 97–102.
Hess A., Bloch W., Su J., Stennert E., Addicks K., Michel O. 1998. Localization of the nitric oxide (NO)/cGMP-pathway in the vestibular system of guinea pigs. Neurosci. Lett. 251, 185-188.
Heinrich U-R., Maurer J., Koesling D., Mann W., Förstermann U. 2000. Immuno-electron microscopic localization of the α1- and β1-subunits of soluble guanylylcyclase in the guinea pig organ of Corti. Brain Res. 885, 6–13.
Lysakowski A., Singer M. 2000. Nitric oxide synthase localized in a subpopulation of vestibular efferents with NADPH diaphorase histochemistry and nitric oxide synthase immunohistochemistry. J. Comp. Neurol. 427, 508–521.
Takumida M., Anniko M. 2004. Functional significance of nitric oxide in the innar ear. In vivo. 18, 345–350.
Takumida M., Anniko M. 1998. Localization of nitric oxide synthase isoforms (NOS I, II and III) in the vestibular end organs of the guinea pig. ORL J. Otorhinolaryngol. Relat. Spec. 60, 67–72.
Heinrich U.-R., Liouduno M., Maurer J., Mann W., Guth P., Förstermann U. 2003. Localization of the two constitutively expressed nitric oxide synthase isoforms (nNOS and eNOS) in the same cell types in the saccule maculae of the frog Rana pipiens by immunoelectron microscopy; evidence for a back-up system? J. Electron Microsc. 52 (2), 197–206.
Boissel J.-P., Schwarz P.M., Fӧrstermann U. 1998. Neuronal-type NO synthase: transcript diversity and expressional regulation. Nitric Oxide. 2 (5), 337–349.
Takumida M., Anniko M. 2000. Direct evidence of nitric oxide production in guinea pig vestibular sensory cells. Acta Otolaryngol. 120, 34–38.
Takumida M., Anniko M. 2000. Glutamate induced production of nitric oxide in guinea pig vestibular sensory cells. Acta Otolaryngol. 120, 466–472.
Shi X., Ren T., Nuttall A.L. 2002. The electrochemical and fluorescence detection of nitric oxide in the cochlea and its increase following loud sound. Hear. Res. 164, 49–58.
Flores A., Vega R., Soto E. 2001. Nitric oxide in the afferent synaptic transmission of the axolotl vestibular system. Neurosci. 103, 457–464.
Андрианов Ю.Н., Рыжова И.В., Тобиас Т.В. 2012. Оксид азота как модулятор афферентной синаптической передачи полукружных каналов лягушки. Сенс. сист. 26 (3), 204–213.
Flores A., Leon-Olea M., Vega R., Soto E. 1996. Histochemistry and role of nitric oxide synthase in the amphibian (Ambystoma tigrinum) inner ear. Neurosci. Lett. 205, 131–134.
Almanza A., Navarrete F., Vega R., Soto E. 2007. Modulation of voltage-gated Ca+2 current in vestibular hair cells by nitric oxide. J. Neurophysiol. 97, 1188–1195.
Chen J., Eatock R. 2000. Major potassium conductance in type I hair cells from rat semicircular canals: Characterization and modulation by nitric oxide. J. Neurophysiol. 84, 139–151.
Behrend O., Schwark C., Kunihiro T., Strupp M. 1997. Cyclic GMP inhibits and shifts the activation curve of the delayed rectifier (IK1) of type I mammalian vestibular hair cells. Neuroreport. 8, 2687–2690.
Palmer Z.J., Duncan R.R., Johnson J.R., Lian L.Y., Mello L.V., Booth D., Barclay J.W., Graham M.E., Burgoyne R.D., Prior I.A., Morganet A. 2008. S-nitrosylation of syntaxin 1 at Cys(145) is a regulatory switch controlling Munc18-1 binding. Biochem. J. 413, 479–491.
Merino J.J., Arce C., Naddaf A., Bellver-Landete V., Oset-Gasque M.J., Pilar Gonzalez M.P. 2014. The nitric oxide donor SNAP-induced amino acid neurotransmitter release in cortical neurons. effects of blockers of voltage-dependent sodium and calcium channels. PLOS ONE. 9 (3), 1–8.
Рыжова И.В., Ноздрачев А.Д., Тобиас Т.В., Орлов И.В., Чихман В.Н., Солнушкин С.Д. 2016. Метаботропные глутаматные рецепторы как мишень нейромодулирующего влияния оксида азота. ДАН. 469 (1), 116–118.
Andrianov G.N., Puyal J., Raymond J., Venteo S., Dememes D., Ryzhova I.V. 2005. Immunocytochemical and pharmacological characterization of metabotropic glutamate receptors of the vestibular end organs in the frog. Hear. Res. 204, 200–209.
Guth P.S., Holt J.C., Perin P., Athas G., Garcia M., Puri A., Zucca G., Botta L., Valli P. 1998. The metabotropic glutamate receptors of the vestibular organs. Hear. Res. 125, 154–162.
Lv P., Rodriguez-Contreras A., Kim H.J., Zhu J., Wei D., Choong-Ryoul S., Eastwood E., Mu K., Levic S., Song H., Petrov Y.Y., Smith P.J.S., Yamoah E.N. 2010. Release and elementary mechanisms of nitric oxide in hair cells. J. Neurophysiol. 103, 2494–505.
Андрианов Ю.Н., Рыжова И.В., Тобиас Т.В. 2011. Функциональная роль оксида азота в механизме афферентной синаптической передачи полукружных каналов лягушки. Сенс. сист. 25 (4), 297–304.
Lujan R., Roberts J.D.B., Shigemoto R., Ohishi H., Somogyi P. 1997. Differential plasma membrane distribution of metabotropic glutamate receptors mGluR1, mGluR2 and mGluR5, relative to neurotransmitter release sites. J. Chem. Neuroanat. 13, 219–241.
Hendricson A.W., Guth P.S. 2002a. Signal discrimination in the semicircular canals: a role for group I metabotropic glutamate receptors. Neuroreport. 13, 1765–1768.
Rossi M.L., Prigioni I., Gioglio L., Rubbini G., Russo G., Martini M., Farinelli F, Rispoli G., Fesce R. 2006. IP3 receptor in the hair cells of frog semicircular canal and its possible functional role. Eur. J. Neurosci. 23, 1775–1783.
Babich H., Zuckerbraun H.L. 2001. In vitro cytotoxicity of glyco-S-nitrosothiols. a novel class of nitric oxide donors. Toxicol. in vitro. 15 (3), 181–190.
Singh R.J., Hogg N., Joseph J., Kalyanaraman B. 1996. Mechanism of nitric oxide release from S-nitrosothiols. J. Biol. Chem. 271 (31), 18 596–18 603.
Ullrich T., Oberle S., Abate A., Schroder H. 1997. Photoactivation of the nitric oxide donor SIN-1. FEBS Lett. 406, 66–68.
Yajima Y., Hayashi Y., Hayakawa T. 2000. Paradoxical actions of the NO donor SIN-1 on single laryngeal motoneurons in the nucleus ambiguus. Neuroreport. 11 (4), 765–769.
Lovick T.A., Key B.J. 1996. Inhibitory effect of nitric oxide on neuronal activity in the periaqueuctal grey matter of the rat. Exp. Brain Res. 108, 382–388.
Feelisch M. 1998. The use of nitric oxide donors in pharmacological studies. Naunyn Schmiedebergs Arch. Pharmacol. 358 (1), 113–122.
Рыжова И.В., Ноздрачев А.Д., Тобиас Т.В., Вершинина Е.А. 2018. Растворимая гуанилатциклаза как ключевой фермент в модулирующем влиянии NO на метаботропные глутаматные рецепторы. Acta Naturae. 10 (2), 76–84.
Garthwaite J., Southam E., Boulton C.L., Nielsen E.B., Schmidt K., Mayer B. 1995. Potent and selective inhibition of nitric oxide-sensitive guanylyl cyclase by 1H-[1,2,4]oxadiazolo[4,3-a]quinoxalin-1-one. Mol. Pharmacol. 48, 184–188.
Gustafsson L.E., Wiklund C.U., Wiklund N.P., Persson M.G., Moncada S. 1990. Modulation of autonomic neuron effector transmission by nitric oxide in guinea pig illeon. Biochem. Biophys. Res. Commun. 173, 106–110.
Nickels T.J., Reed G.W., Drummond J.T., Blevins D.E., Lutz M.C., Wilson D.F. 2007. Does nitric oxide modulate transmitter release at the mammalian neuromuscular junction? Clin. Exp. Pharmacol. Physiol. 34, 318–326.
Kuriyama K., Ohkuma S. 1995. Role of nitric oxide in central synaptic transmission: effects on neurotransmitter release. Jpn. J. Pharmacol. 69, 1–8.
Ohkuma S., Narihara H., Katsura M., Hasegawa T., Kuriyama K. 1995. Nitric oxide-induced [3H]GABA release from cerebral cortical neurons is mediated by peroxynitrite. J. Neurochem. 65, 1109–1114.
Yu D., Eldred W.D. 2005. Nitric oxide stimulates γ-aminobutyric acid release and inhibits glycine release in retina. J. Comp. Neurol. 483 (3), 278–291.
Garthwaite J. 2008. Concepts of neural nitric oxide-mediated transmission. Eur. J. Neurosci. 27, 2783–2802.
Lonart G., Wang J., Johnson K.M. 1992. Nitric oxide induces neurotransmitter release from hippocampal slices. Eur. J. Pharmacol. 220 (2–3), 271–272.
Rieke F., Schwartz E.A. 1994. A cGMP-gated current can control exocytosis at cone synapses. Neuron. 13, 863–873.
Hardingham N., Dachtler J., Fox K. 2013. The role of nitric oxide in pre-synaptic plasticity and homeostasis. Front. Cell. Neurosci. 7, 190.
Hendricson A.W., Guth P.S. 2002b. Transmitter release from Rana pipiens vestibular hair cells via mGluR: A role of intracellular Ca2+ release. Hear Res. 172, 99–109.
Lelli A., Perin P., Martini M., Ciubotaru C.D., Prigioni I., Valli P., Rossi M.L., Mammano F. 2003. Presynaptic calcium stores modulate afferent release in vestibular hair cells. J. Neurosci. 23 (17), 6894–6903.
Murthy K.S., Zhou H. 2003. Selective phosphorylation of the IP3R-I in vivo by cGMP-dependent protein kinase in smooth muscle. Am. J. Physiol. Gastrointest. Liver Physiol. 284, 221–230.
Schlossmann J., Ammendola A., Ashman K., Zong H., Huber A., Neubauer G., Wang G.-X., Allescher H.D., Korth M., Wilm M., Hofmann F., Ruth P. 2000. Regulation of intracellular calcium by a signalling complex of IRAG, IP3 receptor and cGMP kinase Ibeta. Nature. 404, 197–201.
Schlossmann J., Desch M. 2011. IRAG and novel PKG targeting in the cardiovascular system. Am. J. Physiol. Heart Circ. Physiol. 301, 672–682.
Ruth P., Wang G-X, Boekhofft I., May B., Pfeir A., Pennert R., Korth M., Breer H., Hofmann F. 1993. Transfected cGMP-dependent protein kinase suppresses calcium transients by inhibition of inositol 1,4,5-trisphosphate production. Proc. Natl. Acad. Sci. USA. 90, 2623–2627.
Fill M., Copello J.A. 2002. Ryanodine receptor calcium release channels. Physiol. Rev. 82, 893–922.
Hart J.D.E., Dulhunty A.F. 2000. Nitric oxide activates or inhibits skeletal muscle ryanodine receptors depending on its concentration, membrane potential and ligand binding. J. Membr. Biol. 173, 227–236.
Kakizawa S. 2013. Nitric oxide-induced calcium release: activation of type 1 ryanodine receptor, a calcium release channel, through non-enzymatic post-translational modification by nitric oxide. Front. Endocrinol. 4, 1–6.
Kakizawa S., Yamazawa T., Iino M. 2013. Nitric oxide-induced calcium release. Channels. 7, 1–5.
Stoyanovsky D., Murphy T., Anno P.R., Kim Y.-M., Salama G. 1997. Nitric oxide activates skeletal and cardiac ryanodine receptors. Cell Calcium. 21 (1), 19–29.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


