Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 2, стр. 90-100
Моделирование начальной стадии слияния вируса гриппа с липосомами
Р. Ю. Молотковский a, *, Т. Р. Галимзянов b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, стр. 5, Россия
b Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский просп., 4, Россия
* E-mail: rodion.molotkovskiy@gmail.com
Поступила в редакцию 03.12.2018
После доработки 03.12.2018
Принята к публикации 07.12.2018
Аннотация
Начальная стадия вирусного инфицирования – слияние мембран вируса и клетки-мишени – до сих пор является нетривиальной системой для анализа в силу большого числа параметров, влияющих на этот процесс, а также из-за небольших размеров области слияния, долгое время затруднявших экспериментальное исследование этого процесса. Ряд опубликованных недавно работ позволил определить особенности геометрической структуры сливающихся мембран, встраивания белков слияния в монослои мембран, а также определить зависимость эффективности слияния от состава мембраны. Основываясь на новейших экспериментальных данных, на базе теории упругости липидных мембран мы построили модель слияния, позволяющую количественно описать современные экспериментальные результаты: вычислить энергетический барьер, необходимый для обеспечения плотного контакта сливающихся мембран, определяющего эффективность слияния. Это позволяет адаптировать имеющуюся теорию слияния к данным результатам и впервые получить количественное соответствие влияния состава мембраны клетки-мишени на высоту энергетического барьера слияния.
ВВЕДЕНИЕ
Вирус гриппа до сих пор представляет одну из серьезнейших проблем здравоохранения и экономики [1]. Высокая скорость мутации вирусных белков значительно усложняет поиск эффективных вакцин, направленных на уменьшение скорости воспроизводства вируса. Ключевым этапом вирусной инфекции является слияние липидных мембран вируса и клетки-мишени [2]. Поэтому исследование слияния мембран в процессе вирусного инфицирования может помочь созданию возможных лекарств, останавливающих инфекцию в самом ее начале.
Согласно общепринятой теории, слияние мембран происходит в несколько этапов [3, 4]. Сначала происходит локальное сближение мембран до расстояния порядка 1–2 нм. Затем мембраны сливаются, что приводит к образованию сталка – структуры, в которой контактные монослои слились, а дистальные – еще нет. После этого сталк расширяется и возникает диафрагма полуслияния, в которой слились оба монослоя. Слияние завершается, когда в диафрагме полуслияния образуется гидрофильная пора и водные объемы, разделенные мембраной, объединяются. Для того, чтобы осуществить каждый из этих этапов, необходимо преодолеть энергетические барьеры, связанные с топологической перестройкой мембран [5]. Энергетический барьер является ключевой характеристикой процесса, поскольку он определяет эффективность соответствующего процесса. Различные теоретические оценки дают для рассматриваемых барьеров величины в несколько десятков kBT (kBT ~ 10–21 Дж) [5–9]. В случае вирусной инфекции высота барьеров понижается специфическими вирусными белками, называемыми белками слияния [10]. Наиболее хорошо изучен белок слияния вируса гриппа гемагглютинин (ГА). Известно, что ГА является тримером, каждый мономер которого имеет три домена: трансмембранный домен, внедренный в вирусную мембрану, пептид слияния, внедряющийся в мембрану клетки-мишени, и эктодомен, соединяющий их [11]. В процессе слияния ГА претерпевает конформационный переход, в результате которого пептиды слияния и трансмембранные домены оказываются сведены воедино [12], в результате чего мембраны стягиваются вместе и сливаются. Кроме того, показано, что в единичном акте слияния участвует несколько белков, которые кооперативно изгибают мембрану [5, 13, 14]. Эти белки организуют так называемую розетку слияния [15].
Из трех перечисленных этапов слияния наибольший интерес вызывает образование сталка, поскольку данный процесс характеризуется большим числом параметров и наиболее сложен с топологической точки зрения. Вплоть до последнего времени большинство геометрических и физических характеристик этого процесса были известны весьма приближенно, что существенно затрудняло оценку соответствующего энергетического барьера. В ряде недавних работ слияние вируса гриппа с липосомами было визуализировано методом криоэлектронной микроскопии с субнанометровым разрешением [16–18]. Это позволило получить изображения интермедиатов слияния, в частности, сталка и тем самым оценить ряд его геометрических характеристик. В частности, в этих работах продемонстрировано, что мембраны вируса и клетки-мишени деформируются несимметрично; именно, при образовании сталка мембрана вируса практически не деформировалась. Известно, что вирус гриппа имеет под липидной мембраной каркас из белков М1, увеличивающий жесткость мембраны [19]. В процессе слияния белковый каркас разрушается, в результате чего, в частности, вирусная мембрана теряет свою повышенную жесткость [20]. Однако вплоть до недавнего времени не было понятно, в какой момент происходит разрушение каркаса – до образования сталка или после. Эксперименты [16] позволяют заключить, что в процессе образования сталка белковый каркас еще не разрушен, что необходимо учитывать при оценке величины энергетического барьера. Более того, согласно данной работе в начале конформационной перестройки эктодомены ГА удлиняются относительно своего начального состояния, что позволяет внедрить пептиды слияния в далеко отстоящую мембрану.
Далее, нами использованы уточненные данные о характере воздействия ГА на сливающиеся мембраны. Считается, что ГА понижает энергетический барьер по двум механизмам [21, 22]. Во-первых, внедрение пептидов слияния в мембрану клетки-мишени приводит к смещению углеводородных хвостов липидов и, как следствие, к ее локальному искривлению. Во-вторых, в процессе конформационной перестройки белок передает усилие через трансмембранный домен непосредственно на мембрану. Данные, полученные в работе [23], позволяют оценить величину спонтанной кривизны, индуцируемой пептидами слияния в мембране клетки-мишени, а данные, полученные в работе [24] – изменение энергии ГА в процессе его конформационной перестройки.
Наибольший интерес вызывает зависимость эффективности слияния от состава мембраны клетки-мишени [17, 25]. Приводимые в этих работах результаты позволяют напрямую оценить изменение высоты энергетического барьера при варьировании состава мембраны. Это изменение, в свою очередь, может быть описано в рамках рассматриваемой нами модели. Следует отметить, что влияние состава мембраны на слияние вирусных частиц с липосомами оказалось менее выраженным, чем в ранних экспериментах [26], по-видимому, ввиду использования в последних вместо вирусных частиц красных кровяных телец, экспрессирующих гемаглютинин (HAb2).
Таким образом, недавно полученные данные позволяют определить большую часть параметров, влияющих на образование сталка. Это позволяет уточнить теоретическую модель данного процесса и получить значения тех характеристик, которые в эксперименте не определяются или определяются недостаточно точно. Среди последних наиболее важную роль играет равновесное расстояние H0 между мембранами вирусной частицы и клетки-мишени, а также сила Fprot, развиваемая белками слияния в направлении сближения мембран. В рамках данной работы мы рассчитывали зависимость эффективности слияния от доли холестерина в мембране [17], варьируя наименее поддающиеся оценке параметры системы, и построили модель, количественно описывающую экспериментальные данные.
Для расчетов мы используем метод теории упругости жидкокристаллической среды, адаптированной к липидным мембранам. Ранее этот метод был успешно применен для теоретического описания таких процессов, как слияние [6, 7], деление [27], порообразование [28–30] и фазовое разделение в мембранах [31–34]. Согласно данному методу, мембрана рассматривается как сплошная упругая среда, подверженная деформациям, определяющим функционал энергии системы. Минимизация функционала с учетом граничных условий, налагаемых геометрией системы, позволяет определить равновесную свободную энергию, соответствующую этой геометрии. Зависимость свободной энергии от координаты реакции позволяет получить энергетический барьер образования сталка. В дальнейшем мы анализируем зависимость барьера от ключевых характеристик системы, в частности, от липидного состава мембраны клетки-мишени.
МАТЕРИАЛЫ И МЕТОДЫ
Вирусная и клеточная мембраны имеют радиус кривизны более 50 нм, что значительно больше характерной длины затухания деформаций (~1 нм), поэтому в этой работе мы будем считать мембраны плоскими вдали от белков слияния. Рассмотрим два плоских параллельных бислоя с внедренными в них доменами ГА. Вирусная мембрана содержит трансмембранные домены ГА, а мембрана клетки-мишени содержит пептиды слияния. Розетка слияния приближенно считается непрерывной круговой структурой. Трансмембранные домены и пептиды слияния моделируются двумя коаксиальными кольцами радиуса R с полушириной RTM и RFP соответственно. Трансмембранные домены внедрены на всю глубину вирусной мембраны, а пептиды слияния встроены в верхний монослой мембраны клетки-мишени (см. рис. 1). Мы вводим цилиндрическую систему координат Ohr с началом O, осью Or, лежащей в плоскости межмонослойной поверхности нижней мембраны, и осью Oh, совпадающей с осью симметрии розетки слияния и направленной вверх. В силу цилиндрической симметрии система является эффективно одномерной, т.е. все величины зависят только от координаты r.
Рис. 1.
Схематическое изображение исследуемой системы: а – начальная конфигурация; б – появление гидрофобных дефектов, предшествующее образованию сталка. Вирусная мембрана находится наверху, мембрана клетки-мишени – внизу. Тримеры ГА выделены серым цветом: трансмембранные домены показаны прямоугольниками, внедренными на глубину бислоя, пептиды слияния – треугольниками, внедренными на глубину монослоя.
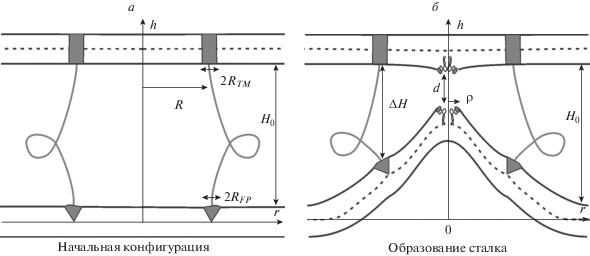
Мы считаем, что вирус и липосома сближаются друг с другом как целое, практически не деформируясь, на расстояние H0, соответствующее длине эктодоменов ГА в активированном состоянии. После этого начинается локальная деформация мембраны клетки-мишени, вызванная конформационной перестройкой ГА, приводящей к уменьшению расстояния между мембранами в области розетки слияния. При этом предполагается, что расстояние ΔH между трансмембранными доменами и пептидами слияния уменьшается, тогда как расстояние между мембранами вдали от розетки слияния остается равным H0 (см. рис. 1). Величину H0 мы принимаем примерно равной 18–20 нм, исходя из результатов работы [16]. Чтобы локально сблизить мембраны, система должна преодолеть энергетический барьер, связанный с деформацией мембран и гидратационным отталкиванием между ними [4, 35]. В процессе сближения мембран сильное гидратационное отталкивание бислоев приводит к боковому смещению полярных липидных голов от области контакта мембран [6]. Таким образом, повышается вероятность образования локальных гидрофобных дефектов в контактных монослоях [36]. Радиус гидрофобного дефекта обозначен ρ на рис. 1б. Взаимодействие гидрофобных дефектов на небольших расстояниях приводит к их притяжению и монослойному слиянию [37]. Мы считаем, что белковый каркас в вирусной частице связан с мембраной достаточно жестко, чтобы она не деформировалась глобально, но допускает локальные изменения положения липидов, в частности, возникновение в мембране гидрофобного дефекта. Мы вычисляем зависимость полной энергии системы от координаты реакции – расстояния ΔH, оптимизируя при этом состояние системы по радиусу дефекта ρ и расстоянию d между дефектами в мембранах.
Полная энергия представляется суммой энергии упругих деформаций мембран We, энергии гидратационного отталкивания Wh между мембранами, энергии взаимодействия между гидрофобными дефектами Wf в разных мембранах и работы белков слияния Wp:
Деформация мембран рассматривается в рамках модели Хамма–Козлова [38], которая хорошо зарекомендовала себя в описании мембранных процессов [29–31, 39–41]. Для описания деформаций монослоя мембраны вводится поле единичных векторов директоров n, характеризующее среднюю ориентацию липидных молекул. Поле директоров считается заданным на некоторой поверхности, проходящей внутри монослоя. Форма поверхности определяется полем единичных нормалей N к ней; нормали считаются направленными в сторону межмонослойной поверхности мембраны. Мы учитываем две деформационные моды – наклона и изгиба. Деформации относим к так называемой нейтральной поверхности, на которой деформации изгиба и латерального растяжения энергетически независимы. Согласно экспериментальным данным [42], нейтральная поверхность проходит в области сочленения липидных головок с углеводородными цепями на глубине ∼0.5 нм от внешней границы монослоя. Деформация изгиба количественно описывается дивергенцией директора вдоль разделяющей поверхности, а деформация наклона описывается вектором наклона t = n/(nN) – N ≈ n – N. В предположении малости деформаций энергия деформированного монослоя, отсчитываемая от состояния плоского монослоя, может быть представлена в виде [38]
(2)
$\begin{gathered} W = \int {\left( {\frac{B}{2}{{{\left( {{\text{div}}{\mathbf{n}} + {{J}_{0}}} \right)}}^{2}} - \frac{B}{2}J_{0}^{2}} \right. + } \\ \left. { + \frac{K}{2}{{{\mathbf{t}}}^{2}} + \sigma + {{K}_{G}}\kappa } \right)dS - \sigma {{A}_{0}}. \\ \end{gathered} $В этом выражении B, K, KG – модули изгиба, наклона и гауссовой кривизны соответственно; σ – латеральное натяжение монослоя; κ – гауссова кривизна мембраны; dS – элемент площади нейтральной поверхности; A0 – площадь нейтральной поверхности в исходном недеформированном состоянии; J0 – спонтанная кривизна монослоя. Малость деформаций означает, что проекция директора на ось Or много меньше единицы. Это позволяет заменить все векторные величины их проекциями на эту ось. Для определения состояния двух монослоев в составе одной мембраны необходимо ввести пять функций: проекции на ось Or директоров верхнего и нижнего монослоев, a(r) и b(r), соответственно; расстояния от плоскости Or до нейтральных поверхностей верхнего и нижнего монослоев, ha(r) и hb(r), соответственно; расстояние от плоскости Or до межмонослойной поверхности, m(r). Кроме того, будем считать, что гидрофобная зона монослоя локально объемно несжимаема, т.е. объем любого элемента монослоя не изменяется при деформации. Это предположение оправдано большой величиной модуля объемного сжатия мембран [43]. Условие локальной объемной несжимаемости записывается в следующем виде [38]:
где Δh – толщина монослоя в данной точке плоскости Or ; h0 – толщина невозмущенного монослоя. Уравнение (3) вкупе с определениями вектора наклона (t = n – N), толщины монослоя (Δha = ha(r) – m(r), Δhb = m(r) – hb(r)), и нормали к нейтральной поверхности монослоя (Na = grad(ha(r)), Nb = –grad(hb(r))), связывает векторы наклона ta(r) и tb(r) в верхнем и нижнем монослоях с директорами, a(r) и b(r), в этих монослоях и положением межмонослойной поверхности, m(r). Таким образом, применение условий локальной объемной несжимаемости к двум монослоям мембраны позволяет уменьшить число независимых функций, характеризующих состояние участка мембраны с пяти (a(r), b(r), ha(r), hb(r), m(r)) до трех (a(r), b(r), m(r)). На этих трех функциях строится функционал упругой энергии, Ур. (2). Функционал минимизируется методами вариационного исчисления с учетом граничных условий. Более подробно методика нахождения упругой энергии описана в работах [28, 31, 44, 45].Граничные условия определяются геометрией пептидов слияния, трансмембранных доменов и гидрофобных участков в контактных монослоях аналогично [9, 46, 47]. Предполагается, что наклон трансмембранного домена относительно нормали к мембране приводит к равному наклону граничащих с ним липидов и деформации вирусной мембраны. Соответственно, проекция директора граничных липидов на ось Or становится отличной от нуля; обозначим ее величину как nTM (рис. 2). Кроме этого, наклон трансмембранных доменов в составе кольца розетки слияния приводит к относительному смещению нейтральных поверхностей монослоев на внутренней (r = = R–RTM) и внешней (r = R + RTM) границах кольца (рис. 1а). Таким образом, имеем следующие граничные условия:
(4)
$\begin{gathered} a(R \pm {{R}_{{TM}}}) = --{{n}_{{TM}}},\,\,\,\,b(R \pm {{R}_{{TM}}}) = {{n}_{{TM}}}, \\ {{h}_{a}}_{{,b}}(R + {{R}_{{TM}}})--{{h}_{a}}_{{,b}}(R + {{R}_{{TM}}}) = --2{{n}_{{TM}}}{{R}_{{TM}}}. \\ \end{gathered} $Рис. 2.
Схематическое изображение доменов белков слияния в бислое. a –трансмембранный домен; б – пептид слияния в мембране клетки-мишени. Стрелками обозначены направления граничных директоров.
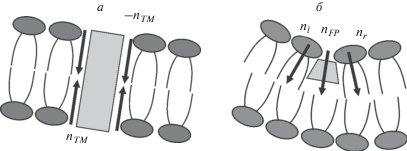
Встраивание пептида слияния в мембрану сопровождается смещением частей примыкающих липидных молекул в латеральном направлении. В общем случае, граничные липиды молекулы наклоняются на некоторый угол относительно нормали к нейтральной поверхности недеформированной мембраны. Обозначим проекцию директора на внутренней границе кольца пептидов слияния (r = R–RFP) через nl, на внешней границе (r = R + RFP) – через nr (рис. 2б). Кроме того, пептид слияния может поворачиваться в мембране как целое; обозначим проекцию директора, описывающую данный поворот, через nFP = (nl + nr)/2, т.е. nFP является средним директором по внутренней и внешней границе кольца пептидов слияния. Разность директоров на внутренней и внешней границах кольца пептидов слияния (“скачок” директора) приводит к следующему граничному условию:
(5)
$a\left( {R + {{R}_{{FP}}}} \right) - a\left( {R - {{R}_{{FP}}}} \right) = {{n}_{r}} - {{n}_{l}} = \Delta n,$При встраивании пептида слияния в контактный монослой происходит разрыв его нейтральной поверхности. Поворот пептида как целого приводит к относительному смещению нейтральных поверхностей на внутренней и внешней границах пептидного кольца:
В области плотного контакта мембран полярные головы липидов в обеих мембранах могут смещаться в латеральном направлении с образованием круглого гидрофобного участка радиуса ρ. Это смещение происходит за счет деформации мембраны и приводит к уменьшению энергии гидратационного отталкивания. Латеральное смещение полярных голов приводит к изменению проекции директора на ось Or на границе образующегося гидрофобного участка:
Данное условие удовлетворяет двум предельным случаям, для которых значение граничного директора известно: из соображений симметрии ясно, что в случае гидрофобного дефекта нулевого радиуса (ρ = 0) директор на его границе должен быть равен нулю. Также ясно, что когда радиус дефекта равен толщине монослоя (r = h0), липидные молекулы ориентированы горизонтально, т.е. директор должен быть равен –1. Кроме введения граничного директора, мы фиксируем расстояние ΔH между нейтральными поверхностями контактных монослоев двух мембран при r = R, и расстояние H0 между нейтральными поверхностями контактных монослоев двух мембран при $r \to \infty $.
Энергия взаимодействия двух плоских гидрофобных участков в контактных монослоях вирусной мембраны и мембраны-мишени, разделенных слоем воды, вычисляется согласно теории Израелашвили [37]:
(8)
${{W}_{f}} = {{\sigma }_{0}}\pi {{\rho }^{2}}\left( {1 - \exp \left( { - \frac{d}{{{{\xi }_{f}}}}} \right)} \right),$(9)
${{W}_{h}} = {{P}_{h}}{{\xi }_{h}}\int {\exp \left[ { - \frac{{z\left( r \right)}}{{{{\xi }_{h}}}}} \right]dS} ,$Влияние пептидов слияния на мембрану клетки-мишени мы оцениваем, исходя из результатов работ [23, 24]. Согласно [23], внедрение пептидов слияния индуцирует в мембране отрицательную спонтанную кривизну, равную JFP = –0.4 нм–1. Считая, что спонтанная кривизна генерируется на характерной длине порядка ширины пептида dFP = 2RFP, можно оценить скачок директора Δn используя определение кривизны J = –div(n). div(n) ≈ Δn/dFP → Δn = –JFP dFP . При ширине dFP = 2 (соответствует RFP ≈ 1 [23]) скачок директора равен Δn = 0.8. Согласно [24], изменение энергии ΔW одного тримера ГА в процессе его конформационной перестройки составляет 30–40 kBT. Для дальнейших расчетов мы примем среднее значение ΔW = 35 kBT. Это позволяет нам оценить усилие, развиваемое розеткой слияния по формуле Fprot = ΔWN/H0, где N – количество тримеров в розетке слияния. Число тримеров N можно оценить из геометрических соображений, зная радиус R розетки слияния, по формуле N = = πR/RE, где RE – радиус эктодомена тримера ГА, равный примерно 2 нм [51]. Мы принимаем значение R равным 4 нм в соответствии с данными [52]. В этом случае число тримеров ГА N равно 6, а совокупное усилие Fprot, развиваемое белками, равно 11.2 kBT/нм при H0 = 18.8 нм. Работа белков записывается в следующем виде:
(10)
${{W}_{{{\text{prot}}}}} = \left( {\Delta H - {{H}_{0}}} \right){{F}_{{{\text{prot}}}}} = \left( {\Delta H - {{H}_{0}}} \right)\frac{{\Delta W}}{{{{H}_{0}}}}.$В процессе вычислений мы фиксируем геометрические параметры, характеризующие белки слияния – R, RTM, RFP и минимизируем энергию Wtot по всем свободным параметрам. Эти параметры включают в себя как неопределенные коэффициенты, возникающие при решении систем дифференциальных уравнений Эйлера–Лагранжа, получающихся при минимизации функционала энергии, так и геометрические параметры, которые не фиксированы заранее, например, радиус гидрофобного участка ρ или наклон белковых доменов в мембране, nTM и nFP. Таким образом, мы получаем зависимость полной энергии Wtot только от координаты процесса H0 – ΔH. Далее мы находим энергетический барьер, т.е. минимальную энергию, необходимую для перехода системы из начального невозмущенного состояния в конечное, в котором дистальные монослои сливающихся мембран образуют бислой и ΔH = 0. Мы считаем, что система преодолевает энергетический барьер согласно больцмановскому весу, т.е. вероятность слияния с меньшим энергетическим барьером будет выше.
Мы используем приведенные выше параметры и анализируем зависимость эффективности слияния от доли холестерина в составе мембраны клетки-мишени, представленную в работах [17, 25]. Рассматривается смесь холестерина с диолеоилфосфатидилхолином (ДОФХ) с мольной долей холестерина, равной 0, 5, 10, 20 и 30%. Наличие холестерина меняет спонтанную кривизну мембраны, которая определяется как средневзвешенное по концентрации значений спонтанных кривизн отдельных компонентов. Значения последних берутся из данных [53], в соответствии с которыми спонтанная кривизна холестерина равна JChol = – 0.49 нм–1, а спонтанная кривизна ДОФХ равна JDOPC = –0.09 нм–1. Таким образом, для спонтанной кривизны смеси имеем следующие значения: J0 = –0.09 нм–1 для мольной доли холестерина, равной 0; J0 = –0.11 нм–1 для доли, равной 5%; J0 = –0.13 нм–1 для доли, равной 10%; J0 = –0.17 нм–1 для доли, равной 20%; J0 = –0.21 нм–1 для доли, равной 30%. Параметры гидратационного отталкивания – расклинивающее давление Ph и характеристическая длина ξh определены в работе [54]. В расчетах нами использованы следующие значения: Ph = 840 kBT/нм3 (3.35 × 109 Па), ξh = 0.24 нм.
Мы считаем, что наличие холестерина мало влияет на величины упругих модулей мембраны, поэтому в расчетах рассматривали упругие модули, характерные для модельных липидных мембран. Их значения в соответствии с экспериментальными и теоретическими данными принимаются равными B = 10 kBT, K = 10 kBT/нм, KG = –5 kBT [38, 55, 56].
РЕЗУЛЬТАТЫ
Нами вычислена зависимость энергетического барьера образования сталка от мольной доли C холестерина в составе клетки-мишени. Для каждого значения C и соответствующего набора параметров находится зависимость энергии W от координаты реакции, после чего определяется высота барьера E. Типичная зависимость представлена на рис. 3.
Рис. 3.
Зависимость энергии W от координаты реакции H0 – ΔH для содержания холестерина в мембране клетки-мишени, равного 30%. Параметры H0 и Fprot принимались равными 18.8 нм и 11.2 kBT/нм соответственно.
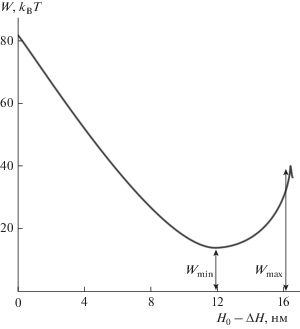
Величина барьера E определяется как разность наибольшей (обозначена Wmax на рис. 3) и наименьшей (обозначена Wmin на рис. 3) энергии на траектории, причем координата максимума должна быть больше координаты минимума. После этого вычисляется зависимость высоты барьера E от доли холестерина С. На рис. 4 представлены зависимости E от доли холестерина в мембране при различных равновесных расстояниях H0 при фиксированной внутренней энергии белков слияния ΔW = 210 kBT; Fprot находится из соотношения Fprot = ΔWN/H0, введенного выше.
Рис. 4.
Зависимость высоты барьера E от доли C холестерина в составе мембраны клетки-мишени при разных значениях расстояния H0. Верхний график (треугольники) соответствует H0 = 19.8 нм, Fprot = 10.6 kBT/нм; средний график (круги) соответствует H0 = 18.8 нм, Fprot = = 11.2 kBT/нм; нижний график (квадраты) соответствует H0 = 17.8 нм, Fprot = 12.4 kBT/нм.
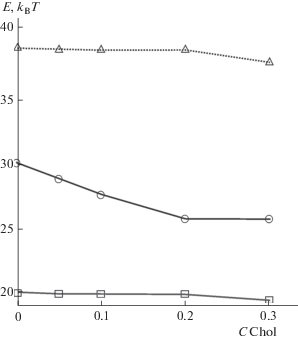
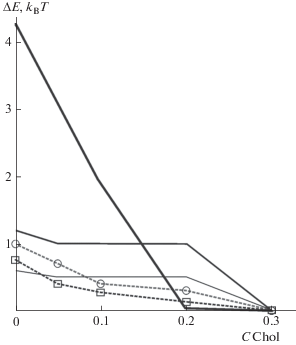
Полученные значения E можно сравнить с экспериментальными данными. Эффективность слияния в работах [17, 25] определяли по числу успешных актов образования сталка (Nstalk), которое пропорционально больцмановскому фактору барьера образования сталка E: Nstalk ~ exp(–E/kBT). Отношение экспериментально измеренных величин N1 и N2, описывающих эффективность в двух разных экспериментах, равно N1/N2 = = exp((E2–E1)/kBT). При этом предэкспоненциальный фактор в этих случаях предполагается равным. Это соотношение позволяет найти по данным работы [17] различие между высотами барьеров при различных долях холестерина C. В работе представлены данные для C = 0, 0.05, 0.1, 0.2 и 0.3. Так, разность барьеров E0 (C = 0) и E30 (C = 0.3) оказывается равной 0.76 kBT. В результатах работы [25] представлена зависимость высоты барьера от спонтанной кривизны мембраны. Поскольку мы знаем соответствие между спонтанной кривизной и содержанием холестерина в мембране, мы можем определить разности барьеров для соответствующих концентраций холестерина. Для соотношения барьеров С = 0 и С = 0.3 имеем E0–E30 ≈ 1 kBT. Поскольку наименьшим во всех рассматриваемых случаях является барьер E30, мы нормируем все значения E на E30 и вычисляем разность ΔE(C) = E(C) – E30. Значения ΔE, полученные нами из экспериментальных данных [17, 25], а также из наших расчетов, представлены на рис. 5.
Рис. 5.
Зависимость ΔE от концентрации холестерина (C). Пунктирной линией и квадратами обозначены данные, полученные на основе [17]. Пунктирной линией и кругами обозначены данные, полученные на основе результатов [25]. Сплошными линиями показаны теоретические зависимости, соответствующие разным значениям H0 и Fprot. Тонкой линией показана зависимость для H0 = 17.8 нм и Fprot = 11.8 kBT/нм. Линией средней толщины показана зависимость для H0 = = 19.8 нм и Fprot = 10.6 kBT/нм. Толстой линией показана зависимость для H0 = 18.8 нм и Fprot = 11.2 kBT/нм.
ОБСУЖДЕНИЕ
Исторически одним из основных способов валидации моделей слияния мембран было получение зависимости эффективности слияния от липидного состава мембран [57]. Считается, что липиды с отрицательной спонтанной кривизной, такие как холестерин, способствуют слиянию в модельных системах [21], поэтому энергетический барьер должен понижаться при увеличении содержания холестерина в составе сливающихся мембран. Наличие холестерина важно также для слияния в процессе непосредственно вирусного инфицирования [58]. В недавних работах [17, 25] получена зависимость эффективности слияния вируса гриппа от содержания холестерина в составе мембраны клетки-мишени. Показано, что эффективность меняется очень слабо: в работе [17] увеличение доли холестерина на 30% увеличивает эффективность слияния в 2 раза, что соответствует изменению энергетического барьера ΔE на ~0.8 kBT. Практически такой же результат получен в работе [25]. Это гораздо более слабая зависимость, чем считалось ранее. Так, например, добавление лизолипидов [26] приводит к 30-кратному уменьшению эффективности слияния. Анализ результатов сильно затрудняется малостью величины ΔE по сравнению с самим барьером и вытекающей отсюда необходимостью максимально точного определения всех связанных со слиянием параметров. Определить эти параметры нам позволяет совокупность недавно полученных экспериментальных данных, представленных в работах [16, 23, 24, 59].
Наименее точно известно значение расстояния H0 между мембранами: согласно результатам [16] H0 = 18.8 ± 3.2 нм. В дополнение к этому данное значение представляет интерес само по себе, поскольку существенно превосходит длину эктодомена ГА в неактивном состоянии (13.5 нм). Именно поэтому мы фокусируемся на данном параметре и его влиянии на величину энергетического барьера. В расчетах мы рассматриваем значения H0 = 18.8 ± 1 нм, фиксируя при этом внутреннюю энергию белков слияния ΔW, затрачиваемую на сближение мембран. Согласно нашим расчетам, энергетический барьер E при фиксированном значении доли холестерина C монотонно снижается с уменьшением H0: уменьшение на 1 нм приводит к снижению барьера примерно на 10 kBT. При этом зависимость величины барьера от доли холестерина C при фиксированной H0 гораздо менее выражена: изменение доли холестерина на треть приводит к изменению высоты барьера на 1–4 kBT. В то же время, именно разность высот барьеров ΔE может быть получена из экспериментальных данных, поэтому сопоставление экспериментальных и рассчитанных значений барьера представляется наиболее важным. Сравнение с экспериментальными результатами позволяет исключить из рассмотрения значение H0 18.8 нм, поскольку в этом случае ΔE практически на порядок превышает значение, полученное из эксперимента. При этом само значение барьера E также достаточно точно оценено и составляет 30–40 kBT [5, 6]. Это означает, что значение H0 17.8 нм также следует отбросить. Таким образом, наши расчеты показывают, что расстояние между мембранами в начале слияния должно равняться ≈ 20 нм. При этом значение этой величины может варьировать в исключительно узких пределах: уменьшение H0 на 1 нм приведет к несоответствию величины ΔE с экспериментальными данными, а увеличение – к несоответствию величины E с ранее полученными теоретическими данными по значению барьера на слияние.
Имеющиеся экспериментальные данные [59] позволяют оценить сверху количество N тримеров ГА, которые могут участвовать в розетке слияния. Это количество связано с радиусом розетки слияния R соотношением N = πR/RE. При R = 4 нм значение N не может превышать 6. Эта величина расходится с данными, представленными в [16], согласно которым, с липосомой взаимодействует N ≈ 15–20 тримеров. Помимо геометрических соображений, достаточно сомнительно, чтобы такое количество белков слияния одновременно участвовало в одном акте слияния. Формально это означало бы увеличение усилия Fprot до значения 28 kBT/нм, что приводило бы к фактически безбарьерному слиянию. Наши расчеты позволяют заключить, что взаимодействие белков слияния с липосомой, наблюдаемое в [16], в некоторых случаях не выходит за рамки внедрения пептидов слияния на поверхности мембраны последней.
Таким образом, благодаря тому, что имеющиеся экспериментальные данные позволяют точнее оценить все параметры, влияющие на эффективность образования сталка, нами впервые была построена модель слияния, описывающая эффективность слияния не только качественно, но и количественно. Полученные нами результаты позволили уточнить некоторые геометрические параметры системы, влияющие на слияние и наименее точно определенные в экспериментах.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации МК-1807.2017.4.
Список литературы
Rolfes M.A., Foppa I.M., Garg S., Flannery B., Brammer L., Singleton J.A., Burns E., Jernigan D., Olsen S.J., Bresee J., Reed C. 2018. Annual estimates of the burden of seasonal influenza in the United States: a tool for strengthening influenza surveillance and preparedness. Influenza Other Respir. Viruses. 12, 132–137.
White J.M., Whittaker G.R. 2016. Fusion of enveloped viruses in endosomes. Traffic. 17 (6), 593–614.
Kozlov M.M., Markin V.S. 1983. Possible mechanism of membrane fusion. Biofizika. 28, 242–247.
Chernomordik L.V., Melikyan G.B., Chizmadzhev Yu.A. 1987. Biomembrane fusion: a new concept derived from model studies using two interacting planar lipid bilayers. Biochim. Biophys. Acta. 906, 309–352.
Ryham R.J., Klotz T.S., Yao L., Cohen F.S. 2016. Calculating transition energy barriers and characterizing activation states for steps of fusion. Biophys. J. 110, 1110–1124.
Kuzmin P.I., Zimmerberg J., Chizmadzhev Yu.A., Cohen F.S. 2001. A quantitative model for membrane fusion based on low-energy intermediates. Proc. Natl. Acad. Sci. USA. 98, 7235–7240.
Molotkovsky R.J., Kuzmin P.I., Akimov S.A. 2015. The Membrane Fusion. Two Possible Mechanisms of a Decrease in a Fusion Energy Barrier in the Presence of Fusion Proteins. Biol. Membrany. 32 (2), 79–92.
Akimov S.A., Molotkovsky R.J., Galimzyanov T.R., Radaev A.V., Shilova L.A., Kuzmin P.I., Batishchev O.V., Voronina G.F., Chizmadzhev Y.A. 2014. Model of membrane fusion: Continuous transition to fusion pore with regard of hydrophobic and hydration interactions. Biol. Membrany. 31 (1), 14–24.
Molotkovsky R.J., Galimzyanov T.R., Jiménez-Munguía I., Pavlov K.V., Batishchev O.V., Akimov S.A. 2017. Switching between successful and dead-end intermediates in membrane fusion. Int. J. Mol. Sci. 18 (12), E2598.
Harrison S.C. 2008. Viral membrane fusion. Nat. Struct. Mol. Biol. 15, 690–698.
Wilson I.A., Skehel J.J., Wiley D.C. 1981. Structure of the haemagglutinin membrane glycoprotein of influenza virus at 3 Å resolution. Nature. 289 (5796), 366.
Skehel J.J., Wiley D.C. 2000. Receptor binding and membrane fusion in virus entry: The influenza hemagglutinin. Annu. Rev. Biochem. 69 (1), 531–569.
Danieli T., Pelletier S.L., Henis Y.I., White J.M. 1996. Membrane fusion mediated by the influenza virus hemagglutinin requires the concerted action of at least three hemagglutinin trimers. J. Cell Biol. 133, 559–569.
Floyd D.L., Ragains J.R., Skehel J.J., Harrison S.C., van Oijen A.M. 2008. Single-particle kinetics of influenza virus membrane fusion. Proc. Natl. Acad. Sci. USA. 105, 15382–15387.
Chernomordik L.V., Leikina E., Kozlov M.M., Frolov V.A., Zimmerberg J. 1999. Structural intermediates in influenza haemagglutinin-mediated fusion. Mol. Membr. Biol. 16 (1), 33–42.
Calder L.J., Rosenthal P.B. 2016. Cryomicroscopy provides structural snapshots of influenza virus membrane fusion. Nat. Struct. Mol. Biol. 23 (9), 853.
Gui L., Ebner J.L., Mileant A., Williams J.A., Lee K.K. 2016. Visualization and sequencing of membrane remodeling leading to influenza virus fusion. J. Virol. JVI-00240.
Chlanda P., Mekhedov E., Waters H., Schwartz C.L., Fischer E.R., Ryham R.J., Cohen F.S., Blank P.S., Zimmerberg J. 2016. The hemifusion structure induced by influenza virus haemagglutinin is determined by physical properties of the target membranes. Nat. Microbiol. 1, 16050.
Schaap I.A., Eghiaian F., des Georges A., Veigel C. 2012. Effect of envelope proteins on the mechanical properties of influenza virus. J. Biol. Chem. jbc-M112.
Li S., Sieben C., Ludwig K., Höfer C.T., Chiantia S., Herrmann A., Eghiaian F., Schaap I.A. 2014. pH-Controlled two-step uncoating of influenza virus. Biophys. J. 106 (7), 1447–1456.
Chernomordik L.V., Kozlov M.M. 2008. Mechanics of membrane fusion. Nat. Struct. Mol. Biol. 15 (7), 675.
McMahon H.T., Kozlov M.M., Martens S. 2010. Membrane curvature in synaptic vesicle fusion and beyond. Cell. 140, 601–605.
Smrt S.T., Draney A.W., Lorieau J.L. 2015. The influenza hemagglutinin fusion domain is an amphipathic helical hairpin that functions by inducing membrane curvature. J. Biol. Chem. 290 (1), 228–238.
Boonstra S., Onck P.R., Van der Giessen E. 2017. Computation of hemagglutinin free energy difference by the confinement method. J. Phys. Chem. B. 121 (50), 11292–11303.
Haldar S., Mekhedov E., McCormick C.D., Blank P.S., Zimmerberg J. 2019. Lipid-dependence of target membrane stability during influenza viral fusion. J. Cell. Sci. 132 (4), jcs218321.
Chernomordik L.V., Frolov V.A., Leikina E., Bronk P., Zimmerberg J. 1998. The pathway of membrane fusion catalyzed by influenza hemagglutinin: Restriction of lipids, hemifusion, and lipidic fusion pore formation. J. Cell Biol. 140 (6), 1369–1382.
Bashkirov P.V., Akimov S.A., Evseev A.I., Schmid S.L., Zimmerberg J., Frolov V.A. 2008. GTPase cycle of dynamin is coupled to membrane squeeze and release, leading to spontaneous fission. Cell. 135 (7), 1276–1286.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin, P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane I: Continuous reversible trajectory from intact bilayer through hydrophobic defect to transversal pore. Sci. Rep. 7, 12152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin, P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane II: Energy landscape under external stress. Sci. Rep. 7, 12509.
Akimov S.A., Aleksandrova V.V., Galimzyanov T.R., Bashkirov P.V., Batishchev O.V. 2017. Mechanism of pore formation in stearoyl-oleoyl-phosphatidylcholine membranes subjected to lateral tension. Biol. Membrany. 34(4), 270–283.
Kuzmin P.I., Akimov S.A., Chizmadzhev Y.A., Zimmerberg J., Cohen F.S. 2005. Line tension and interaction energies of membrane rafts calculated from lipid splay and tilt. Biophys. J. 88 (2), 1120–1133.
Galimzyanov T.R., Akimov S.A. 2011. Phase separation in lipid membranes induced by the elastic properties of components. JETP Lett. 93 (8), 463–469.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E., Cohen F.S., Pohl P., Akimov S.A. 2015. Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains. Phys. Rev. Lett. 115 (8), 088101.
Galimzyanov T.R., Molotkovsky R.J., Cohen F.S., Pohl P., Akimov S.A. Galimzyanov T.R., et al. 2016. Reply. Phys. Rev. Lett. 116 (7), 079802.
Rand R.P., Parsegian V.A. 1989. Hydration forces between phospholipid bilayers. Biochim. Biophys. Acta. 988, 351–376.
Frolov V.A., Zimmerberg J. 2010. Cooperative elastic stresses, the hydrophobic effect, and lipid tilt in membrane remodeling. FEBS Lett. 584, 1824–1829.
Israelachvili J., Pashley R. 1982. The hydrophobic interaction is long range, decaying exponentially with distance. Nature. 300, 341–342.
Hamm M., Kozlov M.M. 2000. Elastic energy of tilt and bending of fluid membranes. Eur. Phys. J. E. 3 (4), 323–335.
Staneva G., Osipenko D.S., Galimzyanov T.R., Pavlov K.V., Akimov S.A. 2016. Metabolic precursor of cholesterol causes formation of chained aggregates of liquid-ordered domains. Langmuir. 32 (6), 1591–1600.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V., Shilova L.A., Mikhalyov I.I., Molotkovskaya I.M., Akimov S.A., Batishchev, O.V. 2017. Line activity of ganglioside GM1 regulates the raft size distribution in a cholesterol-dependent manner. Langmuir. 33 (14), 3517–3524.
Galimzyanov T.R., Kuzmin P.I., Pohl P., Akimov S.A. 2017. Undulations drive domain registration from the two membrane leaflets. Biophys. J. 112 (2), 339–345.
Leikin S., Kozlov M.M., Fuller N.L., Rand R.P. 1996. Measured effects of diacylglycerol on structural and elastic properties of phospholipid membranes. Biophys. J. 71 (5), 2623–2632.
Nagle J.F., Wilkinson D.A. 1978. Lecithin bilayers. Density measurement and molecular interactions. Biophys. J. 23 (2), 159–175.
Galimzyanov T.R., Molotkovsky R.J., Kuzmin P.I., Akimov S.A. 2011. Stabilization of the raft bilayer structure due to elastic deformations of the membrane. Biol. Membrany. 28 (4), 307–314.
Galimzyanov T.R., Molotkovsky R.J., Kheyfets B.B., Akimov S.A. 2013. Energy of the interaction between membrane lipid domains calculated from splay and tilt deformations. JETP Lett. 96 (10), 681–686.
Akimov S.A., Alexandrova V.V., Galimzyanov T.R., Batishchev V.V. 2011. Interaction of amphipathic peptides mediated by elastic membrane deformations. Biol. Membrany. 34 (3), 162–173.
Molotkovsky R.J., Alexandrova V.V., Galimzyanov T.R., Jiménez-Munguía I., Pavlov K.V., Batishchev O.V., Akimov S.A. 2018. Lateral membrane heterogeneity regulates viral-induced membrane fusion during HIV entry. Int. J. Mol. Sci. 19 (5), 1483.
Marčelja S., Radić N. 1976. Repulsion of interfaces due to boundary water. Chem. Phys. Lett. 42 (1), 129–130.
Leikin S.L., Kozlov M.M., Chernomordik L.V., Markin V.S., Chizmadzhev Y.A. 1987. Membrane fusion: Overcoming of the hydration barrier and local restructuring. J. Theor. Biol. 129 (4), 411–425.
Israelachvili J. 2011. Intermolecular and Surface Forces. London: Acad. Press.
Bullough P.A., Hughson F.M., Skehel J.J., Wiley D.C. 1994. Structure of influenza haemagglutinin at the pH of membrane fusion. Nature. 371 (6492), 37.
Zawada K.E., Wrona D., Rawle R.J., Kasson P.M. 2016. Influenza viral membrane fusion is sensitive to sterol concentration but surprisingly robust to sterol chemical identity. Sci. Rep. 6, 29842.
Kollmitzer B., Heftberger P., Rappolt M., Pabst G. 2013. Monolayer spontaneous curvature of raft-forming membrane lipids. Soft Matter. 9 (45), 10 877–10 884
Aeffner S., Reusch T., Weinhausen B., Salditt T. 2012. Energetics of stalk intermediates in membrane fusion are controlled by lipid composition. Proc. Natl. Acad. Sci. USA. 109 (25), E1609–E1618.
Rawicz W., Olbrich K.C., McIntosh T., Needham D., Evans E. 2000. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophys. J. 79 (1), 328–339.
Hu M., Briguglio J.J., Deserno M. 2012. Determining the Gaussian curvature modulus of lipid membranes in simulations. Biophys. J. 102 (6), 1403–1410
Chernomordik L. 1996. Non-bilayer lipids and biological fusion intermediates. Chem. Phys. Lipids. 81 (2), 203–213.
Gibbons D.L., Ahn A., Liao M., Hammar L., Cheng R.H., Kielian M. 2004. Multistep regulation of membrane insertion of the fusion peptide of Semliki Forest virus. J. Virol. 78 (7), 3312–3318.
Zawada K.E., Wrona D., Rawle R.J., Kasson P.M. 2016. Influenza viral membrane fusion is sensitive to sterol concentration but surprisingly robust to sterol chemical identity. Sci. Rep. 6, 29 842.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


