Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 2, стр. 101-108
Изменение емкости и граничного потенциала бислойной липидной мембраны при быстром освобождении протонов на ее поверхности
В. Ю. Ташкин a, В. Е. Вишнякова a, А. А. Щербаков a, О. А. Финогенова a, Ю. А. Ермаков a, В. С. Соколов a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: sokolov.valerij@gmail.com
Поступила в редакцию 21.11.2018
После доработки 28.11.2018
Принята к публикации 28.11.2018
Аннотация
Изучена кинетика связывания протонов с бислойной липидной мембраной (БЛМ) при их быстром освобождении на поверхности мембраны с помощью измерений ее емкости и электростатического потенциала. Освобождение протонов происходило при возбуждении молекул 2-метокси-5-нитросульфата (MNPS), адсорбированных на поверхности мембраны при освещении УФ-светом. Адсорбция анионов MNPS приводила к появлению поверхностного потенциала, который был измерен либо методом компенсации внутримембранного поля, либо как изменение ζ-потенциала липосом, измеренного методом динамического светорассеяния. Освещение БЛМ с адсорбированными на ней молекулами MNPS приводило к изменению ее емкости и смещению в положительную сторону поверхностного потенциала. Это смещение потенциала было вызвано частично разрушением MNPS, частично – связыванием протонов на поверхности мембраны. При увеличении буферной емкости и скачок потенциала, и изменение емкости значительно уменьшались по величине. Восстановление емкости и потенциала после вспышки происходили за время порядка десятков секунд. Изменения потенциала и емкости наблюдались не только на БЛМ, сформированных из фосфолипидов, но и на БЛМ, сформированных из глицерилмоноолеата. Полученные результаты объясняются тем, что протоны, освобождающиеся из MNPS при вспышке света, оказываются связанными на поверхности мембраны в слое ориентированных молекул воды.
ВВЕДЕНИЕ
Ряд исследований последних лет показал, что существует особое состояние протонов на границе раздела мембраны с водой, отделенных от объема раствора потенциальным барьером, в котором важную роль играют ориентированные молекулы воды [1–4]. Транспорт протонов вдоль поверхности мембраны может играть важную роль в биоэнергетических процессах [5]. Протонирование поверхности мембраны и транспорт протонов вдоль нее изучали на искусственных бислойных липидных мембранах с помощью флуоресцентных зондов, при этом для запуска процесса использовали фотоактивируемые соединения [6–8]. Фотоактивируемые соединения ранее использовали в исследованиях кинетики ферментативной активности для быстрого изменения концентрации субстратов. Одним из самых популярных соединений такого класса является Caged ATP, который использовали для исследования кинетики функционирования мембранных транспортных ATP-аз, в частности, электрогенного переноса ионов Na,K-ATP-азой на искусственной мембране [9, 10]. Для создания быстрого скачка рН на поверхности мембраны использовали другое соединение – Caged-H+, в котором при возбуждении светом происходит освобождение протона [11, 12]. С помощью таких соединений изучали диффузию протонов вдоль поверхности мембраны [6, 7, 11] и кинетику функционирования Ca-АТР-азы [12]. Для изучения кинетики электрогенного транспорта в канале доступа ионов Na,K-ATP-азы нами разработан метод измерения быстрых изменений емкости и проводимости мембраны [10]. Применение этого метода при фотоактивируемом освобождении протонов с помощью Caged-H+ позволило исследовать обменный транспорт ионов калия или натрия на протоны с цитоплазматической стороны Na,K-ATP-азы [13–15]. Изменения емкости при скачке рН наблюдались не только с Na,K-ATP-азой, но и на чистых мембранах, не содержащих белок [14]. Это явление позволяет изучать кинетику связывания протонов на поверхности фосфолипидных мембран, чему посвящена настоящая работа.
МАТЕРИАЛЫ И МЕТОДЫ
БЛМ формировали по методу Мюллера–Рудина в тефлоновой ячейке на отверстии диаметром 0.8 мм. C этой целью использовали растворы в н-декане либо дифитаноилфосфатидилхолина (Avanti Polar Lipids, США) в концентрации 15 мг/мл, либо глицерилмоноолеата (Sigma, США) в концентрации 100 мг/мл. Для приготовления растворов использовали хлорид N-метил-D-глюкамина (NMG), KCl, HEPES, Трис (Sigma, США). Все растворы готовили на дважды дистиллированной воде. В экспериментах с Caged-H+ использовали 2-метокси-5-нитрофенилсульфат натрия (MNPS), синтезированный в Институте органической химии им. Н.Д. Зелинского РАН. Во всех опытах Caged-H+ добавляли в дальний (по отношению к свету) отсек. При освещении БЛМ вспышкой света использовали ксеноновую лампу-вспышку с сапфировым окном FJ-249 (EG&G, США). При освещении БЛМ постоянным светом использовали ультрафиолетовый светодиод LED-003W-48C-000-000LM-EL-P с длиной волны 375 нм и электрической мощностью 3 Вт (Artleds, Россия). Емкость БЛМ, а также ее приращение, вызванное фотолизом Caged-H+, измеряли с помощью методики, описанной в [14]. В измерениях использовали хлорсеребряные электроды с агаровыми мостиками, заполненными тем же раствором, который находился в ячейке. Электрический ток регистрировали с помощью усилителя Keithley-427 (Keithley Instruments США). При измерении приращений емкости к БЛМ прикладывали напряжение синусоидальной формы с амплитудой 50 мВ и частотой 64 Гц.
Для измерений медленных изменений электростатического потенциала использовали метод компенсации внутримембранного поля, разработанный в [16] (см. также обзоры [17, 18]). Экспериментальная установка для измерений этим методом была идентична использованной в наших предыдущих работах [19]. Быстрые изменения электростатического потенциала при фотолизе Caged-H+ измеряли с помощью электрометра, собранного на основе операционного усилителя Keithley301 (США).
Измерения электрофоретической подвижности липосом проводили методом квазиупругого светорассеяния с помощью Zetasizer-2 (Malvern, Великобритания) с коррелятором PhotoCor (Россия). В измерениях использовали программу, разработанную авторами на основе алгоритма коммерческой программы фирмы Malvern для Zetasizer-2. Значение поверхностного потенциала считали совпадающим с ζ-потенциалом, который вычисляли с помощью уравнения Смолуховского.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
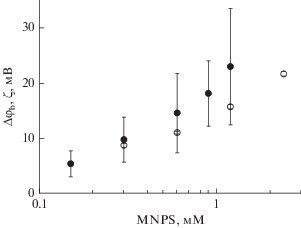
При добавлении MNPS в раствор с одной стороны мембраны появлялась разность граничных потенциалов, знак которой соответствовал адсорбции на поверхности отрицательно заряженных молекул. Изменение потенциала было примерно пропорционально логарифму концентрации MNPS в растворе. Эта зависимость изображена на рис. 1. Полученные результаты объясняются адсорбцией анионов MNPS на границе БЛМ, заряд которых обусловлен депротонированной сульфогруппой, а сама адсорбция – гидрофобной нитрофенольной группой молекулы. Адсорбцию MNPS на мембране изучали также другим методом, основанным на измерении ζ-потенциала липосом. Его зависимость от концентрации MNPS изображена на том же рисунке. Величина ζ-потенциала была ниже величины граничного потенциала, измеренного на БЛМ, что можно объяснить погружением заряженной группы MNPS в мембрану в соответствии с закономерностями, изученными нами ранее с другими амфифильными ионами [17, 18].
Рис. 1.
Зависимость изменений граничного потенциала БЛМ (черные точки) и ζ-потенциала липосом (белые точки) от концентрации MNPS в растворе, содержащем 20 мМ KCl, 2 мМ HEPES, pH 7. БЛМ и липосомы сформированы из дифитаноилфосфатидилхолина.
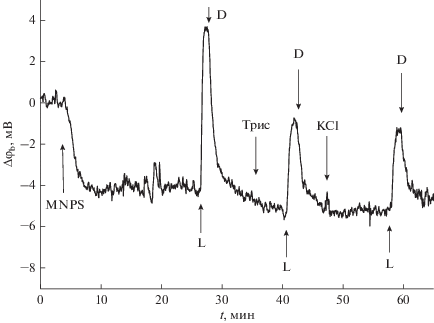
На рис. 2 изображена кинетика изменения разности граничных потенциалов при добавлении MNPS в раствор с одной стороны от мембраны и последующем освещении постоянным светом. Включение освещения приводило к изменению граничного потенциала в положительную сторону. Это изменение потенциала можно было бы отнести к уменьшению количества адсорбированных анионов MNPS вследствие их фотолиза, однако величина изменения потенциала в растворах с низкой концентрацией буфера превышала величину потенциала, вызванного адсорбцией MNPS. При увеличении концентрации буфера изменение потенциала при освещении примерно совпадало с потенциалом адсорбции анионов MNPS, т.е. это изменение потенциала может быть связано с их разрушением. Таким образом, изменение граничного потенциала при освещении происходит частично за счет уменьшения количества заряженных молекул Caged-H+ на поверхности мембраны, частично – за счет связывания с этой поверхностью протонов.
Рис. 2.
Кинетика изменения разности граничных потенциалов при добавлении 300 мкМ MNPS в раствор с одной стороны от мембраны и последующем освещении постоянным УФ-светом. Стрелками отмечены моменты добавления 250 мкМ MNPS, 1.5 мМ Трис-буфера, 20 мМ KCl, а также включения (L) и выключения (D) света. Состав раствора: 0.2 мМ Трис, 10 мМ KCl, pH 8.0. БЛМ и липосомы сформированы из дифитаноилфосфатидилхолина.
При освещении вспышкой УФ-света изменение потенциала было меньше по величине, но происходило быстрее, и для его измерения использовали электрометрический операционный усилитель. На рис. 3а изображена кинетика изменения мембранного потенциала при вспышке УФ-света. В принципе, это быстрое изменение мембранного потенциала, измеренное электрометром, тоже связано с изменением граничного потенциала [17, 18]. При этом наблюдалось также скачкообразное увеличение емкости мембраны (рис. 3б). При увеличении буферной емкости раствора и изменение потенциала, и изменение емкости значительно уменьшались по величине (рис. 3 и 4), откуда можно сделать вывод, что эти изменения вызваны в основном протонами, высвобождающимися при фотолизе MNPS. Их связывание на БЛМ сопровождается изменением ее поверхностного заряда, что приводит к скачку граничного потенциала. Восстановление емкости после вспышки света показано на рис. 3в; оно происходит за время порядка нескольких десятков секунд.
Рис. 3.
Кинетика изменения граничного потенциала (а) и емкости мембраны (б) при фотолизе MNPS, а также кинетика восстановления емкости после вспышки света (в) в нулевой момент времени. Раствор содержал 20 мМ KCl и HEPES, концентрация которого указана на рисунке, pH 7 (а и б), либо 12 мМ NMG, pH 7 (в). БЛМ сформирована из дифитаноилфосфатидилхолина. В отсек ячейки, дальний по отношению к источнику света, добавлен MNPS-Na в концентрации 300 мкМ.
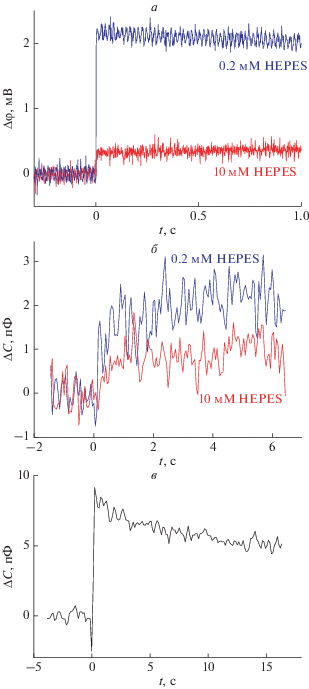
Рис. 4.
Зависимость изменения емкости мембраны (черные кружки) и скачка потенциала (белые кружки), вызванных вспышкой света, от концентрации буфера HEPES в растворе. БЛМ сформирована из дифитаноилфосфатидилхолина. Исходный раствор содержал 10 мМ KCl, 0.2 мМ HEPES, pH 7.0, концентрацию буфера увеличивали, добавляя в раствор HEPES. БЛМ сформирована из дифитаноилфосфатидилхолина. В отсек ячейки, дальний по отношению к источнику света, добавлен MNPS-Na в концентрации 300 мкМ.
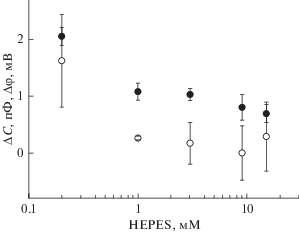
Таким образом, на БЛМ с адсорбированными на ней молекулами MNPS при вспышке света происходит как изменение скачка потенциала на границе мембраны с раствором, так и возрастание емкости мембраны. И то и другое подавлялось при увеличении буферной емкости раствора, что свидетельствует о том, что эти процессы вызваны освобождением протонов при фотолизе MNPS. С чем могут быть связаны эти изменения?
Прежде всего, попробуем оценить, может ли изменение емкости мембраны происходить из-за изменения поверхностного заряда и связанного с ним изменения емкости двойного слоя. Для оценки возможного изменения емкости двойного слоя воспользуемся уравнением Гуи–Чепмена:
(1)
$\frac{\sigma }{{\sqrt {8\varepsilon {{\varepsilon }_{0}}RT{{c}_{1}}} }} = {\text{sh}}\left( {\frac{F}{{2RT}}{{\varphi }_{{\text{b}}}}} \right),$Емкость двойного слоя вычисляется дифференцированием
(2)
${{C}_{{\text{s}}}} = \frac{{d\sigma }}{{d{{\varphi }_{{\text{b}}}}}} = \frac{F}{{2RT}}\sqrt {8\varepsilon {{\varepsilon }_{0}}RT{{c}_{1}}} {\text{ch}}\left( {\frac{F}{{2RT}}{{\varphi }_{{\text{b}}}}} \right).$В эксперименте регистрируется приращение емкости при фотолизе Caged-H+. При этом исходный поверхностный потенциал φb, согласно рис. 1, составляет около –10 мВ, а его изменение после вспышки света – около 1 мВ. Концентрация c1 одновалентного электролита (KCl) составляла 0.02 М. Согласно оценке по приведенной выше формуле, емкость Cs двойного слоя составляет около 10–4 Ф/см2, что на 2 порядка больше емкости Cm липидной мембраны (4 × 10–7 Ф/см2). Суммарная емкость С последовательно соединенных емкостей мембраны и двойного слоя определяется как
откуда видно, что она определяется в основном величиной Cm, а емкость двойного слоя Cs вносит вклад в суммарную емкость примерно во втором знаке после запятой. Изменение этой величины при изменении поверхностного потенциала на 1 мВ можно оценить как(4)
$\begin{gathered} \frac{{dC}}{{d{{\varphi }_{{\text{b}}}}}}\Delta {{\varphi }_{{\text{b}}}} = {{\left( {\frac{{{{C}_{{\text{m}}}}}}{{{{C}_{{\text{m}}}} + {{C}_{{\text{s}}}}}}} \right)}^{2}}\frac{{d{{C}_{{\text{s}}}}}}{{d{{\varphi }_{{\text{b}}}}}}\Delta {{\varphi }_{{\text{b}}}} = \\ = {{\left( {\frac{{{{C}_{{\text{m}}}}}}{{{{C}_{{\text{m}}}} + {{C}_{{\text{s}}}}}}\frac{F}{{2RT}}} \right)}^{2}}\sqrt {8\varepsilon {{\varepsilon }_{0}}RT{{c}_{1}}} {\text{sh}}\left( {\frac{F}{{2RT}}{{\varphi }_{{\text{b}}}}} \right)\Delta {{\varphi }_{{\text{b}}}}. \\ \end{gathered} $Оценка изменения емкости при вспышке света по этой формуле дает около 10–11 Ф/см2, что составляет примерно 2 × 10–5 величины начальной емкости мембраны Cm, в то время как относительное изменение емкости, наблюдаемое после вспышки света в эксперименте, составляло примерно 10–3 , что в 50 раз больше. Сделанные оценки говорят о том, что изменение емкости не может быть вызвано изменением емкости двойного слоя.
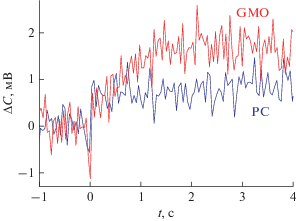
Связывание протонов на поверхности мембраны можно было бы объяснить наличием кислотных групп фосфолипидов, однако у фосфатидилхолина, который использовали при формировании БЛМ, единственная такая группа – фосфат – имеет рК около 2.2. Эксперимент проводили при рН около 7, что далеко от значения рК, а уменьшение рН в растворе около мембраны при фотолизе MNPS, согласно нашим оценкам [14], составляет величину менее 0.1, что не позволяет существенно приблизить рН к значению рК. Более того, если БЛМ была сформирована из глицерилмоноолеата – липида, не содержащего кислотные группы, возрастание емкости при вспышке света тоже наблюдалось, и величина его была сравнима со скачком емкости, измеренным в аналогичных условиях на БЛМ из фосфатидилхолина (рис. 5).
Рис. 5.
Изменения емкости вследствие фотолиза MNPS при вспышке света на БЛМ из дифитаноилфосфатидилхолина (PC) и глицерилмоноолеата (GMO). Вспышка света происходила в нулевой момент времени. Водный раствор содержал 12 мМ NMG, 0.14 EDTA, pH 7.26. В отсек ячейки, дальний по отношению к источнику света, добавлен MNPS-Na в концентрации 300 мкМ.
Вероятнее всего, возрастание емкости мембраны при освобождении протонов из MNPS вызвано с их связыванием не с фосфолипидами, а с молекулами ориентированной воды на поверхности мембраны. Существованием слоя ориентированной воды объясняют аномальную подвижность протонов вдоль поверхности как мембраны, так и любой границы раздела воды с гидрофобной средой [4, 7, 8]. Слой молекул воды на границе имеет диэлектрическую проницаемость ниже, чем в объеме воды, и прохождение протонов через этот слой требует преодоления значительного потенциального барьера [1, 8]. Изменение емкости при протонировании мембраны можно объяснить либо изменением диэлектрической проницаемости этого слоя, либо перемещением протонов через потенциальный барьер между поверхностью мембраны и объемом раствора при приложении переменного электрического поля. Еще одной возможной причиной изменения емкости может быть изменение поверхностного натяжения границы мембраны, вследствие чего изменяется краевой угол между липидным бислоем и микролинзами, а следовательно, и площадь бислоя.
Восстановление емкости мембраны и граничного потенциала после вспышки света происходило за время порядка десятков секунд. Это время значительно больше характерного времени удержания протонов на поверхности мембраны, но сравнимо со временем изменения рН в растворе около мембраны, полученным с помощью флуоресцентных зондов (флуоресценция зондов, находящихся в мембране, изменялась за секунды, а зондов в воде – за десятки секунд [6]). Похожее время восстановления наблюдалось нами для потенциала мембраны, проницаемой для протонов в присутствии протонофора – пентахлорфенола [14]. Кинетику удержания протонов на поверхности мембраны с характерными временами порядка секунд связывают с наличием потенциального барьера на ее границе [4, 6–8]. Десятки секунд, наблюдаемые в наших экспериментах и сопоставимые с временем изменения рН в растворе, указывают на то, что такая кинетика, скорее всего, связана с другим процессом. Им может быть диффузия протонов через неперемешиваемый слой около мембраны.
Вывод о том, что протоны после вспышки света освобождаются в неперемешиваемый слой, можно сделать на основании оценок величины скачка рН при фотолизе адсорбированных на БЛМ молекул MNPS. Количество протонов, освобождаемых при вспышке света на единицу площади БЛМ, можно оценить на основании измерений электростатического потенциала. В соответствии с приведенными выше результатами измерений, исходный поверхностный потенциал на мембране, вызванный адсорбцией MNPS при концентрации в растворе 300 мкМ, равен 10 мВ, а его уменьшение из-за вызванного вспышкой фотолиза равно 1 мВ. Тогда изменение заряда мембраны Δσ вследствие разрушения MNPS, согласно уравнению (1), составляет около 10–7 Кл/см2. Если считать, что при разрушении каждой молекулы MNPS освобождается по протону, то количество выброшенных протонов на единицу поверхности равно Δσ/e = 1012 шт/см2, где e – заряд электрона. Оценим изменение рН около мембраны, предположив, что протоны, освобожденные с ее поверхности при вспышке света, попадают в неперемешиваемый слой. Если толщина неперемешиваемого слоя составляет около 10–4 м, то концентрация протонов, выбрасываемых в этот слой, равна около 10–7 М при условии, что они распределены в нем равномерно. На самом деле это распределение неравномерное, и концентрация протонов около мембраны должна быть выше. Пусть за счет неравномерного распределения эта концентрация будет выше в 10 раз и составлять около 10–6 М. Измерения в [14] проводили при рН 7.4 в растворе 12 мМ NMG, который является буфером с рК, равным 9.5. С учетом буфера изменение рН в неперемешиваемом слое при добавлении 10–6 М протонов составляет около 0.07, что близко с результатами эксперимента, где скачок рН, измеренный по изменению потенциала мембраны, проницаемой по протонам в присутствии разобщителя – пентахлорфенола, составлял около 0.1 [14].
Таким образом, мы показали, что при вспышке света происходит изменение емкости мембраны и скачка потенциала на ее поверхности. Механизм изменения емкости остается невыясненным. В изменении потенциала и емкости участвуют протоны, освободившиеся из MNPS на поверхности мембраны. Величину изменения рН около мембраны и кинетику его восстановления можно объяснить диффузией протонов в неперемешиваемом слое воды около мембраны, куда попадают протоны после фотолиза MNPS на ее поверхности.
Работа поддержана проектом РФФИ № 16-04-01162. Электрокинетические измерения проводились при поддержке проекта РФФИ № 16-04-00556.
Список литературы
Cherepanov D.A., Feniouk B.A., Junge W., Mulkidjanian A.Y. 2003. Low dielectric permittivity of water at the membrane interface: effect on the energy coupling mechanism in biological membranes. Biophys. J. 85 (2), 1307–1316.
Georgievskii Yu., Medvedev E.S., Stuchebrukhov A.A. 2002. Proton transport via the membrane surface. Biophys. J. 82, 2833–2846.
Agmon N., Bakker H.J., Campen R.K., Henchman R.H., Pohl P., Roke S., Thamer M., Hassanali A. 2016. Protons and hydroxide ions in aqueous systems. Chem. Rev. 116 (13), 7642–7672.
Zhang C., Knyazev D.G., Vereshaga Y.A., Ippoliti E., Nguyen T.H., Carloni P., Pohl P. 2012. Water at hydrophobic interfaces delays proton surface-to-bulk transfer and provides a pathway for lateral proton diffusion. Proc. Natl. Acad. Sci. USA. 109 (25), 9744–9749.
Ferguson S.J. 1985. Fully delocalised chemiosmotic or Iocalised proton flow pathways in energy coupling? A scrutiny of experimental evidence. Biochim. Biophys. Acta. 811, 47–95.
Serowy S., Saparov S.M., Antonenko Y.N., Kozlovsky W., Hagen V., Pohl P. 2003. Structural proton diffusion along lipid bilayers. Biophys. J. 84 (2 Pt 1), 1031–1037.
Springer A., Hagen V., Cherepanov D.A., Antonenko Y.N., Pohl P. 2011. Protons migrate along interfacial water without significant contributions from jumps between ionizable groups on the membrane surface. Proc. Natl. Acad. Sci. USA. 108 (35), 14461–14466.
Weichselbaum E., Osterbauer M., Knyazev D.G., Batishchev O.V., Akimov S.A., Hai N.T., Zhang C., Knor G., Agmon N., Carloni P., Pohl P. 2017. Origin of proton affinity to membrane/water interfaces. Sci. Rep. 7 (1), 4553.
Kaplan J.H., Forbush I.B., Hoffman J.F. 1978. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of hunab red blood cell ghosts. Biochemistry. 17, 1929–1935.
Apell H.-J., Sokolov V.S. 2015. Pumps, Channels and Transporters: Methods of Functional Analysis. Eds Clarke R.J., Khalid M.A.A. Hoboken, New Jersey: Wiley, p. 23–49.
Geissler D., Antonenko Y.N., Schmidt R., Keller S., Krylova O.O., Wiesner B., Bendig J., Pohl P., Hagen V. 2005. (Coumarin-4-yl)methyl esters as highly efficient, ultrafast phototriggers for protons and their application to acidifying membrane surfaces. Angew. Chem. Int. Ed Engl. 44 (8), 1195–1198.
Fibich A., Janko K., Apell H.J. 2007. Kinetics of proton binding to the sarcoplasmic reticulum Ca-ATPase in the E1 state. Biophys J. 93 (9), 3092–3104.
Вишнякова В.Е., Ташкин В.Ю., Терентьев А.О., Апель Х.-Ю., Соколов В.С. 2018. Связывание ионов калия в канале доступа с цитоплазматической стороны Na+,K+-ATP-азы. Биол. мембраны. 35 (5), 376–383.
Ташкин В.Ю., Щербаков А.А., Апель Х.-Ю., Соколов В.С. 2013. Конкурентный транспорт ионов натрия и протонов в цитоплазматическом канале Na+,K+-ATP-азы. Биол. мембраны. 30 (2), 105–114.
Ташкин В.Ю., Гаврильчик А.Н., Иловайский А.И., Апель Х.-Ю., Соколов В.С. 2015. Электрогенное связывание ионов с цитоплазматической стороны Na+,K+-ATP-азы. Биол. мембраны. 32 (2), 110–118.
Соколов В.С., Кузьмин В.Г. 1980. Измерение разности поверхностных потенциалов бислойных мембран по второй гармонике емкостного тока. Биофизика. 25 (1),170–172.
Ermakov Yu.A., Sokolov V.S. 2003. Planar lipid bilayers (BLMs) and their applications. Eds Tien H.T., Ottova-Leitmannova A. Amsterdam etc.: Elsevier, p. 109–141.
Sokolov V.S., Mirsky V.M. 2004. Ultrathin electrochemical chemo- and biosensors: technology and performance. Ed. Mirsky V.M. Heidelberg: Springer-Verlag, p. 255–291.
Sokolov V.S., Gavrilchik A.N., Kulagina A.O., Meshkov I.N., Pohl P., Gorbunova Y.G. 2016. Voltage-sensitive styryl dyes as singlet oxygen targets on the surface of bilayer lipid membrane. J. Photochem. Photobiol. B. 161, 162–169.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


