Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 290-295
Нейропротективные свойства антисмысловых олигодезоксинуклеотидов к субъединице GluN1 N-метил-D-аспартатного рецептора
А. А. Мокрушин *
Институт физиологии им. И.П. Павлова РАН,
199034 Санкт-Петербург, наб. Макарова, 6, Россия
* E-mail: mok@inbox.ru
Поступила в редакцию 24.11.2018
После доработки 09.01.2019
Принята к публикации 14.01.2019
Аннотация
Исследовали нейропротективные эффекты антисмысловых (АсОДН) (5'-cagcaggtgcatggtgct-3') и смысловых олигодезоксинуклеотидов (сОДН) (5'-ctacaacgtacaagtagt-3') (10–8 М) к субъединице GluN1 НМДА-рецептора в срезах обонятельной коры мозга крыс Вистар при 10-мин аноксии и в модели глутаматной эксайтотоксичности (L-глутамат, 20 мМ). Анализировали изменения амплитуд НМДА-потенциалов после предварительной инкубации срезов в присутствии АсОДН или сОДН в течение 360 мин. Аноксия в течение 10 мин вызывала необратимое блокирование НМДА-потенциалов. сОДН не влияли на этот процесс, а АсОДН восстанавливали амплитуду НМДА-потенциалов до 46 ± 6% от контроля. При аппликации L-глутамата (20 мМ) на срезы, обработанные АсОДН, амплитуда НМДА-потенциалов сохранялась на уровне 67 ± 7% от контрольных значений, тогда как при действии только L-глутамата НМДА-потенциалы блокировались. При инкубации срезов с сОДН при действии L-глутамата амплитуды НМДА-потенциалов составляли только 29 ± 7% от контроля. Полученные данные свидетельствуют о нейропротективных свойствах АсОДН при действии тяжелой аноксии и в модели глутаматной эксайтотоксичности.
ВВЕДЕНИЕ
Рецепторы N-метил-D-аспартата (НМДА) относятся к семейству ионотропных глутаматергических рецепторов. Установлено, что НМДА-зависимые механизмы являются ключевым элементом возбуждающей глутаматергической медиаторной системы. Они участвуют в различных формах адаптивных реакций в нормальных условиях и при развитии патологий. НМДА-рецепторы – гетеротетрамерные структуры, состоящие из двух субъединиц GluN1 и двух субъединиц GluN2 или GluN3. Белковые субъединицы формируют ионные каналы, способные к проникновению внутрь клеток внеклеточных ионов Ca2+ во время возбуждения. Доказано, что GluN1 как обязательная субъединица играет главную роль в функционировании НМДА-рецепторов [1, 2]. Полагают, что именно эта субъединица ответственна за формирование адаптивных реакций организма [1–4].
Принимая во внимание существенную роль НМДА-зависимых механизмов в реакциях нервных клеток на цитотоксические воздействия, можно полагать, что ингибирование этих механизмов химическими препаратами обеспечит нейропротективный эффект при действии негативных факторов. Среди потенциальных химических агентов, обладающих нейропротективным действием при функционированиии НМДА-зависимых механизмов, заслуживают внимания антисмысловые олигодезоксинуклеотиды (АсОДН). С их помощью можно корректировать процессы в клетке, не затрагивающие целостность генома [5, 6]. АсОДН представляют собой короткие последовательности и применяются для специфического блокирования экспрессии генов. АсОДН присоединяются к специфической мРНК, препятствуют трансляции и, следовательно, выработке белка [7, 8]. Такое воздействие позволяет временно и с высокой специфичностью воздействовать на любой процесс в клетке. В настоящее время создание препаратов на основе АсОДН – одно из перспективных и успешных направлений при разработке лекарственных средств, эффективных при онкологических заболеваниях [9], гипертонической болезни [10] и др. Применение АсОДН в экспериментах на культуре нервных клетках in vitro выявило их способность защищать от негативного воздействия эксайтотоксичности. Введение АсОДН in vivo уменьшало объем мозговой ткани, пораженной ишемией, и защищало от воздействия эксайтотоксичности [11, 12].
В нашей работе на срезах обонятельной коры мозга крыс исследованы нейропротективные эффекты АсОДН на субъединицу GluN1 НМДА-рецептора при воздействии сильного стресс-фактора (10 мин аноксии) и в модели глутаматной эксайтотоксичности. Смысловые олигодезоксинуклеотиды (сОДН) использовали в качестве контроля для сопоставления с эффектами АсОДН.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на крысах-самцах линии Вистар массой 180–200 г из биоколлекции Института физиологии им. И.П. Павлова РАН (“Коллекция лабораторных млекопитающих разной таксономической принадлежности”), поддержанной программой биоресурсных коллекций Минобрнауки России с соблюдением рекомендаций по этике работы с животными, предложенными European Communities Council Direction (86/609 EEC). Опыты с животными проводились в соответствии с Руководством Совета Федерации по уходу и использованию лабораторных животных (1994 г.) и с принципами этического кодекса Института физиологии им. И.П. Павлова РАН (1996 г.).
Тангенциальные срезы обонятельной коры толщиной 450–500 мкм изготавливали из мозга крыс. Срезы помещали в камеру для регистрации электрической активности и перфузировали со скоростью 2 мл/мин искусственной церебральной жидкостью следующего состава (мМ): NaCl – 124.0; KCl – 5.0; CaCl2 – 2.6; KH2PO4 – 1.24; MgSO4 – 1.2; NaHCO3 – 3.0; глюкоза – 10.0; Трис-НCl – 23.0. Инкубационный раствор продували кислородом, рН среды составлял 7.2–7.3.
В срезах внеклеточно регистрировали НМДА-синаптический компонент возбуждающего постсинаптического потенциала (в дальнейшем “НМДА-потенциалы”) стеклянными микроэлектродами, заполненными 1 M NaCl, сопротивление 1–5 мОм. НМДА-потенциалы вызывались стимуляцией латерального обонятельного тракта (ЛОТ) – афферентного входа к нейронам обонятельной коры. Активация ЛОТ производилась электрическими импульсами прямоугольной формы длительностью 0.1 мс, с частотой 0.003 Гц и интенсивностью 0.1–0.3 мА, генерируемыми стимулятором ЭСУ-1 (Россия). Регистрируемые НМДА-потенциалы оцифровывали с частотой 20 кГц с помощью интерфейса Е20-10 (Россия) и обрабатывали на компьютере с помощью специальной программы. Амплитуды НМДА-потенциалов измеряли от изолинии до пика (рис. 1).
Рис. 1.
Идентификация пре- и постсинаптических компонентов фокальных потенциалов (ФП), вызываемых электрической стимуляцией ЛОТ. Усредненные ФП в нормальной инкубационной среде в контроле (n = 7) (кривая 3) и в присутствии блокатора АМПА-рецепторов CNQX (n = 8) (кривая 1). Кривая 2 – ФП в присутствии блокатора НМДА-рецепторов D-APV в среде с пониженным содержанием Mg2+ (200 мкM) (n = 6). Горизонтальная прямая соответствует уровню потенциала, регистрируемого в покое. Вертикальные серые линии – измерение амплитуд АМПА- и НМДА потенциалов; ас – артефакт стимуляции; 1 – пресинаптический компонент ФП, отражает активацию проводящих волокон ЛОТ; 2, 3 – АМПА- и НМДА-потенциалы соответственно. Калибровка: 0.1 мВ; 5 мс.
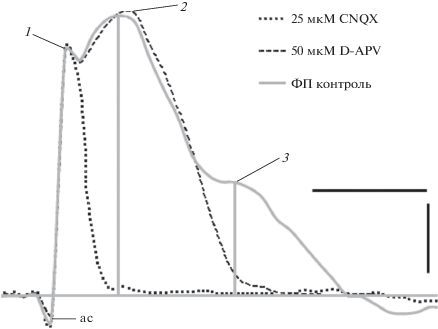
Идентификация отдельных компонентов фокального потенциала (ФП), регистрируемого в срезах обонятельной коры, проводилась с использованием специфических блокаторов: НМДА-рецепторов – D-APV (D-2-amino-5-phosphonovalerate); АМПА-рецепторов – CNQX (6-сyano-7-nitroquinoxaline-2,3-dione), с помощью методов, описанных в работах [13–15]. Вызванные ФП регистрировались в ответ на стимуляцию ЛОТ в контроле и во время инкубации срезов специфическими антагонистами АМПА- и НМДА-рецепторов. ФП является многокомпонентным потенциалом и состоит из пресинаптического компонента, который отражает активность проводящих волокон ЛОТ (ПД ЛОТ), и постсинаптических компонентов, которые отражают активацию глутаматергических ионотропных механизмов – АМПА- и НМДА-потенциалов (рис. 1). Для идентификации НМДА-потенциалов срезы инкубировали с D-APV (50 мкМ). Для предотвращения блокады этих рецепторов ионами Mg2+ срезы инкубировали в среде с низкой концентрацией этих ионов (200 мкМ) в течение 20 мин. Полученные результаты продемонстрировали редукцию позднего синаптического компонента ФП, что указывает на его активацию НМДА-рецепторами. Для выявления АМПА-компонента ФП срезы инкубировали с CNQX (25 мкМ) в течение 20 мин. Такое воздействие блокировало ранний постсинаптический компонент, а также НМДА-компонент, сохранялся только преснаптический компонент – ПД ЛОТ (рис. 1). Таким образом, проведенная фармакологическая идентификация синаптических компонентов ФП свидетельствует, что ранний АМПА-потенциал отражает активацию АМПА, а поздний – НМДА-рецепторов (рис. 1).
В работе были изучены нейропротективные эффекты АсОДН (5'-cagcaggtgcatggtgct-3') и сОДН (5'-ctacaacgtacaagtagt-3'). Срезы инкубировали в стеклянных флаконах в 1 мл инкубационной среды с АсОДН и сОДН в концентрации 10–8 М в течение 360 мин в аппарате Варбурга (Германия) при температуре 37°С.
Следует отметить, что предварительно проведенное тестирование широко применяемых препаратов, усиливающих введение АсОДН и сОДН в нейроны (липосомы, Lipofectamine 2000, Pluronic F127 – блоксополимер полиоксиэтилена и полиоксипропилена), выявило их высокую токсичность. Поэтому в нашей работе была использована методика длительной инкубации срезов в среде с АсОДН и сОДН без применения этих препаратов.
Время достижения эффектов АсОДН и сОДН определяли по возникновению ответных реакций – изменению амплитуд НМДА-потенциалов. Мы обнаружили, что действие как сОДН, так и АсОДН проявлялось после 270-мин инкубации срезов. Для надежности был использован более длительный период инкубации – 360 мин. Эффекты АсОДН и сОДН продолжались 10 ч (время наблюдения). Таким образом, мы изучали эффекты транзиентной трансфекции АсОДН и сОДН нейронов в переживающих срезах мозга.
Эксперименты проводили следующим образом. В начале каждого опыта в срезах регистрировали амплитуды НМДА-потенциалов в течение 15 мин, средние величины амплитуд этих потенциалов рассматривали как контрольные значения для данного среза. Затем в течение 20 мин регистрировали НМДА-потенциалы при действии АсОДН с интервалом 1 мин. На одном срезе регистрировали 23 НМДА-потенциала.
В серии экспериментов по изучению нейропротективного влияния АсОДН и сОДН (10–8 М) в условиях аноксии срезы мозга перфузировали средой, которую продували азотом в течение 2 или 10 мин. Эффекты аноксии на изменения амплитуд НМДА-потенциалов определяли через 360 мин инкубации срезов с АсОДН и сОДН. Для того чтобы оценить протективные эффекты АсОДН и сОДН в модели глутаматной эксайтотоксичности на срезы апплицировали L-глутамат в токсической концентрации 20 мМ. Токсические воздействия L-глутамата регистрировали через 360 мин инкубации срезов с АсОДН и сОДН.
ОДН были приобретены в Государственной научной корпорации “Вектор” (Новосибирск, Россия), химические реактивы для инкубационной среды получены из фирмы “Химреактив” (Россия).
Для статистической обработки данных применяли непараметрический U-критерий Вилкоксона–Манна–Уитни. Уровень статистической значимости был р ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
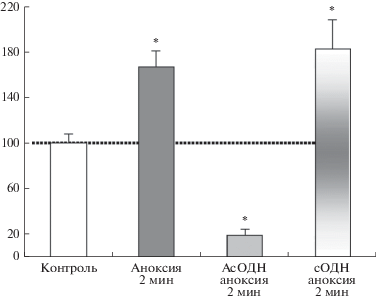
После 360-мин инкубации срезов с АсОДН и сОДН (10–8 М) амплитуда НМДА-потенциалов в срезах мозга в ответ на стимуляцию ЛОТ с частотой 0.003 Гц существенно не изменялась, различия составляли 5–7% (n = 7) по сравнению с контролем. Напротив, после эпизодов аноксии амплитуды НМДА-потенциалов значительно отличались от контрольных значений. Так, при действии 2-мин аноксии амплитуда НМДА-потенциалов увеличивалась до 167 ± 5% от контрольного уровня (рис. 2). Такая потенциация, индуцированная аноксией, возникала во всех протестированных срезах (n = 7). Предварительная инкубация срезов с АсОДН или сОДН в течение 360 мин значительно влияла на амплитуды НМДА-потенциалов. При действии АсОДН амплитуда снижалась до 19 ± 4% по сравнению с контролем (рис. 2). Это указывает на ингибирование активности НМДА-зависимых механизмов и, следовательно, торможение потенциации, вызванной аноксией. В отличие от АсОДН, сОДН не только сохранял, но и усиливал вызванную аноксией потенциацию НМДА-зависимых процессов (рис. 2).
Рис. 2.
Влияние АсОДН и сОДН на амлитуды НМДА-потенциалов в условиях 2-мин аноксии. По оси ординат – амплитуда потенциалов в % от контроля. Горизонтальная пунктирная линия – значение НМДА-потенциалов в контроле. * р ≤ 0.05; U – критерий Вилкоксона–Манна–Уитни, n = 7 для каждой точки.
При 10-мин аноксии НМДА-потенциалы почти полностью блокировались (рис. 3). Если 10-мин аноксии предшествовала инкубация срезов с АсОДН, то амплитуды НМДА-потенциалов составляли 46 ± 6% от контрольных значений (U = 5, n = 7, p ≤ 0.05) (рис. 3). Таким образом, при 10-мин аноксии АсОДН оказывает нейропротективное действие, так как способствует сохранению активности нейронов при действии негативного стресс-фактора.
Рис. 3.
Влияние АсОДН и сОДН на амлитуды НМДА-потенциалов в условиях 10-мин аноксии. Обозначения как на рис. 2.
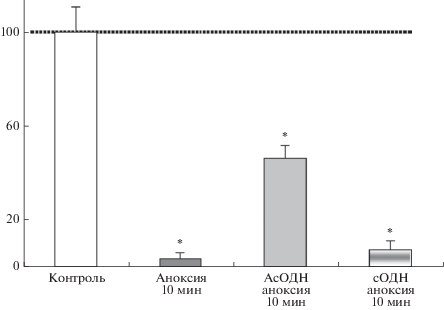
Предварительная инкубация срезов с сОДН практически не влияла на блокаду НМДА-потенциалов при действии 10-мин аноксии (рис. 3): амплитуда НМДА-потенциалов необратимо блокировалась до 7 ± 2% от контроля (U = 2, n = 7, p ≤ 0.05), и, следовательно, сОДН не обладал нейропротективным действием.
Для того чтобы оценить действие АсОДН и сОДН на развитие острой стадии многих нейрологических заболеваний, связанных с глутаматной эксайтотоксичностью (ишемия, эпилепсия, травма), эффекты АсОДН и сОДН были также исследованы на модели глутаматной эксайтотоксичности. С этой целью на срезы апплицировали L-глутамат в концентрации 20 мМ. Согласно ранее полученным данным, L-глутамат индуцировал двухфазные изменения активности НМДА-зависимых механизмов: усиление активности (5–30 мин) и последующее ее блокирование (40–60 мин) [16]. Для того чтобы оценить эффекты АсОДН и сОДН, было проанализировано их влияние на НМДА-потенциалы на 50–60 мин действия L-глутамата. В этом интервале времени эффекты агониста были наиболее выражены, и амплитуда НМДА-потенциалов составляла 6 ± 2% от контроля (U = 2, n = 7, p ≤ 0.05) [6].
Исследования показали, что АсОДН способствовал сохранению активности НМДА-зависимых механизмов. Это выражалось в том, что значения амплитуд НМДА-потенциалов хотя и отличались статистически от контрольных значений (67 ± 7%, U = 11, n = 7, p ≤ 0.05), но сохранялись на высоком уровне по сравнению с величинами НМДА-потенциалов в присутствии L-глутамата без АсОДН (рис. 4). Следовательно, на модели глутаматной эксайтотоксичности АсОДН оказывал нейропротективное действие. Можно ожидать, что на других моделях нейрологических заболеваний, обусловленных развитием глутаматной эксайтотоксичности (инсульт мозга, эпилепсия, травма), АсОДН также будет оказывать протективное действие, однако это предположение требует экспериментальной проверки.
Рис. 4.
Влияние АсОДН и сОДН на амлитуды НМДА-потенциалов при действии токсической концентрации L-глутамата (20 мМ) на срезы мозга. По оси ординат – амплитуда потенциалов в % от контроля. Горизонтальная пунктирная линия – значение НМДА-потенциалов в контроле. * р ≤ 0.05; U – критерий Вилкоксона–Манна–Уитни, n = 7 для каждой точки.
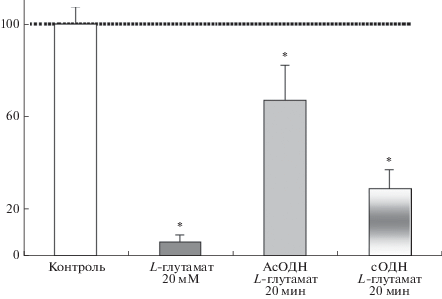
Нейропротективный эффект сОДН на срезах в случае модели глутаматной эксайтотоксичности был менее выражен, чем при действии АсОДН (рис. 4). У срезов, обработанных сОДН, амплитуда НМДА-потенциалов в присутствии L-глутамата составляла 29 ± 6%, что статистически достоверно отличалось от контрольных значений (U = 8, n = 7, p ≤ 0.05) и от значений потенциалов в присутствии L-глутамата без сОДН (U = 3, n = 7, p ≤ 0.05). Сопоставляя эффекты АсОДН и сОДН, можно констатировать, что амплитуды НМДА-потенциалов в присутствии АсОДН были примерно в 2 раза выше, чем при действии сОДН (рис. 4).
ЗАКЛЮЧЕНИЕ
Проведенные исследования свидетельствуют о том, что ингибирование активности субъединицы GluN1 НМДА-рецептора с помощью АсОДН способствует сохранению активности НМДА-зависимых механизмов в условиях аноксии и в модели глутаматной эксайтотоксичности. Оптимизация активности НМДА-механизмов посредством модуляции субъединицы GluN1 обеспечивает нейропротективный эффект АсОДН при действии стресс-факторов и при развитии неврологических нарушений.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 годы (ГП-14, раздел 65.2).
Список литературы
Salussolia C.L., Prodromou M.L., Borker P., Wollmuth L.P. 2010. Arrangement of subunits in functional NMDA receptors. J. Neuroscience. 31 (31), 11 295–11 304.
Traynelis S.F., Wollmuth L.P., McBain C.J., Manniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J., Dingledine R. 2010. Glutamate receptor ion channels: Structure, regulation, and function. Pharmacol. Rev. 62 (3), 405–496.
Cull-Candy S.C., Leszkiewicz D.N. 2004. Role of distinct NMDA receptor subtypes at central synapses. SciSTKE. 255, re16.
Mayer M.L. 2011. Structure and mechanism of glutamate receptor ion channel assembly, activation and modulation. Curr. Opin. Neurobiol. 21 (2), 283–290.
Зеленин A.B., Кайгородов В.А., Прасолов B.С. 1998. Генная терапия сегодня и завтра. Молекуляр. биология. 32, 219–228.
Kurreck J. 2003. Antisense technologies. Improvement through novel chemical modifications. Eur. J. Biochem. 270 (8), 1628–1644.
Weyermann J., Lochmann D., Andreas G. 2005. Albumin-protamine-oligonucleotide-nanoparticles as a new antisense delivery system. Part 2: Cellular uptake and effect Zimmer. Eur. J. Pharmaceutics and Biopharmaceutics. 59, 431–438.
Zamecnik P.C., Stephenson M.L. 1978. Inhibition of Rous sarcoma virus replication and cell transformation by a specific oligodeoxynucleotide. Proc. Natl Acad. Sci. USA. 75, 280–284.
Mullen P., McPhillips F., MacLeod K. 2004. Antisense oligonucleotide targeting of Raf-1: Importance of raf-1 mRNA expression levels and raf-1-dependent signaling in determining growth response in ovarian cancer. Clin. Cancer Res. 10 (6), 2100–2108.
Phillips M.I, Kimura B. 2005. Antisense therapeutics for hypertension: Targeting the renin-angiotensin system. Methods Mol. Med. 106, 51–68.
Wahlestedt C., Golanov . E., Yamamoto S., Yee F., Ericson H., Yoo H., Inturrisi C., Reis D. 1993. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363, 260–263.
Shan W., Wu X., Zhang G., Zhang Y., Liang Y., Wang Z. 1997. Effects of antisense oligodeoxynucleotides to NR1 on suppression of seizures and protection of cortical neurons from excitotoxicity in vivo and in vitro. Chin. Med. J. (Engl). 110, 579–583.
Hoffman W.H., Haberly L. 1989. Bursting induces persistent All-or-None EPSPs by an NMDA-dependent process in piriform cortex. J. Neurosci. 9 (1), 206–215.
Jung M.W., Larson J., Lynch G. 1990. Role of NMDA and non-NMDA receptors in synaptic transmission in rat piriform cortex. Exp. Brain Res. 82 (5), 451–455.
Mokrushin A.A., Pavlinova L.I. 2013. Effects of the blood components on the AMPA and NMDA synaptic responses in brain slices in the onset of hemorrhagic stroke. Gen. Physiol. Biophys. 32, 489–504.
Mokrushin A.A. 2016. Mystixin-7 peptide protects ionotropic glutamatergic mechanisms against glutamate-induced excitotoxicity in vitro. Int. J. Peptides. 2016, 1–10.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


