Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 281-289
Влияние газотрансмиттеров на мембранную эластичность и микрореологию эритроцитов
А. В. Муравьев a, *, П. В. Авдонин b, И. А. Тихомирова a, С. В. Булаева a, Ю. В. Малышева a
a Ярославский государственный педагогический университет
им. К.Д. Ушинского
150000 Ярославль, Республиканская ул., 108, Россия
b Институт биологии развития им. Н.К. Кольцова РАН,
119334 Москва, ул. Вавилова, 26,
Россия
* E-mail: alexei.47@mail.ru
Поступила в редакцию 27.12.2018
После доработки 28.01.2019
Принята к публикации 06.02.2019
Аннотация
При выполнении транспортной функции эритроциты изменяют свои микромеханические свойства, связанные с мембранной вязкоэластичностью. Имеется ряд свидетельств, что это происходит под влиянием сигнальных молекул, к которым относятся и газотрансмиттеры: оксид азота (NO) и сульфид водорода (H2S). Целью данного исследования было изучение микрореологических изменений человеческих эритроцитов под влиянием доноров и стимуляторов эндогенного образования газотрансмиттеров. Регистрировали деформируемость (по индексу удлинения эритроцитов – ИУЭ) и показатели агрегации (ПАЭ) отмытых эритроцитов после их инкубации с нитропруссидом натрия (НПН), донором H2S – гидросульфидом натрия (NaHS), ингибитором активности растворимой гуанилатциклазы – 1H-[1,2,4]-oxadiazolo[4,3-a]quinoxalin-l-one (ODQ), субстратом NO-синтазы L-аргинином и ингибитором ее активности N-Nitroarginine methyl ester (L-NAME), с блокатором ATP-чувствительных калиевых каналов – глибенкламидом (ГлК). Кроме того, готовили восстановленные тени эритроцитов, инкубировали с названными выше соединениями и оценивали изменение их деформируемости. После инкубации эритроцитов с НПН и NaHS наблюдался прирост ИУЭ на 8–11% (p < 0.01) и снижение ПАЭ на 11–26% (p < 0.01). L-аргинин и НПН оказывали сходные с микрореологические эффекты, которые устранялись L-NAME или ODQ. ГлК вызывал увеличение ИУЭ эритроцитов на 8% (p < 0.05); эффекты ГлК и NaHS не были аддитивными. Инкубация восстановленных теней эритроцитов с НПН, L-аргинином и NaHS сопровождалась умеренным, статистически значимым приростом эластичности мембран (p < 0.05). Результаты исследования позволяют заключить, что доноры и стимуляторы образования газотрансмиттеров NO и H2S умеренно повышают деформируемость эритроцитов и заметно снижают их агрегацию. Эксперименты с тенями эритроцитов свидетельствуют о существовании независимого от cGMP прямого действия газотрансмиттеров на вязкоэластичные свойства мембраны этих клеток.
ВВЕДЕНИЕ
В последние десятилетия возник повышенный интерес к новому классу сигнальных молекул, известных как газотрансмиттеры: оксид азота (NO), монооксид углерода (СО) и сульфид водорода (H2S) [1, 2]. Имеются многочисленные работы, в которых сообщается о важной роли газотрансмиттеров в регуляции функций организма [3, 4], в том числе клеток крови [5, 6]. Известно, что эритроциты при выполнении кислород-транспортной функции должны реализовать свои микрореологические свойства – деформируемость и агрегацию [7, 8]. Было показано, что эти клеточные характеристики положительно изменяются под влиянием донора NO нитропруссида натрия (НПН) или при добавлении субстрата эндотелиальной NO-синтазы (eNOS) L-аргинина – увеличивается деформируемость и уменьшается агрегация эритроцитов [9–11]. Что касается других газотрансмиттеров, то имеются только данные о снижающем агрегацию тромбоцитов эффекте сероводорода [5, 12]. Важно заметить, что у зрелых эритроцитов возможна количественная регистрирация изменений микромеханических свойств мембраны. Кроме того, в эритроцитах имеются активные элементы молекулярных сигнальных каскадов [13, 14], в том числе G-белки, аденилатциклаза, гуанилатциклаза, cAMP и cGMP, мембранные ионные каналы, несколько видов фосфодиэстераз, протеинкиназы и фосфатазы [15]. Это как раз те молекулярные мишени, на которые могут действовать газотрансмиттеры [16, 17]. Таким образом, на модели микрореологического поведения эритроцитов можно изучить сигнальные механизмы влияния газотрансмиттеров. Цель настоящей работы состояла в изучении влияния доноров NO и H2S, а также стимулятора эндогенного образования оксида азота L-аргинина на микрореологические свойства эритроцитов.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы цельной крови (9 мл) здоровых доноров (n = 20) получали венопункцией в гепаринизированные вакуумные пробирки (пробирки содержат 12–30 МЕ сухого гепарина на 1 мл крови). Проведение исследования одобрено местным этическим комитетом университета (протокол № 4 от 19.07.2018 г.). Получено информированное согласие всех субъектов в соответствии с рекомендациями Хельсинкской декларации (Хельсинкская декларация WMA об этике. Принципы медицинских исследований с участием людей, с поправками, внесенными 64-й Генеральной Ассамблеей WMA, Форталеза, Бразилия, октябрь 2013 г.). Эритроциты отделяли от плазмы центрифугированием (15 мин, 3000 об/мин), трижды отмывали в изотоническом растворе хлорида натрия и ресуспендировали в буферном растворе (138 мМ NaCl, 3 мМ KCl, 1 мМ K2SO4, 7.5 мМ Na2HPO4, 1 мМ MgSO4, 5 мМ глюкозы, pH 7.4). Поскольку эндотелиальная NO-синтаза (eNOS) является кальций-зависимым ферментом, то в среду инкубации эритроцитов добавляли CaCl2 до его конечной концентрации 150 мкМ. Осмолярность составляла 300 мОсм/л (определяли на осмометре Fogel ОМ-801, Германия). В опытах с исследованием агрегации эритроцитов, для ее стимулирования, добавляли к буферному раствору относительно высокомолекулярный декстран-200 (10% ХАЕС-стерил, компания Fresenius Kabi, Германия) в соотношении 7 : 3 по объему. При этом осмолярность полученной смеси не изменялась. Суспензию эритроцитов делили на несколько аликвот и клетки инкубировали в течение 30 мин при 37°С с каждым из перечисленных ниже соединений:
1) с донором NO – нитропруссидом натрия (НПН, в концентрациях 20, 100 и 200 мкМ);
2) с ингибитором активности растворимой гуанилатциклазы (р-ГЦ) – 1H- [1, 2, 4]- oxadiazolo[4,3-a]quinoxalin-l-one (ODQ, 0.5 мкМ);
3) с субстратом эндотелиальной NO-синтазы (eNOS) L-аргинином (20, 100 и 200 мкМ);
4) с ингибитором активности NOS N-Nitroarginine methyl ester (L-NAME, концентрация 200 мкМ);
5) с донором H2S – гидросульфидом натрия (NaHS, в концентрациях 20, 100 и 200 мкМ);
6) с блокатором ATP-чувствительных калиевых каналов – глибенкламидом (ГлК), в концентрации 50 мкМ).
В каждом опыте в качестве контроля использовали суспензию эритроцитов, инкубируемых в течение 30 мин при 37°С в буферном растворе без добавления указанных выше препаратов. В опыте и в контроле проводилось по 20 параллельных измерений. Все препараты и соединения получены от фирмы Sigma-Aldrich (США). Их растворяли в дистиллированной воде. Все эксперименты проводили в течение 4 ч после взятия крови. Тени эритроцитов готовили по методу Доджа [18]. Эритроциты разрушали осмотическим шоком. Для этого к 1 мл клеток добавляли 7 мл охлажденной дистиллированной воды (при температуре 4°С) с последующей двукратной отмывкой в фосфатном буфере. Затем концентрат теней инкубировали в фосфатном буфере с добавлением 30% декстрана-200 (соотношение буфера и декстрана 7 : 3 по объему). Суспензию восстановленных теней эритроцитов делили на несколько аликвот, добавляли соответствующие препараты и после инкубации в течение 30 мин при 37°С регистрировали деформируемость теней в проточной микрокамере.
Исследование деформируемости и агрегации. Степень агрегации эритроцитов определяли с помощью агрегометра Myrenne M1 (Германия), который дает возможность получить четыре индекса агрегации при низких (3 с–1) и высоких (600 с–1) скоростях сдвига через 5 и 10 мин перемешивания (индексы агрегации: М5, М10, М15 и М110 соответственно). Кроме того, процесс агрегации и форму клеток контролировали с помощью прямой микроскопии. Поскольку все четыре индекса агрегации, которые регистрируются агрегометром Myrenne M1, изменялись однонаправлено и примерно одинаково, то для анализа использовали только индексы М5 и М10, которые регистрируются при низкой скорости сдвига. В таблицах и тексте они обозначены как показатели агрегации эритроцитов (ПАЭ1 и ПАЭ2).
Для оценки мембранной вязкоэластичности эритроцитов определяли индекс удлинения эритроцитов и их восстановленных теней (ИУЭ) в проточной микрокамере, где создавали постоянное течение суспензии эритроцитов (Hct = 0.5%). В микрокамеру подавали давление, которое создавало напряжение сдвига 0.98 Н/м2 к и вытягивало клетки (или их восстановленные тени), прикрепленные ко дну камеры (рис. 1). Адгезия клеток происходила спонтанно. На основе измерения длины (L) и ширины (W) вытянутых потоком клеток рассчитывали индекс их удлинения (ИУЭ) как показатель деформируемости эритроцитов: ИУЭ = L/W (отн. ед.).
Рис. 1.
Интактные недеформированные эритроциты (а); эритроциты, деформированные (вытянутые) строго дозированным напряжением сдвига потока в микрокамере (б); восстановленные тени эритроцитов до приложения напряжения сдвига (в); тени эритроцитов, деформированные в микрокамере (г). Изображение получено с использованием объектива 40× и цифрового окуляра DCM-500.

Статистическая обработка. Статистическую обработку результатов проводили с использованием программы Statistica 6.0. Проверку выборочного распределения проводили с помощью теста Шапиро–Уилка. Значимость различий определяли с помощью t-критерия Стьюдента. Гипотезу о взаимосвязи данных проверяли с помощью корреляции Спирмена. За уровень статистически значимых различий принимали изменения при p < 0.05 и p < 0.01. Данные в таблицах и тексте представлены как М ± m (среднее ± стандартная ошибка среднего).
РЕЗУЛЬТАТЫ
Изменение микрореологии эритроцитов после их инкубации с донором NO нитропруссидом натрия (НПН) и субстратом NO-синтазы L-аргинином. Оценка изменений микрореологических показателей эритроцитов после их инкубации с НПН выявила заметные изменения деформируемости и агрегации эритроцитов при всех трех выбранных концентрациях (рис. 2). При концентрации НПН 100 мкМ в суспензионной среде сдвиги были несколько более выраженными. Это касалось обеих микрореологических характеристик. Ингибитор р-ГЦ ODQ полностью устранял прирост ИУЭ и уменьшение ПАЭ2 под действием донора NO (табл. 1). Достоверного эффекта на вызванное НПН снижение ПАЭ1 выявлено не было.
Рис. 2.
Изменение деформируемости (а) и агрегации эритроцитов (б) после их инкубации с нитропруссидом натрия (НПН) в разных концентрациях. ИУЭ – индекс удлинения эритроцитов как показатель их деформируемости; ПАЭ – показатель агрегации эритроцитов; концентрации НПН составляли 20, 100 и 200 мкМ (НПН20, НПН100 и НПН200 соответственно). * Отличие от контроля статистически значимо (p < 0.05).
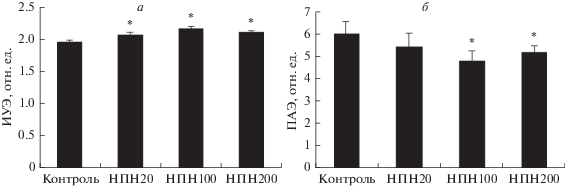
Таблица 1.
Изменение микрореологических характеристик эритроцитов после их инкубации с нитропруссидом натрия, ODQ по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатели, отн. ед. | Контроль | НПН | ODQ | ODQ + НПН |
|---|---|---|---|---|
| ИУЭ | 2.03 ± 0.01 | 2.21 ± 0.02* | 1.91 ± 0.01 | 1.98 ± 0.03 |
| ПАЭ1 | 5.04 ± 0.70 | 4.46 ± 0.80* | 4.93 ± 0.95 | 4.65 ± 0.63 |
| ПАЭ2 | 12.71 ± 1.51 | 8.65 ± 1.11** | 11.90 ± 1.07 | 12.55 ± 0.98* |
L-Аргинин в разных концентрациях (20, 100 и 200 мкМ) вызывал относительно небольшие, но статистически значимые изменения деформируемости эритроцитов (рис. 3а). Наиболее эффективной оказалась концентрация 100 мкМ. Анализ изменений деформируемости эритроцитов под влиянием инкубации с L-аргинином выявил увеличение этой микрореологической характеристики на 8% (р < 0.01; табл. 2). Ингибитор активности NOS, L-NAME, незначительно снижал величину ИУЭ (на 3%) относительно контрольных проб, тогда как после инкубации клеток с L-аргинином снижение составило 10% (р < 0.01). Таким образом, после преинкубации эритроцитов с L-NAME L-аргинин не влиял на деформируемость эритроцитов (табл. 2). Стимулирование образования оксида азота NO-синтазой эритроцитов при добавлении L-аргинина приводило к снижению агрегации эритроцитов, и, напротив, ингибирование активности этого фермента с помощью L-NAME практически полностью устраняло данный эффект (табл. 2, рис. 3б).
Рис. 3.
Дозозависимое влияние L-аргинина (L-A) на деформируемость (а) и агрегацию эритроцитов (б). В скобках указаны концентрации аргинина (мкМ). *Отличие от контроля статистически значимо (p < 0.05).
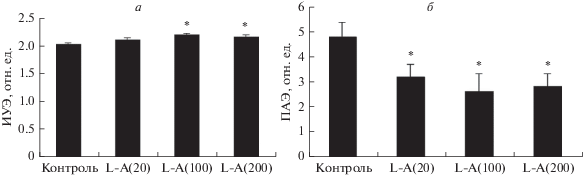
Таблица 2.
Изменение микрореологических характеристик эритроцитов после их инкубации с L-аргинином (100 мкМ) и L-NAME (200 мкМ) по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель, отн. ед. | Контроль | L-Аргинин (L-А) | L-NAME | L-NAME + L-А |
|---|---|---|---|---|
| ИУЭ | 2.01 ± 0.03 | 2.17 ± 0.02** | 1.95 ± 0.04*** | 1.98 ± 0.04 |
| ПАЭ1 | 4.05 ± 0.36 | 3.01 ± 0.31* | 4.40 ± 0.62 | 4.30 ± 0.56 |
| ПАЭ2 | 12.35 ± 1.25 | 9.80 ± 0.92** | 11.3 ± 0.58 | 14.80 ± 0.79 |
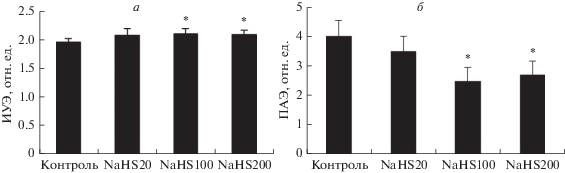
Изменение микрореологии эритроцитов после их инкубации с донором сероводорода – гидросульфидом натрия (NaHS) и глибенкламидом – блокатором ATP-зависимых К+-каналов. Установлено, что при инкубации эритроцитов с гидросульфидом натрия (20, 100 и 200 мкМ) их деформируемость и агрегация изменялись дозозависимым образом. Так, агрегация эритроцитов под влиянием этого донора H2S снижалась на 32 и 38% при концентрации препарата 200 и 100 мкМ соответственно (рис. 4б). Существенно меньшее (~11%), но также значимое изменение деформируемости наблюдалось при 100–200 мкМ NaHS (рис. 4а).
Рис. 4.
Изменение деформируемости (а) и агрегации эритроцитов (б) после их инкубации с гидросульфидом натрия (NaHS) в концентрациях 20, 100 или 200 мкМ. *Отличие от контроля статистически значимо (p < 0.05).
В качестве молекулярной мишени для действия на клетки H2S как газотрансмиттера рассматривают ATP-зависимые К+-каналы (${\text{К }}_{{{\text{А Т Р }}}}^{ + }$-каналы) [20]. Они блокируются ГлК [21]. В наших опытах ГлК на 7% повышал ИУЭ (р < 0.05), но не вызывал значимого изменения показателя агрегации клеток (табл. 3). Добавление NaHS после предварительной инкубации эритроцитов с ГлК не изменяло деформируемость клеток, однако этот показатель был на 8% выше значений в контроле (р < 0.05; табл. 3). ГлК не оказывал заметного влияния на агрегацию эритроцитов и не устранял антиагрегационный эффект NaHS.
Таблица 3.
Изменение микрореологии эритроцитов, полученных от здоровых лиц, после инкубации с гидросульфидом натрия (NaHS) и глибенкламидом (ГлК) по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель | Контроль | NaHS, 100 мкМ | ГлК, 50 мкМ | ГлК + NaHS |
|---|---|---|---|---|
| ПАЭ1 | 4.16 ± 0.24 | 2.61 ± 0.28* | 4.24 ± 0.57 | 2.92 ± 0.44* |
| ПАЭ2 | 11.56 ± 1.45 | 8.38 ± 0.78* | 9.82 ± 1.04 | 7.67 ± 0.94* |
| ИУЭ | 2.05 ± 0.04 | 2.27 ± 0.03* | 2.21 ± 0.01* | 2.23 ± 0.02* |
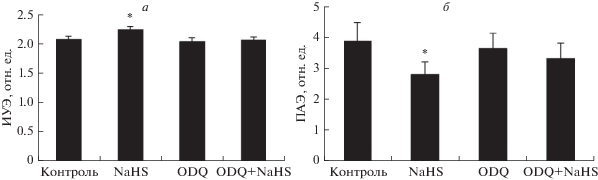
Ингибитор р-ГЦ ODQ полностью блокировал прирост деформируемости и значительно ограничивал снижение ПАЭ под влиянием NaHS (рис. 5). Таким образом, полученные данные свидетельствуют о том, что ингибирование активности р-ГЦ в интактных эритроцитах устраняет положительные микрореологические эффекты двух доноров газотрансмиттеров и субстрата NO-синтазы L-аргинина.
Рис. 5.
Изменения деформируемости (а) и агрегации эритроцитов (б) под влиянием донора сульфида водорода у интактных клеток и после ингибирования растворимой гуанилатциклазы с помощью ODQ. *Отличие от контроля статистически значимо (р < 0.05).
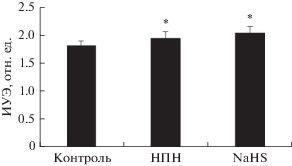
Изменение деформируемости восстановленных теней эритроцитов при инкубации с донором NO – нитропруссидом натрия и донором H2S – гидросульфидом натрия. При инкубации восстановленных теней эритроцитов с НПН эластичность их мембран (на основе расчета индекса удлинения) возросла на 6% (от 1.86 ± 0.02 до 1.98 ± ± 0.03 отн. ед.; р < 0.05). Донор сероводорода NaHS более существенно влиял на мембраны теней эритроцитов (рис. 6). В этом случае прирост индекса удлинения составлял 12% (от 1.86 ± 0.02 до 2.08 ± 0.04 отн. ед.; р < 0.01).
Рис. 6.
Изменение деформируемости (ИУЭ) восстановленных теней эритроцитов после их инкубации с донорами газотрансмиттеров: нитропруссидом натрия (НПН, 100 мкМ) и гидросульфидом натрия (NaHS, 100 мкМ).
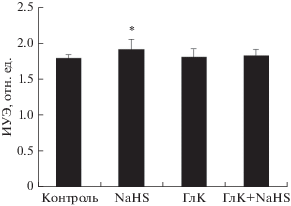
Если восстановленные тени эритроцитов предварительно инкубировать с ГлК, а затем добавить в среду инкубации донор H2S, то умеренный положительный эффект донора устраняется (рис. 7). Эластичность мембран теней эритроцитов под влиянием NaHS возрастала на 10% (р < 0.05), тогда как в условиях их преинкубации с ГлК NaHS практически не изменял ИУЭ (1.76 ± 0.02 – контроль; 1.94 ± 0.03 – NaHS и 1.80 ± 0.04 отн. ед. – ГлК + NaHS).
Рис. 7.
Изменение эластичности мембран восстановленных теней эритроцитов под влиянием гидросульфида натрия (NaHS, 100 мкМ), глибенкламида (ГлК, 50 мкМ) и их сочетания (ГлК + NaHS).
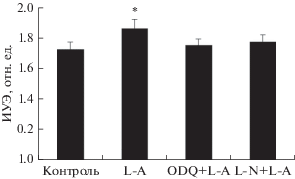
Когда тени эритроцитов инкубировали с L-аргинином, то наблюдали значимый прирост их эластичности на 8%: от 1.72 ± 0.02 до 1.86 ± ± 0.02 отн. ед. (р < 0.05; рис. 8). Это увеличение деформируемости теней эритроцитов практически полностью устранялось при их прединкубации с ODQ или L-NAME. В процессе приготовления теней происходит вымывание внутриклеточного содержимого эритроцитов, включая р-ГЦ и ее субстрат GTP. Это говорит о том, что действие оксида азота на эластичность мембраны эритроцитов не обусловлено образованием cGMP, а происходит по другому механизму, каковым может быть нитрозилирование белков мембраны. Эффект ODQ в таком случае обусловлен не подавлением активности р-ГЦ, а его побочным действием. Показано, что ODQ ингибирует гем-содержащие ферменты – синтазу оксида азота и цитохромы Р-450, катализирующие образование NO из НПН [24].
ОБСУЖДЕНИЕ
Результаты исследования показали, что донор NO НПН существенно влияет на микрореологию эритроцитов, повышая эластичность их мембран и уменьшая агрегацию. В качестве основной молекулярной мишени для NO в клетках рассматривают р-ГЦ [24–27]. В наших опытах ингибирование активности р-ГЦ с помощью соединения ODQ [9] приводило к практически полному отсутствию влияния НПН на деформируемость эритроцитов. Важно отметить, что в восстановленных тенях эритроцитов цитоплазма заменена буферным раствором, следовательно, можно полагать, что р-ГЦ в них отсутствует. Вместе с тем наблюдаемый значимый прирост деформируемости теней под влиянием НПН ставит вопрос об альтернативной молекулярной мишени для NO. Известно, что этот газотрансмиттер может активировать cGMP-независимый регуляторный механизм [28, 29]. Например, показано, что NO модифицирует ATP-чувствительные К+-каналы [30], и это сочетается с увеличением деформируемости эритроцитов [31]. Кроме того, возможно нитрозилирование и транснитрозилирование белков мембраны и цитоскелета эритроцитов [29]. В наших опытах инкубация эритроцитов с ГлК, блокатором $К _{{{\text{А Т Р }}}}^{ + }$-каналов, статистически значимо (p < 0.01) повышала деформируемость клеток. В действии ГлК и гидросульфида натрия на микрореологию эритроцитов не было аддитивности. Опыты на восстановленных тенях эритроцитов в условиях ингибирования NO-синтазы под действием L-NAME продемонстрировали устранение эффекта L-аргинина. При этом эффект L-аргинина на деформируемость теней эритроцитов не может быть объяснен последующей активацией р-ГЦ. Следовательно, можно предполагать, что положительные микрореологические эффекты NO в эритроцитах реализуются с помощью более чем одного молекулярного сигнального пути.
Донор другого газотрансмиттера – сульфида водорода, NaHS, подобно НПН влиял на деформируемость интактных эритроцитов и на их восстановленные тени. Анализ действия NaHS показал, что изменение эластичности мембран эритроцитов, вероятно, связано с активацией $К _{{{\text{А Т Р }}}}^{ + }$-каналов [31], поскольку их блокирование ГлК полностью устраняло эффект NaHS на модели деформационного поведения теней эритроцитов. Интересно заметить, что сигнальный механизм действия H2S на клетки может быть связан с сульфгидрацией, которая способствует полимеризации актина, не влияя при этом на его деполимеризацию [25]. Следовательно, в эритроцитах этот процесс может модифицировать белки цитоскелета и изменять эластичность мембраны и деформируемость клетки в целом [32].
В наших экспериментах ингибирование р-ГЦ с помощью ODQ практически полностью устраняло положительное влияние донора NO на деформируемость эритроцитов. В отношении агрегации эритроцитов этот эффект не был таким выраженным. Следовательно, можно полагать, что эти два клеточных свойства регулируются включением разных сигнальных путей. Известно, что активация р-ГЦ повышает уровень cGMP [33]. Далее этот второй мессенджер модулирует ионные каналы мембраны или cGMP-зависимую протеинкиназу для регуляции физиологических функций, включая вазодилатацию, агрегацию тромбоцитов [34, 36]. Такое разнообразие эффектов cGMP может объяснить разные ответы клеток на ингибирование ее активности. Известно, что изменение агрегации эритроцитов связано с метаболизмом Са2+ [35]. В свою очередь, стимулирование гуанилатциклазного сигнального пути приводит к ингибированию входа Са2+ в клетки [29]. Сходные изменения агрегационных ответов на НПН и NaHS эритроцитов после преинкубации соответственно с ODQ и ГлК могут быть связаны с активацией Ca2+/кальмодулин-зависимых механизмов клеточной регуляции [20, 25]. Кроме того, хотя H2S и NO модулируют независимые сигнальные пути, однако имеется ряд свидетельств о существовании перекрестного взаимодействия между этими двумя газотрансмиттерами [25, 37–39].
Таким образом, данные, полученные в этом исследовании, свидетельствуют о заметном положительном влиянии доноров газотрансмиттеров на микрореологические свойства эритроцитов и их восстановленных теней, однако точные молекулярные сигнальные пути выяснены не до конца.
Исследование поддержано грантом РФФИ №18-015-00475-а.
Список литературы
Северина И.С. 1998. Растворимая форма гуанилатциклазы в молекулярном механизме физиологических эффектов. Биохимия. 63, 939–997.
Olas B. 2015. Gasomediators (NO, CO, and H2S) and their role in hemostasis and thrombosis. Clin. Chim. Acta. 445, 115–121.
Balligand J.L., Cannon P.J. 1997. Nitric oxide synthases and cardiac muscle. Autocrine and paracrine influences. Arterioscler. Thromb. Vasc. Biol. 17, 1846–1858.
Wallace J.L., Ianaro A., Flannigan K.L., Cirino G. 2015. Gaseous mediators in resolution of inflammation. Semin. Immunol. 27, 227–33.
Северина И.С. 1995. Растворимая форма гуанилатциклазы в молекулярном механизме физиологических эффектов оксида азота и в регуляции процесса агрегации тромбоцитов. Бюл. эксперим. биол. и мед. 3, 230–235.
Truss N.J., Warner T.D. 2011. Gasotransmitters and platelets. Pharmacol. Ther. 132, 196–203.
Chen K., Popel A.S. 2009. Nitric oxide production pathways in erythrocytes and plasma. Biorheology. 46, 107–119.
Muravyov A.V., Tikhomirova I.A. 2013. Role molecular signaling pathways in changes of red blood cell deformability. Clin. Hemorheol. Microcirc. 53, 45–59.
Bor-Kucukatay M., Wenby R.B., Meiselman H.J., Baskurt O.K. 2003. Effects of nitric oxide on red blood cell deformability. Am. J. Physiol. Heart Circ. Physiol. 284, 1577–1584.
Uyuklu M., Meiselman H.J., Baskurt O.K. 2009. Role of hemoglobin oxygenation in the modulation of red blood cell mechanical properties by nitric oxide. Nitric Oxide. 21, 20–26.
Mozar A., Connes P., Collins B., Hardy-Dessources M.D., Romana M., Lemonne N., Bloch W., Grau M. 2016. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clin. Hemorheol. Microcirc. 64, 47–53.
Gao L., Cheng C., Sparatore A., Zhang H., Wang C. 2015. Hydrogen sulfide inhibits human platelet aggregation in vitro in part by interfering gap junction channels: effects of ACS14, a hydrogen sulfide-releasing aspirin. Heart Lung Circ. 24, 77–85.
Minetti G., Ciana A., Balduini C. 2004. Differential sorting of tyrosine kinases and phosphotyrosine phosphatases acting on band 3 during vesiculation of human erythrocytes. Biochem. J. 377, 489–497.
Saldanha C., Silva A.S., Gonçalves S., Martins-Silva J. 2007. Modulation of erythrocyte hemorheological properties by band 3 phosphorylation and dephosphorylation. Clin. Hemorheol. Microcirc. 36, 183–194.
Brunati M., Bordin L., Clari G., Moret V. 1996. The Lyn-catalyzed Tyr phosphorylation of the transmembrane band 3 protein of human erythrocytes. Eur. J. Biochem. 240, 394–399.
Petrov V., Lijnen P. 1996. Regulation of human erythrocyte Na+/H+ exchange by soluble and particulate guanylate cyclase. Am. J. Physiol. 271, 1556–1564.
Sélley E., Kun S., Szijártó I.A. 2014. Exenatide induces aortic vasodilation increasing hydrogen sulphide, carbon monoxide and nitric oxide production. Cardiovascular Diabetol. 13, 69.
Dodge J., Mitchell C., Hanahan D. 1963. The preparation and chemical characteristics of hemoglobin free ghosts of erythrocytes. Arch. Biochem. Biophys. 100, 119–130.
Пятакова Н.В., Северина И.С. 2012. Растворимая гуанилатциклаза в молекулярном механизме действия лекарственных средств. Биомед. химия. 58, 32–42.
Monjok E.M., Kulkarni K.H., Kouamou G.M. McKoy C.A. 2008. Inhibitory action of hydrogen sulfide on muscarinic receptor induced contraction of isolated porcine irides. Exp. Eye Res. 87, 612–616.
Green B.D., Hand K.V., Dougan J.E., McDonnell B.M., Cassidy R.S., Grieve D.J. 2008. GLP-1 and related peptides cause concentration-dependent relaxation of rat aorta through a pathway involving KATP and cAMP. Arch. Biochem. Biophys. 478, 136–142.
Lucas K.A., Pitary G.M., Park J. 2000. Guanylyl cyclase and signaling by cyclic GMP. Pharmocol. Rev. 52, 375–413.
Taqatqeh F., Mergia E., Neitz A., Eysel U.T., Koesling D., MittmannTh. 2009. More than a Retrograde Messenger: Nitric Oxide Needs Two cGMP Pathways to Induce Hippocampal Long-Term Potentiation. J. Neurosci. 29. 9344–9350.
Feelisch M., Kotsonis P., Siebe J., Clement B., Schmidt H.H. 1999. The soluble guanylyl cyclase inhibitor 1H-[1,2,4]oxadiazolo[4,3,-a] quinoxalin-1-one is a nonselective heme protein inhibitor of nitric oxide synthase and other cytochrome P-450 enzymes involved in nitric oxide donor bioactivation. Mol. Pharmacol. 56(2). 243–253
Гусакова С.В., Смаглий Л.В., Бирулина Ю.Г., Ковалев И.В., Носарев А.В., Петрова И.В., Реутов В.П. 2017. Молекулярные механизмы действия газотрансмиттеров NO, CO и H2S в гладкомышечных клетках и влияние NO-генерирующих соединений (нитратов и нитритов) на среднюю продолжительность жизни. Усп. физ. наук. 48 (1), 24–52
Mustafa A.K., Gadalla M.M., Snyder S.H. 2009. Signaling by gasotransmitters. Sci. Signal. 2(68), re2.
Korhonen R., Lahti A., Kankaanranta H., Moilanen E. 2005. Nitric oxide production and signaling in inflammation. Curr. Drug Targets Inflamm. Allergy. 4, 471–479.
Капилевич Л.В., Носарев А.В., Ковалев И.В., Дьякова Е.Ю., Баскаков М.Б. 2003. Роль циклических нуклеотидов в регуляции тонуса легочных артерий кролика. Бюл. эксперим. биол. и мед. 6, 714–717.
Cohen R.I., Wilson D., Liu S.F. 2006. Nitric oxide modifies the sarcoplasmic reticular calcium release channel in endotoxemia by both guanosine-3′,5′ (cyclic) phosphate-dependent and independent pathways. Crit. Care Med. 34, 173–181.
Irwin C., Roberts W., Naseem K.M. 2009. Nitric oxide inhibits platelet adhesion to collagen through cGMP-dependent and independent mechanisms: the potential role for S-nitrosylation. Platelets. 20, 478–486.
Ishibashi Y., Duncker D.J., Zhang J., Bache R.J. 1998. ATP-sensitive K+ channels, adenosine, and nitric oxide-mediated mechanisms account for coronary vasodilation during exercise. Circ. Res. 82, 346–359.
Starzyk D., Korbut R., Gryglewski R.J. 1999. Effects of nitric oxide and prostacycline on deformability and aggregability of red blood cells of rats ex vivo and in vitro. J. Physiol. Pharmacol. 50. 629–637.
Derbyshire E.R., Marletta M.A. 2012. Structure and regulation of soluble guanylate cyclase. Annu. Rev. Biochem. 81, 533–539.
Wobst J., Rumpf P.M., Dang T.A., Segura-Puimedon M., Erdmann J., Schunkert H. 2015. Molecular variants of soluble guanylyl cyclase affecting cardiovascular risk. Circ. J. 79, 463–469.
Muravyov A.V., Mikhailova S.G., Tikhomirova I.A. 2015. Role of Intracellular Signaling Systems in Regulation of Erythrocyte Microrheology. Biochemistry (Moscow) Suppl. Ser. A: Membrane and Cell Biol. 9, 178–184.
Boo Y.C., Jo H. 2003. Flow-dependent regulation of endothelial nitric oxide synthase: role of protein kinases. Am. J. Physiol. Cell Physiol. 285, C499–508.
Wang R. 2004. Signal Transduction and the Gasotransmitters. NO, CO and H2S in Biology and Medicine. Totowa: Humana Press, 377 p.
Coletta C., Papapetropoulos A., Erdelyi K., Olah G., Módis K., Panopoulos P., Asimakopoulou A., Gerö D., Sharina I., Martin E., Szabo C. 2012. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation. Proc. Natl. Acad. Sci. USA. 109, 9161–9166.
Giuffrè A., Vicente J.B. 2018. Hydrogen Sulfide Biochemistry and Interplay with Other Gaseous Mediators in Mammalian Physiology. Oxid. Med. Cell Longev. 2018. 6290931. eCollection 2018.https://doi.org/10.1155/2018/6290931
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии