Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 94-102
Влияние высоко- и низкомолекулярной гиалуроновой кислоты на высвобождение омега-3 и омега-6 кислот при активации толл-подобных рецепторов в астроцитах
Н. В. Азбукина a, *, А. А. Астахова b, С. В. Гориянов c, В. В. Чистяков c, М. Г. Сергеева b, **
a Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики
119992 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова,
НИИ физико-химической биологии им. А.Н. Белозерского
119992 Москва, Россия
c Российский университет дружбы народов
117198 Москва, Россия
* E-mail: ridernadya@gmail.com
** E-mail: mg.sergeeva@gmail.com
Поступила в редакцию 06.04.2019
После доработки 25.04.2019
Принята к публикации 14.05.2019
Аннотация
Гиалуроновая кислота (НА) – один из ключевых полимерных компонентов межклеточного матрикса, в зависимости от молекулярной массы может по-разному влиять на внутриклеточную сигнализацию. Сравнили действие низко- (LMW) и высокомолекулярных (HMW) полимеров HA на способность первичных астроцитов, глиальных клеток мозга, высвобождать во внеклеточную среду омега-3-ненасыщенные жирные кислоты: докозагексаеновую (DHA) и эйкозапентаеновую (ЕРА) и омега-6-ненасыщенную арахидоновую кислоту (АА), определяемые методом HPLC-MS/MS. Показано, что добавление LMW НА на 4.5 ч снижает концентрацию АА. HMW НА не влияет на AA, увеличивает высвобождение DHA и ЕРА. Адаптация клеток в течение 48 ч к действию полимеров разной молекулярной массы НА приводила к снижению высвобождения омега-3- и омега-6-ненасыщенных жирных кислот астроцитами. Сравнение способности НА модулировать ответы астроцитов на стимуляцию агонистами Толл-подобных рецепторов (TLR) показало, что НА влияет на TLR4-стимулированную индукцию гена провоспалительного маркера IL-1β при 0.5 ч экспозиции с LMW НА и HMW НА при дальнейшей стимуляции TLR4-агонистом в течение 4 ч. Таким образом, высвобождение полиненасыщенных жирных кислот в астроцитах: 1) чувствительно к действию НА; 2) чувствительно к молекулярной массе полимеров НА; 3) длительная (48 ч) экспозиция с НА приводит к адаптации астроцитов; 4) НА по-разному влияет на высвобождение омега-6 (AA) и омега-3 (DHA)-ненасыщенных жирных кислот, что указывает на различие в механизмах их высвобождения. Поскольку считается, что DHA выполняет противовоспалительную и протекторную функции в мозге, то полученные данные открывают перспективы использования полимеров HA как модуляторов воспалительных ответов астроцитов.
ВВЕДЕНИЕ
В настоящее время показано, что большинство патологий центральной нервной системы (ЦНС), таких, как нейродегенеративные заболевания (болезни Альцгеймера, Паркинсона, Хантингтона), аутоиммунные заболевания (рассеянный склероз), травматические повреждения (в том числе, вследствие острого нарушения мозгового кровообращения) и психические заболевания сопровождаются развитием воспалительных процессов [1, 2]. Основные клетки, регулирующие развитие воспалительных процессов в ЦНС – астроглия и микроглия, содержат рецепторы к различным веществам, вызывающим воспалительные ответы [2, 3]. Важнейшим семейством рецепторов этих сигналов являются Толл-подобные рецепторы (TLR), активация которых приводит к выбросу различных цитокинов и других сигнальных медиаторов клетками глии [4–6]. Понимание молекулярных механизмов процессов нейровоспаления позволит понять механизмы развития указанных патологий, разработать терапевтические подходы для коррекции и направленной регуляции состояний.
Известно, что внеклеточный матрикс, один из ключевых структурных компонентов, отвечающих за поддержание гомеостаза тканей ЦНС, составляет приблизительно 20% от объема ткани. Состав внеклеточного матрикса ЦНС отличается от состава внеклеточного матрикса периферических структур [7]. Основными компонентами матрикса ЦНС являются гиалуроновая кислота (HA) и протеогликаны [7–9]. HA выполняет разнообразные биологические функции, включая регуляцию клеточной адгезии, пролиферацию клеток, диффузию питательных веществ и факторов роста, а также участвует в реакциях репарации тканей после повреждений и в воспалительных процессах [10]. На клетках микроглии показано, что НА влияет на высвобождение цитокинов при стимуляции липополисахаридом (LPS), агонистом рецептора TLR4 [11]. НА влияет также на пролиферацию астроцитов [12], что указывает на возможность модуляции этим полимером ответов астроцитов на действие провоспалительных стимулов. Однако возможность такой модуляции не была изучена ранее и стала целью нашей работы.
Следует отметить, что НА – это полимер с повторяющимися дисахаридными цепями N-ацетилглюкозамина и глюкуроновой кислоты. Известно, что характер влияния НА на развитие воспалительного ответа зависит от молекулярной массы полимера [14]. Различают низкомолекулярную (< 500 кДа, LMW) и высокомолекулярную форму (> 500 кДа, HMW) HA, причем на большинство клеток миелоидного происхождения LMW HA оказывает провоспалительное, а HMW HA – противовоспалительное действие. Астроциты относятся к клеткам эктодермального происхождения, т.е. отличаются от микроглии, которые, как и макрофаги, имеют миелоидное происхождение. Исследования последних лет показали, что экспрессия многих регуляторных генов и белков сигнального пути TLR в астроцитах отличается от других клеток [15–17]. Поэтому нами проведено сравнение действия LMW НА и HMW НА на ответы астроцитов при стимуляции TLR3- и TLR4-агонистами. Влияние НА на действие TLR-агонистов оценивали по уровню экспрессии одного из основных провоспалительных цитокинов – интерлейкина-1β (IL-1β) [18].
Полиненасыщенные жирные кислоты и их метаболиты играют важную роль в регуляции функций астроцитов [19–22]. Известно, что активация сигнальных путей TLR в астроцитах приводит к активации выброса омега-6-ненасыщенной арахидоновой кислоты (АА) и ее метаболитов [5, 19, 23, 24]. При этом в астроцитах повышено содержание омега-3-ненасыщенных жирных кислот: докозагексаеновой (DHA) и эйкозапентаеновой (EPA) в sn-2-положении фосфолипидов мембран [25, 26]. Интересно, что при активации клеток омега-3- и омега-6-ненасыщенные кислоты высвобождаются под действием различных типов фосфолипазы А2 [23]. Влияние LMW HA и HMW НА на высвобождение омега-3- и омега-6-ненасыщенных жирных кислот ранее не было исследовано, поэтому явилось целью данной работы.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты. Липополисахарид (LPS, Sigma-Aldrich, США; кат. № L2630), стрептомицин-пенициллин (кат. № А063), трипсин (кат. № P037), бычья сыворотка (кат. № BS-110/500) (ПАНЭКО, Россия). Культуральная среда DMEM (Gibco, Thermo Fisher Scientific, США; кат. № 21885-025). Дейтерированные стандарты эйкозаноидов: EPA-d5 (кат. № 10005056), DHA-d5 (кат. № 10 005 057), AA-d8 (кат. № 390010) (Cayman Chemical, США). Колонки для твердофазной экстракции Oasis® PRIME HLB (60 мг, 3cc, Waters, Германия; кат. № 186008056). Poly I:C (PIC, InVivoGen, США; кат. № tlrl-pic). HMW HA (1.01 мДа-1.8 мДа, кат. № HA15M-1, HMW) и LMW HA (41 кДа–65 кДа, кат. № HA40K-1, LMW) – Lifecore Biomedical (США).
Клеточная культура. Первичная культура астроцитов получена по методике, описанной ранее [15, 27]. Изолированный мозг новорожденных крысят линии Wistar (не старше 2 дней) измельчали посредством последовательного перетирания сквозь сита, далее клетки культивировали в среде DMEM (Thermo Fisher Scientific, США), содержащей 1 г/л глюкозы, 10% сыворотки (FBS) и антибиотики (50 ед./мл стрептомицина и 50 мкг/мл пенициллина) в течение 14 дней. Первую смену среды проводили на 3-й день, предварительно флакон отряхивали для отделения микроглии (орбитальный шейкер Biosan OS-20, 180 об/мин в течение 90 мин). Затем среду заменяли каждые 2 дня, на 9-й день клетки пересаживали в 12-луночный планшет с плотностью 350 000 клеток на лунку. За 2 ч до начала экспериментов проводили смену среды в лунках.
Для оценки влияния HMW и LMW HA на экспрессию IL-1β клетки предварительно инкубировали по отдельности с указанными кислотами (30 мин или 48 ч) и стимулировали LPS (100 нг/мл) и PIC (10 мкг/мл) в течение 4 ч.
ПЦР в режиме реального времени. Суммарную РНК выделяли из клеток с помощью GeneJET RNA Purification Kit (Thermo Scientific, США). Синтез первой цепи проводили с помощью MMLV RT kit (Evrogen, Россия). Относительный уровень экспрессии определяли с помощью количественной ПЦР с SYBR GREEN (использовали коммерческий 5× PCR-HS-SYBR микс, Evrogen, Россия). Последовательности используемых праймеров (5'-3'): IL1B, прямой: CACCTCTCAAGCAGAGCACAG, обратный: GGGTTCCATGGTGAAGTCAAC, ACTB (референсный ген), прямой: AGATGACCCAGATCATGTTTGAG, обратный: GGCATACAGGGACAACACAG. Температура плавления – 57°C. В одну реакционную смесь объемом 25 мкл брали 50 нг кДНК.
Детекция липидов. Липидные компоненты для масс-спектрометрического анализа экстрагировали из 700 мкл клеточной среды при помощи 1 мл метанола, затем использовали колонки Oasis HBL 3сс для твердофазной экстракции согласно рекомендациям производителя. Анализ проводили с использованием квадрупольного масс-спектрометра Shimadzu 8040 (Shimadzu, Япония), оборудованного системой ультра HPLC Nexera, и колонки Phenomenex C8 (2.1 мм × 150 мм × 2.6 мкм). Регистрацию проводили путем мониторинга множественных реакций по методике, описанной ранее [19]. Для количественного определения детектируемых кислот использовали стандарты: EPA-d5, DHA-d5, AA-d8.
Статистический анализ. Значения представляли как среднее со стандартным отклонением. Статистическую значимость различий между группами оценивали с помощью t-критерия Стъюдента. Максимально допустимую вероятность отвергнуть верную нулевую гипотезу p для определения отличий между группами принимали равной 0.05.
РЕЗУЛЬТАТЫ
Влияние высоко- и низкомолекулярной гиалуроновой кислоты на экспрессию мРНК IL-1beta
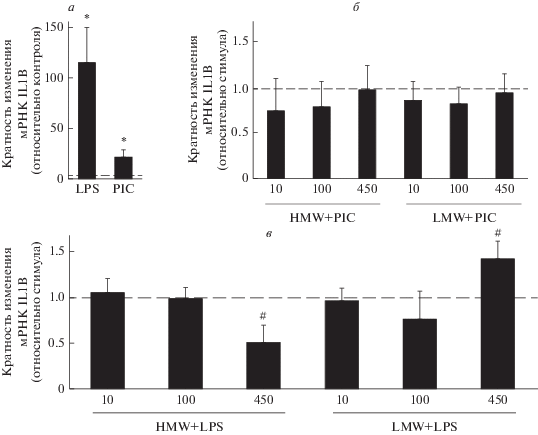
Для определения эффективной концентрации LMW НА и HMW НА добавляли на 30 мин, затем клетки стимулировали агонистами TLR3 (PIC, 10 мкг/мл) и TLR4 (LPS, 100 нг/мл) в течение 4 ч и оценивали уровень экспрессии мРНК IL-1β. Показано что стимуляция астроцитов агонистами TLR3 и TLR4 увеличивает экспрессию гена il1b в среднем в 20 и в 110 раз соответственно (рис. 1а). Далее оценивали влияние предварительной инкубации клеток с различными концентрациями HMW и LMW НА (10, 100, 450 мкг/мл) на стимулированную агонистом экспрессию мРНК гена il1b. Показано, что оба варианта НА во всех концентрациях не влияют на экспрессию гена il1b при стимуляции PIC (рис. 1б). Показано, что HMW и LMW НА в концентрациях 10 и 100 мкг/мл не влияют на экспрессию гена il1b в ответ на 4-часовую стимуляцию LPS, HMW НА в дозе 450 мкг/мл уменьшает ее в 2 раза, а LMW НА в такой же дозе увеличивает в 1.5 раза (рис. 1в). Эффекты, полученные на стимулированных LPS клетках, подтверждают гипотезу о провоспалительном действии LMW НА и противовоспалительном – HMW НА.
Рис. 1.
Влияние HMW и LMW НА на экспрессию мРНК IL-1β в стимулированных астроцитах. Клетки обрабатывали (a) LPS (100 нг/мл, 4 ч) или PIC (10 мкг/мл, 4 ч); или HMW или LMW НА в указанных концентрациях (10, 100, 450 мкг/мл) в течение 30 мин, затем стимулировали PIC (10 мкг/мл, 4 ч) (б) или LPS (100 нг/мл, 4 ч) (в), затем измеряли относительный уровень мРНК методом ПЦР в реальном времени. Полученные значения нормировали на экспрессию гена β-актина. В (а) за единицу принимали уровень экспрессии IL-1βв нестимулированных клетках, в (б), (в) за единицу был принят уровень экспрессии в стимулированных клетках. * – p < 0.05 по сравнению с контрольными клетками, # – p < 0.05 по сравнению со стимулированными клетками.
Влияние высоко- и низкомолекулярной гиалуроновой кислоты на высвобождение полиненасыщенных жирных кислот
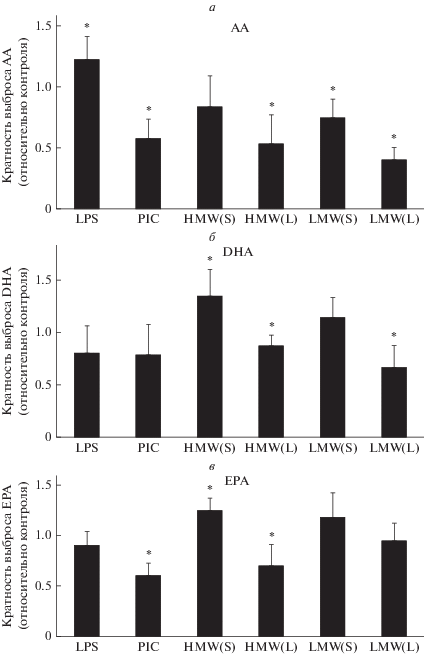
В качестве оптимальной концентрации HMW HA и LMW НА, использованной в дальнейших исследований, нами была выбрана доза 450 мкг/мл. Изучено влияние HMW HA и LMW НА в этих концентрациях на выброс полиненасыщенных жирных кислот. Влияние HA оценивали после предварительной инкубации в течение 30 мин (S) и 48 ч (L). Длительное время инкубации выбрано для оценки возможности адаптации клеток к условиям культивирования в присутствия HMW или LMW НА. Установлено, что длительная инкубация как с HMW НА, так и LMW НА приводит к снижению высвобождаемой АA и DHA (рис. 2а, 2б). Снижение ЕРА происходит только при длительной инкубации с HMW НА (рис. 2в). При кратковременной инкубации с HA наблюдалось незначительное снижение выброса АА, DHA и EPA во внеклеточную среду при действии HMW HA в течение 4.5 ч (рис. 2). Таким образом, полученные данные свидетельствуют о том, что высвобождение полиненасыщенных жирных кислот в астроцитах: 1) чувствительно к действию НА; 2) длительная (48 ч) экспозиция приводит к адаптации клеток к обработке НА; 3) влияние HMW HA и LMW HA различается для омега-6 (AA) и омега-3 (DHA)-ненасыщенных жирных кислот, что указывает на различия в механизмах их высвобождения.
Рис. 2.
Влияние PIC, LPS, HMW и LMW НА на выбросы AA (арахидоновая кислота), DHA (докозагексаеновая кислота), EPA (эйкозапентаеновая кислота). Клетки обрабатывали HMW или LMW НА (450 мкг/мл) в течение 30 мин (S) или 48 ч (L), PIC (10 мкг/мл, 4 ч) или LPS (100 нг/мл, 4 ч), затем измеряли уровень выбрасываемых во внеклеточную среду кислот методом HPLC-MS/MS. За единицу принимался уровень выбросов кислот в контрольных клетках. * – p < 0.05 по сравнению с контрольными клетками.
Гиалуроновая кислота модулирует стимулированный агонистом TLR выброс полиненасыщенных жирных кислот
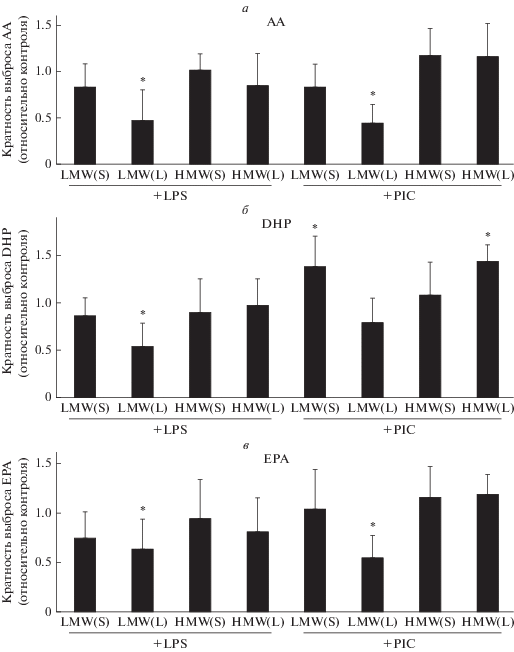
Добавление различных агонистов к астроцитам активирует в них различные фосфолипазы А2 [5, 21, 28], которые выщепляют полиненасыщенные жирные кислоты из фосфолипидов, далее эти кислоты метаболизируются по циклооксигеназному, липоксигеназному, эпоксигеназному пути [29]. Часть кислот выходит во внеклеточное пространство и может модулировать различные функции астроцитов, в частности, осцилляции внутриклеточного кальция [30]. Чтобы ответить на вопрос, изменяют ли HMW HA и LMW НА стимулированный агонистами TLR выброс омега-3 и омега-6- ненасыщенных жирных кислот во внеклеточное пространство, мы добавляли HMW HA или LMW НА (450 мкг/мл) за 30 мин (S) или 48 ч (L) до добавления TLR-агонистов (рис. 3). Длительная экспозиция с LMW НА приводит к снижению высвобождения АА при стимуляции TLR3- и TLR4-агонистами (рис. 3а), снижению высвобождения DHA при стимуляции TLR4-агонистом (рис. 3б), ЕРА при стимуляции TLR3- и TLR4-агонистами (рис. 3в). HMW НА статистически значимо действовала как индуктор высвобождения DHA при стимуляции клеток TLR3-агонистом при длительной экспозиции (рис. 3б). Таким образом, высвобождение омега-3 и омега-6-ненасыщенных жирных кислот при действии TLR3- и TLR4-агонистов чувствительно ко времени экспозиции с НА и молекулярной массе ее полимеров.
Рис. 3.
Влияние HMW и LMW НА на выбросы DHA (докозагексаеновая кислота), AA (арахидоновая кислота), EPA (эйкозапентаеновая кислота) в контрольных и стимулированных астроцитах. Клетки обрабатывали HMW или LMW НА (450 мкг/мл) в течение 30 мин (S) или 48 ч (L) и затем стимулировали PIC (10 мкг/мл, 4 ч) или LPS (100 нг/мл, 4 ч), затем измеряли уровень выбрасываемых во внеклеточную среду кислот методом HPLC-MS/MS. За единицу принимался уровень выбросов кислот в стимулированных клетках. * – p < 0.05 по сравнению со стимулированными клетками.
ОБСУЖДЕНИЕ
Ответы астроцитов на провоспалительные стимулы играют важную роль в развитии патологий мозга [3], поэтому выявление механизмов регуляции этих ответов имеют перспективу поиска новых терапевтических подходов и средств их реализации. Нами впервые показано, что НА влияет на функции астроцитов при моделировании воспалительных условий, т.е. при стимуляции клеток агонистами TLR. При этом наблюдается схожесть астроцитов с клетками неэктодермального происхождения, т.е. LMW НА стимулируют, а HMW НА снижают TLR-стимулируемую индукцию провоспалительных цитокинов [31–34]. Эти данные позволяют предположить, что сигнальные пути действия НА в астроцитах имеют общие черты с ранее показанными механизмами вовлечения HA в регуляцию клеточного воспалительного ответа на других типах клеток.
Обнаружена особая чувствительность астроцитов к действию НА и их способность к адаптации при длительном воздействии НА. Эта чувствительность проявляется при высвобождении во внеклеточную среду полиненасыщенных жирных кислот. Следует отметить, что астроциты отличаются от многих других клеток тем, что в sn-2-положении фосфолипидов у них высокое содержание омега-3 DHA [23, 26]. Показано, что в астроцитах омега-6 AA высвобождается из фосфолипидов при стимуляции фосфолипаз cPLA2, sPLA2A, а омега-3 DHA при действии фосфолипазы iPLA2 [23]. Ранее мы показали, что возможно направленное модулирование фосфолипаз синтетическими агонистами ядерных рецепторов PPAR [35]. Целью данной работы было выявление возможных различий во влиянии НА на омега-3 и омега-6-ненасыщенные жирные кислоты. Впервые показано, что НА стимулирует высвобождение омега-3 DHA. Результаты позволяют предположить возможность регуляции баланса между выбрасываемыми омега-3 и омега-6-ненасыщенными жирными кислотами с помощью олигомеров НА различной длины. Действительно, LMW и HMW НА прямо влияют на высвобождение полиненасыщенных жирных кислот. При этом наблюдается возникновение адаптации к длительному воздействию НА. Если короткие времена инкубации с LMW и HMW НА увеличивают высвобождение жирных кислот, то культивирование клеток в течение 2 дней с НА приводит к снижению высвобождения во внеклеточную среду как омега-6, так и омега-3-кислот. Интересно, что осцилляции внутриклеточного кальция, важные показатели функций астроцитов, чувствительны к действию омега-6 и омега-3-жирных кислот [20]. Насколько связаны воздействия олигомеров НА различной массы с фосфолипазами и существует ли обратная связь между высвобождаемыми омега-6 и омега-3-ненасыщенными жирными кислотами и чувствительностью к воздействию НА, еще не ясно и требует дальнейшего изучения.
Существует много возможных механизмов воздействия НА на сигнальные пути TLR и другие функции клеток. Предполагается, что НА связывается с различными белками плазматической мембраны клетки, такими как CD44 и др. [10].
В пользу реализации эффекта НА через поверхностные рецепторы говорят наши данные о низкой чувствительности ответов клеток при стимуляции агонистом TLR3 к кратковременной экспозиции с НА – значимый эффект оказывала только кратковременная инкубация с LMW НА на выброс DHA. Такая разница в эффектах, наблюдаемых при различных стимуляциях, может быть объяснена расположением целевых рецепторов: рецептор TLR4 расположен на поверхности клеточной мембраны, а TLR3 – на мембране эндосом. При более длительной инкубации возможно, проявляется эффект взаимосвязи сигнальных путей TLR2/TLR3, показанный ранее [36, 37]. Все эти предположения требуют дальнейших исследований.
В данной работе впервые показана связь между действием различных олигомеров НА и сигнальными путями TLR, включая высвобождение омега-3 и омега-6-ненасыщенных жирных кислот. НА широко используется в различных биомедицинских приложениях, включая дерматологию, ортопедию, артриты, офтальмологию [38]. Данное исследование открывает перспективы использования НА при патологиях мозга с нейровоспалительной компонентой.
Работа выполнена при поддержке гранта РНФ № 18-74-00069.
Список литературы
Chistyakov D.V., Astakhova A.A., Sergeeva M.G. 2018. Resolution of inflammation and mood disorders. Exp. Mol. Pathol. 105 (2), 190–201.
Lucas S.-M., Rothwell N.J., Gibson R.M. 2006. The role of inflammation in CNS injury and disease. Br. J. Pharmacol. 147 Suppl, S232–S240.
Sofroniew M.V., Vinters H.V. 2010. Astrocytes: Biology and pathology. Acta Neuropathol. 119 (1), 7–35.
Kumar V. 2019. Toll-like receptors in the pathogenesis of neuroinflammation. J. Neuroimmunol. 332, 16–30.
Chistyakov D.V., Azbukina N.V., Lopachev A.V., Kulichenkova K.N., Astakhova A.A., Sergeeva M.G. 2018. Rosiglitazone as a modulator of TLR4 and TLR3 signaling pathways in rat primary neurons and astrocytes. Int. J. Mol. Sci. 19 (1), 113.
Chistyakov D.V., Aleshin S., Sergeeva M.G., Reiser G. 2014. Regulation of peroxisome proliferator-activated receptor β/δ expression and activity levels by toll-like receptor agonists and MAP kinase inhibitors in rat astrocytes. J. Neurochem. 130 (4), 563–574.
Lau L.W., Cua R., Keough M.B., Haylock-Jacobs S., Yong V.W. 2013. Pathophysiology of the brain extracellular matrix: A new target for remyelination. Nat. Rev. Neurosci. 14 (10), 722–729.
Bignami A., Hosley M., Dahl D. 1993. Hyaluronic acid and hyaluronic acid-binding proteins in brain extracellular matrix. Anat. Embryol. (Berl). 188 (5), 419–433.
Bonneh-Barkay D., Wiley C.A. 2009. Brain extracellular matrix in neurodegeneration. Brain Pathol. 19 (4), 573–585.
Garantziotis S., Savani R.C. 2019. Hyaluronan biology: A complex balancing act of structure, function, location and context. Matrix Biol. 78–79, 1–10.
Austin J.W., Gilchrist C., Fehlings M.G. 2012. High molecular weight hyaluronan reduces lipopolysaccharide mediated microglial activation. J. Neurochem. 122 (2), 344–355.
Struve J., Maher P.C., Li Y.Q., Kinney S., Fehlings M.G., Kuntz I.V.C., Sherman L.S. 2005. Disruption of the hyaluronan-based extracellular matrix in spinal cord promotes astrocyte proliferation. Glia. 52 (1), 16–24.
Khaing Z.Z., Milman B.D., Vanscoy J.E., Seidlits S.K., Grill R.J., Schmidt C.E. 2011. High molecular weight hyaluronic acid limits astrocyte activation and scar formation after spinal cord injury. J. Neural. Eng. 8 (4), 046033.
D’Agostino A., Stellavato A., Corsuto L., Diana P., Filosa R., La Gatta A., Schiraldi C. 2017. Is molecular size a discriminating factor in hyaluronan interaction with human cells? Carbohydr. Polym. 157, 21–30.
Astakhova A.A., Chistyakov D.V., Sergeeva M.G., Reiser G. 2018. Regulation of the ARE-binding proteins, TTP (tristetraprolin) and HuR (human antigen R), in inflammatory response in astrocytes. Neurochem. Int. 118, 82–90.
Buyanova S.M., Chistyakov D.V., Astakhova A.A., Sergeeva M.G. 2017. The effect of dehydroepiandrosterone on inflammatory response of astroglial cells. Biochem. (Moscow), Suppl. Ser. A Membr. Cell Biol. 11 (4), 304–310.
Chistyakov D.V., Azbukina N.V., Astakhova A.A., Goriainov S.V., Chistyakov V.V., Sergeeva M.G. 2018. Sex-mediated differences in lps induced alterations of TNFα, IL-10 expression, and prostaglandin synthesis in primary astrocytes. Int. J. Mol. Sci. 19 (9), 2793.
Ren K., Torres R. 2009. Role of interleukin-1β during pain and inflammation. Brain Res. Rev. 60 (1), 57–64.
Chistyakov D.V., Grabeklis S., Goriainov S.V., Chistyakov V.V., Sergeeva M.G., Reiser G. 2018. Astrocytes synthesize primary and cyclopentenone prostaglandins that are negative regulators of their proliferation. Biochem. Biophys. Res. Commun. 500 (2), 204–210.
Sergeeva M., Strokin M., Wang H., Ubl J.J., Reiser G. 2002. Arachidonic acid and docosahexaenoic acid suppress thrombin-evoked Ca2+ response in rat astrocytes by endogenous arachidonic acid liberation. J. Neurochem. 82 (5), 1252–1261.
Strokin M., Sergeeva M., Reiser G. 2007. Prostaglandin synthesis in rat brain astrocytes is under the control of the n-3 docosahexaenoic acid, released by group VIB calcium-independent phospholipase A2. J. Neurochem. 102 (6), 1771–1782.
Sun G.Y., Simonyi A., Fritsche K.L., Chuang D.Y., Hannink M., Gu Z., Greenlief C.M., Yao J.K., Lee J.C., Beversdorf D.Q. 2018. Docosahexaenoic acid (DHA): An essential nutrient and a nutraceutical for brain health and diseases. Prostaglandins. Leukot. Essent. Fatty Acids 136, 3–13.
Strokin M., Sergeeva M., Reiser G. 2003. Docosahexaenoic acid and arachidonic acid release in rat brain astrocytes is mediated by two separate isoforms of phospholipase A 2 and is differently regulated by cyclic AMP and Ca2+Br. J. Pharmacol. 139 (5), 1014–1022.
Bazinet R.P., Layé S. 2014. Polyunsaturated fatty acids and their metabolites in brain function and disease. Nat. Rev. Neurosci. 15 (12), 771–785.
Strokin M., Sergeeva M., Reiser G. 2004. Role of Ca2+-independent phospholipase A2 and n-3 polyunsaturated fatty acid docosahexaenoic acid in prostanoid production in brain: Perspectives for protection in neuroinflammation. Int. J. Dev. Neurosci. 22 (7), 551–557.
Rapoport S.I., Ramadan E., Basselin M. 2011. Docosahexaenoic acid (DHA) incorporation into the brain from plasma, as an in vivo biomarker of brain DHA metabolism and neurotransmission. Prostaglandins Other Lipid Mediat. 96 (1–4), 109–113.
Astakhova A.A., Chistyakov D.V., Pankevich E.V., Sergeeva M.G. 2015. Regulation of cyclooxygenase 2 expression by agonists of PPAR nuclear receptors in the model of endotoxin tolerance in astrocytes. Biochemistry (Mosc.). 80 (10), 1262–1270.
Sun G.Y., He Y., Chuang D.Y., Lee J.C., Gu Z., Simonyi A., Sun A.Y. 2012. Integrating cytosolic phospholipase A2 with oxidative/ nitrosative signaling pathways in neurons: A novel therapeutic strategy for AD. Mol. Neurobiol. 46 (1), 85–95.
Gabbs M., Leng S., Devassy J.G., Monirujjaman M., Aukema H.M. 2015. Advances in our understanding of oxylipins derived from dietary PUFAs. Adv. Nutr. 6 (5), 513–540.
Sergeeva M., Strokin M., Reiser G. 2005. Regulation of intracellular calcium levels by polyunsaturated fatty acids, arachidonic acid and docosahexaenoic acid, in astrocytes: Possible involvement of phospholipase A2. Reprod. Nutr. Dev. 45 (5), 633–646.
Campo G.M., Avenoso A., Campo S., D’Ascola A., Nastasi G., Calatroni A. 2010. Molecular size hyaluronan differently modulates toll-like receptor-4 in LPS-induced inflammation in mouse chondrocytes. Biochimie. 92 (2), 204–215.
Albano G.D., Bonanno A., Cavalieri L., Ingrassia E., Di Sano C., Siena L., Riccobono L., Gagliardo R., Profita M. 2016. Effect of high, medium, and low molecular weight hyaluronan on inflammation and oxidative stress in an in vitro model of human nasal epithelial cells. Mediators Inflamm. 2016, 1–13.
Gómez-Aristizábal A., Kim K.P., Viswanathan S. 2016. A systematic study of the effect of different molecular weights of hyaluronic acid on mesenchymal stromal cell-mediated immunomodulation. PLoS One 11 (1), e0147868.
Rayahin J.E., Buhrman J.S., Zhang Y., Koh T.J., Gemeinhart R.A. 2015. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater. Sci. Eng. 1 (7), 481–493.
Sergeeva M.G., Aleshin S.E., Grabeklis S., Reiser G. 2010. PPAR activation has dichotomous control on the expression levels of cytosolic and secretory phospholipase A2 in astrocytes; inhibition in naïve, untreated cells and enhancement in LPS-stimulated cells. J. Neurochem. 115 (2), 399–410.
Kim M.Y., Muto J., Gallo R.L. 2013. Hyaluronic acid oligosaccharides suppress TLR3-dependent cytokine expression in a TLR4-dependent manner. PLoS One 8 (8), e72421.
Sloane J.A., Batt C., Ma Y., Harris Z.M., Trapp B., Vartanian T. 2010. Hyaluronan blocks oligodendrocyte progenitor maturation and remyelination through TLR2. Proc. Natl. Acad. Sci. 107 (25), 11 555–11 560.
Jiang D., Liang J., Noble P.W. 2011. Hyaluronan as an immune regulator in human diseases. Physiol. Rev. 91 (1), 221–264.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


