Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 103-109
Мелатонин усиливает химиотерапевтическое действие цитарабина в клетках HL-60
А. И. Ломовский a, Ю. Л. Бабурина a, М. И. Кобякова a, Р. С. Фадеев a, В. С. Акатов a, О. В. Крестинина a, *
a Институт теоретической и экспериментальной биофизики РАН
142290 Московской обл., Пущино, Россия
* E-mail: ovkres@mail.ru
Поступила в редакцию 11.04.2019
После доработки 22.05.2019
Принята к публикации 23.05.2019
Аннотация
Изучено совместное действие мелатонина и цитарабина в низкой концентрации на клетки острого промиелоцитарного лейкоза HL-60. Показано, что совместное действие этих веществ приводит к снижению количества клеток на 70% и индекса митотической активности на 75%. Установлено, что комбинированное действие мелатонина и цитарабина способствует также снижению экспрессии митохондриальных белков. Показано, что совместное применение мелатонина и цитарабина в низкой концентрации (2 нМ) снижает экспрессию потенциал-зависимого анионного канала (VDAC1). Мелатонин в сочетании с цитарабином аналогичным образом влиял на экспрессию транслокаторного белка (TSPO) и антиапоптотического белка Bcl-2. Выявлен синергический эффект мелатонина при комбинированном действии с цитарабином, который обеспечивает повышение эффективности его противоопухолевого действия.
ВВЕДЕНИЕ
Онкологические заболевания представляют одну из основных проблем современной медицины, в решении которой важное значение имеет поиск новых подходов к терапии опухолей. С этой целью необходимо изучение комбинированного действия уже известных препаратов и поиск новых, более эффективных, что позволит повысить выживаемость больных и замедлить развитие злокачественных опухолей. Мелатонин (МЕЛ, N-ацетил-5-метокситриптамин) – гормон, секретируемый шишковидной железой и другими тканями, обладает сходством с производными биогенного амина серотонина, синтезируемого из триптофана [1, 2]. Изучение МЕЛ и его влияния на организм человека показало, что МЕЛ обладает онкостатическими, антиоксидантными и иммунорегуляторными свойствами, поэтому он может рассматриваться как противоопухолевый агент. МЕЛ применяют в комбинированной терапии опухолей. Аномальные уровни МЕЛ у онкологических больных указывают на его участие в онкогенезе [3, 4]. Сообщается о значительных противоопухолевых эффектах МЕЛ в различных типах опухолевых клеток [5].
Цитарабин (ЦИТ) – противоопухолевый препарат на основе пиримидинового нуклеозида и арабинозы, широко используется в терапии лейкозов. ЦИТ применяется преимущественно при остром промиелоцитарном лейкозе (ОПЛ), неходжкинской лимфоме (НХЛ) и хроническом миелоцитарном лейкозе [6, 7]. ЦИТ можно использовать самостоятельно или в сочетании с другими противоопухолевыми агентами, такими как даунорубицин, доксорубицин, тиогуанин или винкристин.
ЦИТ действует на быстро делящиеся клетки и ингибирует синтез ДНК в S-фазе клеточного цикла, а также препятствует переходу клеток из G1-фазы в S-фазу. Точный механизм действия цитарабинтрифосфата не выяснен, но он, по-видимому, ингибирует ДНК-полимеразу, конкурируя с дезоксицитидинтрифосфатом [8]. Помимо противоопухолевой активности ЦИТ обладает и токсическим побочным действием.
Формирование неспецифичекой поры (mitochondrial permeability transition pore, мPTP) и увеличение проницаемости внутренней мембраны митохондрий происходит в процессе ответа на окислительный стресс и перегрузку митохондриального матрикса кальцием. Регуляторами/модуляторами мPTP являются потенциал-зависимый анионный канал (VDAC), транслоказа адениновых нуклеотидов, белок-транслокатор (translocator protein, TSPO) и другие белки. VDAC представляет собой белок 32 кДа, у человека представленный тремя изоформами (VDAC1, VDAC2, VDAC3). Наиболее распространена изоформа VDAC1 [9]. Взаимодействие VDAC с про- и антиапоптотическими белками наружной митохондриальной мембраны могут как способствовать гибели клеток, так и предотвращать ее. Таким образом, митохондриальный VDAC может быть перспективной терапевтической мишенью при различных типах опухолей. TSPO является не только партнером, но и модулятором VDAC [10]. Кроме того, некоторые исследователи считают, что TSPO играет ключевую роль в росте опухолевых клеток [11–13]. Показано также, что экспрессия TSPO увеличивается в опухолях разного типа, включая опухоли головного мозга и глиому. Установлено, что TSPO участвует в клеточной пролиферации и регуляции апоптоза в некоторых типах опухолевых клеток [13–15]. TSPO, локализованный рядом с VDAC, образует прочный комплекс с данным белком, регулируя тем самым проницаемость VDAC и функции митохондрий [16]. Ранее мы показали, что МЕЛ (1 мкМ) совместно с транс-ретиноевой кислотой (ATRA, 10 нМ) увеличивает ее цитотоксичность в отношении клеток HL-60 и подавляет экспрессию антиапоптотического белка Bcl-2, а также VDAC1 и TSPO [17].
В настоящей работе мы исследовали совместное действие МЕЛ (1 мМ) и ЦИТ в низкой концентрации (2 нМ) на пролиферативную активность клеток ОПЛ, используя в качестве модели клетки HL-60, и анализировали изменение уровня таких митохондриальных белков, как Bcl-2, VDAC1 и TSPO.
МАТЕРИАЛЫ И МЕТОДЫ
Культура клеток. Клетки ОПЛ человека HL-60 (CCL-240) получены из ATCC (Manassas, VA, США). Клетки выращивали в среде RPMI 1640 (Sigma-Aldrich, США) с добавлением 20% инактивированной фетальной бычьей сыворотки (Gibco, Grand Island, NY, США) и 40 мкг/мл сульфата гентамицина (Sigma-Aldrich, США) при 37°C, 95% влажности и 5% CO2. Удвоение культуры клеток наблюдали приблизительно через 24 ч.
Анализ жизнеспособности клеток. Жизнеспособность клеток оценивали с помощью ресазурина. Клетки высевали в 96-луночный планшет с плотностью 5 × 103 клеток на лунку. Через 24 ч клетки обрабатывали МЕЛ и ЦИТ в указанных дозах. Через 24 ч после обработки в каждую лунку добавляли ресазурин (Sigma-Aldrich, США) в конечной концентрации 100 мкг/мл, клетки инкубировали в течение 4 ч при 37°C. Интенсивность флуоресценции измеряли с помощью устройства для считывания микропланшетов Infinite F200 (Tecan, Grodig, Австрия) при длине волны возбуждения 535 нм и длине волны излучения 595 нм. Данные представлены как процент от контроля (необработанные образцы клеток).
Определение митотического индекса. Митотическую активность определяли следующим образом: клетки, инкубированные в течение 96 ч в различных условиях, центрифугировали (250 g, 10 мин), ресуспендировали в фосфатно-солевом буфере (PBS) и фиксировали 70% этанолом (30 мин, при комнатной температуре). Затем фиксированные клетки окрашивали бисбензимидом H33342 (Sigma-Aldrich, США) и рассчитывали число митотических клеток, используя флуоресцентный микроскоп DM 6000 (Leica, Германия). Митотический индекс (MI) определяли по формуле MI = = (P + M + A + T)/N, где P + M + A + T – сумма всех клеток в фазах: профазы, метафазы, анафазы и телофазы соответственно, и N – общее количество клеток.
Анализ роста клеток. Рост клеток оценивали путем подсчета клеток в разные моменты времени после обработки. Клетки собирали центрифугированием в течение 10 мин при 250 g и промывали PBS. Затем клетки окрашивали 0.4% трипановым синим (Sigma-Aldrich, США) для оценки количества и жизнеспособности клеток. В каждом эксперименте подсчитывали по три образца на группу. Эксперименты выполняли не менее чем в трех повторах.
Электрофорез и Вестерн-блот-анализ. Клетки HL-60 (2 × 105 клеток/мл), обработанные МЕЛ и/или ЦИТ, собирали, дважды промывали охлажденным PBS и лизировали в буфере для лизиса (50 мМ Трис-HCl (pH 7,4), 150 мМ NaCl, 1% Triton X-100, 0.1% SDS, 1 мМ EDTA, 1 мМ Na3VO4 и 1 мМ NaF) с добавлением ингибиторов протеиназы/фосфатазы. Экстракты инкубировали на льду в течение 30 мин и затем центрифугировали при 13 000 g в течение 20 мин при 4°С. Супернатанты собирали и количественно определяли концентрацию белка с использованием метода Брэдфорда. Затем супернатанты солюбилизировали с помощью буфера для образцов 4× Laemmli (Bio-Rad, США). Для определения уровня митохондриальных белков образцы нагревали до 95°С в течение 5 мин и наносили на гель. Образцы белка разделяли с помощью 12.5% денатурирующего гель-электрофореза (SDS-PAGE) и переносили на нитроцеллюлозную мембрану при 300 мА в течение 1 ч. Мембрану блокировали в растворе Roti-block (ROTH, Германия) в течение 1 ч при комнатной температуре, затем инкубировали с первичными антителами при 4°С в течение ночи, а затем с вторичными антителами, конъюгированным с пероксидазой хрена (HRP). Поликлональные антитела к TSPO и VDAC1 получены от Abcam (Великобритания), моноклональные антитела к Bcl-2 были из Santa Cruz, США. Антитела к α-тубулину (Cell Signaling, Danvers, MA, США) использовали в качестве контроля белковой нагрузки. Пероксидазную активность определяли хемилюминесцентными реагентами (Bio-Rad, США). Количественный анализ интенсивности белковых полос проводили с помощью денситометриии (программа Image Lab, Bio Rad, США).
Статистический анализ. Все данные представлены как среднее значение ±SD. Статистическая значимость подтверждена t-тестом Стьюдента с использованием программного обеспечения Sigma plot (Systat Software Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
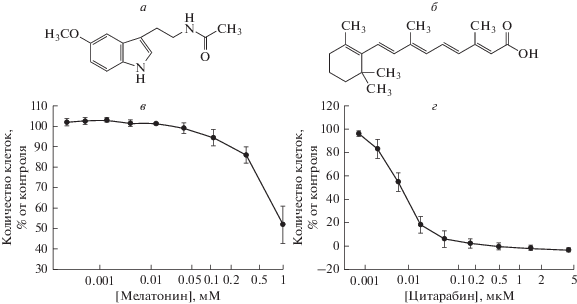
ЦИТ как сам по себе, так и в сочетании с другими противоопухолевыми препаратами широко используется в терапии лейкозов и солидных опухолей [18]. Комбинации препаратов, обладающие синергическим эффектом, обычно улучшают результаты терапии [19]. Понимание механизма действия и метаболизма ЦИТ позволило преодолеть его низкую биодоступность и повысить стабильность, однако негативные эффекты препарата ЦИТ и его токсичность по-прежнему представляют проблему для его применения. Известно, что МЕЛ оказывает благоприятное воздействие, снижает рост и прогрессию клеток рака печени и поджелудочной железы [20, 21]. В настоящей работе изучено совместное действие МЕЛ и ЦИТ в концентрации, ниже используемой в медицинской практике, на пролиферативную активность клеток HL-60 и изменение экспрессии митохондриальных белков, таких как Bcl-2, VDAC1 и TSPO. Сначала было проанализировано действие различных концентраций МЕЛ и ЦИТ на клетки линии HL-60. ОПЛ клетки обрабатывали МЕЛ в течение 96 ч в различных концентрациях (10–3, 3.3 × 10–4, 1.1 × 10–4, 4 × 10–5, 10–5, 4.1 × 10–6, 1.4 × × 10–5, 5 × 10–6, 2 × 10–6 М) и ЦИТ (4.4 × 10–6, 1.5 × 10–6, 0.5 × 10–6, 5.4 × 10–10, 1.8 × 10–10, 6 × 10–10, 2 × 10–10, 7 × 10–11 M). Нами была выбрана максимальная нетоксичная концентрация ЦИТ – 2 нМ и рабочая концентрация МЕЛ, равная 1 мМ.
Рис. 1.
Химическая структура мелатонина (МЕЛ, а) и цитарабина (ЦИТ, б). в, г – Концентрационная зависимость цитотоксических эффектов МЕЛ (в) и ЦИТ (г). Клетки высевали в 96-луночный планшет с плотностью 5 × 103 клеток на лунку и обрабатывали МЕЛ и ЦИТ в указанных концентрациях в течение 96 ч. Данные представлены в виде среднего значения ± стандартное отклонение (SD), вычисленного по результатам 10 отдельных экспериментов.
Затем мы оценили пролиферативную активность клеток HL-60, обработанных ЦИТ и МЕЛ в течение 96 ч (рис. 2). Рисунок 2а показывает прирост клеток в различных условиях относительно контроля. Видно, что количество клеток, обработанных МЕЛ и ЦИТ, снижалось на 50 и 20%, соответственно, по сравнению с контролем (100%). Таким образом, МЕЛ (1 мМ) и ЦИТ в низкой концентрации (2 нМ) оказывают цитостатическое действие на клетки ОПЛ и не влияют на их жизнеспособность. Совместное действие МЕЛ и ЦИТ привело к снижению количества клеток на 70% по сравнению с контролем. При совместном применении МЕЛ значительно усиливал действие ЦИТ.
Рис. 2.
Совместное влияние МЕЛ и ЦИТ на пролиферацию клеток HL-60. Клетки высевали на чашку с плотностью 200 × 103 клеток и обрабатывали МЕЛ и ЦИТ. Контроль (колонка 1), ЦИТ (колонка 2), МЕЛ (колонка 3), ЦИТ и МЕЛ (колонка 4). Данные представлены в виде среднего значения ± стандартное отклонение (SD), вычисленного по результатам 10 отдельных экспериментов. *р < 0.05 – достоверное отличие от контрольной величины. #р < 0.05 – достоверное отличие от величины, полученной при обработке только МЕЛ.
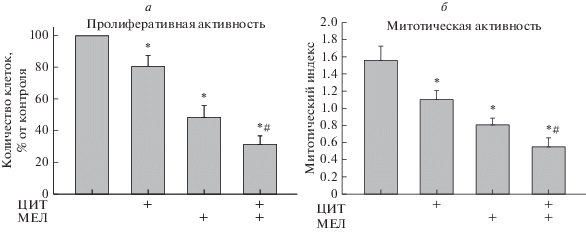
Мерой статуса пролиферации клеточной популяции является митотический индекс (МИ), который определяется как отношение количества клеток в фазе митоза к общему количеству клеток. Нами проанализирован МИ клеток в различных условиях. На рис. 2б показано, как влияют МЕЛ и ЦИТ на митотическую активность клеток HL-60. Таким образом, показано, что действие МЕЛ и ЦИТ способствует снижению МИ на ~50 и 25% соответственно. При совместном действии этих веществ МИ снижался на 64% по сравнению с контролем (необработанные клетки) и на 50% по сравнению с МИ при действии только ЦИТ. Эти результаты показывают, что МЕЛ может усиливать противоопухолевое действие ЦИТ в клетках HL-60.
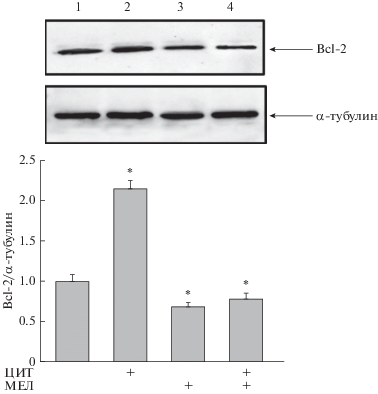
Ранее Кинтана и его соавт. сообщали, что МЕЛ модулирует индукцию апоптоза в клетках лейкоза человека (U937), подвергнутых воздействию гипертермии [22]. Нами определено изменение уровня белка Bcl-2 в наших экспериментальных условиях. На верхней панели рис. 3 приведены Вестерн-блоты Bcl-2 в лизированных клетках ОПЛ (HL-60), обработанных МЕЛ, ЦИТ и МЕЛ + ЦИТ. Количественное изменение уровня белка Bcl-2 показано на рис. 3 (нижняя панель). Количественное соотношение белковых полос оценивали после нормирования белка по α-тубулину. Уровень белка Bcl-2 в клетках HL-60 в присутствии ЦИТ был в 2 раза выше, чем в контрольных условиях. МЕЛ способствовал снижению уровня Bcl-2 на ~45%. Аналогичный результат получен при действии МЕЛ + ЦИТ (снижение Bcl-2 на ~40%). Интересно, что совместное действие МЕЛ и ЦИТ способствовало снижению повышенного уровня Bcl-2, которое наблюдалось в присутствии только ЦИТ. Возможно, снижение уровня Bcl-2 под действием МЕЛ + ЦИТ снижает клеточный ответ на ЦИТ, активируя тем самым запуск сигнального каскада апоптоза.
Рис. 3.
Комбинированное действие МЕЛ и ЦИТ на уровень белка Bcl-2 в клетках HL-60. Клетки высевали на чашки с плотностью 5 × 105 и обрабатывали МЕЛ (столбец 2), ЦИТ (столбец 3), совместное действие МЕЛ и ЦИТ (столбец 4), контрольные необработанные клетки (столбец 1). Иммунодетекцию α-тубулина использовали в качестве контроля нагрузки. Верхняя часть – иммуноокрашивание Bcl-2 и α-тубулина. Нижняя часть – диаграмма количественного определения иммуноокрашивания с использованием компьютерной денситометрии. Гистограммы представляют уровни белков в относительных единицах. Уровень белка в клеточном лизате без каких-либо добавок принят за единицу и служит контролем. Данные представлены в виде среднего значения ± стандартное отклонение (SD), вычисленного по результатам 5 отдельных экспериментов, * р < 0.05.
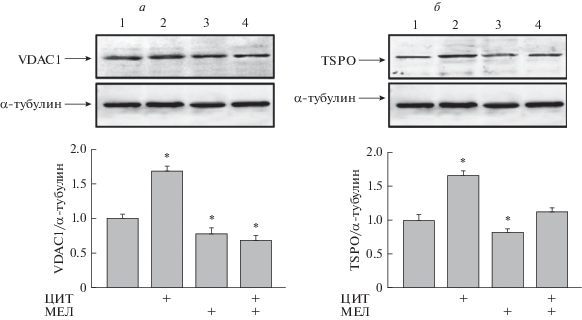
Молекулярные взаимодействия VDAC с про- и антиапоптотическими белками наружной митохондриальной мембраны являются многогранными, и они могут как способствовать, так и предотвращать гибель клеток. Митохондриальный VDAC – основной компонент, который можно рассматривать как перспективную мишень для противоопухолевой терапии. Поскольку сообщается, что VDAC инициирует апоптотические сигнальные каскады [23], и VDAC1 используется как противоопухолевая мишень [24], мы определяли содержание VDAC1 в наших экспериментальных условиях (рис. 4а). В клетках, обработанных ЦИТ, уровень VDAC1 повышался на ~70%. Анализ результатов действия МЕЛ и МЕЛ + ЦИТ показал снижение уровня VDAC1 на ~30 и ~35%, соответственно, что указывает на изменения в регуляции метаболических и энергетических функций митохондрий и дальнейшей выживаемости опухолевых клеток. Как сказано ранее, VDAC в митохондриях может образовывать прочный комплекс с TSPO. Таким образом, TSPO может влиять на проницаемость образованных VDAC каналов и модулировать функции митохондрий. Также известно, что экспрессия TSPO возрастает в различных опухолях, включая опухоли головного мозга и глиому [25–27]. Учитывая сказанное, мы оценили изменение уровня TSPO в наших экспериментальных условиях. На рис. 4б показано, что в присутствии ЦИТ уровень и TSPO, и VDAC1 повышался на ~70%. МЕЛ, напротив, снижал уровень исследуемых белков на ~20%. В случае применения МЕЛ + ЦИТ МЕЛ компенсировал повышение уровня TSPO, вызванное ЦИТ. Следовательно, можно предположить, что МЕЛ способствует снижению экспрессии TSPO в условиях совместного действия с ЦИТ и может вызывать снижение онкогенности.
Рис. 4.
Комбинированное влияние МЕЛ и ЦИТ на уровень TSPO и VDAC1 в клетках HL-60. Клетки высевали на чашки с плотностью 5 × 105 и обрабатывали МЕЛ (столбец 2), ЦИТ (столбец 3), совместное действие МЕЛ и ЦИТ (столбец 4), контрольные необработанные клетки (столбец 1). Иммунодетекция α-тубулина использована в качестве контроля нагрузки. а – Иммуноокрашивание (верхняя часть) и количественное определение (нижняя часть) уровня белка VDAC1. б – TSPO. На гистограммах представлены уровни соответствующих белков в относительных единицах. Уровень белка в клеточном лизате без каких-либо добавок принят за единицу и служит контролем. Данные представлены в виде среднего значения ± стандартное отклонение (SD), вычисленного по результатам 5 отдельных экспериментов, * р < 0.05.
Таким образом, МЕЛ увеличивал цитостатическое действие ЦИТ в клетках HL-60 и подавлял экспрессию антиапоптотического белка Bcl-2. Применение МЕЛ способствует усилению действия низкой концентрации ЦИТ, приводя к значительным изменениям пролиферативной и митотической активности клеток HL-60, модели ОПЛ. Экспрессия VDAC1 и TSPO в этих условиях снижалась. В целом, наши результаты показывают, что МЕЛ способен усиливать действие других химиотерапевтических агентов и может использоваться в новых стратегиях терапии рака.
Работа поддержана грантом РФФИ № 17-04-00747.
Список литературы
Carlberg C. 2000. Gene regulation by melatonin. Ann. N. Y. Acad. Sci. 917, 387–396.
Stehle J.H., Saade A., Rawashdeh O., Ackermann K., Jilg A., Sebesteny T., Maronde E. 2011. A survey of molecular details in the human pineal gland in the light of phylogeny, structure, function and chronobiological diseases. J. Pineal Res. 51 (1), 17–43.
Bizzarri M., Proietti S., Cucina A., Reiter R.J. 2013. Molecular mechanisms of the pro-apoptotic actions of melatonin in cancer: A review. Expert Opin. Ther. Targets. 17 (12), 1483–1496.
Vijayalaxmi, Thomas C.R., Jr., Reiter R.J., Herman T.S. 2002. Melatonin: From basic research to cancer treatment clinics. J. Clin. Oncol. 20 (10), 2575–2601.
Shiu S.Y. 2007. Towards rational and evidence-based use of melatonin in prostate cancer prevention and treatment. J. Pineal Res. 43 (1), 1–9.
Pinilla-Ibarz J., Bello C. 2008. Modern approaches to treating chronic myelogenous leukemia. Curr. Oncol. Rep. 10 (5), 365–371.
Shah M., Agarwal B. 2008. Recent advances in management of acute myeloid leukemia (AML). Indian J. Pediatr. 75 (8), 831–837.
Kantarjian H.M., O’Brien S., Smith T.L., Cortes J., Giles F.J., Beran M., Pierce S., Huh Y., Andreeff M., Koller C., Ha C.S., Keating M.J., Murphy S., Frei-reich E.J. 2000. Results of treatment with hyper-CVAD, a dose-intensive regimen, in adult acute lymphocytic leukemia. J. Clin. Oncol. 18 (3), 547–561.
Bayrhuber M., Meins T., Habeck M., Becker S., Giller K., Villinger S., Vonrhein C., Griesinger C., Zweckstetter M., Zeth K. 2008. Structure of the human voltage-dependent anion channel. Proc. Natl. Acad. Sci. USA. 105 (40), 15 370–15 375.
McEnery M.W., Snowman A.M., Trifiletti R.R., Snyder S.H. 1992. Isolation of the mitochondrial benzodiazepine receptor: Association with the voltage-dependent anion channel and the adenine nucleotide carrier. Proc. Natl. Acad. Sci. USA. 89 (8), 3170–3174.
Landau M., Weizman A., Zoref-Shani E., Beery E., Wasseman L., Landau O., Gavish M., Brenner S., Nordenberg J. 1998. Antiproliferative and differentiating effects of benzodiazepine receptor ligands on B16 melanoma cells. Biochem. Pharmacol. 56 (8), 1029–1034.
Veenman L., Gavish M. 2012. The role of 18 kDa mitochondrial translocator protein (TSPO) in programmed cell death, and effects of steroids on TSPO expression. Curr. Mol. Med. 12 (4), 398–412.
Wu X., Gallo K.A. 2013. The 18-kDa translocator protein (TSPO) disrupts mammary epithelial morphogenesis and promotes breast cancer cell migration. PLoS One. 8 (8), e71258.
Beinlich A., Strohmeier R., Kaufmann M., Kuhl H. 2000. Relation of cell proliferation to expression of peripheral benzodiazepine receptors in human breast cancer cell lines. Biochem. Pharmacol. 60 (3), 397–402.
Ikezaki K., Black K.L. 1990. Stimulation of cell growth and DNA synthesis by peripheral benzodiazepine. Cancer Lett. 49 (2), 115–120.
McEnery M.W., Dawson T.M., Verma A., Gurley D., Colombini M., Snyder S.H. 1993. Mitochondrial voltage-dependent anion channel. Immunochemical and immunohistochemical characterization in rat brain. J. Biol. Chem. 268 (31), 23289–23296.
Krestinina O., Fadeev R., Lomovsky A., Baburina Y., Kobyakova M., Akatov V. 2018. Melatonin can strengthen the effect of retinoic acid in HL-60 cells. Int. J. Mol. Sci. 19 (10), 2873.
Matsumura I. 2009. Standard therapies for acute myeloid leukemia. Rinsho Ketsueki. 50 (10), 1389–1400.
Robak T., Wierzbowska A. 2009. Current and emerging therapies for acute myeloid leukemia. Clin. Ther. 31 Pt 2, 2349–2370.
Fan L.L., Sun G.P., Wei W., Wang Z.G., Ge L., Fu W.Z., Wang H. 2010. Melatonin and doxorubicin synergistically induce cell apoptosis in human hepatoma cell lines. World J. Gastroenterol. 16 (12), 1473–1481.
Leja-Szpak A., Jaworek J., Pierzchalski P., Reiter R.J. 2010. Melatonin induces pro-apoptotic signaling pathway in human pancreatic carcinoma cells (PANC-1). J. Pineal. Res. 49 (3), 248–255.
Quintana C., Cabrera J., Perdomo J., Estevez F., Loro J. F., Reiter R. J., Quintana J. 2016. Melatonin enhances hyperthermia-induced apoptotic cell death in human leukemia cells. J. Pineal. Res. 61 (3), 381–395.
Shimizu S., Narita M., Tsujimoto Y. 1999. Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel VDAC. Nature. 399 (6735), 483–487.
Mathupala S.P., Pedersen P.L. 2010. Voltage dependent anion channel-1 (VDAC-1) as an anti-cancer target. Cancer Biol. Ther. 9 (12), 1053–1056.
Black K.L., Ikezaki K., Santori E., Becker D.P., Vinters H.V. 1990. Specific high-affinity binding of peripheral benzodiazepine receptor ligands to brain-tumors in rat and man. Cancer. 65 (1), 93–97.
Ferrarese C., Appollonio I., Frigo M., Gaini S. M., Piolti R., Frattola L. 1989. Benzodiazepine receptors and diazepam-binding inhibitor in human cerebral-tumors. Ann. Neurol. 26 (4), 564–568.
Veenman L., Levin E., Weisinger G., Leschiner S., Spanier I., Snyder S. H., Weizman A., Gavish M. 2004. Peripheral-type benzodiazepine receptor density and in vitro tumorigenicity of glioma cell lines. Biochem. Pharmacol. 68 (4), 689–698.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


