Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 110-119
Свидетельства в пользу преимущественной локализации рецепторов цитокининов картофеля в эндоплазматическом ретикулуме
С. Н. Ломин a, Е. М. Савельева a, Д. В. Архипов a, Г. А. Романов a, *, **
a Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, Россия
* E-mail: gar@ippras.ru
** E-mail: gromanov@yahoo.com
Поступила в редакцию 20.04.2019
После доработки 27.07.2019
Принята к публикации 29.07.2019
Аннотация
Цитокинины, классические гормоны растений, узнаются клеткой благодаря рецепторам – гибридным сенсорным гистидинкиназам, мультидоменным трансмембранным белкам. Cубклеточная локализация рецепторов во многом определяет как характер воздействия гормона на клетку, так и путь трансдукции гормонального сигнала до первичных мишеней. Недавно мы клонировали и исследовали семейство рецепторов цитокининов у картофеля Solanum tuberosum L. Два типичных представителя этого семейства, рецепторы StHK2a и StHK4b, были отобраны для изучения их субклеточной локализации. Мы провели фракционирование в двухфазной системе суммарных мембран, выделенных из листьев табака, в которых транзиентно экспрессировали отобранные рекомбинантные рецепторы картофеля, соединенные с GFP-репортером. Были получены две мембранные фракции, одна из которых была обогащена эндоплазматическим ретикулумом (ЭР), другая – плазматической мембраной (ПМ). Содержание StHK2a и StHK4b в каждой из фракций определяли радиолигандным методом. Каждый из рецепторов был выявлен в обеих фракциях, с некоторым перевесом во фракции, обогащенной ЭР (для StHK4b). Поскольку содержание мембран ЭР в клетке значительно превосходит содержание ПМ, основная масса рецепторов должна быть в составе ЭР. Сайты специфического связывания цитокинина были обнаружены и в аналогичных фракциях мембран из корней картофеля. Хотя удельное содержание цитокинин-связывающих сайтов было выше в ПМ, бóльшая часть этих сайтов, т.е. рецепторов в клетке, все же находилась в ЭР. Для того чтобы выяснить, нет ли ограничений функциональной активности у рецепторов в ЭР, был применен недавно предложенный рН-критерий. Согласно этому критерию, рецепторы цитокининов картофеля, как и их ортологи из других видов, настроены на работу в условиях ЭР, но не ПМ. В пользу ЭР свидетельствуют и результаты молекулярного моделирования интерфейса димеризации рецепторов при разных значениях рН. Таким образом, основным местом субклеточной локализации функционально активных цитокининовых рецепторов картофеля является ЭР, хотя существенная доля рецепторов находится и в составе ПМ. При этом вопрос о функциональности рецепторов в ПМ остается открытым.
ВВЕДЕНИЕ
Характер и значимость функционирования белка в эукариотической клетке во многом зависят от клеточного компартмента, в котором локализуется данный белок. Это в полной мере относится к гормональным рецепторам, субклеточная локализация которых определяет сайты инициации гормонального сигналинга и местоположение активного пула гормонов. В этой связи становится понятным то повышенное внимание, которое уделяется проблеме субклеточной локализации белков, особенно таких, которые необходимы для сигналинга гормонов.
Мы изучали субклеточную локализацию рецепторов цитокининов картофеля, крупных трансмембранных белков. Цитокинины – это классические гормоны растений, они регулируют множество процессов, таких, как деление клеток, скорость роста побега и корня, развитие хлоропластов, старение листьев, устойчивость к повреждающим факторам и др. [1]. Рецепторы цитокининов представляют собой сенсорные гибридные гистидинкиназы, гомологичные сенсорным гистидинкиназам бактерий так называемой двухкомпонентной системы передачи сигнала [2]. У бактерий эти белки находятся на мембране клетки и воспринимают сигналы из межклеточного пространства. После открытия рецепторов цитокининов в 2000–2001 гг. возникло представление об их локализации на плазматической мембране (ПМ), видимо, по аналогии с бактериальной клеткой [3–6]. В пользу локализации на ПМ также свидетельствовали биоинформатические оценки [7] и отдельные экспериментальные факты [8].
Однако более основательное изучение свойств рецепторов заставило пересмотреть эти представления. Оказалось, что рецепторы активно связывают гормон, т.е. цитокинин, в условиях нейтрального или слабощелочного значения рН, но резко теряют связывающую способность при снижении рН до 5–5.5 [9–11]. Как известно, такие клеточные компоненты, как ядро, эндоплазматический ретикулум (ЭР) , цитозоль, характеризуются слабощелочным рН, близким к нейтральному, тогда как внешняя среда клеток (апопласт) обычно закислена до рН 4.5–6 (ссылки в [12]). Это указывает на то, что локализация сенсорного модуля рецептора на внешней стороне ПМ, как предполагали вначале, неблагоприятна для его функционирования из-за сильного закисления внешней среды, тогда как локализация на внутренних мембранах, например ЭР, снимала бы это ограничение. Последующие прямые опыты, выполненные в основном на арабидопсисе, четко указали на нахождение основной массы цитокининовых рецепторов в составе ЭР [13–15]. Аналогичные данные в пользу преимущественной локализации цитокининовых рецепторов на ЭР были получены на растениях других видов: кукурузы [16], риса [17] и яблони [18]. В то же время появилась статья, авторы которой на основании полученного ими экспериментального, хотя и косвенного, материала утверждали, что активные цитокининовые рецепторы локализуются главным образом на ПМ [19]. Хотя эта работа вызвала серьезную критику [12] и до сих пор не получила независимого подтверждения, она характеризует остроту дискуссии о субклеточной локализации рецепторов цитокининов, которая еще далеко не закончена.
В этой связи мы попытались определить субклеточную локализацию рецепторов у нового для таких исследований вида растений, а именно у картофеля. Недавно рецепторы цитокининов картофеля были клонированы и детально охарактеризованы [11], что создало базу для дальнейшего изучения этих белков. Все полученные разными методами результаты свидетельствовали в пользу локализации основного пула активных цитокининовых рецепторов картофеля на мембранах ЭР.
МАТЕРИАЛЫ И МЕТОДЫ
Плазмидные конструкции. В работе использованы конструкции для транзиентной экспрессии генов рецепторов в листьях табака Nicotiana benthamiana, как описано у Lomin et al. [11]. Тотальная РНК была получена из растений картофеля сорта Désirée, выращенных in vitro на агаризованной среде Мурасиге и Скуга. Эту РНК использовали для синтеза кДНК. Затем на матрице кДНК были амплифицированы кодирующие последовательности генов рецепторов StHK2a и StHK4b. Для амплификации гена StHK2a использовали праймеры 5'-TACAAAAAAGCAGGCTTGATGAGCTTTTCTGCTCTGGGTG-3' (StHK2_attB1) и ACAAGAAAGCTGGGTAACCTGACCCGAAGAAG (StHK2_attB2), предполагаемая длина ампликона StHK2a – 3823 пн. Для амплификации гена StHK4b использовали праймеры ACTAGTATGGGTGAGAAGATGCAAAGCC (StHK4_BcuI) и AGGAATTCCAAGTCTCTTCAGATGGTATC (StHK4_EcoRI), предполагаемая длина ампликона StHK4 – 2163 пн.
StHK2a был встроен с помощью технологии GATEWAY (ThermoScientific) в плазмиду pB7FWG2 [20]. StHK4b был встроен в конструкцию pB7FWG2-AHK3 [10] вместо AHK3 по сайтам рестрикции BcuI и EcoRI. В полученных конструкциях ген рецептора был на 5'-конце объединен с конститутивным промотором 35S CaMV, а на 3'-конце – с геном флуоресцентного белка GFP, причем в случае StHK4b – через сохранившийся фрагмент 3'-концевой последовательности AHK3 длиной 804 пн. Затем полученными плазмидными конструкциями трансформировали агробактерии Agrobacterium tumefaciens штамма GV3101.
Экспрессия генов рецепторов. Трансформацию листьев табака N. benthamiana осуществляли согласно Sparkles et al. [21]. Для инфильтрации использовали растения возрастом 8 недель. Инфильтрацию проводили смесью клонов A. tumefaciens: клона с плотностью OD600 0.035, несущего ген рецептора, и клона с плотностью OD600 0.05, несущего рекомбинантную плазмиду с геном p19 [22]. Экспрессию целевых генов детектировали с помощью флуоресцентного микроскопа AxioImager Z2 (Carl Zeiss Microscopy GmbH). Листья с выраженной транзиентной экспрессией рецепторов использовали для получения мембран. Иммуноблотинг с антителами против GFP показал, что экспрессируемые рекомбинантные рецепторы обладают массой, близкой к ожидаемой.
Получение мембранных фракций. Все операции проводили при 4°С. Мембранные фракции нетрансгенного картофеля выделяли из корней и листьев растений сорта Жуковский ранний возрастом 55 дней, выросших в условиях поля. Листья табака (10 г), экспрессирующие рецепторы цитокининов, или органы (корней или листьев) картофеля, растирали с помощью ступки и пестика в 30 мл буфера гомогенизации 100 мМ Трис-HCl pH 7.6, 0.33 М сахарозы, 10 мМ EDTA, 5 мМ метабисульфита калия, 0.6% PVP K30, 5 мМ дитиотреитола, 1 мМ фенилметилсульфонилфторида. Полученный гомогенат фильтровали через ткань Miracloth (Calbiochem®). Фильтрат центрифугировали при 10 000 g 10 мин, удаляя клеточный дебрис и крупные органеллы. Супернатант далее центрифугировали при 100000 g 30 мин. Последний супернатант удаляли, а осадок мембран тщательно ресуспендировали с помощью стеклянного гомогенизатора до отдельных везикул в фазовом буфере 5 мМ К2HPO4/ КH2PO4, pH 7.8, 0.33 М сахарозы, 3 мМ KCl, 0.1 мМ EDTA. Аналогично выделяли суммарные мембраны из листьев и корней картофеля. Фракционирование мембран осуществляли в водной полимерной двухфазной системе на основе декстрана 500 000 и PEG 3350. Разделение проводили в 36 г раствора при равной концентрации полимеров 7.2% в/в для листьев табака и 6.6% в/в для корней и листьев картофеля. Для этого соответственно 2.59 г или 2.38 г декстрана 500 000 и PEG 3350 смешивали с фазовым буфером до общей массы 27 г. Затем к полученной смеси добавляли 9 г суспензии тотальных мембран в фазовом буфере. Полученную смесь перемешивали и разделяли фазы центрифугированием при 3000 g 10 мин в бакет-роторе. Далее верхнюю фазу объемом около 18 мл, обогащенную ПМ, переносили в новую пробирку, содержащую 1.224 г KH2PO4 и 0.784 г K2HPO4. После растворения солей в содержимом верхней фазы смесь центрифугировали при 3000 g 10 мин в бакет-роторе. При этом смесь разделялась на две фазы, а мембраны перемещались в интерфазу. Содержимое интерфазы переносили в новую пробирку и разбавляли 30 мл фазового буфера. 2 мл нижней фазы, содержащей все внутриклеточные мембраны, переносили в новую пробирку и разбавляли 30 мл фазового буфера. Затем полученные смеси центрифугировали повторно при 100 000 g 30 мин. Полученные осадки ресуспендировали в 0.5 мл раствора 50 мМ KCl и 10% глицерина. Определяли содержание белка по методу Брэдфорд.
Анализ гомогенности мембранных фракций. Степень гомогенности мембранных фракций проверяли с помощью иммуноблотинга с антителами против белков-маркеров мембран. Маркером ПМ была плазмалеммная H+-ATP-аза, маркером ЭР – белок-шаперон BiP. Мембраны в количестве 7 мкг тотального белка каждой фракции смешивали с буфером нанесения на гель. Образец инкубировали в течение часа при 37°С, затем наносили на 10% полиакриламидный гель с додецилсульфатом натрия (SDS). После электрофореза белки из геля переносили на мембрану из поливинилиденфторида. После этого проводили иммуноблотинг с первичными кроличьими поликлональными антителами против плазмалеммной H+-ATP-азы (Agrisera, AS07 260) при разведении 1 : 600, против BiP (Agrisera, AS09 481) при разведении 1 : 1000 и против GFP (Agrisera, AS15 2987) при разведении 1 : 5000. Инкубацию с антителами проводили в течение 2 ч в фосфатно-солевом буфере (PBS) c 5% обезжиренного сухого молока. Прочно связанные первичные антитела “проявляли” вторичными козьими антителами против иммуноглобулинов кролика, конъюгированными с пероксидазой хрена (Millipore, AP132P), в разведении 1 : 30 000 в буфере PBS c 5% обезжиренного сухого молока. Активность пероксидазы выявляли с помощью набора Clarity™ Western ECL Substrate (Bio-Rad). Люминесценцию детектировали с применением рентгеновской фотопленки CL-XPosure™ Film (ThermoScientific).
Детектирование рецепторов в мембранных фракциях. Рецепторы в мембранных фракциях детектировали по связыванию меченного тритием изопентениладенина ([3H]iP, 17.4 Kи/ммоль) [10, 23]. Реакцию проводили в 0.75 мл PBS с [3H]iP в концентрации 2.6 нМ (2 пмоль на пробу) с суспензией мембран (25 мкг тотального белка) при температуре 4°С в течение часа. Затем мембраны осаждали при 16 000 g в течение 20 мин. Супернатант удаляли, а связанный с мембранами [3H]iP экстрагировали в 200 мкл этанола в течение 16 ч. Затем экстракт смешивали со сцинтилляционной жидкостью и определяли радиоактивность с помощью сцинтилляционного счетчика. Для определения неспецифического связывания инкубацию с [3H]iP проводили в присутствии большого избытка (10 мкМ) немеченого iP. Специфическое связывание определяли количественно по разнице между тотальным и неспецифическим связыванием. Анализ влияния рН на связывание гормона рецептором был выполнен, как описано ранее [10, 11].
Молекулярное моделирование структуры и взаимодействия сенсорных модулей рецепторов. Молекулярное моделирование белковых структур по гомологии проводили в программе Modeller 9.20 [24] с использованием класса automodel. Шаблоном для моделирования служила кристаллическая структура сенсорного модуля цитокининового рецептора AHK4 (PDB ID: 3T4L) [25]. После добавления атомов водорода, структуры были минимизированы в программе USCF Chimera 1.13.1 [26] в силовом поле AMBER ff14SB [27]. Стереохимическую достоверность и качество упаковки моделей проверяли в программе ProCheck [28]. Для изучения комплементарности интерфейсов по гидрофобности и электростатическому потенциалу в программе MolSurfer были получены 2D проекции интерфейсов [29] с использованием PQR-файлов, подготовленных с помощью сервера PDB2PQR [30], при различных значениях pH для симуляции среды, характерной для апопласта и ЭР.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В тетраплоидном картофеле сорта Désirée ранее мы идентифицировали шесть рецепторов цитокининов: StHK2a, StHK2b, StHK3a, StHK3b, StHK4a и StHK4b [11]. Целью нашей работы было установить субклеточную локализацию рецепторов цитокининов картофеля на примере белков StHK2a и StHK4b. В каждой паре паралогов (a и b) рецепторы очень похожи друг на друга. Поэтому мы ограничились характеристикой одного представителя из каждой из этих двух групп. Что касается рецепторов группы StHK3, то при экспрессии в гетерологичных системах возникли проблемы с детекцией связывания лиганда. Гены анализируемых рецепторов были соединены в векторе с геном флуоресцентного белка GFP, что позволило оценивать экспрессию таких рекомбинантных рецепторов по уровню флуоресценции. Гены рецепторов были транзиентно экспрессированы в листьях табака N. benthamiana. На пятый день после инокуляции листьев соответствующим клоном A. tumefaciens проводили оценку уровня экспрессии с помощью флуоресцентной микроскопии. Затем из экспрессирующих листьев выделяли суммарную фракцию мембран с помощью дифференциального центрифугирования. Мембраны представляли собой осадок микросом, полученный в результате центрифугирования при 100 000 g. Выделенные микросомы разделяли на фракции, предположительно обогащенные ПМ или внутриклеточными мембранами, с помощью двухфазной полимерной водной системы декстран–полиэтиленгликоль [31]. После этого мембраны концентрировали путем повторного ультрацентрифугирования. По общему количеству в пересчете на тотальный белок фракция, соответствующая внутриклеточным мембранам, преобладала над фракцией ПМ в среднем в 10–15 раз. Степень фактического обогащения фракций мембранами ПМ и ЭР определяли с помощью иммуноблотинга с антителами против плазмалеммной H+-ATP-азы и белка-шаперона BiP, резидента ЭР. Согласно иммуноблотингу, плазмалеммная H+-ATP-аза ожидаемо преобладала в верхней фракции, а BiP – в нижней (рис. 1). По нашим оценкам, во фракциях, обогащенных ПМ, содержание H+-ATP-азы превышало таковое во фракции внутриклеточных мембран в 3.1 и 2.4 раза в опытах с рецепторами StHK2a и StHK4b соответственно, тогда как во фракциях, обогащенных внутриклеточными мембранами, преобладало содержание маркера BiP (в 3.7 и 2.7 раза в опытах с рецепторами StHK2a и StHK4b соответственно). Наличие цитокининовых рецепторов в мембранных фракциях оценивали по уровню специфического связывания с меченным тритием изопентениладенином. Присутствием эндогенных рецепторов табака можно было пренебречь, так как их специфическое связывание не превышало 5% от общего уровня специфически связанной метки [10]. Тестируемые рецепторы картофеля были обнаружены в обеих фракциях мембран (рис. 1). В случае рецептора StHK2a его удельное содержание (в расчете на 1 мкг белка) во фракциях было примерно равным, тогда как содержание StHK4b было заметно выше в ЭР, чем в ПМ. Известно, что основная масса внутренних мембран клетки относится к мембранам ЭР, поэтому было естественно ожидать присутствия рецепторов именно в ретикулуме. На это же указывали ранее полученные данные конфокальной микроскопии и сахарозных градиентов для рецепторов арабидопсиса [13–15], кукурузы [16], риса [17] и яблони [18]. По-видимому, оба рецептора присутствуют как в ЭР, так и в ПМ, с несколько более высоким удельным содержанием StHK4b в ЭР. Однако, поскольку внутренние мембраны (т.е. ЭР) в общем пуле микросом преобладают [32], то получается, что основная масса рецепторов цитокининов картофеля находится на мембранах ЭР (см. Приложение на сайте www.elibrary.ru).
Рис. 1.
Связывание меченого цитокинина [3Н]iP фракциями мембран табака N. benthamiana в результате экспрессии рецепторов цитокининов картофеля StHK2a и StHK4b. T, NS и SB обозначают тотальное, неспецифическое и специфическое связывание, соответственно; PM – плазматическая мембрана; IM – внутриклеточные мембраны. Вверху показано распределение специфических маркеров ПМ (H+-ATP-аза) и ЭР (BiP) в полученных фракциях мембран.
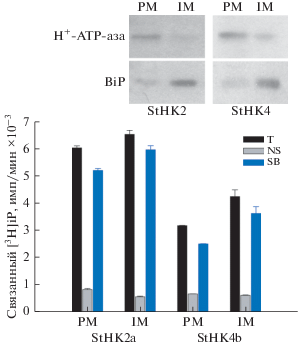
Следует отметить, что эктопическая экспрессия рецепторов при участии конститутивного промотора в принципе может приводить к артефактной избыточной локализации рецепторов в ЭР. Чтобы проверить эту возможность, мы провели аналогичное двухфазное разделение нативных мембран, выделенных из нетрансгенных зрелых растений тетраплоидного картофеля (сорт Жуковский ранний). Содержание рецепторов в полученных фракциях определяли количественно по связыванию меченого цитокинина [3H]iP. Специфическое связывание метки, характеризующее присутствие эндогенных рецепторов цитокининов, достоверно проявилось у микросом корней, но не листьев (рис. 2). Это качественно соответствовало данным о низком уровне специфического связывания цитокинина микросомами из листьев интактных растений табака ([10], данная работа) и кукурузы [16], причем в последнем случае наблюдалось высокое специфическое связывание меченого цитокинина мембранами корней, в отличие от листьев.
Рис. 2.
Связывание меченого цитокинина [3Н]iP фракциями мембран из корней и листьев зрелых растений картофеля. Обозначения те же, что на рис. 1.
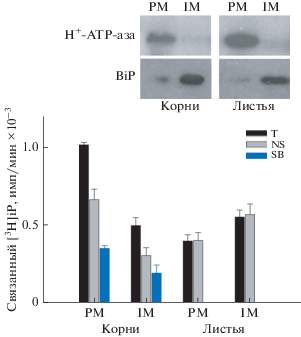
Результаты количественных определений связывания [3H]iP мембранами корней картофеля представлены на рис. 2. Из рисунка следует, что эндогенные рецепторы картофеля локализуются на мембранах обеих фракций, причем удельное связывание гормона фракцией ПМ в 1.8 раза выше, чем фракцией ЭР. Однако расчеты, сделанные с учетом степени гомогенности (чистоты) полученных фракций и соотношения их количеств, привели к выводу, что бóльшая часть рецепторов цитокининов в клетках корней картофеля все же находится в составе ЭР (см. Приложение на сайте www.elibrary.ru). Таким образом, данные на основе интактных корней картофеля качественно вполне соответствуют результатам, полученным при транзиентной экспрессии рецепторов картофеля в листьях табака.
Присутствие белка в том или ином компартменте клетки не означает, что он функционирует в этом же компартменте. Особенно это относится к ЭР, через который проходят практически все трансмембранные белки, направляемые затем в разные мембраны клетки. В работе [33] показано, что белок липаза липопротеинов действительно аккумулируется (на 95%) в ЭР и не проявляет там ферментативной активности. Эта липаза активируется лишь после секреции во внеклеточное пространство. В этой связи нельзя исключить того, что цитокининовые рецепторы активны только в составе ПМ, тогда как в составе ЭР они представляют собой некий резервный пул инертных белков.
В случае локализации рецептора на ПМ естественно ожидать, что сенсорный модуль рецептора находится вне клетки, тогда как каталитический и ресиверный (принимающий фосфат и передающий его на фосфотрансмиттер) модули – в цитозоле. Иная топология рецептора не позволит ему выполнять свои функции как инициатора сигналинга фитогормона. Для выполнения той же сигнальной функции в ЭР рецепторы должны быть ориентированы таким образом, чтобы сенсорный модуль выступал в люмен ЭР, а остальная часть рецептора пребывала в цитозоле. Именно такая топология рецептора цитокинина в ЭР была подтверждена экспериментально на примере АНК3 [15].
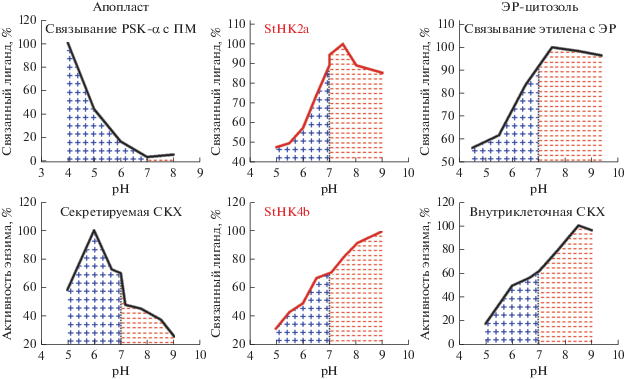
Таким образом, в зависимости от локализации рецептора его сенсорный модуль может находиться либо в кислом растворе апопласта, либо в слабощелочном содержимом ЭР. Рассматриваемые компартменты (ПМ и ЭР) сильно различаются по значениям pH омывающей среды. Поэтому для выбора компартмента функционирования рецепторов картофеля можно применить предложенный недавно pH-критерий [12]. В отличие от прямых методов, позволяющих выявлять физическое присутствие изучаемого белка в том или ином компартменте клетки, рН-критерий дает основание для выбора компартмента, где белок реально функционирует. Это следует из того установленного факта, что практически у всех белков pH-оптимум активности коррелирует с типичными диапазонами рН среды, в которой белок осуществляет свою функцию. Так, для апопласта максимальная активность белков приходится на значения рН в районе 4.5–6 (в основном 5.4 ± 0.5). Что касается белков, функционирующих внутри клетки (в частности, в ЭР), то здесь пик их активности приходится на рН в интервале 7–8 (в среднем 7.8 ± 0.8). Дополнительным критерием служит соотношение площадей под графиками pH-зависимостей (заштрихованы на рис. 3) в щелочной и в кислой областях рН на графиках рН-зависимости связывания. Это простой, но четкий и наглядный критерий, который ранее уже был применен к рецепторам цитокининов арабидопсиса и кукурузы [12]. Рисунок 3 показывает, что рецепторы картофеля не стали исключением и полностью отвечают критериям функционирования внутри клетки, в компартментах со слабощелочным рН. Для StHK2a максимум активности наблюдался при рН 7.5, а для StHK4b – при рН 9.0, причем в последнем случае пик активности, возможно, еще не был достигнут. Соотношение площадей под графиками pH-зависимостей также полностью соответствует белкам, функционирующим в слабощелочной среде, характерной для цитозоля, ядер и ЭР. На основе всех этих результатов можно заключить, что изучаемые рецепторы картофеля настроены на работу внутри клетки, точнее – в ЭР.
Рис. 3.
Кривые рН-зависимости активности белков: в левой колонке – примеры типичных белков, функционирующих в кислой среде апопласта; в правой колонке – типичных белков, функционирующих в слабощелочной среде внутри клетки. PSK-α – фитосульфокин-α, дисульфатированный пентапептид; ПМ – плазматическая мембрана; CKX – цитокининоксидаза/дегидрогеназа. Очевидно подобие кривых рН-зависимости активности изучаемых цитокининовых рецепторов картофеля (средняя колонка) аналогичным кривым правой колонки и явное несходство с ходом кривых левой колонки. Соотношение ограниченных кривой рН областей выше/ниже рН 7 на графиках смещено в сторону кислых рН (плюсы) у белков, функционирующих на ПМ и в апопласте, а у белков, функционирующих в ЭР, в том числе у испытуемых рецепторов, смещено, наоборот, в сторону щелочных рН (минусы). Обоснование рН-критерия дано в статье [12].
Еще одним pH-зависимым критерием может служить способность рецепторов образовывать совершенные димеры, которые, как полагают [34], необходимы для их нормального функционирования. Одна из областей димеризации расположена на сенсорном модуле рецептора. Эта область высококонсервативна, что позволяет паралогам рецепторов образовывать как гомо-, так и гетеродимеры [15]. Ранее с применением методов молекулярного моделирования нами были построены модели 3D-структур рецепторов картофеля [11], в том числе сенсорных модулей в форме мономеров и димеров. Здесь мы попытались оценить с помощью специализированных биоинформатических программ, как влияет рН среды на характеристики димеризационного интерфейса рецепторов.
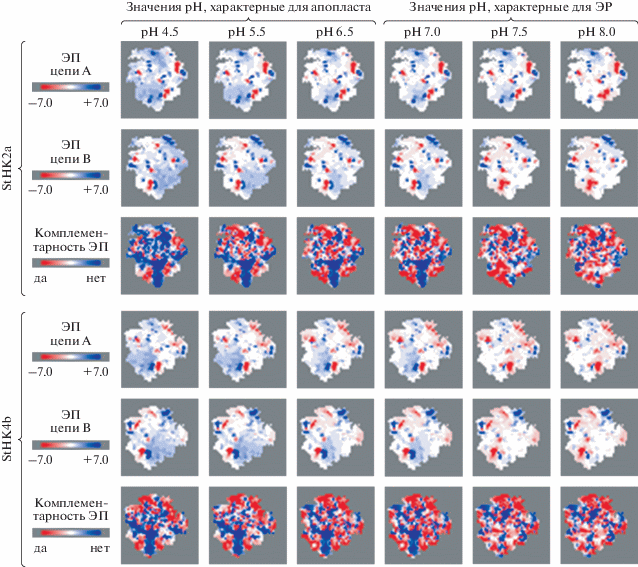
Расчеты, проведенные с помощью программы Molsurfer, показали, что электростатическая комплементарность поверхностей интерфейса сенсорных модулей рецепторов высока в растворах с рН выше 7 (что характерно для ЭР), но существенно уменьшается при закислении среды ниже рН 7 (что характерно для апопласта) (рис. 4). Степень комплементарности поверхностей интерфейса положительно коррелирует с прочностью образованных димеров, поэтому полученные результаты моделирования также свидетельствуют в пользу функционирования рецепторов цитокининов картофеля в форме димеров в составе ЭР. Эти результаты соответствуют аналогичным данным для рецептора АНК3 арабидопсиса [35].
Рис. 4.
Визуализация комплементарности взаимодействующих поверхностей сенсорных модулей гомодимеров рецепторов цитокининов картофеля, при имитации разных рН среды. ЭП – электростатический потенциал, определен для областей димеризации каждого из изучаемых рецепторов (ряды 1–2 и 4–5). Третий и шестой ряды демонстрируют зоны комплементарности, рассчитанные на основе сопоставления электростатических паттернов областей контакта гомодимеров рецептора. В этих рядах зоны электростатической комплементарности отмечены красным цветом, а некомплементарности – синим.
В целом, проведенное исследование с белками картофеля подтвердило наличие и возможность функционирования рецепторов цитокининов в составе ЭР. Хотя транзиентную экспрессию рецепторов проводили в листьях другого растения, а именно табака, тем не менее, среду нахождения экспрессируемых рецепторов нельзя считать чужеродной, так как табак является близким родственником картофеля (виды одного семейства пасленовых). Маловероятно, что транспортные системы клетки не справились со своевременной транспортировкой из ЭР рекомбинантного белка из-за его сверхвысокой продукции при временнóй трансфекции. При экспрессии в аналогичных условиях гомологичной гистидинкиназы АНК1 последняя успевала за считанные дни практически полностью встроиться в ПМ, место своей окончательной субклеточной локализации [13]. Опыты с фракционированием собственных мембран из корней картофеля полностью подтвердили присутствие цитокининовых рецепторов как в ПМ, так и в ЭР. Хотя плотность рецепторов в ПМ оказалась в 1.8 раза выше, чем в ЭР, бóльшая часть общего количества рецепторов в клетках, согласно расчетам (см. Приложение на сайте www.elibrary.ru), все же находилась в составе ЭР. Отсутствие специфического связывания цитокинина мембранами листьев можно объяснить не только низким уровнем экспрессии рецепторов, но и тем, что в листьях превалирует StHK3 [11], который, в отличие от других рецепторов, при выделении мембран может терять способность связывать лиганд.
Проведенные ранее исследования [12] свидетельствуют о том, что основной пул активных рецепторов находится внутри клетки, на мембранах ЭР. Это указывает на важность внутриклеточного пула цитокининов для осуществления сигналинга этих фитогормонов. Особая роль в сигналинге цитокининов может принадлежать рецепторам, расположенным в непосредственной близости к ядру клетки [12, 14, 15]. Однако данная закономерность вовсе не исключает наличия определенной части рецепторов и в составе других мембран клетки, в первую очередь в ПМ, откуда они также могут посылать сигналы внутрь клетки. В этой связи особую значимость приобретают системы транспорта, активации и метаболизации цитокининов, от которых может зависеть соотношение их активных форм в люменах ЭР и в апопласте.
Работа поддержана грантом Российского научного фонда, проект № 17-74-20 181.
Список литературы
Kieber J.J., Schaller G.E. 2014. Cytokinins. Arabidopsis Book. 12, e0168.
Lomin S.N., Krivosheev D.M., Steklov M.Y., Osolodkin D.I., Romanov G.A. 2012. Receptor properties and features of cytokinin signaling. Acta Naturae. 4 (3), 31–45.
Mähönen A.P., Bonke M., Kauppinen L., Riikonen M., Benfey P.N., Helariutta Y. 2000. A novel two-component hybrid molecule regulates vascular morphogenesis of the Arabidopsis root. Genes Dev. 14 (23), 2938–2943.
Романов Г.А. 2002. Рецепторы фитогормонов. Физиология растений. 49 (4), 615–625.
Kakimoto T. 2003. Perception and signal transduction of cytokinins. Annu Rev. Plant Biol. 54, 605–627.
Ferreira F.J., Kieber J.J. 2005. Cytokinin signaling. Curr. Opin. Plant Biol. 8 (5), 518–525.
Ueguchi C., Sato S., Kato T., Tabata S. 2001. The AHK4 gene involved in the cytokinin-signaling pathway as a direct receptor molecule in Arabidopsis thaliana. Plant Cell Physiol. 42 (7), 751–755.
Kim H.J., Ryu H., Hong S.H., Woo H.R., Lim P.O., Lee I.C., Sheen J., Nam H.G., Hwang I. 2006. Cytokinin-mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 in Arabidopsis. Proc. Natl. Acad. Sci. USA. 103 (3), 814–819.
Romanov G.A., Lomin S.N., Schmülling T. 2006. Biochemical characteristics and ligand-binding properties of Arabidopsis cytokinin receptor AHK3 compared to CRE1/AHK4 as revealed by a direct binding assay. J. Exp. Bot. 57 (15), 4051–4058.
Lomin S.N., Krivosheev D.M., Steklov M.Y., Arkhi-pov D.V., Osolodkin D.I., Schmülling T., Romanov G.A. 2015. Plant membrane assays with cytokinin receptors underpin the unique role of free cytokinin bases as biologically active ligands. J. Exp. Bot. 66 (7), 1851–1863.
Lomin S.N., Myakushina Y.A., Kolachevskaya O.O., Getman I.A., Arkhipov D.V., Savelieva E.M., Osolodkin D.I., Romanov G.A. 2018. Cytokinin perception in potato: New features of canonical players. J. Exp. Bot. 69 (16), 3839–3853.
Romanov G.A., Lomin S.N., Schmülling T. 2018. Cytokinin signaling: From the ER or from the PM? That is the question! New Phytol. 218 (1), 41–53.
Caesar K., Thamm A.M., Witthöft J., Elgass K., Huppenberger P., Grefen C., Horak J., Harter K. 2011. Evidence for the localization of the Arabidopsis cytokinin receptors AHK3 and AHK4 in the endoplasmic reticulum. J. Exp. Bot. 62 (15), 5571–5580.
Wulfetange K., Lomin S.N., Romanov G.A., Stolz A., Heyl A., Schmülling T. 2011. The cytokinin receptors of Arabidopsis are located mainly to the endoplasmic reticulum. Plant Physiol. 156 (4), 1808–1818.
Lomin S.N., Myakushina Y.A., Arkhipov D.V., Leonova O.G., Popenko V.I., Schmülling T., Romanov G.A. 2018. Studies of cytokinin receptor–phosphotransmitter interaction provide evidences for the initiation of cytokinin signalling in the endoplasmic reticulum. Func. Plant Biol. 45 (1–2), 192–202.
Lomin S.N., Yonekura-Sakakibara K., Romanov G.A., Sakakibara H. 2011. Ligand-binding properties and subcellular localization of maize cytokinin receptors. J. Exp. Bot. 62 (14), 5149–5159.
Ding W., Tong H., Zheng W., Ye J., Pan Z., Zhang B., Zhu S. 2017. Isolation, characterization and transcriptome analysis of a cytokinin receptor mutant OsCKT1 in rice. Front. Plant Sci. 8, 88.
Daudu D., Allion E., Liesecke F., Papon N., Courdavault V., Dugé de Bernonville T., Mélin C., Oudin A., Clastre M., Lanoue A., Courtois M., Pichon O., Giron D., Carpin S., Giglioli-Guivarc’h N., Crèche J., Besseau S., Glévarec G. 2017. CHASE-containing histidine kinase receptors in apple tree: From a common receptor structure to divergent cytokinin binding properties and specific functions. Front. Plant Sci. 8, 1614.
Zürcher E., Liu J., di Donato M., Geisler M., Müller B. 2016. Plant development regulated by cytokinin sinks. Science. 353 (6303), 1027–1030.
Karimi M., Bleys A., Vanderhaeghen R., Hilson P. 2007. Building blocks for plant gene assembly. Plant Physiol. 145 (4), 1183–1191.
Sparkes I.A., Runions J., Kearns A., Hawes C. 2006. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants. Nat. Protoc. 1 (4), 2019–2025.
Voinnet O., Rivas S., Mestre P., Baulcombe D. 2003. An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus. Plant J. 33 (5), 949–956.
Сидоров Г.В., Мясоедов Н.Ф., Ломин С.Н., Романов Г.А. 2015. Синтез меченного тритием и дейтерием изопентениладенина. Радиохимия. 57 (1), 94–96.
Sali A., Blundell T.L. 1993. Comparative protein modelling by satisfaction of spatial restraints. J. Mol. Biol. 234 (3), 779–815.
Hothorn M., Dabi T., Chory J. 2011. Structural basis for cytokinin recognition by Arabidopsis thaliana histidine kinase 4. Nat. Chem. Biol. 7 (11), 766–768.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. 2004. UCSF Chimera – a visualization system for exploratory research and analysis. J. Comput. Chem. 25 (13), 1605–1612.
Maier J.A., Martinez C., Kasavajhala K., Wickstrom L., Hauser K. E., Simmerling C. 2015. ff14SB: Improving the accuracy of protein side chain and backbone parameters from ff99SB. J. Chem. Theory Comput. 11 (8), 3696–3713.
Laskowski R.A., MacArthur M.W., Moss D.S., Thornton J.M. 1993. TI – PROCHECK: A program to check the stereochemical quality of protein structures. J. App. Cryst. 26 (2), 283–291.
Gabdoulline R.R., Wade R.C., Walther D. 2003. MolSurfer: A macromolecular interface navigator. Nucl. Acids Res. 31 (13), 3349–3351.
Dolinsky T.J., Nielsen J.E., McCammon J.A., Baker N.A. 2004. PDB2PQR: An automated pipeline for the setup of Poisson-Boltzmann electrostatics calculations. Nucl. Acids Res. 32, W665–W667.
Трофимова М.С., Шевырева Т.А., Жесткова И.М., Ломин С.Н. 2012. Получение плазмалеммы методом разделения микросомальных мембран в водной двухфазной полимерной системе. В сб. Молекулярно-генетические и биохимические методы в современной биологии растений. М.: БИНОМ, с. 456–466.
Morré D.J., Brightman A.O., Sandelius A.S. 1987. Membrane fractions from plant cells. In: Biological Membranes: A Practical Approach. Eds Findlay J.B.C., Evans W.H., Washington, DC: IRL Press, p. 37–68.
Scow R.O., Schultz C.J., Park J.W., Blanchette-Mackie E.J. 1998. Combined lipase deficiency (cld/cld) in mice affects differently post-translational processing of lipoprotein lipase, hepatic lipase and pancreatic lipase. Chem. Phys. Lipids. 93 (1–2), 149–155.
Wolanin P.M., Thomason P.A., Stock J.B. 2002. Histidine protein kinases: Key signal transducers outside the animal kingdom. Genome Biol. 3 (10), REVIEWS3013.
Arkhipov D.V., Lomin S.N., Myakushina Yu.A., Savelieva E.M., Osolodkin D.I., Romanov G.A. 2019. Modeling of protein-protein interactions in cytokinin signal transduction. Intern. J. Mol. Sciences, 20 (9), 2096.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


