Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 120-125
Влияние галоперидола и ципрогептадина на цитоскелет дробящихся зародышей морского ежа
Д. А. Никишин a, b, *, Л. А. Мальченко a, И. Милошевич c, Л. Ракич d, Ю. Б. Шмуклер a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова
119192 Москва, Россия
c Институт биологии моря
85330 Доброта, Черногория
d Сербская академия наук и искусств
11000 Белград, Сербия
* E-mail: denisnikishin@gmail.com
Поступила в редакцию 15.04.2019
После доработки 07.08.2019
Принята к публикации 15.08.2019
Аннотация
Ранние эмбрионы морских ежей обладают чувствительностью к агонистам и антагонистам рецепторов нейротрансмиттеров, как метабо-, так и ионотропных. В данной работе исследованы механизмы цитостатического действия ципрогептадина и галоперидола – антагонистов серотониновых 5HT2-рецепторов и дофаминовых D2-рецепторов соответственно – на модели блокады первого деления дробления морского ежа, позволяющей количественно оценить эффекты эмбриотоксических веществ. Эффект галоперидола и ципрогептадина опосредован влиянием на элементы цитоскелета. Оба антагониста вызывают увеличение степени полимеризации актинового цитоскелета, причем эффект наблюдается как в кортикальном слое, так и в цитоплазме. Кроме того, оба антагониста влияют на тубулиновый цитоскелет, причем если галоперидол преимущественно вызывает нарушения пространственной организации веретена деления, то ципрогепталин приводит к полной деполимеризации тубулина и прекращению митотических процессов. По всей вероятности, цитостатическое действие антагонистов дофамина и серотонина на дробящиеся зародыши морских ежей основано на сходных и/или пересекающихся молекулярных механизмах, которые требуют дальнейших исследований.
ВВЕДЕНИЕ
Серотонин и дофамин хорошо известны как классические донервные трансмиттеры, которые выполняют большое количество регуляторных функций в эмбриогенезе. Наличие функционально активных серотониновой и дофаминовой систем показано на ранних стадиях эмбрионального развития, задолго до появления первых нервных клеток, у широкого ряда видов [1]. Классическими объектами исследования донервных функций нейротрансмиттеров являются морские ежи, для ранних эмбрионов которых показана высокая чувствительность к нейрофармакологическим препаратам [2]. Описаны некоторые механизмы их действия, связанные с активностью сигнальных каскадов метаботропных и ионотропных рецепторов и влиянием на механизмы клеточного деления, межбластомерные взаимодействия, состояние цитоскелета и ресничную активность [1, 3]. Ранние эмбрионы морских ежей обладают чувствительностью к агонистам и антагонистам серотониновых, дофаминовых, адренергических рецепторов, причем эти эффекты являются специфическими, поскольку ослабляются или устраняются самими трансмиттерами или их агонистами [4]. Однако специфичность эффектов, опосредованных рецепторами, в данном случае необходимо оценивать с учетом того, что фармакологические свойства рецепторов морских ежей могут довольно существенно отличаться от таковых млекопитающих. Ранее нами показано, что на всех стадиях развития морского ежа Paracentrotus lividus от ооцита до плутеуса экспрессируется ген, гомологичный дофаминовому рецептору D2, а также несколько генов, аннотированных как гомологи серотониновых рецепторов [4]. Изучены некоторые компоненты сигнальных цепей донервных трансмиттеров в ранних эмбрионах морских ежей, в частности, показано, что эти механизмы включают аденилатциклазную систему и фосфатидил-инозитольный путь, включая изменение внутриклеточной концентрации свободных ионов кальция [5, 6]. Существуют данные, свидетельствующие о том, что различные элементы цитоскелета являются конечными звеньями этих сигнальных цепей [3, 7]. В данной работе исследовано влияние антагонистов серотониновых и дофаминовых рецепторов на состояние актинового и тубулинового цитоскелета на модели блокады первого деления дробления морского ежа [8], позволяющей количественно оценить эффекты эмбриотоксических веществ.
МАТЕРИАЛЫ И МЕТОДЫ
Работу с эмбрионами морского ежа Paracentrotus lividus (Lamarck, 1816), выловленными в заливе Траште Адриатического моря, проводили в Институте биологии моря (Доброта, Черногория). Содержание морских ежей, получение гамет и проведение искусственного оплодотворения проводили в соответствии со стандартными процедурами [9]. Через 5 мин после оплодотворения регистрировали отделение оболочки оплодотворения, в экспериментах использовали только качественный эмбриональный материал с процентом оплодотворения более 95%. Эксперименты на модели блокады первого деления дробления проводили согласно описанному ранее протоколу [8]. Действующие вещества – гидрохлорид галоперидола (0931 Tocris Bioscience, США), гидрохлорид ципрогептадина (C6022 Sigma Aldrich, США) – добавляли в необходимой концентрации через 10 мин после оплодотворения. Через 40 мин после оплодотворения производили фоторегистрацию с использованием инвертированного светового микроскопа Opton (Carl Zeiss, Германия) и цифровой окулярной насадки DCM130 (Scopetek, Китай), после чего на фотографиях, содержащих не менее 100 эмбрионов на группу, производили подсчет доли эмбрионов, завершивших деление дробления (% Clv). Для построения концентрационной зависимости проведено 8 экспериментов. Аппроксимацию экспериментальных данных и определение IC50 проводили в программе GraphPad Prism (GraphPad Software, Inc., США) с применением модели четырех-параметрической кривой зависимости эффекта от дозы (4PL):
Зародыши, полученные в результате воздействия минимальных блокирующих концентраций, были фиксированы 4% параформальдегидом при 4°C в течение 16 ч и хранились в PBS c 0.05% азидом натрия до последующего иммуноцитохимического анализа. Фибриллярный актин окрашивали фаллоидином, конъюгированным с Alexa Fluor 546 (A12380 Invitrogen, США), микротрубочки выявляли иммуноокрашиванием с использованием мышиных моноклональных антител против тубулина (T6793 Sigma-Aldrich, США) и козьих антител против мышиных иммуноглобулинов, конъюгированных с Alexa Fluor 488 (ab150113 Abcam, Великобритания), а ДНК окрашивали красителем Hoechst 33 342 (40 046 Biotium, США). Полученные препараты заключали в среду Fluoroshield (ab104135 Abcam, Великобритания) и просматривали на лазерном сканирующем конфокальном микроскопе Olympus FV10i (лаборатория конфокальной микроскопии ЦКП МГУ им. М.В. Ломоносова). Срединные оптические срезы, полученные при одинаковых параметрах интенсивности облучения и чувствительности детектора, использовали для анализа состояния выявленных компонентов цитоскелета с применением программного пакета Fiji [11]. Количественная оценка распределения фибриллярного актина вдоль радиальной оси бластомеров проводилась по всей окружности клетки с помощью плагина Clock Scan [12], каждый график построен по усредненным значениям, полученным на 10 эмбрионах. Статистическую обработку всех данных проводили в программе GraphPad Prism (GraphPad Software, Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
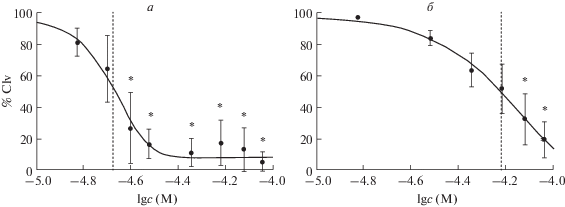
На модели блокады первого деления дробления морского ежа были проведены эксперименты, уточняющие зависимость эффектов галоперидола и ципрогептадина от концентрации, продемонстрированную в предыдущих работах [4]. На рис. 1 представлены графики зависимости эффекта от концентрации антагонистов в диапазоне от 10 до 100 мкМ, полученные с применением модели четырехпараметрической кривой зависимости эффекта от дозы [13]. Статистически значимый эффект антагониста D2-подобных рецепторов галоперидола проявляется при концентрации 25 мкМ и составляет в среднем 27.1% дробящихся зародышей. При этом, согласно модели, IC50 для галоперидола составляет 21.14 мкМ. Минимальная концентрация антагониста серотониновых рецепторов 2-го типа ципрогептадина, вызывающая статистически значимый эффект, составляет 75 мкМ (средний процент дробления 32.9%), тогда как IC50 равна 59.99 мкМ. Установленные минимальные действующие концентрации исследуемых антагонистов согласуются с ранее полученными данными [4] и были использованы в последующих экспериментах. Следует отметить, что чувствительность зародышей к антагонисту дофаминовых рецепторов галоперидолу оказалась почти в 3 раза выше, чем к антагонисту рецепторов серотонина ципрогептадину.
Рис. 1.
Концентрационная зависимость эффектов галоперидола (а) и ципрогептадина (б) на модели блока первого деления дробления морского ежа P. lividus. % Clv – доля эмбрионов, завершивших первое деление дробления. M ± SEM, * – p < 0.05 по критерию Данна. Пунктиром обозначена IC50.
Для выявления механизмов цитостатического воздействия антагонистов мембранных трансмиттерных рецепторов были проведены повторные эксперименты по воздействию минимальных блокирующих концентраций дофамина и ципрогептадина на дробящиеся зародыши с последующим иммуноцитохимическим исследованием состояния цитоскелета. Галоперидол в концентрации 25 мкМ вызывает блокаду делений дробления (рис. 2б). В таких зародышах наблюдается некоторое увеличение толщины кортикального актинового цитоскелета и появление в цитоплазме гранул полимеризованного актина (рис. 2л, 2о). Количественная оценка распределения актина по радиальной оси зародыша (рис. 3а) показала, что при воздействии галоперидола происходит достоверное увеличение количества фибриллярного актина как в составе цитокортекса (рис. 3в), так и в цитоплазме (рис. 3г). Наблюдаемый эффект согласуется с литературными данными о влиянии трансмиттеров на цитоскелет зародышей морских ежей, из которых следует, что дофамин и антагонисты серотониновых рецепторов уменьшают, а серотонин и антагонисты дофаминовых рецепторов увеличивают жесткость кортикального слоя зигот морских ежей [3, 7]. Эти факты свидетельствуют о негативном влиянии D2-подобного рецептора на полимеризацию актина и механические параметры цитокортекса, играющие важную роль в процессе дробления. При иммуногистохимическом окрашивании микротрубочек в зародышах, инкубированных в галоперидоле, выявляются значительные нарушения организации тубулинового цитоскелета – отсутствие периферических микротрубочек, асимметричное митотическое веретено (рис. 2з), а также нарушение расхождения хромосом, приводящее к появлению микроядер (рис. 2д). Полученные данные свидетельствуют о возможной роли D2‑подобного рецептора в поддержании правильной организации структур митотического веретена у дробящихся зародышей морского ежа.
Рис. 2.
Влияние галоперидола и ципрогептадина на цитоскелет дробящихся зародышей морского ежа P. lividus. Оптическая микроскопия (а–в), фазово-контрастная микроскопия, совмещенная с инвертированным флуоресцентным окрашиванием ДНК (г–е), иммунофлуоресценция тубулинового цитоскелета (ж–и), флуоресцентное мечение F-актина (к–п). Контроль (а, г, ж, к, н), галоперидол 25 мкМ (б, д, з, л, о), ципрогептадин 75 мкМ (в, е, и, м, п).
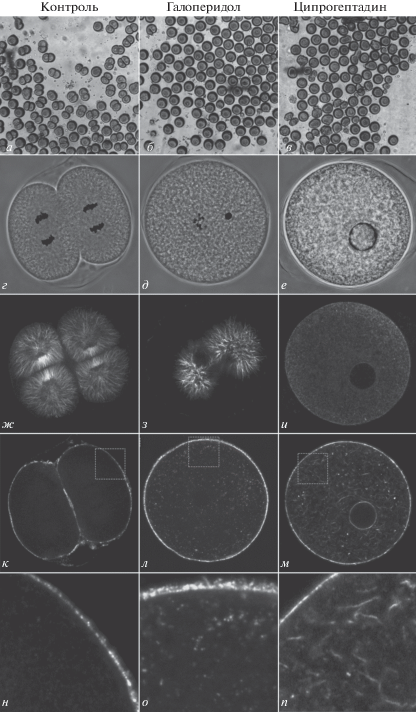
Рис. 3.
Количественный анализ эффектов галоперидола (25 мкМ) и ципрогептадина (75 мкМ) на цитоскелет дробящихся зародышей P. lividus. Изменение распределения фибриллярного актина вдоль радиальной оси зародышей, инкубированных в присутствии ципрогептадина (а) и галоперидола (б). Количественная оценка степени полимеризации актина в составе цитокортекса (в) и в цитоплазме (г). M ± SEM, * – p < 0.05 по критерию Манна–Уитни.
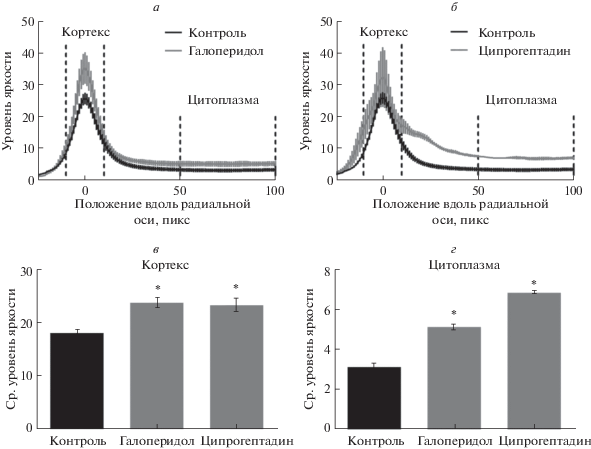
При воздействии ципрогептадина в концентрации 75 мкМ на зиготы морского ежа происходит блокада первого деления дробления (рис. 2в). В таких зародышах наблюдается появление в цитоплазме гранул и многочисленных хаотично ориентированных коротких актиновых филаментов (рис. 2м, 2п). Анализ распределения фибриллярного актина вдоль радиальной оси зародыша (рис. 3б) выявил достоверное увеличение степени полимеризации актина как в цитоплазме (рис. 3г), так и в кортикальном слое (рис. 3в). Общее содержание выявленного иммуногистохимически тубулина у интактных и обработанных ципрогептадином зародышей не отличается. В то же время тубулиновый цитоскелет в зародышах, инкубированных с ципрогептадином, полностью деполимеризован (рис. 2и). Кроме того, в зародышах отсутствуют признаки кариотомии (рис. 2е), что свидетельствует о критическом воздействии ципрогептадина на самые ранние фазы первого клеточного цикла.
Таким образом, получены данные, свидетельствующие о том, что цитостатический эффект антагонистов рецепторов дофамина и серотонина на дробящиеся зародыши морского ежа связан с влиянием на элементы цитоскелета. Оба антагониста вызывают увеличение степени полимеризации актинового цитоскелета, причем эффект наблюдается как в кортикальном слое, так и в цитоплазме. Кроме того, оба антагониста влияют на тубулиновый цитоскелет, причем если галоперидол преимущественно вызывает нарушения пространственной организации веретена деления, то ципрогептадин приводит к полной деполимеризации тубулина и прекращению митотических процессов.
Анализ концентрационной зависимости цитостатического эффекта антагонистов показал, что зародыши морского ежа почти в 3 раза более чувствительны к антагонисту D2 рецепторов галоперидолу, чем к антагонисту рецепторов серотонина 5HT2 ципрогептадину. В опубликованных ранее работах показано, что цитостатический эффект используемых веществ ослабляется в присутствии самих трансмиттеров, причем эффективность дофамина, серотонина и адреналина, а также их липофильных аналогов сопоставима [4]. В нашей работе мы не выявили эффектов самих трансмиттеров на деления дробления и состояние цитоскелета. При этом ципрогептадин и галоперидол влияют на состояние микрофиламентов сходным образом, что говорит о возможных перекрестных механизмах серотонин- и дофаминергических сигнальных путей в регуляции ранних стадий развития. Одним из вероятных ключевых звеньев в этих процессах является метаботропный рецептор, гомологичный D2-рецептору, экспрессия которого показана на ранних стадиях развития P. lividus начиная с зиготы [4]. Различное влияние галоперидола и ципрогептадина на состояние тубулинового цитоскелета, по всей вероятности, связано с различиями механизмов трансдукции сигнала, запускаемых D2-подобными и 5-HT2-подобными рецепторами. В первом случае при воздействии антагониста происходит активация cAMP-сигнального каскада. Известно, что галоперидол способен выступать в качестве дезорганизатора тубулинового цитоскелета, воздействуя на активность киназ PKA и Akt [14] и эффекторные белки Tau [15], Aurora A [16] и KSP/Eg5 [17]. В случае же ципрогептадина происходит блок PKC-сигнального каскада, также играющего важную роль в стабилизации как актинового, так и тубулинового цитоскелета [18]. По всей вероятности, цитостатическое действие антагонистов дофамина и серотонина на дробящиеся зародыши морских ежей основано на сходных и/или пересекающихся молекулярных механизмах, которые требуют дальнейших исследований.
Исследование выполнено Н.Д.А., М.Л.А. и Ш.Ю.Б. с использованием оборудования ЦКП Института биологии развития им. Н.К. Кольцова РАН при поддержке Российской академии наук и Сербской академии наук и искусств (совместная программа “Neurotransmitters – Ontogenetic and Neurobiological Aspects”) в рамках раздела Государственного задания ИБР РАН № 0108-2019-0003.
Список литературы
Бузников Г.А. 1987. Нейротрансмиттеры в эмбриогенезе. М.: Наука. 232 с.
Buznikov G.A., Nikitina L.A., Rakić L.M., Milosević I., Bezuglov V.V., Lauder J.M., Slotkin T.A. 2007. The sea urchin embryo, an invertebrate model for mammalian developmental neurotoxicity, reveals multiple neurotransmitter mechanisms for effects of chlorpyrifos: therapeutic interventions and a comparison with the monoamine depleter, reserpine. Brain Res. Bull. 74 (4), 221–231.
Бузников Г.А., Григорьев Н.К. 1990. Эффект биогенных моноаминов и их антагонистов на кортикальный цитоплазматический слой у ранних зародышей морских ежей. Журн. эвол. биохим. и физиол. 26, 614–622.
Nikishin D.A., Milošević I., Gojković M., Rakić L., Bezuglov V.V., Shmukler Y.B. 2016. Expression and functional activity of neurotransmitter system components in sea urchins’ early development. Zygote. 24, 206–218.
Buznikov G.A., Marshak T.L., Malchenko L.A., Nikitina L.A., Shmukler Yu.B., Buznikov A.G., Rakic Lj., Whitaker M.J. 1998. Serotonin and acetylcholine modulate the sensitivity of early sea urchin embryos to protein kinase C activators. Comp. Biochem. Physiol. 120A (2), 457–462.
Shmukler Yu.B., Buznikov G.A., Whitaker M.J. 1999. Action of serotonin antagonists on cytoplasmic calcium level in early embryos of sea urchin Lytechinus pictus. Int. J. Dev. Biol. 42 (3), 179–182.
Григорьев Н.Г. 1988. Кортикальный слой цитоплазмы – возможное место действия донервных трансмиттеров. Журн. эвол. биохим. и физиол. 24 (5), 625–629.
Григорьев Н.Г., Шмуклер Ю.Б. 1984. О роли ионных градиентов клеточной мембраны в раннем развитии зародышей морских ежей. Докл. АН СССР. 274 (2), 464–466.
Бузников Г.А., Подмарев В.И. 1975. Морские ежи Strongylocentrotus drobachiensis, S. nudus, S. intermedius. В кн.: Объекты биологии развития. Ред. Детлаф Т.А. М.: Наука, с. 188–216.
Bindslev N. 2017. Drug-Acceptor Interactions. London: CRC Press. 428 p.
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. 2012. Fiji: An open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676–682.
Dobretsov M., Petkau G., Hayar A., Petkau E. 2017. Clock scan protocol for image analysis: ImageJ plugins. J. Vis. Exp. (124), e55819.
Giraldo J., Vivas N.M., Vila E., Badia A. 2002. Assessing the (a)symmetry of concentration-effect curves: empirical versus mechanistic models. Pharmacol. Ther. 95 (1), 21–45.
Bowling H., Santini E. 2016. Unlocking the molecular mechanisms of antipsychotics – a new frontier for discovery. Swiss Med. Wkly. 146, w14314.
Liu X., Shi Y., Woods K.W., Hessler P., Kroeger P., Wilsbacher J., Wang J., Wang J.Y., Li C., Li Q., Rosenberg S.H., Giranda V.L., Luo Y. 2008. Akt inhibitor a-443654 interferes with mitotic progression by regulating Aurora A kinase expression. Neoplasia. 10 (8), 828–837.
Benítez-King G., Ortíz-López L., Jiménez-Rubio G., Ramírez-Rodríguez G. 2010. Haloperidol causes cytoskeletal collapse in N1E-115 cells through tau hyperphosphorylation induced by oxidative stress: Implications for neurodevelopment. Eur. J. Pharmacol. 644 (1–3), 24–31.
Lee M.S., Johansen L., Zhang Y., Wilson A., Keegan M., Avery W., Elliott P., Borisy A.A., Keith C.T. 2007. The novel combination of chlorpromazine and pentamidine exerts synergistic antiproliferative effects through dual mitotic action. Cancer Res. 67 (23), 11 359–11 367.
Callender J.A., Newton A.C. 2017. Conventional protein kinase C in the brain: 40 years later. Neuronal Signal. (1), NS20160005.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


