Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 126-133
Динамика содержания в мышечных ядрах транскрипционных регуляторов экспрессии медленной изоформы миозина в камбаловидной мышце крыс на фоне гравитационной разгрузки
И. И. Парамонова a, *, К. А. Шарло a, Н. А. Вильчинская a, Б. С. Шенкман a
a Государственный научный центр Российской Федерации –
Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: inna199221@gmail.com
Поступила в редакцию 15.04.2019
После доработки 09.07.2019
Принята к публикации 18.08.2019
Аннотация
В условиях гравитационной разгрузки наблюдается сдвиг миозинового фенотипа мышц в быструю сторону. Причиной таких изменений является снижение экспрессии гена, кодирующего тяжелые цепи миозина (MyHC) медленного типа, и увеличение экспрессии генов, кодирующих MyHC быстрых типов. Известно, что такие сигнальные каскады, как кальцинейрин/NFAT и HDAC4/MEF-2D способны регулировать экспрессию гена MyHC I. В литературе практически отсутствуют данные о содержании транскрипционных факторов NFATc1 и MEF-2D, участвующих в регуляции экспрессии гена MyHC I, а также гистондеацетилазы HDAC4 и MAP-киназы ERK2 в камбаловидной мышце крыс при действии гравитационной разгрузки. Цель данного исследования заключалась в изучении вклада различных механизмов контроля экспрессии MyHC I типа на каждом этапе гравитационной разгрузки. Было обнаружено достоверное снижение уровня белков MEF-2D и ERK2 на 3 и 7 сут разгрузки, снижение NFATc1 на 1 и 7 сут в ядерной фракции. Однако содержание NFATc1, HDAC4, MEF-2D и ERK2 в ядерной фракции после 14 сут гравитационной разгрузки соответствует контрольному уровню. На основании этих данных можно сделать вывод, что содержание транскрипционных регуляторов в мышечных ядрах на поздней стадии гравитационной разгрузки не является лимитирующим фактором для поддержания их транскрипционной активности.
ВВЕДЕНИЕ
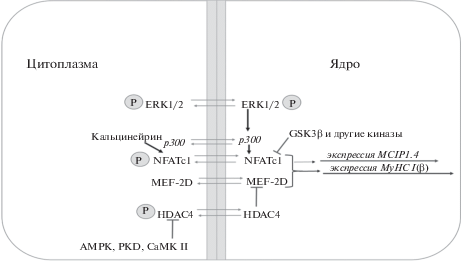
Для скелетных мышц, как на уровне целого органа, так и для отдельных волокон, ключевой характеристикой является миозиновый фенотип, т.е. соотношение экспрессируемых быстрых и медленных изоформ тяжелых цепей миозина (MyHC). Миозиновый фенотип определяет основные функциональные, прежде всего, сократительные характеристики данного волокна и целой мышцы. При действии гравитационной разгрузки наблюдается уменьшение доли волокон, экспрессирующих “медленную” изоформу тяжелых цепей миозина (MyHC I типа), и увеличение доли волокон, экспрессирующих “быстрые” изоформы, т.е. сдвиг миозинового фенотипа в быструю сторону [1, 2]. Многочисленные исследования свидетельствуют о том, что в регуляции экспрессии MyHC I типа принимают участие как минимум два сигнальных пути: кальцинейрин/NFATc1 и MEF-2D/HDAC4, оба эти пути взаимодействуют с транскрипционным фактором MEF-2D (рис. 1) [3]. Кальцинейрин является серин-треониновой фосфатазой. При взаимодействии с комплексом кальций-кальмодулин он активируется и дефосфорилирует NFATс1 (ядерный фактор активированных Т-клеток), который получает возможность проникновения в миоядра [4]. В ядре NFATс1 непосредственно взаимодействует с MEF-2D и p300, транскрипционными факторами, специфически связывающими промотор гена медленной MyHC [5]. Таким образом запускается интенсивная транскрипция гена “медленной” MyHC. Известно, что NFATc1 крайне важен для кальций-зависимой активации экспрессии MyHC I типа во время трансформации миозинового фенотипа. Недавно было показано, что митоген-активируемая киназа ERK1/2 активирует экспрессию MyHC I типа через ядерный NFATc1 [6]. Интересно что, ERK1/2 не влияет на субклеточную локализацию NFATc1, но оказывает активирующее влияние на промоторную активность MyHC I типа через ядерный NFATc1. ERK1/2 может фосфорилировать транскрипционный фактор p300, тем самым увеличивая связывание NFATc1 с ДНК в промоторе гена MyHC I типа. Активация промотора MyHC I типа с помощью p300 реализуется через ацетилирование двух консервативных сайтов в молекуле NFATc1, которые влияют на связывание с ДНК и стимуляцию транскрипции.
Транскрипционный фактор MEF-2 (фактор энхансер миоцитов 2) принадлежит к семейству транскрипционных факторов MADS-box и имеет четыре изоформы: A, B, C и D. Дефосфорилирование MEF-2A и -2D кальцинейрином было описано в исследованиях in vivo [7, 8]. Гистондеацетилаза 4 (HDAC4) подавляет экспрессию мышечных генов посредством прямого связывания и ингибирования активности MEF2. Гистондеацетилазы подразделяют на три основных класса: I, II и III. Известно, что HDAC класса IIa (HDAC4, 5, 7 и 9) в основном осуществляют регуляцию генов скелетных и сердечной мышц. В неактивном состоянии HDAC класса IIa дефосфорилированы и локализованы в ядрах, где взаимодействуют с различными транскрипционными факторами и подавляют экспрессию генов. Фосфорилирование HDAC приводит к их переходу из ядра в цитоплазму и к активации экспрессии генов. Фосфорилирование гистондеацетилаз класса IIa осуществляют CaMKII, РКD и AMPK [9]. В миоядрах HDAC4 деацетилирует не только гистон Н3, но и транскрипционный фактор MEF-2D, взаимодействующий с промотором гена myh7 (т.е. гена MyHC I типа) [10]. Это приводит к снижению как общей транскрипционной активности генома, так и экспрессии MyHC I типа. В настоящее время мало известно о молекулярных механизмах трансформации миозинового фенотипа в быструю сторону при гравитационной разгрузке. Цель нашего эксперимента заключалась в исследовании динамики ядерного содержания NFATc1, MEF-2D, гистондеацетилазы HDAC4 и MAP-киназы ERK2 с целью определения относительного вклада различных механизмов контроля экспрессии MyHC I типа на каждом этапе гравитационной разгрузки.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве модели гравитационной разгрузки было проведено 1-, 3-, 7- и 14-суточное антиортостатическое вывешивание задних конечностей крыс по методике Ильина–Новикова в модификации Морри-Холтон [11]. Для проведения этого эксперимента крысы линии Вистар (56 самцов массой 180–200 г) были случайным образом распределены на восемь групп по восемь животных в каждой: вывешивание в течение 24 ч (Hs), 3-суточное вывешивание (3Hs), 7-суточное вывешивание (7Hs), 14-суточное вывешивание (14Hs). Каждой вывешенной группе соответствовала группа виварного контроля (С, четыре группы по восемь животных в каждой); животных из контрольных групп и из соответствующих им вывешенных групп эвтанизировали в тот же день. После проведения эксперимента у каждого животного под авеpтиновым наркозом из обеих ног была выделена камбаловидная мышца m. soleus и заморожена в жидком азоте, после чего животные были эвтаназированы сверхдозой авертина. Все процедуры с животными были одобрены Комиссией по биомедицинской этике ГНЦ PФ–ИМБП PАН.
Содержание фосфорилированной (Y204) и тотальной ERK2, NFATc1, HDAC4 и MEF2-D определяли с использованием гель-электpофоpеза и иммуноблотинга. Для этого выделяли белок из мышечной ткани m. soleus крысы с помощью набора реагентов для выделения ядерной и цитоплазматической фракции белков NE-PER Nuclear and Cytoplasmic Extraction (Thermo Scientific, CША). Электрофорез проводили в 10% разделяющем полиакриламидном геле (ПААГ). Использовали трис-глициновый буфер (192 мМ Tris-глицин (pH 8.6), 0.1% додецилсульфата Na (SDS)). Электроперенос белков проводили в буфере (25 мМ Tris (pH 8.3), 192 мМ глицин, 20% этанол, 0.02% SDS) на нитроцеллюлозную мембрану при 100 В при температуре 4°C в системе mini Trans-Blot (Bio-Rad Laboratories) в течение 120 мин. Далее нитроцеллюлозные мембраны блокировали в растворе 5% сухого молока (Bio-Rad Laboratories) в PBST (PBS + 0.1% Tween 20) в течение 1 ч при комнатной температуре. После чего инкубировали с первичными антителами в течение 12 ч. Далее мембрану отмывали от первичных антител в PBST (3 раза по 5 мин). Инкубацию с вторичными антителами проводили в течение 1 ч. Для определения белковых полос использовали первичные поликлональные антитела против фосфо-ERK2 (Y204) в разведении 1 : 500 (Cell Signaling, CША, #9102), против тотальной HDAC4 в разведении 1 : 500 (Cell Signaling, CША, #2072); против тотальной MEF-2D в разведении 1 : 1000 (Abcam, США, #32845), против NFATc1 в разведении 1 : 1000 (Abcam, ab2796, США), против Lamin B1 в разведении 1 : 500 (Abcam, США, #16 048), вторичные антитела goat-anti-rabbit в разведении 1 : 30 000 (Jackson Immuno Research, США). Оптическая плотность полос белка была нормирована по pефеpенcному белку Lamin B1. Белковые полосы анализировали с использованием C-DiGit Blot Scanner (LI–COR Biotechnology, США). Фосфорилированные формы белков определяли, нормируя на тотальное содержание белков, оцененное на той же мембране, что и целевой белок после проведения стриппирования с использованием restore western blot stripping buffer (Thermo Scientific, CША). Для определения количества каждого анализируемого белка вестерн-блотинг был повторен не менее 3 раз.
Для определения статистической значимости результатов использовали непаpаметpичеcкий кpитеpий Манна–Уитни. Результаты приведены в процентах от медианы контрольной группы в виде максимума, минимума, медианы и интеpкваpтильной широты (0.25–0.75).
РЕЗУЛЬТАТЫ
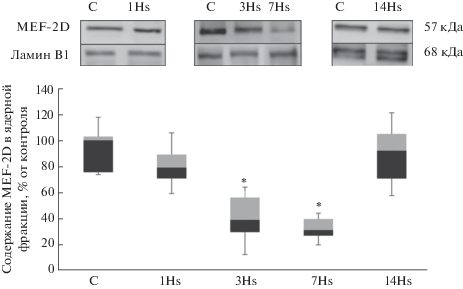
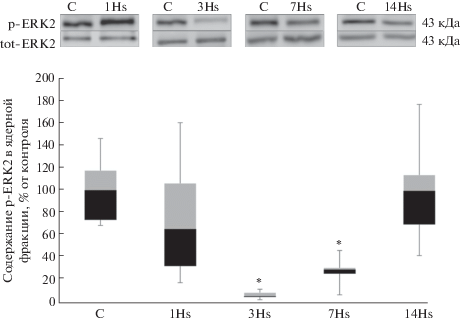
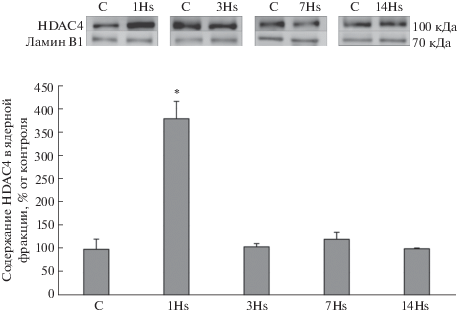
После первых суток вывешивания мы обнаружили достоверное снижение содержания в ядерной фракции транскрипционного фактора NFATc1 на 49% относительно группы контроля, однако на 3-и сут содержание NFATc1 составляло 71% от группы контроля и не имело достоверных отличий от контроля (рис. 2). После 7 сут гравитационной разгрузки содержание NFATc1 в ядерной фракции было достоверно снижено на 53% относительно контрольной группы (рис. 2). После 14 сут вывешивания содержание NFATc1 в ядерной фракции не отличалось от контроля (рис. 2). В результате 1-суточного вывешивания наблюдалось достоверное увеличение содержания HDAC4 на 243% в ядерной фракции белков относительно контрольной группы (рис. 3), однако после 3-, 7- и 14-суточного вывешиваний достоверных изменений не обнаружено (рис. 3). После 1-суточного вывешивания содержание MEF-2D в ядерной фракции было снижено на 20% в сравнении с контролем, однако эти отличия не были достоверными. После 3-суточного вывешивания выявлено достоверное снижение содержания МEF-2D на 60% в ядерной фракции по сравнению с группой контроля (рис. 4). После 7-суточного вывешивания обнаружено достоверное снижение содержания МEF-2D на 69% в ядерной фракции относительно группы контроля (рис. 4). После 14 сут вывешивания содержание MEF-2D в ядерной фракции не отличалось от контроля (рис. 4). После 3-суточного вывешивания выявлено достоверное снижение содержания фосфо-ERK 2 на 96% в ядерной фракции по сравнению с группой контроля (рис. 5). После 7-суточного вывешивания обнаружено достоверное снижение содержания фосфо-ERK 2 на 72% в ядерной фракции относительно группы контроля (рис. 5). После 1 и 14 сут вывешивания в содержании фосфо-ERK2 в ядерной фракции достоверных отличий не обнаружено (рис. 5).
Рис. 2.
Динамика содержания NFATc1 в ядерной фракции белков m. soleus крысы в условиях моделируемой гравитационной разгрузки. Здесь и на рис. 3, 4, 5 С – контроль, 1Hs – вывешивание 1-е сут, 3Hs – вывешивание 3 сут, 7Hs – вывешивание 7 сут, 14Hs – вывешивание 14 сут. * – достоверные отличия от группы “Контроль” (р < 0.05).
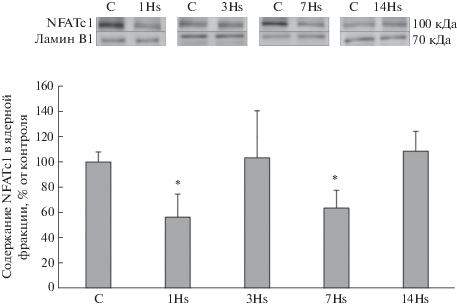
Рис. 3.
Динамика содержания HDAC4 в ядерной фракции белков m. soleus крысы в условиях моделируемой гравитационной разгрузки.
ОБСУЖДЕНИЕ
Механизмы сдвига миозинового фенотипа в быструю сторону остаются в значительной степени неизученными, но за последние годы нашему коллективу удалось несколько продвинуться в понимании физиологической регуляции экспрессии мРНК медленной и быстрых изоформ MyHC крысы при использовании стандартной модели антиортостатического вывешивания животного. Было показано, что уже на 1 сут гравитационной разгрузки наблюдается снижение экспрессии мРНК медленной изоформы тяжелых цепей миозина в камбаловидной мышце крыс [12]. Также нами было выявлено значимое снижение содержания мРНК MyHC I типа на 7 сут вывешивания, некоторая тенденция к снижению на 3 сут и существенное снижение содержания мРНК MyHC I типа на 14-е сут вывешивания в камбаловидной мышце крыс [13, 14].
Уже после первых суток вывешивания мы обнаружили достоверное снижение содержания в ядерной фракции транскрипционного фактора NFATc1 относительно группы контроля (рис. 4). Мы предполагаем, что этот феномен может быть связан со снижением уровня фосфорилирования и соответствующей активацией GSK-3β, активность которой приводит к фосфорилированию NFAT и его удалению из ядра [15]. Известно, что транспорт NFATc1 в мышечные ядра является кальций-зависимым, и после второго дня гравитационной разгрузки в миоплазме камбаловидной мышцы повышается концентрация кальция [16]. Мы предполагаем, что повышение содержания NFATc1 в ядерной фракции после 3 сут вывешивания может быть обусловлено кальций-зависимой реактивацией системы кальцинейрин/NFATc1, при этом к 7 сут вывешивания данный эффект подавляется из-за роста экспрессии эндогенного ингибитора кальцинейрина кальсарцина-2 при сохраняющейся повышенной активности GSK-3β [15]. Данные о снижении содержания NFATc1 после 7 сут вывешивания согласуются с ранее полученными в нашей лаборатории данными [17]. Данные по отсутствию снижения NFATc1 в ядерной фракции после 14 сут вывешивания согласуются с данными, ранее полученными в 2002 [18] и 2016 годах [19]. Причины повышения содержания NFATc1 в мышечных ядрах к 14-м сут вывешивания пока не очень ясны. Возможно, некоторую роль в этом процессе играет возвращение уровня фосфорилирования GSK-3β к уровню контроля на данном сроке вывешивания [15, 20, 21].
Второй, эпигеномный, механизм, контролирующий экспрессию MyHC I типа, реализуется через ядерную транслокацию HDAC4 и ингибирующее деацетилирование MEF-2D [22]. После 1 сут вывешивания мы обнаружили, что содержание HDAC4 в ядерной фракции камбаловидной мышцы крыс достоверно и значительно увеличилось относительно контроля, однако после 3, 7 и 14 сут вывешивания содержание HDAC4 в ядерной фракции не отличалось от контроля (рис. 2). Ранее было показано, что в медленном типе мышечных волокон HDAC4 преимущественно локализуется в цитоплазме, а в быстром типе волокон – в мышечных ядрах [23]. Мы предполагаем, что накопление HDAC4 в ядерной фракции позволяет деацетилировать гистон H3 и транскрипционный фактор MEF2D, контролирующий промоторную активность гена myh7. В результате снижается экспрессия мРНК MyHC I типа. Ранее в нашей лаборатории было показано, что накопление HDAC4 в миоядрах, обусловленное дефосфорилированием AMP-активируемой протеинкиназы (AMPK), сопровождается снижением интенсивности экспрессии гена myh7 [24, 25]. Эти данные хорошо согласуются с результатами эксперимента зарубежных коллег, где было показано, что один из возможных механизмов воздействия AMPK на экспрессию генов медленного миозина и ферментов окислительного метаболизма связывают с фосфорилированием/дефосфорилированием гистондеацетилазы 4 [26]. Мы предполагаем, что локализация MEF-2D в миоядрах в норме может обеспечиваться активностью кальцинейрина, так как показана кальцинейрин-зависимая транслокация в ядро близкого гомолога MEF-2D, MEF-2C [27]. В настоящем исследовании после 3 сут вывешивания содержание MEF-2D в ядерной фракции достоверно снизилось и после 7 сут вывешивания оставалось сниженным в сравнении с контролем (рис. 3). Обращает на себя внимание тот факт, что содержание MEF-2D в миоядрах снижается после 3 сут разгрузки, когда ядерное содержание HDAC4 повышается до уровня контроля. Сейчас мы не можем судить о причинах экспорта MEF-2D из ядерного пространства, однако этот феномен, очевидно, может сказываться на интенсивности транскрипции гена myh7.
Meissner и соавт. [6] в 2011 году обнаружили, что фосфорилированные молекулы митоген-активируемой протеинкиназы ERK1/2 транслоцируются в ядерное пространство и фосфорилируют гистоацетилтрансферазу p300, ассоциированную с промотором гена myh7. Следствием этого взаимодействия является ацетилирование NFATc1, активирующее транскрипцию этого гена [6].
По нашим данным, после 3 сут вывешивания фосфорилированный ЕRK2 почти не обнаруживался в ядерной фракции. После 7 сут воздействия его содержание в ядерном пространстве оставалось значительно ниже контрольного уровня. Не исключено, что снижение ядерного содержания ERK1/2 является еще одним механизмом, ингибирующим экспрессию медленной изоформы MyHC в условиях разгрузки.
Обращает на себя внимание тот факт, что содержание NFATc1, HDAC4, MEF-2D и ERK2 в ядерной фракции после 14 сут гравитационной разгрузки соответствует контрольному уровню. На этом временном отрезке (вторая неделя вывешивания) продолжается снижение содержания мРНК MyHC I типа [14]. Этот феномен свидетельствует о том, что не всегда транскрипционная активность соответствует содержанию транскрипционного регулятора в ядерном пространстве. Не исключено, что на некоторых этапах гравитационной разгрузки существуют функционально-зависимые сайт-специфичные механизмы контроля экспрессии медленного миозина. Эти механизмы еще предстоит исследовать.
Однако сейчас можно с уверенностью утверждать, что на разных этапах гравитационной разгрузки снижение экспрессии медленного миозина может быть обусловлено действием разных физиологических сигнальных входов и различных транскрипционных регуляторов.
Работа поддержана грантом РНФ 18-15-00107.
Список литературы
Kandarian S.C., Stevenson E.J. 2002. Molecular events in skeletal muscle during disuse atrophy. Exerc. Sport Sci. Rev. 30, 111–116.
Шенкман Б.С. 2016. От медленных к быстрым. Гипогравитационная перестройка миозинового фенотипа мышечных волокон. Acta Naturae. 8 4(31), 52–64.
Shen T., Liu Y., Randall W.R., Schneider M.F. 2006. Parallel mechanisms for resting nucleo-cytoplasmic shuttling and activity dependent translocation provide dual control of transcriptional regulators HDAC and NFAT in skeletal muscle fiber type plasticity. J. Muscle Res. Cell Motil. 27, 405–411.
Chin E.R., Olson E.N., Richardson J.A., Yang Q., Humphries C., Shelton J.M., Wu H., Zhu W., Bassel-Duby R., Williams R.S. 1998. A calcineurin-dependent transcriptional pathway controls skeletal muscle fiber type. Genes Dev. 12, 2499–2509.
Meissner J.D., Umeda P.K., Chang K.C., Gros G., Scheibe R.J. 2007. Activation of the beta myosin heavy chain promoter by MEF-2D, MyoD, p300, and the calcineurin/NFATc1 pathway. J. Cell. Physiol. 211, 138–148.
Meissner J.D., Freund R., Krone D., Umeda P.K., Chang K.C., Gros G., Scheibe R.J. 2011. Extracellular signal-regulated kinase 1/2-mediated phosphorylation of p300 enhances myosin heavy chain I/beta gene expression via acetylation of nuclear factor of activated T cells c1. Nucleic Acids Res. 39, 5907–5925.
Dunn S.E., Simard A.R., Bassel-Duby R., Williams R.S., Michel R.N. 2001. Nerve activity-dependent modulation of calcineurin signaling in adult fast and slow skeletal muscle fibers. J. Biol. Chem. 276, 45243–45254.
Wu H., Rothermel B., Kanatous S., Rosenberg P., Naya F.J., Shelton J.M., Hutcheson K.A., DiMaio J.M., Olson E.N., Bassel-Duby R., Williams R.S. 2001. Activation of MEF2 by muscle activity is mediated through a calcineurin-dependent pathway. EMBO J. 20, 6414–6423.
McGee S.L., Swinton C., Morrison S., Gaur V., Campbell D.E., Jorgensen S.B., Kemp B.E., Baar K., Steinberg G.R., Hargreaves M. 2014. Compensatory regulation of HDAC5 in muscle maintains metabolic adaptive responses and metabolism in response to energetic stress. FASEB J. 28, 3384–3395.
Liu Y., Randall W.R., Schneider M.F. 2005. Activity-dependent and -independent nuclear fluxes of HDAC4 mediated by different kinases in adult skeletal muscle. J. Cell Biol. 168, 887–897.
Morey-Holton E.R.,Globus R.K. 2002. Hindlimb unloading rodent model: Technical aspects. J. Appl. Physiol. 92, 1367–1377.
Giger J.M., Bodell P.W., Zeng M., Baldwin K.M., Haddad F. 2009. Rapid muscle atrophy response to unloading: Pretranslational processes involving MHC and actin. J. Appl. Physiol. 107, 1204–1212.
Красный А.М., Лысенко Е.А., Козловская И.Б., Шенкман Б.С., Ломоносова Ю.Н. 2013. Фосфорилирование элонгационного фактора и экспрессия его киназы в m. soleus крысы в течение трех суток гравитационной разгрузки. Докл. АН. 453, 106–108.
Lomonosova Y.N., Turtikova O.V., Shenkman B.S. 2016. Reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway. J. Muscle Res. Cell Motil. 37, 7–16.
Mirzoev T., Tyganov S., Vilchinskaya N., Lomonosova Y., Shenkman B. 2016. Key markers of mTORC1-dependent and mTORC1-independent signaling pathways regulating protein synthesis in rat soleus muscle during early stages of hindlimb unloading. Cell. Physiol. Biochem. 39, 1011–1020.
Ingalls C.P., Wenke J.C., Armstrong R.B. 2001. Time course changes in [Ca2+]i, force, and protein content in hindlimb-suspended mouse soleus muscles. Aviat. Space Environ. Med. 72, 471–476.
Шарло К.А., Ломоносова Ю.Н., Туртикова О.В., Митрофанова О.В., Каламкаров Г.Р., Бугрова А.Е., Шевченко Т.Ф., Шенкман Б.С. 2017.Роль фосфорилирования GSK-3β в процессах регуляции экспрессии медленного миозина в m. soleus при функциональной разгрузке. Биол. мембраны. 34 (6). 164–171.
Dupont-Versteegden E.E., Knox M., Gurley C.M., Houle J.D., Peterson C.A. 2002. Maintenance of muscle mass is not dependent on the calcineurin-NFAT pathway. Am. J. Physiol. 282, C1387–1395.
Xia L., Cheung K.K., Yeung S.S., Yeung E.W. 2016. The involvement of transient receptor potential canonical type 1 in skeletal muscle regrowth after unloading-induced atrophy. J. Physiol. 594 (11), 3111–3126.
van der Velden J.L., Langen R.C., Kelders M.C., Willems J., Wouters E.F., Janssen-Heininge, Y.M., Schols A.M. 2007. Myogenic differentiation during regrowth of atrophied skeletal muscle is associated with inactivation of GSK-3beta. Am. J. Physiol. 292, C1636–1644.
Мирзоев Т.М., Тыганов С.А., Петрова И.О., Шенкман Б.С. 2017. Сигнальные пути регуляции синтеза белка в постуральной мышце крысы в период реадаптации после функциональной разгрузки. Авиакосмическая и экологическая медицина. 51 (7), 99–105.
Miska E.A., Karlsson C., Langley E., Nielsen S.J., Pines J., Kouzarides T. 1999. HDAC4 deacetylase associates with and represses the MEF2 transcription factor. EMBO J. 18, 5099–5107.
Cohen T.J., Choi M.C., Kapur M., Lira V.A., Yan Z., Yao T.P. 2015. HDAC4 regulates muscle fiber type-specific gene expression programs. Mol. Cells. 38, 343–348.
Vilchinskaya N.A., Mochalova E.P., Nemirovskaya T.L., Mirzoev T.M., Turtikova O.V., Shenkman B.S. 2017. Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J. Physiol. 595, 7123–7134.
Вильчинcкая Н.А., Мочалова Е.П., Белова C.П., Шенкман Б.С. 2016. Дефоcфоpилиpование амф-активиpуемой пpотеинкиназы в поcтуpальной мышце – ключевое cигнальное cобытие пеpвыx cуток функциональной pазгpузки. Биофизика. 61, 1228–1235.
Yoshihara T., Machida S., Kurosaka Y., Kakigi, R., Sugiura T., Naito H. 2016. Immobilization induces nuclear accumulation of HDAC4 in rat skeletal muscle. J. Physiol. Sci. 66, 337–343.
Lynch J., Guo L., Gelebart P., Chilibeck K., Xu J., Molkentin J.D., Agellon L.B., Michalak M. 2005. Calreticulin signals upstream of calcineurin and MEF2C in a critical Ca2+-dependent signaling cascade. J. Cell Biol. 170, 37–47.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии