Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 134-148
Влияние умеренной гипотермии на фосфолипидный и жирнокислотный состав мембран эритроцитов крыс
З. Г. Раджабова b, С. А. Забелинский a, *, М. А. Чеботарева a, Е. П. Шуколюкова a, Н. К. Кличханов b, А. И. Кривченко a
a Институт эволюционной физиологии и биохимии
им. И.М. Сеченова
194223 Санкт-Петербург, Россия
b Дагестанский государственный университет
367000 Республика Дагестан, Махачкала, Россия
* E-mail: stas@iephb.ru
Поступила в редакцию 22.04.2019
После доработки 24.05.2019
Принята к публикации 27.05.2019
Аннотация
Изучено влияние умеренной гипотермии (30°С) различной длительности на фосфолипидный и жирнокислотный состав мембран эритроцитов крыс. Установлено, что содержание фосфатидилхолина и сфингомиелина почти не зависит от длительности гипотермии, хотя содержание фосфолипидов (ФЛ) внутреннего слоя мембраны изменяется, и особенно значительно – содержание фосфатидилсерина и монофосфоинозитида. В общих ФЛ эритроцитов кратковременная гипотермия не приводит к существенному изменению содержания насыщенных (НЖК), моноеновых (МНЖК), полиненасыщенных жирных кислот (ПНЖК) и индекса ненасыщенности (ИН), которое наблюдается при длительной гипотермии – увеличение НЖК и МНЖК и уменьшение ПНЖК и ИН. Длительность гипотермии не оказывает влияния на суммарные характеристики жирных кислот фосфатидилхолина, однако в других фосфолипидах отклонения, наблюдаемые при кратковременной гипотермии, практически возвращаются к норме после долговременного воздействия гипотермии. Нормализация состава липидов мембран после пролонгированной гипотермии частично связана с внесосудистым гемолизом поврежденных эритроцитов, о чем свидетельствует снижение количества эритроцитов и повышение уровня билирубина в крови. Полученные данные обсуждаются в связи с их значением для понимания механизмов липидной адаптации мембран эритроцитов крысы пониженным температурам.
ВВЕДЕНИЕ
Несмотря на то, что у гомойотермных организмов температура тела постоянна в широком диапазоне температур окружающей среды, при долгом пребывании на холоде, особенно при отрицательной температуре, в холодной воде, в условиях гипоксии возникает так называемая непреднамеренная (случайная) гипотермия. В то же время гипотермию используют в клинической практике для снижения метаболических процессов в тканях, требующих кислорода [1]. Непреднамеренная гипотермия, в отличие от гипотермии, используемой в клинической практике, возникает без анестезиологической защиты, что способствует развитию холодового стресса, приводящего к активации гипоталамо-гипофизарно-надпочечниковой системы и ускорению синтеза и секреции катехоламинов и глюкокортикоидов [2, 3]. При этом запускается гормонзависимый липолиз депонированных липидов, что приводит к существенному росту уровня свободных жирных кислот (ЖК) в плазме крови [4, 5]. Исследования показали, что как ЖК плазмы, так и фосфолипиды (ФЛ) липопротеинов плазмы включаются в состав мембран эритроцитов [6], что в условиях гипотермии может привести к изменению фосфолипидного и жирнокислотного состава мембран этих клеток. Однако при кратковременной умеренной гипотермии у крыс, в отличие от сусликов, мы не обнаружили изменений в жирнокислотном составе ФЛ цельной крови [7]. Возможно, это связано с тем, что при гипотермии происходят разнонаправленные изменения в составе ФЛ и их ЖК в плазме крови и мембранах форменных элементов крови. В этой связи заслуживают внимания данные об изменении состава липопротеинов плазмы крови при гипотермии [8]. Так, кратковременная гипотермия 30°C более чем в 2 раза увеличивает содержание липопротеинов очень низкой плотности и снижает содержание липопротеинов высокой плотности в плазме крови крыс. После пролонгированной (в течение 3 ч) умеренной гипотермии наблюдается тенденция к нормализации их уровня. Имеются сведения об изменении состава ФЛ мембран эритроцитов крыс при гипотермии [9]. Вместе с тем данные о влиянии умеренной гипотермии разной длительности на состав ФЛ и их ЖК в мембранах эритроцитов крыс отсутствуют.
Эритроциты представляют собой уникальные биологические структуры, содержащие высокие концентрации полиненасыщенных жирных кислот, кислорода и ионов железа в связанном состоянии, что делает их потенциально чувствительными к повреждающему действию активных форм кислорода (АФК), образующихся как в самом эритроците, так и в плазме крови [10]. По этой причине эритроциты имеют эффективную систему антиоксидантной защиты, которая включает глутатион, витамин C и витамин E, а также ферменты – супероксиддисмутазу, каталазу, глутатионпероксидазу, глутатион-S-трансферазу и глутатионредуктазу. Однако в условиях гипотермии генерация АФК может увеличиваться, а активность антиоксидантной системы может снижаться [5], что будет стимулировать процессы перекисного окисления липидов (ПОЛ), приводящие к изменению липидного состава мембран эритроцитов. Нами было установлено, что кратковременная умеренная гипотермия стимулирует, а ее пролонгирование в течение 3 ч снижает интенсивность ПОЛ эритроцитов крыс [11]. Активация свободнорадикальных процессов в мембране эритроцитов может способствовать заметному уменьшению количества ФЛ, имеющих в своем составе полиненасыщенные жирные кислоты – фосфатидилсерин (ФС), фосфатидилинозитол (ФИ) и фосфатидилэтаноламин (ФЭА). В свою очередь, избирательная делипидизация мембран может привести к росту отношения холестерин/ФЛ, изменению физико-химических свойств мембран и увеличению их микровязкости [12], что может значительно ухудшить функционирование эритроцитов, а, следовательно, и снабжение тканей кислородом.
Целью исследования является выяснение зависимости содержания ФЛ и состава их жирных кислот в мембранах эритроцитов крыс от длительности умеренной гипотермии.
МАТЕРИАЛЫ И МЕТОДЫ
Животных декапитировали под легким эфирным наркозом. Кровь собирали в пробирки с гепарином (25 ед/мл), а затем эритроциты осаждали центрифугированием при 1500 об/мин в течение 5 мин. В плазме определяли содержание общего билирубина на биохимическом анализаторе UniCelDxC 800 PRO автомат (Beсkman Coulter, США). Количество эритроцитов крови подсчитывали на гематологическом анализаторе Sismex KX-21 (Япония).
Для получения мембран эритроциты трижды промывали 0.9% раствором NaCl при 4°C, каждый раз осаждая клетки путем центрифугирования при 1500 g в течение 10 мин. Отмытые эритроциты гемолизировали в 10 мМ трис-HCl буфере рН 7.4, содержащем 1.5 мМ EDTA. Тени эритроцитов осаждали при 20 000 g в течение 20 мин при 4°C, используя центрифугу MR23i (Thermo Scientific, Германия), а затем пятикратно отмывали от гемоглобина 10 мМ трис-HCl буфером рН 8.2. Белые тени эритроцитов хранили при –70°С до использования.
Липиды из мембран эритроцитов экстрагировали по методу Фолча [13] смесью хлороформ : метанол (2 : 1). Состав ФЛ в полученных липидных экстрактах анализировали методом двумерной тонкослойной хроматографии на силикагеле КСК, используя систему растворителей [14]: 1-е направление – хлороформ, метанол и 28%-ный аммиак (81.2 : 31.2 : 6.0 по объему), 2-е направление – хлороформ, метанол, ацетон, уксусная кислота и вода (62.00 : 12.5 : 25.00 : 12.50 : 6.25 по объему). Содержание общих и отдельных фракций ФЛ оценивали по количеству липидсвязанного неорганического фосфора по методу Фиске и Суббароу [15].
Метиловые эфиры ЖК получали щелочным метилированием 0.21 М NaOH на абсолютном метаноле [16]. Анализ метиловых эфиров проводили на газо-жидкостном хроматографе Pye-104 (Англия) на хромосорбе W, содержащем 3% диэтиленгликольсукцината, при 194°С. Газ-носитель – гелий (50 мл/мин). Содержание отдельных ЖК оценивали по площади пика. Результаты выражали в процентах от всех ЖК пробы. Идентификацию ЖК проводили как сравнением относительных времен удержания проб и стандартов, так и после обработки полученных масс-спектров.
Обработка данных произведена с помощью однофакторного дисперсионного анализа (ANOVA) с использованием пакета Statistica8.0. Достоверность различий определяли с помощью критерия Фишера на уровне значимости p = 0.05. Результаты экспериментальных исследований представлены как среднее ± стандартная ошибка.
РЕЗУЛЬТАТЫ
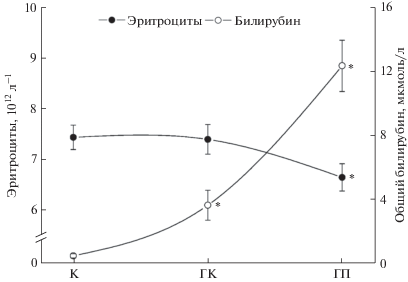
Анализ эритроцитов в крови не выявил изменения их количества после кратковременной гипотермии, но после пролонгированной гипотермии их количество достоверно снижается на 10.6% относительно контроля (рис. 1). В плазме крови нами обнаружено зависимое от длительности гипотермии повышение уровня билирубина – продукта деградации гема гемоглобина клетками ретикуло-эндотелиальной системы. Концентрация общего билирубина в плазме крови после кратковременной гипотермии возрастает в 7.9 раз, а после пролонгированной гипотермии – в 26.8 раз относительно контроля (рис. 1).
Рис. 1.
Изменение количества эритроцитов и общего билирубина в плазме крови крыс при гипотермии. К – контроль; ГК – кратковременная гипотермия 30°C; ГП – пролонгированная 3 ч гипотермия 30°С. * – достоверные (p < 0.05) различия относительно контроля.
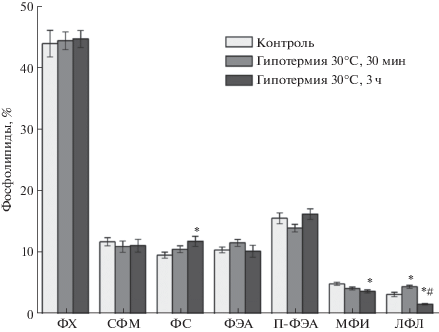
На рис. 2 приведены данные по содержанию ФЛ во фракции мембран эритроцитов в норме и при гипотермических состояниях. В липидах мембран эритроцитов доминирующим ФЛ является фосфатидилхолин (ФХ), а минорным – монофосфоинозитид (МФИ), что согласуется с данными литературы [17]. Это соотношение не изменяется при гипотермии. Как видно, при обоих гипотермических состояниях произошли изменения в процентном содержании различных ФЛ. Независимо от длительности гипотермии содержание ФХ в липидах мембран эритроцитов не изменяется. При кратковременной и пролонгированной гипотермии имеется тенденция к снижению содержания сфингомиелина (СФМ). Сразу после снижения температуры тела до 30°C имеется тенденция к повышению уровня ФС, а через 3 ч гипотермии его содержание в мембранных липидах достоверно увеличилось на 23.2%. После кратковременной гипотермии наблюдается некоторое повышение (на 11.1%) содержания ФЭА, но после пролонгирования гипотермии его содержание снижается до уровня контроля. В отличие от ФЭА количество плазмалогенной формы ФЭА (п-ФЭА) после кратковременной гипотермии недостоверно снижается на 10.2%, но после пролонгированной гипотермии его содержание увеличивается до уровня контроля. При гипотермии более существенно изменяется содержание МФИ в липидах мембран эритроцитов. Так, после кратковременной гипотермии обнаружена тенденция к снижению (на 15.1%) содержания МФИ, а через 3 ч гипотермии его уровень существенно (на 24.7%, р < 0.05) снижен относительно контроля. После кратковременной гипотермии на 37.7% по сравнению с контролем возросло содержание лизофосфолипидов (ЛФЛ). Однако через 3 ч гипотермии количество ЛФЛ в липидах мембран эритроцитов почти в 2 раза снижается относительно контроля.
Рис. 2.
Изменение содержания фосфолипидов (в % от суммы) в мембранах эритроцитов крыс при гипотермии. * – достоверные (p < 0.05) различия относительно контроля, # – достоверные (p < 0.05) различия относительно кратковременной гипотермии.
При гипотермии, наряду с изменением содержания различных классов ФЛ, происходят изменения и их жирнокислотного состава. Изменение состава ЖК суммарных ФЛ в мембранах эритроцитов отражено в табл. 1. Полученные нами данные по составу ЖК суммарных ФЛ мембран контрольных крыс примерно соответствует данным литературы [18]. После кратковременной гипотермии из насыщенных жирных кислот (НЖК) суммарных ФЛ снижается (на 10.5%) количество только С18:0 (табл. 1). В составе моноеновых жирных кислот (МНЖК) количество С16:1 снижается на 10.1%, а С20:1 обнаруживается в надежно регистрируемых количествах. При гипотермии изменения происходят и в составе полиненасыщенных жирных кислот (ПНЖК). Так, содержание таких ПНЖК, как С20:4, С22:2, С22:5 возрастает на 4.6, 26.3 и 6% соответственно, а содержание С20:3, С22:4, С22:6 снижается на 10, 36.6, 8.9% соответственно по отношению к контролю. Следует указать, что обнаруженные изменения в содержании ПНЖК, за исключением С22:4, являются недостоверными. Однако в целом, обнаруженные изменения в содержании ЖК не отразились на общем содержании НЖК, МНЖК и ПНЖК, а также на индексе ненасыщенности.
Таблица 1.
Содержание жирных кислот (ЖК) в суммарных фосфолипидах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 32.98 ± 1.12 | 33.91 ± 1.50 | 35.05 ± 1.44 |
| С16:1 | 1.58 ± 0.12 | 1.42 ± 0.11 | 3.78 ± 0.18*# |
| С17:0 | 0.52 ± 0.08 | 0.51 ± 0.07 | 1.03 ± 0.10*# |
| С18:0 | 13.37 ± 0.46 | 11.97 ±0.40 | 14.23 ± 0.43 |
| С18:1 | 10.55 ± 0.23 | 10.80 ± 0.41 | 10.57 ± 0.36 |
| С18:2 | 9.60 ± 0.33 | 9.28 ± 0.23 | 9.74 ± 0.41 |
| С20:1 | Сл | 0.60 ± 0.04 | Сл |
| С20:3 | 0.80 ± 0.15 | 0.72 ± 0.16 | 0.65 ± 0.11 |
| С20:4ω6 | 21.81 ± 0.72 | 22.82 ± 0.61 | 18.38 ± 0.52*# |
| С22:2 | 1.33 ± 0.11 | 1.68 ± 0.15 | 2.58 ± 0.20*# |
| С22:4ω6 | 2.35 ± 0.23 | 1.49 ± 0.12* | 1.33 ± 0.07* |
| С22:5ω6 | 1.51 ± 0.09 | 1.60 ± 0.13 | Сл |
| С22:6ω3 | 3.47 ± 0.34 | 3.16 ± 0.37 | 2.36 ± 0.15* |
| Насыщенные | 46.78 | 46.39 | 50.31 |
| Моноеновые | 12.13 | 12.82 | 14.35 |
| Полиеновые | 40.87 | 40.75 | 35.04 |
| Индекс ненасыщенности | 161.4 ± 4.9 | 161.1 ± 4.7 | 133.9 ± 3.9*# |
Примечание: здесь и в табл. 2–6 * – достоверность различий относительно контроля; # – достоверность различий относительно кратковременной гипотермии 30°С; *, #p < 0.05; Сл – следы, содержание жирной кислоты менее 0.5%.
После пролонгирования гипотермии общее количество НЖК в суммарных ФЛ возрастает на 7.3%, главным образом, за счет С17:0, содержание которого увеличивается на 98.1% относительно контроля (табл. 1). Количество МНЖК возрастает на 18.3% относительно контроля за счет значительного увеличения (на 139.2%) содержания С16:1. В отличие от НЖК и МНЖК, содержание ПНЖК при пролонгировании гипотермии снижается на 17%. Такое снижение происходит за счет уменьшения количества С20:3 (на 18.8%), С20:4 (на 15.7%), С22:4 (на 56.6%) и С22:6 (на 32%). При этом в составе ЖК не обнаруживается С22:5. В отличие от других ПНЖК при пролонгировании гипотермии содержание С22:2 достоверно увеличивается на 93.4% относительно контроля. После пролонгирования гипотермии за счет существенного снижения содержания большинства ПНЖК индекс ненасыщенности снижается на 17% (р < 0.01) как относительно контроля, так и кратковременной гипотермии (табл. 1).
Анализ ЖК в составе суммарных ФЛ не дает представления о том, в составе каких ФЛ происходят обнаруженные при гипотермии изменения их содержания. Поэтому мы проанализировали изменения жирнокислотного состава различных классов ФЛ, вызванные гипотермией.
В табл. 2 приведены данные по влиянию гипотермии на жирнокислотный состав ФХ. В контроле в составе ФХ преобладающей НЖК является пальмитиновая, МНЖК – олеиновая, ПНЖК – арахидоновая. При кратковременной гипотермии обращает на себя внимание резкое увеличение содержания С16:1 (на 130.3%). В то же время содержание С20:1 моноена надежно не регистрируется. Содержание ПНЖК существенно снижается. Это связано с тем, что при гипотермии в составе ФХ надежно не регистрируется С20:3, а количество С20:4 снижается на 27.5% относительно контроля. Поэтому и индекс ненасыщенности для ФХ при гипотермии достоверно уменьшается. Отношение ПНЖК/МНЖК снижается с 1.47 в контроле до 1.30 при гипотермии (табл. 2).
Таблица 2.
Содержание жирных кислот (ЖК) в фосфатидилхолинах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 51.97 ± 1.28 | 52.46 ± 1.18 | 51.90 ± 2.40 |
| С16:1 | 1.45 ± 0.19 | 3.34 ± 0.23* | 3.00 ± 0.25* |
| С17:0 | Сл | 0.69 ± 0.17 | 1.00 ± 0.11 |
| С18:0 | 13.26 ± 0.71 | 13.53 ± 0.54 | 12.00 ± 0.49 |
| С18:1 | 11.62 ± 0.59 | 11.14 ± 0.82 | 10.70 ± 0.79 |
| С18:2 | 12.98 ± 0.65 | 13.36 ± 0.74 | 14.73 ± 0.94 |
| С20:0 | Сл | 0.55 ± 0.03 | – |
| С20:1 | 0.95 ± 0.06 | Сл | – |
| С20:3 | 0.92 ± 0.06 | Сл | – |
| С20:4ω6 | 6.65 ± 0.25 | 4.82 ± 0.28* | 6.47 ± 0.39# |
| Насыщенные | 65.23 | 67.23 | 64.90 |
| Моноеновые | 14.02 | 14.48 | 13.70 |
| Полиеновые | 20.55 | 18.18 | 21.20 |
| Индекс ненасыщенности | 69.3 ± 2.3 | 60.5 ± 1.9* | 69.0 ± 1.6# |
У животных, перенесших пролонгированную гипотермию, как и после кратковременной гипотермии, общее содержание НЖК в составе ФХ, не отличается от контрольных значений (табл. 2). Общее содержание МНЖК также не отличается от контрольных значений. В то же время общее содержание ПНЖК, пониженное после кратковременной гипотермии, возрастает до уровня контроля после пролонгированной гипотермии. Это достигается за счет повышения содержания С18:2 (на 13.5%) и возрастания уровня С20:4 до контрольных значений. После пролонгированной гипотермии значение индекса ненасыщенности возрастает до уровня контроля. Отношение ПНЖК/МНЖК составляет 3.25. Оно существенно не отличается от значений, обнаруженных как в контроле, так и при кратковременной гипотермии.
В табл. 3 приведены данные по влиянию гипотермии на жирнокислотный состав ФС. В контроле в составе ФС преобладающей НЖК является стеариновая, МНЖК – олеиновая, ПНЖК – арахидоновая. При кратковременной гипотермии в составе НЖК содержание С16:0 снижается на 27%, но содержание С18:0 возрастает почти на 18% и появляются отсутствующие в контроле С17:0 и С20:0. При этом существенно снижается (на 51.5%) содержание С16:1 моноена. В то же время содержание С18:1 моноена повышается и выявляется нерегистрируемый в контроле С22:1 моноен. Общее содержание ПНЖК при кратковременной гипотермии снижается примерно на 10%. Это является результатом разнонаправленных изменений ПНЖК. Так, если содержание С18:2 имеет тенденцию к росту (на 13.8%), а содержание С22:4 достоверно возрастает (на 57.4%), то содержание С20:4 снижается на 11.2% (р < 0.05), а содержание С22:6 недостоверно снижается на 13.1% относительно контроля. В то же время С22:2 в составе ФС при гипотермии надежно не регистрируется. В целом эти изменения приводят к тому, что индекс ненасыщенности для ФС при гипотермии достоверно уменьшается. Отношение ПНЖК/МНЖК снижается с 7.94 в контроле до 5.37 при кратковременной гипотермии (табл. 3).
Таблица 3.
Содержание жирных кислот (ЖК) в фосфатидилсеринах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 5.93 ± 0.29 | 4.33 ± 0.18* | 4.27 ± 0.17* |
| С16:1 | 1.30 ± 0.09 | 0.63 ± 0.03* | 0.57 ± 0.06* |
| С17:0 | – | 0.67 ± 0.09 | 0.57 ± 0.07 |
| С18:0 | 21.86 ± 0.91 | 25.74 ± 0.73* | 20.20 ± 0.35# |
| С18:1 | 6.76 ±0.36 | 7.13 ± 0.17 | 6.48 ± 0.26 |
| С18:2 | 3.40 ± 0.16 | 3.87 ± 0.22 | 3.73 ± 0.11 |
| С20:0 | – | 0.55 ± 0.03 | – |
| С20:4ω6 | 49.20 ± 1.28 | 43.67 ± 1.89* | 49.40 ± 1.37# |
| С22:1 | Сл | 3.01 ± 0.45 | 3.33 ± 0.28 |
| С22:2 | 2.29 ± 0.20 | Сл | 2.35 ± 0.10 |
| С22:4ω6 | 3.43 ± 0.31 | 5.40 ± 0.25* | 4.00 ± 0.26# |
| С22:6ω3 | 5.67 ± 0.13 | 4.93 ± 0.28 | 5.03 ± 0.23 |
| Насыщенные | 27.79 | 31.29 | 25.04 |
| Моноеновые | 8.06 | 10.77 | 10.38 |
| Полиеновые | 63.99 | 57.87 | 64.51 |
| Индекс ненасыщенности | 264.0 ± 4.6 | 244.4 ± 4.4* | 266.32 ± 3.1 |
У животных, перенесших пролонгированную гипотермию, общее содержание НЖК в составе ФС, повышенное после кратковременной гипотермии, снижается не только до уровня контроля, но и на 10% ниже него (табл. 3). Это происходит за счет снижения С16:0 (на 28%), С18:0 (7.6%), а также исчезновения С20:0. После пролонгирования гипотермии общее количество МНЖК остается повышенным, как и после кратковременной гипотермии. Общее количество ПНЖК возрастает до уровня контроля. Это достигается в основном за счет С20:4 и С22:4 полиенов, в результате чего индекс ненасыщенности возрастает до уровня контроля. Отношение ПНЖК/МНЖК снижается с 7.94 при кратковременной гипотермии до 6.21 после пролонгированной гипотермии, приближаясь к контрольным значениям.
Анализ жирнокислотного состава МФИ показал, что в контроле в их составе преобладающей НЖК является стеариновая, МНЖК – олеиновая, ПНЖК – арахидоновая (табл. 4). При кратковременной гипотермии общее содержание НЖК не изменяется относительно контроля. Общее содержание МНЖК возрастает на 21.4%. Это происходит как за счет С16:1 (на 12.8%), так и С18:1 (на 23.9%). Общее содержание ПНЖК при кратковременной гипотермии снижается на 10.1%. Такое падение уровня ПНЖК происходит за счет снижения содержания С20:4 (на 10.4%), С22:2 (на 28%) и С22:4 (на 32%). В то же время содержание С18:2 возрастает на 30.4%. В целом эти изменения приводят к тому, что индекс ненасыщенности для МФИ при гипотермии уменьшается на 10.1% по отношению к контролю. Отношение ПНЖК/МНЖК снижается с 4.77 в контроле до 3.53 при кратковременной гипотермии (табл. 4).
Таблица 4.
Содержание жирных кислот (ЖК) в монофосфоинозитидах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 20.57 ± 0.64 | 21.63 ± 0.92 | 23.85 ± 1.18* |
| С16:1 | 1.80 ± 0.09 | 2.03 ± 0.23 | 2.49 ± 0.12* |
| С18:0 | 34.06 ± 1.25 | 35.05 ± 1.36 | 30.25 ± 1.13# |
| С18:1 | 6.06 ± 0.31 | 7.51 ± 0.38* | 6.45 ± 0.49 |
| С18:2 | 4.15 ± 0.29 | 5.41 ± 0.34* | 6.23 ± 0.33* |
| С20:4ω6 | 25.44 ± 0.98 | 22.80 ± 1.24 | 21.78 ± 1.19* |
| С22:2 | 2.86 ± 0.12 | 2.05 ± 0.16 | 4.55 ± 0.37*# |
| С22:4ω6 | 5.03 ± 0.14 | 3.42 ± 0.17* | 3.62 ± 0.19* |
| Насыщенные | 54.63 | 56.68 | 54.10 |
| Моноеновые | 7.86 | 9.54 + 21.4 | 8.94 + 13.7 |
| Полиеновые | 37.48 | 33.68 | 36.18 |
| Индекс ненасыщенности | 143.8 ± 5.9 | 129.3 ± 4.9 | 132.1 ± 4.4 |
При пролонгировании гипотермии содержание С16:0 возрастает на 15.9%, а С18:0 снижается на 11.2% относительно контроля, но эти изменения не оказывают влияния на общее содержание НЖК в составе МФИ относительно контроля (табл. 4). После пролонгирования гипотермии общее количество МНЖК снижается относительно кратковременной гипотермии, но остается на 13.7% выше уровня контроля. Общее содержание ПНЖК, пониженное после кратковременной гипотермии, возрастает до уровня контроля. Такое повышение достигается за счет существенного роста содержания С18:2 (на 50.1%) и С22:2 (на 59.1%) с одной стороны, и менее существенного снижения содержания С20:4 (на 14.4%) и С22:4 (на 28%) с другой стороны. В целом эти изменения приводят к тому, что индекс ненасыщенности для МФИ после пролонгированной гипотермии возрастает относительно кратковременной гипотермии, но остается сниженным по отношению к контролю. Отношение ПНЖК/ МНЖК после пролонгированной гипотермии возрастает (4.05) относительно кратковременной гипотермии (3.53), но остается ниже контроля (4.77).
Исследование жирнокислотного состава ФЭА показало, что в контроле преобладающей НЖК является пальмитиновая, МНЖК – олеиновая, ПНЖК – арахидоновая (табл. 5). При кратковременной гипотермии общее содержание НЖК существенно не изменяется относительно контроля. При гипотермии значительные изменения происходят в составе ПНЖК. Если содержание С18:2, С20:3, С20:4 и С22:6 существенно не изменяется, то содержание таких полиенов, как С22:2, С22:4, С22:5 снижается на 23.7, 56.4 и 50% соответственно относительно контроля. Это, однако, существенно не изменяет общее содержание ПНЖК в составе ФЭА. В целом эти изменения лишь незначительно снижают индекс ненасыщенности для ФЭА при гипотермии по отношению к контролю. Отношение ПНЖК/МНЖК снижается с 2.10 в контроле до 1.88 при кратковременной гипотермии (табл. 5).
Таблица 5.
Содержание жирных кислот (ЖК) в фосфатидилэтаноламинах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 17.59 ± 0.67 | 19.23 ± 1.19 | 16.43 ± 0.97 |
| С16:1 | 1.97 ± 0.15 | 2.03 ± 0.11 | 1.97 ± 0.13 |
| С17:0 | 0.62 ± 0.04 | Сл | – |
| С18:0 | 6.78 ± 0.31 | 7.23 ± 0.29 | 6.97 ± 0.37 |
| С18:1 | 21.04 ± 1.13 | 22.80 ± 1.47 | 21.76 ± 1.79 |
| С18:2 | 10.34 ± 0.52 | 10.33 ± 0.68 | 9.30 ± 0.50 |
| С20:1 | 1.15 ± 0.06 | 0.70 ± 0.05* | 0.60 ± 0.04* |
| С20:3 | Сл | 0.80 ± 0.06 | Сл |
| С20:4ω6 | 25.06 ± 1.31 | 26.87 ± 1.69 | 25.80 ± 1.26 |
| С22:2 | 3.58 ± 0.13 | 2.73 ± 0.15* | 4.70 ± 0.26*# |
| С22:4ω6 | 5.05 ± 0.38 | 2.20 ± 0.10* | 5.73 ± 0.33# |
| С22:5ω3 | 3.14 ± 0.15 | 1.57 ± 0.13* | 2.13 ± 0.11* |
| С22:6ω3 | 3.59 ± 0.16 | 3.47 ± 0.21 | 4.60 ± 0.18 |
| Насыщенные | 24.99 | 26.46 | 23.40 |
| Моноеновые | 24.16 | 25.53 | 24.33 |
| Полиеновые | 50.76 | 47.97 | 52.26 |
| Индекс ненасыщенности | 209.7 ± 9.3 | 199.0 ± 8.9 | 216.7 ± 11.1 |
После пролонгирования гипотермии общее содержание НЖК и МНЖК в составе ФЭА существенно не отличается от уровня контроля (табл. 5). Обращает внимание на себя тот факт, что после пролонгирования гипотермии содержание большинства изученных ПНЖК, пониженное после кратковременной гипотермии, возрастает. Так, содержание С22:2 возрастает на 31.3%, С22:4 – на 13.5%, С22:6 – на 28.1% относительно контроля. Содержание С22:5 также возрастает относительно кратковременной гипотермии, хотя остается ниже контроля. В то же время общее содержание ПНЖК после пролонгированной гипотермии, как и после кратковременной гипотермии, не изменяется относительно контроля. Индекс ненасыщенности для ФЭА после пролонгированной гипотермии не отличается от значений контроля. Отношение ПНЖК/МНЖК возрастает до значений контроля.
В табл. 6 приведены данные по влиянию гипотермии на жирнокислотный состав п-ФЭА. В контроле в составе п-ФЭА преобладающей НЖК является пальмитиновая, МНЖК – олеиновая, ПНЖК – арахидоновая. Для п-ФЭА характерно очень высокое содержание ПНЖК. При кратковременной гипотермии общее содержание НЖК существенно возрастает (на 33.6%) относительно контроля. Это повышение происходит как за счет С16:0 (14.9%), так и С18:0 (119%). При гипотермии общее количество МНЖК снижается на 20% по отношению к контролю, это происходит в основном за счет снижения содержания С16:1 (на 15.1%) и С18:1 (на 21.4%). При гипотермии разнонаправленные изменения происходят в составе ПНЖК. Так, содержание С18:2, С20:4, С22:4 возрастает, а содержание С22:2, С22:5ω3 и С22:5ω6 снижается. В целом при гипотермии значение индекса ненасыщенности для п-ФЭА не изменяется по отношению к контролю. Отношение ПНЖК/МНЖК возрастает с 18.6 в контроле до 23.1 при кратковременной гипотермии (табл. 6).
Таблица 6.
Содержание жирных кислот (ЖК) в плазмалоген-фосфатидилэтаноламинах мембран эритроцитов крыс при гипотермии (% суммы всех ЖК)
| ЖК | Контроль | Гипотермия 30°C | |
|---|---|---|---|
| 30 мин | через 3 ч | ||
| С16:0 | 4.18 ± 0.17 | 4.91 ± 0.27 | 4.22 ± 0.23 |
| С16:1 | 1.06 ± 0.09 | 0.90 ± 0.10 | 0.91 ± 0.08 |
| С18:0 | 0.79 ± 0.06 | 1.73 ± 0.12* | 1.08 ± 0.2 |
| С18:1 | 3.78 ± 0.27 | 2.97 ± 0.12 | 2.68 ± 0.13* |
| С18:2 | 1.50 ± 0.13 | 1.87 ± 0.09* | 1.85 ± 0.07* |
| С20:4ω6 | 55.06 ± 0.42 | 59.03 ± 0.35* | 57.88 ± 0.43 |
| С22:2 | 3.83 ± 0.30 | 2.47 ± 0.13* | 2.34 ± 0.17* |
| С22:4ω6 | 5.53 ± 0.28 | 6.27 ± 0.29 | 7.85 ± 0.41* |
| С22:5ω3 | 12.88 ± 0.67 | 10.30 ± 0.39* | 10.91 ± 0.54 |
| С22:5ω6 | 11.31 ± 0.68 | 9.43 ± 0.51 | 10.19 ± 0.79 |
| Насыщенные | 4.97 | 6.64 | 5.30 |
| Моноеновые | 4.84 | 3.87 | 3.59 |
| Полиеновые | 90.11 | 89.37 | 91.02 |
| Индекс ненасыщенности | 378.8 ± 9.6 | 372.4 ± 10.9 | 380.4 ± 11.2 |
При пролонгировании гипотермии общее содержание НЖК в составе п-ФЭА снижается до уровня контроля (табл. 6). После пролонгирования гипотермии общее количество МНЖК продолжает снижаться. Общее содержание ПНЖК после пролонгированной гипотермии, как и после кратковременной гипотермии, не изменяется относительно контроля. Однако при этом содержание С18:2 и С22:4 существенно возрастает, в тоже время содержание С22:2, С22:5ω3 и С22:5ω6 – снижается. Содержание С20:4 после пролонгированной гипотермии, как и после кратковременной гипотермии не изменяется относительно контроля. Значение индекса ненасыщенности для п-ФЭА после пролонгированной гипотермии, как и после кратковременной гипотермии, не изменяется по отношению к контролю. Пролонгирование гипотермии способствует увеличению отношения ПНЖК/МНЖК с 18.6 (контроль) до 25.3.
ОБСУЖДЕНИЕ
Эритроцитарная мембрана эволюционно адаптирована для реагирования на механический стресс путем быстрых и обратимых изменений формы. Эта своеобразная морфологическая гибкость обеспечивается сложным взаимодействием между компонентами мембраны: различными видами липидов, большим количеством интегральных мембранных белков и актин-спектриновой сети цитоскелета. Состав липидов плазматической мембраны зрелых эритроцитов млекопитающего поддерживается на протяжении жизни клетки. Его молекулярный состав включает более 250 различных видов глицерофосфолипидов [19]. В зрелом эритроците все липиды находятся в бислое мембраны и состоят из ФЛ и холестерина в молярном соотношении 1.2 : 1. Полученные нами данные свидетельствуют о том, что в липидах мембран эритроцитов крыс больше всего имеется ФХ, минорным компонентом является МФИ, остальные ФЛ представлены примерно в одинаковом количестве (рис. 2). Примерно половина жирных кислот в ФЛ мембран представлена ненасыщенными кислотами (табл. 1), что согласуется с литературными данными [20].
В физиологических условиях эритроциты имеют асимметричное распределение ФЛ: ФХ и СФМ, составляющие большинство ФЛ, располагаются на внешнем слое, а ФС и ФЭА сконцентрированы на внутреннем слое мембраны [21]. Такие минорные ФЛ, как фосфатидная кислота, ФИ и его производные, также находятся на цитозольной стороне мембраны. Следует отметить, что при гипотермии, независимо от ее длительности, содержание холинсодержащих ФЛ (ФХ, СФМ), расположенных на внешнем слое мембраны, не изменилось (рис. 2). Содержание ФС, расположенного на внутреннем слое мембраны, сразу после падения температуры тела возрастает и продолжает увеличиваться при пролонгировании гипотермии. Несмотря на то что ФЭА также расположен на внутренней стороне мембраны, его количество при гипотермии не изменяется. Возможно, что различия в изменении количества ФЛ при гипотермии являются следствием различия функций, которые выполняют эти липиды в мембране эритроцитов. При гипотермии изменяется также жирнокислотный состав индивидуальных ФЛ, степень которого зависит от длительности гипотермии.
Метаболически эритроциты довольно простые клетки. Они имеют ограниченный энергетический обмен (отсутствуют митохондрии), не способны синтезировать ЖК (нет синтаз жирных кислот, десатураз и элонгаз), а также они не способны синтезировать ФЛ (отсутствует эндоплазматический ретикулум). Тогда каким образом изменяется липидный состав мембран эритроцитов при снижении температуры тела животного?
Анализ полученных нами результатов, а также данные литературы позволяют предположить, что в изменении липидного состава мембран эритроцитов при гипотермии могут быть задействованы несколько механизмов. Это может быть результатом (1) включения механизмов ремоделирования мембранных липидов путем деацилирования и реацилирования ФЛ, (2) обмена с ФЛ плазмы, а также (3) изменения возрастного состава популяции циркулирующих эритроцитов.
Известно, что эритроциты весьма чувствительны к АФК, образующимся в самой клетке и в плазме [22]. Основным источником внутриклеточных АФК в эритроцитах является процесс аутоокисления оксигемоглобина (Hb), дающий супероксид, после дисмутации которого образуется H2O2 [10]. Установлено, что в интактных эритроцитах небольшая часть Hb, связанная с мембранами, способствует генерации трудно нейтрализуемых АФК, поскольку в примембранном пространстве они менее доступны для клеточной антиоксидантной системы, которая локализована в основном в цитоплазме. При гипотермии существенно возрастает доля Hb, связанного с мембранами [23]. Это может быть причиной активации свободнорадикальных процессов в эритроцитах на начальных этапах снижения температуры тела у крыс, о чем свидетельствует повышение уровня продуктов ПОЛ и окислительной модификации белков мембран эритроцитов, а также снижение активности антиоксидантной защиты клеток [5, 11, 24].
В составе ФЛ ПНЖК более восприимчивы к пероксидации, что приводит к образованию в мембранах эритроцитов ряда альдегидов, в том числе и малонового диальдегида (МДА) [25]. Как следствие, наблюдается заметное увеличение НЖК и снижение уровня МНЖК и ПНЖК в мембранах клеток. В ЖК суммарных ФЛ эритроцитарных мембран индекс ненасыщенности, а также отношение ПНЖК/НЖК и неНЖК/НЖК сразу после снижения температуры тела существенно не изменяется, но после пролонгированной гипотермии заметно снижается (табл. 1). Однако в пяти исследованных ФЛ (ФХ, ФС, МФИ, ФЭА, п-ФЭА) мы обнаружили обратную картину (табл. 2–6). Значительное снижение отношения ПНЖК/НЖК и неНЖК/НЖК, обнаруженное в индивидуальных классах ФЛ мембран эритроцитов после кратковременной гипотермии, свидетельствует об их пероксидации. Эти результаты согласуются с данными о более высоком уровне таких продуктов ПОЛ, как МДА, обнаруженном нами [11] и другими исследователями [26] в эритроцитах крыс после кратковременной гипотермии. В то же время после пролонгированной гипотермии значения отношения ПНЖК/НЖК и неНЖК/НЖК в исследованных классах ФЛ возрастают до уровня контроля или даже выше. Эти результаты также согласуются с нашими данными о снижении интенсивности процессов ПОЛ в эритроцитах крыс после пролонгированной 3 ч гипотермии [11]. Таким образом, в динамике умеренной гипотермии изменение жирнокислотного состава индивидуальных ФЛ коррелирует с изменением интенсивности ПОЛ в эритроцитах.
Поскольку после пролонгированной гипотермии происходит нормализация процессов окислительной модификации липидов и белков мембран эритроцитов, нормализация активности компонентов антиоксидантной защиты [11] и осмотической хрупкости эритроцитов [27], а также структурно-функционального состояния мембраны [28], то мы склонны думать, что и нормализация жирнокислотного состава индивидуальных ФЛ, обнаруженная в данной работе, является адаптивной реакцией, направленной на сохранение функциональной активности клеток.
Изменения в составе/структуре липидов под воздействием различных факторов имеют решающее значение для поддержания стабильности и функций мембраны эритроцитов. Несмотря на отсутствие возможности синтезировать липиды de novo, эритроциты способны обновлять липиды мембран. Ван ден Бум с коллегами [29] ввели в мембраны изолированных эритроцитов кролика радиоактивно меченные ФЛ, а затем реинфузировали их в кровоток животным. По потере радиоактивности их жирнокислотных радикалов определили скорость обновления ФЛ. Оказалось, что наиболее быстро обновлялся ФХ (полупериод обновления составил 1.5 сут), медленнее всех обновлялся ФЭА (12 сут), а полупериод обновления остальных ФЛ составлял примерно 5 дней. По данным авторов примерно 1/3 часть ФХ обновлялась в течение суток либо путем замены, либо за счет деацилирования и реацилирования. В целом исследование показало, что in vivo скорость обновления ФЛ мембран эритроцитов зависит от структуры их полярных головок, их локализации в мембране и, в большей степени, от состава ЖК.
Процессы обновления ФЛ ускоряются после их окислительной модификации, в ходе которого окисленные ацильные цепи быстро удаляются из ФЛ мембран под действием (кальций-зависимой) фосфолипазы А2 [30]. Свободные ЖК из плазмы крови поглощаются эритроцитами и этерифицируются с КоА в АТР-зависимой реакции, катализируемой ацил-КоА-синтетазой для ЖК с длинной цепью [31]. Переэтерификация ацильной группы из ацил-КоА в лизофосфолипид затем катализируется ацил-КоА : лизофосфолипид-ацилтрансферазой [32].
Выше мы отмечали, что при острой гипотермии запускается механизм гормонзависимого липолиза депонированных липидов, в результате чего в плазме крови существенно возрастает уровень свободных ЖК [4]. Причем в их спектре увеличивается количество неНЖК. Позже было установлено, что гормонзависимый липолиз приводит к селективной мобилизации неНЖК из триацилглицеролов белой жировой ткани [33], которые затем используются для ремоделирования ФЛ мембран различных тканей. В своей монографии В.Н. Гурин предполагал, что повышение уровня неНЖК в плазме необходим для снижения вязкости мембран клеток в условиях гипотермии. Учитывая динамику изменения интенсивности процессов ПОЛ, индекса ненасыщенности, отношений ПНЖК/НЖК и неНЖК/ НЖК в зависимости от длительности гипотермии, мы полагаем, что процессы пероксидации липидов доминируют в начале гипотермии, в период развития холодового стресса, а процессы ремоделирования липидов запускаются при пролонгировании этого состояния. В пользу этого предположения свидетельствуют также данные по изменению содержания ЛФЛ в мембранных липидах при гипотермии (рис. 2). Так, после кратковременной гипотермии их содержание возросло на 37.7% по сравнению с контролем, а через 3 ч гипотермии, наоборот, снизилось почти в 2 раза относительно контрольного уровня.
При гипотермии в зависимости от ее длительности происходит изменение содержания некоторых ФЛ в составе мембран. Такие изменения могут происходить не только за счет ремоделирования ФЛ, но также в результате их участия в метаболических и регуляторных процессах.
Полученные нами результаты показали, что сразу после снижения температуры тела до 30°C имеется тенденция к повышению уровня ФС, а через 3 ч гипотермии его содержание в мембранных липидах достоверно на 23.2% увеличилось.
Известно, что в норме ФС локализуется исключительно на внутреннем листке клеточной мембраны [21], что важно для нормального функционирования эритроцитов. ФС взаимодействует со спектрином, что способствует поддержанию формы клеток и таких механических свойств мембраны, как деформируемость и стабильность. Гликирование определенных аминокислотных остатков спектрина приводит к значительному снижению деформируемости мембраны [21, 34]. ФС, связываясь с этими аминокислотными остатками-мишенями спектрина, блокирует их гликирование, что предотвращает снижение деформируемости мембраны. Следовательно, обнаруженное нами повышение уровня ФС в мембране может иметь адаптивное значение, поскольку это будет способствовать поддержанию деформируемости мембраны эритроцитов при гипотермии.
Большое значение для асимметричного распределения ФС имеет уровень свободного Ca2+ в эритроцитах. Базальная концентрация свободного Ca2+ в эритроцитах в физиологических условиях находится в диапазоне от 30 до 60 нМ [35]. Огромный градиент (не менее 40 000 раз) между цитозолем и плазмой крови поддерживается из-за особенно низкой проницаемости мембран эритроцитов для Ca2+ (~50 мкмоль на клетку в час), а также эффективного удаления этих ионов из клетки Ca2+-насосом. У молодых эритроцитов, когда внутриклеточный уровень АТР высокий, а Са2+ низкий, асимметричное распределение ФС поддерживается за счет работы АТР-зависимой аминофосфолипдтранслоказы – флипазы [21, 36]. Активность флипазы ингибируется высокими концентрациями Са2+. При старении эритроцитов концентрация Ca2+ в клетке повышается (>1 мкмоль/л), что приводит к ингибированию флипазы и активированию скрамблазы, осуществляющей перенос ФС с внутреннего листка мембраны на внешний [21]. Экстернализация ФС является одним из путей, вызывающих удаление эритроцитов из кровообращения путем фагоцитоза макрофагами ретикуло-эндотелиальной системы.
В условиях окислительного стресса флипаза может быть ингибирована в результате окисления важной для транслоказы тиоловой группы [37]. Кроме того, окислительный стресс приводит к ингибированию Са2+-ATP-азы [38], которая ответственна за поддержание низкой концентрации кальция в клетке. К тому же Ca2+-насос чрезвычайно чувствителен к температуре: скорость оборота фермента падает примерно в 30 раз на каждые 10°C [39].
Полагают [40], что при гипотермии в эритроцитах происходит снижение уровня АТР и повышение содержания Са2+. Кроме того, после кратковременной гипотермии в эритроцитах обнаружено развитие окислительного стресса, который сопровождается существенным повышением окислительной модификации липидов и белков мембран, а также снижением уровня восстановленного глутатиона [11]. В нашей лаборатории также показано, что кратковременная умеренная гипотермия приводит к значительному сокращению продолжительности жизни эритроцитов [41]. Эти данные позволяют предположить, что при кратковременной гипотермии в части эритроцитов создаются условия для экстернализации ФС и элиминации таких клеток макрофагами ретикуло-эндотелиальной системы.
Одним из минорных ФЛ мембран эритроцитов является МФИ. Следует отметить, что сразу после снижения температуры тела и особенно после пролонгированной гипотермии содержание МФИ в мембранах эритроцитов снижается (рис. 2). Фосфоинозитиды, расположенные на цитоплазматической стороне мембраны, из-за их отрицательного заряда (до –4 при рН 7) служат сайтами для взаимодействия с цитозольными белками, имеющими специфические участки, и, таким образом, участвуют в сигнальных процессах и ремоделировании цитоскелета [36]. В плазматических мембранах МФИ находится в виде фосфатидилинозитол-4-фосфата, который в последующем подвергается фосфорилированию с образованием фосфатидилинозитол-4,5-бисфосфата. При активации фосфолипазы Cδ из фосфатидилинозитол-4,5-бисфосфата образуются два вторичных мессенджера – диацилглицерол и инозитол-1,4,5-трифосфат, участвующие в сигнальных процессах. Следовательно, снижение содержания МФИ в структуре мембран может происходить вследствие его большого расходования в качестве предшественника вторичных мессенджеров внутриклеточных процессов. Снижение уровня МФИ может происходить также в результате его деградации из-за усиления свободнорадикального окисления ПНЖК, которыми богат данный ФЛ. Действительно, после кратковременной гипотермии как количество ПНЖК, так и индекс ненасыщенности в МФИ снижается (табл. 4).
В зависимости от длительности гипотермии в мембранных липидах изменяется также и содержание п-ФЭА. Уровень п-ФЭА, после кратковременной гипотермии снижается на 10%, но после пролонгированной гипотермии повышается до контрольных величин (рис. 2). Энгельман с сотр. [42] показали, что п-ФЭА, в отличие от диацил-ФЭА, быстро переходит из липопротеинов плазмы в мембрану эритроцитов. Можно предположить, что нормализация уровня п-ФЭА в мембранах эритроцитов после пролонгированной гипотермии связана с поступлением их из липопротеинов плазмы крови.
Установлено, что плазмалогены являются естественными антиоксидантами, способными перехватывать свободные радикалы, тем самым защищая ПНЖК ФЛ от пероксидации [43]. Поскольку изменение содержания п-ФЭА в динамике гипотермии противоположно изменению интенсивности процессов пероксидации липидов мембран эритроцитах крыс [11], то можно предположить, что снижение уровня п-ФЭА после кратковременной гипотермии и повышение после пролонгированной гипотермии отражает также степень их участия в свободнорадикальных процессах в эритроцитах.
Снижение уровня п-ФЭА после кратковременной гипотермии может быть связано также с его метаболизмом. Поскольку плазмалогены обогащены арахидоновой кислотой, они могут функционировать в качестве резервуаров для этого биологически активного липидного медиатора. Плазмалоген-избирательная Ca2+-независимая фосфолипаза A2 вызывает деградацию плазмалогена с образованием лизоплазмалогена и арахидоновой кислоты [44]. Последняя играет важную роль в передаче сигнала, являясь субстратом для синтеза простагландинов, тромбоксанов и лейкотриенов. Образующиеся лизоплазмалогены могут вызывать изменения проницаемости и текучести мембраны, а также способствовать поступлению Ca2+ извне через каналы мембраны.
Как было отмечено выше, эритроциты, в отличие от плазмы крови, содержат лишь незначительное количество кальция [35]. Интенсивное проникновение кальция через мембрану эритроцитов должно в первую очередь приводить к активации кальций-зависимых фосфолипаз. Повышение доли ЛФЛ (рис. 2), обнаруженное нами после кратковременной гипотермии, является свидетельством повышения в эритроцитах кальция и активации фосфолипазы А2. Следует подчеркнуть, что для фосфолипазы А2 предпочтительным субстратом являются окисленные ФЛ [46]. Образующиеся ЛФЛ и свободные ЖК имеют не цилиндрическую форму [23]. По этой причине их накопление в мембране приводит к появлению кривизны в мембране и изменяет латеральный профиль давления через мембрану, что приводит к дестабилизации мембраны и повышению ее проницаемости [46]. Возможно, в результате превращения в сфероциты такие эритроциты подвергаются внутрисосудистому гемолизу. Видимо, по этой причине после пролонгирования гипотермии количество ЛФЛ в мембране эритроцитов значительно снижается (рис. 2). Однако нельзя исключить того, что в ходе пролонгирования гипотермии ЛФЛ могут подвергаться этерификации.
Оиши и сотр. [47] при исследовании влияния иммобилизационного стресса на крыс обнаружили повышение активности антиоксидантных ферментов в эритроцитах и одновременное уменьшение общего количества эритроцитов в крови. Авторы предположили, что одним из возможных механизмов таких изменений является лизис эритроцитов, имеющих низкую активность антиоксидантных ферментов, в результате чего остаются только клетки с высокой активностью ферментов.
Могут ли происходить такие изменения состава эритроцитов при гипотермии, которые отражаются и на составе липидов их мембран?
По нашим наблюдениям плазма крови крыс, полученная сразу после снижения температуры тела до 30°C, всегда имеет интенсивно розовый цвет. Количественный анализ уровня внеэритроцитарного гемоглобина подтвердил факт ускорения внутрисосудистого гемолиза эритроцитов [5]. Причем чем ниже температура тела (30°C → 20°С), тем выше уровень гемолиза эритроцитов. Пролонгирование умеренной гипотермии в течение 3 ч уменьшает интенсивность внутрисосудистого гемолиза эритроцитов. Ускорение внутрисосудистого гемолиза эритроцитов при гипотермии может быть связано с процессами, происходящими как в плазме крови, так и в самих эритроцитах.
Установлено, что при снижении температуры тела происходит нарушение микроциркуляции, обусловленное вазоспазмом и централизацией кровотока, повышением вязкости крови, уровней фибриногена и гематокрита [48, 49]. При этом уменьшается объем внутрисосудистой жидкости, возникают гиповолемия и гемоконцентрация [50]. Эритроцит в данном случае находится в условиях гипоксии, ацидоза, гипоосмолярности, что способствует развитию окислительного стресса. При кратковременной гипотермии снижение уровня восстановленного глутатиона в эритроцитах является дополнительным фактором, способствующим окислительной модификации белков и липидов мембран [11, 26]. Окислительная деструкция ПНЖК в составе ФЛ приводит к повышению уровня МДА, который, как известно, обладает цитотоксическими эффектами, образуя сшивки между ФЛ и белками мембран эритроцитов [51]. В условиях окислительного стресса накопление таких дефектов может привести к превращению части эритроцитов из классической двояковогнутой формы в эхиноциты и сфероциты с потерей их нормальной деформируемости [25]. Умеренная гипотермия действительно приводит к снижению количества дискоцитов и повышению доли их измененных форм (стоматоцитов и сфероцитов) [40]. Снижение деформируемости эритроцитов приводит к снижению капиллярного кровотока и уменьшению доставки кислорода к тканям [52]. В условиях гипотермии, когда эти поврежденные клетки пытаются пройти через капиллярную сеть, они агрегируют [53] и разрушаются, что приводит к гемолизу [5, 40], микротромбозу и окклюзии этих мелких сосудов [49].
Следует также отметить, что окислительно поврежденные эритроциты узнаются и интернализируются макрофагами в отсутствие опсонизации антителами [54]. Кроме того, в условиях окислительного стресса происходит транслокация ФС на наружный монослой мембраны эритроцитов, что является сигналом для их удаления из кровотока путем фагоцитоза макрофагами ретикуло-эндотелиальной системы [55]. Удаление окислительно поврежденных клеток из кровотока путем фагоцитоза, носящее название “внесосудистый гемолиз”, происходит в физиологических условиях во время старения эритроцитов, и он усиливается при некоторых патологических состояниях [56]. Показателем интенсивности этого “внесосудистого” гемолиза эритроцитов является уровень билирубина в плазме крови [57]. Результаты анализа уровня билирубина в плазме крови выявили повышение скорости элиминации эритроцитов сразу после снижения температуры тела и значительное ее ускорение после пролонгированной гипотермии (рис. 1).
Возрастной состав циркулирующих эритроцитов может измениться также за счет поступления в кровоток ретикулоцитов. Так, по данным нашей лаборатории [41] после кратковременной умеренной гипотермии в крови крыс на 50% увеличивается количество ретикулоцитов, существенно снижается продолжительность жизни эритроцитов и, как следствие, происходит усиление суточного эритропоэза в качестве компенсации. После пролонгированной 3 ч гипотермии показатели костномозговой продукции стабилизировались и приблизились к контрольным значениям.
Таким образом, после кратковременной гипотермии имеет место усиление элиминации из кровотока низкорезистентных, старых и дефектных клеток, что является адаптивной реакцией, направленной на стимулирование эритропоэза. Это, в свою очередь, способствует появлению в крови молодых эритроцитов с высокой антиоксидантной защитой, препятствующей пероксидации мембранных липидов.
Совокупность ранее полученных нами данных и результаты настоящего исследования позволяют утверждать, что изменение липидного состава мембран эритроцитов в динамике умеренной гипотермии связано не только с запуском процессов ремоделирования и обмена с липидами липопротеинов плазмы крови, но может отражать изменение возрастного состава циркулирующих в сосудистом русле эритроцитов.
Список литературы
Григорьев Е.В., Шукевич Д.Л., Плотников Г.П., Тихонов Н.С. 2014. Терапевтическая гипотермия: возможности и перспективы. Клиническая медицина. 9, 9–16.
Frank M.S., Cattaneo G.C., Wieneke-Brady B.M., El-Rahmany H., Gupta N., Lima A.C.J., Goldstein S.D. 2002. Threshold for adrenomedullary activation and increased cardiac work during mild core hypothermia. Clinical Science. 102, 119–125.
Маяхи М.Т.Д., Кличханов Н.К. 2012. Влияние даларгина на содержание гормонов гипофизарно-надпочечникового и гипофизарно-тиреоидного эндокринного комплексов в крови крыс при гипотермии. Изв. Самарского науч. центра РАН. 14 (5), 273–277.
Гурин В.Н. 1986. Обмен липидов при гипотермии, гипертермии и лихорадке. Мн.: Беларусь. 190 с.
Эмирбеков Э.З., Кличханов Н.К. 2011. Свободнорадикальные процессы и состояние мембран при гипотермии. Ростов-на-Дону: Изд-во Южного федерального университета. 200 с.
Ferreri C., Masi A., Sansone A., Giacometti G., Larocca A.V., Menounou G., Scanferlato R., Tortorella S., Rota D., Conti M., Deplano S., Louka M., Maranini A.R., Salati A., Sunda V., Chatgilialoglu C. 2017. Fatty acids in membranes as homeostatic, metabolic and nutritional biomarkers: Recent advancements in analytics and diagnostics. Diagnostics. 7 (1), 1. https://doi.org/10.3390/diagnostics7010001
Забелинский С.А., Чеботарева М.А., Каландаров А.М., Фейзуллаев Б.А., Кличханов Н.К., Кривченко А.И., Казеннов А.М. 2011. Влияние общей гипотермии на жирнокислотный состав фосфолипидов крови крыс и сусликов и светового излучения на химические процессы в липидном экстракте. Журн. эволюц. биохми. и физиол. 47 (4), 284–289.
Маяхи Мохаммед Т. Джабер, Таджибова Л.Т., Даудова Т.Н., Кличханов Н.К. 2012. Влияние гипотермии на содержание гормонов и липопротеинов в сыворотке крови крыс. Вестник Дагестанского гос. университета. Естеств. науки. 1, 140–143.
Линчевская А.А., Кондратьева Л.А. 1989. Влияние гипотермии на структурно-функциональные свойства эритроцитов белых крыс. Вопр. мед. химии. 6, 36–39.
Kuhn V., Diederich L., Keller T.C.S., Kramer C. M., Lückstädt W., Panknin C., Suvorava T., Isakson B.E., Kelm M., Cortese-Krott M.M. 2017. Red blood cell function and dysfunction: Redox regulation, nitric oxide metabolism, anemia. Antioxid. Redox Signal. 26, 718–742.
Аль-Рабии М.А.М., Астаева М.Д., Кличханов Н.К. 2015. Свободнорадикальные процессы в крови крыс при умеренной гипотермии разной длительности. Естественные науки. 1 (50), 35–42.
Шишкина Л.Н., Шевченко О.Г. 2010. Липиды эритроцитов крови и их функциональная активность. Успехи соврем. биол. 130 (6), 587–602.
Folch J., Lees M., Sloane-Stanly G.H. 1957. A simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226, 497–509.
Rouser G., Siakotos A.N., Fleischer S. 1966. Quantitative analysis of phospholipids by thin-layer chromatography and phosphorus analysis of spots. Lipids. 1, 85–86.
Fiske C.U., Subbarow Y. 1925. The colorimetric determination of phosphorus. J. Biol. Chem. 68375 (2), 375– 400.
Foote J.L., Allen R.J., Agranoff B.W. 1965. Fatty acids in esters and cerebrosides of human brain in phenylketonuria. J. Lipid Res. 6, 518–524.
Шевченко О.Г., Шишкина Л.Н. 2011. Сравнительный анализ состава фосфолипидов эритроцитов крови различных видов мышевидных грызунов. Журн. эвол. биохим. и физиол. 47 (2), 151–156.
Nakbi A., Tayeb W., Dabbou S., Issaoui M., Grissa A. K, Attia N., Hammami M. 2010. Dietary olive oil effect on antioxidant status and fatty acid profile in the erythrocyte of 2,4-Dexposed rats. Lipids Health Dis. 9, 89. https://doi.org/10.1186/1476-511X-9-89
Myher J.J., Kuksis A., Pind S. 1989. Molecular species of glycerophospholipids and sphingomyelins of human erythrocytes: mproved method of analysis. Lipids. 24, 396–407.
Yawata Y. 2003. Cell membrane: The red blood cell as a model. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA. 439 p.
Arashiki N., Takakuwa Y. 2017. Maintenance and regulation of asymmetric phospholipid distribution in human erythrocyte membranes: Implications for erythrocyte functions. Curr. Opinion Hematol. 24 (3), 167–172.
Arias C.F., Arias C.F. 2017. How do red blood cells know when to die? R. Soc. Open Sci. 4, 160 850. https://doi.org/10.1098/rsos.160850
Кличханов Н.К., Халилов Р.А., Мейланов И.С. 2001. Влияние гипотермии на активность Na, K-АТФазы и связывание гемоглобина в мембранах эритроцитов крыс. Биофизика. 46 (6), 1092–1095.
Aslan L., Meral I. 2007. Effect of oral vitamin E supplementation on oxidative stress in guinea-pigs with short-term hypothermia. Cell Biochem. Function. 25 (6), 711–715.
Mohanty J., Nagababu E., Rifkind J. 2014. Red blood cell oxidative stress impairs oxygen delivery and induces red blood cell aging. Front. Physiol. 5, 84. https://doi.org/10.3389/fphys.2014.00084
Dede S., Deger Y., Mera I. 2002. Effect of short-term hypothermia on lipid peroxidation and antioxidant enzyme activity in rats. J. Vet. Med. A 49, 286–288.
Аль-Рабии М.А.М., Чалабов Ш.И., Астаева М.Д., Кличханов Н.К. 2015. Осмотическая резистентность эритроцитов крыс и концентрация тиоловых групп белков их мембраны зависят от длительности умеренной гипотермии. Современные проблемы науки и образования. 3, 539–545.
Кличханов Н.К., Джафарова А.М., Аль-Рабии М.А.М. 2017. Кинетические характеристики ацетилхолинэстеразы и структурно-функциональное состояние мембран эритроцитов крыс при умеренной гипотермии. Биол. мембраны. 34 (3), 201–214.
van den Boom M.A., Wassink M.G., Westerman J., de Fouw N.J., Roelofsen B., Op den Kamp J.A., van Deenen L.L. 1994. In vivo turnover of phospholipids in rabbit erythrocytes. Biochim. Biophys. Acta. Lipids and Lipid Metabolism. 1215 (3), 314–320.
van den Berg J.J., Op den Kamp J.A., Lubin B.H., Kuypers F.A. 1993. Conformational changes in oxidized phospholipids and their preferential hydrolysis by phospholipase A2: A monolayer study. Biochemistry. 32, 4962– 4967.
Soupene E., Fyrst H., Kuypers F. A. 2008. Mammalian acyl-CoA: Lysophosphatidylcholine acyltransferase enzymes. PNAS. 105 (1), 88–93.
Fyrst H., Knudsen J., Schott M. A., Lubin B.H., Kuypers F.A. 1995. Detection of acyl-CoA-binding protein in human red blood cells and investigation of its role in membrane phospholipid renewal. Biochem. J. 306. 793–799.
Raclot T. 2003. Selective mobilization of fatty acids from adipose tissue triacylglycerols. Prog. Lipid Res. 42, 257–288.
Manno S., Mohandas N., Takakuwa Y. 2010. ATP-dependent mechanism protects spectrin against glycation in human erythrocytes. J. Biol. Chem. 285, 33923–33929.
Bogdanova A., Makhro A., Wang J., Lipp P., Kaestner L. 2013. Calcium in red blood cells – a perilous balance. Int. J. Mol. Sci. 14, 9848–9872.
Орлов Ю.Н. 2015. Фосфоинозитидзависимые примембранные механизмы регулирования клеточных процессов. Биол. мембраны. 32 (3), 151–167.
DeJong K., Kuypers F.A. 2004. Oxidative modifications to flippase and scramblase affect phosphatidylserine exposure in mouse sickle cells. Blood. 104, 3752.
Pengpanichpakdee N., Thadtapong T., Auparakkitanon S., Wilairat P. 2012. Plasma membrane Ca2+-ATPase sulfhydryl modifications: Implication for oxidized red cell. Southeast Asian J. Trop. Med. Public Health. 43 (5), 1252–1257.
Sarkadi B., Szasz I., Gerloczy A., Gardos G. 1977. Transport parameters and stoichiometry of active calcium-ion extrusion in intact human red-cells. Biochim. Biophys. Acta. 464, 93–107.
Ломако В.В., Коваленко И.Ф., Шило А.В. 2012. Эритроциты периферической крови при разных вариантах гипотермии гомойотермного организма. Криобиология. 22 (4), 398–409.
Аль-Рабии М.А.М. 2016. Свободнорадикальный гомеостаз и структурно-функциональное состояние мембран эритроцитов крыс при гипотермии. Дис. канд. биол. наук. Махачкала: Дагестанский гос. ун-т, 133 с.
Engelmann B., Brӓutigam C., Kulschar R., Duham J., Prenner E., Hermetter A., Richter W.O., Thiery J., Seidl D. 1994. Reversible redaction of phospholipd bound arachidonic acid after low density lipoprotein apheresis. Evidence for rapid incorporation of plasmologenphosphatidylethanolamine into the red blood cell membrane. Biochem. Biophis. Acta. 1196, 154–164.
Lessig J., Fuchs B. 2009. Plasmalogens in biological systems: Their role in oxidative processes in biological membranes, their contribution to pathological processes and aging and plasmalogen analysis. Cur. Med. Chem. 16 (16), 2021–2041. https://doi.org/10.2174/092986709788682164
Yang H.-C., Farooqui A.A., Horrocks L.A. 1996. Plasmalogenselective phospholipase A2 and its role in signal transduction. J. Lipid Mediat. Cell Signal. 14, 9–13.
McLean L.R., Hagaman K.A., Davidson W.S. 1993. Role of lipid structure in the activation of phospholipase A2 by peroxidized phospholipids. Lipids. 28, 505–509.
Mouritsen O.G. 2011. Lipids, curvature, and nano-medicine. Eur. J. Lipid Sci. Technol. 113, 1174–1187.
Oishi K., Yokoi M., Maekawa S., Sodeyama C., Shiraishi T., Kondo R., Kuriyama T., Machida K. 1999. Oxidative stress and haematological changes in immobilised rats. Acta Physiol. Scand. 165, 65–69.
Martini W.Z. 2007. The effects of hypothermia on fibrinogen metabolism and coagulation function in swine. Metabolism. 56, 214–221.
Луценко Д.Г., Марченко В.С., Слета И.В. 2008. Применение фрактального анализа для комплексной оценки структурно-функционального состояния микрогемоциркуляции у крыс после общей гипотермии. Проблемы криобиологии. 18 (3), 391–393.
Мищук Н.Е. 2006. Холодовая болезнь (гипотермия). Медицина неотложных состояний. 4 (5),42–47.
Şekeroğlu M.R., Huyut Z., Him A. 2012. The susceptibility of erythrocytes to oxidation during storage of blood: Effects of melatonin and propofol. Clin. Biochem. 45, 315–319.
Hoehn R.S., Jernigan. P.L., Chang A.L., Edwards M.J., Pritts T.A. 2015. Molecular mechanisms of erythrocyte aging. Biol. Chem. 396 (6-7), 621–631.
Erken G., Erken H.A., Bor-Kucukatay M., Kucukatay V., Genc O. 2011. The effects of in vivo and ex vivo various degrees of cold exposure on erythrocyte deformability and aggregation. Med. Sci. Moni. 17 (8), BR210–215.
Sambrano G.R., Parrhasarathe S., Steinbrg D. 1994. Recognition of oxidatively damaged erythrocytes by a macrophage receptor with specificity for oxidized low density lipoprotein. Proc. Nati. Acad. Sci. USA. 91, 3265–3269.
Manda D., Moitra P. K., Saha S., Basu J. 2002. Caspase 3 regulates phosphatidylserine externalization and phagocytosis of oxidatively stressed erythrocytes. FEBS Letters. 513, 184–188.
Zwaal R.F., Comfurius P., Bevers E.M. 2005. Surface exposure of phosphatidylserine in pathological cells. Cell Mol. Life Sci. 62, 971–988.
Панин Л.Я., Мокрушников П.В., Куницын В.Г., Панин В.Е., Зайцев Б.Н. 2011. Основы многоуровневой мезомеханикинаноструктурных переходов в мембранах эритроцитов и их разрушения при взаимодействии с гормонами стресса. Физическая мезомеханика. 14 (1), 5–17.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


