Биологические мембраны: Журнал мембранной и клеточной биологии, 2020, T. 37, № 2, стр. 149-155
Тетранитрозильный биядерный комплекс железа повышает устойчивость проростков гороха и клеток E. coli к стрессовым воздействиям
И. В. Жигачева a, *, С. В. Васильева a, И. П. Генерозова b, М. М. Расулов c
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
b Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, Россия
c Государственный научно-исследовательский институт химии
и технологии элементоорганических соединений
105118 Москва, Россия
* E-mail: zhigacheva@mail.ru
Поступила в редакцию 02.04.2019
После доработки 27.05.2019
Принята к публикации 28.06.2019
Аннотация
В настоящей работе исследовали влияние донора оксида азота – железо-серанитрозильного комплекса с тиосульфатом Na2[Fe2(S2O3)2(NO)4]2 · 4H2O (ТНКЖтио) на перекисное окисление липидов (ПОЛ) в мембранах митохондрий 5-дневных этиолированных проростков гороха (Pisum sativum L.) в модельной системе “старения” митохондрий и в условиях дефицита воды. Кроме того, изучали влияние ТНКЖтио на экспрессию гена sfiA ДНК-репарационного SOS-ответа в клетках E. сoli PQ37. ТНКЖтио в концентрационном интервале 10–5–10–9 М снижал интенсивность ПОЛ до контрольных значений в модельной системе “старения” митохондрий, что, возможно, указывало на наличие антистрессовых свойств у препарата. В условиях дефицита воды в 2 раза повышалась интенсивность флуоресценции продуктов ПОЛ в мембранах этих органелл. При этом обработка семян гороха 3 × 10–5 или 3 × 10–6 М ТНКЖтио предотвращала активацию ПОЛ в условиях дефицита воды. Кроме того, обработка клеток E. coli этим препаратом в 2.7 раза усиливала экспрессию гена sfiA SOS-регулона в условиях теплового стресса, что также указывало на адаптогенные свойства препарата. Протекторные свойства ТНКЖтио отразились и на физиологических показателях, а именно на росте проростков. Обработка семян и проростков гороха исследуемым препаратом предотвращала торможение роста корней и побегов в условиях дефицита воды. Предполагается, что защитные свойства ТНКЖтио обусловлены его способностью предотвращать ПОЛ.
ВВЕДЕНИЕ
В конце 1980-х годов впервые появились сведения о действии NO как вторичного внутриклеточного регулятора сердечнососудистой, нервной и иммунной систем млекопитающих [1]. И только в 1998 г. сформировались первые представления о возможной сигнальной роли NO у растений [2]. NO – внутриклеточная сигнальная молекула, с помощью которой регулируются метаболизм и физиологические процессы на всех этапах онтогенеза растений. Монооксид азота принимает участие в регуляции клеточного цикла, процессах дифференциации и морфогенеза у растений [3, 4]. Он участвует в трансдукции сигналов, стимулирующих у растений синтез ряда фитогормонов, в частности, этилена [3], абсцизовой кислоты (АБК) [5] и ауксина [6]. NO регулирует прорастание семян, рост боковых корней, цветение и созревание плодов, а также участвует в формировании защиты от стрессовых факторов. Молекула оксида азота имеет неспаренный электрон на внешней π-орбитали, обладает свойствами свободного радикала, что обеспечивает высокую химическую реактивность и короткий полупериод жизни. Среднее время жизни NO in vivo составляет от 5 до 30 с [7]. За это время происходит его взаимодействие с мишенями (тиолами и переходными металлами). Причем для молекулы NO кластеры железо-серных белков [Fe–S] являются наиболее предпочтительными мишенями в клетке. Отметим, что митохондрии растений являются источниками и мишенью для оксида азота [8]. При этом почти все комплексы электрон-транспортной цепи митохондрий могут быть мишенью для NO и участвовать в его метаболизме. Комплекс I и нечувствительные к ротенону NADPH-дегидрогеназы регулируют образование NO в условиях гипоксии. С помощью комплекса III и комплекса IV в отсутствие кислорода образуется NO за счет анаэробного восстановления нитрита. Генерируемый NO участвует в цикле фитоглобин–NO, что приводит к поддержанию уровня окислительно-восстановительного потенциала клетки при гипоксии. Отметим, что комплекс IV является основным сайтом генерации NO и способствует поддержанию уровня ATP в условиях глубокой гипоксии в цикле фитоглобин–NO. Установлено, что в условиях нормоксии восстановление нитрита до NO нарушается под действием ингибиторов альтернативной оксидазы, а также ингибиторов комплексов III и IV электрон-транспортной цепи митохондрий. Эти данные указывают на участие в синтезе NO альтернативной оксидазы (АОХ), III и IV комплексов дыхательной цепи митохондрий [9, 10]. Экспрессия генов альтернативной оксидазы индуцируется NO при гипоксии. Индукция AOX может происходить посредством ингибирования аконитазы с последующим накоплением цитрата [11], являющегося специфическим индуктором AOX.
Молекулярной мишенью действия NO являются также железо-серные центры в белках. При этом образуются связанные с белком динитрозильные комплексы железа (ДНКЖ), что продлевает время жизни монооксида азота и сохраняет его биологическую активность [12]. Когда такая трансформация обратима, реакцию [2Fe–2S]-кластеров с низкомолекулярными ДНКЖ можно рассматривать как один из способов регуляции активности железо-серных белков. Включение SH-групп в ДНКЖ снижает их химическую активность, при распаде комплексов SH-группы высвобождаются в виде тиолят-анионов (R–S-), которые на порядок реакционноспособнее SH-групп. Получается, что ДНКЖ могут быть блокаторами и сенсибилизаторами (усилителями) активности SH-групп.
Возможно, в клетках растений, подобно клеткам животных и бактерий, одним из механизмов антиоксидантного действия NO является связывание свободных ионов железа в составе нитрозильных комплексов [13, 14]. В этом случае могут ингибироваться реакции свободно-радикального окисления, катализируемые редокс-активными ионами железа. В пользу этого предположения свидетельствуют данные об антиоксидантных свойствах NO, благодаря которым он предотвращает окислительные повреждения, вызванные различными стрессовыми факторами [15, 16].
Стрессовые воздействия вызывают смещение антиоксидантно-прооксидантного равновесия в сторону увеличения содержания активных форм кислорода в клетке. При этом одним из основных источников АФК являются митохондрии и хлоропласты [17]. В этих условиях NO может функционировать как антиоксидант, непосредственно поглощая АФК, в частности ${\text{O}}_{2}^{{ - \,\centerdot }}$, с образованием пероксинитрита (ONOO–) [15]. Перекисное окисление липидов ингибируется также благодаря взаимодействию NO с алкилпероксильными и алкоксильными радикалами [18]. При этом NO в условиях стресса регулирует антиоксидантные ферменты на уровне активности и экспрессии генов, которые могут вызывать либо усиление, либо снижение окислительно-восстановительного статуса клеток. Например, активация образования NO во время солевого или водного стресса индуцировало антиоксидантную систему: увеличивалась активность таких ферментов как супероксиддисмутаза, аскорбатпероксидаза и глутатионредуктаза, что приводило к повышению устойчивости различных растений к дефициту воды или к засолению [16, 19]. Однако в других случаях быстрое накопление NO в ответ на сильные стрессовые стимулы вызывало ингибирование антиоксидантных ферментов и последующее повышение уровня перекиси водорода [20].
С другой стороны быстрая реакция между ${\text{O}}_{2}^{{ - \,\centerdot }}$ и NO с образованием мощного окислителя пероксинитрита (ONOO–), окисляющего ДНК, липиды, тиоловые группы белков и кластеры железа, приводящая к нарушению ферментативной активности, часто рассматривается как повреждающий клетки фактор, т.е. стрессор [21].
Таким образом, оксид азота находится в центре многих адаптивных и патологических процессов [22]. Адаптогенное или стрессовое действие NO, вероятно, определяется его концентрацией, возрастом растения, и видом стресса (дефицит воды, низкотемпературный стресс, тепловой шок и т.д.).
Изучение протекторных свойств оксида азота часто проводят с применением экзогенных доноров NO. Наиболее перспективными экзогенными донорами NO являются нитрозильные комплексы железа с тиолсодержащими лигандами. Они обладают рядом преимуществ перед другими NO-донорами, такими как органические нитраты и нитриты, требующие участия ферментов для донирования NO. Нитрозильные комплексы железа донируют монооксид азота при физиологических значениях рН без какой-либо (термо-, редокс- или фото-) активации, и при разложении этих комплексов не образуется токсичных или канцерогенных веществ. Эти комплексы являются структурными и спектроскопическими аналогами активных центров негеминовых [2Fe–2S]-белков, найденных во всех живых организмах от бактерий до млекопитающих [23].
В нашей работе мы использовали натрий µ2-дитиосульфатотетранитозилдиферрат тетрагидрат (комплекс железа с тиосульфатом) – Na2[Fe2(S2O3)2(NO)4]2 · 4H2O (кристаллический ТНКЖтио) [23]. Этот комплекс относительно устойчив при хранении на свету в отсутствии влаги. При хранении комплекса в условиях повышенной влажности наблюдается его заметное разложение, сопровождаемое изменением окраски и кристалличности и появлением характерного запаха. В протонных растворителях наблюдается темновое разложение биядерного комплекса, сопровождающееся появлением характерных пиков моноядерного динитрозильного комплекса железа при 343 (ε = 3.889 × 103 М–1 см–1), 455 (ε = 1.180 × 103 М–1 см–1) и 501 (ε = 1.014 × × 103 М–1 см–1). Генерация NO и образование мононитрозильного интермедиата и частицы [Fe(S2O3)]- из ДНКЖтио начинается только спустя 40 мин после растворения комплекса [24].
Целью работы было исследование антистрессовых свойств ТНКЖтио. Изучали функциональное состояние митохондрий проростков гороха в условиях дефицита воды и обработки ТНКЖтио. Кроме того, изучали влияние теплового стресса и обработки клеток Escherichia coli ТНКЖтио на экспрессию гена sfiA ДНК-репарационного SOS-ответа. Одна из SOS-функций, контролируемая геном sfiA, выражается в ингибировании клеточного деления и нитевидном росте. В E. coli оксид азота избирательно активирует ДНК-репарационную систему SoxRS и транскрипцию SoxR фактора, контролирующего в том числе рост уровня антиоксидантного фермента супреоксиддисмутазы [25].
МАТЕРИАЛЫ И МЕТОДЫ
Работу проводили на митохондриях 5-дневных этиолированных проростков гороха (Pisum sativum L), сорт Флора 2. Семена гороха промывали водой с мылом и 0.01% раствором КMnO4. Контрольную группу семян в течение 1 ч замачивали в воде, а опытную группу – в 3 × 10–5 или 3 × 10–6 М ТСНЖтио. Затем семена переносили на влажную фильтровальную бумагу, где они находились в темноте в течение суток. Затем половину проростков контрольной группы (ДВ) и проростки, обработанные ТНКЖтио, на 2 сут переносили на сухую фильтровальную бумагу. Через 2 сут проростки обеих групп переносили на влажную фильтровальную бумагу, где они находились в течение последующих 2 сут. Вторая половина семян контрольной группы оставалась на влажной фильтровальной бумаге в течение 5 сут. На 5-е сут выделяли митохондрии из эпикотилей проростков всех исследуемых групп.
Выделение митохондрий из 5-дневных эпикотилей проростков гороха (Pisum sativum L) проводили методом дифференциального центрифугирования [26]. Эпикотили гороха длиной 3–6 см (20–25 г) гомогенизировали со 100 мл среды выделения, содержащей: 0.4 М сахарозу, 5 мМ EDTA, 20 мМ КН2РО4 (рН 8.0), 10 мМ KCl, 2 мМ дитиоэритрита и 0.1% БСА (свободный от жирных кислот). Гомогенат центрифугировали при 25 000 g в течение 5 мин. Второе центрифугирование – в течение 3 мин при 3000 g. Осаждение митохондрий проводили в течение 10 мин при 11 000 g. Осадок ресуспендировали в 2–3 мл среды, содержащей: 0.4 М сахарозу, 20 мМ КН2РО4 (рН 7.4), 0.1% БСА, (свободный от жирных кислот), и вновь осаждали митохондрии при 11 000 g в течение 10 мин.
Интенсивность перекисного окисления липидов (ПОЛ) оценивали флуоресцентным методом [27]. Липиды экстрагировали из митохондрий, содержащих 3–5 мг белка, смесью хлороформ : метанол = = 2 : 1 (по объему). Соотношение митохондрии : : смесь хлороформ–метанол = 1 : 10. Регистрацию флуоресценции проводили в десятимиллиметровых кварцевых кюветах на спектрофлуориметре FluoroMax (Horiba Scientific, Германия). Длина волны возбуждения флуоресценции была 360 нм, испускания – 420–470 нм. Результаты выражали в условных единицах флуоресценции пересчитанных на мг белка.
Содержание NO в эпикотилях 5-дневных этиолированных проростков анализировали по методу, описанному в [28]. В основе данного метода лежит превращение содержащегося в растениях NO в нитрит, которое можно определять спектрофотометрически. Определение его концентрации проводили по реакции Грисса. Навеску 60 г эпикотилей гомогенизировали на льду в 50 мМ ацетатном буфере (рН 3.6) с добавлением 4% ацетата цинка. Гомогенат центрифугировали при 8000 g в течение 15 мин, затем к 10 мл супернатанта добавляли 150 мг древесного угля. Смесь фильтровали через бумажный фильтр, после чего смешивали 2 мл фильтрата с 1 мл 1% реактива Грисса в 12% уксусной кислоте и выдерживали при комнатной температуре 30 мин. Оптическую плотность измеряли при λ = 540 нм. В качестве стандарта использовали растворы нитрита натрия.
Культура бактерий. В работе исследовали клетки штамма E. coli PQ37, содержащие в геноме слитый оперон [sfiA::lacZ]. В этом штамме структурный ген β-галактозидазы lacZ находится под контролем промотора гена sfiA (SOS-регулона), либо промотора sosS (SoxRS-регулона), а в геноме присутствует делеция хромосомного lac-оперона. Таким образом, о величине экспрессии генов sfiA и soxS судят опосредованно, измеряя активность lacZ β-галактозидазы в колориметрическом тесте [29]. Хромоген для β-галактозидазы – о-нитрофенил-β-D-галактопиранозид (ONPG, Sigma, США). В качестве позитивного контроля экспрессии гена sfiA SOS-регулона использовали 2.63 нМ водный раствор 4-нитрохинолина оксида (4НХО). Активность β-галактозидазы рассчитывали по формуле А = (1000 × OD420 × V/(OD600 × t), где OD420 и OD600 – значения оптической плотности при 420 и 600 нм, V – разведение, t – время инкубации с хромогеном в мин.
Тепловой стресс. Суспензию бактериальных клеток нагревали на водяной бане в течение 15 мин при 43°С.
Тетранитрозильный комплекс железа с тиосульфатом. Кристаллический водорастворимый донор оксида азота µ2-дитиосульфатотетранитозилдиферрат тетрагидрат (комплекс железа с тиосульфатом) Na2[Fe2(S2O3)2(NO)4]2 · 4H2O (ТНКЖтио) синтезирован в Институте проблем химической физики РАН (Черноголовка). В водном растворе ТНКЖтио образует тиосульфат дианиона Fe2[(S2O3)2(NO)4]2–. Отметим, что в кристаллическом состоянии [Na2[Fe2(S2O3)2(NO)4]2 · 4H2O также очень стабилен. В медицине ТНКЖтио является перспективным препаратом для лечения онкологических заболеваний [30].
Использовали реактивы следующих фирм: сахароза, БСА (V-фракция) (Sigma-Aldrich, США), KCl, 1,4-дитио-DL-треитол (Fluka, Германия), HEPES (Biochemica Ultra, для молекулярной биологии), трис (Fluka, Германия), хлороформ, метанол (Merck, Германия), нитрохинолин-1-оксид (Sigma, США), 5-галактозидаза (Boehringer Mannheim, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
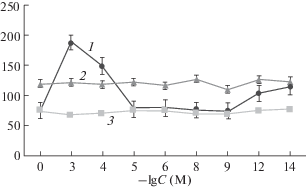
Поиск концентраций комплекса железа с тиосульфатом (ТНКЖтио), эффективно снижающих генерацию АФК в условиях стресса, проводили на модели “старения” митохондрий (инкубация митохондрий 5-дневных этиолированных проростков гороха в гипотонической среде, содержащей 1 мМ КН2PО4) [31]. Инкубация митохондрий в гипотонической среде вызывала слабое набухание митохондрий и, возможно, рост генерации АФК, что, вероятно, привело к увеличению интенсивности флуоресценции конечных продуктов ПОЛ (оснований Шиффа) в мембранах митохондрий проростков гороха в 1.6 раза (рис. 1). Введение ТНКЖтио в среду инкубации митохондрий снижало интенсивность флуоресценции продуктов ПОЛ; этот эффект зависел от дозы ТНКЖтио. Препарат в концентрационном интервале 10–5–10–9 М снижал интенсивность флуоресценции продуктов ПОЛ почти до контрольных значений, что, возможно, свидетельствует о наличии у препарата антистрессовых свойств. Отметим, что в концентрации 10–3–10–4 М препарат проявлял прооксидантный эффект, повышая интенсивность флуоресценции конечных продуктов ПОЛ в 2–3 раза. Это указывает на необходимость четко придерживаться концентраций, в которых препарат проявляет антиоксидантный эффект.
Рис. 1.
Влияние “старения” железо-серанитрозильного комплекса с тиосульфатом (ТНКЖтио) на интенсивность флуоресценции продуктов ПОЛ в мембранах митохондрий 5-дневных проростков гороха. По оси ординат – интенсивность флуоресценции (усл. ед/мг белка), по оси абсцисс – концентрация ТНКЖтио, логарифмическая шкала. 1 – “старение” + + ТНКЖтио; 2 – “старение”; 3 – контрольная группа проростков, которая находилась на влажной фильтровальной бумаге в течение 5 сут.
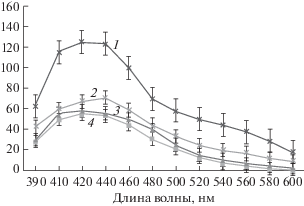
Наличие протекторных свойств у ТНКЖтио мы проверили на модели дефицита воды. Поскольку на модельной системе ТНКЖтио в концентрациях 10–5 и 10–6 М снижал интенсивность флуоресценции продуктов ПОЛ в мембранах митохондрий проростков гороха, то в исследованиях его антистрессовых свойств in vivo использовали его в концентрациях 3 × 10–5 или 3 × 10–6 М. Дефицит воды приводил к активации ПОЛ в мембранах митохондрий этиолированных проростков гороха, о чем свидетельствует почти 2-кратное увеличение интенсивности флуоресценции конечных продуктов перекисного окисления липидов (рис. 2). Отметим, что обработка семян гороха 3 × 10–5 или 3 × 10–6 М ТНКЖтио приводила к снижению интенсивности флуоресценции продуктов ПОЛ почти до контрольного уровня.
Рис. 2.
Спектры флуоресценции продуктов ПОЛ в мембранах митохондрий проростков гороха в условиях дефицита воды (ДВ) и при обработке семян ТНКЖтио. По оси ординат – интенсивность флуоресценции (усл. ед/мг белка), по оси абсцисс – длина волны в нм. 1 – ДВ; 2 – ДВ + 3 × 10–5 М ТНКЖтио; 3 – ДВ + + 3 × 10–6 М ТНКЖтио; 4 – контрольная группа проростков, которая находилась на влажной фильтровальной бумаге в течение 5 сут.
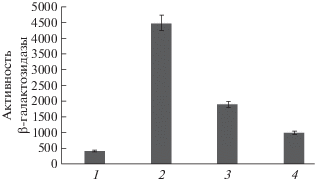
При обработке клеток E. coli комплексом железа с тиосульфатом происходит усиление экспрессии гена sfiA SOS-регулона в 2.7 раза. При этом в положительном контроле с 4НХО этот показатель усиливался в 5.7 раз (рис. 3). Внесение 0.1–1.0 мМ п-аминобензойной кислоты (ПАБК) в клеточную суспензию способствовало снижению экспрессии гена sfiA SOS-регулона на 37–47% в сравнении с обработкой ТНКЖтио. Это согласуется с установленным нами феноменом ингибирования ПАБК всего комплекса индуцибельных генетических функций, составляющих глобальный ДНК-репарационнный SOS-ответ в E. coli, поскольку изучаемый ген sfiA входит в состав SOS-регулона. Мы можем также предположить, что в этом случае имеет место снижение донирования NO раствором ПАБК + NO и последующее подавление внутриклеточного формирования на его основе новых сигнальных молекул динитрозильного комплекса железа. Известно, что у Е. coli при тепловом шоке ингибируется экспрессия генов katG, katE и sodA, контролирующих синтез компонентов главных антиоксидантных систем, а также активности каталазы и глутатионредуктазы. Таким образом, тепловой стресс сопровождается явлениями, характерными для окислительного стресса [32]. Экспрессия гена sfiA SOS-регулона является адаптивным ответом клетки на окислительный стресс, в частности на увеличение концентрации супероксида. Усиление экспрессии гена sfiA SOS-регулона комплексом железа с тиосульфатом, возможно, свидетельствует о протекторных свойствах ТНКЖтио.
Рис. 3.
Влияние теплового шока и ТНКЖ на экспрессию гена sfiA в клетках E. coli PQ37. 1 – тепловой шок (ТШ); 2 – ТШ + НХО (4-нитрохинолина оксид); 3 – ТШ + ТНКЖтио; 4 – ТШ + ТНКЖтио + ПАБК (парааминобензойная кислота). По оси ординат – активность β-галактозидазы в единицах Миллера.
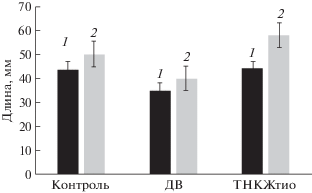
Подтверждением предположения об антистрессовых свойствах препарата является изменение физиологических показателей проростков гороха (рост) в условиях дефицита воды и обработки семян водными растворами ТНКЖтио. Известно, что проростки гороха очень чувствительны к дефициту воды, особенно на ранних стадиях роста. В наших экспериментах мы использовали наиболее чувствительные к данному стрессу 2-дневные проростки. Дефицит воды тормозил процессы роста (рис. 4), что согласуется с данными литературы [33]. Обработка семян гороха исследуемым препаратом предотвращала торможение роста корней и побегов проростков в этих условиях. Протекторное действие препарата, вероятно, было обусловлено увеличением содержания NO в тканях растений. Так, содержание оксида азота в тканях эпикотилей 5-дневных проростков гороха, выращенных из семян, обработанных ТНКЖтио и находящихся в условиях дефицита воды, было в 1.86 раз выше (75 нмоль/г сырого веса), чем у необработанных проростков, находящихся в тех же условиях (40 нмоль/г сырого веса). Таким образом, ТСНЖтио в концентрациях 3 × 10–5 и 3 × 10–6 М проявляет антистрессовые свойства.
Рис. 4.
Влияние дефицита воды (ДВ) и обработки семян гороха ТНКЖтио на длину побегов и корней 5-дневных проростков. 1 – корни; 2 – побеги.
Исходя из полученных данных, можно предположить, что влияние NO на метаболические процессы в клетке имеет концентрационную зависимость: в низких концентрациях NO ингибирует свободно-радикальные процессы и, следовательно, перекисное окисление липидов; в высоких концентрациях – активирует. Протекторный эффект донора оксида азота ТНКЖтио, вероятно, обусловлен активацией антиоксидантных ферментов [34] вследствие увеличения экспрессии генов, кодирующих данные ферменты [35]. Кроме того, протекторный эффект препарата, возможно, определяется как активацией альтернативного пути транспорта электронов в дыхательной цепи митохондрий с участием альтернативной оксидазы [36], так и увеличением экспрессии генов альтернативной оксидазы [37].
Список литературы
Palmer R.M., Ferrige A.G., Moncada S. 1987. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327, 524–526.
Delledonne M., Xia Y., Dixon R.A., Lamb C. 1998. Nitric oxide functions as a signal in plant disease resistance. Nature. 394, 585–588.
Wilson I.D., Neill S.J., Hancock J.T. 2008. Nitric and signaling in plants. Plant Cell Environ. 31. 622–631.
Емец А.И., Красиленко Ю.А., Шеремет Я.А., Блюм Я.Б. 2009. Реорганизация микротрубочек, как ответ на реализацию сигнальных каскадов оксида азота (II) в растительной клетке. Цитология и генетика. 43 (2), 3–12.
Xing H., Tan L., An L., Zhao Z., Wang S., Zhang C. 2004. Evidence for the involvement of nitric oxide and reactive oxygen species in osmotic stress tolerance of wheat seedlings: Inverse correlation between leaf abscisic acid accumulation and leaf water loss. Plant Growth Regul. 42, 61–68.
Tewari R.K., Kim S.Y., Hahn E.J., Paek K.Y. 2008. Involvement of nitric oxide-induced NADPH oxidase in adventitious root growth and antioxidant defense in Panax ginseng. Plant Biotechnol. Rep. 2, 113–122.
Соловьева А.Г., Кузнецова, В.Л., Перетягин С.П., Диденко Н.В., Дударь А.И. 2016. Роль оксида азота в процессах свободно-радикального окисления. Вестник Рос. военно-мед. академии. 1 (53), 228–233.
Gupta K. J., Kumari A., Florez-Saras I., Fernie A.R., Igamberdiev A.U. 2018. Interaction of nitric oxide with the components of the plant mitochondrial electron transport chain. J. Exp. Botany. 69 (14), 3413–3424. https://doi.org/10.1093/jxb/ery119
Gupta K.J., Kaiser W.M. 2010. Production and scavenging of nitric oxide by barley root mitochondria. Plant Cell Physiol. 51, 576–584.
Stoimenova M., Igamberdiev A.U., Gupta K.J., Hill R.D. 2007. Nitrite-driven anaerobic ATP synthesis in barley and rice root mitochondria. Planta. 226, 465–474.
Gupta K.J., Shah J.K., Brotman Y., Jahnke K., Willmitzer L., Kaiser W.M., Bauwe H., Igamberdiev A.U. 2012. Inhibition of aconitase by nitric oxide leads to induction of the alternative oxidase and to a shift of metabolism towards biosynthesis of amino acids. J. Exp. Botany. 63, 1773–1784.
Санина Н.А., Алдошин С.М. 2011. Строение и свойства нитрозильных комплексов железа с функциональными серосодержащими лигандами. Изв. АН. Сер. хим. 7, 1199–1227.
Yalowich J.C., Garbunov N.V., Kozlov A.V., Allan V., Kagan V.E. 1999. Mechanisms of nitric oxide protection against tert-butyl hydroperoxide-induced cytotoxicity in iNOS transduced human erythroleukemia cells. Biochemistry. 38 (33), 10691–10698.
Ванин А.Ф. 1998. Динитрозильные комплексы железа и S-нитрозотиолы – две возможные формы стабилизации и транспорта оксида азота в биосистемах. Биохимия. 63 (7), 924–938.
Laspina, N.V., Groppa M.D., Tomaro M.L., Benavides M.P. 2005. Nitric oxide protects sunflower leaves against Cd-induced oxidative stress. Plant Science. 169, 323–330.
Sang J., Jiang M., Lin F., Xu S., Zhang A, Tan M. 2008. Nitric oxide reduces hydrogen peroxide accumulation involved in water stress-induced subcellular anti-oxidant defense in maize plants. J. Integr. Plant Biol. 50, 231–243.
Tailor N.L., Day D.A., Millar A.H. 2003. Tagrets of stress-induced oxidative damage in plant mitochondria and their impact on cell carbon/nitrogen metabolism. J. Exp. Bot. 55 (394), 1–10.
Kanner J., Harel S., Granit R. 1991. Nitric oxide as an antioxidant. Arch. Biochem. Biophys. 289 (1), 130–136.
Leshem Y.Y. 1996. Nitric oxide in biological systems. Plant Growth Regulation. 18 (3), 155–159.
Groß F., Durner J., Gaupels F. 2013. Nitric oxide, antioxidants and prooxidants in plant defence responses. Front Plant Sci. 4, 419–429. https://doi.org/10.3389/fpls.2013.00419
Van Breusegem F., Vranová E., Dat J.F., Inze D. 2001. The role of active oxygen species in plant signal transduction. Plant Science.161, 405–414.
Neill S.J., Desikan R., Clarke A., Hurst R.D., Hancock J.T. 2002. Hydrogen peroxide and nitric oxide as signalling molecules in plants. J. Exp. Bot. 5, 1237–1247.
Aldoshin S.M., Sanina N.A., Rakova O.A., Shilov G.V., Kulikov A.V., Shulga Yu.M., Ovanesyan N.S. 2003. New class of neutral paramagnetic binuclear sulfur-containing iron nitrosyl complexes. Russ. Chem. Bulletin. 52 (8), 1702–1708.
Руднева Т.Н. 2007. Синтез, исследование строения и NO-донорной активности нитрозильных комплексов железа с 2-меркаптоимидазолами. Автореф. дис. канд. хим. наук. Черноголовка: Ин-т проблем химической физики РАН. 26 с.
Безматерных К.В. 2018. Влияние биологически активных соединений на индукцию стрессовых регулонов и толерантность к антибиотикам у бактерий Escherichia coli. Автореф. дис. канд. биол. наук. Пермь: ИЭГМ УрО РАН. 24 с.
Попов В.Н., Руге Э.К., Старков А.А. 2003. Влияние ингибиторов электронного транспорта на образование активных форм кислорода при окислении сукцината митохондриями гороха. Биохимия. 68 (7), 910–916.
Fletcher B.I., Dillard C.D., Tappel A.L. 1973. Measurement of fluorescent lipid peroxidation products in biological systems and tissues. Anal. Biochem. 52, 1–9.
Zhou B., Guo Z., Xing J., Huang B. 2005. Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis. J. Exp. Bot. 56, 3223–3228.
Quillardet P., Huisman O., D’ari R., Hofnung N. 1982. The SOS chromotest. A direct assay of induction of an SOS function in Escherichia colli K-12 to measure genotoxicity. Proc. Natl. Acad. Sci. U S A. 79 (19), 5971–5975.
Санина Н.А., Руднева Т.Н., Сулименков И.В., Коновалова Н.П., Сашенкова Т.Е., Алдошин С.М. 2009. Противоопухолевая активность нитрозильных комплексов железа – новых доноров монооксида азота. Рос. хим. журн. 53 (1), 164–171.
Жигачева И.В., Бурлакова Е.Б., Генерозова И.П., Шугаев А.Г. 2013. Роль адаптогенов в регуляции биоэнергетических функций митохондрий в условиях стресса. Биол. мембраны. 30 (4), 313–321.
Закирова О.Н. 2001. Роль антиоксидантных систем в отклике бактерий Escherichia coli на температурные стрессы. Дис. канд. биол. наук. Пермь: Ин-т экологии и генетики микроорганизмов УрО РАН, 135 с.
Koster K.L., Reisdorph N., Ramsau J.L. 2003. Changing desiccation tolerance of pea embryo protoplasts during germination. J. Exp. Bot. 54, 1607–1614.
Колупаев Ю.Е. 2009. Роль основных сигнальных интермедиатов в формировании адаптивных реакций растений к действию абиотических стрессов. В кн: Физиология растений: проблемы и перспективы развития. Киев: Логос, 2, с. 166–194.
Zhang T., Che F., Zhang H., Pan Y., Xu M.Q., Ban Q., Han Y., Rao J. 2017. Effect of nitric oxide treatment on chilling injury, antioxidant enzymes and expression of the CmCBF1 and CmCBF3 genes in cold-stored Hami melon (Cucumis melo L.) fruit. Postharvest biology and technology. 127, 88–98.
Royo B., Moran J.F., Ratcliffe R.G., Gupta K.J. 2015. Nitric oxide induces the alternative oxidase pathway in Arabidopsis seedlings deprived of inorganic phosphate. J. Exp. Bot. 66 (20), 6273–6280. https://doi.org/10.1093/jxb/erv338
Huang X., von Rad U., Durner J. 2002. Nitric oxide induces transcriptional activation of the nitric oxide-tolerant alternative oxidase in Arabidopsis suspension cells. Planta. 215 (6), 914–923.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


